Regolamento certificazione PED - INAIL
Regolamento certificazione PED - INAIL 2025
ID 13480 | Update Rev. 21 del 13/01/2025
Il Regolamento descrive le modalità e le risorse con le quali INAIL O.N. 0100 gestisce l’erogazione dei servizi, in conformità alle norme UNI CEI EN ISO/IEC 17065, 17024, 17021-1, 17020, sotto notifica per le attrezzature a pressione e insiemi, nell’ambito della direttiva 2014/68/UE PED.
L'INAIL ON 0100 è un organismo notificato per la direttiva 2014/68/UE PED.
Nel Regolamento sono indicate le modalità che il Fabbricante deve seguire per l'ottenimento degli attestati di certificazione richiesti.
Sono inoltre indicati i diritti e i doveri del Fabbricante e le modalità seguite da INAIL O.N. 0100 per l'accertamento della conformità in relazione al modulo/i scelto/i dal Fabbricante. Agli effetti del Regolamento si intende per Fabbricante il soggetto che richiede la certificazione.
Il Regolamento riporta adempimenti relativamente alla direttiva 2014/68/UE PE.
La direttiva 2014/68/UE è una direttiva di prodotto riguardante gli apparecchi a pressione emanata dalla Comunità Europea e recepita in Italia con decreto legislativo n. 26 del 15/02/2016. Disciplina la progettazione, la costruzione, l’equipaggiamento e l’istallazione in sicurezza di apparecchi a pressione.
Il servizio di certificazione è effettuato dall'Inail in qualità di organismo notificato. I tecnici dell’Istituto eseguono – in accordo al relativo modulo di valutazione della conformità – adeguati esami e verifiche sulle attrezzature o insiemi a pressione fabbricati in accordo alla direttiva 2014/68/UE destinati a essere immessi sul mercato e messi in servizio all’interno dell’Unione Europea.
Il documento può essere considerato un valido esempio delle modalità in cui opera un organismo notificato.
Nel Regolamento, difatti, sono riportati oltre alle condizioni economiche anche i doveri dei richiedenti la certificazione.
...
Destinatari
Fabbricante o suo rappresentante autorizzato stabilito nell’Unione Europea, dell’attrezzatura/insieme a pressione destinato a essere immesso sul mercato europeo e marcato CE.
Finalità
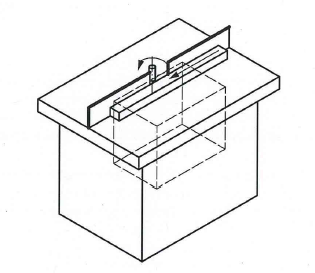
Moduli di valutazione della conformità
Approvazione modalità operative e del personale che esegue giunzioni permanenti
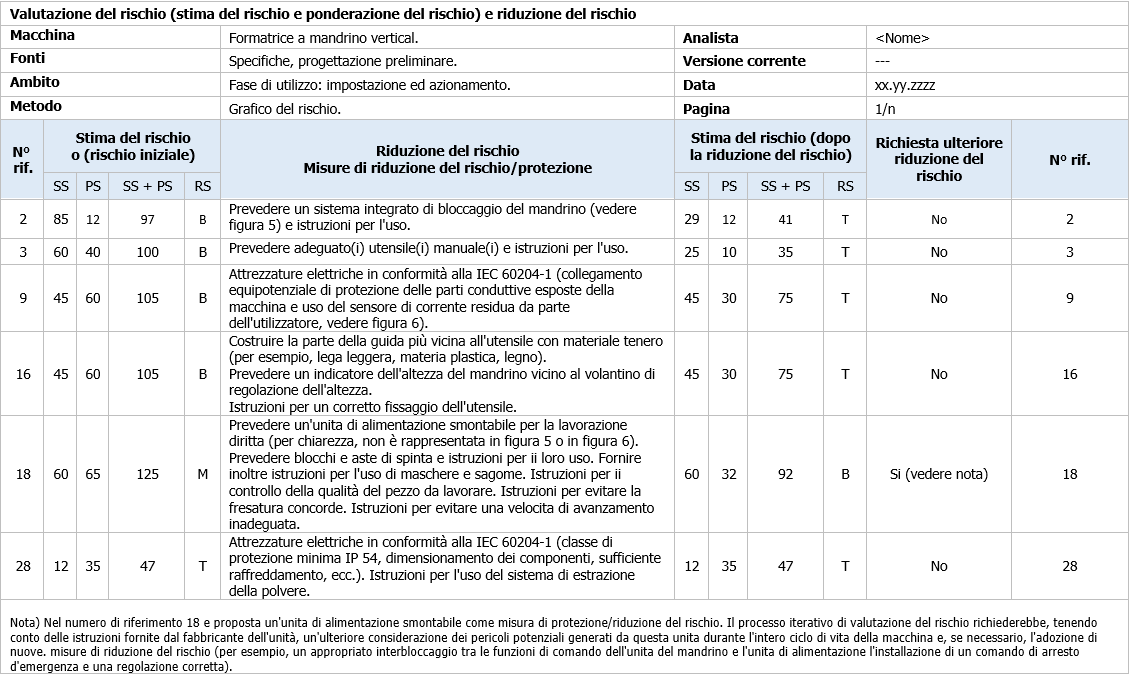
Caratteristiche
La direttiva 2014/68/UE PED si applica alle attrezzature o insiemi di attrezzature a pressione (recipienti, generatori di vapore, tubazioni, accessori a pressione).
Il servizio di certificazione è effettuato dall'Inail in qualità di organismo notificato. I tecnici dell’Istituto eseguono – in accordo al relativo modulo di valutazione della conformità – adeguati esami e verifiche sulle attrezzature o insiemi a pressione fabbricati in accordo alla direttiva 2014/68/UE PED destinati a essere immessi sul mercato e messi in servizio all’interno dell’Unione Europea.
Modalità di richiesta
Il cliente richiede il servizio di certificazione all’Organismo Notificato 0100 e, per conoscenza, all’Unità operativa territoriale di certificazione, verifica e ricerca competente, attraverso la compilazione delle richieste di prestazione PED.
Il cliente deve allegare alla richiesta tutta la documentazione tecnica necessaria per consentire la valutazione della conformità del prodotto ai corrispondenti requisiti essenziali di sicurezza previsti dalla direttiva di riferimento. La richiesta può essere inoltrata:
- per posta ordinaria (O.N.0100- Via Roberto Ferruzzi 38-40, 00143 Roma);
- attraverso PEC (Questo indirizzo email è protetto dagli spambots. E' necessario abilitare JavaScript per vederlo.
).
Modalità di erogazione del servizio
Al termine dell'iter, l'Istituto rilascia il certificato e invia all’utente la fattura con i costi relativi alla prestazione svolta. Il relativo pagamento può essere effettuato a mezzo bonifico bancario con specifico riferimento al numero della fattura assegnato.
_______
[panel]12. Doveri della ditta richiedente la certificazione
La Ditta richiedente la Certificazione deve:
- rispettare le prescrizioni del presente Regolamento;
- fornire tutta la documentazione tecnica (come previsto da ciascun Modulo di cui all’Allegato III della Direttiva PED) relativa al prodotto da certificare in lingua italiana (eventualmente può essere accettata la lingua inglese), necessaria alla valutazione dello stesso;
- mettere a disposizione gli esemplari, eventuali campioni o il prototipo per l’esecuzione della verifica finale prevista dalla Direttiva e tutte le verifiche e prove necessarie, garantendo al personale ispettivo di INAIL O.N. 0100 accesso ai locali di fabbricazione del prodotto;
- non commercializzare prodotti prima della conclusione con esito positivo dell’iter di Certificazione;
- comunicare ad INAIL O.N. 0100, in forma preventiva, delle eventuali modifiche apportate al prodotto oggetto di certificazione e/o al relativo processo di produzione e/o al sistema qualità;
- comunicare ad INAIL O.N. 0100 eventuali reclami ricevuti da clienti relativamente al prodotto certificato;
- consentire, nel periodo di validità del contratto e del certificato, ove applicabile, lo svolgimento delle attività di sorveglianza sulla produzione o sul sistema di qualità attuato;
- fornire e mantenere aggiornata tutta la documentazione richiesta;
- informare INAIL O.N. 0100 in merito a trasferimenti di proprietà, variazioni di recapiti, apertura nuove sedi e/o succursali, cambi di denominazione sociale, modifiche significative dei propri cicli lavorativi;
- fornire, in caso rinnovo della certificazione, i dati aggiornati relativi al prodotto nonché gli eventuali reclami ricevuti;
- interrompere l’utilizzo di tutti i materiali pubblicitari che fanno riferimento alla certificazione, nel caso di sospensione o di revoca della stessa;
- rettificare tutti i materiali pubblicitari qualora il campo di applicazione della certificazione sia stato ridotto;
- non lasciare intendere che la certificazione si applichi a prodotti o attività che sono fuori dal campo di applicazione della certificazione;
- non utilizzare la propria certificazione in modo tale da poter danneggiare la reputazione dell’organismo di certificazione e/o del sistema di certificazione e compromettere la fiducia del pubblico;
- garantire l’accesso degli Ispettori/Auditor ivi compresi quelli ACCREDIA alla documentazione, alle aree aziendali di produzione e, ove applicabile, a tutte le registrazioni del Sistema Qualità per assicurare il corretto svolgimento della Verifica Ispettiva;
- garantire l’accesso ai valutatori ACCREDIA previa comunicazione da parte di INAIL O.N. 0100 dei loro nominativi;
- il Fabbricante in possesso di Certificazione si impegna a mantenere efficiente ed efficace il proprio sistema di gestione della qualità conformemente ai requisiti della direttiva PED;
- attuare i trattamenti alle non conformità e le azioni correttive al proprio Sistema di Gestione a seguito degli scostamenti rilevati;
- garantire l’accesso al personale ispettivo in addestramento e in supervisione;
- rendersi disponibile ad eventuali verifiche supplementari richieste sia da parte di INAIL O.N. 0100 sia da parte dell’Ente di Accreditamento. Alcune verifiche supplementari possono essere eseguite con un preavviso massimo di 5 giorni e il fabbricante non può ricusare il team incaricato di eseguire l’attività di valutazione. Tali verifiche sono in genere a carico di INAIL O.N. 0100 e sono eseguite a fronte di segnalazioni gravi che coinvolgono il prodotto; la non effettuazione di questa tipologia di verifica, comporta la revoca della certificazione concessa;
- rendersi disponibile ad eseguire delle verifiche con un preavviso di 5 giorni, a seguito di ricezione di reclami e/o segnalazioni, di sospensioni della certificazione senza possibilità di ricusare il team incaricato di eseguire tale audit;
- in caso di scadenza, o ritiro/revoca della certificazione, restituire i certificati e cessare di utilizzare tutti i riferimenti alla certificazione. Nei casi di scadenza del certificato correlato ai moduli di qualità il fabbricante non può continuare la produzione e la relativa certificazione;
- obbligo di informazione su eventuali procedimenti giudiziari e/o amministrativi in corso L'Organizzazione in possesso di Certificazione si impegna a: - informare entro 5 giorni dall’evento l'Istituto a mezzo e-mail lettera raccomandata A.R. o PEC di tutte le situazioni difformi rilevate dalle Autorità di controllo, eventuali sospensioni o revoche di autorizzazioni, concessioni, ecc. relative alla produzione/erogazione di prodotti e/o servizi connessi alla certificazione - comunicare immediatamente all’Istituto eventuali procedimenti giudiziari e/o amministrativi in corso, riguardanti l’oggetto della certificazione, fatti salvi i limiti posti dalla legge; - comunicare immediatamente il verificarsi di incidenti o di infortuni gravi o mortali o di danni ambientali. - mantenere informato l’Istituto sugli sviluppi dei suddetti procedimenti. In relazione a quanto sopra l’Istituto si riserva la facoltà di eseguire opportune e tempestive verifiche ispettive straordinarie ed, eventualmente, adottare provvedimenti di sospensione, riduzione, e/o revoca della certificazione rilasciata, in base agli impatti sul Sistema di gestione dell’Organizzazione.[/panel]
Fonte: INAIL
Collegati:
[box-note]Nuova Direttiva PED 2014/68/UE
Norme Armonizzate nuova Direttiva PED Settembre 2018
Nuova Direttiva PED 2014/68/UE: file CEM[/box-note]
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2021
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2021
CECE, January 2021
The purpose of this frequently asked questions (hereinafter ‘FAQ’) document is to contribute to a clear understanding of the Regulation (EU) 2016/1628, as amended by Regulation (EU) 2020/1040 (hereafter referred to as ‘the regulation’) and the relevant supplementing legislation:
a) Commission Delegated Regulation (EU) 2017/654 with regard to technical and general requirements relating to emission limits and type-approval for internal combustion engines for non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/989
b) Commission Delegated Regulation (EU) 2017/655 on monitoring of gaseous pollutant emissions from in-service combustion engines installed in non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/987
c) Commission Implementing Regulation (EU) 2017/656 on administrative requirements relating to emission limits and type-approval for internal combustion engines for non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/988
The new requirements introduced in the amendments to the supplementing legislation are applicable from the following dates:
- 07 August 2018: These amendments may be used for Stage V type-approvals, revisions or extensions from this date onwards
- 01 January 2019: These amendments must be used for Stage V type-approvals, revisions or extensions from this date onwards
- 01 July 2019: All engines placed on market from this date must comply with these amendments and, for Stage V engines, be covered by a type-approval that was originally issued, or where necessary has been updated, in accordance with these amendments
The new requirements introduced in the amendment Regulation (EU) 2020/1040 to the Regulation (EU) 2016/1628 are applicable from the following dates:
- 01 July 2020: Amending Regulation (EU) 2016/1628 as regards its transitional provisions in order to address the impact of the COVID-19 crisis. The amendment covers only machines in which transition engines (variable or constant speed) that are in the power categories <56kW and ≥130kW are installed.
This regulation:
- concerns emission limits and type approval procedures for engines installed or intended to be installed in non-road mobile machinery
- it is also applicable to non-road mobile machinery where these engines are fitted
- entered into force on 6 October 2016 and is applicable from 1 January 2017
This FAQ:
- is intended to provide answers to key questions that are likely to be asked by users of the regulations, focusing especially on relevant provisions and obligations for the machine manufacturer (original equipment manufacturer (OEM)), importers and distributors
- does not cover the type-approval of the engine
...
Fonte: CECE, January 2021
Correlati
[box-note]Regolamento (UE) 2016/1628 NRMM
Non-Road Mobile Machinery emissions - NRMM Guide
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Non-Road Mobile Machinery emissions - NRMM Guide Update 2021.pdf |
1417 kB | 10 |
Rettifica del regolamento (UE) 2020/740 | 30.04.2021
Rettifica del regolamento (UE) 2020/740 | 30.04.2021
Rettifica del regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009
GU L 147/23 del 30.4.2021
...
1) Nella Tavola di concordanza e alla pagina 1, titolo
anziché:
«Regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009»,
leggasi:
«Regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009 (Testo rilevante ai fini del SEE)».
2) Pagina 18, allegato II, punto 2.1, l'immagine della parte superiore dell'etichetta del pneumatico è sostituita dalla seguente:

3) Pagina 20, allegato II, punto 2.1.4, l'immagine della parte inferiore dell'etichetta del pneumatico è sostituita dalla seguente:
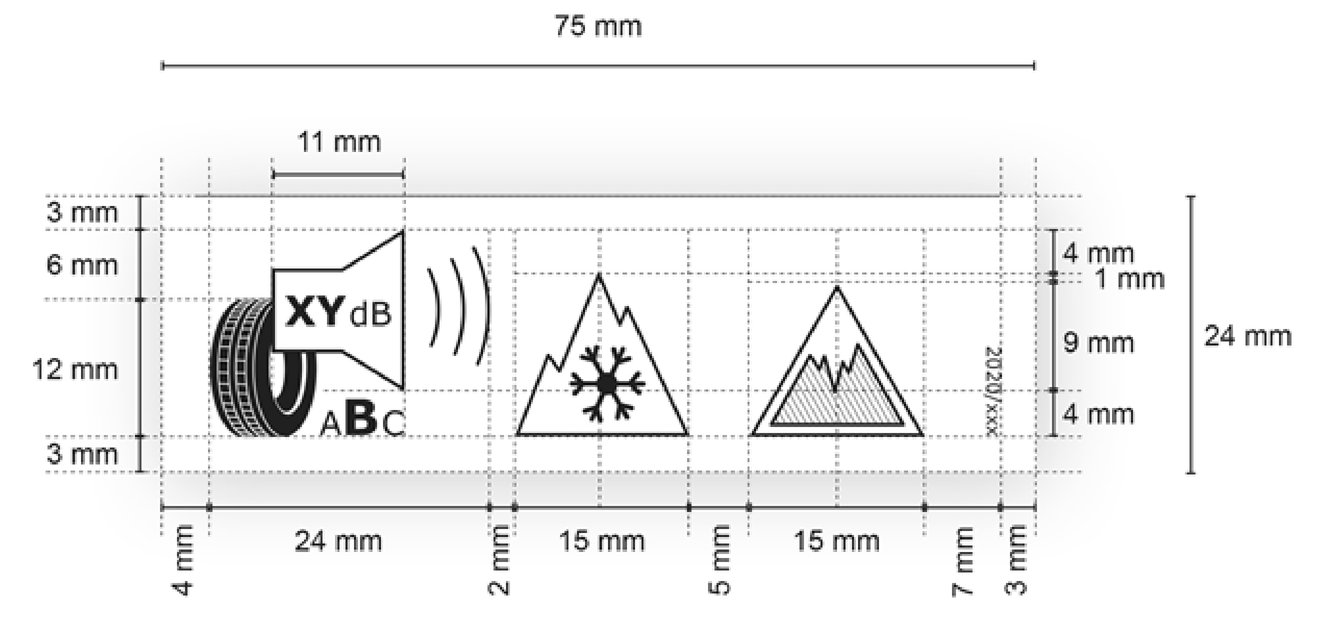
4) Pagina 21, allegato II, punto 2.2, lettera e), trattino 28:
anziché:
«pittogramma aderenza sulla neve: larghezza 15 mm, altezza 13 mm, <…>»,
leggasi:
«pittogramma aderenza sulla neve: larghezza 15 mm, altezza 14 mm, <…>».
Collegati
[box-note]Regolamento (UE) 2020/740[/box-note]
RAPEX Report 14 del 09/04/2021 N. 01 A12/00484/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 14 del 09/04/2021 N. 01 A12/00484/21 Repubblica Ceca
Approfondimento tecnico: Felpa per bambini
Il prodotto, di marca KILPI, mod. COTNY, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla norma tecnica europea EN 14682:2015 “Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini - Specifiche”
Il laccio del cappuccio è troppo lungo e con le estremità libere, il bambino potrebbe restare intrappolato con conseguente strangolamento.
EN 14682:2015 Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini – Specifiche
[…]
3.3 - Zona testa, collo e parte superiore del torace nei capi di abbigliamento per bambini più grandi e ragazzi (figura 1, zona A)
I lacci non devono avere estremità libere.
I lacci passanti privi di estremità libere non devono avere passanti sporgenti quando il capo di abbigliamento è steso su una superficie piana, alla massima estensione. Quando il capo è steso in taglia, ossia con la chiusura regolata alla vestibilità prevista, la circonferenza massima dei passanti sporgenti non deve essere di 15 cm.
Quando sono utilizzati dei fermacorda per la regolazione dei lacci passanti privi di estremità, il fermacorda deve essere fissato al capo di abbigliamento.
I cordoncini funzionali devono avere lunghezza non maggiore di 7.5 cm. I cordoncini funzionali non devono essere realizzati con cordoncini elastici.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 14 del 09_04_2021 N. 01 A12_00484_21 Repubblica Ceca.pdf Felpa per bambini |
364 kB | 0 |
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Tavola di concordanza estesa Direttiva/Regolamento Macchine 2023 - Testo pubblicato in GU in vigore dal 19.07.2023
ID 13382 | Rev. 5.0 del 13 Maggio 2025 / In allegato tavola di concordanza completa
La tavola di seguito proposta mette a confronto e raccorda l’articolato e gli allegati della Direttiva 2006/42/CE (IT) con i novelli propri del Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
[box-note]Rev. 5.0 del 13 Maggio 2025
- Regolamento (UE) 2024/2748 del Parlamento europeo e del Consiglio, del 9 ottobre 2024, che modifica i regolamenti (UE) n. 305/2011, (UE) 2016/424, (UE) 2016/425, (UE) 2016/426, (UE) 2023/988 e (EU) 2023/1230 per quanto riguarda le procedure di emergenza per la valutazione della conformità, la presunzione di conformità, l’adozione di specifiche comuni e la vigilanza del mercato nel contesto di un’emergenza nel mercato interno. GU L 2024/2748 dell'8.11.2024. Entrata in vigore: 28.11.2024. Applicazione a decorrere dal 29 maggio 2026[/box-note]
[box-note]Rev. 4.0 del 04 Luglio 2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-note]
[box-note]Rev. 3.0 del 03 Luglio 2023
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU n. 165/1 del 29.06.2023). Entrata in vigore: 19.07.2023[/box-note]
[box-note]Rev. 2.0 del 21 Aprile 2023
- Tavola aggiornata con il raffronto Direttiva 2006/42/CE (IT) e nuovo Regolamento macchine così come da Testo approvato - Macchine - P9_TA(2023)0097 - Risoluzione legislativa del Parlamento europeo del 18 aprile 2023 sulla proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina in lingua italiana.
Il Parlamento Europeo, con 595 voti a favore, 7 contrari e 30 astenuti, ha adottato, nella seduta del 18 aprile 2023, il nuovo Regolamento Macchine.
Il nuovo Regolamento Macchine dovrebbe essere pubblicato sulla Gazzetta Ufficiale dell’Unione Europea nella prima parte del prossimo mese di luglio: entrata in vigore, quindi, 20 giorni dopo la pubblicazione.
Il nuovo Regolamento Macchine, poi, diverrà applicabile 42 mesi dopo l’entrata in vigore.
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal... [42 mesi dopo la data di entrata in vigore del presente regolamento].
I riferimenti alla La direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della La direttiva 2006/42/CE prima del … [42 mesi dopo la data di entrata in vigore del presente regolamento]. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal... [data di entrata in vigore del presente regolamento] mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della La direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della La direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal … [42 mesi dopo la data di entrata in vigore del presente regolamento]. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal … [sei mesi dopo la data di entrata in vigore del presente regolamento];
b) l'articolo 50, paragrafo 1, si applica a decorrere dal ... [39 mesi dopo la data di entrata in vigore del presente regolamento];
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal ... [data di entrata in vigore del presente regolamento];
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal ... [12 mesi dopo l'entrata in vigore del presente regolamento].
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.[/box-note]
[box-note]Rev. 1.0 del 29.10.2021
- Inserita nella tavola di concordanza colonna di raffronto contenente novità/modifiche previste dagli emendamenti del 20 Ottobre 2021 alla Proposta CE di regolamento del 21 Aprile 2021.
In rosso le novità/modifiche previste dagli emendamenti del 20 Ottobre 2021 alla Proposta CE di regolamento del 21 Aprile 2021.[/box-note]
...
Estratto
Tavola di concordanza estesa Direttiva / Regolamento Macchine 2023
Colonna (1) - Direttiva 2006/42/CE
Colonna (2) - Regolamento (UE) 2023/1230
... Segue in allegato
Certifico Srl - IT | Rev. 5.0 2025
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 5.0 | 13.05.2025 | Regolamento (UE) 2024/2748 | Certifico Srl |
| 4.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 (GU L 169/35 del 4.7.2023) | Certifico Srl |
| 3.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 2.0 | 21.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 1.0 | 29.10.2021 | Emendamenti del 20 Ottobre 2021 | Certifico Srl |
| 0.0 | 22.04.2021 | --- | Certifico Srl |
Collegati
[box-note]Il Parlamento Europeo adotta il Regolamento Macchine
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Proposal for a Regulation on machinery products
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020
Regolamento (UE) 2024/2748[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 5.0 2025.pdf Certifico Srl - Rev. 5.0 2025 |
1036 kB | 20 | ||
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 4.0 2023.pdf Certifico Srl - Rev. 4.0 2023 |
937 kB | 138 | ||
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
940 kB | 71 | ||
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 2.0_2023.pdf Certifico Srl - Rev. 2.0 2023 |
933 kB | 198 | ||
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 1.0 2021.pdf Certifico Srl - Rev. 1.0 2021 |
939 kB | 110 | ||
| Tavola di concordanza estesa Direttiva-Regolamento Macchine Rev. 00 2021.pdf Certifico S.r.l. Rev. 0.0 2021 |
708 kB | 173 |
Direttiva delegata (UE) 2021/647

Direttiva delegata (UE) 2021/647
Direttiva delegata (UE) 2021/647 della Commissione del 15 gennaio 2021 che modifica, adeguandolo al progresso scientifico e tecnico, l’allegato III della direttiva 2011/65/UE del Parlamento europeo e del Consiglio per quanto riguarda l’esenzione relativa all’uso di determinati composti di piombo e cromo esavalente negli iniziatori elettrici e elettronici di esplosivi per uso civile (professionale)
GU L 133/54 del 20.4.2021
Entrata in vigore: 10.05.2021
Applicazione dal 1° novembre 2021
...
Articolo 1
L’allegato III della direttiva 2011/65/UE è modificato conformemente all’allegato della presente direttiva.
Articolo 2
1. Gli Stati membri adottano e pubblicano, entro il 31 ottobre 2021, le disposizioni legislative, regolamentari e amministrative necessarie per conformarsi alla presente direttiva. Essi ne informano immediatamente la Commissione.
Essi applicano tali disposizioni a decorrere dal 1° novembre 2021.
Le disposizioni adottate dagli Stati membri contengono un riferimento alla presente direttiva o sono corredate di tale riferimento all’atto della pubblicazione ufficiale. Le modalità del riferimento sono stabilite dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni principali di diritto interno che adottano nel settore disciplinato dalla presente direttiva.
Articolo 3
La presente direttiva entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
...
ALLEGATO
All’allegato III della direttiva 2011/65/UE, è aggiunto il seguente punto 45:
|
«45 |
L’azoturo di piombo, lo stifnato di piombo, il dipicramato di piombo, il minio arancione (tetrossido di piombo), il biossido di piombo presenti negli iniziatori elettrici ed elettronici di esplosivi per uso civile (professionale) e il cromato di bario utilizzato nelle cariche a lungo ritardo degli iniziatori elettrici ed elettronici degli esplosivi per uso civile (professionale) |
Si applica alla categoria 11 e scade il 20 aprile 2026.» |
Collegati
[box-note]Direttiva RoHS: Open Scope dal 22 luglio 2019
Direttiva RoHS: Evoluzioni
Direttiva (UE) 2015/863: Modifica all'allegato II RoHS II
Dichiarazione UE di Conformità RoHS II - Modello
Direttiva RoHS 2 Testo Consolidato 2017
Decreto Legislativo n. 27 del 4 Marzo 2014
Indicazioni operative ambito applicazione direttiva RAEE[/box-note]
Norme armonizzate Direttiva dispositivi medici (MD) 93/42/CEE
Norme armonizzate Direttiva dispositivi medici 93/42/CEE
ID 13362 | Elenco Norme armonizzate Direttiva dispositivi medici 93/42/CEE ad Aprile 2021
[box-warning]Come consultare i riferimenti alle norme armonizzate 2021
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi della Direttiva 93/42/CEE sono contenuti nelle:
1. Comunicazione della Commissione nell’ambito dell’applicazione della direttiva 93/42/CEE del Consiglio, del 14 giugno 1993, concernente i dispositivi medici. Comunicazione 2017/C 389/03 del 17 Novembre 2017 (GU C 389/29 del 17.11.2017)
2. Decisione di esecuzione (UE) 2020/437 della Commissione del 24 marzo 2020 relativa alle norme armonizzate per i dispositivi medici elaborate a sostegno della direttiva 93/42/CEE del Consiglio. (GU LI 90/1 del 25.03.2020). Entrata in vigore: 25.03.2020. Applicazione fino al 26.05.2024
3. Decisione di esecuzione (UE) 2021/610 della Commissione del 14 aprile 2021 che modifica la decisione di esecuzione (UE) 2020/437 per quanto riguarda le norme armonizzate sui veicoli medici e loro attrezzatura, sulle apparecchiature per anestesia e ventilazione polmonare, sulla valutazione biologica dei dispositivi medici, sugli imballaggi per dispositivi medici sterilizzati terminalmente, sulla sterilizzazione dei dispositivi medici, sull'indagine clinica dei dispositivi medici per soggetti umani, sugli impianti chirurgici non attivi, sui dispositivi medici che utilizzano tessuti animali e loro derivati, sull'elettroacustica e sugli apparecchi elettromedicali. (GU L 129/153 del 15.04.2021). Entrata in vigore: 15.04.2021
e devono essere letti insieme, tenendo conto che l'ultima decisione modifica alcuni riferimenti pubblicati nella comunicazione e nelle decisioni precedenti pubblicate.[/box-warning]
[box-download]In fondo all'articolo, scorrendo la pagina, allegato PDF dell'elenco consolidato delle norme armonizzate MD ad Aprile 2021 riservato Abbonati Marcatura CE. [/box-download]
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
...
Elenco consolidato Norme armonizzate Direttiva 93/42/CEE MD al 15 Aprile 2021
Elenco consolidato che tiene conto delle:
1. Comunicazione 2017/C 389/03 del 17 Novembre 2017 (GU C 389/29 del 17.11.2017)
2. Decisione di esecuzione (UE) 2020/437 (GU LI 90/1 del 25.03.2020).
3. Decisione di esecuzione (UE) 2021/610 (GU L 129/153 del 15.04.2021)
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Prima pubblicazione GU |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione Nota 4 |
|
CEN |
EN 285:2006+A2:2009 Sterilizzazione - Sterilizzatrici a vapore - grandi sterilizzatrici |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
3EN 455-1:2000 Guanti medicali monouso - Assenza di fori - requisiti e prove |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 455-2:2009+A2:2013 Guanti medicali monouso - Parte 2: Requisiti e prove per le proprietà fisiche |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 455-3:2006 Guanti medicali monouso - Parte 3: Requisiti e prove per la valutazione biologica |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 455-4:2009 Guanti medicali monouso - Parte 4: Requisiti e prove per la determinazione della durata di conservazione |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 556-1:2001 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l'indicazione "STERILE" - Requisiti per i dispositivi medici sterilizzati terminalmente EN 556-1:2001/AC:2006 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 556-2:2015 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l'indicazione "STERILE" - Parte 2: Requisiti per i dispositivi medici preparati asetticamente |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 794-3:1998+A2:2009 Ventilatori polmonari - Parte 3: Requisiti particolari dei ventilatori per emergenza e trasporto |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1041:2008 Informazioni fornite dal fabbricante di dispositivi medici |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1060-3:1997+A2:2009 Sfigmomanometri non invasivi - Parte 3: Requisiti supplementari per sistemi elettromeccanici di misurazione della pressione sanguigna |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1060-4:2004 Sfigmomanometri non invasivi - Parte 4: Procedimenti di prova per determinare l'accuratezza generale del sistema degli sfigmomanometri non invasivi automatici |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 1135-4:2011 Attrezzatura di trasfusione per uso medico - Parte 4: Set di trasfusione monouso (ISO 1135-4:2010) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1282-2:2005+A1:2009 Tubi per tracheotomia - Parte 2: Tubi pediatrici (ISO 5366-3:2001 modificata) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1422:1997+A1:2009 Sterilizzatrici per uso medico - Sterilizzatrici a ossido di etilene - Requisiti e metodi di prova |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
16EN 1618:1997 Cateteri diversi da quelli intravascolari - Metodi di prova per le proprietà comuni |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
1EN 1639:2009 Odontoiatria - Dispositivi medici per odontoiatria - Strumenti |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
1EN 1640:2009 Odontoiatria - Dispositivi medici per odontoiatria - Attrezzatura |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
19EN 1641:2009 Odontoiatria - Dispositivi medici per odontoiatria - Materiali |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1642:2011 Odontoiatria - Dispositivi medici per odontoiatria - Impianti dentali |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1707:1996 Raccordi conici al 6% (Luer) per siringhe, aghi ed altra strumentazione medica - Raccordi di serraggio |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1782:1998+A1:2009 Tubi tracheali e raccordi |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1789:2020 Veicoli medici e loro attrezzatura – Autoambulanze |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 1820:2005+A1:2009 Palloni per anestesia (ISO 5362:2000 modificata) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1865-1:2010+A1:2015 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - Parte 1: Sistemi generali di barelle e attrezzature per il trasporto dei pazienti |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1865-2:2010+A1:2015 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - Parte 2: Barelle a propulsione assistita |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
27EN 1865-3:2012 Att28rezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - Parte 3: Barelle per carichi pesan29ti |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
3 EN 1865-4:2012 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - Parte 4: Poltrona pieghevole per il trasferimento del paziente |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1865-5:2012 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - Parte 5: Supporto per barella |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 1985:1998 Ausili alla deambulazione - Requisiti generali e metodi di prova Questa norma non è stata ancora modificata per tener conto delle prescrizioni introdotte dalla direttiva 2007/47/CE. La norma modificata sarà pubblicata dal CEN il più presto possibile. Si consiglia ai fabbricanti di verificare se è opportunamente rispettata la conformità a tutti i pertinenti requisiti essenziali della direttiva modificata. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 3826-2:2008 Contenitori pieghevoli di plastica per sangue umano e componenti del sangue - Parte 2: Simboli grafici per l’utilizzo sulle etichette e sui fogli illustrativi (ISO 3826-2:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 3826-3:2007 Contenitori pieghevoli di plastica per sangue umano e componenti del sangue - Parte 3: Sistemi a sacca di sangue con accessori integrati (ISO 3826-3:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
33EN ISO 3826-4:2015 Contenitori pieghevoli di plastica per sangue umano e componenti del sangue - Parte 4: Sistemi per aferesi a sacca di sangue con accessori integrati (ISO 3826-4:2015) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
34EN ISO 4074:2002 Profilattici in lattice di gomma naturale - Requisiti e metodi di prova (ISO 4074:2002) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 4135:2001 Apparecchi per anestesia e ventilazione polmonare - Vocabolario (ISO 4135:2001) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 5359:2008 Tubi flessibili per bassa pressione per l'utilizzo con i gas medicali (ISO 5359:2008) EN ISO 5359:2008/A1:2011 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
3EN ISO 5360:2009 Vaporizzatori d'anestesia - Sistemi di riempimento specifici (ISO 5360:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 5361:2016 Apparecchiature per anestesia e ventilazione polmonare - Tubi tracheali e raccordi (ISO 5361:2016)
|
15.04.2021 |
|
|
Con Dec. di esec. (UE) 2021/610 la norma è pubblicata |
|
CEN |
3EN ISO 5366-1:2009 Apparecchiature per anestesia e ventilazione polmonare - Tubi di tracheostomia - Parte 1: Tubi e connettori per l'utilizzo su adulti (ISO 5366-1:2000) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 5840:2009 Impianti cardiovascolari - Protesi valvolari cardiache (ISO 5840:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7197:2009 Impianti neurochirurgici - Sistemi di deviazione "shunt" e componenti sterili, monouso per idrocefalia |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7376:2009 Apparecchiature per anestesia e ventilazione polmonare - Laringoscopi per intubazione tracheale (ISO 7376:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7396-1:2007 Impianti di distribuzione dei gas medicali - Parte 1: Impianti di distribuzione dei gas medicali compressi e per vuoto (ISO 7396-1:2007) EN ISO 7396-1:2007/A1:2010 EN ISO 7396-1:2007/A2:2010 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7396-2:2007 Impianti di distribuzione dei gas medicali - Parte 2: Impianti di evacuazione dei gas anestetici (ISO 7396-2:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7886-3:2009 Sir45inghe ipodermiche sterili monouso - Parte 3: Siringhe autobloccanti per vaccinazione a dose fissa (ISO 7886-3:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 7886-4:2009 Siringhe ipodermiche sterili monouso - Parte 4: Siringhe con dispositivo che impedisce il riuso (ISO 7886-4:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8185:2009 Umidificatori per le vie respiratorie per uso medico - Requisiti particolari per i sistemi di umidificazione respiratoria (ISO 8185:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8359:2009 Concentratori di ossigeno per uso medico - Requisiti di sicurezza (ISO 8359:1996) EN ISO 8359:2009/A1:2012 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8835-2:2009 Sistemi di anestesia per inalazione - Parte 2: Sistemi respiratori anestetici (ISO 8835-2:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8835-3:2009 Sistemi di anestesia per inalazione - Parte 3: Sistemi di trasferimento e di ricezione degli impianti di evacuazione dei gas anestetici (ISO 8835-3:2007) EN ISO 8835-3:2009/A1:2010 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8835-4:2009 Sistemi di anestesia per inalazione - Parte 4: Dispositivi di alimentazione di vapore anestetico (ISO 8835-4:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 8835-5:2009 Sistemi di anestesia per inalazione - Parte 5: Ventilatori per anestesia (ISO 8835-5:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 9170-1:2008 Unità terminali per impianti di distribuzione dei gas medicali - Parte 1: Unità terminali per l'utilizzo con gas medicali compressi e vuoto (ISO 9170-1:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 9170-2:2008 Unità terminali per impianti di distribuzione di gas medicali - Parte 2: Unità terminali per impianti di evacuazione dei gas anestetici (ISO 9170-2:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 9360-1:2009 Apparecchiature per anestesia e ventilazione polmonare - Scambiatori di calore e di umidità (SCU) utilizzati per umidificare i gas respirati dalle persone - Parte 1: Scambiatori di calore e di umidità per l'impiego con volumi minimi di emissione del respiro di 250 ml (ISO 9360-1:2000) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 9360-2:2009 Apparecchiature per anestesia e ventilazione polmonare - Scambiatori di calore e di umidità (SCU) utilizzati per umidificare i gas respirati dalle persone - Parte 2: Scambiatori di calore e di umidità per l'impiego con pazienti tracheostomizzati aventi volumi minimi di emissione del respiro di 250 ml (ISO 9360-2:2001) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 9713:2009 Impianti neurochirurgici - Clips intracraniali autochiudenti per aneurisma (ISO 9713:2002) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10079-1:2009 Aspiratori per uso medico - Parte 1: Aspiratori azionati elettricamente - Requisiti di sicurezza (ISO 10079-1:1999) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10079-2:2009 Aspiratori per uso medico - Parte 2: Aspiratori azionati manualmente (ISO 10079-2:1999) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10079-3:2009 Aspiratori per uso medico - Parte 3: Aspiratori azionati da una sorgente di vuoto o di pressione (ISO 10079-3:1999) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10328:2016 Protesica - Prove strutturali delle protesi degli arti inferiori - Requisiti e metodi di prova (ISO 10328:2016) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10524-1:2006 Riduttori di pressione per l'utilizzo con i gas medicali - Parte 1: Riduttori di pressione e riduttori di pressione con flussometro (ISO 10524-1:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10524-2:2006 Riduttori di pressione per l'utilizzo con i gas medicali - Parte 2: Riduttori di pressione di centrale e di linea (ISO 10524-2:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10524-3:2006 Riduttori di pressione per l'utilizzo con i gas medicali - Parte 3: Riduttori di pressione incorporati nella valvola della bombola (ISO 10524-3:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10524-4:2008 Riduttori di pressione per l'utilizzo con i gas medicali - Parte 4: Riduttori per bassa pressione (ISO 10524-4:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10535:2006 Sollevatori per il trasferimento di persone disabili - Requisiti e metodi di prova (ISO 10535:2006) Questa norma non è stata ancora modificata per tener conto delle prescrizioni introdotte dalla direttiva 2007/47/CE. La norma modificata sarà pubblicata dal CEN il più presto possibile. Si consiglia ai fabbricanti di verificare se è opportunamente rispettata la conformità a tutti i pertinenti requisiti essenziali della direttiva modificata. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10555-1:2009 Cateteri intravascolari sterili monouso - Parte 1: Requisiti generali |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10651-2:2009 Ventilatori polmonari per uso medico - Requisiti particolari per la sicurezza di base e le prestazioni essenziali - Parte 2: Ventilatori per le cure a domicilio per pazienti dipendenti dal ventilatore (ISO 10651-2:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10651-4:2009 Ventilatori polmonari - Parte 4: Requisiti particolari per resuscitatori manuali (ISO 10651-4:2002) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10651-6:2009 Ventilatori polmonari per uso medico - Requisiti particolari per la sicurezza di base e le prestazioni essenziali - Parte 6: Dispositivi di assistenza respiratoria a domicilio (ISO 10651-6:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-1:2009 Valutazione biologica dei dispositivi medici - Parte 1: Valutazione e prove all'interno di un processo di gestione del rischio (ISO 10993-1:2009) EN ISO 10993-1:2009/AC:2010 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-3:2014 Valutazione biologica dei dispositivi medici - Parte 3: Prove di genotossicità, carcinogenicità e tossicità sulla riproduzione (ISO 10993-3:2014) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-4:2009 Valutazione biologica dei dispositivi medici - Parte 4: Scelta delle prove relative alla interazione col sangue |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-5:2009 Valutazione biologica dei dispositivi medici - Parte 5: Prove per la citotossicità in vitro (ISO 10993-5:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-6:2009 Valutazione biologica dei dispositivi medici - Parte 6: Prove relative agli effetti locali dopo l'impianto (ISO 10993-6:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-7:2008 Valutazione biologica dei dispositivi medici - Parte 7: Residui della sterilizzazione a ossido di etilene (ISO 10993-7:2008) EN ISO 10993-7:2008/AC:2009 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-9:2009 Valutazione biologica dei dispositivi medici - Parte 9: Struttura per l'identificazione e la quantificazione dei prodotti potenziali di degradazione (ISO 10993-9:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-11:2018 Valutazione biologica dei dispositivi medici - Parte 11: Prove di tossicità sistematica (ISO 10993-11:2017) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
Valutazione biologica dei dispositivi medici - Parte 11: Prove di tossicità sistemica (ISO 10993-11:2006) |
2.12.2009 |
EN ISO 10993- 11:2006 Nota 2.1 |
21.3.2010 |
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 10993-12:2012 Valutazione biologica dei dispositivi medici - Parte 12: Preparazione dei campioni e materiali di riferimento (ISO 10993-12:2012) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-13:2010 Valutazione biologica dei dispositivi medici - Parte 13: Identificazione e quantificazione di prodotti di degradazione di dispositivi medici a base di polimeri (ISO 10993-13:2010) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-14:2009 Valutazione biologica dei dispositivi medici - Parte 14: Identificazione e quantificazione dei prodotti di degradazione dalle ceramiche (ISO 10993-14:2001) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-15:2009 Valutazione biologica dei dispositivi medici - Parte 15: Identificazione e quantificazione dei prodotti di degradazione da metalli e leghe (ISO 10993-15:2000) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-16:2017 Valutazione biologica dei dispositivi medici - Parte 16: Concezione di studi tossicocinetici per i prodotti di degradazione e le sostanze rilasciabili (ISO 10993-16:2017) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 10993-17:2009 Valutazione biologica dei dispositivi medici - Parte 17: Definizione dei limiti ammissibili per le sostanze rilasciabili (ISO 10993-17:2002) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 10993-18:2020 Valutazione biologica dei dispositivi medici - Parte 18: Caratterizzazione chimica dei materiali di dispositivi medici all'interno di un processo di gestione del rischio (ISO 10993-18:2020) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 11135-1:2007 Sterilizzazione dei prodotti sanitari - Ossido di etilene - Requisiti per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 11135-1:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006, incl. Amd 1:2013) EN ISO 11137-1:2015/A2:2019 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006, including Amd 1:2013)
|
13.5.2016 |
EN ISO 11137-1:2006 Nota 2.1 |
30.06.2016 |
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 11137-2:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 2: Definizione della dose sterilizzante (ISO 11137-2:2013) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11138-2:2009 Sterilizzazione dei prodotti sanitari - Indicatori biologici - Parte 2: Indicatori biologici per processi di sterilizzazione a ossido di etilene (ISO 11138-2:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11138-3:2009 Sterilizzazione dei prodotti sanitari - Indicatori biologici - Parte 3: Indicatori biologici per processi di sterilizzazione a calore umido (ISO 11138-3:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11140-1:2009 Sterilizzazione dei prodotti sanitari - Indicatori chimici - Parte 1: Requisiti generali (ISO 11140-1:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11140-3:2009 Sterilizzazione dei prodotti sanitari - Indicatori chimici - Parte 3: Sistemi indicatori di Classe 2 destinati a essere utilizzati per la prova Bowie-Dick di penetrazione del vapore |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11197:2009 Unità di alimentazione per uso medico (ISO 11197:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11607-1:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - Parte 1: Requisiti per materiali, sistemi di barriera sterili e sistemi di imballaggio (ISO 11607-1:2019) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 11607-2:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - Parte 2: Requisiti di convalida per il formato, la tenuta e i processi di assemblaggio (ISO 11607-2:2019) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 11608-7:2017 Sistemi di iniezione ad ago per uso medico - Requisiti e metodi di prova - Accessibilità per persone con disabilità visiva (ISO 11608-7:2016) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11737-1:2006 Sterilizzazione dei dispositivi medici - Metodi microbiologici - Parte 1: Determinazione di una popolazione di microrganismi sui prodotti (ISO 11737-1:2006) EN ISO 11737-1:2006/AC:2009 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11737-2:2020 Sterilizzazione dei dispositivi medici - Metodi microbiologici - Parte 2: Prove di sterilità eseguite nel corso della definizione, della convalida e del mantenimento di un processo di sterilizzazione (ISO 11737-2:2019) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 11810-1:2009 Laser e sistemi laser - Metodo di prova e classificazione per la resistenza laser dei teli chirurgici e/o delle coperture di protezione dei pazienti - Parte 1: Accensione primaria e penetrazione (ISO 11810-1:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11810-2:2009 Laser e sistemi laser - Metodo di prova e classificazione per la resistenza laser dei teli chirurgici e/o delle coperture di protezione dei pazienti - Parte 2: Accensione secondaria (ISO 11810-2:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11979-8:2009 Impianti oftalmici - Lenti intraoculari - Parte 8: Requisiti fondamentali (ISO 11979-8:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11990:2018 Laser e sistemi laser - Determinazione della resistenza al laser del fusto del tubo tracheale e del palloncino dei tubi tracheali (ISO 11990:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 11990-1:2014 Laser e sistemi laser - Determinazione della resistenza al laser di tubi tracheali - Parte 1: Fusto del tubo tracheale (ISO 11990-1:2011)
|
10.07.2015 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 11990-2:2014 Laser e sistemi laser - Determinazione della resistenza al laser di tubi tracheali - Parte 2: Palloncino dei tubi tracheali (ISO 11990-2:2010) |
10.07.2015 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN 12006-2:1998+A1:2009 Impianti chirurgici non attivi - Requisiti particolari per gli impianti cardio-vascolari - Parte 2: Protesi vascolari inclusi i condotti per valvole cardiache |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12006-3:1998+A1:2009 Impianti chirurgici non attivi - Requisiti particolari per impianti cardiaci e vascolari - Parte 3: Dispositivi endovascolari |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12183:2009 Sedie a rotelle a propulsione manuale - Requisiti e metodi di prova |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12184:2009 Sedie a rotelle a propulsione elettrica, motorette e loro sistemi di carica - Requisiti e metodi di prova |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12342:1998+A1:2009 Tubi di respirazione destinati all'uso con sistemi per anestesia e ventilatori |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12470-1:2000+A1:2009 Termometri clinici - Parte 1: Termometri a dilatazione di liquido metallico in vetro con dispositivo di massimo |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12470-2:2000+A1:2009 Termometri clinici - Parte 2: Termometri a cambiamento di fase (matrice a punti) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12470-3:2000+A1:2009 Termometri clinici - Parte 3: Prestazione dei termometri elettrici compatti (a comparazione e estrapolazione) aventi un dispositivo di massimo |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12470-4:2000+A1:2009 Termometri clinici - Parte 4: Prestazioni dei termometri elettrici per misurazione continua |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 12470-5:2003 Termometri clinici - Parte 5: Prestazioni dei termometri a infrarossi per orecchio (con dispositivo di massimo) Questa norma non è stata ancora modificata per tener conto delle prescrizioni introdotte dalla direttiva 2007/47/CE. La norma modificata sarà pubblicata dal CEN il più presto possibile. Si consiglia ai fabbricanti di verificare se è opportunamente rispettata la conformità a tutti i pertinenti requisiti essenziali della direttiva modificata. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 12870:2009 Ottica oftalmica - Montature per occhiali - Requisiti e metodi di prova (ISO 12870:2004) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13060:2014 Piccole sterilizzatrici a vapore |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-1:2015 Trattamento asettico dei prodotti per la cura della salute - Parte 1: Requisiti generali (ISO 13408-1:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-2:2018 Trattamento asettico dei prodotti per la cura della salute - Parte 2: Filtrazione sterilizzante (ISO 13408-2:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-2:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 2: Filtrazione (ISO 13408-2:2003)
|
19.08.2011 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 13408-3:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 3: Liofilizzazione (ISO 13408-3:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-4:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 4: Tecnologie per la pulizia in loco (ISO 13408-4:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-5:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 5: Sterilizzazione in loco (ISO 13408-5:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-6:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 6: Sistemi isolatori (ISO 13408-6:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13408-7:2015 Trattamento asettico dei prodotti per la cura della salute - Parte 7: Processi alternativi per dispositivi medici e prodotti di combinazione (ISO 13408-7:2012) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2018 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità – Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2016 |
17.11.2017 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN 13544-1:2007+A1:2009 Attrezzatura per terapia respiratoria - Parte 1: Sistemi di nebulizzazione e loro componenti |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13544-2:2002+A1:2009 Attrezzatura per terapia respiratoria - Parte 2: Tubi e connettori |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13544-3:2001+A1:2009 Attrezzatura per terapia respiratoria - Parte 3: Dispositivi per il trasporto dell'aria |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13624:2003 Disinfettanti chimici ed antisettici - Prova quantitativa in sospensione per la valutazione dell'attività fungicida dei disinfettanti chimici per strumenti utilizzati in campo medico - Metodo di prova e requisiti (fase 2, stadio 1) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13718-1:2014+A1:2020 Veicoli medici e loro attrezzatura - Ambulanze aeree - Parte 1: Requisiti per i dispositivi medici utilizzati nelle ambulanze aeree |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 13718-2:2015+A1:2020 Veicoli medici e loro attrezzatura - Ambulanze aeree - Parte 2: Requisiti tecnici e operativi per ambulanze aeree |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 13726-1:2002 Metodi di prova per le medicazioni primarie a contatto con la ferita - Aspetti di assorbimento EN 13726-1:2002/AC:2003 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13726-2:2002 Metodi di prova per le medicazioni primarie a contatto con la ferita - Permeabilità al vapore d'acqua delle medicazioni con pellicola permeabile |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13727:2012 Disinfettanti chimici ed antisettici - Prova quantitativa in sospensione per la valutazione dell’attività battericida in area medica - Metodo di prova e requisiti (fase 2, stadio 1) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13795-1:2019 Indumenti e teli chirurgici - Requisiti e metodi di prova - Parte 1: Teli e camici chirurgici |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13795-2:2019 Indumenti e teli chirurgici - Requisiti e metodi di prova - Parte 2: Tute per blocchi operatori |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13867:2002+A1:2009 Concentrati per emodialisi e terapie associate |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13976-1:2011 Sistemi di soccorso - Trasporto di incubatori - Parte 1: Condizioni di interfaccia |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13976-2:2018 Sistemi di soccorso - Trasporto di incubatori - Parte 2: Requisiti di sistema |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 13976-2:2011 Sistemi di soccorso - Trasporto di incubatori - Parte 2: Requisiti di sistema |
19.08.2011 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN 14079:2003 Dispositivi medici non attivi - Requisiti di prestazione e metodi di prova per le garze di cotone assorbente e le garze di cotone e viscosa assorbente |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14139:2010 Ottica oftalmica - Specifiche per occhiali premontati |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 14155:2020 Indagine clinica dei dispositivi medici per soggetti umani - Buona pratica clinica (ISO 14155:2020) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 14180:2003+A2:2009 Sterilizzatrici per uso medico - Sterilizzatrici a vapore a bassa temperatura e sterilizzatrici a formaldeide - Requisiti e prove |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14348:2005 Disinfettanti chimici ed antisettici - Prova quantitativa in sospensione per la valutazione dell'attività mico-battericida dei disinfettanti chimici nel campo medico, compresi i disinfettanti per strumenti - Metodi di prova e requisiti (fase 2/stadio 1) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 14408:2009 Tubi tracheali progettati per la chirurgia laser - Requisiti per la marcatura e le informazioni di accompagnamento (ISO 14408:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14561:2006 Disinfettanti chimici e antisettici - Prova quantitativa a portatore di germi per la valutazione dell'attività battericida per strumenti utilizzati nell'area medicale - Metodo di prova e requisiti (fase 2, stadio 2) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14562:2006 Disinfettanti chimici e antisettici - Prova quantitativa a portatore di germi per la valutazione dell'attività fungicida o fermentativa per strumenti utilizzati nell'area medicale - Metodo di prova e requisiti (fase 2, stadio 2) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14563:2008 Disinfettanti chimici ed antisettici. Prova quantitativa a portatore di germi per la valutazione dell'attività micobattericida e tubercolicida di disinfettanti chimici usati per strumenti nell'area medicale. Metodo di prova e requisiti (fase 2, stadio 2) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
145EN ISO 14602:2011 Impianti chirurgici non attivi - Impianti per osteosintesi - Requisiti particolari (ISO 14602:2010) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 14607:2018 Impianti chirurgici non attivi - Impianti mammari - Requisiti particolari (ISO 14607:2018, versione rettificata 2018-08) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 14630:2009 Impianti chirurgici non attivi - Requisiti generali (ISO 14630:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14683:2019+AC:2019 Maschere facciali ad uso medico - Requisiti e metodi di prova |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14683:2005 Maschere chirurgiche - Requisiti e metodi di prova
|
2.6.2006 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 14889:2009 Ottica oftalmica - Lenti per occhiali - Requisiti fondamentali relativi a lenti finite non tagliate (ISO 14889:2003) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 14931:2006 Camere iperbariche per persone - Camere iperbariche multiposto per terapia iperbarica - Prestazioni, requisiti di sicurezza e prove |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 14937:2009 Sterilizzazione dei prodotti sanitari - Requisiti generali per la caratterizzazione di un agente sterilizzante e per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 14937:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 14971:2012 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (ISO 14971:2007, Corrected version 2007-10-01) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15001:2011 Apparecchi per anestesia e ventilazione polmonare - Compatibilità con l'ossigeno (ISO 15001:2010) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15002:2008 Dispositivi per la misurazione del flusso per il collegamento alle unità terminali degli impianti di distribuzione dei gas medicali (ISO 15002:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15004-1:2009 Strumenti oftalmici - Requisiti fondamentali e metodi di prova - Parte 1: Requisiti generali applicabili a tutti gli strumenti oftalmici (ISO 15004-1:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15223-1:2016 Dispositivi medici - Simboli da utilizzare nelle etichette del dispositivo medico, nell'etichettatura e nelle informazioni che devono essere fornite - Parte 1: Requisiti generali (ISO 15223-1:2016, Corrected version 2017-03) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15747:2019 Contenitori di plastica per iniezioni intravenose (ISO 15747:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15747:2011 Contenitori di plastica per iniezioni intravenose (ISO 15747:2010) |
27.4.2012 |
EN ISO 15747:2010 Nota 2.1 |
30.4.20212 |
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 15798:2010 Impianti oftalmici - Dispositivi oftalmici viscoelastici (ISO 15798:2010) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15883-1:2009 Apparecchi di lavaggio e disinfezione - Parte 1: Requisiti generali, termini, definizioni e prove (ISO 15883-1:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15883-2:2009 Apparecchi di lavaggio e disinfezione - Parte 2: Requisiti e prove per apparecchi di lavaggio e disinfezione per strumenti chirurgici, apparecchiature per anestesia, corpi cavi, utensili, vetreria, ecc., che utilizzano la termodisinfezione (ISO 15883-2:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15883-3:2009 Apparecchi di lavaggio e disinfezione - Parte 3: Requisiti e prove per apparecchi di lavaggio e disinfezione che utilizzano la termodisinfezione per i contenitori di deiezioni umane (ISO 15883-3:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15883-4:2018 Apparecchi di lavaggio e disinfezione - Parte 4: Requisiti e prove per apparecchi di lavaggio e disinfezione destinati alla disinfezione chimica degli endoscopi termolabili (ISO 15883-4:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 15883-4:2009 Apparecchi di lavaggio e disinfezione - Parte 4: Requisiti e prove per apparecchi di lavaggio e disinfezione destinati alla disinfezione chimica degli endoscopi termolabili (ISO 15883-4:2008)
|
2.12.2009 |
EN ISO 15883-4:2008 Nota 2.1 |
21.3.2010 |
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN 15986:2011 Simbolo utilizzato per l'etichettatura dei dispositivi medici - Requisiti per l'etichettatura dei dispositivi medici contenenti ftalati |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 16061:2009 Strumentazione da utilizzare in associazione con impianti chirurgici non attivi - Requisiti generali (ISO 16061:2008, Corrected version 2009-03-15) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 16201:2006 Ausili tecnici per disabili - Requisiti e metodi di prova per sistemi di controllo dell’ambiente (ISO 16201:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 17510-1:2009 Terapia respiratoria per l'apnea nel sonno - Parte 1: Dispositivi per la terapia respiratoria dell'apnea nel sonno (ISO 17510-1:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 17510-2:2009 Terapia respiratoria per l'apnea nel sonno - Parte 2: Maschere e accessori di applicazione (ISO 17510-2:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 17664:2017 Condizionamento dei prodotti per la cura della salute - Informazioni che devono essere fornite dal fabbricante per il condizionamento di dispositivi medici (ISO 17664:2017) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 17664:2004 Sterilizzazione dei dispositivi medici - Informazioni che devono essere fornite dal fabbricante per i processi di dispositivi medici risterilizzabili (ISO 17664:2004)
|
30.09.2005 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 17665-1:2006 Sterilizzazione dei prodotti sanitari - Calore umido - Sviluppo, validazione e controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 17665-1:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 18777:2009 Sistemi trasportabili di ossigeno liquido per uso medico - Requisiti particolari (ISO 18777:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 18778:2009 Apparecchi per ventilazione polmonare - Monitor per infanti - Requisiti particolari (ISO 18778:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 18779:2005 Dispositivi medici economizzatori di ossigeno e di miscele di ossigeno - Requisiti particolari (ISO 18779:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 19054:2006 Sistemi a barre per sostenere apparecchiature medicali (ISO 19054:2005) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 20594-1:1993 Raccordi conici, con conicità 6% (Luer), per siringhe, aghi ed altra strumentazione medica - Requisiti generali (ISO 594-1:1986) EN 20594-1:1993/A1:1997 EN 20594-1:1993/AC:1996 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21534:2009 Impianti chirurgici non attivi - Protesi articolari - Requisiti particolari (ISO 21534:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21535:2009 Impianti chirurgici non attivi - Protesi articolari - Requisiti specifici per protesi articolari dell'anca (ISO 21535:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21536:2009 Impianti chirurgici non attivi - Protesi articolari - Requisiti specifici per protesi articolari del ginocchio (ISO 21536:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21649:2009 Iniettori senza ago per uso medico - Requisiti e metodi di prova (ISO 21649:2006) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21969:2009 Collegamenti flessibili per alta pressione per l'utilizzo con gli impianti per gas medicali (ISO 21969:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21987:2017 Ottica oftalmica - Lenti per occhiali montate (ISO 21987:2017) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 21987:2009 Ottica oftalmica - Lenti per occhiali montate (ISO 21987:2009)
|
07.07.2010 |
|
|
Dec. di esec. 2020/437 la norma si applica fino al 30.09.2021 |
|
CEN |
EN ISO 22442-1:2020 Dispositivi medici che utilizzano tessuti animali e loro derivati - Parte 1: Applicazione della gestione del rischio (ISO 22442-1:2020) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 22442-2:2020 Dispositivi medici che utilizzano tessuti animali e loro derivati - Parte 2: Controlli sull'origine, sulla raccolta e sul trattamento (ISO 22442-2:2020) |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN ISO 22442-3:2007 Dispositivi medici che utilizzano tessuti animali e loro derivati - Parte 3: Validazione dell'eliminazione e/o dell'inattivazione dei virus e di agenti delle encefalopatie spongiformi trasmissibili (ISO 22442-3:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 22523:2006 Protesi d'arto esterne e ortesi esterne - Requisiti e metodi di prova (ISO 22523:2006) Questa norma non è stata ancora modificata per tener conto delle prescrizioni introdotte dalla direttiva 2007/47/CE. La norma modificata sarà pubblicata dal CEN il più presto possibile. Si consiglia ai fabbricanti di verificare se è opportunamente rispettata la conformità a tutti i pertinenti requisiti essenziali della direttiva modificata. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 22675:2016 Protesica - Prove dei dispositivi d'articolazione caviglia-piede e unità piede - Requisiti e metodi di prova (ISO 22675:2016) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 23328-1:2008 Filtri di sistemi respiratori per uso anestetico e respiratorio - Parte 1: Metodo di prova con sale per valutare le prestazioni di filtrazione (ISO 23328-1:2003) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 23328-2:2009 Filtri di sistemi respiratori per uso anestetico e respiratorio - Parte 2: Aspetti diversi dalla filtrazione (ISO 23328-2:2002) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 23747:2009 Apparecchiature per anestesia e ventilazione polmonare - Spirometri per la misurazione del flusso al picco espiratorio per la valutazione della funzione polmonare nelle persone con respirazione spontanea (ISO 23747:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 25424:2019 Sterilizzatrici a bassa temperatura a vapore e formaldeide - Requisiti per lo sviluppo, la convalida e il controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 25424:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 25539-1:2009 Impianti cardiovascolari - Dispositivi endovascolari - Parte 1: Protesi endovascolari EN ISO 25539-1:2009/AC:2011 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 25539-2:2009 Impianti cardiovascolari - Dispositivi endovascolari - Parte 2: Stents vascolari (ISO 25539-2:2008) EN ISO 25539-2:2009/AC:2011 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 26782:2009 Apparecchiature per anestesia e ventilazione polmonare - Spirometri destinati alla misurazione dei volumi forzati espirati al secondo nelle persone (ISO 26782:2009) EN ISO 26782:2009/AC:2009 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 27740:1992 Strumenti chirurgici, bisturi a lame intercambiabili, dimensioni di assemblaggio (ISO 7740:1985) EN 27740:1992/A1:1997 EN 27740:1992/AC:1996 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN IEC 60118-13:2020 Elettroacustica - Protesi acustiche – Parte 13: Requisiti e metodi di misura per l'immunità elettromagnetica ai dispositivi wireless digitali mobili |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 60522:1999 Determinazione della filtrazione permanente dei tubi radiogeni (IEC 60522:1999) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60580:2000 Apparecchi elettromedicali - Misuratori del prodotto esposizione-area (IEC 60580:2000) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1:2006 Apparecchi elettromedicali - Parte 1: Prescrizioni generali relative alla sicurezza fondamentale e alle prestazioni essenziali (IEC 60601-1:2005) EN 60601-1:2006/AC:2010 EN 60601-1:2006/A1:2013 (IEC 60601-1:2005/A1:2012) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-1:2001 Apparecchi elettromedicali - Parte 1: Norme generali per la sicurezza - Norma Collaterale: Prescrizioni di sicurezza per i sistemi elettromedicali (IEC 60601-1-1:2000) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-2:2015 Apparecchi elettromedicali - Parte 1-2: Prescrizioni generali relative alla sicurezza fondamentale e alle prestazioni essenziali - Norma collaterale: Compatibilità elettromagnetica - Prescrizioni e prove (IEC 60601-1-2:2014) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-3:2008 Apparecchi elettromedicali - Parte 1-3: Prescrizioni generali per la sicurezza e prestazioni essenziali - Norma collaterale: Prescrizioni Generali per la radioprotezione in apparecchi radiologici per diagnostica (IEC 60601-1-3:2008) EN 60601-1-3:2008/AC:2010 EN 60601-1-3:2008/A11:2016 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-4:1996 Apparecchi elettromedicali - Parte 1-4:Norme generali per la sicurezza - Norma collaterale: Sistemi elettromedicali programmabili (IEC 60601-1-4:1996) EN 60601-1-4:1996/A1:1999 (IEC 60601-1-4:1996/A1:1999) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-6:2010 Apparecchi elettromedicali - Parte 1: Norme generali per la sicurezza - Norma collaterale: Usabilità (IEC 60601-1-6:2010) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-8:2007 Apparecchi elettromedicali - Parte 1: Prescrizioni generali di sicurezza - Norma collaterale: Sistemi di allarme - Prescrizioni generali, prove e linee-guida per sistemi di allarme usati in apparecchi e sistemi elettromedicali (IEC 60601-1-8:2006) EN 60601-1-8:2007/AC:2010 EN 60601-1-8:2007/A11:2017 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-10:2008 Apparecchi elettromedicali - Parte 1-10: Prescrizioni generali per la sicurezza fondamentale e le prestazioni essenziali - Norma collaterale: Prescrizioni per lo sviluppo di dispositivo per il controllo fisiologico di tipo ad anello chiuso (IEC 60601-1-10:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-1-11:2010 Apparecchi elettromedicali - Parte 1-11: Prescrizioni generali per la sicurezza di base e le prestazioni essenziali - Norma collaterale: Prescrizioni per apparecchi elettromedicali e sistemi elettromedicali per uso domiciliare (IEC 60601-1-11:2010) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-1:1998 Apparecchi elettromedicali - Parte 2-1: Norme particolari di sicurezza per gli acceleratori medicali di elettroni nella gamma da 1 MeV a 50 MeV (IEC 60601-2-1:1998) EN 60601-2-1:1998/A1:2002 (IEC 60601-2-1:1998/A1:2002) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-2:2009 Apparecchi elettromedicali - Parte 2-2: Prescrizioni particolari per la sicurezza di base e le prestazioni essenziali degli apparecchi ed accessori per elettrochirurgia ad alta frequenza (IEC 60601-2-2:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-3:1993 Apparecchi elettromedicali - Parte 2-3: Norme particolari per la sicurezza degli apparecchi di terapia a onde corte (IEC 60601-2-3:1991) EN 60601-2-3:1993/A1:1998 (IEC 60601-2-3:1991/A1:1998) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
Apparecchi elettromedicali - Parte 2-4: Norme particolari per la sicurezza fondamentale e prestazioni essenziali dei defibrillatori |
15.04.2021 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata Con Dec. di esec. (UE) 2021/610 voce sostituita 15.04.2021 |
|
CEN |
EN 60601-2-5:2000 Apparecchi elettromedicali - Parte 2-5: Norme particolari per la sicurezza delle apparecchiature per la terapia a ultrasuoni (IEC 60601-2-5:2000) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-8:1997 Apparecchi elettromedicali - Parte 2-8: Norme particolari di sicurezza degli apparecchi radiologici per uso terapeutico funzionanti con una gamma di tensione compresa tra 10 kV e 1 MV (IEC 60601-2-8:1987) EN 60601-2-8:1997/A1:1997 (IEC 60601-2-8:1987/A1:1997) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-10:2000 Apparecchi elettromedicali - Parte 2-10: Norme particolari di sicurezza per gli stimolatori neuromuscolari (IEC 60601-2-10:1987) EN 60601-2-10:2000/A1:2001 (IEC 60601-2-10:1987/A1:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-11:1997 Apparecchi elettromedicali - Parte 2-11: Norme particolari per la sicurezza per apparecchi di gammaterapia (IEC 60601-2-11:1997) EN 60601-2-11:1997/A1:2004 (IEC 60601-2-11:1997/A1:2004) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-12:2006 Apparecchi elettromedicali - Parte 2-12: Norme particolari per la sicurezza dei ventilatori polmonari - Ventilatori per terapia intensiva (IEC 60601-2-12:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-13:2006 Apparecchi elettromedicali - Parte 2-13: Norme particolari per la sicurezza e prestazioni essenziali di sistemi di anestesia (IEC 60601-2-13:2003) EN 60601-2-13:2006/A1:2007 (IEC 60601-2-13:2003/A1:2006) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-16:1998 Apparecchi elettromedicali - Parte 2-16: Norme particolari per la sicurezza degli apparecchi per emodialisi, emodiafiltrazione e emofiltrazione (IEC 60601-2-16:1998) EN 60601-2-16:1998/AC:1999 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-17:2004 Apparecchi elettromedicali - Parte 2-17: Norme particolari di sicurezza degli apparecchi proiettori automatici di sorgenti gamma con comando a distanza (IEC 60601-2-17:2004) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-18:1996 Apparecchiature elettromedicali - Parte 2-18: norme particolari per la sicurezza delle apparecchiature endoscopiche (IEC 60601-2-18:1996) EN 60601-2-18:1996/A1:2000 (IEC 60601-2-18:1996/A1:2000) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-19:2009 Apparecchi elettromedicali - Parte 2-19: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di incubatrici per bambini (IEC 60601-2-19:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-20:2009 Apparecchi elettromedicali - Parte 2-20: Norme particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di incubatrici da trasporto (IEC 60601-2-20:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-21:2009 Apparecchi elettromedicali - Parte 2-21: Prescrizioni generali relative alla sicurezza fondamentale e alle prestazioni essenziali di riscaldatori radianti per neonati (IEC 60601-2-21:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-22:1996 Apparecchi elettromedicali - Parte 2-22: Norme particolari per la sicurezza degli apparecchi laser terapeutici e diagnostici (IEC 60601-2-22:1995) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-23:2000 Apparecchi elettromedicali - Parte 2-23: Norme particolari per la sicurezza, comprese le prestazioni essenziali, degli apparecchi di monitoraggio di pressione parziale per via transcutanea (IEC 60601-2-23:1999) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-24:1998 Apparecchi elettromedicali - Parte 2-24: Norme particolari di sicurezza per pompe d'infusione e dispositivi di controllo (IEC 60601-2-24:1998) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-25:1995 Apparecchi elettromedicali - Parte 2-25: Norme particolari per la sicurezza degli elettrocardiografi (IEC 60601-2-25:1993) EN 60601-2-25:1995/A1:1999 (IEC 60601-2-25:1993/A1:1999) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-26:2003 Apparecchi elettromedicali - Parte 2-26: Norme particolari per la sicurezza degli elettroencefalografi (IEC 60601-2-26:2002) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-27:2006 Apparecchi elettromedicali - Parte 2-27: Norme particolari per la sicurezza degli apparecchi di monitoraggio elettrocardiografico (IEC 60601-2-27:2005) EN 60601-2-27:2006/AC:2006 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-28:2010 Apparecchi elettromedicali - Parte 2-28: Norme particolari per la sicurezza di complessi radianti a raggi X e complessi tubo-guaina per diagnostica medica (IEC 60601-2-28:2010) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-29:2008 Apparecchi elettromedicali - Parte 2-29: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di simulatori per radioterapia (IEC 60601-2-29:2008) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-30:2000 Apparecchi elettromedicali - Parte 2-30: Norme particolari per la sicurezza, compresi i requisiti essenziali, degli apparecchi di monitoraggio della pressione del sangue prelevata in modo indiretto, automatico e periodico (IEC 60601-2-30:1999) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-33:2010 Apparecchi elettromedicali - Parte 2-33: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di apparecchi a risonanza magnetica per diagnostica medica (IEC 60601-2-33:2010) EN 60601-2-33:2010/A1:2015 (IEC 60601-2-33:2010/A1:2013) EN 60601-2-33:2010/A2:2015 (IEC 60601-2-33:2010/A2:2015) EN 60601-2-33:2010/AC:2016-03 EN 60601-2-33:2010/A12:2016 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-34:2000 Apparecchi elettromedicali - Parte 2-34: Norme particolari per la sicurezza degli apparecchi di monitoraggio diretto della pressione del sangue (IEC 60601-2-34:2000) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-36:1997 Apparecchi elettromedicali - Parte 2-36: Norme particolari per la sicurezza di apparecchi di litotrissia indotta extracorporea (IEC 60601-2-36:1997) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
|
|
|
|
|
CEN |
EN 60601-2-37:2008 Apparecchi elettromedicali - Parte 2-37: Norme particolari per la sicurezza degli apparecchi per la diagnosi e il monitoraggio medico a ultrasuoni (IEC 60601-2-37:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-39:2008 Apparecchi elettromedicali - Parte 2-39: Norme particolari per la sicurezza degli apparecchi per la dialisi peritoneale (IEC 60601-2-39:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-40:1998 Apparecchi elettromedicali - Parte 2-40: Norme particolari per la sicurezza di elettromiografi e apparecchi per potenziale evocato (IEC 60601-2-40:1998) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-41:2009 Apparecchi elettromedicali - Parte 2-41: Norme particolari per la sicurezza di apparecchi di illuminazione per uso chirurgico e per la diagnosi (IEC 60601-2-41:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-43:2010 Apparecchi elettromedicali - Parte 2-43: Norme particolari per la sicurezza di base e le prestazioni essenziali degli apparecchi radiologici per procedure interventistiche (IEC 60601-2-43:2010) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-44:2009 Apparecchiature elettromedicali - Parte 2-44: Prescrizioni particolari per la sicurezza e le prestazioni fondamentali di apparecchi a raggi X per tomografia computerizzata (IEC 60601-2-44:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-45:2001 Apparecchi elettromedicali - Parte 2-45: Norme particolari per la sicurezza degli apparecchi radiologici per mammografia e dispositivi stereotassici per mammografia (IEC 60601-2-45:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
|
|
|
|
|
CEN |
EN 60601-2-46:1998 Apparecchi elettromedicali - Parte 2-46: Norme particolari per la sicurezza dei tavoli operatori (IEC 60601-2-46:1998) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-47:2001 Apparecchi elettromedicali - Parte 2-47: Norme particolari per la sicurezza, comprese le prestazioni essenziali, per i sistemi elettrocardiografici ambulatoriali (IEC 60601-2-47:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-49:2001 Apparecchi elettromedicali - Parte 2-49: Norme particolari di sicurezza di apparecchi di monitoraggio multifunzione dei pazienti (IEC 60601-2-49:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-50:2009 Apparecchi elettromedicali - Parte 2-50: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di apparecchiature per fototerapia infantile (IEC 60601-2-50:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-51:2003 Apparecchi elettromedicali - Parte 2-51: Norme particolari per la sicurezza, incluse le prestazioni essenziali, per la registrazione e analisi dei dati di elettrocardiografi a canale singolo e multiplo (IEC 60601-2-51:2003) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-52:2010 Apparecchi elettromedicali - Parte 2-52: Requisiti particolari per la sicurezza di base e le prestazioni essenziali dei letti medici (IEC 60601-2-52:2009) EN 60601-2-52:2010/AC:2011 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60601-2-54:2009 Apparecchiature elettromedicali - Parte 2-54: Prescrizioni particolari per la sicurezza e le prestazioni fondamentali di apparecchi a raggi X per radiografia e radioscopia (IEC 60601-2-54:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN IEC 60601-2-66:2020 Apparecchi elettromedicali - Parte 2-66: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di strumenti e sistemi per l'udito (IEC 60601-2-66:2019)
|
15.04.2021 |
|
|
Con Dec. di esec. (UE) 2021/610 la norma è pubblicata |
|
CEN |
EN IEC 60601-2-83:2020 Apparecchi elettromedicali - Parte 2-83: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali degli apparecchi per fototerapia ad uso domiciliare
|
15.04.2021 |
|
|
Con Dec. di esec. (UE) 2021/610 la norma è pubblicata |
|
CEN |
EN 60627:2001 Apparecchiature di diagnostica per immagine a raggi X - Caratteristiche delle griglie antidiffusione d'uso generale e per mammografia (IEC 60627:2001) EN 60627:2001/AC:2002 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60645-1:2001 Elettroacustica - Apparecchi acustici - Parte 1: Audiometri a toni puri (IEC 60645-1:2001) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60645-2:1997 Audiometri - Parte 2: Apparecchi per audiometria vocale (IEC 60645-2:1993) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60645-3:2007 Elettroacustica - Apparecchi audiometrici - Parte 3: Segnali di prova di breve durata (IEC 60645-3:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 60645-4:1995 Audiometri - Parte 4: Apparati per l'analisi audiometrica in alta frequenza (IEC 60645-4:1994) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 61217:2012 Apparecchiature utilizzate in radioterapia - Coordinate, movimenti e scale (IEC 61217:2011) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 61676:2002 Apparecchi elettromedicali - Strumenti dosimetrici usati per la misura non-invasiva della tensione del tubo radiogeno in radiologia diagnostica (IEC 61676:2002) EN 61676:2002/A1:2009 (IEC 61676:2002/A1:2008) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62083:2009 Apparecchi elettromedicali - Prescrizioni particolari di sicurezza per i sistemi di pianificazione del trattamento in radioterapia (IEC 62083:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62220-1:2004 Apparecchi elettromedicali - Caratteristiche dei dispositivi di immagine radiografica di tipo digitale - Parte 1: Determinazione del quantum di rilevazione (IEC 62220-1:2003) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62220-1-2:2007 Apparecchi elettromedicali - Caratteristiche dei dispositivi digitali per la produzione di immagini mediante raggi X - Parte 1-2: Determinazione dell'efficienza quantica di rivelazione - Rivelatori usati in mammografia (IEC 62220-1-2:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62220-1-3:2008 Apparecchi elettromedicali - Caratteristiche dei dispositivi digitali per la produzione di immagini mediante raggi X - Parte 1-3: Determinazione dell'efficienza quantica di rivelazione - Rivelatori usati per immagini dinamiche (IEC 62220-1-3:2008) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62304:2006 Software per dispositivi medici - Processi relativi al ciclo di vita del software (IEC 62304:2006) EN 62304:2006/AC:2008 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 62366:2008 Dispositivi medici - Applicazione dell'ingegneria delle caratteristiche utilizzative ai dispositivi medici (IEC 62366:2007) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 80601-2-35:2009 Apparecchi elettromedicali - Parte 2: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali coperte, cuscini e materassi riscaldanti per uso medico (IEC 80601-2-35:2009) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
Apparecchi elettromedicali - Parte 2-55: Requisiti particolari per la sicurezza di base e le prestazioni essenziali dei monitor dei gas respiratori (ISO 80601-2-55:2018) |
15.04.2021 |
|
|
Con Dec. di esec. (UE) 2021/610 la norma è pubblicata |
|
CEN |
EN 80601-2-58:2009 Apparecchi elettromedicali - Parte 2-58: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di dispositivi per la rimozione del cristallino e dispositivi per vitrectomia, per chirurgia oftalmica (IEC 80601-2-58:2008) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN 80601-2-59:2009 Apparecchi elettromedicali - Parte 2: Norme particolari relative alla sicurezza fondamentale e alle prestazioni essenziali di termografi di screening per la verifica della temperatura febbrile umana (IEC 80601-2-59:2008) Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 81060-1:2012 Sfigmomanometri non invasivi - Parte 1: Requisiti e metodi di prova per il tipo a misurazione non automatica (ISO 81060-1:2007) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
|
CEN |
EN ISO 81060-2:2019 Sfigmomanometri non invasivi - Parte 2: Indagine clinica per il tipo intermittente a misurazione automatica (ISO 81060-2:2018) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/437 la norma è pubblicata |
...
Collegati:
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Elenco consolidato Norme armonizzate Direttiva MD Aprile 2021.pdf Certifico Srl - Rev. 0.0 2021 |
1128 kB | 57 |
Organismi notificati Prodotti CE Turchia
Organismi notificati Prodotti CE Turchia
ID 13330 | 17.05.2021 / Scheda allegata
La Turchia, pur non essendo uno Stato membro UE può essere sede di Organismi Notificati UE (Organismi di Valutazione della Conformità) per la marcatura CE di Prodotti (che possono essere autorizzati solo agli Stati membri UE), in virtù degli accordi doganali di libero scambio EU-Turchia e della decisione n. 1/95 e Decisione n. 1/2006.
[box-warning]L'Organismo Notificato CE 2163 (DPI)
Nel periodo di pandemia Covid-19 è alla cronica l'Organismo Notificato per i DPI con numero CE 2163:
Universal Uygunluk Degerlendirme Hizmetleri ve Tic. A.Ş.
Tatlısu Mah. Arif Ay Sk. No:16-3 Umraniye-Istanbul /TURKEY
Umraniye-Istanbul /TURKEY
Country : Turkey
Phone : +90 216 455 80 80
Fax : +90 216 455 80 08
Email : Questo indirizzo email è protetto dagli spambots. E' necessario abilitare JavaScript per vederlo.
Website : www.universalcert.com[/box-warning]
La decisione n. 1/95 del Consiglio di associazione CE- Turchia, del 22 dicembre 1995, istituisce l'unione doganale tra la Turchia e l'Unione europea, e prevede che le disposizioni giuridiche stabilite nell'Unione europea siano create nella legislazione interna della Turchia al fine di eliminare gli ostacoli tecnici agli scambi al fine di garantire la libera circolazione delle merci.
Gli Organismi Notificati intervengono nelle procedure di valutazione della conformità indicate nelle direttive del nuovo approccio applicabili che prevedono l’intervento di terzi.
Gli Stati membri devono notificare gli organismi competenti. Essi possono scegliere gli organismi da notificare tra quelli che rientrano nell’ambito della loro giurisdizione e che siano costantemente conformi ai requisiti delle direttive.
Esempi modalità di designazione Organismi Notificati:
[box-note]Regolamento (UE) 2016/425 "DPI"
12) «organismo nazionale di accreditamento»: l'organismo nazionale di accreditamento quale definito all'articolo 2, punto 11, del regolamento (CE) n. 765/2008;
...
14) «organismo di valutazione della conformità»: un organismo che svolge attività di valutazione della conformità, fra cui tarature, prove, certificazioni e ispezioni;
Articolo 21 Autorità di notifica
1. Gli Stati membri designano un'autorità di notifica responsabile dell'elaborazione e dell'esecuzione delle procedure necessarie per la valutazione e la notifica degli organismi di valutazione della conformità e il controllo degli organismi notificati, anche per quanto riguarda l'ottemperanza all'articolo 26.
2. Gli Stati membri possono decidere che la valutazione e il controllo di cui al paragrafo 1 siano eseguiti da un organismo nazionale di accreditamento secondo quanto disposto ai sensi del regolamento (CE) n. 765/2008.
3. Se l'autorità di notifica delega o altrimenti affida la valutazione, la notifica o il controllo di cui al paragrafo 1 del presente articolo ad un organismo che non è un ente pubblico, detto organismo è una persona giuridica e rispetta mutatis mutandis i requisiti di cui all'articolo 22. Inoltre, tale organismo adotta disposizioni per coprire la responsabilità civile connessa alle proprie attività.
4. L'autorità di notifica si assume la piena responsabilità dei compiti svolti dall'organismo di cui al paragrafo 3.
...
Articolo 24 Requisiti relativi agli organismi notificati
1. Ai fini della notifica, l'organismo di valutazione della conformità rispetta i requisiti di cui ai paragrafi da 2 a 11.
2. L'organismo di valutazione della conformità è stabilito a norma del diritto nazionale di uno Stato membro e ha personalità giuridica.
3. L'organismo di valutazione della conformità è un organismo terzo indipendente dall'organizzazione o dal DPI che valuta. Un organismo appartenente a un'associazione di imprese o a una federazione professionale che rappresenta imprese coinvolte nella progettazione, nella fabbricazione, nella fornitura, nell'assemblaggio, nell'uso o nella manutenzione di DPI che esso valuta può essere ritenuto un organismo siffatto a condizione che siano dimostrate la sua indipendenza e l'assenza di qualsiasi conflitto di interesse.[/box-note]
[box-note]Direttiva 2006/42/CE "Macchine"
Articolo 14 Organismi notificati
1. Gli Stati membri notificano alla Commissione e agli altri Stati membri gli organismi da essi designati per effettuare la valutazione della conformità in vista dell'immissione sul mercato di cui all'articolo 12, paragrafi 3 e 4, nonché le procedure specifiche per la valutazione della conformità e le categorie di macchine per le quali tali organismi sono stati designati e i numeri di identificazione che sono stati loro attribuiti in precedenza dalla Commissione. Gli Stati membri notificano alla Commissione e agli altri Stati membri qualsiasi modifica successiva.
2. Gli Stati membri provvedono affinché gli organismi notificati siano controllati periodicamente per accertare che soddisfino sempre i criteri di cui all'allegato XI. L'organismo notificato fornisce, a richiesta, tutte le informazioni pertinenti, compresi i documenti relativi al bilancio, per consentire agli Stati membri di assicurare che i requisiti di cui all'allegato XI siano soddisfatti.
3. Per la valutazione degli organismi da notificare e di quelli già notificati gli Stati membri applicano i criteri previsti nell'allegato XI.
4. La Commissione pubblica nella Gazzetta ufficiale dell'Unione europea, a fini informativi, un elenco degli organismi notificati in cui figurano i loro numeri di identificazione, nonché i compiti per i quali sono stati notificati. Essa provvede all'aggiornamento di tale elenco.
5. Si presume che gli organismi che soddisfano i criteri di valutazione previsti dalle norme armonizzate pertinenti, i cui riferimenti devono essere pubblicati nella Gazzetta ufficiale dell'Unione europea a titolo della presente direttiva, rispondano ai criteri pertinenti.
...[/box-note]
segue
©Copia autorizzata Abbonati
[box-note]Decisione n. 1/95
Decisione n. 1/2006
Guida Organismi Notificati CE
Elenco Organismi Notificati CE per DPI | UNI EN 149[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Organismi Notificati Prodotti CE Turchia Rev. 00 2021.pdf Certifico S.r.l. Rev. 0.0 2021 |
123 kB | 32 |
Guidelines Regulations (EU) n. 811-812-813-814/2013 and Regulations (EU) 2015/1187-1189
Guidelines Regulations (EU) n. 811-812-813-814/2013 and Regulations (EU) 2015/1187-1189
EC, 2018
The Ecodesign and Energy Labelling Regulations for space and water heaters were published in 2013 and for solid fuel boilers in 2015. The regulations establish minimum requirements and an energy labelling scheme for the products in their scope. These guidelines aim to help relevant stakeholders, including industry and public authorities, to implement the Regulations in practice. They summarise the most relevant information from the regulations to give SMEs an introduction to the subject matter and answer the most common questions.
Throughout this document, the wording "space heaters and combination heaters" is used in reference to the products in scope of Regulations (EU) 811/2013 and (EU) 813/2013; the wording "water heaters" is used in reference to the products in scope of Regulations (EU) 812/2013 and (EU) 814/2013; and the wording "solid fuel boilers" is used in reference to the products in scope of Regulations (EU) 2015/1187 and (EU) 2015/1189.
The guidelines are intended to be used only for facilitating the implementation of the Regulations. They are not intended to replace the Regulations or to provide “interpretation” beyond their intent. The guidelines only reflect the opinion of the Commission services and are not legally binding. A finally binding legal interpretation of EU legislation may only be provided by the European Court of Justice. The guidelines are without prejudice to the position the Commission might take should an issue arise in a procedure before the European Court of Justice.
...
Table of Contents
1. Purpose of the guidelines and disclaimer
2. The Regulations
3. Scope
3.1. Space Heaters and Combination Heaters
3.2. Water Heaters
3.3. Solid fuel boilers
4. Product environmental impacts
5. State of play of legislation
5.1. Timetable
5.2. Transitional provision
5.3. Review
6. Key requirements
6.1. Ecodesign requirements
6.2. Energy Labelling requirements
6.3. Labelling requirements for packages
6.4. Packages where not all information is available
7. Measurements and calculations, the Relationship between the regulations, the commission communications and harmonised standards
8. Frequently Asked Questions
...
Fonte: EC
Collegati
[box-note]Regolamento Delegato (UE) N. 811/2013
Regolamento (UE) N. 813/2013
Regolamento (UE) 2015/1189[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidelines Regulations EU n. 811-812-813-814 2013.pdf EC 2018 |
1237 kB | 26 |
RAPEX Report 13 del 02/04/2021 N. 07 A12/00467/21 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 13 del 02/04/2021 N. 07 A12/00467/21 Germania
Approfondimento tecnico: Braccialetto
Il prodotto, di marca sconosciuta, mod. X00149NUIX, è stato sottoposto alla procedura di rimozione dal mercato online perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il metallo dei braccialetti contiene cadmio (valore misurato: 90% in peso).
Il cadmio è dannoso per la salute umana, perché si accumula nell'organismo, può danneggiare gli organi e può provocare il cancro.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
23. Cadmium
[…] 10. Sono vietati l'uso o l'immissione sul mercato se il tenore è pari o superiore allo 0,01 % in peso del metallo in:
i) monili di metallo e altri componenti di metallo impiegati nella fabbricazione di oggetti di gioielleria;
ii) parti di metallo di articoli di gioielleria e di bigiotteria e accessori per capelli, compresi:
- braccialetti, collane e anelli
- gioielli per piercing,
- orologi da polso e cinturini,
- spille e gemelli per polsini. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 13 del 02_04_2021 N. 07 A12_00467_21 Germania.pdf Braccialetto |
371 kB | 0 |
Rettifica del regolamento (UE) 2019/1020 | 31.03.2021
Rettifica del regolamento (UE) 2019/1020 | 31.03.2021
Rettifica del regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio, del 20 giugno 2019, sulla vigilanza del mercato e sulla conformità dei prodotti e che modifica la direttiva 2004/42/CE e i regolamenti (CE) n. 765/2008 e (UE) n. 305/2011.
GU L 111/35 del 31.03.2021
...
Pagina 26, articolo 28, paragrafo 1
anziché:
«1.
Le autorità di vigilanza del mercato, se concludono che un prodotto comporta un rischio grave, adottano misure intese a vietarne l’immissione sul mercato e impongono alle autorità designate a norma dell’articolo 25, paragrafo 1, di non immetterlo in libera pratica. Esse impongono inoltre a dette autorità di inserire la seguente dicitura nel sistema informatico doganale e, se del caso, nella fattura commerciale che accompagna il prodotto e in qualsiasi altro documento di accompagnamento pertinente:
“Prodotto non conforme - Immissione in libera pratica non autorizzata - Regolamento (UE) 2019/1020”.»
leggasi:
«1.
Le autorità di vigilanza del mercato, se concludono che un prodotto comporta un rischio grave, adottano misure intese a vietarne l’immissione sul mercato e impongono alle autorità designate a norma dell’articolo 25, paragrafo 1, di non immetterlo in libera pratica. Esse impongono inoltre a dette autorità di inserire la seguente dicitura nel sistema informatico doganale e, se del caso, nella fattura commerciale che accompagna il prodotto e in qualsiasi altro documento di accompagnamento pertinente:
“Prodotto pericoloso - Immissione in libera pratica non autorizzata - Regolamento (UE) 2019/1020”.».
Collegati
[box-note]Regolamento (CE) N. 765/2008
Direttiva COV
Regolamento Prodotti da Costruzione (UE) 305/2011 - CPR[/box-note]
Decreto 13 febbraio 2021
Decreto 13 febbraio 2021
Adozione delle tariffe per i servizi resi del Corpo delle Capitanerie di porto per le procedure di cui agli articoli 7, 11, 31, 32 e 33 del decreto del Presidente della Repubblica 20 dicembre 2017, n. 239.
(GU n.75 del 27.03.2021)
...
Art. 1. Finalità
1. Il presente decreto determina, ai sensi dell’art. 35, comma 6, del decreto del Presidente della Repubblica 20 dicembre 2017, n. 239, le tariffe spettanti per le attività di cui agli articoli 7, 11, 31, 32 e 33 del citato decreto del Presidente della Repubblica 20 dicembre 2017, n. 239, svolte, su istanza di parte, dal personale del Corpo delle Capitanerie di porto.
______
Collegati
[box-note]D.P.R. 20 dicembre 2017 n. 239 | Equipaggiamento marittimo[/box-note]
Norme armonizzate Direttiva macchine Marzo 2021: Note
Norme armonizzate Direttiva macchine Marzo 2021: Note
ID 13178 | 23.03.2021 / Documento completo allegato
Con la Decisione di esecuzione (UE) 2021/377 della Commissione del 2 marzo 2021 che modifica la decisione di esecuzione (UE) 2019/436 relativa alle norme armonizzate per le macchine redatte a sostegno della direttiva 2006/42/CE del Parlamento europeo e del Consiglio (GU L 72/12 del 3.3.2021), sono entrate in regime di armonizzazione 3 importanti norme di tipo B comuni a molte macchine e altre norme di tipo C.
Come illustrato nella figura e tabelle seguenti, è presente un periodo di coesistenza tra le nuove norme armonizzate (03.03.2021) e loro ritirate di 18 mesi (03.09.2022).
In questo periodo è garantita la "presunzione di conformità" ai RESS della Direttiva macchine 2006/42/CE con l'applicazione di una delle 2 norme (nuova norma armonizzata dal 03.03.2021 / norma ritirata dal 03.09.2022).
Fig. 1 - Timeline Presunzione di Conformità nuove norme armonizzate / norme ritirate
Nelle tabelle sottostanti lo stato delle nuove norme armonizzate e loro ritirate (selezione):
| n. |
Norma |
Data | Tipo | Norma ritirata | Data ritiro |
| 72 |
EN ISO 13851:2019 |
03.03.2021 | B | EN 574:1996+A1:2008 Sicurezza del macchinario - Dispositivi di comando a due mani - Aspetti funzionali - Principi per la progettazione |
03.09.2022 |
| 73 |
EN ISO 13854:2019 |
03.03.2021 | B | EN 349:1993+A1:2008 Sicurezza del macchinario - Spazi minimi per evitare lo schiacciamento di parti del corpo |
03.09.2022 |
| 74 |
EN ISO 13857:2019 |
03.03.2021 | B | EN ISO 13857:2008 Sicurezza del macchinario - Distanze di sicurezza per impedire il raggiungimento di zone pericolose con gli arti superiori e inferiori (ISO 13857:2008) |
03.09.2022 |
Fig. 2 - Norme di tipo B Decisione di esecuzione (UE) 2021/377 (selezione)
Si segnalano inoltre le norme di tipo C:
| n. |
Norma |
Data | Tipo | Norma ritirata | Data ritiro |
| 79 |
EN ISO 7096:2020 |
03.03.2021 | C |
EN ISO 7096:2008 EN ISO 7096:2008/AC:2009 |
03.09.2022 |
| 88 |
EN ISO 21904-1:2020 |
03.03.2021 | C | EN ISO 15012-4:2016 Salute e sicurezza in saldatura e nelle tecniche affini - Attrezzatura per la captazione e la separazione dei fumi di saldatura - Parte 4: Requisiti generali (ISO 15012-4:2016) |
03.09.2022 |
| 89 |
EN 62745:2017 |
03.03.2021 | C | --- | --- |
Fig. 3- Norme di tipo C Decisione di esecuzione (UE) 2021/377 (selezione)
Tutto l'elenco delle norme armonizzate per la Direttiva macchine 2006/42/CE è disponibile sia online/pdf a questo link
...
Segue in allegato
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Collegati
[box-note]Direttiva macchine 2006/42/CE
Norme armonizzate Direttiva macchine 2006/42/CE (DM)[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Norme armonizzate Direttiva macchine Marzo 2021 - Note Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
236 kB | 168 |
Decreto 2 febbraio 2021
Decreto 2 febbraio 2021
Modalita' per la vigilanza sul mercato dell'equipaggiamento marittimo.
(GU n.67 del 18.03.2021)
Entrata in vigore: 19.03.2021
...
Art. 1. Finalità e ambito di applicazione
1. Il presente decreto definisce le modalità per la vigilanza sul mercato dell’equipaggiamento marittimo.
2. Il presente decreto si applica all’equipaggiamento marittimo di cui all’art. 2, comma 1, lettera c) , presente sul mercato nazionale ovvero installato o in fase di installazione a bordo di unità nazionali.
[...]
Art. 8. Identificazione dell’equipaggiamento da valutare e dell’attività di vigilanza da effettuare
1. L’autorità di vigilanza del mercato individua l’equipaggiamento marittimo da sottoporre a valutazione in accordo al programma nazionale di vigilanza o, nei casi di vigilanza di tipo reattivo, in accordo ai criteri di cui all’art. 6.
2. L’autorità di vigilanza del mercato, sulla base degli elementi di informazione acquisiti, decide di effettuare una o più attività di valutazione ai sensi dell’art. 3, comma 3, lettera c).
Art. 9. Acquisizione di documentazione, esemplari di prodotto e accesso alle strutture del fabbricante
1. Il fabbricante, il suo rappresentante autorizzato e gli operatori economici individuati quali soggetti responsabili di un determinato equipaggiamento marittimo cooperano, ai sensi di quanto previsto dal decreto del Presidente della Repubblica 20 dicembre 2017, n. 239, con l’autorità di vigilanza del mercato e forniscono alla stessa, su richiesta, tutte le informazioni, la documentazione tecnica e, ove necessario, gli esemplari del prodotto richiesto e consentono l’accesso alle proprie sedi e impianti utilizzati nella filiera di produzione e di commercializzazione.
2. Qualora necessario e giustificato, gli esemplari dell’equipaggiamento marittimo da sottoporre a valutazione sono acquisiti dall’autorità di vigilanza del mercato a titolo gratuito, previa richiesta al fabbricante o agli operatori economici identificati, per l’esecuzione di prove ed esami. Nell’individuazione del numero di esemplari da acquisire, l’autorità di vigilanza del mercato tiene conto delle attività di valutazione da effettuare.
3. L’acquisizione di cui al comma 2 avviene, se necessario, anche attraverso operazioni di prelievo presso gli stabilimenti di produzione e di confezionamento, i magazzini di stoccaggio e i magazzini di vendita, in relazione alle quali il personale dell’autorità di vigilanza operante redige apposito processo verbale.
4. Qualora il fabbricante, il suo rappresentante autorizzato o l’operatore economico individuato rifiutano di cooperare, l’autorità di vigilanza del mercato adotta le misure restrittive previste all’art. 13.
Art. 10. Valutazione dell’equipaggiamento identificato
1. La valutazione degli equipaggiamenti marittimi è svolta dall’autorità di vigilanza del mercato.
2. L’autorità di vigilanza del mercato può disporre ed effettuare le attività di valutazione fino alla fase dell’utilizzo del prodotto, anche procedendo a ispezioni presso gli stabilimenti di produzione e di confezionamento, i magazzini di stoccaggio e i magazzini di vendita.
3. L’autorità di vigilanza del mercato ha accesso a tutte le informazioni necessarie sul prodotto e, qualora necessario, dispone di esemplari di prodotto per esaminare il fascicolo tecnico o effettuare le altre attività di ispezione,
di prova e verifica del sistema di produzione.
4. L’autorità di vigilanza del mercato, nell’espletamento dell’attività di valutazione degli equipaggiamenti marittimi, tiene conto:
a) della documentazione tecnica di riferimento che individua gli elementi identificativi del prodotto, come riportati nella dichiarazione di conformità UE e nei moduli in essa richiamati e, se del caso, che descrive le caratteristiche del prodotto, dei suoi componenti e di tutti gli aspetti relativi al suo funzionamento a bordo;
b) dei requisiti tecnici, previsti dagli strumenti internazionali applicabili all’equipaggiamento identificato, da verificare anche solo parzialmente;
c) della necessità di coinvolgere esperti del settore, interni o esterni all’autorità di vigilanza del mercato, o autorità di vigilanza del mercato di altri Stati membri;
d) di ogni altro elemento ritenuto necessario o utile al fine di una completa valutazione.
5. L’autorità di vigilanza del mercato effettua le attività di valutazione con proprie risorse interne o, qualora necessario, con risorse esterne, se disponibili, ferma restando la responsabilità dell’autorità di vigilanza anche in merito agli aspetti relativi alla riservatezza e al conflitto d’interessi.
6. Le attività di valutazione sono effettuate con le modalità di cui al capo IV e sono adeguatamente documentate.
7. Salvo i casi di urgenza, il fabbricante o il suo rappresentante autorizzato o l’operatore economico individuato possono prendere parte, in contraddittorio, alla valutazione dei prodotti dell’equipaggiamento marittimo. 8. Se durante l’attività di valutazione di uno specifico equipaggiamento marittimo emergono aspetti di sicurezza soggetti all’applicazione di altre direttive di settore, l’autorità di vigilanza del mercato comunica, senza ritardo, tale informazione all’autorità di vigilanza competente per materia.
[...]
Collegati
[box-note]D.P.R. 20 dicembre 2017 n. 239 | Equipaggiamento marittimo
Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
D.P.R. 18 Settembre 2020 n. 171[/box-note]
Questions & Answers Direttiva 2014/28/UE - Direttiva 2008/43/CE
Questions & Answers Direttiva 2014/28/UE - Direttiva 2008/43/CE
This document gathers some questions and answers concerning the interpretation of certain provisions of Directive 2014/28/EU and of Commission Directive 2008/43/EC.
The answers were discussed between the relevant Commission services and members and observers of the Group of Experts on Explosive, of the AdCo group on Explosives for Civil Uses, and/or with the Forum of Notified Bodies for Explosives. The document attempts to provide guidance to Member States' competent authorities, market surveillance authorities, notified bodies and economic operators.
The answers represent the opinion of the relevant Commission services but may not necessarily represent the opinion of the Commission. This guidance document does not constitute any formal commitment on behalf of the Commission. Only the European Court of Justice can give an authoritative interpretation of Union legislation.
This guidance document was last updated in October 2017. It will continue to be regularly updated and published on CIRCABC and on the dedicated webpage of DG GROW.
____
Table of contents
1. Introduction
2. CE marking of on-site mixed explosives
3. If one notified body has type-certified a product (Module B), can the manufacturer turn to another notified body to take care of the complementary conformity assessment module (Modules C2, D, E or F) for the same product?
4. Which notified body is responsible in case of a product found to be not in conformity with the Directive after having been placed on the market: the notified body responsible for module B or the notified body responsible for the modules C2, D, E or F?
5. Which notified body is responsible for allowing the manufacturer to CE-mark the product?
6. Can certificates [for the different modules] be withdrawn? If yes, at which occasions and how?
7. Do propellant cartridges for powder actuated fastening tools (PAT) fall under the Explosives Directive because their UN Number is not listed in Annex I of Directive 2014/28/EU?
8. Distinction between civil explosives and military explosives in the context of intra-EU transfers
9. What is the status of shock tubes under the Directive?
10. What is the procedure for attributing manufacturing site codes to non-EU manufacturing sites under Commission Directive 2008/43/EC, as amended by Directive 2012/4/EU?
11. How should the term 'end-user' be understood for the purposes of Commission Directive 2008/43/EC?
12. Marking of various explosives in compliance with Directive 2008/43/EC, as amended by Directive 2012/4/EU
13. Interpretation of "use for own purposes" pursuant to the Explosives Directive
14. Date of application of rules on explosives traceability
15. The case when a quarry or mine mixes its own explosive on site for blasting on its own site: does it fall under the definition of a manufacturer using an explosive for own purposes?
16. How shall the wording “product, type, batch or serial number” in the example for the declaration of conformity (see Annex IV of the Directive 2014/28/EU) be interpreted in the case of explosives?
17. Are explosives in transit through the territory of the EU subject to the traceability provisions of Directive 2008/43/EC?
18. Applicability of Directive 2008/43/EC to two-or multi-component explosives
...
Fonte: EU
Collegati
[box-note]Direttiva 2014/28/UE
Direttiva 2008/43/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Questions Answers Direttiva 2014 28 UE - Direttiva 2008 43 CE.pdf |
344 kB | 1 |
Riqualificazione serbatoi GPL con metodo EA
Riqualificazione serbatoi GPL con metodo EA
ID 13112 | 15.03.2021
INAIL, Marzo 2021
Documento riepilogativo dell'applicazione della metodologia dell’emissione acustica anche alle verifiche di integrità dei serbatoi per GPL interrati, ricoperti (o tumulati) e fuori terra con capacità:
- non superiore a 13 m3 (decreto interdirettoriale del 17 gennaio 2005) (eX ISPESL)
- superiore a 13 m3 (Determina DG n. 58 del 18 dicembre 2020 (INAIL)
_______
Riqualificazione serbatoi GPL con metodo EA
Destinatari
Proprietari e/o gestori dei serbatoi per GPL, Soggetti Abilitati (Organismi Competenti Abilitati)
Descrizione dell’attività
Con il decreto interdirettoriale del 17 gennaio 2005 è stata adottata la procedura operativa elaborata dall’ex Ispesl per l’effettuazione delle verifiche di integrità dei serbatoi interrati per GPL con capacità non superiore a 13 m3 attraverso il metodo delle emissioni acustiche. La procedura operativa costituisce l’allegato I al sopra richiamato decreto.
Analogamente, l’art. 64-bis comma 3, del decreto-legge 16 luglio 2020, n. 76 convertito, con modificazioni, dalla legge 11 settembre 2020, n. 120, estende l’applicazione della metodologia dell’emissione acustica anche alle verifiche di integrità dei serbatoi per GPL interrati, ricoperti (o tumulati) e fuori terra con capacità superiore a 13 m3. Sulla base di tale disposizione di legge l’Inail ha elaborato una specifica procedura operativa, il documento è stato pubblicato con Determina del Direttore Generale dell’Istituto n. 58 del 18 dicembre 2020.
La tecnica utilizzata in entrambe le procedure si basa sul metodo di emissione acustica.
Tuttavia gli approcci sono sostanzialmente diversi, in particolare:
[alert]- la procedura operativa per l’effettuazione delle verifiche di integrità dei serbatoi interrati con capacità non superiore a 13 m3 è conforme allo standard UNI EN 12817 (già UNI EN 12818) e prevede criteri di tipo statistico di aggregazione dei serbatoi in lotti omogenei per fabbricazione, capacità, orientamento e tipologia di rivestimento,
- la procedura operativa per l’effettuazione delle verifiche di integrità dei serbatoi interrati, ricoperti e fuori terra con capacità superiore a 13 m3 è conforme allo standard UNI EN 12819 e prescinde da qualsiasi approccio di tipo statistico.[/alert]
Procedura EA per serbatoi GPL fino a 13 m3
Procedura per il controllo di serbatoi interrati per GPL di capacità non superiore a 13 m3 con tecnica basata sul metodo di Emissione Acustica ai fini della verifica di integrità.
Premessa
La procedura costituisce l’Allegato I al decreto interdirettoriale del 17 gennaio 2005 emanato a seguito della pubblicazione del decreto del Ministero delle attività produttive del 23 settembre 2004 (Modifica del D.M. 29 febbraio 1988, recante norme di sicurezza per la progettazione, l'installazione e l'esercizio dei depositi di gas, di petrolio liquefatto con capacità complessiva non superiore a 5 m3 e adozione dello standard europeo EN 12818 per i serbatoi di gas di petrolio liquefatto di capacità inferiore a 13 m3).
La procedura definisce le modalità tecnico-operative per l’effettuazione delle verifiche di integrità di serbatoi per GPL interrati, di capacità non superiore a 13 m3 con tecnica basata sul metodo di Emissione Acustica (EA) e relativi requisiti tecnici dei soggetti abilitati (gli Organismi Competenti Abilitati, OCA) ad effettuare le verifiche. La procedura prevede un approccio di tipo statistico mediante l’effettuazione delle prove EA su serbatoi campioni rappresentativi di lotti omogenei per caratteristiche di fabbricazione, capacità, orientamento e tipologia di rivestimento (resina epossidica, guscio in polietilene, cassa di contenimento in conglomerato cementizio).
Campo di applicazione
La procedura EA è applicabile a serbatoi interrati con configurazione verticale o orizzontale che abbiano i seguenti requisiti essenziali:
[alert]- capacità non superiore a 13 m3;
- membrature metalliche protette da un idoneo sistema (rivestimento con resine epossidiche e anodi sacrificali, guscio in polietilene, cassa di contenimento in conglomerato cementizio);
- pressione massima ammissibile non superiore a 17,65 bar;
- accessibilità, sia pur limitata, al serbatoio in pressione.[/alert]
La procedura EA deve essere applicata esclusivamente da Organismi Competenti Abilitati con decreto dell’Autorità competente ai sensi del decreto interdirettoriale del 17 gennaio 2005.
Caratteristiche della procedura EA
La procedura definisce:
[alert]- le modalità di esecuzione delle prove integrative preliminari alla prova EA;
- le modalità organizzative necessarie alla conduzione della prova EA;
- le caratteristiche tecniche della strumentazione necessaria allo svolgimento della prova EA;
- il protocollo di prova con tecnica basata sul metodo EA;
- il procedimento interpretativo dei dati di prova in accordo al modello analitico messo a punto da Inail;
- i criteri di classificazione della prova EA;
- le modalità di redazione del rapporto di prova e della sua trasmissione al Centro Banca Dati EA dell’Inail;
- le modalità di certificazione del lotto omogeneo a cui afferiscono i serbatoi campioni sottoposti a prova EA.[/alert]
Schema descrittivo della metodica
La pressurizzazione del serbatoio deve essere ottenuta utilizzando uno specifico impianto che adotti una delle due possibili metodiche:
[alert]- ciclo aperto, immissione di GPL in fase vapore da una sorgente esterna;
- ciclo chiuso, prelievo del GPL in fase liquida e re-immissione dello stesso in fase vapore.[/alert]
La pressione deve essere costantemente rilevata mediante un idoneo sensore installato sul serbatoio o sulla linea dell'impianto di pressurizzazione ad esso direttamente connessa.
La tecnica prevede l'installazione di due sensori EA. I segnali EA acquisiti devono essere caratterizzati da alcuni parametri descrittori più significativi, in conformità alla norma UNI EN 13554. Tali segnali, opportunamente elaborati ed interpretati, vengono impiegati per il calcolo di due indici di valutazione ICSE ed ISRE e quindi per la determinazione di un indicatore sintetico. Il valore massimo dell'indicatore sintetico registrato nel corso della prova EA viene, infine, utilizzato per la definitiva classificazione del serbatoio.
Architettura del sistema
Il sistema prevede l’interazione dei quattro soggetti di seguito sinteticamente definiti:
il Proprietario, il soggetto che possiede il serbatoio e ne dispone l’installazione e ne cura l’esercizio in conformità alle prescrizioni e alle raccomandazioni fornite dal Fabbricante;
l’Inail (già Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro), designato dal Ministero dello Sviluppo Economico quale Organismo Nazionale Competente ai fini della definizione, aggiornamento e corretta applicazione della “Procedura per la verifica decennale di serbatoi interrati per GPL mediante tecnica di controllo basata sul metodo di Emissioni Acustiche”;
l’Organismo Competente Abilitato, il soggetto abilitato dal Ministero dello Sviluppo Economico, mediante apposito decreto, ad espletare le attività connesse all’applicazione della procedura EA;
il Ministero dello Sviluppo Economico, che sovraintende le attività.
Le attività ed i flussi informativi tra i vari soggetti sono articolati secondo lo schema di seguito illustrato
Trasmissione domande di riqualificazione decennale dei piccoli serbatoi interrati per GPL
Le domande di riqualificazione e i relativi elenchi dei serbatoi contenenti i dati necessari per l’individuazione dei lotti omogenei devono essere trasmessi dai soggetti interessati, con dovuto anticipo rispetto ai termini di scadenza, tramite l’accesso al portale istituzionale dell’Inail immettendo le credenziali dispositive nella sezione “accedi ai servizi online” -> “My Home” -> “Certificazione e verifica” -> Emissioni Acustiche.
Attività
Il Centro Banca Dati EA (CBDEA) di Inail svolge correntemente alcune attività connesse all'applicazione della procedura EA che possono sinteticamente essere così descritte:
discriminazione dei lotti omogenei;
analisi delle prove EA;
analisi dei lotti;
certificazione dei lotti.
In allegato:
Sintesi attività EA aggiornamento: 31 dicembre 2020
Procedura EA
Chiarimenti applicativi
Procedura EA per serbatoi GPL oltre 13 m3
Procedura per l’accertamento dell’integrità strutturale dei grandi serbatoi (GS) per GPL con il metodo di Emissione Acustica (EA).
In attuazione dell’art. 64-bis comma 3, del decreto-legge 16 luglio 2020, n. 76 convertito, con modificazioni, dalla legge 11 settembre 2020, n. 120, l’Inail ha approvato, con Determina del Direttore Generale dell’Istituto n. 58 del 18 dicembre 2020 la “Procedura per il controllo di serbatoi per GPL interrati, tumulati (o ricoperti) e fuori terra di capacità maggiore di 13 m3 con tecnica basata sul metodo di Emissione Acustica ai fini della verifica d’integrità”. Il documento rappresenta la sintesi dell’attività di studio, ricerca e sperimentazione pluriennale condotta da Inail, e in precedenza dall’Ispesl, in materia di messa a punto di tecniche diagnostiche sui metodi di controllo non distruttivo e in particolare di emissione acustica.
La procedura è conforme allo standard UNI EN 12819 e definisce le modalità tecnico-operative per l’effettuazione delle verifiche di integrità di serbatoi per GPL interrati, ricoperti e fuori terra di capacità maggiore di 13 m3 (Grandi Serbatoi, GS) con tecnica basata sul metodo di Emissione Acustica (EA) e relativi requisiti tecnici dei soggetti abilitati (gli Organismi Competenti Abilitati, OCA) ad effettuare le verifiche.
La verifica di integrità effettuata in accordo alla procedura operativa EA – GS è riferita al singolo serbatoio e prescinde da qualsiasi approccio di valutazione statistica basata su aggregazione in lotti omogenei di costruzione.
Campo di applicazione
La procedura EA-GS è applicabile unicamente a serbatoi installati in Italia interrati, ricoperti o fuori terra che abbiano:
- capacità maggiore di 13 m3;
- membrature metalliche protette da un idoneo sistema (es: protezione catodica, coibentazione, cassa di contenimento).
La procedura EA-GS deve essere applicata esclusivamente da Organismi Competenti Abilitati con decreto dell’Autorità competente ai sensi del decreto interdirettoriale 17 gennaio 2005 e che soddisfino specifici requisiti tecnici riportati in appendice A del documento esplicativo della procedura stessa.
Caratteristiche della procedura EA – GS
La procedura definisce:
[alert]- i requisiti tecnici degli Organismi Competenti Abilitati – Grandi Serbatoi (OCA-GS);
- le modalità di esecuzione delle prove integrative preliminari alla prova EA;
- le modalità organizzative necessarie alla conduzione della prova EA;
- le caratteristiche tecniche della strumentazione necessaria allo svolgimento della prova EA;
- il protocollo di prova con tecnica basata sul metodo EA;
- il procedimento interpretativo dei dati di prova in accordo al modello analitico messo a punto da Inail;
- i criteri di classificazione della prova EA;
- le modalità di redazione del rapporto di prova e della sua trasmissione al Centro Banca Dati EA dell’Inail;
- le modalità di redazione del verbale della verifica d’integrità.[/alert]
La prova EA può essere svolta solo a valle della presentazione del progetto di fattibilità della prova EA elaborato a cura dell’OCA-GS indicato dal Proprietario al Centro Banca Dati EA e del parere positivo espresso da apposita Commissione Tecnica dell’Inail.
L’OCA-GS, preliminarmente ad ogni prova EA, deve elaborare specifiche procedure interne di complemento alla procedura EA-GS, di seguito elencate:
Procedura per l’analisi dei rischi connessi all’esecuzione della prova EA e l’individuazione delle misure da adottare per la eliminazione o mitigazione degli stessi;
Procedura di gestione in sicurezza dell’impianto di pressurizzazione;
Procedura per l’esecuzione delle prove integrative preliminari;
Procedura delle prove non distruttive (PND) di dettaglio a fronte delle indicazioni emerse nell’analisi di follow up.
Schema descrittivo della metodica
La pressurizzazione del serbatoio deve essere ottenuta utilizzando uno specifico impianto che immetta gas inerte (tipicamente azoto).
La pressione deve essere costantemente rilevata mediante un idoneo sensore installato sul serbatoio o sulla linea dell'impianto di pressurizzazione ad esso direttamente connessa.
La tecnica prevede l'installazione di una rete di sensori EA sulle membrature del serbatoio. I segnali EA acquisiti devono essere caratterizzati da alcuni parametri descrittori più significativi, in conformità alla norma UNI EN 13554. Tali segnali, opportunamente elaborati ed interpretati, vengono impiegati per il calcolo un indicatore sintetico utilizzato per la classificazione del serbatoio.
Architettura del sistema
Il sistema prevede l’interazione dei soggetti di seguito sinteticamente definiti:
il Proprietario, il soggetto che possiede il serbatoio e ne dispone l’installazione e ne cura l’esercizio in conformità alle prescrizioni e alle raccomandazioni fornite dal Fabbricante;
l’Inail (già Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro), quale Organismo Nazionale Competente ai fini della definizione, aggiornamento e corretta applicazione della “Procedura per il controllo di serbatoi per GPL interrati, tumulati (o ricoperti) e fuori terra di capacità maggiore di 13 m3 con tecnica basata sul metodo di Emissione Acustica ai fini della verifica d’integrità”;
l’Organismo Competente Abilitato ad espletare le attività connesse all’applicazione della procedura EA, il soggetto abilitato dal Ministero dello Sviluppo Economico, mediante apposito decreto, che soddisfi gli specifici requisiti tecnici riportati in appendice A della stessa procedura.
Il Ministero dello Sviluppo Economico, che sovraintende le attività.
Trasmissione istanze ai fini della verifica di integrità di serbatoi per GPL interrati, tumulati (o ricoperti) e fuori terra di capacità maggiore di 13 m3
Le domande corredate dagli allegati previsti dalla procedura devono essere trasmesse dai soggetti interessati, con dovuto anticipo rispetto ai termini di scadenza, tramite l’accesso al portale istituzionale dell’Inail immettendo le credenziali dispositive nella sezione “accedi ai servizi online” -> “My Home” -> “Certificazione e verifica” -> Applicazioni e procedure -> CIVA -> “Verifiche d'integrità decennale con EA per serbatoi con capacità > 13 mc”.
Attività
Il Centro Banca Dati EA (CBDEA) di Inail svolge correntemente alcune attività connesse all'applicazione della procedura EA che possono sinteticamente essere così descritte:
- Verifica del progetto di fattibilità della prova EA;
- rilascio del nulla osta alla esperibilità della prova EA;
- acquisizione ed analisi dei dati di prova;
- sorveglianza degli Organismi Competenti Abilitati.
In allegato: Procedura EA - GS aggiornamento: 18 dicembre 2020
...
Fonte: INAIL
Collegati
[box-note]Circolare Inail n. 10 dell'11 marzo 2021
Determina del Direttore Generale n. 58 del 18 dicembre 2020
Controllo periodico decennale serbatoi interrati GPL metodo EA
Verifiche periodiche attrezzature a pressione
Depositi GPL: Quadro normativo Prevenzione Incendi
Periodicità e metodi dei controlli sui serbatoi interrati[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Riqualificazione serbatoi GPL con metodo EA Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
484 kB | 19 | ||
| Sintesi attività EA_dicembre 2020.pdf 31 dicembre 2020 |
1500 kB | 14 | ||
| Procedura EA - Rev. 2 Dicembre 2008.pdf ISPLES - Rev. 2 Dicembre 2008 |
1409 kB | 13 | ||
| Chiarimenti applicativi.pdf |
370 kB | 12 | ||
| Procedura EA-GS 18.12.2020.pdf Aggiornamento 18 dicembre 2020 |
2046 kB | 15 |
Stima del rischio ISO/TR 14121-2 p. 6.4 Punteggio numerico - Esempio e scheda
Stima del rischio ISO/TR 14121-2 p. 6.4 Punteggio numerico - Esempio e scheda
ID 13083 | 12.03.2021 / Documento di esempio e scheda applicazione in allegato
La norma ISO/TR 14121-2 (Rapporto Tecnico) Sicurezza del macchinario Valutazione del rischio Parte 2: Guida pratica ed esempi di metodi, fornisce una guida pratica per l'esecuzione della valutazione del rischio per il macchinario in conformità alla EN ISO 12100 e descrive diversi metodi e strumenti per ogni fase del processo. Fornisce esempi di differenti misure che possono essere utilizzate per ridurre il rischio ed è destinata ad essere utilizzata per la valutazione del rischio di una estesa varietà di macchinari in termini di complessità e di potenziale di danno.
I suoi utilizzatori previsti sono le persone coinvolte nella progettazione, installazione o modifica del macchinario.
[panel]Nel Documento è illustrato uno dei metodi riportati nella ISO/TR 14121-2, il “Punteggio Numerico” (p. 6.4), con esempio / scheda di valutazione del rischio e processo di riduzione del rischio per una Macchina formatrice a mandrino verticale, in cui l'identificazione dei pericoli è limitata, in questo esempio, alla fase di utilizzo e, in particolare, alla messa a punto e al funzionamento della macchina.
Nel rapporto tecnico ISO/TR 14121-2, nell’esempio relativo la macchina formatrice, viene usato il metodo grafico. In questo documento, allo stesso esempio viene applicato un metodo a punteggio numerico usando i parametri riportati al capitolo 2.[/panel]
[box-info]Metodi di Stima del Rischio ISO/TR 14121-2
Nella ISO/TR 14121-2 sono illustrati 4 metodi per la Stima del rischio:
1. Matrice del rischio (6.2)
2. Grafico del rischio / Metodo grafico (6.3)
3. Punteggio numerico (6.4)
4. Metodo ibrido (6.5)
Si ricorda che la EN ISO 12100 demanda all'uso dei metodi illustrati nella ISO/TR 14121-2 (anche se non armonizzata) per la valutazione dei rischi relativi alle macchine:
"EN ISO 12100
...
Scopo e campo di applicazione ...L’uso pratico di diversi metodi per ogni fase della valutazione del rischio è descritto nell’ISO/TR 14121-2".[/box-info]
Figura 0 - ISO/TR 14121-2 Metodi di Stima del rischio
1. Punteggio numerico
Gli strumenti basati sul punteggio numerico considerano due o più parametri che sono suddivisi in un certo numero di classi come le matrici e i grafici del rischio. Tuttavia, alle classi sono associati diversi valori numerici invece di un termine qualitativo. Per ogni parametro è scelta una classe e i valori (o punteggi) associati sono combinati tra di loro (per esempio, attraverso addizione e/o moltiplicazione) per ottenere un punteggio numerico per il rischio stimato. In alcuni casi, questi valori assegnati sono rappresentati in prospetto(i) e, pertanto, il loro uso è molto simile a quello di una matrice.
I sistemi basati sul punteggio consentono una ponderazione semplice ed esplicita dei parametri. L'uso di numeri può trasmettere un'impressione di obiettività del livello di rischio anche se l'assegnazione dei punteggi per ogni elemento del rischio è altamente soggettiva. Comunque questo effetto può essere eliminato raggruppando i punteggi in classificazioni qualitative del rischio, come "alto", "medio" e "basso".
Esistono diversi strumenti a punteggio numerico utilizzati per la stima del rischio.
2. Esempio di uno strumento basato sul punteggio numerico del rischio o metodo
In questo esempio vi sono due parametri, (gravità e probabilità del verificarsi del danno) e ognuno di questi parametri è suddiviso nelle quattro classi indicate.
Al parametro della gravità sono attribuiti i seguenti punteggi (Severity Scores - SS):
[panel]- Catastrofica, SS=100;
- Grave, 99≥SS≥90;
- Moderata, 89≥SS≥30;
- Minore, 29≥SS≥0.[/panel]
Il parametro della probabilità di verificarsi del danno ha i seguenti punteggi di probabilità (Probability Scores - PS):
[panel]- Molto probabile, PS=100, probabile o certo che accada;
- Probabile, 99≥PS≥70, può accadere (ma non è probabile);
- Improbabile, 69≥PS≥30, non probabile che accada;
- Remota, 29≥PS≥0, la probabilità che si verifichi è così remota da essere praticamente uguale a zero.[/panel]
In questo esempio, la formula che combina la probabilità che si verifichi il danno e la gravità è data dall’equazione seguente:
Dove RS è il punteggio del rischio (Risk Score).
Il punteggio del rischio può essere quindi interpretato secondo la tabella 1.
Tabella 1 - Categorie di punteggio del rischio utilizzate
[...]
9. Descrizione della concezione della macchina
Nota) Vedere figura 1.
Il processo di fresatura è eseguito da una fresa montata su un mandrino verticale. Il mandrino ruota in una sola direzione e può essere sollevato e abbassato mediante un volantino (unità mandrino). Il mandrino può ruotare a quattro diverse velocità (vedere di seguito velocità del mandrino), azionato da un motore elettrico e da una serie di pulegge (unita di azionamento).
L'unità del mandrino e l'unità di azionamento sono fissate a una tavola di ghisa che poggia su di un armadio di acciaio. La tavola e l'armadio forniscono un buon sostegno per il pezzo da lavorare e sono di altezza tale da garantire una postura eretta ergonomica.
La macchina è dotata di apposite guide per mantenere la corretta posizione del pezzo da lavorare durante la lavorazione.
La velocità del mandrino è selezionata manualmente spostando una cinghia di trasmissione da una puleggia a un'altra.
Figura 1 - Concezione della macchina
[...]
13. Determinazione dei limiti del macchinario
13.1. Descrizione delle diverse fasi dell'intero ciclo di vita del macchinario
Le fasi del ciclo di vita di questo macchinario considerate significative in questo esempio sono le seguenti:
[panel]Trasporto
Tutte le attività di trasporto che possono essere eseguite dall'utilizzatore della macchina, in questo caso trasporto interno, rimozione, ecc.
Montaggio, installazione e messa in funzione
Rimozioni di parti associate al trasporto (per esempio, coperture, bulloni di fissaggio) che fissano la macchina al pavimento, collegamento alla fonte di energia, verifica della corretta installazione (corretta direzione di rotazione dell'utensile), verifica del funzionamento di tutti i comandi e della capacità della macchina di svolgere le operazioni richieste.
Messa a punto
Sostituzione di un utensile sul mandrino, montaggio e regolazione delle guide, modifica della velocità del mandrino e prove.
Utilizzo
Fresatura alimentata a mano.
Pulizia, manutenzione
lngrassaggio degli elementi rotanti e di trasmissione, sostituzione delle cinghie, pulizia delle parti interne della macchina.
Ricerca e riparazione delle avarie
Operazioni in caso di malfunzionamento della macchina e dopo l'attuazione dei dispositivi di protezione.
Messa fuori servizio, smantellamento
Smaltimento di tutte le parti della macchina da parte dell'utilizzatore.[/panel]
[...]
16. Stima, valutazione e riduzione del rischio
Le abbreviazioni utilizzate nel prospetto 2 hanno i seguenti significati.
Tabella 2 - Abbreviazioni
[...]
B. Valutazione del rischio (stima del rischio e ponderazione del rischio) e riduzione del rischio
Prospetto 2
...
Segue in allegato (Documento di esempio e scheda applicazione in allegato)
Fonti
ISO/TR 14121-2:2012
EN ISO 12100:2010
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 0.0 | 12.03.2021 | --- | Certifico Srl |
Collegati
[box-note]Stima del rischio ISO/TR 14121-2 p. 6.4 Punteggio numerico - Esempio e scheda
EN ISO 12100 e ISO/TR 14121-2: Esempio Valutazione del rischio
ISO TR 14121-2: Metodi per l'analisi del rischio
ISO/TR 14121-2 Risk assessment Hybrid Tool - File CEM
EN ISO 12100 Valutazione del Rischio | File CEM
EN ISO 12100: La sequenza per la Valutazione del Rischio e la documentazione prevista
Direttiva macchine 2006/42/CE
ebook Guida Tecnica Direttiva macchine Ed. 6.0 2020
ebook Direttiva macchine e Norme Tecniche Armonizzate[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Stima del Rischio ISO TR 14121-2 p. 6.4 Punteggio numerico - Scheda Rev. 00 2021.docx Certifico Srl - Rev. 00 2021 |
27 kB | 232 | ||
| Stima del Rischio ISO TR 14121-2 p. 6.4 Punteggio numerico Rev. 00 2021.pdf Certifico Srl - Rev. 00 2021 |
720 kB | 336 |
Decreto 25 gennaio 2021 n. 28
Decreto 25 gennaio 2021 n. 28
Regolamento recante proroga delle scadenze delle revisioni generali e speciali quinquennali, nonche' di quelle relative agli scorrimenti e alle sostituzioni delle funi e al rifacimento dei loro attacchi di estremita' degli impianti a fune.
(GU n.60 del 11.03.2021)
Entrata in vigore del provvedimento: 26/03/2021
...
Art. 1. Finalità e definizioni
1. Il presente regolamento stabilisce le procedure per l’attuazione dell’articolo 14 -ter del decreto-legge 8 aprile 2020 n. 23, convertito, con modificazioni, dalla legge 5 giugno 2020 n. 40, nonché definisce, al fine di uniformare i suddetti adempimenti, i modelli delle dichiarazioni che devono essere rese dai direttori di esercizio o dai responsabili dell’esercizio.
2. Ai fini del presente regolamento, si intende per:
a) USTIF: Ufficio Speciale Trasporti a Impianti Fissi;
b) MUM: Manuale di Uso e Manutenzione;
c) CIC-Pnd: Comitato Italiano di Coordinamento Prove non distruttive.
Art. 2. Revisione generale e speciale quinquennale
Art. 3. Scorrimenti, sostituzioni delle funi e rifacimento degli attacchi di estremità
Art. 4. Termini di inizio e di conclusione di opere di realizzazione
Art. 5. Esclusioni
1. Non sono ricompresi nell’ambito di applicazione del presente regolamento:
1) gli impianti le cui scadenze della revisione generale o speciale quinquennale sono state già prorogate ai sensi del decreto direttoriale 17 aprile 2012 e del decreto del Ministro delle infrastrutture e dei trasporti 1° dicembre 2015, n. 203;
2) gli impianti per i quali la revisione generale è necessaria ai fini del proseguimento dell’esercizio dopo la scadenza della vita tecnica, ai sensi del punto 2.5.3
dell’Allegato tecnico A al decreto del Ministro delle infrastrutture e dei trasporti 1° dicembre 2015, n. 203;
3) le funi tenditrici in scadenza, la cui età massima è prefissata in dodici anni o 18.000 ore di esercizio;
4) gli attacchi di estremità delle funi a teste fuse metalliche, la cui età massima è prefissata in cinque anni di esercizio.
Art. 6. Clausola di invarianza finanziaria
...
Allegato 1 (articolo 2, comma 1)
SCHEMA DICHIARAZIONE
Proroga della scadenza della revisione generale o speciale quinquennale ai sensi dell’articolo 14-ter del decreto-legge 8 aprile 2020 n. 23, convertito, con modificazioni, dalla legge 5 giugno 2020, n. 40
Allegato 2 (articolo 3, comma 1)
SCHEMA DI DICHIARAZIONE
Proroga della scadenza inerente agli scorrimenti, alla sostituzione delle funi ed al rifacimento degli attacchi di estremità ai sensi dell’art. 14-ter del decreto-legge 8 aprile 2020 n. 23, convertito, con modificazioni, dalla legge 5 giugno 2020, n. 40
_______
Collegati
[box-note]Decreto Milleproroghe 2021 | Impianti a fune[/box-note]
Regolamento certificazione T-PED - INAIL 2021
Regolamento certificazione T-PED - INAIL 2021
Certificazione in accordo alla direttiva 2010/35/UE T-PED
Destinatari
Fabbricante, proprietario o utilizzatore dell’attrezzatura
Caratteristiche
La direttiva T-PED (2010/35/UE) si applica alle attrezzature a pressione trasportabili (Apt), disciplinando:
- la valutazione della conformità (immissione sul mercato e messa in servizio)
- la rivalutazione della conformità dei recipienti costruiti in accordo alle normative nazionali previgenti
- l’ispezione periodica.
L’Inail realizza il servizio in qualità di organismo notificato. I tempi di esecuzione e il tipo di verifica variano in funzione dell’equipaggiamento del richiedente e del tipo di attrezzatura da verificare. La valutazione della conformità e l’ispezione periodica delle A.p.t. può essere anche direttamente effettuata dal Fabbricante/Richiedente che opera in accordo ad un sistema di gestione in qualità approvato da INAIL 0100.
Finalità
Accertare la conformità alla Direttiva 2010/35/UE delle attrezzature a pressione trasportabili in sede di valutazione della conformità, rivalutazione della conformità e ispezione periodica.
Modalità di richiesta
Il fabbricante, il proprietario o l’utilizzatore dell’attrezzatura inviano attraverso la compilazione delle richieste di prestazione TPED, specificando il luogo e il tipo di intervento richiesto, all’Unità operativa territoriale di certificazione, verifica e ricerca competente e ad ON0100.
Modalità di erogazione del servizio
L’Unità operativa territoriale di certificazione esegue le verifiche e prove previste dalla Direttiva e comunica a ON0100 l’esito delle stesse predisponendo le certificazioni del caso che vengono riesaminate dal Responsabile Tecnico. La comunicazione al fabbricante/richiedente sull’esito della certificazione avviene comunque contestualmente in sede di verifica sul luogo dell’intervento e, in seguito, attraverso posta ordinaria.
Costi a carico dell’utente
Il rilascio della certificazione prevede un costo a carico dell’utente secondo quanto previsto dal Tariffario pubblicato in Gazzetta Ufficiale n. 165 del 18 luglio 2005. Il pagamento deve essere effettuato a seguito del ricevimento della fattura.
_______
[panel]5.1 Doveri dell'organizzazione certificata
Il fabbricante non deve aver presentato analoga domanda di certificazione/ispezione ad altro Organismo Notificato per il medesimo prodotto ne la stessa domanda può essere già stata rifiutata da un altro Organismo Notificato.
Al richiedente INAIL O.N. 0100 richiede:
- di mantenere una registrazione dei procedimenti delle istruttorie per azioni di controllo del mercato, relativi alla non conformità dei prodotti certificati, da segnalare con tempestività a INAIL O.N. 0100;
- di registrare le azioni correttive adottate, nonché relativi eventuali provvedimenti degli organi di vigilanza;
- il rispetto dei doveri cogenti, descritti dalle disposizioni vigenti che traspongono le direttive 2010/35/UE e 2020/1833/UE;
- il rispetto dei doveri contrattuali sottoscritti, nell'accettazione dell'offerta e del presente regolamento;
- di mettere a disposizione di INAIL O.N. 0100, se pertinente, un campione del tipo ed essere consapevole che INAIL O.N. 0100 possa chiedere altri campioni, se il programma delle prove lo richiede;
- di consentire a INAIL O.N. 0100 di accedere, a fini ispettivi in funzione delle procedure di certificazione richiesta, ai locali di progettazione, fabbricazione, ispezione, prova e deposito e di fornirgli tutte le informazioni necessarie e la relativa documentazione.
L'Organizzazione richiedente la Certificazione e quella certificata devono, inoltre:
1. consentire, previo accordo con INAIL O.N. 0100, durante il periodo di validità della certificazione relativa alla sorveglianza del servizio interno di ispezione del richiedente, lo svolgimento delle verifiche ispettive di sorveglianza sulla produzione e sul sistema di gestione;
2. fornire e mantenere aggiornata tutta la documentazione richiesta da INAIL O.N. 0100;
3. non commercializzare prodotti prima della conclusione con esito positivo dell'iter di certificazione;
4. comunicare a INAIL O.N. 0100 eventuali reclami ricevuti da clienti relativamente al prodotto certificato;
5. informare preventivamente INAIL O.N. 0100 in merito a trasferimenti di proprietà, variazioni di recapiti, apertura nuove sedi e/o filiali, cambi di denominazione sociale, modifiche significative dei propri cicli lavorativi.
6. Fornire, prima del rinnovo della certificazione relativa al sistema di gestione in qualità, i dati aggiornati sull'introduzione di nuovi processi/prodotti e sulle modifiche alla struttura organizzativa;
7. non emettere senza preventiva autorizzazione di INAIL O.N. 0100 versioni modificate della
documentazione tecnica di prodotto e/o della documentazione del sistema di gestione in qualità che contengano variazioni ai requisiti previsti dalla Direttiva e/o dalle norme applicate;
8. comunicare l'eventuale coinvolgimento del Legale Rappresentante in procedimenti giudiziari connessi con l'attività dell'Organizzazione;
9. evitare di fare e vietare ad altri di mettere in atto azioni che possano trarre in inganno riguardo la certificazione ottenuta;
10. evitare di utilizzare e vietare l'utilizzo del certificato o di una sua parte in modo ingannevole;
11. interrompere l'utilizzo di materiale pubblicitario che fa riferimento alla certificazione nel caso di sospensione o di revoca della stessa;
12. non lasciare intendere che la certificazione si applichi ad attività/prodotti che sono fuori dal campo di applicazione della stessa;
13. non utilizzare la propria certificazione in modo tale da poter danneggiare la reputazione dell'organismo di certificazione e compromettere la fiducia del pubblico;
14. garantire l'accesso degli ispettori, ivi compresi quelli ACCREDIA (salvo quanto riportato al successivo punto “diritti dell’organizzazione certificata”, a tutte le aree aziendali ed a tutte le registrazioni pertinenti al fine di assicurare il corretto svolgimento della valutazione di conformità;
15. garantire (salvo quanto riportato al successivo punto “diritti dell’organizzazione certificata”) l'accesso ai valutatori ACCREDIA previa comunicazione da parte di INAIL O.N. 0100 dei loro nominativi,
16. garantire (salvo quanto riportato al successivo punto “diritti dell’organizzazione certifica
17. accettare che in caso di diniego della certificazione l'informazione sia fornita in copia all'Ente di Accreditamento;
18. rendersi disponibile all'esecuzione di verifiche ispettive con un preavviso di 5 giorni, a seguito di ricezione di reclami e/o segnalazioni, o di sospensione della certificazione, senza possibilità di ricusare il personale tecnico incaricato di eseguire tale ispezione.[/panel]
Fonte: INAIL
Collegati
[box-note]Direttiva 2010/35/UE
Attrezzature T-PED
Direttiva TPED Consolidato
Pacchi di bombole ADR | TPED
Cisterne ADR | TPED[/box-note]
RAPEX Report 16 del 23/04/2021 N. 20 A12/00543/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 16 del 23/04/2021 N. 20 A12/00543/21 Repubblica Ceca
Approfondimento tecnico: Seggiolone per bambini
Il prodotto, di marca 4 BABY® Fashion Red, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 14988:2017 “Seggioloni per bambini - Requisiti e metodi di prova”.
Il seggiolone non è sufficientemente stabile e può facilmente ribaltarsi all'indietro.
La norma tecnica EN 14988:2017 “Seggioloni per bambini - Requisiti e metodi di prova” al punto 8.12.2.4 descrive come eseguire la prova per verificare che i seggioloni siano sufficientemente stabili da non ribaltarsi all’indietro.
La prova consiste nel posizionare il seggiolone come nella figura seguente ed nell’applicare gradualmente una forza verticale verso il basso di 150 N a una distanza di 140 mm misurata orizzontalmente verso l'esterno dal punto anteriore in cui la trave di prova scarica è appoggiata allo schienale.
La forza deve essere applicata per (60 ± 3)s, a meno che il seggiolone non si ribalti prima.
Fig. 1 - Test stabilità ribaltamento all’indietro
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 16 del 23_04_2021 N. 20 A12_00543_21 Repubblica Ceca.pdf Seggiolone per bambini |
406 kB | 0 |
RAPEX Report 15 del 16/04/2021 N. 02 A11/00025/21 Malta

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 15 del 16/04/2021 N. 02 A11/00025/21 Malta
Approfondimento tecnico: Friggitrice
Il prodotto, di marca GIRMI, mod. FG20, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60335-2-13:2010 “Sicurezza degli apparecchi elettrici d'uso domestico e similare Parte 2: Norme particolari per padelle per friggere, friggitrici e apparecchi similari”.
l termostato non spegne correttamente la friggitrice. Il prodotto si può surriscaldare e causare un incendio.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 15 del 16_04_2021 N. 02 A11_00025_21 Malta.pdf Friggitrice |
367 kB | 0 |
Proposal for a Regulation on a European approach for Artificial Intelligence
Proposal for a Regulation on a European approach for Artificial Intelligence
ID 13380 | 12.07.204 / Documenti in allegato
Update 12.07.2024 / Testo Pubblicato GU 12.07.2024
Regolamento (UE) 2024/1689 del Parlamento europeo e del Consiglio, del 13 giugno 2024, che stabilisce regole armonizzate sull'intelligenza artificiale e modifica i regolamenti (CE) n. 300/2008, (UE) n. 167/2013, (UE) n. 168/2013, (UE) 2018/858, (UE) 2018/1139 e (UE) 2019/2144 e le direttive 2014/90/UE, (UE) 2016/797 e (UE) 2020/1828 (regolamento sull'intelligenza artificiale) (GU L 2024/1689 del 12.7.2024)
EP, 14.06.2023 Amendments adopted by the European Parliament
Emendamenti del Parlamento europeo, approvati il 14 giugno 2023, alla proposta di regolamento del Parlamento europeo e del Consiglio che stabilisce regole armonizzate sull'intelligenza artificiale (legge sull'intelligenza artificiale) e modifica alcuni atti legislativi dell'Unione (COM(2021)0206 – C9-0146/2021 – 2021/0106(COD))
_________
EC, 21.04.2021 Regolamento AI 2021: la proposta
In allegato:
- COM(2021) 206 final - Proposta di regolamento su un approccio europeo all'intelligenza artificiale
- COM(2021) 206 final - Allegati
...
Fonte: CE
Vedi Roadmap:
Collegati
[box-note]Regolamento intelligenza artificiale (AI Act): Roadmap
Proposal for a Regulation on machinery products
Artificial Intelligence for Europe[/box-note]
Proposal for a Regulation on machinery products
Proposal for a Regulation of the European Parliament and of the Council on machinery products
ID 13380 | 29.10.2021 / In allegato Proposta 2021 ed emendamenti Regolamento macchine
EC, 21.04.2021 Regolamento Macchine 2021: la proposta
[box-info]Update 29.10.2021
In data 20 Ottobre 2021, pubblicato Report di emendamenti alla Proposta, per dettagli: (2021/0105(COD) 20.10.2021) [/box-info]
[box-warning]Article 49 Transitional and final provisions
Directive 2006/42/EC is repealed with effect from … [30 months after the date of entry into force of this Regulation.][/box-warning]
[box-warning]Article 50 Transitional provisions
1. Member States shall not until … [42 months after the date of entry into force of this Regulation] impede the making available on the market of machinery which was placed on the market in conformity with Directive 2006/42/EC before … [the date of entry into force of this Regulation][/box-warning]
[box-warning]Article 52 Entry into force and application
This Regulation shall enter into force on the twentieth day following that of its publication in the Official Journal of the European Union. It shall apply from … [30 months after the date of entry into force of this Regulation.][/box-warning]
In attachement:
[alert]- 2021/0105/COD Emendament Proposal Regulation machinery 2021
- COM(2021) 202 - Proposal for a Regulation of the European Parliament and of the Council on machinery products
- COM(2021) 202 ANNEX - Annex to the Proposal for a Regulation of the European Parliament and of the Council on machinery products
- SWD(2021) 82 - Impact assessment
- SWD(2021) 83 - Executive summary of the Impact assessment[/alert]
...
The Machinery Directive (hereafter ‘MD’) establishes a regulatory framework for placing machinery on the Single Market, based on Article 114 of the TFEU (the approximation of laws. The general objectives of the MD are to: i) ensure free movement of machinery within the internal market; and ii) ensure a high level of protection for users and other exposed persons. The MD follows the ‘new approach’ principles of EU legislation. It is intentionally written to be technology neutral, which means that it lays down the essential health and safety requirements (hereafter ‘safety requirements’) to be complied with, without prescribing any specific technical solution to comply with those requirements. The choice of the technical solution is a prerogative of manufacturers, which leaves space for innovation and new design development.
During the REFIT evaluation of the directive, all interested parties confirmed it is an essential piece of legislation although it identified a necessity to improve, simplify and adapt the MD to the needs of the market. Some Members of the European Parliament’s expressed their support to the revision of the Machinery Directive. In particular, by ‘taking the legislation’ to the XXI century and promoting innovation for the EU economy.
As part of the Commission Work Programme 2020 under the priority ‘A Europe fit for the Digital Age’, the revision of the product safety Directive 2006/42/EC on Machinery (MD) contributes to the digital transition and to the strengthening of the Single Market. Indeed, regarding new technologies and their impact on safety legislation, the Commission has published in February 2020 a White Paper on Artificial Intelligence accompanied by a ‘Report on the safety and liability implications of Artificial Intelligence, the Internet of Things and robotics’. The Report, which has conducted an analysis of the impact of new technologies and the challenges they pose to Union safety legislation, concluded that the current product safety legislation contains a number of gaps that need to be addressed, in particular, among other, in the Machinery Directive. This is even more relevant for a sustainable recovery from the COVID pandemic, since the machinery sector is an essential part of the engineering industry and one of the industrial mainstays of the EU economy.
In view of dealing with the elements highlighted in the evaluation and developed in the impact assessment report of the machinery directive5, as well as responding to the Commission policy objectives on digitalization, this proposal expects to tackle the following problems:
[panel]Problem 1: The MD does not sufficiently cover new risks originating from emerging technologies.
In order to boost the trust in digital technologies, the MD needs to provide legal certainty as regards those technologies, existing gaps could hinder a level playing field for manufacturers, which would impact the efficiency of the MD.
There are several aspects that need to be addressed within this problem. The first one relates to the potential risks that originate from a direct human-robot collaboration as the collaborative robots (co-bots) that are designed to work alongside human and employees are exponentially increasing. A second source of potential risk originates from connected machinery. A third area of concern lies with the way software updates affects the ‘behaviour’ of the machinery after its placing on the market. A fourth concern relates to the ability of manufacturers to conduct a full risk assessment on machine learning applications before the product is placed on the market. Finally, as far as the autonomous machines and remote supervisory stations, the current MD foresees a driver or an operator responsible for the movement of a machine. The driver may be transported by the machinery or may be accompanying the machinery, or may guide the machinery by remote control, but does not consider the possibility of no driver, and sets up no requirements for autonomous machines.
Problem 2:
(i) Legal uncertainty due to a lack of clarity on the scope and definitions; and
(ii) possible safety gaps in traditional technologies.
The MD needs greater legal certainty in its scope and definitions, which generated some difficulties for manufacturers to understand the correct legal framework they should apply.
Some overlaps or inconsistencies with other EU specific legislation were identified. With respect to the definitions set by the Directive, the definition of 'partly completed machinery' raised a number of concerns particularly centred at the borderline with the definition of 'machinery' and the definition of ‘machinery’ has been clarified. Besides, there is a need to clarify the exclusion of means of transport and to reinforce the coherence of the exclusion of some products covered by the Low Voltage Directive 2014/35/EU when those products integrate a Wi-Fi function.
Furthermore, it is a common practice that machines placed on the market are modified in order for example to add a function or improve the performance. The problem is that if the machine suffers a substantial modification, without the manufacturer’s agreement, may be not in conformity any longer with the essential health and safety requirements. The current MD does not address this situation.
There are a number of requirements on traditional technologies not related to new technologies that were identified either as not clear or safe enough, or as too prescriptive and potentially hindering innovation. These requirements are related to installation of lifting appliances, slow speed lifts, seating, protection against hazardous substances, overhead power lines and vibration from portable handheld and hand guided machinery.
Problem 3: Insufficient provisions for high risk machines.
The third party conformity assessment is considered by some Member States and stakeholders more adapted to address the high risks stemming from certain groups of machines.
Another problem is that the current list of high-risk machines in Annex I was elaborated 15 years ago, and the market has much evolved since then. It is necessary to remove machines no longer considered high risk and/or introducing new ones (such as machinery embedding AI systems, which fulfil a safety function).
Problem 4: Monetary and environmental costs due to extensive paper-based documentation.
The MD requires manufacturers to provide the necessary machinery information, such as instructions. To ensure that every machine user has access to the instructions, providing a printed version was considered as the most viable option. Since then, however, the use of the internet and digital technologies has increased. The requirement to provide printed versions increases the costs and administrative burdens for economic operators and has a negative impact on the environment. However, it must be also considered that some users are less digitally savvy, there is a lack of internet access in certain environments and the digital manual might not match the version of the product.
Problem 5: Inconsistencies with other pieces of Union product safety legislation.
The New Legislative Framework is a package of measures aimed at brought together all the elements required for a comprehensive regulatory framework to operate effectively for the safety and compliance of industrial products with the requirements adopted to protect the various public interests and for the proper functioning of the single market. A main objective of the Commission is to bring product harmonisation legislation in line with the reference provisions of Decision 768/2008/EC. While the Machinery Directive is already a New Approach directive, it is not yet aligned to the NLF.
The lack of MD’s alignment to the NLF creates inconsistencies with other EU product legislation.
Problem 6: Divergences in interpretation due to transposition.
The fact that the current machinery legislation is a Directive leaving Member States to choose the means to comply with the legislative objectives, has led to different interpretations of the MD provisions creating legal uncertainty and lack of coherence throughout the single market.
Furthermore, there have been delays in the transposition of the Directive in some Member States.[/panel]
Fonte: EC
Collegati
[box-note]Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| 2021 0105 COD Emendament Proposal Regulation machinery 2021.pdf Ivan Štefanec - 2021 |
272 kB | 43 | ||
| Executive summary - Machinery.pdf SWD(2021) 83 |
214 kB | 60 | ||
| Assessment - Machinery.pdf SWD(2021) 82 |
1680 kB | 69 | ||
| Regulation annex machinery.pdf COM(2021) 202 |
479 kB | 62 | ||
| Regulation machinery.pdf COM(2021) 202 |
416 kB | 90 |
Norme armonizzate Direttiva dispositivi medico-diagnostici in vitro (IVD) 98/79/CE
Norme armonizzate Direttiva dispositivi medico-diagnostici in vitro 98/79/CE
ID 13364 | Elenco Norme armonizzate Direttiva dispositivi medico-diagnostici in vitro ad Aprile 2021
[box-warning]Come consultare i riferimenti alle norme armonizzate 2021
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi della direttiva 98/79/CE sono contenuti nelle:
1. Comunicazione 2017/C 389/04 del 17 novembre 2017 Comunicazione della Commissione nell’ambito dell’applicazione della direttiva 98/79/CE del Parlamento europeo e del Consiglio, del 27 ottobre 1998, relativa ai dispositivi medico-diagnostici in vitro (GU C 389/62 del 17.11.2017)
2. Decisione di esecuzione 2020/439 della Commissione del il 24 marzo 2020 relativa alle norme armonizzate per i dispositivi medico-diagnostici in vitro elaborate a sostegno della direttiva 98/79/CE del Parlamento europeo e del Consiglio GU LI 90/33 del 25.03.2020. Applicazione fino al 26 maggio 2024.
3. Decisione di esecuzione (UE) 2021/609 della Commissione del 14 aprile 2021 che modifica la decisione di esecuzione (UE) 2020/439 per quanto riguarda le norme armonizzate sugli imballaggi per dispositivi medici sterilizzati terminalmente e sulla sterilizzazione dei dispositivi medici. (GU L 129/150 del 15.04.2021). Entrata in vigore: 15.04.2021
e devono essere letti insieme, tenendo conto che l'ultima decisione modifica alcuni riferimenti pubblicati nella comunicazione e nelle decisioni precedenti pubblicate.[/box-warning]
[box-download]In fondo all'articolo, scorrendo la pagina, allegato PDF dell'elenco consolidato delle norme armonizzate IVDD ad Aprile 2021 riservato Abbonati Marcatura CE. [/box-download]
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
...
Elenco consolidato Norme armonizzate direttiva 98/79/CE IVD al 15 Aprile 2021
Elenco consolidato che tiene conto delle:
1. Comunicazione 2017/C 389/04 del 17 novembre 2017 (GU C 389/62 del 17.11.2017)
2. Decisione di esecuzione 2020/439 (GU LI 90/33 del 25.03.2020)
3. Decisione di esecuzione (UE) 2021/609 (GU L 129/150 del 15.04.2021)
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Prima pubblicazione GU |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione Nota 4 |
|
CEN |
EN 556-1:2001 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l'indicazione "STERILE" - Requisiti per i dispositivi medici sterilizzati terminalmente EN 556-1:2001/AC:2006 |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 556-2:2015 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l'indicazione "STERILE" - Parte 2: Requisiti per i dispositivi medici preparati asetticamente
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006, incl. Amd 1:2013) EN ISO 11137-1:2015/A2:2019
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006, incl. Amd 1:2013)
|
17.11.2017 |
|
|
Con la Dec. di esec. 2020/439 la norma è continua ad applicarsi fino al 30.09.2021 |
|
CEN |
EN ISO 11137-2:2015 Sterilizzazione dei prodotti sanitari - Radiazione - Parte 2: Definizione della dose sterilizzante (ISO 11137-2:2013)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 11607-1:2020 |
15.04.2021 |
|
|
Con la Dec.di esec. (UE) 2021/609 la norma è pubblicata 15.04.2021 |
|
CEN |
EN ISO 11607-2:2020 |
15.04.2021 |
|
|
Con la Dec.di esec. (UE) 2021/609 la norma è pubblicata 15.04.2021 |
|
CEN |
|
15.04.2021 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata 25.03.2020 Con la Dec.di esec. (UE) 2021/609 la norma è sostituita 15.04.2021 |
|
CEN |
EN 12322:1999 Dispositivi medico-diagnostici in vitro - Mezzi di coltura per microbiologia - Criteri di prestazione per mezzi di coltura EN 12322:1999/A1:2001
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
Trattamento asettico dei prodotti per la cura della salute - Parte 1: Requisiti generali (ISO 13408-1:2008) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-2:2018 Trattamento asettico dei prodotti per la cura della salute - Parte 2: Filtrazione sterilizzante (ISO 13408-2:2018)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-2:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 2: Filtrazione (ISO 13408-2:2003)
|
19.8.2011 |
|
|
Con la Dec. di esec. 2020/439 la norma è continua ad applicarsi fino al 30.09.2021 |
|
CEN |
EN ISO 13408-3:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 3: Liofilizzazione (ISO 13408-3:2006)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-4:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 4: Tecnologie per la pulizia in loco (ISO 13408-4:2005)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-5:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 5: Sterilizzazione in loco (ISO 13408-5:2006)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-6:2011 Trattamento asettico dei prodotti per la cura della salute - Parte 6: Sistemi isolatori (ISO 13408-6:2005)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13408-7:2015 Trattamento asettico dei prodotti per la cura della salute - Parte 7: Processi alternativi per dispositivi medici e prodotti di combinazione (ISO 13408-7:2012)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2018
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità – Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2016
|
17.11.2017 |
EN ISO 13485:2012 Nota 2.1 |
31.3.2019 |
Con la Dec. di esec. 2020/439 la norma è continua ad applicarsi fino al 30.09.2021 |
|
CEN |
EN 13532:2002 Requisiti generali per i dispositivi medico-diagnostici in vitro per test auto-diagnostici
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
17EN 13612:2002 Va18lutazione delle prestazioni dei dispositivi medico-diagnostici in vitro EN 1193612:2002/AC:2002
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 13641:2002 Eliminazione o riduzione del rischio di infezione relativa ai reagenti diagnostici in vitro
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 13975:2003 Procedure di campionamento utilizzate per le prove di accettazione dei dispositivi medico- diagnostici in vitro - Aspetti statistici
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 14136:2004 Utilizzo di schemi di valutazione esterna della qualità per la valutazione delle prestazioni dei procedimenti di esami diagnostici in vitro
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 14254:2004 Dispositivi medico-diagnostici in vitro - Contenitori monouso per la raccolta di campioni di origine umana, diversi dal sangue
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 14820:2004 Contenitori monouso per il prelievo di campioni di sangue venoso umano
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 14937:2009 Sterilizzazione dei prodotti sanitari - Requisiti generali per la caratterizzazione di un agente sterilizzante e per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 14937:2009)
|
25.03.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 14971:2012 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (ISO 14971:2007, Corrected version 2007-10-01)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 15193:2009 Dispositivi medico-diagnostici in vitro - Misura di grandezze in campioni di origine biologica - Requisiti per il contenuto e la presentazione di procedimenti di misura di riferimento (ISO 15193:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 15194:2009 Dispositivi medico-diagnostici in vitro - Misura di grandezze in campioni di origine biologica - Requisiti relativi ai materiali di riferimento certificati e al contenuto della documentazione di supporto (ISO 15194:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 15197:2015 Sistemi di dosaggio dei diagnostici in vitro - Requisiti per i sistemi auto-diagnostici di monitoraggio della glicemia nel trattamento del diabete mellito (ISO 15197:2013)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 15223-1:2016 Dispositivi medici - Simboli da utilizzare nelle etichette del dispositivo medico, nell'etichettatura e nelle informazioni che devono essere fornite - Parte 1: Requisiti generali (ISO 15223-1:2016, Corrected version 2017-03)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 17511:2003 Dispositivi medico-diagnostici in vitro - Misura di grandezze di campioni di origine biologica - Tracciabilità metrologica dei valori assegnati ai calibratori e ai materiali di controllo (ISO 17511:2003)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 18113-1:2011 Dispositivi medico-diagnostici in vitro - Informazioni fornite dal fabbricante (etichettatura) - Parte 1: Termini, definizioni e requisiti generali (ISO 18113-1:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 18113-2:2011 Dispositivi medico-diagnostici in vitro - Informazioni fornite dal fabbricante (etichettatura) - Parte 2: Reagenti diagnostici in vitro per uso professionale (ISO 18113-2:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 18113-3:2011 Dispositivi medico-diagnostici in vitro - Informazioni fornite dal fabbricante (etichettatura) - Parte 3: Strumenti diagnostici in vitro per uso professionale (ISO 18113-3:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
Dispositivi medico-diagnostici in vitro - Informazioni fornite dal fabbricante (etichettatura) - Parte 4: Reagenti diagnostici in vitro per test auto-diagnostici (ISO 18113-4:2009) |
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 18113-5:2011 Dispositivi medico-diagnostici in vitro - Informazioni fornite dal fabbricante (etichettatura) - Parte 5: Strumenti diagnostici in vitro per test auto-diagnostici (ISO 18113-5:2009)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 18153:2003 Dispositivi medico-diagnostici in vitro - Misura di grandezze in campioni di origine biologica - Tracciabilità metrologica dei valori per la concentrazione catalitica di enzimi assegnati a calibratori e materiali di controllo (ISO 18153:2003)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 20776-1:2006 Sistemi di prova in laboratorio e di dosaggio dei diagnostici in vitro - Prova di sensibilità degli agenti infettivi e valutazione delle prestazioni dei dispositivi di sensibilità antimicrobici - Parte 1: Metodo di riferimento per la determinazione della sensibilità in vitro agli agenti antimicrobici dei batteri aerobici a crescita rapida presenti in malattie infettive (ISO 20776-1:2006)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 23640:2015 Dispositivi medico-diagnostici in vitro - Valutazione della stabilità dei reagenti diagnostici in vitro (ISO 23640:2011)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN ISO 25424:2019 Sterilizzatrici a bassa temperatura a vapore e formaldeide - Requisiti per lo sviluppo, la convalida e il controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 25424:2018)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 61010-2-101:2002 Prescrizioni di sicurezza per apparecchi elettrici di misura, controllo e per utilizzo in laboratorio - Parte 2-101: Prescrizioni particolari per apparecchiature mediche per la diagnosi in-vitro (IEC 61010-2-101:2002 (Modificata))
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 61326-2-6:2006 Apparecchi elettrici di misura, controllo e laboratorio - Prescrizioni di compatibilità elettromagnetica - Parte 2-6: Requisiti particolari - Apparecchiature mediche per diagnostica in vitro (IVD) (IEC 61326-2-6:2005)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 62304:2006 Software per dispositivi medici - Processi relativi al ciclo di vita del software (IEC 62304:2006) EN 62304:2006/AC:2008
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
|
CEN |
EN 62366:2008 Dispositivi medici - Applicazione dell'ingegneria delle caratteristiche utilizzative ai dispositivi medici (IEC 62366:2007)
|
25.3.2020 |
|
|
Con la Dec. di esec. 2020/439 la norma è pubblicata |
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, 1040 Bruxelles, tel. +32 2 55008 11; fax +32 2 550 0819 (http://www.cen.eu)
- CENELEC: Rue de la Science 23, 1040 Bruxelles, tel. +32 2 55008 11; fax +32 2 550 0819 (http://www.cenelec.eu)
- ETSI: 650, route des Lucioles, 06921 Sophia Antipolis, tel. +33 492 944200; fax +33 493 654716 (http://www.etsi.eu)
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata. La norma sostituita perciò consiste nella EN CCCCC:YYYY e nelle sue precedenti eventuali modifiche, ma senza la nuova modifica citata. Alla data stabilita, la norma sostituita cessa di fornire la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 4: Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione. (Vedasi Com.(2018) 764 EC).
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui l'elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (1).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet: http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
...
Collegati:
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Elenco consolidato Norme armonizzate Direttiva IVD Aprile 2021.pdf Certifico Srl - Rev. 0.0 Aprile 2021 |
470 kB | 10 |
SAFAP 2021 - Call for papers
SAFAP 2021 - Call for papers
ID 13345 | CTI del 08/04/2021 / Call for papers entro il 26 aprile 2021
L'INAIL ha programmato la nona edizione del Convegno SAFAP “Sicurezza e affidabilità delle attrezzature - La gestione del rischio dalla costruzione all’esercizio”, che si terrà in modalità digitale. Il convegno è rivolto a tutti coloro che, a vario titolo, operano nel settore delle attrezzature a pressione, dei generatori di vapore e degli impianti a rischio d’incidente rilevante: ricercatori, progettisti, fabbricanti, organismi notificati, impiantisti, esercenti, esperti della sicurezza, addetti ai controlli/verifiche/ispezioni/vigilanza. Gli ambiti di applicazione sono: Direttiva PED, TPED, ATEX, SEVESO III, DM 329/04, DM 11/4/2011, nuovo e vecchio parco, omologazione residuale.
Gli autori interessati a proporre memorie tecnico-scientifiche possono inviare gli abstract all’indirizzo Questo indirizzo email è protetto dagli spambots. E' necessario abilitare JavaScript per vederlo.
entro il 26 aprile 2021, seguendo le istruzioni nel documento in allegato.
Fonte: CTI
Collegati
[box-note]Nuova Direttiva PED 2014/68/UE
Direttiva 2010/35/UE
Nuova Direttiva ATEX Prodotti 2014/34/UE
Direttiva 2012/18/UE - Seveso III
Decreto 1 dicembre 2004 n. 329
D.M. 11 aprile 2011 Verifica impianti e attrezzature[/box-note]
Direttiva macchine 2021: la proposta di revisione
Direttiva macchine 2021: la proposta di revisione
ID 133324 | 14.04.2021
Nella presente pagina saranno riportate le informazioni sulla revisione della Direttiva macchine 2006/42/CE prevista per il 1° semestre 2021
Update 14.04.2021
Commenti di Orgalim (con tabella delle modifiche in 65 punti) alla proposta di revisione della Direttiva macchine 2006/42/CE presentata al gruppo di lavoro della Commissione riunione del 9-10 novembre 2020.
[box-note]Revision of Machinery Directive - December 2020 Orgalim Comments to WG-2020.91.1
Orgalim comments to proposals for the revision of the Machinery Directive 2006/42/EC tabled at the Commission Working Group meeting of 9-10 November 2020[/box-note]
Segue in allegato
Collegati
[box-note]Direttiva macchine 2006/42/CE
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Revision of Machinery Directive - December 2020 Orgalim Comments to WG-2020.91.1.pdf Orgalime Dec. 2020 |
430 kB | 109 |
WHO guideline on the use of safety-engineered syringes for intramuscular
WHO guideline on the use of safety-engineered syringes for intramuscular
WHO guideline on the use of safety-engineered syringes for intramuscular, intradermal and subcutaneous injections in health care settings
OMS 2016
L'OMS ha pubblicato una serie di linee guida sull'uso dei tipi di siringhe raccomandate, come le linee guida dell'OMS sull'uso di siringhe progettate per la sicurezza per iniezioni intramuscolari, intradermiche e sottocutanee in strutture sanitarie, pubblicate nel 2016. Queste linee guida descrivono cosa L'OMS considera pratiche non sicure e fornisce raccomandazioni su quelle sicure. Sostengono l'uso di siringhe realizzate secondo le definizioni e i requisiti di diversi standard ISO per garantire che soddisfino i livelli di sicurezza e qualità concordati a livello internazionale.
Questi includono ISO 23908, Protezione da lesioni da taglio - Requisiti e metodi di prova - Funzioni di protezione da oggetti taglienti per aghi ipodermici monouso, introduttori per cateteri e aghi utilizzati per il prelievo di sangue , che fornisce standard minimi concordati a livello internazionale per ridurre il rischio di lesioni da oggetti taglienti. Inoltre, la serie ISO 7886, che specifica proprietà e requisiti per le siringhe ipodermiche sterili monouso, copre anche le siringhe con disabilitazione automatica (ISO 7886-3) e le siringhe con funzioni di prevenzione del riutilizzo (ISO 7886-4). Le siringhe con disabilitazione automatica sono anche quelle utilizzate nell'iniziativa COVAX.
Questi standard sono strumenti estremamente utili per i produttori di siringhe per garantire che siano conformi alle raccomandazioni dell'OMS e alle migliori pratiche globali. Assistono anche i nuovi produttori con ciò che è necessario per realizzare un prodotto adatto all'uso con i vaccini, risparmiando loro enormi quantità di tempo. Questo è estremamente importante perché non possiamo permetterci di sprecare un solo sforzo date le elevate quantità richieste per i milioni e milioni di vaccini.
....
Contents
Acknowledgements
Abbreviations and acronyms
Executive summary
Scope and purpose
Target audience
Background
Methodology
Guideline development process
Guideline Steering Committee
Guideline Development Group
Management of conflicts of interest
Recommendations
Question 1: Recommendation for the use of sharp injury protection syringes (SIPs) for intramuscular, intradermal and subcutaneous injections
Question 2: Recommendation for the use of re-use prevention syringes (RUPs) for intramuscular, intradermal and subcutaneous injections
Implications for future research
Considerations for the development of future guidelines
Dissemination, adaptation and implementation
Dissemination
Adaptation and implementation
Monitoring and evaluation of guideline implementation
Plans for updating this guideline
References
______
Fonte: WHO
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| WHO guideline on the use of safety-engineered syringes for intramuscular.pdf WHO 2016 |
724 kB | 4 |
RAPEX Report 12 del 26/03/2021 N. 06 A12/00419/21 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 12 del 26/03/2021 N. 06 A12/00419/21 Svezia
Approfondimento tecnico: Tappeto di protezione pavimento
Il prodotto Fallskyddsplatta svart , di marca sconosciuta, mod. 00-004-383-1, è stato sottoposto alla procedura che impone il ritiro della vendita online, perché non conforme Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
Il prodotto contiene una quantità eccessiva di idrocarburi policiclici aromatici (IPA), compresi benzo(a)pirene e benzo(e)pirene, (valori misurati corrispondentemente 2,9 ppm e 2,3 ppm). Gli IPA sono cancerogeni.
1. Idrocarburi policiclici aromatici (IPA)
a) Benzo[a]pirene (BaP) N. CAS 50-32-8
b) Benzo[e]pirene (BeP) N. CAS 192-97-2
c) Benzo[a]antracene (BaA) N. CAS 56-55-3
d) Crisene (CHR) N. CAS 218-01-9
e) Benzo[b]fluorantene (BbFA) N. CAS 205-99-2
f) Benzo[j]fluorantene (BjFA) N. CAS 205-82-3
g) Benzo[k]fluorantene (BkFA) N. CAS 207-08-9
h) Dibenzo[a,h]antracene (DBAhA) N. CAS 53-70-3
1. A decorrere dal 1 gennaio 2010, non possono essere immessi sul mercato o utilizzati per la produzione di pneumatici o parti di pneumatici gli olii diluenti aventi un contenuto:
- di BaP superiore a 1 mg/kg (0,0001 % in peso), o
- un contenuto complessivo di tutti gli IPA elencati superiore a 10 mg/kg (0,001 % in peso).
La norma EN 16143-2013 [Prodotti petroliferi - Determinazione del contenuto di Benzo(a)pirene (BaP) e di alcuni idrocarburi policiclici aromatici (IPA) negli oli diluenti - Procedimento che utilizza la doppia purificazione mediante LC e l'analisi GC/MS] è utilizzata come metodo di prova per dimostrare la conformità con i limiti di cui al primo comma.
Fino al 23 settembre 2016, si ritiene che i limiti di cui al primo comma siano rispettati se l'estratto di policiclici aromatici (PCA) è inferiore al 3 % in peso, secondo la norma dell'Institute of Petroleum IP 346:1998 (Determinazione dei PCA negli oli lubrificanti di base inutilizzati e nelle frazioni di petrolio prive di asfaltene - estrazione di dimetile solfossido), purché il rispetto dei limiti di BaP e degli elencati IPA, nonché la correlazione dei valori misurati con l'estratto PCA, siano misurati dal fabbricante o dall'importatore ogni sei mesi o dopo ogni cambio operativo di rilievo, optando per il più prossimo.
2. Inoltre, non possono essere immessi sul mercato pneumatici e battistrada per rigenerazione fabbricati dopo il 1 gennaio 2010 se contengono oli diluenti in quantitativi superiore ai limiti fissati nel paragrafo 1.
Tali limiti sono considerati rispettati se i composti di gomma vulcanizzata non superano il limite dello 0,35 % di HBay come misurato e calcolato con il metodo ISO 21461 (gomma vulcanizzata - determinazione dell’aromaticità degli olii nei composti di gomma vulcanizzata).
3. In deroga a quanto sopra stabilito, le disposizioni del paragrafo 2 non si applicano agli pneumatici rigenerati se il loro battistrada non contiene oli diluenti che superano i limiti di cui al paragrafo 1.
4. Ai fini della presente voce, per «pneumatici» si intendono i pneumatici di veicoli contemplati nelle seguenti direttive:
- direttiva 2007/46/CE del Parlamento europeo e del Consiglio, del 5 settembre 2007, che istituisce un quadro per l’omologazione dei veicoli a motore e dei loro rimorchi (*4),
- direttiva 2003/37/CE del Parlamento europeo e del Consiglio, del 26 maggio 2003, relativa all’omologazione dei trattori agricoli o forestali, dei loro rimorchi e delle loro macchine intercambiabili trainate, nonché dei sistemi, componenti ed entità tecniche di tali veicoli (*5), e
- direttiva 2002/24/CE del Parlamento europeo e del Consiglio, del 18 marzo 2002, relativa all’omologazione dei veicoli a motore a due o tre ruote e che abroga la direttiva 92/61/CEE del Consiglio (*6).
5. Gli articoli non possono essere immessi in commercio per la vendita al pubblico se uno dei loro componenti in gomma o in plastica che vengono a contatto diretto e prolungato o ripetuto e a breve termine con la pelle umana o con la cavità orale, in condizioni d’ uso normali o ragionevolmente prevedibili, contiene oltre 1 mg/kg (0,0001 % del peso di tale componente) di uno degli IPA elencati.
Tali articoli comprendono, tra l’altro:
- attrezzature sportive come le biciclette, le mazze da golf, le racchette,
- utensili per la casa, carrelli, girelli,
- attrezzi per uso domestico,
- abbigliamento, calzature, guanti e abbigliamento sportivo,
- cinturini di orologi, bracciali, maschere, fasce per i capelli.
6. I giocattoli, inclusi quelli per le attività, e gli articoli di puericultura non devono essere immessi in commercio se uno dei loro componenti in gomma o in plastica che vengono a contatto diretto e prolungato oppure ripetuto e a breve termine con la pelle umana o con la cavità orale, in condizioni d'uso normali o ragionevolmente prevedibili, contiene oltre 0,5 mg/kg (0,00005 % del peso di tale componente) di uno degli IPA elencati.
7. In deroga ai paragrafi 5 e 6, la restrizione non si applica agli articoli immessi in commercio per la prima volta anteriormente al 27 dicembre 2015.
8. Entro il 27 dicembre 2017 la Commissione riesamina i valori limite di cui ai paragrafi 5 e 6 alla luce dei nuovi dati scientifici, compresi quelli relativi alla migrazione degli IPA presenti negli articoli di cui allo stesso regolamento, nonché quelli relativi a materie prime alternative e, se del caso, modifica tali paragrafi.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 12 del 26_03_2021 N. 06 A12_00419_21 Svezia.pdf Tappeto di protezione pavimento |
422 kB | 0 |
RAPEX Report 11 del 19/03/2021 N. 06 A12/00382/21 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 11 del 19/03/2021 N. 06 A12/00382/21 Francia
Approfondimento tecnico: Braccialetto
Il prodotto, di marca sconosciuta, mod. Bracelet Harry Potter doré hiboux triangle RDLM, è stato sottoposto alla procedura di eliminazione dai listini del mercato online perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il braccialetto rilascia una quantità eccessiva di nichel (valore misurato fino a: 1,3 µg/cm2/settimana). Il nichel è un forte sensibilizzante e provoca reazioni allergiche se presente in articoli che entrano in contatto diretto e prolungato con la pelle.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
27. Nichel
1. Non è consentito l’uso:
a) in tutti gli oggetti metallici che vengono inseriti negli orecchi perforati o in altre parti perforate del corpo umano, a meno che il tasso di cessione di nickel da tali oggetti metallici sia inferiore a 0,2 μg/cm2 per settimana (limite di migrazione);
b) in articoli destinati ad entrare in contatto diretto e prolungato con la pelle, quali:
- orecchini,
- collane, bracciali e catenelle, cavigliere, anelli,
- casse di orologi da polso, cinturini per orologi e chiusure di orologi,
- bottoni automatici, fermagli, rivetti, cerniere lampo e marchi metallici, se sono applicati agli indumenti,
se il tasso di cessione di nickel dalle parti di questi articoli che vengono a contatto diretto e prolungato con la pelle è superiore a 0,5 μ/cm2/settimana;
c) negli articoli di cui alla lettera b) se hanno un rivestimento senza nickel, a meno che tale rivestimento sia sufficiente a garantire che il tasso di cessione di nickel dalle parti di tali articoli che sono a contatto diretto e prolungato con la pelle non superi 0,5 μg/cm2/settimana per un periodo di almeno due anni di uso normale dell’articolo.
2. Gli articoli che sono oggetto del paragrafo 1 non possono essere immessi sul mercato se non sono conformi alle prescrizioni di tale paragrafo.
3. Le norme adottate dal Comitato europeo di normalizzazione (CEN) sono utilizzate come metodi di prova per dimostrare la conformità degli articoli ai paragrafi 1 e 2.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 11 del 19_03_2021 N. 06 A12_00382_21 Francia.pdf Braccialetto |
354 kB | 1 |
Schema Direttiva | Schede tecniche verifica periodica strumenti di misura
Schema Direttiva | Schede tecniche verifica periodica strumenti di misura
ID 13206 | 26.03.2021 In allegato schema direttiva
Schema di direttiva del Ministro dello sviluppo economico recante l’adozione, ai sensi dell’articolo 3, comma 4, del decreto del Ministro dello sviluppo economico 21 aprile 2017 n. 93, di schede tecniche per la verificazione periodica di strumenti di misura in servizio utilizzati per funzioni di misura legali.
Lo schema in parola è stato inviato alla CE il 23 marzo 2021, il termine dello status quo pertanto, è fissato il 24 giugno 2021.
Lo direttiva ha l'obiettivo di uniformare sul territorio nazionale le procedure tecniche per la verificazione periodica degli strumenti di cui alle schede tecniche riportate. Tale direttiva aggiunge 3 nuovi allegati a quelli già definiti dal decreto 93/2017 e si inquadra in un contesto che mira a rendere omogenee le attività svolte dagli organismi che effettuano la verificazione periodica e a migliorare l’efficacia dei controlli da parte delle autorità competenti, al fine di rafforzare la fiducia del consumatore e a garanzia degli scambi commerciali.
La direttiva si applica alla verificazione periodica dei seguenti strumenti di misura:
[alert]a) sistemi per la misurazione continua e dinamica di quantità di liquidi diversi dall’acqua del tipo sistemi di misurazione per gas liquefatti per autotrazione (distributori di GPL);
b) misuratori massici di gas metano per autotrazione;
c) strumenti per pesare a funzionamento automatico del tipo selezionatrici ponderali, utilizzati per le funzioni di misura legali.[/alert]
Lo schema di Direttiva è costituito da 3 articoli e da 3 schede allegate.
L’articolo 1 contiene l’oggetto e l’ambito di applicazione della direttiva e specifica gli strumenti di misura a cui essa si applica.
L’articolo 2 elenca gli allegati in cui sono riportate le procedure da seguire nella verificazione periodica degli strumenti di misura di cui all’ articolo 1.
L’articolo 3 definisce l’iter di pubblicazione della Direttiva.
Gli allegati contengono le schede integrative a quelle già contenute nel precitato Decreto 93/2017 (L’articolo 3, comma 4 del citato Decreto 21 aprile 2017 n. 93, reca “Anche al fine di uniformare su tutto il territorio nazionale le procedure tecniche da seguire nei controlli e di meglio specificare le prescrizioni al riguardo già contenute nel presente regolamento, possono essere definite dal Ministero dello Sviluppo Economico apposite direttive, anche rinviando a specifiche norme tecniche”.):
Allegato I - Scheda G: Sistemi per la misurazione continua e dinamica di quantità di liquidi diversi dall’acqua del tipo sistemi di misurazione per gas liquefatti per autotrazione (distributori di GPL);
Allegato II - Scheda H - Misuratori massici di gas metano per autotrazione;
Allegato III - Scheda I – Strumenti per pesare a funzionamento automatico del tipo selezionatrici ponderali.
...
Fonte: EU
Collegati
[box-note]Direttiva 2014/32/UE
Decreto Legislativo 84/2016 Strumenti misura
Decreto 21 aprile 2017 n. 93[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Schema Direttiva Schede tecniche verifica periodica strumenti di misura.pdf EU, 23.03.2021 |
994 kB | 25 |
RAPEX Report 10 del 12/03/2021 N. 01 A11/00018/21 Islanda

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 10 del 12/03/2021 N. 01 A11/00018/21 Islanda
Approfondimento tecnico: Scala per arrampicata bambini
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-8:2018 “Sicurezza dei giocattoli - Parte 8: Giocattoli di attività per uso domestico”
La scala non è sufficientemente stabile e può ribaltarsi causando lesioni al bambino. Inoltre, c’è il rischio che la testa del bambino possa restare intrappolata tra i gradini della scala.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
I. Proprietà fisico-meccaniche
1. I giocattoli e le loro parti e, nel caso dei giochi fissi, i relativi ancoraggi devono avere la resistenza meccanica e, se del caso, la stabilità necessarie per sopportare - senza rompersi o deformarsi con il rischio di provocare lesioni fisiche - le sollecitazioni cui sono sottoposti durante l’uso. […]
11. I giochi di attività devono essere costruiti in modo da ridurre, per quanto possibile, il rischio di schiacciare parti del corpo, intrappolare parti del corpo o indumenti, nonché di cadute, di urti e di annegamento. In particolare, ogni superficie di tale giocattolo accessibile a uno o più bambini che vi giochino sopra, deve essere progettata in modo da sopportarne il peso. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 10 del 12_03_2021 N. 01 A11_00018_21 Islanda.pdf Scala per arrampicata bambini |
118 kB | 0 |
Ricondizionamento dispositivi medici monouso
Ricondizionamento dei dispositivi medici monouso (ai sensi del Regolamento MD)
ID 13138 | Rev. 00 del 18.03.2020 / Documento completo allegato
Il Regolamento (UE) 2017/745, prevede all’Art. 17 (Dispositivi monouso e loro ricondizionamento), le prescrizioni per il ricondizionamento e l'ulteriore utilizzo dei dispositivi monouso. Con il Regolamento di esecuzione (UE) 2020/1207 (GU L 273/3 del 20.08.2020), sono state stabilite le Specifiche Comuni (SC) in esecuzione dell’Art. 17 p. 3 del Regolamento (UE) 2017/745 che consente la deroga al p. 2 relativa alla persona fisica o giuridica che ricondiziona un dispositivo monouso che potrà non assumere gli obblighi imposti ai fabbricanti dal Regolamento (UE) 2017/745.
Le istituzioni sanitarie che ricondizionano dispositivi monouso, dovranno conformarti all'articolo 17 del Regolamento (UE) 2017/745. Il regolamento aggiunge condizioni rigorose per il ricondizionamento dei dispositivi medici monouso e pone la piena responsabilità del prodotto sul ricondizionatore. Inoltre, il ricondizionamento può avvenire solo se autorizzato dalla legislazione nazionale e conformemente alle disposizioni del MDR. Alcuni paesi dell'UE potrebbero avere disposizioni più severe o addirittura vietare il ricondizionamento.
Pubblicato nella GU L 273/3 del 20.08.2020 il Regolamento di esecuzione (UE) 2020/1207 che stabilisce le norme per l’applicazione dell’articolo 17, paragrafo 3, del Regolamento (UE) 2017/745, qualora il diritto nazionale autorizzi il ricondizionamento dei dispositivi monouso e uno Stato membro abbia deciso di non applicare tutte le norme relative agli obblighi dei fabbricanti previste in tale regolamento in relazione ai dispositivi monouso ricondizionati e utilizzati all’interno di un’istituzione sanitaria.
Il regolamento stabilisce inoltre le norme applicabili nel caso in cui uno Stato membro abbia deciso di applicare l’articolo 17, paragrafo 3, del Regolamento (UE) 2017/745 anche per quanto riguarda i dispositivi monouso ricondizionati da un ricondizionatore esterno. Esso si applica a decorrere dal 26 maggio 2021.
...
[box-note]Regolamento (UE) 2017/745
Articolo 17. Dispositivi monouso e loro ricondizionamento
1. Il ricondizionamento e l'ulteriore utilizzo dei dispositivi monouso è autorizzato solo se consentito dal diritto nazionale e solo a norma del presente articolo.
2. Una persona fisica o giuridica che ricondiziona un dispositivo monouso per renderlo adatto a un ulteriore utilizzo nell'Unione è considerata il fabbricante del dispositivo ricondizionato e assume gli obblighi imposti ai fabbricanti dal presente regolamento, ivi compresi gli obblighi connessi alla tracciabilità del dispositivo ricondizionato, conformemente al capo III del presente regolamento. Il ricondizionatore del dispositivo è considerato un produttore ai fini dell'articolo 3, paragrafo 1, della direttiva 85/374/CEE.
3. In deroga al paragrafo 2, gli Stati membri possono decidere di non applicare tutte le norme relative agli obblighi dei fabbricanti previste nel presente regolamento in relazione ai dispositivi monouso ricondizionati e utilizzati all'interno di un'istituzione sanitaria, purché garantiscano che:
a) la sicurezza e le prestazioni del dispositivo ricondizionato sono equivalenti a quelle del dispositivo d'origine e che le prescrizioni di cui all'articolo 5, paragrafo 5, lettere a), b), d), e), f), g) e h) sono rispettate;
b) il ricondizionamento è effettuato a norma delle SC (*) che precisano le prescrizioni applicabili:
- alla gestione del rischio, comprese l'analisi della fabbricazione e i materiali, le proprietà relative del dispositivo (ingegneria inversa) e le procedure necessarie a individuare le modifiche nella progettazione del dispositivo originale e la sua prevista applicazione dopo il ricondizionamento,
- alla convalida delle procedure per l'intero processo, tra cui le fasi relative alla pulizia,
- al rilascio del prodotto e ai test sulla prestazione,
- al sistema di gestione della qualità,
- alla segnalazione di incidenti relativi a dispositivi sottoposti a ricondizionamento, e
- alla tracciabilità dei dispositivi ricondizionati. Gli Stati membri incoraggiano le istituzioni sanitarie, e possono obbligarle, a fornire ai pazienti informazioni sull'uso dei dispositivi ricondizionati all'interno dell'istituzione sanitaria e, se del caso, qualsiasi altra informazione pertinente sui dispositivi ricondizionati con cui tali pazienti sono trattati. Gli Stati membri informano la Commissione e gli altri Stati membri delle disposizioni nazionali adottate in virtù del presente paragrafo e dei motivi che ne giustificano l'adozione. La Commissione mette tali informazioni a disposizione del pubblico.
4. Gli Stati membri possono scegliere di applicare le disposizioni di cui al paragrafo 3 anche ai dispositivi monouso ricondizionati da un soggetto esterno su richiesta di un'istituzione sanitaria, purché il dispositivo ricondizionato nella sua totalità sia rinviato alla medesima istituzione sanitaria e il soggetto esterno soddisfi le prescrizioni di cui al paragrafo 3, lettere a) e b).
5. La Commissione adotta, ai sensi dell'articolo 9, paragrafo 1, le necessarie SC di cui al paragrafo 3, lettera b) entro il 26 maggio 2021. Tali SC sono coerenti con i più recenti dati scientifici e riguardano l'applicazione dei requisiti generali di sicurezza e prestazione di cui al presente regolamento. Se le SC non sono adottate entro il 26 maggio 2021, il ricondizionamento è effettuato secondo le norme armonizzate pertinenti e le disposizioni nazionali che garantiscono il rispetto delle prescrizioni previste al paragrafo 3, lettera b). Il rispetto delle SC o, in assenza di queste, delle norme armonizzate pertinenti e delle disposizioni nazionali è certificato da un organismo notificato.
6. Possono essere ricondizionati solo i dispositivi monouso che sono stati immessi sul mercato conformemente al presente regolamento o, prima del 26 maggio 2021, conformemente alla direttiva 93/42/CEE.
7. Il ricondizionamento di dispositivi monouso può essere effettuato solo se considerato sicuro in base ai più recenti dati scientifici.
8. Il nome e l'indirizzo della persona fisica o giuridica di cui al paragrafo 2 e le altre informazioni pertinenti di cui all'allegato I, punto 23, figurano sull'etichetta e, se del caso, nelle istruzioni per l'uso del dispositivo ricondizionato. Il nome e l'indirizzo del fabbricante del dispositivo monouso iniziale non figurano più sull'etichetta, ma sono indicati nelle istruzioni per l'uso del dispositivo ricondizionato.
9. Uno Stato membro che consente il ricondizionamento di dispositivi monouso può mantenere o introdurre disposizioni nazionali più rigorose di quelle previste dal presente regolamento, che limitino o vietino nel proprio territorio:
a) il ricondizionamento di dispositivi monouso e il trasferimento di dispositivi monouso in un altro Stato membro o in un paese terzo per esservi ricondizionati;
b) la messa a disposizione o l'ulteriore utilizzo di dispositivi monouso ricondizionati. Gli Stati membri informano la Commissione e gli altri Stati membri di tali disposizioni nazionali. La Commissione rende disponibile al pubblico tali informazioni.
10. Entro il 27 maggio 2024 la Commissione redige una relazione sul funzionamento del presente articolo e la presenta al Parlamento europeo e al Consiglio. Sulla base di tale relazione, la Commissione, se del caso, presenta proposte di modifica del presente regolamento.[/box-note]
[box-note](*) (SC) Specifiche Comuni
Regolamento (UE) 2017/745
71) «specifiche comuni» (SC): una serie di requisiti tecnici e/o clinici, diversi da una norma, che consentono di rispettare gli obblighi giuridici applicabili a un dispositivo, a un processo o a un sistema.
Le Specifiche Comuni (SC) sono state pubblicate con il Regolamento di esecuzione (UE) 2020/1207 della Commissione del 19 agosto 2020 recante modalità di applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda le specifiche comuni per il ricondizionamento dei dispositivi monouso (GU L 273/3 del 23.08.2020).[/box-note]
Figura 1 - Ricondizionamento DM monouso (Deroga Art. 17 p. 3)
...
Regolamento di esecuzione (UE) 2020/1207
della Commissione del 19 agosto 2020 recante modalità di applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda le specifiche comuni per il ricondizionamento dei dispositivi monouso (GU L 273/3 del 23.08.2020).
Regolamento di esecuzione (UE) 2020/1207
Articolo 3 Ricondizionatori esterni contraenti
1. Se il ricondizionamento è effettuato da un ricondizionatore esterno, l’istituzione sanitaria e il ricondizionatore esterno concludono un contratto scritto.
2. Il contratto comprende i seguenti elementi:
a) l’attribuzione dei compiti, degli obblighi e delle responsabilità delle due parti;
b) le disposizioni per il passaggio da un ricondizionatore esterno a un altro e le responsabilità del ricondizionatore esterno che è parte del contratto;
c) i requisiti relativi alla qualifica e alle competenze del personale che partecipa alle attività di ricondizionamento;
d) gli obblighi relativi al ricondizionamento, alla raccolta di informazioni riguardanti i dispositivi ricondizionati e allo scambio di informazioni tra l’istituzione sanitaria e il ricondizionatore esterno;
e) l’obbligo di garantire la compatibilità dei sistemi di gestione della qualità delle parti, di cui all’articolo 21;
f) la procedura per il monitoraggio della qualità del ricondizionamento effettuato dal ricondizionatore esterno mediante audit in loco.
Articolo 4 Personale, locali e attrezzature
1. Il ricondizionatore provvede affinché il personale addetto al ricondizionamento:
a) sia sufficiente a garantire la qualità del ricondizionamento;
b) possieda le conoscenze specifiche pertinenti e una formazione professionale sufficiente in considerazione delle fasi di ricondizionamento applicate;
c) abbia compiti e responsabilità chiaramente definiti per iscritto.
2. Il ricondizionatore designa una o più persone responsabili del ricondizionamento.
3. La persona responsabile del ricondizionamento soddisfa i seguenti criteri:
a) possiede esperienza e qualifiche sufficienti nel campo del ricondizionamento;
b) ha ricevuto una formazione in materia di segnalazione di incidenti e di analisi critica conformemente all’articolo 23, paragrafo 8.
La persona responsabile del ricondizionamento è permanentemente e continuamente a disposizione del ricondizionatore durante l’orario di lavoro di quest’ultimo. La persona responsabile del ricondizionamento è anche responsabile dell’elaborazione e della gestione della documentazione tecnica di cui all’articolo 9 e del sistema di gestione della qualità di cui all’articolo 21.
4. I locali in cui avviene il ricondizionamento e le attrezzature utilizzate sono adattati al tipo di dispositivi monouso da sottoporre a ricondizionamento, alle fasi del ciclo di ricondizionamento e al numero di fasi di ricondizionamento.
5. Le superfici dei locali, l’aria ambiente (temperatura, umidità, particelle sospese vitali e non vitali), l’acqua e gli altri gas e fluidi sono controllati e monitorati periodicamente per verificare che la qualità microbiologica e fisica sia adeguata al ricondizionamento.
6. Le attrezzature sono periodicamente sottoposte, secondo le istruzioni del fabbricante, a manutenzione, controlli delle prestazioni e calibrazioni generalmente riconosciuti come i più avanzati. Le attrezzature sono convalidate e, ove applicabile, periodicamente riconvalidate, al fine di stabilire se siano adatte alla destinazione d’uso.
7. Il ricondizionatore descrive nella documentazione tecnica di cui all’articolo 9, paragrafo 1, i tipi di dispositivi monouso per i quali ha deciso di essere in grado di effettuare il ricondizionamento e la motivazione di tale decisione. Il ricondizionatore rende disponibile al pubblico l’elenco dei dispositivi che è in grado di ricondizionare.
8. Se decide che non è più in grado di ricondizionare determinati tipi di dispositivi monouso, il ricondizionatore descrive i motivi di tale decisione nella documentazione tecnica di cui all’articolo 9, paragrafo 1. L’elenco di cui al paragrafo 7 del presente articolo è aggiornato di conseguenza.
Articolo 5 Valutazione preliminare dell’idoneità di un dispositivo monouso al ricondizionamento
1. Prima di decidere di iniziare a ricondizionare un dispositivo monouso, o di chiedere di farlo a un ricondizionatore esterno, l’istituzione sanitaria valuta se il dispositivo monouso sia adatto al ricondizionamento.
2. Ai fini del paragrafo 1, l’istituzione sanitaria valuta se la sicurezza e le prestazioni del dispositivo monouso una volta ricondizionato saranno equivalenti a quelle del dispositivo monouso d’origine.
3. Nel valutare l’idoneità di un dispositivo monouso al ricondizionamento, l’istituzione sanitaria, ove applicabile:
a) verifica che il dispositivo monouso rechi la marcatura CE;
b) verifica che il dispositivo monouso non sia stato ritirato dal mercato e che il suo certificato di conformità non sia stato sospeso, ritirato o sottoposto a limitazioni;
c) verifica se l’utilizzo del dispositivo monouso sia stato sottoposto a limitazioni per motivi di sicurezza, secondo quanto indicato negli avvisi di sicurezza;
d) effettua un’analisi delle proprietà del dispositivo monouso, tenendo conto di tutta la documentazione e di tutte le informazioni disponibili sul dispositivo monouso, per garantire una comprensione e una conoscenza sufficienti in materia di progettazione, proprietà di fabbricazione, caratteristiche dei materiali, proprietà funzionali e altri fattori di rischio connessi al ricondizionamento del dispositivo monouso, compreso l’uso precedente.
Ove applicabile, nell’effettuare una valutazione a norma del primo comma, l’istituzione sanitaria consulta un ricondizionatore esterno e si avvale del suo sostegno operativo conformemente al contratto di cui all’articolo 3.
Ai fini delle lettere b) e c), l’istituzione sanitaria verifica le informazioni contenute nella banca dati europea dei dispositivi medici (Eudamed). Fino a quando Eudamed non sarà pienamente operativa, l’istituzione sanitaria verifica le informazioni conformemente alle disposizioni sullo scambio di informazioni di cui all’articolo 123, paragrafo 3, lettera d), del regolamento (UE) 2017/745.
Qualora le informazioni non possano essere ottenute conformemente al terzo comma, l’istituzione sanitaria verifica le informazioni sul sito web del fabbricante o del suo mandatario.
Ai fini della lettera d), l’istituzione sanitaria riesamina le informazioni di cui all’allegato I, capo III, punto 23.4, lettera p), del regolamento (UE) 2017/745 e qualsiasi altra documentazione e informazione pertinente di pubblico dominio.
4. La decisione dell’istituzione sanitaria in merito all’idoneità di un dispositivo monouso al ricondizionamento è basata su un parere positivo scritto fornito dalla persona responsabile del ricondizionamento. Il dispositivo monouso non viene ricondizionato se la persona responsabile del ricondizionamento ha espresso un parere negativo sull’idoneità del dispositivo monouso al ricondizionamento.
Articolo 6 Destinazione d’uso originaria e monitoraggio delle modifiche apportate dal fabbricante del dispositivo monouso d’origine
1. Il ricondizionatore non modifica la destinazione d’uso originaria del dispositivo monouso quale indicata nelle istruzioni per l’uso.
2. Il ricondizionatore stabilisce un processo di monitoraggio al fine di verificare:
a)
che il dispositivo monouso non sia ritirato dal mercato;
b) che il certificato di conformità del dispositivo monouso non sia stato sospeso, ritirato o sottoposto a limitazioni;
c) che l’utilizzo del dispositivo monouso non sia sottoposto a limitazioni per motivi di sicurezza sulla base delle informazioni di cui all’articolo 5, paragrafo 3, lettere b) e c).
Il ricondizionatore individua inoltre qualsiasi modifica apportata dal fabbricante a componenti, materiali, destinazione d’uso o specifiche del dispositivo monouso che possa incidere sul ricondizionamento. Il ricondizionatore valuta l’importanza di tali modifiche per l’adeguatezza del ricondizionamento. Se una modifica incide negativamente sul dispositivo monouso ricondizionato, il ricondizionamento è interrotto o il processo di ricondizionamento è modificato per adattarlo alla modifica apportata al dispositivo monouso.
Articolo 7 Determinazione del ciclo di ricondizionamento
1. Le istituzioni sanitarie che ricondizionano dispositivi monouso stabiliscono, se applicabile insieme ai ricondizionatori esterni, il ciclo di ricondizionamento del dispositivo monouso da sottoporre a ricondizionamento.
2. Il ciclo di ricondizionamento è stabilito in base alla documentazione e alle informazioni raccolte conformemente all’articolo 5 e ai risultati di una valutazione tecnica che comprende, ove opportuno, test fisici, elettrici, chimici, biologici e microbiologici, e ingegneria inversa. Il ciclo di ricondizionamento non modifica la destinazione d’uso del dispositivo monouso, tiene conto delle conoscenze scientifiche e tecniche e, se applicabile, del metodo originale di sterilizzazione e delle norme pertinenti.
3. Il ciclo di ricondizionamento è stabilito per iscritto ed è convalidato dall’istituzione sanitaria che ricondiziona i dispositivi monouso, se applicabile insieme ai ricondizionatori esterni. Il ciclo di ricondizionamento descrive ogni fase del ricondizionamento. Per ciascuna fase è stabilita la procedura pertinente e ogni fase è convalidata. La convalida delle fasi di ricondizionamento consiste nell’installazione e nelle qualifiche del funzionamento e delle prestazioni.
4. La convalida garantisce che le prestazioni e la sicurezza del dispositivo monouso rimangano equivalenti a quelle del dispositivo monouso d’origine dopo ogni ciclo di ricondizionamento e fino al numero massimo consentito di cicli di ricondizionamento.
5. Il ciclo di ricondizionamento è monitorato mediante periodici test di routine e controlli della contaminazione, monitoraggi fisici, elettrici, chimici e biologici e verifiche dei parametri di processo e della calibrazione.
6. Il dispositivo monouso ricondizionato è rilasciato dopo che è stato confermato che le fasi di pulizia, disinfezione e sterilizzazione e i test pertinenti secondo i casi assicurano che il ciclo di ricondizionamento è stato completato conformemente alle prescrizioni applicabili a tale ciclo.
Articolo 8 Numero massimo di cicli di ricondizionamento
1. Ciascun ricondizionamento conforme all’articolo 11 è conteggiato come un unico ciclo di ricondizionamento. Ogni ciclo di ricondizionamento di un dispositivo monouso è conteggiato per determinare il numero massimo di cicli di ricondizionamento, anche qualora un dispositivo monouso non sia stato riutilizzato su un paziente in seguito al ricondizionamento.
2. L’istituzione sanitaria, se applicabile insieme al ricondizionatore esterno, stabilisce il numero massimo di cicli di ricondizionamento che possono essere applicati al dispositivo monouso ricondizionato durante i quali le prestazioni e la sicurezza di tale dispositivo rimangono equivalenti a quelle del dispositivo monouso d’origine.
3. Una volta raggiunto il numero massimo di cicli di ricondizionamento, il dispositivo monouso ricondizionato è smaltito.
Articolo 9 Documentazione tecnica
1. Il ricondizionatore dispone di una documentazione tecnica sulle sue attività di ricondizionamento che comprende:
a) le procedure di controllo e monitoraggio periodico dei locali e delle attrezzature di cui all’articolo 4, paragrafi 5 e 6;
b) qualsiasi decisione relativa al fatto di essere in grado o meno di ricondizionare un tipo di dispositivo monouso.
2. Il ricondizionatore dispone anche di una documentazione tecnica specifica per ciascun modello di dispositivo monouso, fabbricato dallo stesso fabbricante, quale identificato dal suo identificativo del dispositivo nel sistema di identificazione unica del dispositivo («UDI-DI»). La documentazione tecnica comprende:
a) i risultati della determinazione del ciclo e delle procedure di ricondizionamento di cui all’articolo 7;
b) le azioni da intraprendere nel caso in cui una o più fasi del ciclo di ricondizionamento non siano state eseguite.
3. La documentazione tecnica specifica per ciascun modello di dispositivo monouso fabbricato dallo stesso fabbricante, quale identificato dal suo UDI-DI, conservata dalle istituzioni sanitarie comprende altresì:
a) i risultati della valutazione dell’idoneità del dispositivo monouso al ricondizionamento di cui all’articolo 5 e i dati e le informazioni utilizzati per stabilire che la sicurezza e le prestazioni del dispositivo ricondizionato saranno equivalenti a quelle del dispositivo monouso d’origine;
b) i risultati del processo di monitoraggio di cui all’articolo 6;
c) la descrizione del sistema di tracciabilità del dispositivo monouso dal primo utilizzo fino al suo ultimo riutilizzo;
d) la descrizione del sistema di segnalazione di incidenti gravi conformemente all’articolo 23;
e) la descrizione del sistema di identificazione e di smaltimento del dispositivo monouso in caso di mancata conformità ad aspetti di funzionalità, prestazioni o sicurezza prima o durante il riutilizzo.
4. La documentazione tecnica è conservata per 10 anni dopo l’ultimo riutilizzo del dispositivo monouso.
CAPO III PROCEDURE E FASI DEL CICLO DI RICONDIZIONAMENTO
Articolo 10 Stabilimento delle procedure
1. Prima di iniziare il ricondizionamento, il ricondizionatore effettua un controllo visivo dei dispositivi monouso per individuare eventuali danni. Verifica che i pezzi mobili si muovano correttamente. Qualora il dispositivo monouso debba essere sottoposto a manutenzione o tarato per poter funzionare come specificato nelle istruzioni per l’uso, la manutenzione è effettuata conformemente alla procedura stabilita. Il ricondizionatore provvede allo smaltimento dei dispositivi monouso danneggiati o mal funzionanti.
2. Il ricondizionatore stabilisce una procedura convalidata di decontaminazione adattata alle proprietà e alle caratteristiche del dispositivo monouso e ai rischi connessi al suo utilizzo.
3. La preparazione per il ricondizionamento non compromette lo stato igienico e la funzionalità del dispositivo decontaminato. In caso di ritardo superiore a un termine stabilito nella procedura prima della pulizia e della disinfezione o sterilizzazione, il dispositivo monouso è sottoposto a un’adeguata pulizia preliminare e a immagazzinamento intermedio. I dispositivi monouso sono trasportati nei locali di ricondizionamento in appositi contenitori chiusi e identificati, secondo le condizioni stabilite in una procedura.
4. I requisiti necessari in termini di proprietà microbiologiche e chimiche dell’acqua, delle sostanze chimiche e di altri prodotti utilizzati nel ricondizionamento sono indicati nelle procedure relative a ciascun ciclo specifico.
5. Nella scelta delle procedure di pulizia, disinfezione e sterilizzazione, è data priorità a procedure automatizzate convalidate che ne garantiscano la riproducibilità. La disinfezione garantisce adeguati effetti battericidi (anche sui micobatteri), fungicidi e virucidi, e l’efficacia della disinfezione è verificata periodicamente su campioni.
6. Le soluzioni di pulizia e disinfezione e, se applicabile, l’agente sterilizzante sono rimossi con un metodo convalidato descritto in una procedura.
7. La sterilizzazione con calore umido (sterilizzazione a vapore) è utilizzata nei casi in cui è appropriata. Altri metodi convalidati possono tuttavia essere scelti in base alle proprietà e alle caratteristiche del dispositivo monouso da sottoporre a ricondizionamento.
8. Il monitoraggio dei cicli di sterilizzazione e il rilascio dei dispositivi monouso sterilizzati si basano sul raggiungimento di parametri di sterilizzazione entro i limiti di tolleranza stabiliti e convalidati descritti in una procedura. Se non è possibile misurare tutti i parametri di sterilizzazione pertinenti, tali misurazioni fisiche sono completate utilizzando idonei indicatori biologici che forniscano ulteriori garanzie che non si sono verificate variazioni non rilevate rispetto al ciclo convalidato.
9. Il sistema di confezionamento è adeguato al contenuto, convalidato secondo le norme pertinenti e il metodo di sterilizzazione utilizzato, se applicabile, convalidato per le proprietà del dispositivo monouso ricondizionato e per l’immagazzinamento e il trasporto previsti. Il confezionamento permette la sterilizzazione e garantisce la sterilità durante la durata di vita dichiarata e fino all’utilizzo, in condizioni adeguate di immagazzinamento e trasporto. Se durante il ricondizionamento è rilevato un problema relativo alla funzionalità, alle prestazioni o alla sicurezza del dispositivo monouso, il problema è affrontato e il dispositivo monouso è riparato, se possibile, o smaltito se la riparazione non è possibile. La causa del problema è indagata per verificare che il ciclo continui ad essere efficace. Se non raggiunge più l’obiettivo, il ciclo viene modificato o il ricondizionamento è interrotto per tale dispositivo monouso specifico. Se una delle fasi del ricondizionamento non soddisfa i requisiti stabiliti nelle procedure per un dato dispositivo monouso, tale dispositivo monouso non è rilasciato per il riutilizzo.
Articolo 11 Fasi del ciclo di ricondizionamento
Il ciclo di ricondizionamento comprende le seguenti fasi, se applicabili al dispositivo in questione:
a) pretrattamento nel punto di utilizzo;
b) trasporto, comprese procedure per il trasporto sicuro di materiali pericolosi;
c) preparazione precedente la pulizia;
d) pulizia;
e) disinfezione termica o chimica;
f) essiccazione;
g) ispezione, manutenzione, riparazione e test di funzionalità;
h) confezionamento;
i) etichettatura e fornitura di istruzioni per l’uso;
j) sterilizzazione;
k) immagazzinamento.
Figura 2 - Fasi del ciclo di ricondizionamento
...
segue in allegato
Certifico Srl - IT | Rev. 00 2021
©Copia Autorizzata Abbonati
Collegati
[box-note]Regolamento (UE) 2017/745
Regolamento di esecuzione (UE) 2020/1207[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Ricondizionamento Dispositivi medici monouso Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
267 kB | 57 |
Direttiva 2008/43/CE
Direttiva 2008/43/CE
Direttiva 2008/43/CE della Commissione, del 4 aprile 2008, relativa all'istituzione, a norma della direttiva 93/15/CEE del Consiglio, di un sistema di identificazione e tracciabilità degli esplosivi per uso civile
(GU L 94/8 del 5.4.2008)
_____
Testo consolidato al 14.03.2012
Modifiche:
Direttiva 2012/4/UE della Commissione, del 22 febbraio 2012 , che modifica la direttiva 2008/43/CE, relativa all’istituzione, a norma della direttiva 93/15/CEE del Consiglio, di un sistema di identificazione e tracciabilità degli esplosivi per uso civile (GU L 50 del 23.2.2012, pagg. 18–20)
...
Collegati
[box-note]Direttiva click
Direttiva 2014/28/UE
Decreto Legislativo N. 7 del 2 Gennaio 1997[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Direttiva 2008 43 CE Testo consolidato 2012.pdf |
621 kB | 0 |
RAPEX Report 09 del 05/03/2021 N. 04 A11/00013/21 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 09 del 05/03/2021 N. 04 A11/00013/21 Svezia
Approfondimento tecnico: Caricabatterie USB
Il prodotto, di marca Huawei, mod. HW-100400E00, è stato sottoposto alla procedura di rimozione dal listino dal mercato online perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60950-1:2006 “Apparecchiature per la tecnologia dell'informazione – Sicurezza | Parte 1: Requisiti generali”.
L'isolamento elettrico e le distanze di dispersione sono inadeguate. L'utente potrebbe ricevere una scossa elettrica dalle parti in tensione. Il dispositivo, inoltre, potrebbe surriscaldarsi e provocare un incendio.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 09 del 05_03_2021 N. 04 A11_00013_21 Svezia.pdf Caricabatterie USB |
346 kB | 0 |
Circolare Inail n. 10 dell'11 marzo 2021
Circolare Inail n. 10 dell'11 marzo 2021 | Controllo di serbatoi per GPL
Controllo di serbatoi per GPL interrati, ricoperti e fuori terra: procedura con tecnica basata sul metodo di emissione acustica
Con circolare n. 10 dell'11 marzo 2021 sono fornite indicazioni per le verifiche da effettuare sui serbatoi GPL di capacità maggiore di 13 m³ tramite la tecnica di controllo basata sull’EA.
L’art. 64-bis, comma 3, del d.l. 76/2020, convertito, con modificazioni, dalla l. 120/2020, estende la disciplina di verifica tramite la tecnica di controllo basata sull'emissione acustica ai recipienti a pressione fissi interrati, tumulati e fuori terra con capacità complessiva superiore a 13 m³. Contestualmente affida all’Inail la definizione della procedura operativa per l’effettuazione delle verifiche di integrità, nonché dei requisiti dei soggetti abilitati ad effettuare le verifiche.
La circolare n. 10 dell'11 marzo 2021, nel richiamare la determina del Direttore Generale n. 58 del 18 dicembre 2020 che ha approvato la “Procedura per il controllo di serbatoi per GPL interrati, tumulati (o ricoperti) e fuori terra di capacità maggiore di 13 m³ con tecnica basata sul metodo di Emissione Acustica ai fini della verifica d’integrità”, chiarisce quali sono i destinatari della disposizione, il campo di applicazione e le caratteristiche della procedura.
...
Fonte: INAIL
Collegati
[box-note]Determina del Direttore Generale n. 58 del 18 dicembre 2020
Controllo periodico decennale serbatoi interrati GPL metodo EA
Verifiche periodiche attrezzature a pressione
Depositi GPL: Quadro normativo Prevenzione Incendi
Periodicità e metodi dei controlli sui serbatoi interrati[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Testo integrale della circolare Inail n. 10 dell'11 marzo 2021.pdf |
192 kB | 11 | ||
| Allegato alla circolare Inail n. 10 11 marzo 2021.pdf |
1881 kB | 8 |
Rettifica del regolamento (UE) 2019/1781 dell'11 Marzo 2021
Rettifica del regolamento (UE) 2019/1781 dell'11 Marzo 2021
Rettifica del regolamento (UE) 2019/1781 della Commissione, del 1° ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile dei motori elettrici e dei variatori di velocità in applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio recante modifica del regolamento (CE) n. 641/2009 della Commissione per quanto riguarda le specifiche per la progettazione ecocompatibile dei circolatori senza premistoppa indipendenti e dei circolatori senza premistoppa integrati in prodotti e abroga il regolamento (CE) n. 640/2009 della Commissione
GU L 84/27 dell'11 Marzo 2021
_____
Pagina 82, articolo 12, il secondo comma è sostituito dal seguente testo:
«Esso si applica a decorrere dal 1o luglio 2021. Tuttavia, l’articolo 7, primo comma, e l’articolo 11 si applicano a decorrere dal 14 novembre 2019.»
...
Collegati
[box-note]Regolamento (UE) 2019/1781
Direttiva 2009/125/CE - ERP[/box-note]