RAPEX Report 04 del 28/01/2022 N. 04 A12/00190/22 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 04 del 28/01/2022 N. 04 A12/00190/22 Ungheria
Approfondimento tecnico: Giocattolo in plastica
Il prodotto, di marca Le Royal, mod. R18118-9, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN IEC 62115:2020 “Giocattoli elettrici - Sicurezza“.
La piccola luce e le batterie sono facilmente accessibili, un bambino potrebbe metterle in bocca con il rischio di soffocare o di causare dei danni al tratto gastrointestinale se ingeriti.
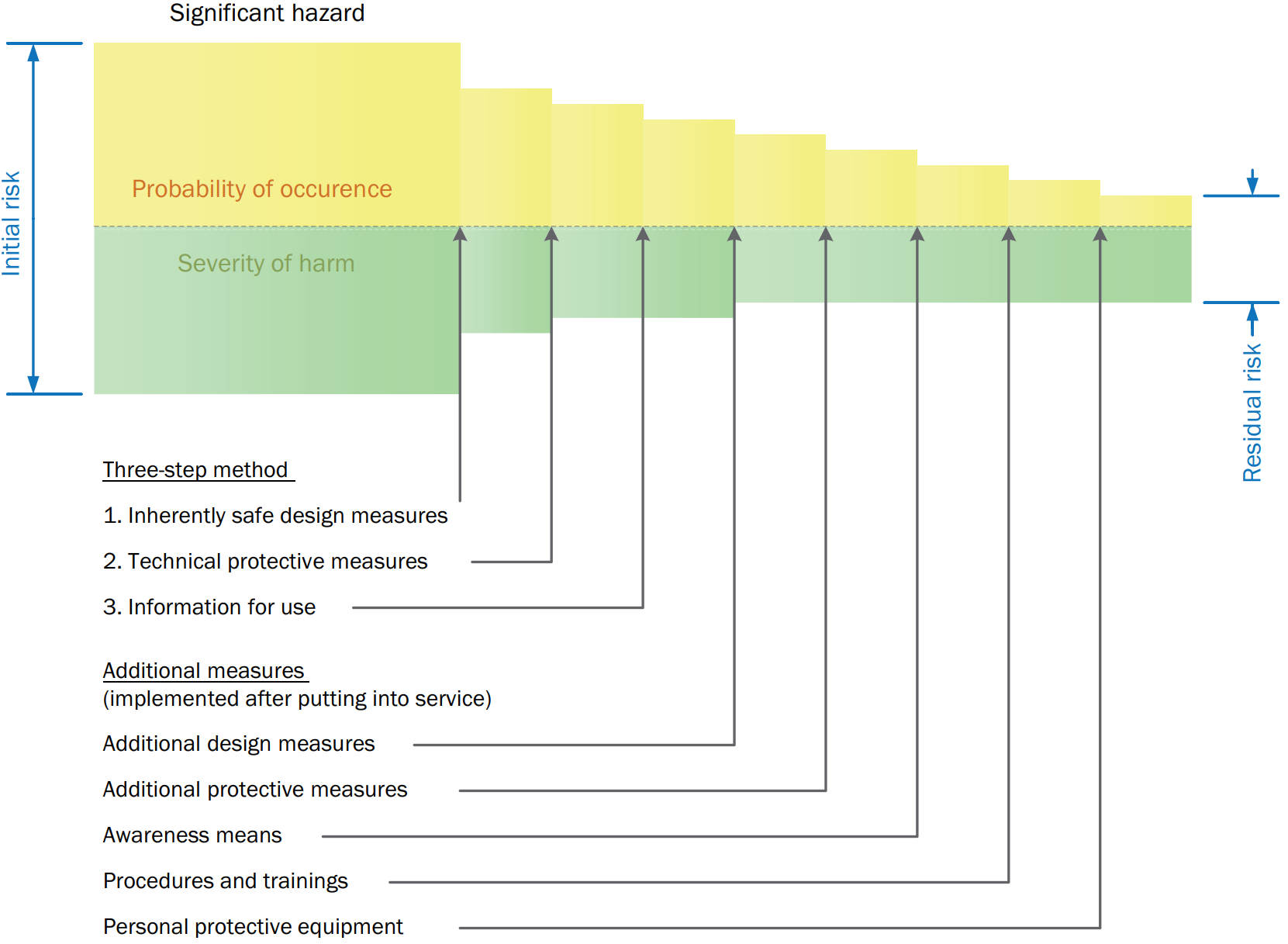
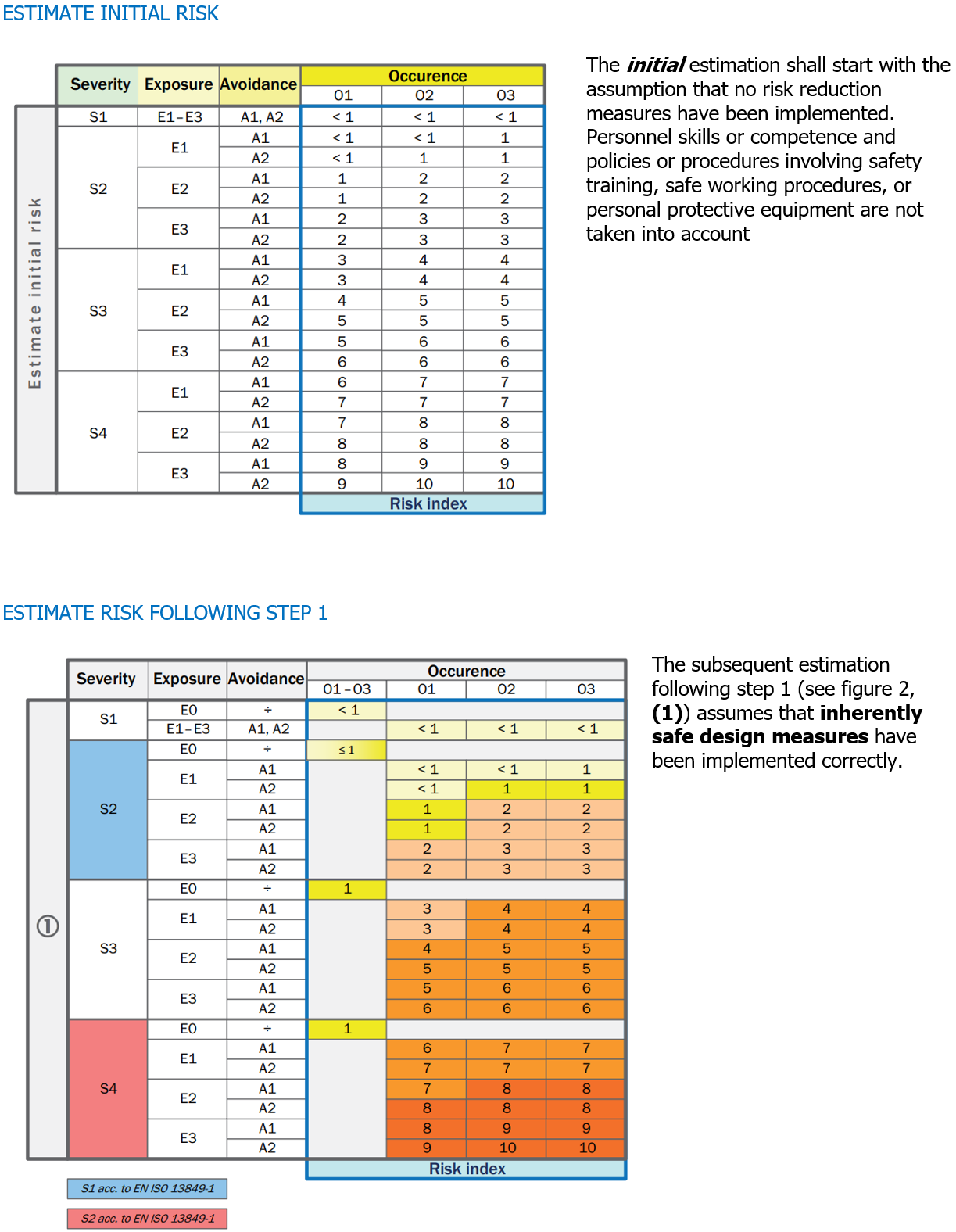
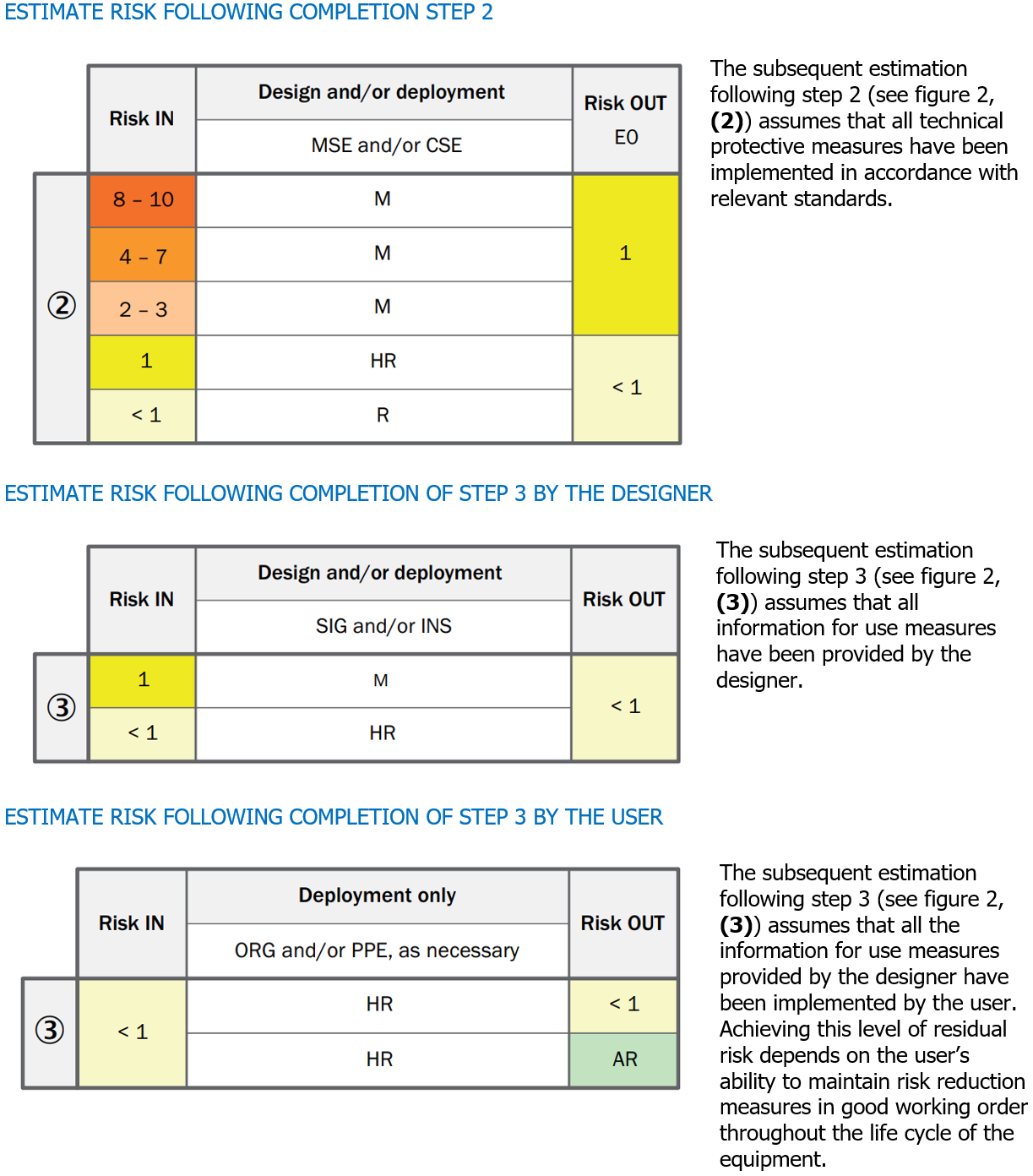
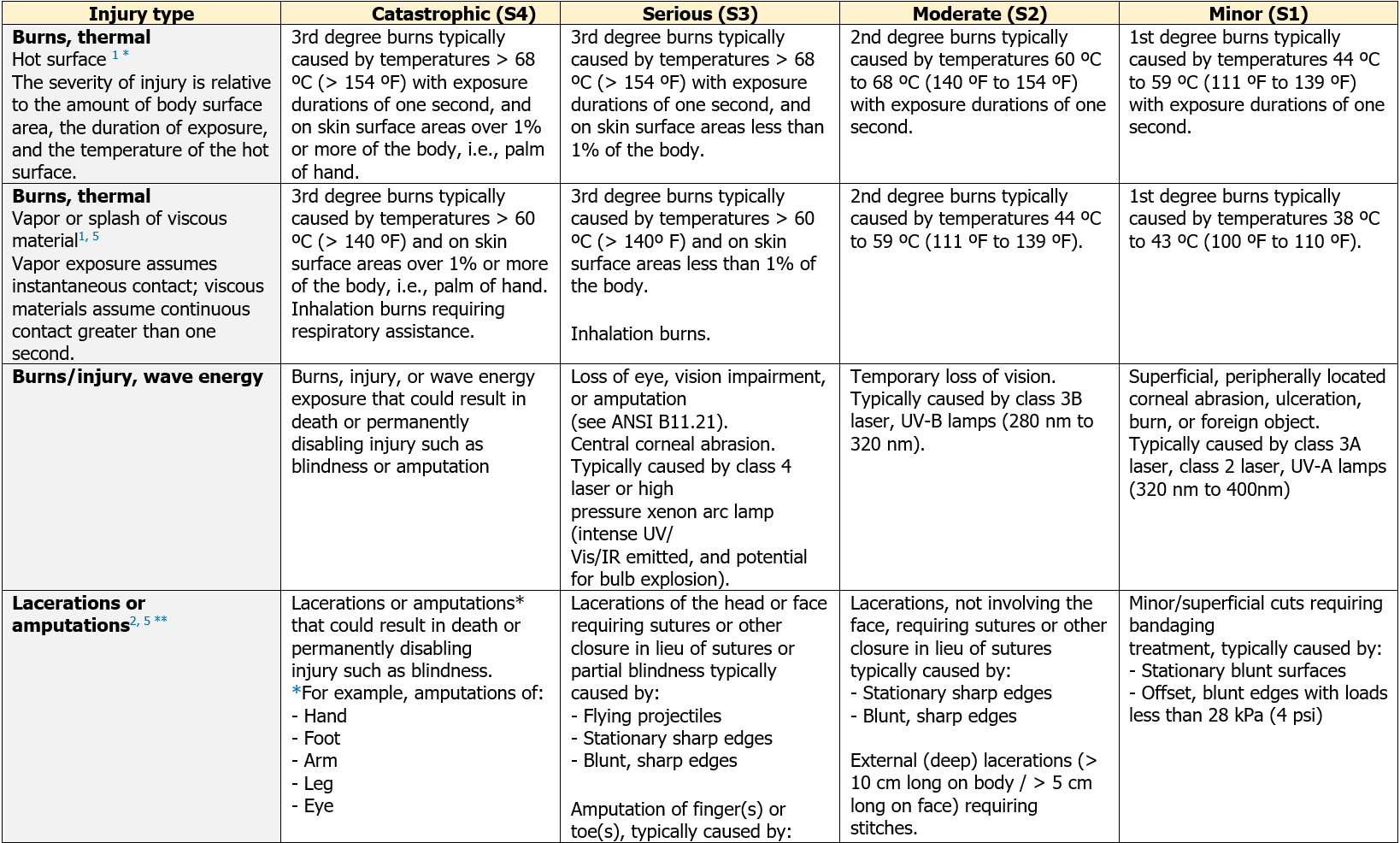
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
[…] 4. a) I giocattoli e le loro parti non devono comportare un rischio di strangolamento.
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori. […]
EN IEC 62115:2020 “Giocattoli elettrici - Sicurezza“
13. Costruzione
[…] Per ridurre il rischio di ingestione delle batterie i componenti che le contengono non devo poter essere aperti senza l’uso di uno strumento. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 04 del 28_01_2022 N. 04 A12_00190_22 Ungheria.pdf Giocattolo in plastica |
378 kB | 0 |
Programma di lavoro annuale dell’Unione per la normazione europea per il 2022
Programma di lavoro annuale dell’Unione per la normazione europea per il 2022
ID 15695 | 08.02.2022 / In allegato Com. CE Programma normazione 2022
Comunicazione della Commissione Programma di lavoro annuale dell’Unione per la normazione europea per il 2022
(GU C 66/1 dell'8.2.2022)
_______
A norma dell’articolo 8 del regolamento (UE) n. 1025/2012 sulla normazione europea, la Commissione deve adottare un «programma di lavoro annuale dell’Unione per la normazione europea».
La presente comunicazione della Commissione individua pertanto le norme europee e i prodotti della normazione europea che la Commissione intende chiedere per il 2022 e definisce gli obiettivi e le politiche specifici per tali norme e prodotti (cfr. allegato).
Tale azione in materia di normazione europea è integrata nelle politiche dell’Unione. Sostiene l’attuazione di politiche quali:
[box-info]- la duplice transizione verde e digitale;
- il mercato unico;
- il mercato unico digitale;
- il mercato unico dei servizi;
- il programma spaziale;
- i mercati interni dei gas rinnovabili e naturali e dell’idrogeno;
- l’efficienza energetica e il clima; e
- il commercio internazionale.[/box-info]
Le norme da un lato sostengono queste politiche affinché i prodotti e i servizi dell’UE siano competitivi in tutto il mondo e riflettano le considerazioni più avanzate in fatto di sicurezza, salute e ambiente e, dall’altro, favoriscono il conseguimento degli obiettivi di sviluppo sostenibile.
La Commissione adotta la presente comunicazione insieme a una comunicazione sulla strategia di normazione.
Quest’ultima individua le priorità nell’ambito della normazione («questioni urgenti»). In questi settori infatti si impone la necessità urgente di norme e di prodotti della normazione per conseguire gli obiettivi strategici dell’UE per un mercato unico verde, digitale e resiliente.
Il programma di lavoro dell’UE di quest’anno si sofferma sulle priorità in materia di normazione, tra cui:
[box-info]- riesame delle norme esistenti per individuare le esigenze di revisione o elaborazione di nuove norme per conseguire gli obiettivi del Green Deal europeo e del decennio digitale europeo e sostenere la resilienza del mercato unico dell’UE
- produzione di vaccini e medicinali contro la COVID-19;
- materie prime critiche per batterie e rifiuti di batterie;
- resilienza delle infrastrutture ai cambiamenti climatici e cemento a basse emissioni di carbonio;
- tecnologie e componenti per l’idrogeno;
- trasporto e stoccaggio dell’idrogeno;
- norme per la certificazione dei chip in termini di sicurezza, autenticità e affidabilità;
- contratti intelligenti per spazi di dati.[/box-info]
Oltre alle questioni urgenti definite dalla comunicazione sulla strategia di normazione, l’allegato della presente comunicazione elenca le azioni per l’elaborazione e la revisione di norme europee e prodotti della normazione europea che sono necessarie e idonee a sostenere la legislazione e le politiche dell’Unione.
A livello internazionale la Commissione proseguirà la cooperazione in materia di normazione con gli Stati Uniti, nell’ambito del gruppo di lavoro 1 – Norme tecnologiche del Consiglio UE-USA per il commercio e la tecnologia, e collaborerà sulle norme tecniche in seno al G7. La Commissione sostiene inoltre il lavoro della piattaforma multilaterale europea delle parti interessate sulla normalizzazione delle TIC nell’individuare le esigenze di normazione mediante il programma continuativo per la normazione delle TIC.
Infine la Commissione si impegnerà affinché, in ogni accordo di libero scambio che negozia, la normazione sia una parte essenziale del capitolo relativo agli ostacoli tecnici agli scambi.
[box-download]In calce all'articolo Documento "Programma di lavoro annuale dell’Unione per la normazione europea per il 2022"[/box-download]
...
ALLEGATO
|
Questioni urgenti in materia di normazione definite dalla comunicazione sulla strategia di normazione |
||||
|
Titolo |
Riferimento |
Norme europee/prodotti della normazione europea |
Politiche e obiettivi specifici per le norme europee/i prodotti della normazione europea |
|
|
1 |
Riesame delle norme esistenti per individuare le esigenze di revisione o elaborazione di nuove norme per conseguire gli obiettivi del Green Deal europeo e del decennio digitale europeo e sostenere la resilienza del mercato unico dell’UE. |
Green Deal europeo (COM(2019) 640 final). Bussola per il digitale 2030: il modello europeo per il decennio digitale (COM(2021) 118 final). Aggiornamento della nuova strategia industriale 2020: costruire un mercato unico più forte per la ripresa dell’Europa (COM(2021) 350 final). |
Definizione di una metodologia, valutazione preliminare e selezione di un campione di norme esistenti da riesaminare alla luce degli obiettivi fissati nell’ambito del Green Deal europeo, del decennio digitale europeo e di un mercato unico resiliente. |
Contribuire agli obiettivi della Commissione europea, ad esempio azzerare le emissioni nette di gas a effetto serra entro il 2050 o consentire al 75 % delle imprese dell’UE di utilizzare strumenti digitali, come il cloud, l’intelligenza artificiale o i big data. |
|
2 |
Produzione di vaccini e medicinali contro la COVID-19 |
Comunicazione della Commissione al Parlamento europeo, al Consiglio europeo e al Consiglio, Fare fronte comune per sconfiggere la COVID-19 (COM(2021) 35 final). |
Elaborazione di norme europee per definire una serie standard di dati da includere nel modulo contenente i risultati dei test per la COVID-19. Valutare la fattibilità dell’elaborazione di norme per gli articoli monouso necessari per la produzione di vaccini e farmaci al fine di migliorare l’interoperabilità dei principali componenti produttivi e ridurre al minimo il rischio di interruzioni della produzione qualora vi sia penuria di tali materiali. |
Aumentare le capacità di produzione e fornitura di vaccini e farmaci contro la COVID-19 e la quantità di informazioni al riguardo. |
|
3 |
Materie prime critiche per batterie e rifiuti di batterie |
Proposta di regolamento del Parlamento europeo e del Consiglio relativo alle batterie e ai rifiuti di batterie, che abroga la direttiva 2006/66/CE e modifica il regolamento (UE) 2019/1020 (COM(2020) 798 final e 2020/0353(COD)). |
Revisione delle norme europee esistenti ed elaborazione di nuove norme europee per i rifiuti di apparecchiature elettriche ed elettroniche e i rifiuti di batterie. La revisione riguarderà: riciclaggio di alta qualità ed efficiente sotto il profilo dei materiali e preparazione al riutilizzo dei principali flussi di rifiuti (rifiuti di apparecchiature elettriche ed elettroniche, compresi i pannelli fotovoltaici), rifiuti di batterie, veicoli fuori uso e scarti delle turbine eoliche. Requisiti di qualità a livello dell’UE per le materie prime riciclate. |
Le norme contribuiranno a valorizzare, attraverso il riciclaggio, le materie prime presenti nei rifiuti, come nel caso delle batterie, e a ridurre il fabbisogno di nuove materie prime in applicazioni critiche: tale aspetto è particolarmente importante per poter rafforzare la resilienza dell’UE mitigando il rischio connesso all’approvvigionamento di materie prime. |
|
4 |
Resilienza delle infrastrutture ai cambiamenti climatici e cemento a basse emissioni di carbonio |
Plasmare un’Europa resiliente ai cambiamenti climatici – La nuova strategia dell’UE di adattamento ai cambiamenti climatici – punto 2.3.2 (COM(2021) 82 final), e Un’ondata di ristrutturazioni per l’Europa: inverdire gli edifici, creare posti di lavoro e migliorare la vita (COM(2020) 662 final). |
Revisione di una gamma più ampia di norme per i beni (compresi quelli non connessi alle infrastrutture) vulnerabili agli impatti climatici, secondo le conoscenze più avanzate, al fine di migliorarne la resilienza ai cambiamenti climatici. Elaborazione di norme a sostegno di soluzioni tecniche per l’adattamento ai cambiamenti climatici, al fine di facilitarne e accelerarne l’adozione in tutta l’UE. |
Migliorare la resilienza ai cambiamenti climatici delle infrastrutture esistenti e dei nuovi grandi progetti infrastrutturali. Poiché il cemento è una componente essenziale del settore edile, sarà effettuata una valutazione del suo potenziale di diventare un prodotto da costruzione a basse emissioni di carbonio, nel pieno rispetto del principio della neutralità tecnologica. |
|
5 |
Tecnologie e componenti per l’idrogeno |
Proposta di regolamento del Parlamento europeo e del Consiglio relativo ai mercati interni dei gas rinnovabili e naturali e dell’idrogeno (rifusione) (COM(2021) 804 final). |
Elaborazione di norme europee in materia di qualità, tecnologia e sicurezza a sostegno dello sviluppo di un mercato unico dell’idrogeno. |
Aumentare la disponibilità di punti di ricarica e migliorarne la manutenzione. |
|
6 |
Trasporto e stoccaggio dell’idrogeno |
Proposta di direttiva che modifica la direttiva (UE) 2018/2001 per quanto riguarda la promozione dell’energia da fonti rinnovabili (COM(2021) 557 final). Proposta di regolamento sugli orientamenti per le infrastrutture energetiche transeuropee e che abroga il regolamento (UE) n. 347/2013 (COM(2020) 824 final). Direttiva (UE) 2019/692 che modifica la direttiva 2009/73/CE relativa a norme comuni per il mercato interno del gas naturale. Regolamento (UE) 2018/1999 sulla governance dell’Unione dell’energia e dell’azione per il clima. |
Revisione delle norme europee esistenti per la qualità e la sicurezza del gas e/o elaborazione di nuove norme europee in materia, pertinenti per l’iniezione nella rete del gas e altri usi finali, ma anche per la qualità dei combustibili a base di idrogeno. |
Consentire e promuovere la diffusione dei metodi di trasporto e stoccaggio dell’idrogeno, garantendo nel contempo la sicurezza e l’efficienza operativa delle reti del gas ed evitando ostacoli accidentali. |
|
7 |
Norme per la certificazione dei chip in termini di sicurezza, autenticità, affidabilità |
Decennio digitale europeo: obiettivi digitali per il 2030. Bussola per il digitale 2030: il modello europeo per il decennio digitale. |
Elaborazione di norme a sostegno della certificazione dei chip per garantirne la sicurezza, l’autenticità e l’affidabilità. |
Garantire l’affidabilità e la conformità alle prescrizioni in materia di cibersicurezza dei futuri dispositivi intelligenti, delle piattaforme di connettività e dei sistemi, che dovranno basarsi sull’elettronica avanzata e dipenderanno in larga misura dalle caratteristiche della tecnologia sottostante. Le norme sosterranno la certificazione dell’affidabilità e della sicurezza di questi chip e si applicheranno a tutta la relativa catena del valore fino all’integrazione nei prodotti finali. |
|
8 |
Contratti intelligenti per spazi di dati |
Legge sui dati (compresa la revisione della direttiva 96/9/CE relativa alla tutela giuridica delle banche di dati). Regolamento che istituisce un quadro per l’uso dei dati nell’UE. Cfr. le iniziative pubblicate all’indirizzo seguente: https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13045-Data-Act-&-amended-rules-on-the-legal-protection-of-databases_it. |
Elaborazione di norme che soddisfino determinati requisiti essenziali per i contratti intelligenti, come stabilito nell’imminente legge sui dati. Un contratto intelligente che soddisfa la norma deve essere considerato conforme ai requisiti essenziali. |
Garantire che i contratti intelligenti utilizzati per la condivisione dei dati siano affidabili e interoperabili, in modo da poter essere utilizzati a sostegno dello scambio e della messa in comune di dati. In Europa i dati non sono concentrati su grandi piattaforme tecnologiche, ma continuano a essere distribuiti in molti luoghi. Nell’ambito della sua strategia per i dati, l’UE aiuta le imprese a mettere in comune i dati, ad esempio per l’allenamento di algoritmi e applicazioni di apprendimento automatico nei settori sanitario, dei trasporti e dell’energia. |
|
Azioni volte all’elaborazione e alla revisione di norme europee o prodotti della normazione europea necessari e adeguati a sostenere la legislazione e le politiche dell’Unione |
||||
|
Titolo |
Riferimento |
Norme europee/prodotti della normazione europea |
Politiche e obiettivi specifici per le norme europee/i prodotti della normazione europea |
|
|
9 |
Servizi manifatturieri avanzati |
Direttiva 2006/123/CE del Parlamento europeo e del Consiglio relativa ai servizi nel mercato interno per la pertinente legislazione settoriale e Una strategia europea per i dati (COM(2020) 66). |
Elaborazione di norme europee a sostegno della prestazione di servizi e dati relativi ai robot, alla gestione della catena di approvvigionamento industriale e alla manutenzione predittiva delle macchine di rete. |
Migliorare la prestazione di servizi transfrontalieri nel mercato unico e promuovere la trasparenza delle transazioni nella catena di approvvigionamento. |
|
10 |
Servizi di costruzione |
Direttiva 2006/123/CE del Parlamento europeo e del Consiglio relativa ai servizi nel mercato interno. |
Elaborazione di norme europee a sostegno della prestazione di servizi transfrontalieri nei settori dell’edilizia, per esempio i servizi architettonici e ingegneristici e i servizi connessi all’efficienza energetica degli edifici. |
Migliorare la prestazione di servizi transfrontalieri nel mercato unico. |
|
11 |
Servizi postali |
Direttiva 97/67/CE concernente regole comuni per lo sviluppo del mercato interno dei servizi postali comunitari e il miglioramento della qualità del servizio; direttiva 2002/39/CE che modifica la direttiva 97/67/CE per quanto riguarda l’ulteriore apertura alla concorrenza dei servizi postali della Comunità; direttiva 2008/6/CE che modifica la direttiva 97/67/CE per quanto riguarda il pieno completamento del mercato interno dei servizi postali comunitari e regolamento (UE) 2018/644 relativo ai servizi di consegna transfrontaliera dei pacchi. |
Revisione delle norme europee/dei prodotti della normazione europea esistenti e/o elaborazione di nuove norme europee/prodotti della normazione europea in ambiti quali la qualità del servizio e la digitalizzazione. |
Migliorare la qualità del servizio e promuovere l’interoperabilità tra le reti nazionali, nonché un servizio universale efficiente all’interno del mercato unico. |
|
12 |
Requisiti di accessibilità dei prodotti e dei servizi, comprese le TIC |
Direttiva (UE) 2019/882 del Parlamento europeo e del Consiglio, del 17 aprile 2019, sui requisiti di accessibilità dei prodotti e dei servizi e Direttiva (UE) 2016/2102 del Parlamento europeo e del Consiglio relativa all’accessibilità dei siti web e delle applicazioni mobili degli enti pubblici. |
Elaborazione di norme per i requisiti di accessibilità dei prodotti di cui all’allegato I della direttiva (UE) 2019/882, quali: - requisiti relativi alla fornitura di informazioni; - progettazione interfaccia utente e funzionalità; servizi di assistenza; imballaggio del prodotto; -istruzioni per l’installazione, la manutenzione, lo stoccaggio e lo smaltimento del prodotto; - garanzia dell’accessibilità dei prodotti utilizzati per la fornitura del servizio; - agevolazione dell’uso di tali servizi da parte delle persone con disabilità: fornitura di informazioni sul funzionamento del servizio, prestazione di servizi ottimali per le persone con disabilità e definizione dei criteri funzionali di prestazione a tal fine. Elaborazione di norme armonizzate per quanto riguarda i servizi che rientrano nell’ambito di applicazione della direttiva e i luoghi in cui sono prestati i servizi. |
Agevolare l’uso, da parte delle persone con disabilità, di prodotti e servizi TIC, quali terminali self-service, applicazioni, siti web/piattaforme, servizi online e comunicazione online con i servizi di emergenza e altri servizi che rientrano nell’ambito di applicazione della direttiva. |
|
13 |
Gestione del traffico spaziale e diffusione sul mercato di dati spaziali |
Regolamento (UE) 2021/696 che istituisce il programma spaziale dell’Unione e l’Agenzia dell’Unione europea per il programma spaziale. |
Elaborazione di norme europee per la gestione del traffico spaziale. Elaborazione di norme europee a sostegno della diffusione tra gli utenti e sul mercato dei dati e dei servizi spaziali forniti dal programma spaziale dell’UE (Galileo, EGNOS, Copernicus, SSA, GOVSATCOM). |
Obiettivi: |
|
14 |
Qualità dell’aria ambiente - prestazioni dei sistemi basati su sensori che misurano l’inquinamento atmosferico |
Articoli 6 e 7 e allegato I della direttiva 2008/50/CE relativa alla qualità dell’aria ambiente. |
Elaborazione di una o più norme approvate riguardanti le prove per la valutazione delle prestazioni dei sistemi basati su sensori che misurano l’inquinamento atmosferico. Le norme valuteranno se i sistemi basati su sensori siano conformi agli obiettivi di qualità dei dati di cui alla direttiva 2008/50/CE. |
Migliorare le valutazioni della qualità dell’aria ambiente verificando in che misura i sistemi basati su sensori siano conformi agli obiettivi di qualità dei dati di cui alla direttiva 2008/50/CE. Le norme consentiranno inoltre un uso più esteso di tale metodo di monitoraggio e quindi una migliore valutazione della qualità dell’aria. |
|
15 |
Qualità dell’aria ambiente - valutazioni basate sulla modellizzazione |
Articoli 6 e 7 e allegato I della direttiva 2008/50/CE. |
Elaborazione di norme che garantiscano che le valutazioni della qualità dell’aria basate sulla modellizzazione siano obiettive, affidabili e comparabili e di qualità sufficiente per fornire informazioni affidabili sulle concentrazioni di inquinanti atmosferici nell’aria ambiente. |
Garantire che le informazioni raccolte sull’inquinamento atmosferico siano sufficientemente rappresentative e comparabili in tutta l’UE. |
|
16 |
Qualità dell’aria ambiente - metodi di misurazione per il monitoraggio degli idrocarburi policiclici aromatici nell’ambiente |
Articolo 4, paragrafi 1, 8 e 13, e allegato V della direttiva 2004/107/CE concernente l’arsenico, il cadmio, il mercurio, il nickel e gli idrocarburi policiclici aromatici nell’aria ambiente. |
Elaborazione di norme per i metodi di riferimento per la misurazione delle concentrazioni nell’aria ambiente di idrocarburi policiclici aromatici. |
Garantire che le analisi degli idrocarburi policiclici aromatici nell’aria ambiente siano sufficientemente precise, affidabili e confrontabili in tutta l’UE. |
|
17 |
Emissioni industriali |
Direttiva 2010/75/UE relativa alle emissioni industriali (prevenzione e riduzione integrate dell’inquinamento). |
Elaborazione di norme europee per garantire il campionamento e l’analisi delle sostanze inquinanti pertinenti e le misurazioni dei parametri di processo, nonché l’assicurazione di qualità dei sistemi automatici di misurazione e i metodi di misurazione di riferimento per calibrare tali sistemi. |
Ridurre e, per quanto possibile, eliminare l’inquinamento dovuto alle attività industriali. |
|
18 |
Rifiuti di plastica raccolti in modo differenziato e plastica riciclata |
L’azione di cui all’allegato I della strategia europea per la plastica nell’economia circolare (COM(2018) 28 final). Azioni volte a promuovere l’uso del materiale riciclato:- sviluppo, in cooperazione con il Comitato europeo di normalizzazione, di standard di qualità per i rifiuti di plastica raccolti in modo differenziato e per la plastica riciclata. |
Elaborazione di nuove norme europee e di nuovi prodotti della normazione europea e revisione delle norme europee esistenti per affrontare le questioni procedurali e infrastrutturali relative al riciclaggio della plastica, al fine di sostenere la qualità della catena del valore del riciclaggio della plastica. Tali norme dovrebbero stabilire requisiti in materia di riciclabilità dei prodotti di plastica, qualità dei rifiuti di plastica raccolti in modo differenziato e qualità della plastica riciclata, tenendo conto della loro applicazione prevista nei prodotti dopo il riciclaggio. |
Offrire plastica riciclata che risponda all’esigenza dei marchi e dei fabbricanti di prodotti di disporre di volumi elevati di materiale affidabile con specifiche di qualità costanti. |
|
19 |
Materiali a contatto con l’acqua potabile |
Direttiva (UE) 2020/2184 del Parlamento europeo e del Consiglio, del 16 dicembre 2020, concernente la qualità delle acque destinate al consumo umano (rifusione). |
Elaborazione di nuove norme europee per quanto riguarda i metodi di analisi per determinare le sostanze che migrano dai materiali e i metodi per testare i materiali finali a contatto con l’acqua potabile. |
Tutelare la qualità dell’acqua potabile e la salute pubblica. I materiali che entrano in contatto con l’acqua potabile possono incidere sulla qualità di quest’ultima (ad esempio mediante la lisciviazione delle sostanze). Occorre elaborare metodi di analisi e di prova per garantire la sicurezza dei materiali finali che entrano in contatto con l’acqua potabile. |
|
20 |
Trattamento delle acque reflue |
Direttiva del Consiglio concernente il trattamento delle acque reflue urbane (91/271/CEE) e regolamento (UE) n. 305/2011 che fissa condizioni armonizzate per la commercializzazione dei prodotti da costruzione come modificato dal regolamento delegato (UE) n. 568/2014 della Commissione, dal regolamento delegato (UE) n. 574/2014 della Commissione e dal regolamento (UE) 2019/1020. |
Revisione della norma esistente EN 12566 - «Piccoli sistemi di trattamento delle acque reflue fino a 50 PT» in sette parti. |
Migliorare la protezione dell’ambiente e ridurre i rischi per la salute. |
|
21 |
Refrigeranti naturali |
Regolamento (UE) n. 517/2014 del Parlamento europeo e del Consiglio, del 16 aprile 2014, sui gas fluorurati a effetto serra e che abroga il regolamento (CE) n. 842/2006. |
Elaborazione di una nuova norma relativa ai requisiti e al processo di analisi dei rischi per gli impianti di refrigerazione funzionanti con refrigeranti infiammabili utilizzati nel trasporto su strada di merci termosensibili. Revisione delle norme EN 378-1, EN 378-2 e EN 378-3 e creazione di una parte 5 completamente nuova relativa alla classificazione di sicurezza e alle informazioni sui refrigeranti. |
Garantire una diffusione più agevole e più ampia dei refrigeranti naturali nel settore della refrigerazione e del condizionamento d’aria, che ridurrebbe l’impatto ambientale di tali apparecchiature. In questo modo si potrebbe favorire indirettamente la competitività delle imprese dell’UE che operano in questo settore. |
|
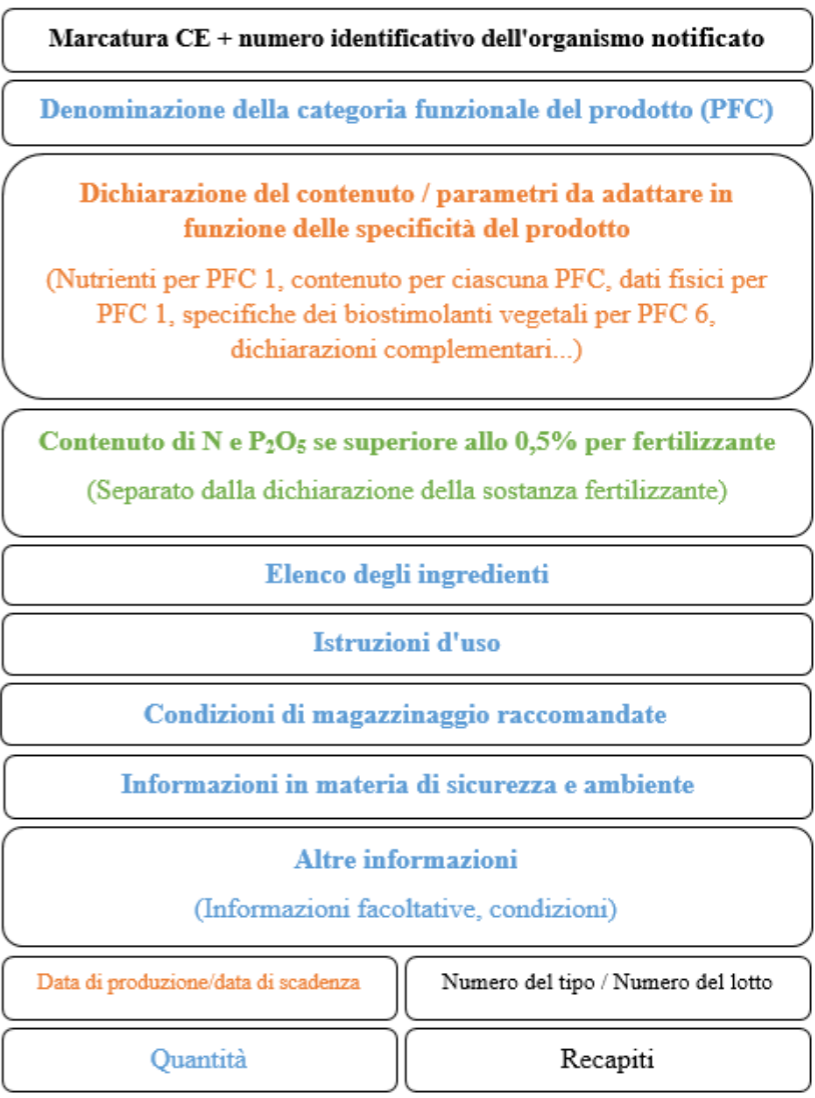
22 |
Prodotti fertilizzanti |
Regolamento (UE) 2019/1009 che stabilisce norme relative alla messa a disposizione sul mercato di prodotti fertilizzanti dell’UE e decisione di esecuzione C(2020) 612 della Commissione relativa a una richiesta di normazione al Comitato europeo di normalizzazione per quanto riguarda i prodotti fertilizzanti dell’UE a sostegno del regolamento (UE) 2019/1009. |
Elaborazione di nuove norme europee, aggiornamento dei prodotti della normazione esistenti e adeguamento del programma di lavoro della Commissione che attua la decisione C(2020) 612 al fine di emanare norme tempestive e più avanzate. |
Mettere a disposizione i fertilizzanti sul mercato unico e definire condizioni uniformi per la messa a disposizione di fertilizzanti ottenuti da materiali riciclati o organici sull’intero mercato unico. |
|
23 |
Sicurezza alimentare - alimentazione animale |
Regolamento (UE) 2017/625 relativo ai controlli ufficiali e alle altre attività ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi, delle norme sulla salute e sul benessere degli animali, sulla sanità delle piante nonché sui prodotti fitosanitari. |
Elaborazione di nuove norme europee in materia di metodi analitici nel settore dell’alimentazione animale per quanto riguarda: - additivi vietati; - contaminanti (metalli, tossine vegetali, micotossine); - additivi autorizzati; - radioattività; - materiali da imballaggio. |
Definire metodi di analisi standardizzati è fondamentale per garantire: |
|
24 |
Sicurezza alimentare - contaminanti negli alimenti |
Regolamento (UE) 2017/625 relativo ai controlli ufficiali e alle altre attività ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi, delle norme sulla salute e sul benessere degli animali, sulla sanità delle piante nonché sui prodotti fitosanitari. |
Elaborazione di nuove norme europee relative ai metodi analitici nell’ambito della legislazione in materia di sicurezza alimentare per quanto riguarda i contaminanti che si sviluppano negli alimenti durante la trasformazione (quali acrilammide, perclorato, furani, 3-monocloropropano diolo e glicidil esteri). |
Definire metodi di analisi standardizzati è fondamentale per garantire: |
|
25 |
Sicurezza alimentare - metalli negli alimenti |
Regolamento (UE) 2017/625 relativo ai controlli ufficiali e alle altre attività ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi, delle norme sulla salute e sul benessere degli animali, sulla sanità delle piante nonché sui prodotti fitosanitari. |
Elaborazione di nuove norme europee relative ai metodi analitici nell’ambito della legislazione in materia di sicurezza alimentare per quanto riguarda i metalli (ad esempio nickel, cromo VI) negli alimenti. |
Definire metodi di analisi standardizzati è fondamentale per garantire: i) un’applicazione e un controllo uniformi della legislazione europea in tutti gli Stati membri dell’UE e ii) un livello elevato di sicurezza alimentare. |
|
26 |
Sicurezza alimentare - micotossine e tossine vegetali negli alimenti |
Regolamento (UE) 2017/625 relativo ai controlli ufficiali e alle altre attività ufficiali effettuati per garantire l’applicazione della legislazione sugli alimenti e sui mangimi, delle norme sulla salute e sul benessere degli animali, sulla sanità delle piante nonché sui prodotti fitosanitari. |
Elaborazione di nuove norme europee relative ai metodi analitici nell’ambito della legislazione in materia di sicurezza alimentare per quanto riguarda le micotossine e le tossine vegetali presenti negli alimenti. |
Definire metodi di analisi standardizzati è fondamentale per garantire: i) un’applicazione e un controllo uniformi della legislazione europea in tutti gli Stati membri dell’UE e ii) un livello elevato di sicurezza alimentare. |
|
27 |
Protezione delle navi adibite al trasporto alla rinfusa di gas liquefatti e delle navi alimentate a gas |
Direttiva 2014/90/UE sull’equipaggiamento marittimo. |
Elaborazione di una nuova norma europea per la prova della polvere chimica secca e dei relativi impianti di estinzione incendi per la protezione delle navi adibite al trasporto alla rinfusa di gas liquefatti e delle navi alimentate a gas. |
Migliorare la sicurezza marittima. In seno all’Organizzazione marittima internazionale è in corso la revisione delle linee guida per l’approvazione di impianti fissi di estinzione incendi a polvere chimica secca per la protezione delle navi adibite al trasporto alla rinfusa di gas liquefatti. Tuttavia finora non sono state approvate norme riguardanti le prove relative ai jet fire e/o le prove antincendio delle passerelle portacavi. L’elaborazione di tale norma, in stretta collaborazione con l’ISO, dovrebbe migliorare la sicurezza della navigazione in mare non solo per le navi cisterna, ma anche per le navi passeggeri alimentate a gas. |
|
28 |
Dati relativi al clima |
Comunicazione della Commissione al Parlamento europeo, al Consiglio, al Comitato economico e sociale europeo e al Comitato delle regioni, «Plasmare un’Europa resiliente ai cambiamenti climatici - La nuova strategia dell’UE di adattamento ai cambiamenti climatici»(COM(2021)82 final) e Una strategia europea per i dati (COM(2020) 66). |
Elaborazione di norme che garantiscano la registrazione, la raccolta e la condivisione dei dati provenienti dal settore pubblico e privato in modo esaustivo e uniforme. |
Migliorare l’accuratezza della valutazione del rischio climatico fornendo dati che quantifichino le perdite in caso di catastrofi. |
|
29 |
Analisi del ciclo di vita dinamico per stimare i processi di assorbimento della CO2 nei prodotti da costruzione |
Strategia dell’UE per le foreste, punto 2.1. (COM(2021) 572 final) e Cicli del carbonio sostenibili, punto 3.1. (COM(2021) 800 final). |
Elaborazione di un quadro armonizzato per l’analisi del ciclo di vita dinamico che tenga conto con maggiore precisione dei processi di assorbimento della CO2 associati allo stoccaggio della CO2 nei prodotti da costruzione, |
L’obiettivo principale è tenere conto in maniera più adeguata dei progressi compiuti nell’analisi del ciclo di vita dinamico, al fine di riconoscere lo stoccaggio della CO2 nelle norme per i prodotti da costruzione, soprattutto quando si utilizzano fattori di caratterizzazione tempo-dipendenti applicati a un inventario del ciclo di vita dinamico. |
|
30 |
Progettazione ecocompatibile ed etichettatura energetica dei computer |
Regolamento (UE) n. 617/2013 della Commissione, del 26 giugno 2013, recante misure di esecuzione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile di computer e server informatici. |
Revisione delle norme esistenti ed elaborazione di norme nuove per computer e server mediante metodi di misurazione affidabili, accurati e riproducibili che tengano conto dei metodi più avanzati. |
Ridurre il consumo di energia dei computer e dei server informatici. |
|
31 |
Progettazione ecocompatibile ed etichettatura energetica degli apparecchi di cottura |
Regolamento (UE) n. 66/2014 della Commissione, del 14 gennaio 2014, recante misure di esecuzione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile di forni, piastre di cottura e cappe da cucina per uso domestico. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli apparecchi di cottura. |
Ridurre il consumo energetico degli apparecchi di cottura. |
|
32 |
Progettazione ecocompatibile ed etichettatura energetica dei display elettronici |
Regolamento (UE) 2019/2021 della Commissione, del 1°ottobre 2019, che stabilisce le specifiche per la progettazione ecocompatibile dei display elettronici in applicazione della direttiva 2009/125/CE e regolamento delegato (UE) 2019/2013 della Commissione, dell’11 marzo 2019, che integra il regolamento (UE) 2017/1369 del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica dei display elettronici. |
Revisione delle norme esistenti ed elaborazione di norme nuove per i display elettronici che riguardino la funzione di codifica a gamma dinamica ampia (High Dynamic Range, HDR) e i livelli di risoluzione superiori a 4K (o HD), stabilendo un metodo di prova specifico per i comportamenti dei sistemi di controllo automatico della luminosità (ABC) e adeguando i metodi di verifica del contenuto di additivi plastici. |
Ridurre il consumo energetico dei display elettronici (televisori, monitor) riguardo ai livelli di HDR e di risoluzione superiori a 4K (o HD), stabilendo un metodo di prova specifico per i sistemi di controllo automatico della luminosità (ABC) e adeguando i metodi di verifica del contenuto di additivi plastici. |
|
33 |
Progettazione ecocompatibile ed etichettatura energetica delle sorgenti luminose |
Regolamento (UE) 2019/2020 della Commissione, del 1° ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile delle sorgenti luminose e delle unità di alimentazione separate a norma della direttiva 2009/125/CE e regolamento delegato (UE) 2019/2015 della Commissione, dell’11 marzo 2019, che integra il regolamento (UE) 2017/1369 del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica delle sorgenti luminose. |
Revisione delle norme esistenti ed elaborazione di norme nuove per le procedure e i metodi di misurazione dei parametri richiesti per quanto riguarda: - lampade fluorescenti e lampade a scarica ad alta intensità; - alimentatori in grado di far funzionare tali lampade; - apparecchi di illuminazione in grado di far funzionare tali lampade; - apparecchi per l’illuminazione degli uffici; apparecchi per l’illuminazione stradale. |
Ridurre il consumo energetico delle sorgenti luminose per arrivare a un risparmio energetico annuo finale stimato a 41,9 TWh nel 2030. |
|
34 |
Progettazione ecocompatibile ed etichettatura energetica degli apparecchi per il riscaldamento d’ambiente locale |
Regolamento (UE) 2015/1188 della Commissione, del 28 aprile 2015, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile degli apparecchi per il riscaldamento d’ambiente locale e regolamento delegato (UE) 2015/1186 della Commissione, del 24 aprile 2015, che integra la direttiva 2010/30/UE del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica degli apparecchi per il riscaldamento d’ambiente locale. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli apparecchi per il riscaldamento d’ambiente locale. |
Ridurre il consumo di energia e limitare ulteriormente l’impatto ambientale degli apparecchi per il riscaldamento d’ambiente locale. |
|
35 |
Progettazione ecocompatibile ed etichettatura energetica degli apparecchi di refrigerazione |
Regolamento (UE) 2019/2019 della Commissione, del 1° ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile degli apparecchi di refrigerazione a norma della direttiva 2009/125/CE del Parlamento europeo e del Consiglio e che abroga il regolamento (CE) n. 643/2009 della Commissione. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli apparecchi di refrigerazione a sostegno della misurazione dei parametri di prodotto pertinenti mediante metodi di misurazione affidabili, accurati e riproducibili che tengano conto dello stato dell’arte riconosciuto dei metodi di misurazione. |
Ridurre il consumo energetico degli apparecchi di refrigerazione per arrivare a un risparmio energetico annuo finale stimato a 10 TWh nel 2030. |
|
36 |
Progettazione ecocompatibile ed etichettatura energetica degli apparecchi di refrigerazione con funzione di vendita diretta |
Regolamento (UE) 2019/2024 della Commissione che stabilisce specifiche per la progettazione ecocompatibile degli apparecchi di refrigerazione con funzione di vendita diretta in applicazione della direttiva 2009/125/CE e regolamento delegato (UE) 2019/2018 della Commissione, dell’11 marzo 2019, che integra il regolamento (UE) 2017/1369 del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica degli apparecchi di refrigerazione con funzione di vendita diretta. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli apparecchi di refrigerazione con funzione di vendita diretta che riguardino i metodi e i calcoli per la misurazione dei parametri richiesti. |
Ridurre il consumo energetico degli apparecchi di refrigerazione con funzione di vendita diretta per arrivare a un risparmio energetico annuo finale stimato a 48 TWh nel 2030. |
|
37 |
Progettazione ecocompatibile ed etichettatura energetica degli aspirapolvere |
Regolamento (UE) n. 666/2013 della Commissione, dell’8 luglio 2013, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile degli aspirapolvere. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli aspirapolvere a sostegno della misurazione dei pertinenti parametri del prodotto utilizzando metodi di misurazione affidabili, accurati e riproducibili che tengano conto dei metodi di misurazione più avanzati generalmente riconosciuti. |
Ridurre il consumo energetico degli aspirapolvere durante l’uso. |
|
38 |
Progettazione ecocompatibile ed etichettatura energetica degli apparecchi per il riscaldamento d’ambiente |
Regolamento (UE) n. 813/2013 della Commissione, del 2 agosto 2013, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile degli apparecchi per il riscaldamento d’ambiente e degli apparecchi di riscaldamento misti e regolamento delegato (UE) n. 811/2013 della Commissione che integra la direttiva 2010/30/UE del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura indicante il consumo d’energia degli apparecchi per il riscaldamento d’ambiente, degli apparecchi di riscaldamento misti, degli insiemi di apparecchi per il riscaldamento d’ambiente, dispositivi di controllo della temperatura e dispositivi solari e degli insiemi di apparecchi di riscaldamento misti, dispositivi di controllo della temperatura e dispositivi solari. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli apparecchi per il riscaldamento d’ambiente e gli apparecchi di riscaldamento misti a sostegno della misurazione dei parametri di prodotto pertinenti. A tal fine ci si dovrebbe avvalere di metodi di misurazione affidabili, accurati e riproducibili che tengano conto delle metodologie di misurazione più avanzate e generalmente riconosciute. |
Normare i requisiti relativi al consumo energetico, al livello di potenza sonora e alle emissioni di ossidi di azoto degli apparecchi per il riscaldamento d’ambiente e degli apparecchi di riscaldamento misti in tutta l’UE. Ciò dovrebbe contribuire a migliorare il funzionamento del mercato unico e le prestazioni ambientali di tali prodotti. |
|
39 |
Progettazione ecocompatibile ed etichettatura energetica degli scaldacqua |
Regolamento (UE) n. 814/2013 della Commissione, del 2 agosto 2013, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile degli scaldacqua e dei serbatoi per l’acqua calda modificato dal regolamento (UE) 2016/2282 della Commissione, del 30 novembre 2016, e regolamento delegato (UE) n. 812/2013 della Commissione che integra la direttiva 2010/30/UE del Parlamento europeo e del Consiglio per quanto concerne l’etichettatura energetica degli scaldacqua, dei serbatoi per l’acqua calda e degli insiemi di scaldacqua e dispositivi solari. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli scaldacqua e i serbatoi per l’acqua calda a sostegno della misurazione dei parametri di prodotto pertinenti mediante metodi di misurazione affidabili, accurati e riproducibili che prendano in considerazione i metodi più avanzati abitualmente riconosciuti. |
Normare i requisiti relativi al consumo energetico, al livello di potenza sonora e alle emissioni di ossidi di azoto degli scaldacqua e dei requisiti relativi alle perdite di carico dei serbatoi per l’acqua calda in tutta l’UE. Ciò dovrebbe contribuire a migliorare il funzionamento del mercato unico e le prestazioni ambientali di tali prodotti. |
|
40 |
Progettazione ecocompatibile ed etichettatura energetica di telefoni cellulari e tablet |
Regolamento PLAN/2020/9213 della Commissione recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile di telefoni cellulari e tablet e regolamento delegato PLAN/2020/9217 della Commissione che integra il regolamento (UE) 2017/1369 del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica di telefoni cellulari e tablet. |
Elaborazione di nuove norme per telefoni cellulari e tablet a sostegno della misurazione e del calcolo dei parametri di prodotto pertinenti mediante metodi di misurazione affidabili, accurati e riproducibili che tengano conto dei metodi di misurazione più avanzati generalmente riconosciuti. |
Ridurre gli impatti ambientali associati a telefoni cellulari e tablet. |
|
41 |
Progettazione ecocompatibile ed etichettatura energetica dei prodotti fotovoltaici (moduli, invertitori e sistemi) |
Regolamento PLAN/2020/7002 della Commissione recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio per quanto riguarda le specifiche per la progettazione ecocompatibile dei prodotti fotovoltaici (moduli, invertitori e sistemi) e regolamento delegato PLAN/2020/7007 della Commissione che integra il regolamento (UE) 2017/1369 del Parlamento europeo e del Consiglio per quanto riguarda l’etichettatura energetica dei prodotti fotovoltaici (moduli, invertitori e sistemi). |
Elaborazione di nuove norme per i prodotti fotovoltaici (moduli, invertitori e sistemi) a sostegno della misurazione e del calcolo dei parametri di prodotto pertinenti mediante metodi di misurazione affidabili, accurati e riproducibili che tengano conto dei metodi di misurazione più avanzati generalmente riconosciuti. |
Ridurre gli impatti ambientali associati ai prodotti fotovoltaici (moduli, invertitori e sistemi). |
|
42 |
Progettazione ecocompatibile dei condizionatori d’aria aria-aria e delle pompe di calore |
Regolamento (UE) n. 206/2012 della Commissione, del 6 marzo 2012, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile dei condizionatori d’aria e dei ventilatori come modificato dal regolamento (UE) 2016/2282 della Commissione, del 30 novembre 2016. |
Revisione delle norme esistenti ed elaborazione di norme nuove per i condizionatori d’aria aria-aria e le pompe di calore mediante metodi di misurazione affidabili, accurati e riproducibili che tengano conto dei metodi di misurazione riconosciuti come i più avanzati. |
Ridurre il consumo energetico dei condizionatori d’aria aria-aria e delle pompe di calore durante l’uso nonché il loro livello di potenza sonora. |
|
43 |
Progettazione ecocompatibile dei motori elettrici |
Regolamento (UE) 2019/1781 della Commissione, dell’1 ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile dei motori elettrici e dei variatori di velocità in applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio recante modifica del regolamento (CE) n. 641/2009 per quanto riguarda le specifiche per la progettazione ecocompatibile dei circolatori senza premistoppa indipendenti e dei circolatori senza premistoppa integrati in prodotti e abroga il regolamento (CE) n. 640/2009 della Commissione. |
- Revisione delle norme esistenti in aggiunta agli elementi seguenti: 1) definire requisiti di efficienza delle risorse, tra cui l’identificazione e il riutilizzo di terre rare nei motori a magneti permanenti; 2) il livello delle tolleranze ammesse a fini della verifica; 3) metodi e classi energetiche per i motori con una tensione nominale superiore a 1 000 V; 4) combinazioni di motori e variatori di velocità immessi insieme sul mercato e variatori di velocità integrati (variatori compatti); 5) aggiungere altri tipi di motori all’ambito di applicazione, compresi i motori a magneti permanenti. |
Definire metodi di prova ripetibili, riproducibili, efficaci rispetto ai costi e pertinenti alla pratica per misurare il consumo energetico dei motori elettrici. L’obiettivo è di ridurne il tasso di perdita di energia, contribuendo in tal modo al funzionamento del mercato unico e al risparmio energetico. |
|
44 |
Progettazione ecocompatibile delle apparecchiature elettriche ed elettroniche domestiche e da ufficio |
Progetto di proposta di regolamento (UE).../... della Commissione che stabilisce specifiche di progettazione ecocompatibile per il consumo di energia nei modi spento, stand-by e stand-by in rete delle apparecchiature elettriche ed elettroniche domestiche e da ufficio a norma della direttiva 2009/125/CE del Parlamento europeo e del Consiglio e abroga il regolamento (CE) n. 1275/2008 della Commissione - PLAN/2016/444. |
Revisione delle norme esistenti ed elaborazione di norme nuove per le apparecchiature elettriche ed elettroniche domestiche e da ufficio. |
Ridurre il consumo di energia nei modi stand-by, spento e stand-by in rete delle apparecchiature elettriche ed elettroniche domestiche e da ufficio. |
|
45 |
Progettazione ecocompatibile degli alimentatori esterni |
Regolamento (UE) 2019/1782 della Commissione, del 1° ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile degli alimentatori esterni in applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio e abroga il regolamento (CE) n. 278/2009 della Commissione. |
Revisione delle norme esistenti ed elaborazione di norme nuove per gli alimentatori esterni a sostegno della misurazione dei parametri pertinenti dei prodotti. A tal fine ci si dovrebbe avvalere di metodi di misurazione affidabili, accurati e riproducibili che tengano conto dello stato dell’arte riconosciuto. |
L’obiettivo principale è la normazione del consumo di energia degli alimentatori esterni, contribuendo in tal modo al funzionamento del mercato unico e al risparmio energetico. |
|
46 |
Progettazione ecocompatibile dei ventilatori per usi industriali |
Regolamento (UE) n. 327/2011 della Commissione, del 30 marzo 2011, recante modalità di applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile di ventilatori a motore la cui potenza elettrica di ingresso è compresa tra 125 W e 500 kW come modificato dal regolamento (UE) n. 666/2013 della Commissione, dell’8 luglio 2013, e dal regolamento (UE) n. 2016/2282 della Commissione, del 30 novembre 2016. |
Revisione delle norme esistenti ed elaborazione di norme nuove per consentire un approccio esteso ai prodotti, in particolare definendo un numero sufficiente di punti di funzionamento e un metodo di interpolazione/calcolo e/o una curva caratteristica. Integrare i metodi di misurazione diretta con adeguati metodi di calcolo/interpolazione e quantificarne la validità. Metodi per i ventilatori circolanti e ventilatori di grandi dimensioni, ad esempio mediante estrapolazione da modelli scalati. |
Definire metodi di prova ripetibili, riproducibili, efficaci rispetto ai costi e pertinenti alla pratica per misurare il consumo energetico dei ventilatori per usi industriali. L’obiettivo è di ridurne il tasso di perdita di energia, contribuendo in tal modo al funzionamento del mercato unico e al risparmio energetico. |
|
47 |
Progettazione ecocompatibile dei variatori di velocità |
Regolamento (UE) 2019/1781 della Commissione, dell’1 ottobre 2019, che stabilisce specifiche per la progettazione ecocompatibile dei motori elettrici e dei variatori di velocità in applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio recante modifica del regolamento (CE) n. 641/2009 per quanto riguarda le specifiche per la progettazione ecocompatibile dei circolatori senza premistoppa indipendenti e dei circolatori senza premistoppa integrati in prodotti e abroga il regolamento (CE) n. 640/2009 della Commissione. |
Revisione delle norme esistenti in aggiunta agli elementi seguenti: 1) valutare le perdite dei sistemi direttamente associate ai variatori di velocità, in particolare le perdite indotte a monte della rete quando la corrente di ingresso non è sinusoidale, e le perdite armoniche indotte a valle del motore; 2) il livello delle tolleranze ammesse a fini della verifica; 3) se del caso, aggiungere classi energetiche per promuovere variatori più efficienti; 4) fissare specifiche per combinazioni di motori e variatori di velocità immessi insieme sul mercato e per i variatori di velocità integrati (variatori compatti); 5) aggiungere altri tipi di variatori di velocità nell’ambito di applicazione. |
Definire metodi di prova ripetibili, riproducibili, efficaci rispetto ai costi e pertinenti alla pratica per misurare il consumo energetico/le perdite di energia dei variatori di velocità. L’obiettivo è di ridurne i tassi di perdita di energia, contribuendo in tal modo al funzionamento del mercato unico e al risparmio energetico. |
|
48 |
Interoperabilità del sistema ferroviario |
Direttiva (UE) 2016/797 del Parlamento europeo e del Consiglio, dell’11 maggio 2016, relativa all’interoperabilità del sistema ferroviario dell’Unione europea (rifusione) e Una strategia europea per i dati (COM(2020) 66). |
Aggiornamento delle norme europee esistenti ed elaborazione di norme europee nuove (in particolare, ma non esclusivamente) relative: -al trasporto merci riguardo ad aspetti generali della catena del valore della logistica; - ai sistemi di comunicazione treno-terra; - alla digitalizzazione e all’automazione, alla multimodalità e alla mobilità come servizio; - alla cibersicurezza; - al sistema europeo di gestione del traffico ferroviario e al funzionamento automatico dei treni (basato sul 5G); - agli accoppiatori automatici digitali per vagoni merci e a soluzioni innovative per il trasporto intermodale e combinato; - alla certificazione virtuale; - alla manutenzione in funzione delle condizioni; - all’uso di nuovi materiali e di combustibili alternativi. Prendere in esame il collegamento dei dati con i dati europei sulla mobilità, mettendo in comune e condividendo dati provenienti da banche dati esistenti e future in materia di trasporti e mobilità. |
Sostenere le specifiche tecniche per l’interoperabilità e l’architettura del sistema ferroviario, tra cui la digitalizzazione (per l’esercizio efficiente del sistema ferroviario e i benefici per gli utenti), l’automazione e la cibersicurezza. |
|
49 |
Dispositivi medici e dispositivi medico-diagnostici in vitro |
Regolamento (UE) 2017/745 sui dispositivi medici. Regolamento (UE) 2017/746 sui dispositivi medico-diagnostici in vitro. |
Revisione delle norme europee esistenti ed elaborazione di norme europee nuove per la progettazione e la fabbricazione dei: - dispositivi medici di cui al regolamento (UE) 2017/745 (regolamento sui dispositivi medici); - dispositivi medico-diagnostici in vitro di cui al regolamento (UE) 2017/746 (regolamento sui dispositivi medico-diagnostici in vitro). Le norme si applicheranno alla progettazione e alla fabbricazione, alla gestione del rischio e agli obblighi degli operatori economici e degli sponsor, tra cui quelli relativi a: - sistemi di gestione della qualità; - gestione del rischio; - indagini cliniche e studi delle prestazioni; - valutazione clinica; - evidenze cliniche. |
Garantire il buon funzionamento del mercato unico per quanto riguarda i dispositivi medici, fissando standard elevati di qualità e sicurezza dei dispositivi medici e dei dispositivi medico-diagnostici in vitro. Tali standard dovrebbero rispondere alle esigenze comuni di sicurezza relative a tali prodotti, garantendo in tal modo un livello elevato di protezione della salute e di sicurezza per i pazienti, gli utilizzatori e altre persone. |
|
50 |
Utilizzo sicuro dei sistemi aeromobili senza equipaggio |
Regolamento delegato (UE) 2020/1058 della Commissione, del 27 aprile 2020, che modifica il regolamento delegato (UE) 2019/945 per quanto riguarda l’introduzione di due nuove classi di sistemi aeromobili senza equipaggio. |
Elaborazione di nuove norme europee che riguardino i requisiti che affrontano i rischi derivanti dall’esercizio dei sistemi aeromobili senza equipaggio. Tali requisiti riguardano le specifiche caratteristiche e funzionalità necessarie ad attenuare i rischi inerenti alla sicurezza del volo, alla tutela della riservatezza, alla protezione dei dati personali, alla security o all’ambiente. |
Garantire che i sistemi aeromobili senza equipaggio funzionino in maniera sicura e con un rischio basso, in modo che non debbano essere soggetti alle procedure standard in materia di conformità aeronautica. |
|
51 |
Sicurezza dei giocattoli |
Direttiva 2009/48/CE sulla sicurezza dei giocattoli. |
Elaborazione di nuove norme europee o revisione di quelle esistenti a sostegno delle tecnologie più avanzate in materia di sicurezza dei giocattoli e di sostanze chimiche presenti nei giocattoli. |
Affrontare il tema dello sviluppo tecnologico nel settore dei giocattoli, che ha sollevato perplessità in merito alla sicurezza e destato sempre più preoccupazioni fra i consumatori. |
|
52 |
Requisiti di sicurezza di alcuni prodotti per bambini |
Direttiva 2001/95/CE relativa alla sicurezza generale dei prodotti. |
Elaborazione di nuove norme europee e revisione di quelle esistenti per garantire la sicurezza di alcuni prodotti per bambini (esclusi i giocattoli), tenendo conto dello stato di avanzamento delle conoscenze. |
Garantire un livello elevato di protezione dei consumatori, rafforzando la sicurezza dei prodotti per bambini e tenendo conto dei più recenti sviluppi tecnologici e scientifici e delle prescrizioni di legge. |
|
53 |
Sistemi di protezione in atmosfera potenzialmente esplosiva |
Direttiva 2014/34/UE relativa agli apparecchi e ai sistemi di protezione destinati a essere utilizzati in atmosfera potenzialmente esplosiva. |
Elaborazione di nuove norme europee e revisione di quelle esistenti per garantire la salute e la sicurezza degli apparecchi e dei sistemi di protezione destinati a essere utilizzati in atmosfera potenzialmente esplosiva. I requisiti sono definiti nell’allegato II della direttiva 2014/34/UE. |
Garantire che le macchine e le altre attrezzature dotate di una propria sorgente potenziale di innesco, destinate a essere installate in ambienti esplosivi, siano sufficientemente protette contro il rischio di esplosione oppure, in caso contrario, che qualsiasi esplosione sia adeguatamente contenuta. |
|
54 |
Articoli pirotecnici |
Direttiva 2013/29/UE del Parlamento europeo e del Consiglio, del 12 giugno 2013, concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di articoli pirotecnici (rifusione). |
Lavoro di normazione per aumentare la sicurezza degli articoli pirotecnici: aggiornare le norme attuali sugli articoli pirotecnici al fine di tenere conto delle prescrizioni dell’attuale direttiva 2013/29/UE e dei più recenti sviluppi tecnologici. |
Aumentare la sicurezza degli articoli pirotecnici e la qualità delle valutazioni della conformità degli stessi, allineando le norme esistenti in questo campo alle attuali prescrizioni di legge e di sicurezza e ai più recenti sviluppi tecnologici. |
|
55 |
Impianti a fune |
Regolamento (UE) 2016/424 relativo agli impianti a fune. |
Elaborazione o revisione di norme al fine di formulare specifiche tecniche dettagliate per i) la progettazione e la costruzione di impianti a fune, delle loro infrastrutture, dei loro sottosistemi e componenti di sicurezza e ii) l’esercizio degli impianti a fune. |
Migliorare la sicurezza degli impianti a fune. |
|
56 |
Prodotti da costruzione |
Regolamento (UE) n. 305/2011 sui prodotti da costruzione e Un’ondata di ristrutturazioni per l’Europa: inverdire gli edifici, creare posti di lavoro e migliorare la vita (COM(2020) 662). |
Elaborazione di nuove norme europee per i metodi e i criteri di valutazione dei prodotti da costruzione, in particolare quelli impiegati per la ristrutturazione degli edifici, da utilizzare come specifiche tecniche standardizzate a norma del regolamento (UE) n. 305/2011. |
Garantire il buon funzionamento del mercato unico dei prodotti da costruzione e l’inverdimento degli edifici. |
|
57 |
Ascensori e componenti di sicurezza degli ascensori |
Direttiva 2014/33/UE per l’armonizzazione delle legislazioni degli Stati membri relative agli ascensori e ai componenti di sicurezza per ascensori, decisione di esecuzione (UE) 2021/76 della Commissione e decisione di esecuzione (UE) 2021/1220 della Commissione. |
Elaborazione di nuove norme europee, aggiornamento dei prodotti della normazione esistenti e adeguamento del programma di lavoro della Commissione che attua le decisioni di esecuzione (UE) 2021/76 e (UE) 2021/1220 al fine di emanare norme tempestive e più avanzate. |
Garantire un livello elevato di protezione della salute e di sicurezza e, se del caso, la sicurezza dei beni, nonché garantire una concorrenza leale sul mercato dell’UE. |
|
58 |
Apparecchiature di pesatura installate a bordo dei veicoli |
Regolamento di esecuzione (UE) 2019/1213 della Commissione, del 12 luglio 2019, che stabilisce disposizioni dettagliate a garanzia di condizioni uniformi ai fini dell’attuazione dell’interoperabilità e della compatibilità delle apparecchiature di pesatura installate a bordo dei veicoli. |
Elaborazione di una norma per la trasmissione di informazioni relative alle apparecchiature di pesatura installate a bordo tra motrice e rimorchio attraverso un collegamento tra sistemi di trasporto intelligenti cooperativi. La nuova norma deve definire il livello di applicazione della comunicazione tra i diversi veicoli di motrici combinate, sulla base di un collegamento wireless tra le stazioni dei sistemi di trasporto intelligenti cooperativi del veicolo a motore e quelle dei rimorchi o semirimorchi, in conformità delle norme EN 302 663, EN 302 636-4-1 e EN 302 636-5. |
Promuovere un metodo standardizzato per il controllo di veicoli o veicoli combinati che potrebbero essere in sovraccarico, al fine di evitare danni eccessivi alle strade e garantire la manovrabilità. |
|
59 |
Attrezzature a pressione |
Direttiva 2014/68/UE, del 15 maggio 2014, concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di attrezzature a pressione. |
Revisione delle norme esistenti ed elaborazione di norme nuove per le attrezzature a pressione o gli insiemi. |
Migliorare la sicurezza e agevolare l’accesso al mercato per le piccole e medie imprese. In questo modo le imprese dell’UE diverranno più competitive sul mercato mondiale. |
|
60 |
Apparecchi a gas |
Regolamento (UE) 2016/426 sugli apparecchi che bruciano carburanti gassosi. |
Elaborazione di nuove norme europee o revisione di quelle esistenti a sostegno delle tecnologie più avanzate nel settore degli apparecchi che bruciano carburanti gassosi. Il lavoro svolto affronterà le questioni seguenti: — modifiche introdotte nei requisiti essenziali; — sviluppi relativi ai carburanti gassosi ottenuti da fonti rinnovabili; — aumento previsto dell’uso dell’idrogeno; — nuove tecnologie disponibili (ad esempio apparecchi a celle a combustibile). |
Garantire la salute e la sicurezza nonché l’uso razionale dell’energia (efficienza energetica) per gli apparecchi che bruciano carburanti gassosi. |
|
61 |
Recipienti semplici a pressione |
Direttiva 2014/29/UE concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di recipienti semplici a pressione. |
Revisione delle norme esistenti della serie EN 286 ed elaborazione di norme nuove. |
Migliorare la sicurezza e agevolare l’accesso al mercato per le piccole e medie imprese. In questo modo le imprese dell’UE diverranno più competitive sul mercato mondiale. |
|
62 |
Strumenti per pesare e strumenti di misura |
Direttiva 2014/31/UE concernente gli strumenti per pesare a funzionamento non automatico. Direttiva 2014/32/UE concernente gli strumenti di misura. |
Elaborazione di nuove norme europee o revisione di quelle esistenti a sostegno delle tecnologie più avanzate nel settore degli strumenti per pesare e degli strumenti di misura. |
i) Tutelare il pubblico contro la possibilità di ottenere risultati scorretti dalle operazioni di pesatura effettuate mediante strumenti per pesare a funzionamento non automatico utilizzati in talune categorie di applicazioni; |
|
63 |
Sistemi di intelligenza artificiale sicuri e affidabili |
Proposta di regolamento del Parlamento europeo e del Consiglio che stabilisce regole armonizzate sull’intelligenza artificiale (legge sull’intelligenza artificiale) e modifica alcuni atti legislativi dell’Unione. https://eur-lex.europa.eu/legal-content/IT/TXT/?uri=CELEX%3A52021PC0206&qid=1643636361244. |
Stabilire norme per l’immissione sul mercato, la messa in servizio e l’uso nell’UE dei sistemi di intelligenza artificiale, che prevedano requisiti relativi alla sicurezza e affidabilità di tali sistemi, tra cui la gestione del rischio, la qualità dei dati, la trasparenza, la sorveglianza umana, l’accuratezza, la solidità e la cibersicurezza. |
Garantire che i sistemi di intelligenza artificiale siano potenzialmente sicuri e affidabili, siano adeguatamente monitorati durante tutto il loro ciclo di vita, rispettino i valori fondamentali e i diritti umani riconosciuti nell’UE e rafforzino la competitività europea. |
|
64 |
Appalti pubblici |
Direttiva 2014/24/UE sugli appalti pubblici, articolo 22, e Una strategia europea per i dati (COM(2020) 66). |
Elaborazione di prodotti della normazione per l’intero ciclo di vita degli appalti elettronici, al fine di garantire l’interoperabilità a livello transfrontaliero e sostenere spazi comuni europei di dati per le pubbliche amministrazioni. |
Le norme sono finalizzate ad agevolare l’interoperabilità tra committenti e fornitori negli appalti pubblici, specialmente a livello transfrontaliero. Per creare un mercato unico in Europa è essenziale conseguire l’interoperabilità. |
|
65 |
Cibersicurezza delle apparecchiature radio |
Direttiva 2014/53/UE del Parlamento europeo e del Consiglio, del 16 aprile 2014, concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di apparecchiature radio. |
Elaborazione di nuove norme a sostegno di determinati requisiti di cibersicurezza per apparecchiature radio specifiche. |
Migliorare la cibersicurezza di talune apparecchiature radio. |
|
66 |
Fatturazione elettronica |
Direttiva 2014/55/UE relativa alla fatturazione elettronica, articolo 3, e decisione di esecuzione (UE) 2017/1870 della Commissione, del 16 ottobre 2017. |
Aggiornamento o revisione della norma europea relativa alla fatturazione elettronica per tenere conto degli sviluppi tecnologici e garantire la piena e costante interoperabilità della fatturazione elettronica negli appalti pubblici. |
Promuovere la diffusione della fatturazione elettronica negli appalti pubblici e integrare gli sforzi volti a promuovere la diffusione degli appalti elettronici. |
|
67 |
Passaporti digitali per prodotti e servizi |
Iniziativa legislativa sulla politica in materia di prodotti sostenibili. |
Elaborazione di norme europee riguardanti i requisiti relativi all’affidabilità, alla sicurezza e alla trasparenza dei passaporti digitali per prodotti e servizi. |
L’obiettivo è porre le basi affinché siano garantite prestazioni ambientali elevate per tutti i prodotti e, per quanto possibile e pertinente, i servizi offerti sul mercato dell’UE migliorando i flussi di informazioni attraverso passaporti digitali. |
|
68 |
Codice di risposta rapida per i pagamenti istantanei al punto di interazione |
Comunicazione relativa a una strategia in materia di pagamenti al dettaglio per l’UE (COM(2020) 592). |
Elaborazione di una norma per il codice di risposta rapida che consenta di disporre ordini di pagamento istantanei e accettarli (sia all’interno di uno Stato membro che a livello transfrontaliero), utilizzando un dispositivo elettronico (ad esempio un telefono cellulare) in diverse situazioni, ad esempio presso negozi fisici, nel commercio elettronico, tra privati, tra imprese, da imprese a consumatori, per il pagamento di fatture, ecc. |
Sostenere l’interoperabilità transfrontaliera delle soluzioni di pagamento istantaneo, nonché l’emergere e la diffusione di soluzioni di pagamento istantaneo paneuropee. |
|
69 |
Norme a sostegno dell’infrastruttura di servizi blockchain |
Decennio digitale europeo: obiettivi digitali per il 2030. Bussola per il digitale 2030: il modello europeo per il decennio digitale. |
Elaborazione di norme a sostegno dell’introduzione dell’infrastruttura di servizi blockchain in generale e delle tecnologie di registro distribuito in tutta l’UE. |
Sostenere l’infrastruttura europea di servizi blockchain in modo che sia verde, sicura, interoperabile, pienamente conforme ai valori dell’UE e al quadro giuridico dell’UE, rendendo la fornitura di servizi pubblici nazionali/locali e transfrontalieri più efficiente e affidabile e promuovendo nuovi modelli di business. |
Collegati
[box-note]Regolamento (UE) n. 1025/2012[/box-note]
RAPEX Report 03 del 21/01/2022 N. 13 A12/00145/22 Bulgaria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 03 del 21/01/2022 N. 13 A12/00145/22 Bulgaria
Approfondimento tecnico: Letto completo
Il prodotto, di marca Confort Set, è stato respinto in fase di importazione perché non conforme Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 1725:1998 “Mobili domestici - Letti e materassi - Requisiti di sicurezza e metodi di prova”.
La struttura del letto non è abbastanza solida e sotto carico potrebbe rompersi.
In accordo alla norma EN 1725:1998, quando materasso, base del letto ed intelaiatura sono parte di un’unica fornitura devono essere sottoposti a prova insieme. Mediante un tampone di carico è necessario applicare una forza di 1400 N verso il basso per dieci volte in ogni punto della base del letto dove si ritiene probabile che si verifichi una rottura.
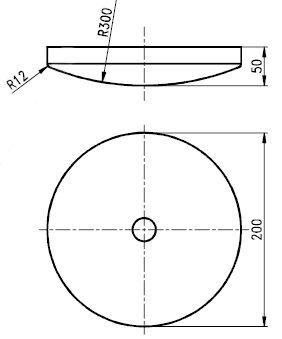
Il tampone di carico da usare per la prova consiste in un oggetto rigido di forma circolare del diametro di 200 mm, la cui faccia presenta una curvatura sferica convessa del raggio di 300 mm con raggio del bordo frontale di 12 mm.
Dimensioni in mm
Fig. 1 - Tampone di carico
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 03 del 21_01_2022 N. 13 A12_00145_22 Bulgaria.pdf Letto completo |
360 kB | 0 |
Decreto 6 dicembre 2021
Decreto 6 dicembre 2021
Aggiornamento dell'allegato 6 al decreto legislativo n. 75 del 29 aprile 2010, recante: «Riordino e revisione della disciplina in materia di fertilizzanti, a norma dell'articolo 13 della legge 7 luglio 2009, n. 88».
(GU n.28 del 03.02.2022)
Collegati
[box-note]Decreto Legislativo n. 75 del 29 aprile 2010[/box-note]
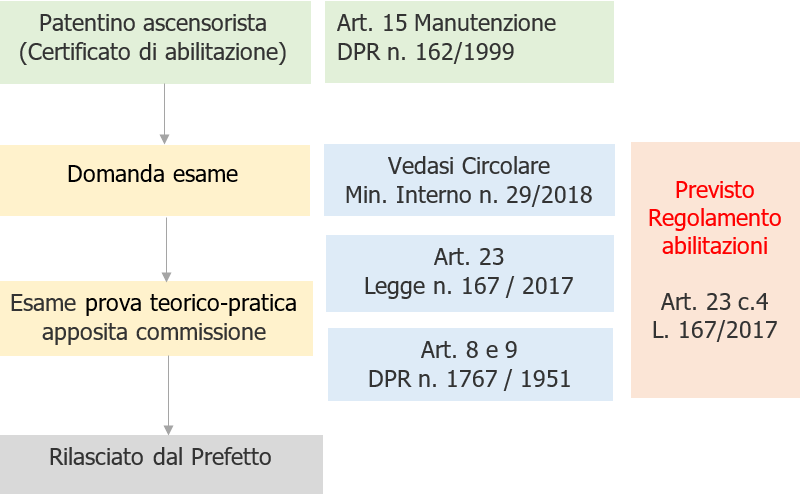
Circolare Ministero dell'Interno n. 29/2018
Circolare Ministero dell'Interno n. 29/2018
Art. 23 della Legge 20/11/2017 n.167 - Ricostituzione della Commissioni per l'abilitazione per la manutenzione di ascensori e montacarichi - Istruzioni operative.
Allegati:
- Circolare Ministero dell'Interno n. 29/2018
- Istanza per l'ammissione alla prova teorico-pratica all'abilitazione della professione di manutentore di ascensori e montacarichi e apparecchi di sollevamento
(Da allegare all'istanza dichiarazione del legale rappresentante di una Ditta specializzata nel settore o autocertificazione, in caso di lavoratore autonomo, attestante la formazione pratica eseguta per almeno X mesi relativa alle mansioni di manutentore di ascensori e montacarichi)
[box-info]Legge 20 novembre 2017 n. 167
Art. 23. Disposizioni per l’integrale attuazione della direttiva 2014/33/UE relativa agli ascensori e ai componenti di sicurezza degli ascensori nonché per l’esercizio degli ascensori
1. Al fine di assicurare l’integrale attuazione della direttiva 2014/33/UE del Parlamento europeo e del Consiglio, del 26 febbraio 2014, relativa agli ascensori e ai componenti di sicurezza degli ascensori nonché per l’esercizio degli ascensori, il certificato di abilitazione previsto dall’articolo 15, comma 1, del regolamento di cui al decreto del Presidente della Repubblica 30 aprile 1999, n. 162, è valido in tutto il territorio nazionale ed è rilasciato dal prefetto in seguito all’esito favorevole di una prova teorico-pratica innanzi a un’apposita commissione esaminatrice, dal medesimo nominata e composta da cinque funzionari, in possesso di adeguate competenze tecniche, dei quali almeno uno, oltre al presidente, con laurea in ingegneria, designati rispettivamente dal Ministero del lavoro e delle politiche sociali, dal Ministero delle infrastrutture e dei trasporti, dal Ministero dello sviluppo economico, dall’Istituto nazionale per l’assicurazione contro gli infortuni sul lavoro (INAIL) e da un’azienda sanitaria locale, ovvero da un’agenzia regionale per la protezione ambientale, qualora le disposizioni regionali di attuazione del decreto-legge 4 dicembre 1993, n. 496, convertito, con modificazioni, dalla legge 21 gennaio 1994, n. 61, attribuiscano a tale agenzia le competenze in materia.
La commissione è presieduta dal funzionario designato dal Ministero del lavoro o delle politiche sociali. Alla prova teorico-pratica sono presenti almeno tre membri della commissione, compreso il presidente. Al presidente e ai componenti della commissione non spetta alcun compenso.
2. La data e la sede delle sessioni di esame è determinata dal prefetto. Il prefetto del capoluogo di regione, tenuto conto del numero e della provenienza delle domande pervenute, previe intese con gli altri prefetti della regione, può disporre apposite sessioni di esame per tutte le domande presentate nella regione allo scopo di razionalizzare le procedure finalizzate al rilascio del certificato di abilitazione.
3. Gli articoli 6 e 7 del regolamento di cui al decreto del Presidente della Repubblica 24 dicembre 1951, n. 1767, sono abrogati.
4. Il Governo è autorizzato a modificare, con apposito regolamento, il regolamento di cui al decreto del Presidente della Repubblica 30 aprile 1999, n. 162, sulla base delle disposizioni del presente articolo. Alla data di entrata in vigore del regolamento adottato ai sensi del presente comma sono abrogati i commi 1 e 2 del presente articolo.[/box-info]
Collegati
[box-note]Legge 20 novembre 2017 n. 167
ebook Decreto Ascensori | D.P.R. 162/1999
D.P.R. N. 162 del 30 Aprile 1999
D.P.R. 24 dicembre 1951 n. 1767[/box-note]
Status fasi Regolamento macchine
Status fasi Regolamento macchine | Update Luglio 2023 / il 29.06.2023 pubblicato il Regolamento (UE) 2023/1230
ID 15553 | Update 20.07.2023 / Il 29 Giugno 2023 pubblicato il Regolamento (UE) 2023/1230 - Documento completo in allegato
La Direttiva Macchine (Direttiva 2006/42/CE), entrata in vigore da dicembre 2009, disciplina i prodotti dell'industria meccanica. I suoi obiettivi sono garantire un elevato livello di sicurezza e protezione per gli utenti delle macchine (lavoratori, consumatori e altre persone esposte), nonché garantire la libera circolazione delle macchine nel mercato interno. Per quanto riguarda i macchinari utilizzati nelle applicazioni di pesticidi, la direttiva mira anche alla protezione dell'ambiente.
[box-note]Update 20.07.2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-note]
[box-note]Update 03.07.2023
Il 29 Giugno 2023 pubblicato il Regolamento (UE) 2023/1230.
Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio.
(GU n. 165/1 del 29.06.2023)
Entrata in vigore: 19.07.2023
Applicazione dal 14.01.2027 [43 mesi firma del Regolamento]. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 14.01.2024 [7 mesi firma del regolamento];
- l'articolo 50, paragrafo 1, si applica a decorrere dal 14.10.2023 [4 mesi firma del regolamento];
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 13.07.2023 [30 giorni firma del regolamento];
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 14.07.2024 [13 mesi firma del regolamento].
La direttiva 2006/42/CE è abrogata a decorrere dal 14.01.2027 [43 mesi firma del Regolamento].
La direttiva 73/361/CEE è abrogata.
Download Testo Regolamento macchine IT
Download Regolamento macchine EN[/box-note]
[box-note]Update 22.06.2023
Regolamento macchine: firmato presidenti del PE e del Consiglio il 14 giugno - previsto in GU il 29 giugno 2023
Il nuovo regolamento macchine è stato firmato dai presidenti del Parlamento europeo e del Consiglio il 14 giugno 2023 ed è attesa l'imminente pubblicazione in Gazzetta ufficiale dell'Unione europea, prevista per il 29 giugno p.v.
Una volta pubblicato in GU il regolamento entrerà in vigore il ventesimo giorno successivo alla pubblicazione, ovvero il 19 luglio 2023. Gli Stati membri e gli operatori economici avranno 42 mesi di tempo prima che vengano applicate le norme del nuovo regolamento.
La direttiva 2006/42/CE verrà abrogata a decorrere da gennaio 2027.
Vedi[/box-note]
[box-note]Update 22.05.2023
Il Consiglio ha adottato il 22 maggio 2023 il nuovo regolamento macchine. La normativa proposta aggiorna la direttiva "macchine" del 2006 e la trasforma in un regolamento. Il nuovo testo armonizza i requisiti essenziali in termini di sicurezza e di tutela della salute applicabili alle macchine nell'UE, promuove la libera circolazione delle macchine e assicura un livello elevato di sicurezza per lavoratori e cittadini. - PE-CONS 6-23[/box-note]
[box-note]Update 15.05.2023
Discussione in Consiglio
- Consiglio: 10 maggio 2023 - PE-CONS 6/23 [in lingua italiana] Progetto di Regolamento del Parlamento Europeo e del Consiglio relativo alle macchine (prima lettura) - Adozione dell'atto legislativo
- 15 maggio 2023: Dichiarazione della Commissione
Nel valutare i criteri di cui all'articolo 6, paragrafo 4, la Commissione presterà particolare attenzione alle categorie di prodotti per i quali si verifica un numero significativo di incidenti e decessi.[/box-note]
[box-note]Update 21.04.2023
Il Parlamento Europeo, con 595 voti a favore, 7 contrari e 30 astenuti, ha adottato, nella seduta del 18 aprile 2023, il nuovo Regolamento Macchine.
Testo approvato - Macchine - P9_TA(2023)0097 - Risoluzione legislativa del Parlamento europeo del 18 aprile 2023 sulla proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina[/box-note]
[box-note]Update 27.03.2023
List of working papers (WK) distributed to the Working Party on Technical Harmonisation (Machinery) in the third and the fourth quarter of 2022 ST 7740 2023 INIT[/box-note]
[box-note]Update 30.01.2023
Proposta di regolamento del Parlamento europeo e del Consiglio relativo alle macchine - Lettera al presidente della commissione IMCO del Parlamento europeo 25.01.2023 (ST 5617 2023 INIT)[/box-note]
[box-note]Update 17.12.2022
Nuovo Regolamento macchine 2023: prossima la pubblicazione
Il Consiglio e il Parlamento europeo concordano nuovi requisiti di sicurezza per i "prodotti macchina".[/box-note]
[box-note]Update 12.08.2022
- List of working papers (WK) have been distributed by the General Secretariat of the Council to the Working Party on Technical Harmonisation (Machinery) in the first and second quarter of 2022 (29.07.2022 - ST 11407 2022 INIT)[/box-note]
[box-note]Update 24.06.2022
- Proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina - Mandato negoziale con il Parlamento europeo / Testo proposta MR aggiornato.
Documenti allegati:
ST 9801 2022 REV 1 COR 1 FR
ST 9801 2022 REV 1 FR
ST 9801 2022 INIT FR[/box-note]
[box-note]Update 24.05.2022
- Parlamento europeo: Relazione sulla proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina (COM(2021)0202 – C9-0145/2021 – 2021/0105(COD))
Documenti allegati:
Report A-9-2022-0141 IT[/box-note]
[box-note]Update 05.05.2022
- European Parliamento: Report on the proposal for a regulation of the European Parliament and of the Council on Machinery products (COM(2021)0202 – C9-0145/2021 – 2021/0105(COD))
Documenti allegati:
Report A-9-2022-0141 EN[/box-note]
[box-note]Update 21.04.2022
- Parlamento europeo: Riunione del 20.04.2022 - Commissione per il mercato interno e la protezione dei consumatori: Approvazione del progetto di relazione.
Documenti allegati:
Progetto di relazione 20.10.2021 - PR – PE697.614v02-00
Emendamenti 101-438 - 10.11.2021 - AM – PE699.191v01-00
Emendamenti 16-132 - 21.01.2022 AM – PE704.618v01-00
Parere 08.03.2022 - AD – PE703.051v02-00[/box-note]
La Direttiva definisce la macchina come un insieme di componenti, di cui almeno uno mobile, uniti tra loro per una specifica applicazione, il sistema di azionamento essendo alimentato da energia diversa dallo sforzo umano o animale. I prodotti coperti includono ad esempio macchine edili, tosaerba, stampanti 3D o robot. Oltre alle macchine in senso stretto , l'ambito di applicazione copre altri prodotti correlati, come componenti di sicurezza o quasi macchine.
La Direttiva si basa sui principi del cosiddetto "Nuovo approccio all'armonizzazione tecnica e alle norme": stabilisce i requisiti essenziali di salute e sicurezza che le macchine devono soddisfare per essere immesse sul mercato, nonché le procedure di valutazione della conformità da utilizzato per dimostrare che la macchina soddisfa questi requisiti. La dimostrazione della conformità ai requisiti può essere effettuata mediante l'applicazione di norme armonizzate europee o un'altra soluzione che dimostri un livello di sicurezza simile. La Direttiva richiede ai produttori di produrre un fascicolo tecnico, firmare una Dichiarazione di Conformità ed apporre la marcatura "CE".
Una valutazione pubblicata nel 2018 ha concluso che la direttiva era generalmente pertinente, efficace, efficiente, coerente e presentava un valore aggiunto dell'UE. Ha tuttavia individuato una serie di questioni, ad esempio relative al monitoraggio e all'applicazione della direttiva o alla necessità di una maggiore chiarezza giuridica e di un chiarimento della sua interazione con altre normative.
Ha anche dimostrato che alcuni requisiti amministrativi ne mettevano a dura prova l'efficienza. Inoltre, la valutazione ha evidenziato che la direttiva era sufficientemente flessibile per consentire gli sviluppi tecnologici nell'era digitale, ma ha sottolineato che ulteriori innovazioni in settori quali l'intelligenza artificiale (AI) e l'Internet delle cose (IoT) potrebbero testare l'efficacia della direttiva in futuro. In particolare, i robot di intelligenza artificiale potrebbero comportare rischi molto più elevati rispetto ai sistemi di intelligenza artificiale puramente software.
La Commissione ha pubblicato una valutazione d'impatto iniziale il 10 gennaio 2019. Una consultazione pubblica è stata aperta dal 7 giugno al 30 agosto 2019. Uno studio di valutazione d'impatto sulla revisione della direttiva è stato pubblicato il 31 agosto 2020.
Il 21 aprile 2021
la Commissione ha presentato una proposta per un nuovo regolamento sulle macchine, nell'ambito di un più ampio "pacchetto AI".
La proposta sui prodotti meccanici affronta una serie di problemi individuati nell'attuale quadro dell'UE:
- copertura insufficiente dei nuovi rischi derivanti dalle nuove tecnologie digitali (come l'IA, l'IoT e la robotica);
- incertezza giuridica riguardo all'ambito e alle definizioni e potenziali lacune in materia di sicurezza nelle tecnologie "tradizionali";
- copertura insufficiente per "macchine ad alto rischio";
- costi dovuti alla documentazione cartacea richiesta;
- incongruenze con altri atti legislativi sulla sicurezza dei prodotti;
- e divergenze interpretative tra gli Stati membri dovute al recepimento (da qui la scelta di un regolamento anziché di una direttiva).
La proposta di regolamento che stabilisce norme armonizzate sull'IA (la "legge sull'IA"), inclusa nel pacchetto sull'IA, mira a stabilire regole armonizzate per lo sviluppo, l'immissione sul mercato e l'uso dei sistemi di IA, seguendo un approccio basato sul rischio . Affronta i rischi per la sicurezza dei sistemi di intelligenza artificiale, mentre la proposta sui prodotti macchinari si concentra sull'integrazione sicura dei sistemi di intelligenza artificiale nelle macchine.
Fasi Proposta Regolamento macchine
2 Agosto 2021
Il feedback sulla proposta della Commissione era aperto fino al 2 agosto 2021.
In sede di Consiglio, la proposta della Commissione è stata discussa per la prima volta nella riunione del 26 aprile 2021 del gruppo di lavoro sull'armonizzazione tecnica. In totale, fino ad oggi si sono svolte 12 riunioni.
18 Novembre 2021
Al Parlamento europeo, il fascicolo è stato assegnato alla commissione per il mercato interno e la protezione dei consumatori (IMCO). La proposta è stata discussa per la prima volta in sede di IMCO il 27 maggio 2021.
Lo stesso giorno, Ivan ŠTEFANEC (PPE, Slovacchia) è stato nominato relatore (ossia l'eurodeputato incaricato di redigere la relazione sulla proposta a nome di IMCO e che guiderà gruppo negoziale del Parlamento durante i negoziati interistituzionali).
Il progetto di relazione preparato dal relatore è stato discusso in IMCO il 28 ottobre 2021. Il relatore ha modificato la proposta per chiarirne l'ambito di applicazione e le definizioni. Ha inoltre proposto di mantenere la possibilità per i fabbricanti di utilizzare la procedura di controllo interno della produzione per la valutazione della conformità di macchinari ad alto rischio. Inoltre, il relatore ha modificato la proposta in modo che le specifiche tecniche possano essere redatte dalla Commissione solo se gli organismi di normalizzazione non hanno fornito norme armonizzate tre anni dopo la richiesta di normazione. Il relatore ha inoltre proposto di posticipare di 18 mesi le scadenze e il periodo transitorio (ad es. il periodo transitorio è stato prorogato da 42 a 60 mesi).
28 Febbraio 2022
In totale, sono stati presentati 438 emendamenti alla proposta della Commissione (di cui 100 dal relatore). L'esame degli emendamenti di compromesso si svolgerà in seno all'IMCO il 28 febbraio 2022.
16-17 Marzo 2022
la votazione in commissione è prevista per il 16-17 marzo 2022.
20 Aprile 2022
Parlamento europeo: Riunione Commissione per il mercato interno e la protezione dei consumatori. Approvazione del progetto di relazione (PE697.614v02-00).
[...]
Fonte: CE
©Copia autorizzata Abbonati
| Rev. | Data | Oggetto | Autore |
| 15.0 | 20.07.2023 | Rettifica del regolamento (UE) 2023/1230 | Certifico Srl |
| 14.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 13.0 | 22.06.2023 | Regolamento macchine: firmato presidenti del PE e del Consiglio il 14 giugno | Certifico Srl |
| 12.0 | 22.05.2023 | Il Consiglio ha adottato il 22 maggio 2023 il nuovo regolamento macchine | Certifico Srl |
| 11.0 | 15.05.2023 | Discussione Consiglio Regolamento macchine - Maggio 2023 [PE-CONS 6/23] | Certifico Srl |
| 10.0 | 21.04.2023 | Testo approvato PE - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 9.0 | 27.03.2023 | List of working papers (WK) distributed to the Working Party on Technical Harmonisation (Machinery) in the third and the fourth quarter of 2022 ST 7740 2023 INIT | Certifico Srl |
| 8.0 | 30.01.2023 | Proposta di regolamento del Parlamento europeo e del Consiglio relativo alle macchine - Lettera al presidente della commissione IMCO del Parlamento europeo 25.01.2023 (ST 5617 2023 INIT) | Certifico Srl |
| 7.0 | 17.1.2022 | Update 15.17.2022 Nuovo Regolamento macchine 2023: prossima la pubblicazione Il Consiglio e il Parlamento europeo concordano nuovi requisiti di sicurezza per i "prodotti macchina". |
Certifico Srl |
| 6.0 | 12.08.2022 | Update 12.08.2022 - List of working papers (WK) have been distributed by the General Secretariat of the Council to the Working Party on Technical Harmonisation (Machinery) in the first and second quarter of 2022 (29.07.2022 - ST 11407 2022 INIT) |
Certifico Srl |
| 5.0 | 27.06.2022 | Update 27.06.2022 - Proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina - Mandato negoziale con il Parlamento europeo / Testo proposta MR aggiornato. Documenti allegati: ST 9801 2022 REV 1 COR 1 FR ST 9801 2022 REV 1 FR ST 9801 2022 INIT FR |
Certifico Srl |
| 4.0 | 24.05.2022 | Update 24.05.2022 - Parlamento europeo: Relazione sulla proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina (COM(2021)0202 – C9-0145/2021 – 2021/0105(COD)) Documenti allegati: Report A-9-2022-0141 IT |
Certifico Srl |
| 3.0 | 11.05.2022 | Update 05.05.2022 - Parlamento europeo: Report on the proposal for a regulation of the European Parliament and of the Council on Machinery products (COM(2021)0202 – C9-0145/2021 – 2021/0105(COD)) Documenti allegati: Report A-9-2022-0141 EN |
Certifico Srl |
| 2.0 | 21.04.2022 | Parlamento europeo: Riunione del 20.04.2022 Commissione per il mercato interno e la protezione dei consumatori: Approvazione del progetto di relazione. Documenti allegati: Progetto di relazione 20.10.2021 - PR – PE697.614v02-00 Emendamenti 101-438 - 10.11.2021 - AM – PE699.191v01-00 Emendamenti 16-132 - 21.01.2022 AM – PE704.618v01-00 Parere 08.03.2022 - AD – PE703.051v02-00 |
Certifico Srl |
| 1.0 | 08.03.2022 | Esame in Commissione degli emendamenti (ST 6724 2022 INIT) | Certifico Srl |
| 0.0 | 25.01.2022 | --- | Certifico Srl |
Collegati
[box-note]Regolamento (UE) 2023/1230
Regolamento macchine | Regolamento (UE) 2023/1230
Nuovo Regolamento macchine 2023: prossima la pubblicazione
Proposal for a Regulation on machinery products
Proposal for a Regulation on a European approach for Artificial Intelligence
Orgalim Position Paper on the Proposal for a Machinery Regulation
Report CE Regulation on Machinery Products - 18.11.2021[/box-note]
ISO 7010 Raccolta segnaletica di sicurezza - Ed. 2022
ISO 7010 Raccolta dei Segnali di sicurezza previsti dalla norma / Ed. 2022 Amd 6 Agosto 2022
ID 15545 | Ed. 10.0 del 10 Agosto 2022 / File immagini PNG e Lista segnaletica allegata
Aggiornata la raccolta segnaletica ISO 7010:2019, con altri segnali pubblicati con l'emendamento 6 di Agosto 2022, in allegato:
- Raccolta immagini segnaletica Ed. 10.0 aggiornata con l'emendamento n. 6 di Agosto 2022
[box-info]Nuovi Pittogrammi Emendamento A6 Agosto 2022
ISO 7010 E065 - Natural disaster outdoor refuge area
ISO 7010 E070 - Evacuation lift for people unable to use stairs
ISO 7010 M060 - Hold the trolley handle
ISO 7010 P073 - Do not shut lid when burners are operating
ISO 7010 P074 - Child seat installation prohibited[/box-info]
[box-info]Nuovi Pittogrammi Emendamento A5 Gennaio 2022
M056 - Ventilate before and during entering
M057 - Ensure continuous ventilation
M058 - Entry only with supervisor outside.[/box-info]
[box-info]Nuovi Pittogrammi Emendamento A4 Dicembre 2021
F018: Fire alarm flashing light,
M059: Wear laboratory coat,
W073: Warning; Large-scale fire zone,
W074: Warning; Tornado zone,
W075: Warning; Active volcano zone,
W076: Warning; Debris flow zone,
W077: Warning; Flood zone,
W078: Warning; Landslide zone.[/box-info]
[box-info]Nuovi Pittogrammi Emendamento A3 Luglio 2021
E067 - Evacuation mattress
E068 - Lifebuoy with light and smoke
E069 - Person overboard call point
F019 - Unconnected fire hose[/box-info]
[box-info]Segnaletica EN ISO 7010 e Segnaletica allegato XXV del TUS
In relazione all'uso della segnaletica di sicurezza di cui all'Allegato XXV D.Lgs n. 81/2008 e s.m.i, che non è aggiornata e armonizzata rispetto alla segnaletica EN ISO 7010 si è espresso il MLPS con la:
- Circolare n. 30 del 16.07.2013
Segnaletica di sicurezza - D.Lgs n. 81/2008 e s.m.mi. allegato XXV - Prescrizioni generali. Uso e rispondenza dei pittogrammi con la Norma UNI EN ISO 7010:2017 - Chiarimenti[/box-info]
ISO 7010:2019
Graphical symbols - Safety colours and safety signs - Registered safety signs
Corrigenda/Amendments:
ISO 7010:2011/Amd 1:2012
ISO 7010:2011/Amd 2:2012
ISO 7010:2011/Amd 3:2012
ISO 7010:2011/Amd 4:2013
ISO 7010:2011/Amd 5:2014
ISO 7010:2011/Amd 6:2014
ISO 7010:2011/Amd 7:2016
ISO 7010:2011/Amd 8:2017
ISO 7010:2011/Amd 9:2018
ISO 7010:2019/Amd 1:2020
ISO 7010:2019/Amd 2:2020
ISO 7010:2019/Amd 3:2021
ISO 7010:2019/Amd 4:2021
ISO 7010:2019/Amd 5:2022
ISO 7010:2019/Amd 6:2022
ISO 7010:2019: https://www.iso.org/standard/72424.html
[alert]Lista Norme ISO
ISO 7010:2011
ISO 7010:2011/Amd 1:2012
ISO 7010:2011/Amd 2:2012
ISO 7010:2011/Amd 3:2012
ISO 7010:2011/Amd 4:2013
ISO 7010:2011/Amd 5:2014
ISO 7010:2011/Amd 6:2014
ISO 7010:2011/Amd 7:2016
ISO 7010:2011/Amd 8:2017
ISO 7010:2011/Amd 9:2018
ISO 7010:2019
ISO 7010:2019/Amd 1:2020
ISO 7010:2019/Amd 2:2020
ISO 7010:2019/Amd 3:2021
ISO 7010:2019/Amd 4:2021
ISO 7010:2019/Amd 5:2022[/alert]
Dim.: 800 x 800 px
Formato: png
Raccolta Elaborata su norma Licenza ISO
[box-note]Versioni precedenti:
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2012
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2015
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2017
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2018
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2020
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2021[/box-note]
Maggiori Info e acquisto Documento
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ISO 7010 2019 Amd 6 2022.zip |
13667 kB | 137 | ||
| ISO 7010 2019 Amd 5 2022.zip Certifico Srl - Ed. 9.0 Gennaio 2022 |
18280 kB | 115 |
RAPEX Report 02 del 14/01/2022 N. 16 A12/00080/22 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 02 del 14/01/2022 N. 16 A12/00080/22 Svezia
Approfondimento tecnico: Seggiolone per bambini
Il prodotto, di marca Roba, mod. 10018118. 10018119, 10018121, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 14988:2020 “Seggioloni per bambini - Requisiti e metodi di prova”.
Il prodotto ha solo un fermo inguinale sulla cintura, non tra il sedile e la barra. Di conseguenza, se la cintura di sicurezza non viene utilizzata, il bambino potrebbe scivolare attraverso l'apertura, tra la barra e il sedile, cadendo o rimanendo intrappolato con il torace, la testa o il collo, con il rischio di strangolamento o intrappolamento o altre lesioni.
La norma EN 14988:2020 “Seggioloni per bambini - Requisiti e metodi di prova” stabilisce che i prodotti con almeno un elemento orizzontale posto di fronte al bambino, ad esempio una barra o un vassoio, devono disporre di un sistema di ritenuta inguinale passivo, a meno che l’apertura tra l’elemento orizzontale e il sedile non consenta il passaggio della sonda per testa di grandi dimensioni quando questa viene spinta lungo l’asse della maniglia con una forza maggiore di 5 N.
Questo sistema di ritenuta inguinale passivo supplementare non deve permettere alla sonda per gambe di passare da un’apertura all’altra quando la sonda viene spostata lungo il perimetro dell’apertura per gambe, mantenendo l’asse principale perpendicolare all’apertura per gambe, per simulare il movimento della gamba di un bambino seduto nel seggiolone. Durante la prova è necessario verificare se la sonda per gambe può passare con una forza di 5 N da una apertura per gambe all’altra.
Dimensioni in mm
Legenda
1 Maniglia
Figura 1 – Sonda testa di grandi dimensioni
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 02 del 14_01_2022 N. 16 A12_00080_22 Svezia.pdf Seggiolone per bambini |
392 kB | 0 |
RAPEX Report 01 del 07/01/2022 N. 09 A11/00004/22 Lussemburgo

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 01 del 07/01/2022 N. 09 A11/00004/22 Lussemburgo
Approfondimento tecnico: Pneumatico da moto
Il prodotto, di marca DUNLOP, è stato sottoposto alla procedura richiamo presso i consumatori perché non conforme Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti.
A causa di una modifica al processo produttivo, alcuni pneumatici presentano dei difetti che potrebbero causare la caduta del pilota della moto.
Direttiva 2001/95/CE
Articolo 3
1. I produttori sono tenuti ad immettere sul mercato soltanto prodotti sicuri.
2. Un prodotto è considerato sicuro, per quanto concerne gli aspetti disciplinati dalla pertinente normativa nazionale, quando in mancanza di disposizioni comunitarie specifiche che ne disciplinano la sicurezza, è conforme alle normative nazionali specifiche dello Stato membro nel cui territorio è commercializzato, che sono stabilite nel rispetto del trattato, in particolare degli articoli 28 e 30, e che fissano i requisiti cui deve rispondere il prodotto sul piano sanitario e della sicurezza per poter essere commercializzato.
Si presume che un prodotto sia sicuro, per quanto concerne i rischi e le categorie di rischi disciplinati dalla pertinente normativa nazionale, quando è conforme alle norme nazionali non cogenti che recepiscono le norme europee, i cui riferimenti sono stati pubblicati dalla Commissione nella Gazzetta ufficiale delle Comunità europee a norma dell'articolo 4. Gli Stati membri pubblicano i riferimenti di tali norme nazionali.
3. In circostanze diverse da quelle di cui al paragrafo 2, si valuta la conformità di un prodotto all'obbligo generale di sicurezza tenendo conto in particolare, se esistono, dei seguenti elementi:
a) norme nazionali non cogenti che recepiscono norme europee pertinenti diverse da quelle di cui al paragrafo 2;
b) norme in vigore nello Stato membro in cui il prodotto è commercializzato;
c) raccomandazioni della Commissione relative ad orientamenti sulla valutazione della sicurezza dei prodotti;
d) codici di buona condotta in materia di sicurezza dei prodotti vigenti nel settore interessato;
e) ultimi ritrovati della tecnica;
f) sicurezza che i consumatori possono ragionevolmente attendere.
4. La conformità di un prodotto ai criteri volti a garantire l'obbligo generale di sicurezza, in particolare alle disposizioni di cui ai paragrafi 2 o 3 non vieta alle autorità competenti degli Stati membri di adottare le opportune misure per limitarne l'immissione sul mercato o chiederne il ritiro dal mercato o il richiamo qualora, nonostante tale conformità, il prodotto si riveli pericoloso.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 01 del 07_01_2022 N. 09 A11_00004_22 Lussemburgo.pdf Pneumatico da moto |
380 kB | 0 |
Regolamento delegato (UE) 2022/30
Regolamento delegato (UE) 2022/30 / Applicazione Requisiti essenziali direttiva RED / Testo consolidato 10.2023
Regolamento delegato (UE) 2022/30 della Commissione del 29 ottobre 2021 che integra la direttiva 2014/53/UE del Parlamento europeo e del Consiglio per quanto riguarda l’applicazione dei requisiti essenziali di cui all’articolo 3, paragrafo 3, lettere d), e) ed f), di tale direttiva.
(GU L 7/6 del 12.1.2022)
Entrata in vigore: 11.02.2022
Applicazione dal 1° agosto 2025
________
Modifiche:
- Regolamento delegato (UE) 2023/2444 (GU L 2023/2444 del 27.10.2023) [Testo consolidato 27 ottobre 2023]
________
Articolo 1
1. Il requisito essenziale di cui all’articolo 3, paragrafo 3, lettera d), della direttiva 2014/53/UE si applica a qualsiasi apparecchiatura radio che può di per sé comunicare tramite Internet, sia direttamente sia tramite qualsiasi altra apparecchiatura («apparecchiature radio connesse a Internet»).
2. Il requisito essenziale di cui all’articolo 3, paragrafo 3, lettera e), della direttiva 2014/53/UE si applica a una qualsiasi delle seguenti apparecchiature radio, se queste ultime possono effettuare il trattamento, ai sensi dell’articolo 4, punto 2, del regolamento (UE) 2016/679, di dati personali quali definiti all’articolo 4, punto 1, del regolamento (UE) 2016/679, o di dati relativi al traffico e dati relativi all’ubicazione, quali definiti all’articolo 2, lettere b) e c), della direttiva 2002/58/CE:
a) apparecchiature radio connesse a Internet, diverse dalle apparecchiature di cui alle lettere b), c) o d);
b) apparecchiature radio progettate o destinate esclusivamente alla cura dei bambini;
c) apparecchiature radio disciplinate dalla direttiva 2009/48/CE;
d) apparecchiature radio progettate o destinate, esclusivamente o non esclusivamente, ad essere indossate oppure ad essere assicurate o appese:
i) a qualsiasi parte del corpo umano, compresi la testa, il collo, il tronco, le braccia, le mani, le gambe e i piedi;
ii) a qualsiasi indumento, compresi copricapi, guanti e calzature, indossato da esseri umani.
3. Il requisito essenziale di cui all’articolo 3, paragrafo 3, lettera f), della direttiva 2014/53/UE si applica a qualsiasi apparecchiatura radio connessa a Internet, se tale apparecchiatura consente al detentore o all’utente di trasferire denaro, valore monetario o valuta virtuale quale definita all’articolo 2, lettera d), della direttiva (UE) 2019/713.
Articolo 2
1. In deroga all’articolo 1, i requisiti essenziali di cui all’articolo 3, paragrafo 3, lettere d), e) ed f), della direttiva 2014/53/UE non si applicano alle apparecchiature radio alle quali si applica anche una delle seguenti normative dell’Unione:
a) il regolamento (UE) 2017/745;
b) il regolamento (UE) 2017/746.
2. In deroga all’articolo 1, paragrafi 2 e 3, i requisiti essenziali di cui all’articolo 3, paragrafo 3, lettere e) ed f), della direttiva 2014/53/UE non si applicano alle apparecchiature radio alle quali si applica anche una delle seguenti normative dell’Unione:
a) il regolamento (UE) 2018/1139;
b) il regolamento (UE) 2019/2144;
c) la direttiva (UE) 2019/520.
Articolo 3
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 1° agosto 2025 (*).
...
(*) Data di applicazione modificata dal Regolamento delegato (UE) 2023/2444
...
Collegati
[box-note]Nuova Direttiva R&TTE 2014/53/UE (Direttiva RED)
Guidance on Article 10 (10) of RED (Directive 2014/53/EU)
Norme armonizzate Apparecchiature Radio Direttiva 2014/53/UE (RED)[/box-note]
RAPEX: Report annuale Certifico 2021
RAPEX: Report annuale Certifico 2021
Tutti gli Approfondimenti relativi al RAPEX di Certifico elaborati nel 2021:
Vedi tutti i Report pubblicati Certifico 2021
RAPEX: Rapid Alert System for non-food consumer products
Archivio prodotti pericolosi
Creato nel 1984, il RAPEX (Rapid Alert System for non-food consumer products) ha la funzione di prevenire i rischi per la salute e sicurezza dei consumatori relativa a prodotti non alimentari in commercio, con uno scambio rapido di informazioni tra gli Stati membri dell'UE.
Il sistema consente alle autorità nazionali di notificare alla Commissione la presenza sul mercato europeo di un prodotto non alimentare pericoloso, la cui vendita, una volta pervenuta la segnalazione a livello europeo, sarà vietata o condizionata.
| N. |
DATA |
PRODOTTO |
CODICE |
NON CONFORMITÀ |
|
1 |
08-01-2021 |
12 |
||
|
2 |
15-01-2021 |
09 |
||
|
3 |
22-01-2021 |
34 |
||
|
4 |
29-01-2021 |
15 |
||
|
5 |
05-02-2021 |
02 |
Direttiva 2014/35/UE, EN 60598-1:2015 |
|
|
6 |
12-02-2021 |
01 |
EN 1335-2:2018 |
|
|
7 |
19-02-2021 |
13 |
||
|
8 |
26-02-2021 |
46 |
||
|
9 |
05-03-2021 |
04 |
||
|
10 |
12-03-2021 |
01 |
||
|
11 |
19-03-2021 |
06 |
||
|
12 |
26-03-2021 |
06 |
||
|
13 |
02-04-2021 |
07 |
||
|
14 |
09-04-2021 |
01 |
EN 14682:2015 |
|
|
15 |
16-04-2021 |
02 |
||
|
16 |
23-04-2021 |
20 |
||
|
17 |
30-04-2021 |
06 |
||
|
18 |
07-05-2021 |
10 |
||
|
19 |
14-05-2021 |
03 |
||
|
20 |
21-05-2021 |
01 |
||
|
21 |
28-05-2021 |
22 |
Direttiva 2009/48/CE, EN 71-12:2017 |
|
|
22 |
04-06-2021 |
17 |
||
|
23 |
11-06-2021 |
12 |
||
|
24 |
18-06-2021 |
09 |
||
|
25 |
25-06-2021 |
14 |
Direttiva 2014/35/UE, EN 60598-1:2015 |
|
|
26 |
02-07-2021 |
08 |
||
|
27 |
09-07-2021 |
17 |
Direttiva 2001/95/CE, EN 14682:2015 |
|
|
28 |
16-07-2021 |
17 |
||
|
29 |
23-07-2021 |
10 |
Direttiva 2013/29/UE, EN 16263-2:2015 |
|
|
30 |
30-07-2021 |
01 |
Direttiva 2009/48/CE, EN 71-2:2020 |
|
|
31 |
06-08-2021 |
01 |
||
|
32 |
13-08-2021 |
02 |
||
|
33 |
20-08-2021 |
04 |
||
|
34 |
27-08-2021 |
27 |
||
|
35 |
03-09-2021 |
03 |
||
|
36 |
10-09-2021 |
06 |
Direttiva 2001/95/CE, EN 14682:2015 |
|
|
37 |
17-09-2021 |
13 |
Direttiva 2001/95/CE, EN 13869:2016 |
|
|
38 |
24-09-2021 |
04 |
||
|
39 |
01-10-2021 |
05 |
||
|
40 |
08-10-2021 |
03 |
||
|
41 |
15-10-2021 |
01 |
||
|
42 |
22-10-2021 |
07 |
||
|
43 |
29-10-2021 |
21 |
||
|
44 |
05-11-2021 |
04 |
||
|
45 |
12-11-2021 |
08 |
||
|
46 |
19-11-2021 |
01 |
||
|
47 |
26-11-2021 |
16 |
||
|
48 |
03-12-2021 |
19 |
||
|
49 |
10-12-2021 |
34 |
||
|
50 |
17-12-2021 |
41 |
||
|
51 |
24-12-2021 |
03 |
Direttiva 2006/42/CE, EN 1494:2000+A1:2008 |
RAPEX Safety Gate - Most recent alerts
Resp.: Giuseppe Zappia
Collegati
[box-note]RAPEX 2021
Codice del Consumo
Direttiva 2001/95/CE Sicurezza Generale Prodotti
Decreto Legislativo 21 maggio 2004, n.172
Evoluzione Direttiva 2001/95/CE (DSGP): Il nuovo pacchetto "sicurezza dei prodotti e vigilanza del mercato"[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Rapex Report Certifico 2021.pdf Certifico Srl - 2021 |
510 kB | 1 |
RAPEX Report 50 del 17/12/2021 N. 41 A12/01765/21 Cipro

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 50 del 17/12/2021 N. 41 A12/01765/21 Cipro
Approfondimento tecnico: Giocattolo musicale
Il prodotto, di marca YI BAO KINGDOM, mod. 6666 / 3328, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2014+A1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
La ruota del giocattolo si può rimuovere facilmente. Di conseguenza, il bambino mettendola in bocca potrebbe soffocare.
La Direttiva 2009/48/CE, all’Allegato II, Requisiti Particolari di Sicurezza, stabilisce che:
4. […]
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili. […]
Inoltre, in accordo alla norma tecnica EN 71-1:2014+A1:2018, ogni giocattolo o suo componente deve superare la prova del cilindro per le piccole parti (Rif. paragrafo 8.2).
Ogni giocattolo o componente non deve entrare completamente nel cilindro di prova previsto dalla norma.
Figura 1 - Cilindro di prova
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 50 del 17_12_2021 N. 41 A12_01765_21 Cipro.pdf Giocattolo musicale |
398 kB | 0 |
Decreto Legislativo 25 novembre 1996 n. 626
Decreto Legislativo 25 novembre 1996 n. 626
Attuazione della direttiva 93/68/CEE in materia di marcatura CE del materiale elettrico destinato ad essere utilizzato entro taluni limiti di tensione.
Entrata in vigore: 29/12/1996
(GU n.293 del 14.12.1996 - S.O. n. 219)
Abrogato da: Decreto Legislativo 19 maggio 2016 n. 86
Collegati
[box-note]Direttiva 93/68/CEE
Decreto Legislativo 86/2016 Bassa Tensione[/box-note]
RAPEX Report 49 del 10/12/2021 N. 34 A12/01705/21 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 49 del 10/12/2021 N. 34 A12/01705/21 Finlandia
Approfondimento tecnico: Peluche con ventosa
Il prodotto, di marca sconosciuta, mod. m7, è stato respinto durante l’importazione perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
La ventosa del giocattolo contiene una quantità eccessiva di Bis(2-etilesil) ftalato (DEHP) e Dibutil Ftalato (DBP) (valori misurati fino a 6% e 0,032% in peso, rispettivamente).
Regolamento (CE) n .1907/2006
Allegato XVII | Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. Bis(2-etilesil) ftalato (DEHP) | Dibutilftalato (DBP) | Benzilbutilftalato (BBP) | Diisobutilftalato (DIBP)
1. Non possono essere utilizzati nei giocattoli e negli articoli di puericultura, come sostanze o in miscele, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
2. Non possono essere immessi sul mercato nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
Inoltre, il DIBP non può essere immesso sul mercato dopo il 7 luglio 2020 nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
3. Non possono essere immessi sul mercato dopo il 7 luglio 2020 in articoli, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato contenuto nell'articolo. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 49 del 10_12_2021 N. 34 A12_01705_21 Finlandia.pdf Peluche con ventosa |
369 kB | 0 |
Guide to application of the Regulation (EU) 2016/424 on cableway installations
Guide to application of the Regulation (EU) 2016/424 on cableway installations / Ed. 1.2 November 2024
ID 15194 | Update 28.11.2024 - Ed. 1.2 November 2024
- Edition 1.2 - November 2024
- Edition 1.1 - December 2023 (published May 2024)
- Edition 1.0 - December 2021
...
On 27 March 2014, the Commission presented a draft Proposal for a Regulation of the European Parliament and of the Council relating to cableway installations in order to replace Directive 2000/9/EC.
Regulation (EU) 2016/424, of the European Parliament and of the Council of 9 March 2016 on cableway installations (hereinafter “the Regulation”) was published in the Official Journal of the European Union of 31 March 2016 and entered into force on the 20th day following this publication, i.e. on 21 March 2016.
The Regulation is fully applicable since 21 April 2018, with the exception of Articles 22 to 38, on notification of conformity assessment bodies, and of Article 44, on Committee procedure, which apply since October 2016. In addition, Article 45(1) on penalties applies since 21 March 2018. The Regulation repeals Directive 2000/9/EC.
The Guide is intended to provide a reference source for both economic operators and the competent regulatory authorities but does not replace or amend the Regulation, which remains the sole binding legal instrument.
The information addressed to the 27 EU Member States in this Guide also applies to Iceland, Liechtenstein and Norway as signatories to the agreement on the European Economic Area (EEA). Other countries applying Regulation (EU) 2016/424 are Switzerland, Turkey and Andorra. The extension of the single market ensures that its member countries and their economic operators have the same rights and obligations as their EU counterparts.
______
TABLE OF CONTENTS
1. FOREWORD
2. OBJECTIVES OF THE REGULATION
3. PROVISIONS OF THE REGULATION
CHAPTER I
General provisions
Article 1 Subject matter
Article 2 Scope
Article 3 Definitions
Article 4 Making available on the market of subsystems and safety components
Article 5 Entry into service of cableway installations
Article 6 Essential requirements
Article 7 Free movement of subsystems and safety components
Article 8 Safety analysis and safety report for planned cableway installations
Article 9 Authorisation of cableway installations
Article 10 Operation of cableway installations
CHAPTER II
Obligations of economic operators
Article 11 Obligations of manufacturers
Article 12 Authorised representatives
Article 13 Obligations of importers
Article 14 Obligations of distributors
Article 15 Cases in which obligations of manufacturers apply to importers and distributors
Article 16 Identification of economic operators
CHAPTER III Conformity of subsystems and safety components
Article 17 Presumption of conformity of subsystems and safety components
Article 18 Conformity assessment procedures
Article 19 EU declaration of conformity
Article 20 General principles of the CE marking
Article 21 Rules and conditions for affixing the CE marking
CHAPTER IV Notification of conformity assessment bodies
Article 22 Notification
Article 23 Notifying authorities
Article 24 Requirements relating to notifying authorities
Article 25 Information obligation on notifying authorities
Article 26 Requirements relating to notified bodies
Article 27 Presumption of conformity of notified bodies
Article 28 Subsidiaries of and subcontracting by notified bodies
Article 29 Application for notification
Article 30 Notification procedure
Article 31 Identification numbers and lists of notified bodies
Article 32 Changes to notifications
Article 33 Challenge of the competence of notified bodies
Article 34 Operational obligations of notified bodies
Article 35 Appeal against decisions of notified bodies
Article 36 Information obligation on notified bodies
Article 37 Exchange of experience
Article 38 Coordination of notified bodies
Chapter V Union market surveillance, control of subsystems and safety components
Article 39 Union market surveillance and control of subsystems and safety components entering the Union market
Article 40 Procedure at national level for dealing with subsystems or safety components presenting a risk
Article 41 Union safeguard procedure
Article 42 Compliant subsystems or safety components which present a risk
Article 43 Formal non-compliance
Chapter VI Committee procedure, transitional and final provisions
Article 44 Committee procedure
Article 45 Penalties
Article 46 Transitional provisions
Article 47 Repeal
Article 48 Entry into force and application
4. ANNEXES
Annex I Subsystems
Annex II Essential requirements
Annex III Conformity assessment for subsystems and safety components: Module B: EU type examination– Production type
Annex IV Conformity assessment for subsystems and safety components: Module D: Conformity to type based on quality assurance of the production process
Annex V Conformity assessment for subsystems and safety components: Module F: Conformity to type based on subsystem or safety component verification
Annex VI Conformity assessment for subsystems and safety components: Module G: Conformity based on
Unit verification
Annex VII Conformity assessment for subsystems and safety components: Module H1: Conformity based on full quality assurance plus design examination
Annex VIII: Technical documentation for subsystems and safety components
Annex IX EU Declaration of conformity for subsystems and safety components
Fonte: EC
Collegati
[box-note]Regolamento (UE) 2016/424 - Impianti a fune | Testo consolidato e NTA
Norme armonizzate Regolamento (UE) 2016/424 Impianti a fune
Regolamento (UE) 2016/424: Impianti a fune
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guide to application of the Regulation (EU) 2016 424 on cableway installations Ed. 1.2 2024.pdf Ed. 1.2 November 2024 |
719 kB | 6 | ||
| Guide to application of the Regulation (EU) 2016 424 on cableway installations Ed. 1.1 2023.pdf Ed. 1.1 December 2023 |
722 kB | 1 | ||
| Guide to application of the Regulation EU 2016 424 on cableway installations.pdf Ed. 1.0 December 2021 |
1263 kB | 9 |
RAPEX Report 47 del 26/11/2021 N. 16 A12/01623/21 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 47 del 26/11/2021 N. 16 A12/01623/21 Svezia
Approfondimento tecnico: Striscia luminosa led
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2011/65/UE del Parlamento e del Consiglio dell’8 giugno 2011 sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche - RoHS III.
Le saldature nel connettore USB e nel telecomando contengono una quantità eccessiva di piombo (valore misurato rispettivamente fino al 29,2% e 37,2% in peso). Il piombo è pericoloso per l'ambiente.
Direttiva 2011/65/UE
Articolo 4 – Prevenzione
1. Gli Stati membri provvedono affinché le AEE immesse sul mercato, compresi i cavi e i pezzi di ricambio destinati alla loro riparazione, al loro riutilizzo, all’aggiornamento delle loro funzionalità o al potenziamento della loro capacità, non contengano le sostanze di cui all’allegato II.
Allegato II
Sostanze con restrizioni d’uso di cui all’articolo 4, paragrafo 1, e valori delle concentrazioni massime tollerate per peso nei materiali omogenei:
- Piombo (0,1 %)
- Mercurio (0,1 %)
- Cadmio (0,01 %)
- Cromo esavalente (0,1 %)
- Bifenili polibromurati (PBB) (0,1 %)
- Ftalato di bis(2-etilesile) (DEHP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863 | ROHS III
- Benzilbutilftalato (BBP) (0,1%) | Aggiunta da Direttiva Delegata delegata (UE) 2015/863 | ROHS III
- Dibutilftalato (DBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863 | ROHS III
- Diisobutilftalato (DIBP) (0,1%) | New RoHS III | Aggiunta da Direttiva delegata (UE) 2015/863 | ROHS III
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 47 del 26_11_2021 N. 16 A12_01623_21 Svezia.pdf Striscia luminosa led |
371 kB | 2 |
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2021 / Dicembre 2021
Norme armonizzate Click | Marzo 2021 / Dicembre 2021
ID 15111 | 16.12.2021 / Documento allegato
I testi consolidati dell'elenco delle norme armonizzate per Direttiva / Regolamento UE pubblicate Marzo 2021 / Dicembre 2021.
Download Norme armonizzate Click Marzo 2021 - Dicembre 2021
Come consultare i riferimenti delle norme armonizzate 2019/2021.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi delle Direttive nuovo approccio UE devono essere letti in relazione alle pubblicazioni precedenti.
Per facilitare la consultazione sono stati realizzati dei "testi consolidati" che saranno aggiornati nel tempo, dove sono riporti l'elenco dei titoli delle norme armonizzate pubblicate per Direttiva/Regolamento UE.
I testi consolidati Giugno 2021 / Dicembre 2021:
Direttiva Imbarcazioni da diporto

15 Ottobre 2021
Direttiva Macchine

12 Ottobre 2021
Norme armonizzate Direttiva PED
Norme armonizzate Direttiva RED
Regolamento Dispositivi medici (MD)

16 Marzo 2021
Direttiva EMC
Collegati
[box-note]Norme armonizzate Click
Direttiva click
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Agosto 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Settembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Ottobre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Novembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Gennaio 2020 / Luglio 2020[/box-note]
Regolamento delegato (UE) 2021/2088
Regolamento delegato (UE) 2021/2088
Regolamento delegato (UE) 2021/2088 della Commissione del 7 luglio 2021 che modifica gli allegati II, III e IV del regolamento (UE) 2019/1009 del Parlamento europeo e del Consiglio al fine di aggiungere i materiali di pirolisi e gassificazione come categoria di materiali costituenti nei prodotti fertilizzanti dell’UE
GU L 427/140 del 30.11.2021
Entrata in vigore: 20.12.2021
Applicazione dal 16 luglio 2022
_________
Articolo 1
Il regolamento (UE) 2019/1009 è così modificato:
1) l’allegato II è modificato conformemente all’allegato I del presente regolamento;
2) l’allegato III è modificato conformemente all’allegato II del presente regolamento;
3) l’allegato IV è modificato conformemente all’allegato III del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 16 luglio 2022.
...
Collegati
[box-note]Regolamento (UE) 2019/1009
FAQs related to Regulation (EU) 2019/1009[/box-note]
RAPEX: Prodotti con emissioni continue di radiazioni ionizzanti
RAPEX: Prodotti con emissioni continue di radiazioni ionizzanti
ID 15734 | 11.02.2022 / Schede RAPEX prodotti allegate
Con il Report n. 01 pubblicato in data 07 Gennaio 2022, il Sistema di Allerta Europeo RAPEX (Sistema comunitario di informazione rapida sui prodotti non alimentari) ha vietato la commercializzazione e la vendita – anche on line - di accessori (braccialetti, pendenti, ecc.) che contengono materiale radioattivo, con emissione continua di radiazioni ionizzanti.
Si tratta di articoli al cui interno sono stati inseriti radionuclidi di origine naturale per la produzione di ioni negativi, fattispecie espressamente vietata ai sensi dell’articolo 39 del d.lgs. 101/2020 e sanzionabile penalmente secondo quanto previsto all’articolo 207, comma 3, dello stesso provvedimento.
[panel]Art. 39. Divieto di pratiche D.Lgs. 101/2020 (Direttiva 2013/59/EURATOM, articoli 20 e 21; decreto legislativo 17 marzo 1995, n. 230, articolo 98).
1. È vietata l’aggiunta intenzionale di sostanze radioattive, direttamente o mediante attivazione, nella produzione di:
a) prodotti per l’igiene e cosmesi;
b) oggetti di uso domestico o personale;
c) giocattoli;
d) alimenti e bevande;
e) mangimi per animali;
f) dispositivi antifulmine.
2. Sono altresì vietati:
a) l’importazione, l’acquisizione tramite commercio elettronico, l’esportazione, il commercio, la distribuzione, l’impiego, la manipolazione dei prodotti di cui al comma 1 ai quali sono deliberatamente aggiunte materie radioattive, direttamente o mediante attivazione;
b) le pratiche implicanti l’attivazione di materiali che comportano un aumento dell’attività nei prodotti di consumo;
c) le pratiche che comportano l’attivazione di materiali usati nei giocattoli e negli oggetti d’uso personale, nonché l’importazione e l’esportazione di tali prodotti o materiali;
d) l’uso sulle persone di sorgenti di radiazioni ionizzanti che non è effettuato a scopo diagnostico, terapeutico o di ricerca scientifica clinica, salvo quanto disposto dall’articolo 169;
e) la produzione, l’importazione, l’impiego o comunque l’immissione sul mercato di apparati elettronici di visione a distanza o comunque idonei alla riproduzione elettronica di immagini, che emettono radiazioni ionizzanti a livelli superiori a quelli stabiliti con decreto del Ministro della salute, di concerto con i Ministri dello sviluppo economico e dell’ambiente e della tutela del territorio e del mare, sentito l’ISIN.[/panel]
[panel]Art. 207. Sanzioni penali relative al Titolo VI (Decreto Legislativo 17 marzo 1995, n. 230, articolo 136).
1. Chiunque pone in essere le attività di cui agli articoli 36, 38 e 43 in assenza dell’autorizzazione prevista o in violazione delle prescrizioni dettate nella stessa, è punito con l’arresto da sei mesi a due anni o con l’ammenda da euro 30.000,00 ad euro 50.000,00.
2. Chiunque omette la notifica prevista dagli articoli 37 e 46, nonché la denuncia prevista dall’articolo 44, comma 1, è punito con l’arresto da tre mesi ad un anno o con l’ammenda da euro 10.000,00 ad euro 20.000,00.
3. Chiunque pone in essere le condotte vietate dagli articoli 38, comma 7, e 39, commi 1 e 2, è punito con l’arresto da uno a tre anni e con l’ammenda da euro 20.000,00 ad euro 100.000,00.
4. Chiunque non ottempera agli obblighi di informazione di cui all’articolo 41, con le modalità in esso indicate, oppure omette di dare la comunicazione di cui all’articolo 45, comma 1, è punito con l’arresto da quindici giorni a due mesi o con l’ammenda da euro 5.000,00 ad euro 10.000,00.
5. La prosecuzione delle attività dopo la sospensione o la revoca dei provvedimenti autorizzatori è punita con le pene previste per lo svolgimento dell’attività in assenza dei prescritti titoli autorizzatori.[/panel]
Alcuni di questi articoli sono ingannevolmente pubblicizzati come “anti 5G”, o come oggetti dagli “effetti energetici”. I campi elettromagnetici a radiofrequenza (il “5G”) sono classificati dallo IARC nel gruppo 2B degli agenti cancerogeni, ovvero come possibilmente cancerogeni per gli esseri umani (vale a dire che la cancerogenicità è solo ipotizzata ma non dimostrata), mentre tutte le radiazioni ionizzanti sono classificate nel gruppo I degli agenti cancerogeni, e cioè nelle sostanze dove c’è evidenza e certezza di cancerogenicità per l’uomo. Inoltre non è dimostrato nessun effetto energetico da parte degli ioni negativi. Ciò che rende ancor più preoccupante il commercio di questi articoli è che tra di essi ce n'è uno espressamente destinato ai bambini.
I livelli di radiazioni riscontrati su questi specifici prodotti sono bassi e quindi il rischio per la salute potrebbe essere legato principalmente ad un uso continuo e ad un contatto diretto con la pelle. Chi li indossa per un periodo prolungato potrebbe comunque essere esposto ad un livello di radiazioni superiore al limite di esposizione della pelle per il pubblico in vigore in Italia (art.146, comma 7, d.lgs. 101/2020).
[panel]Art. 146. Limiti di dose D.Lgs. 101/2020 (Direttiva 2013/59/EURATOM, articoli 9, 10, 11; decreto legislativo 17 marzo 1995, n. 230, articolo 96).
1. I limiti di dose per i lavoratori esposti sono stabiliti in:
a) 20 mSv dose efficace in un anno solare;
b) fermo restando il rispetto del limite di dose efficace di cui alla lettera a), sono stabiliti i seguenti limiti di dose equivalente in un anno solare:
1) 20 mSv per il cristallino;
2) 500 mSv per la pelle; tale limite si applica alla dose media, su qualsiasi superficie di 1 cm2, indipendentemente dalla superficie esposta;
3) 500 mSv per le estremità.
2. I limiti di dose per gli apprendisti e per gli studenti di cui all’articolo 120, comma 1, sono stabiliti, in relazione alla suddivisione dei medesimi in ragione dell’età e del tipo di attività lavorativa o di studio, nel modo seguente:
a) per gli apprendisti e studenti di cui all’articolo 120, comma 1, lettera a) i limiti di dose efficace e di dose equivalente per particolari organi o tessuti, sono uguali ai limiti fissati per i lavoratori esposti di cui al comma 1;
b) per gli apprendisti e studenti di cui all’articolo 120, comma 1, lettera b), i limiti di esposizione sono stabiliti in:
1) 6 mSv di dose efficace per anno solare;
2) fermo restando il rispetto del limite di dose efficace di cui alla lettera a), sono stabiliti i seguenti limiti di dose equivalente in un anno solare:
2.1) 15 mSv per il cristallino;
2.2) 150 mSv per la pelle; tale limite si applica alla dose media, su qualsiasi superficie di 1 cm2 indipendentemente dalla superficie esposta;
2.3) 150 mSv per le estremità;
c) per gli apprendisti e gli studenti di cui all’articolo 120, comma 1, lettere c) e d) i limiti annuali di dose efficace nonché di dose equivalente per particolari organi o tessuti sono uguali alla metà di quelli stabiliti al comma 7, per gli individui della popolazione; per detti soggetti, inoltre, la dose ricevuta per ogni singola esposizione correlata alla loro attività non può superare un ventesimo dei limiti annuali di cui allo stesso comma 7.
3. Qualora per i lavoratori esposti e per gli apprendisti e gli studenti ad essi equiparati ai sensi del comma 2, lettera a), sia superato, anche a seguito di esposizioni accidentali, di emergenza o esposizioni soggette ad autorizzazione speciale di cui al paragrafo 5 dell’Allegato XXII stesso, il limite annuale di dose efficace di 20 mSv di cui al comma 1, le successive esposizioni devono essere limitate, per anno solare, a 10 mSv sino a quando la media annuale delle esposizioni stesse per tutti gli anni seguenti, compreso l’anno del superamento, risulti non superiore a 20 mSv.
4. L’obbligo della sorveglianza sanitaria eccezionale previsto dall’articolo 141 sussiste per i lavoratori esposti, gli apprendisti e gli studenti che, nel corso delle loro attività lavorative o di studio, abbiano ricevuto, in un anno solare:
a) una dose superiore al limite di 20 mSv fissato al comma 1, lettera a) per la dose efficace, determinata in base alle indicazioni di cui al comma 3, oppure
b) una dose maggiore di uno dei limiti fissati nel comma 1, lettera b) per particolari organi o tessuti.
5. L’obbligo di comunicazione di cui all’articolo 142 sussiste ove si sia verificata anche una delle condizioni di cui al comma 4.
6. I limiti di dose per i lavoratori che, in relazione alle proprie occupazioni, sono considerati, ai sensi dell’articolo 133, comma 2, lavoratori non esposti, nonché per i lavoratori autonomi e dipendenti da terzi, di cui all’articolo 117, sono, con riferimento all’attività lavorativa di tali soggetti, pari ai corrispondenti limiti fissati nel comma 7, per gli individui della popolazione.
7. I limiti di esposizione per gli individui della popolazione sono stabiliti in:
a) 1 mSv di dose efficace per anno solare;
b) fermo restando il rispetto del limite di dose efficace di cui alla lettera a), sono stabiliti i seguenti limiti di dose equivalente in un anno solare:
1) 15 mSv per il cristallino;
2) 50 mSv per la pelle, calcolato in media su 1 cm2 di pelle, indipendentemente dalla superficie esposta.
8. Con decreto del Presidente del Consiglio dei ministri, su proposta dei Ministri dell’ambiente e della tutela del territorio e del mare e della salute, di concerto con il Ministro del lavoro e delle politiche sociali e del Dipartimento della protezione civile della Presidenza del Consiglio dei ministri, sentiti l’ISIN, l’INL, l’ISS e l’INAIL, sono stabiliti, con riferimento alle diverse modalità di classificazione di cui all’articolo 133:
a) le specifiche grandezze radioprotezionistiche, come mezzo per garantire l’osservanza dei limiti di dose, con i relativi criteri di utilizzo, anche per i casi di esposizione esterna e interna concomitante;
b) particolari casi per i quali non si applicano i limiti di dose;
c) metodi di valutazione delle dosi per lavoratori, apprendisti, studenti e individui della popolazione;
d) i valori di concentrazione di radionuclidi nelle acque di miniera ai fini dell’articolo 23, comma 1.
e) l’aggiornamento dei coefficienti di dose efficace impegnata per unità di introduzione secondo le indicazioni fornite dall’Unione europea.
9. Nelle more dell’adozione del decreto di cui al comma 8, si applicano le disposizioni dell’Allegato XXIV.[/panel]
I prodotti non sono conformi ai requisiti della Direttiva sulle norme fondamentali di sicurezza per la protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti (Direttiva 2013/59/EURATOM del Consiglio, del 5 dicembre 2013, che stabilisce norme fondamentali di sicurezza relative alla protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti, e che abroga le direttive 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom e 2003/122/Euratom).
Per evitare ogni rischio, si raccomanda agli eventuali possessori di tali accessori di non indossarli; sono stati già allertati i NAS, si sta provvedendo ai relativi avvisi di divieto di vendita rivolti agli importatori e ai siti internet che li commercializzano; questi articoli non possono neppure essere disseminati nell’ambiente: dovrebbero infatti essere conferiti a un soggetto autorizzato allo smaltimento, secondo le procedure dell’art. 204, commi 4 e 5, del d.lgs. 101/2020.
[panel]Art. 204. Rinvenimento di materiale radioattivo D.Lgs. 101/2020 (Direttiva 2013/59/EURATOM, articolo 94; decreto legislativo 17 marzo 1995, n. 230, articolo 126-bis).
1. Il presente articolo si applica alle situazioni di esposizione esistente di cui all’articolo 198, comma 1, lettera b) ovvero a situazioni di rinvenimento di materiale radioattivo non altrove disciplinato dal presente decreto.
2. Ferme restando le disposizioni degli articoli 45 e 202, comma 4, nel caso in cui l’origine dei materiali radioattivi sia riconducibile a una pratica, i suddetti materiali non sono soggetti al regime autorizzatorio del presente decreto e possono essere allontanati se la concentrazione di attività rispetta i valori stabiliti nell’Allegato I. Nei casi di superamento di tali valori, la medesima condizione ricorre se viene dimostrato il rispetto del criterio di non rilevanza radiologica di cui
all’Allegato I.
3. Ferme restando le disposizioni degli articoli 26 e 202, comma 4, nel caso in cui i materiali radioattivi contengano radionuclidi di origine naturale e non sono stati utilizzati per le loro proprietà radioattive, fissili o fertili, non sono soggetti al regime autorizzatorio del presente decreto e sono allontanati se hanno concentrazioni di attività minori o uguali ai valori stabiliti nell’Allegato II ovvero, in caso di superamento di detti valori, sia rispettato il livello di esenzione di dose efficace per l’individuo rappresentativo di cui all’Allegato II.
4. Il soggetto responsabile dell’attività all’interno della quale avviene il rinvenimento del materiale radioattivo verifica le condizioni di cui ai commi 2 e 3 avvalendosi dell’esperto di radioprotezione. Negli altri casi di rinvenimento tale onere è a carico dell’ARPA/APPA per le funzioni tecniche e di valutazione della dose.
5. Il soggetto di cui al comma 4 è tenuto a comunicare preventivamente al Prefetto e agli organi di vigilanza competenti per territorio l’allontanamento del materiale radioattivo che soddisfa i criteri di cui ai commi 2 e 3.
6. Nei casi in cui il materiale radioattivo che non soddisfa le condizioni di cui ai commi 2 e 3 è introdotto nel territorio nazionale da soggetti con sede o stabile organizzazione fuori dal territorio italiano, anche appartenenti a Stati membri dell’Unione europea, il Prefetto adotta, valutate le circostanze del caso e in relazione alle necessità di tutela della popolazione dai rischi di esposizione e di tutela dell’ambiente, i provvedimenti opportuni ivi compreso il rinvio del materiale
radioattivo o il respingimento dell’intero carico o di parte di esso al soggetto responsabile dell’invio del carico stesso in Italia. Il soggetto estero è responsabile anche per quanto riguarda gli oneri inerenti il rinvio del materiale radioattivo o del carico medesimo. Il Prefetto, con la collaborazione dell’ISIN, avvisa il Ministero degli affari esteri e della cooperazione internazionale, che provvede a informare, della restituzione del materiale radioattivo o del carico alla competente autorità dello Stato responsabile dell’invio.[/panel]
Elenco prodotti
1. Alert number: A11/00129/21
Type / number of model:
Magenetix Kids bracelet, 4720iM
Magnetix Sillicone bracelet Xl, 4708iXL
Magnetix sportboost bracelet, 470
Brand: Magnetix
2. Alert number: A11/00128/21
Type / number of model:
4657iXL
Brand: Magnetix
3. Alert number: A11/00127/21
Type / number of model:
736211735560
Brand: Energy Armor
4. Alert number: A11/00126/21
Type / number of model:
609132886690
Brand: Energy Armor
5. Alert number: A11/00124/21
Type / number of model:
609132886690
Brand: Energy Armor
6. Alert number: A11/00125/21
Type / number of model:
SKU: IO.TIT.046
Brand: Basic Nero
7. Alert number: A11/00123/21
Type / number of model:
non presente
Name: Quantum Pendant
[...] seguono in allegato schede notifiche RAPEX
Fonti:
Ministero della Salute
European Commission RPEX
Collegati
[box-note]RAPEX 2022
Direttiva 2001/95/CE Sicurezza Generale Prodotti
Evoluzione Direttiva 2001/95/CE (DSGP): Il nuovo pacchetto "sicurezza dei prodotti e vigilanza del mercato
Decreto Legislativo 6 settembre 2005, n. 206
Codice del Consumo[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Notification_A11_00129_21.pdf RAPEX 2022 |
706 kB | 7 | ||
| Notification_A11_00128_21.pdf RAPEX 2022 |
374 kB | 0 | ||
| Notification_A11_00127_21.pdf RAPEX 2022 |
333 kB | 0 | ||
| Notification_A11_00126_21.pdf RAPEX 2022 |
462 kB | 0 | ||
| Notification_A11_00125_21.pdf RAPEX 2022 |
195 kB | 0 | ||
| Notification_A11_00124_21.pdf RAPEX 2022 |
381 kB | 0 | ||
| Notification_A11_00123_21.pdf RAPEX 2022 |
339 kB | 0 |
Direttiva ministeriale 6 dicembre 2021
Direttiva ministeriale 6 dicembre 2021 / Schede tecniche verificazione periodica strumenti di misura
Schede tecniche per la verificazione periodica di strumenti di misura utilizzati per funzioni di misura legali
Il decreto del Ministro dello sviluppo economico 21 aprile 2017, n. 93, entrato in vigore nel mese di settembre 2017, ha realizzato un’ importante opera di codificazione, integrazione, semplificazione, armonizzazione della normativa in materia di controlli metrologici (verificazione periodica, controlli casuali o a richiesta e vigilanza) sugli strumenti di misura in servizio qualora utilizzati per funzioni di misura legali, ossia funzioni di misura giustificate da motivi di interesse pubblico, sanità pubblica, sicurezza pubblica, ordine pubblico, protezione dell’ambiente, tutela dei consumatori, imposizione di tasse e di diritti e lealtà delle transazioni commerciali.
Il decreto, al fine di rispondere alle future esigenze di uniformare su tutto il territorio nazionale le procedure tecniche da seguire nei controlli sugli strumenti di misura in servizio non già contemplati nel decreto stesso, ha previsto la possibilità di adottare apposite direttive, senza la necessità di emanare nuovi ulteriori separati regolamenti, al fine di integrare le schede tecniche già incluse dal decreto stesso, così come espressamente indicato dall’art. 3, comma 4, che dispone: “Anche al fine di uniformare su tutto il territorio nazionale le procedure tecniche da seguire nei controlli e di meglio specificare le prescrizioni al riguardo già contenute nel presente regolamento, possono essere definite dal Ministro dello sviluppo economico apposite direttive, anche rinviando a specifiche norme tecniche”.
L’allegata direttiva introduce le schede tecniche recanti le procedure per la verificazione periodica dei seguenti strumenti di misura in servizio utilizzati per funzioni di misura legali:
[box-info]a) sistemi per la misurazione continua e dinamica di quantità di liquidi diversi dall’acqua del tipo sistemi di misurazione di gas liquefatti per autotrazione (distributori di GPL);
b) misuratori massici di gas metano per autotrazione (Gas Naturale Compresso – CNG);
c) strumenti per pesare a funzionamento automatico del tipo selezionatrici ponderali.
atte a uniformare il comportamento di tutte le parti interessate nei controlli di tali strumenti.[/box-info]
Con la pubblicazione della direttiva, nel sito istituzionale del Ministero dello sviluppo economico si intendono assolti gli obblighi di pubblicazione di atti e provvedimenti amministrativi aventi effetto di pubblicità legale.
Gli organismi che effettuano la verificazione periodica degli strumenti adeguano le proprie procedure di verificazione entro 9 mesi dalla data di pubblicazione.
...
Collegati
[box-note]Decreto 21 aprile 2017 n. 93
Direttiva 2014/32/UE
Decreto Legislativo 84/2016 Strumenti misura
Schema Direttiva | Schede tecniche verifica periodica strumenti di misura[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Direttiva ministeriale 6 dicembre 2021.PDF |
1345 kB | 3 |
Linea guida etichettatura prodotti fertilizzanti regolamento (UE) 2019/1009 (FPR)
Linea guida etichettatura prodotti fertilizzanti regolamento (UE) 2019/1009 (FPR)
ID 15668 | 06.02.2022 / Linea guida allegata C(2021)726
Comunicazione della Commissione relativa all'aspetto dell'etichettatura dei prodotti fertilizzanti dell'UE di cui all'allegato III del regolamento (UE) 2019/1009 del Parlamento europeo e del Consiglio
A norma dell'articolo 4, paragrafo 3, del regolamento (UE) 2019/1009 del Parlamento europeo e del Consiglio, del 5 giugno 2019 (entra definitivamente in vigore il 16 luglio 2022), che stabilisce norme relative alla messa a disposizione sul mercato di prodotti fertilizzanti dell'UE, che modifica i regolamenti (CE) n. 1069/2009 e (CE) n. 1107/2009 e che abroga il regolamento (CE) n. 2003/20031 ("regolamento sui prodotti fertilizzanti" o "FPR"), la Commissione pubblica un documento di orientamento per i fabbricanti e le autorità di vigilanza del mercato con informazioni chiare ed esempi sull'aspetto che dovrebbero avere le etichette di cui all'allegato III di tale regolamento.
Il presente documento di orientamento fornisce spiegazioni sull'attuazione pratica delle prescrizioni di etichettatura di cui all'allegato III del FPR. Comprende esempi di etichette per le diverse PFC dei prodotti fertilizzanti dell'UE. Questi esempi sono puramente indicativi. La posizione di ciascuna parte e i colori utilizzati nel presente documento di orientamento non sono obbligatori. Spetta al fabbricante decidere dove posizionare le informazioni sull'etichetta e come disporle, nel rispetto delle prescrizioni del FPR.
Salvo diversa disposizione contenuta nel presente documento di orientamento o se non si utilizzano affatto i colori, negli esempi delle etichette si utilizzano i seguenti codici cromatici:
- in blu: prescrizioni generali;
- in arancione: prescrizioni specifiche per ciascuna PFC;
- in nero: altre informazioni che devono figurare sull'etichetta;
- in verde: sostanze nutrienti indicate.
...
2.13. Esempio di prescrizioni generali di etichettatura e aspetto visivo
Un riquadro di etichetta dettagliato che include tutte le PFC e i riferimenti alle prescrizioni di etichettatura del FPR viene fornito nell'allegato del presente documento di orientamento.
...
4.1. Esempio di etichetta
Collegati
[box-note]Guidance document labelling EU fertilising products
Regolamento (UE) 2019/1009
Dichiarazione UE di conformità Fertilizzanti - Modello[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Linea guida etichettatura prodotti fertilizzanti regolamento (UE) 2019 1009 (FPR).pdf |
1655 kB | 36 |
Patentino ascensorista: Normativa e Procedura
Patentino ascensorista: Normativa e Procedura / Marzo 2022
ID 15629 | 03.03.2022 / Documento completo allegato
Quadro normativo e procedura per il rilascio del "Certificato di abilitazione" alla manutenzione di ascensori di cui all'Art. 15 del DPR 30 aprile 1999 n. 162 (cd Patentino ascensorista) con tutti i riferimenti normativi alla data.
Attesa evoluzione della procedura, con l'emanazione di apposito regolamento per l'abilitazione previsto dall'Art. 23 c. 4 della Legge 20 novembre 2017 n. 167, che ha dato integrale attuazione della direttiva 2014/33/UE “ascensori”.
Nelle more dell'emanazione di tale regolamento è da applicare quanto previsto dalla normativa esistente (es DPR n. 1767 del 1951) e secondo quanto indicato dalla Circolare Ministero dell'Interno n. 29/2018).
[box-info]Attenzione!
Risulta, al momento, assente una regolamentazione che renda uniforme, sia i requisiti dei soggetti, che le modalità di svolgimento dei corsi di formazione abilitanti all’esame (possibilmente chiusa dal Regolamento previsto dall’Art. 24 c. 4 della Legge 20 novembre 2017 n. 167.
Al momento, infatti, non è neppure previsto l’obbligo di frequentazione di corsi per la preparazione all’esame, ma comunque opportuna.
Questo ha ingenerato difformità e disallineamenti per i requisiti dei soggetti e per la modalità di svolgimento dei corsi di preparazione all’esame esistenti.[/box-info]
_______
Decreto del Presidente della Repubblica 30 aprile 1999 n. 162
Art. 15. Manutenzione
1. Ai fini della conservazione dell'impianto e del suo normale funzionamento, il proprietario o il suo legale rappresentante sono tenuti ad affidare la manutenzione di tutto il sistema degli ascensori, dei montacarichi e degli apparecchi di sollevamento rispondenti alla definizione di ascensore la cui velocita' di spostamento non supera 0,15 m/s a persona munita di certificato di abilitazione o a ditta specializzata ovvero a un operatore comunitario dotato di specializzazione equivalente che debbono provvedere a mezzo di personale abilitato. Il certificato di abilitazione e' rilasciato dal prefetto, in seguito all'esito favorevole di una prova teorico-pratica, da sostenersi dinanzi ad apposita commissione esaminatrice ai sensi degli articoli 6, 7, 8, 9 e 10 del decreto del Presidente della Repubblica 24 dicembre 1951, n. 1767. (N)
2. Il manutentore provvede anche alla manovra di emergenza che, in caso di necessita', puo' essere effettuata anche da personale di custodia o altro personale competente, autorizzato dal proprietario o dal suo legale rappresentante e istruito per questo scopo.
3. Il manutentore, al fine di garantire la corretta funzionalita' dell'impianto, esegue interventi di manutenzione tenendo conto delle esigenze dell'impianto stesso e, comunque, provvede periodicamente almeno a:
a) a verificare il regolare funzionamento dei dispositivi meccanici, idraulici ed elettrici e, in particolare, delle porte dei piani e delle serrature;
b) a verificare lo stato di conservazione delle funi e delle catene;
c) alle operazioni normali di pulizia e di lubrificazione delle parti.
4. Il manutentore provvede, almeno una volta ogni sei mesi per gli ascensori, compresi gli apparecchi di sollevamento rispondenti alla definizione di ascensore la cui velocita' di spostamento non supera 0.15 m/s, e almeno una volta all'anno per i montacarichi:
a) a verificare l'integrita' e l'efficienza del paracadute, del limitatore di velocita' e degli altri dispositivi di sicurezza;
b) a verificare minutamente le funi, le catene e i loro attacchi;
c) a verificare l'isolamento dell'impianto elettrico e l'efficienza dei collegamenti con la terra;
d) ad annotare i risultati di queste verifiche sul libretto di cui all'articolo 16.
5. Il manutentore promuove, altresi', tempestivamente la riparazione e la sostituzione delle parti rotte o logorate, o a verificarne l'avvenuta, corretta, esecuzione.
6. Il proprietario o il suo legale rappresentante provvedono prontamente alle riparazioni e alle sostituzioni.
7. Nel caso in cui il manutentore rilevi un pericolo in atto, deve fermare l'impianto, fino a quando esso non sia stato riparato informandone, tempestivamente, il proprietario o il suo legale rappresentante e il soggetto incaricato delle verifiche periodiche, nonche' il comune per l'adozione degli eventuali provvedimenti di competenza.
___________
Aggiornamento (N)
La Legge 20 novembre 2017 n. 167 ha disposto (con l'art. 23, comma 1) che "Al fine di assicurare l'integrale attuazione della direttiva 2014/33/UE del Parlamento europeo e del Consiglio, del 26 febbraio 2014, relativa agli ascensori e ai componenti di sicurezza degli ascensori nonche' per l'esercizio degli ascensori, il certificato di abilitazione previsto dall'articolo 15, comma 1, del regolamento di cui al Decreto del Presidente della Repubblica 30 aprile 1999 n. 162, e' valido in tutto il territorio nazionale ed e' rilasciato dal prefetto in seguito all'esito favorevole di una prova teorico-pratica innanzi a un'apposita commissione esaminatrice, dal medesimo nominata e composta da cinque funzionari, in possesso di adeguate competenze tecniche, dei quali almeno uno, oltre al presidente, con laurea in ingegneria, designati rispettivamente dal Ministero del lavoro e delle politiche sociali, dal Ministero delle infrastrutture e dei trasporti, dal Ministero dello sviluppo economico, dall'Istituto nazionale per l'assicurazione contro gli infortuni sul lavoro (INAIL) e da un'azienda sanitaria locale, ovvero da un'agenzia regionale per la protezione ambientale, qualora le disposizioni regionali di attuazione del decreto-legge 4 dicembre 1993, n. 496, convertito, con modificazioni, dalla legge 21 gennaio 1994, n. 61, attribuiscano a tale agenzia le competenze in materia. La commissione e' presieduta dal funzionario designato dal Ministero del lavoro o delle politiche sociali. Alla prova teorico-pratica sono presenti almeno tre membri della commissione, compreso il presidente. Al presidente e ai componenti della commissione non spetta alcun compenso".
...
Art. 23. Disposizioni per l’integrale attuazione della direttiva 2014/33/UE relativa agli ascensori e ai componenti di sicurezza degli ascensori nonché per l’esercizio degli ascensori
1. Al fine di assicurare l’integrale attuazione della direttiva 2014/33/UE del Parlamento europeo e del Consiglio, del 26 febbraio 2014, relativa agli ascensori e ai componenti di sicurezza degli ascensori nonché per l’esercizio degli ascensori, il certificato di abilitazione previsto dall’articolo 15, comma 1, del regolamento di cui al decreto del Presidente della Repubblica 30 aprile 1999, n. 162, è valido in tutto il territorio nazionale ed è rilasciato dal prefetto in seguito all’esito favorevole di una prova teorico-pratica innanzi a un’apposita commissione esaminatrice, dal medesimo nominata e composta da cinque funzionari, in possesso di adeguate competenze tecniche, dei quali almeno uno, oltre al presidente, con laurea in ingegneria, designati rispettivamente dal Ministero del lavoro e delle politiche sociali, dal Ministero delle infrastrutture e dei trasporti, dal Ministero dello sviluppo economico, dall’Istituto nazionale per l’assicurazione contro gli infortuni sul lavoro (INAIL) e da un’azienda sanitaria locale, ovvero da un’agenzia regionale per la protezione ambientale, qualora le disposizioni regionali di attuazione del decreto-legge 4 dicembre 1993, n. 496, convertito, con modificazioni, dalla legge 21 gennaio 1994, n. 61, attribuiscano a tale agenzia le competenze in materia. La commissione è presieduta dal funzionario designato dal Ministero del lavoro o delle politiche sociali. Alla prova teorico-pratica sono presenti almeno tre membri della commissione, compreso il presidente. Al presidente e ai componenti della commissione non spetta alcun compenso.
2. La data e la sede delle sessioni di esame è determinata dal prefetto. Il prefetto del capoluogo di regione, tenuto conto del numero e della provenienza delle domande pervenute, previe intese con gli altri prefetti della regione, può disporre apposite sessioni di esame per tutte le domande presentate nella regione allo scopo di razionalizzare le procedure finalizzate al rilascio del certificato di abilitazione.
3. Gli articoli 6 e 7 del regolamento di cui al decreto del Presidente della Repubblica 24 dicembre 1951, n. 1767, sono abrogati.
4. Il Governo è autorizzato a modificare, con apposito regolamento, il regolamento di cui al decreto del Presidente della Repubblica 30 aprile 1999, n. 162, sulla base delle disposizioni del presente articolo. Alla data di entrata in vigore del regolamento adottato ai sensi del presente comma sono abrogati i commi 1 e 2 del presente articolo.
[box-info]Competenza rilascio Patentino / Prefetto
Il Prefetto è competente il fini del conseguimento del certificato di abilitazione per l'esercizio dell'attività di manutentore di ascensori e montacarichi, al cui rilascio in accordo con l'Art. 23 della Legge 20 novembre 2017 n. 167 - [/box-info]
[box-info]Regolamento "esami abilitazione" / Previsto
Art. 23 Legge 20 novembre 2017 n. 167
4. Il Governo è autorizzato a modificare, con apposito regolamento, il regolamento di cui al decreto del Presidente della Repubblica 30 aprile 1999, n. 162, sulla base delle disposizioni del presente articolo. Alla data di entrata in vigore del regolamento adottato ai sensi del presente comma sono abrogati i commi 1 e 2 del presente articolo.[/box-info]
________
[box-note]Circolare Ministero dell'Interno n. 29/2018
Oggetto: Art. 23 della Legge 20/11/2017, n. 167. Ricostituzione delle Commissioni per l’abilitazione per la manutenzione di ascensori e montacarichi. Istruzioni operative.
A seguito di alcuni quesiti insorti in merito al corretto funzionamento delle Commissioni per l’abilitazione per la manutenzione di ascensori e montacarichi, ricostituite ai sensi dell’articolo 23, della legge 20 novembre 2017 n. 167, si portano a conoscenza delle SS.LL. le seguenti indicazioni operative condivise con le altre Amministrazioni Centrali rappresentate all’interno delle predette Commissioni.
Come noto, l’articolo 23 della legge 20 novembre 2017 n. 167 “Disposizioni per l’integrale attuazione della direttiva 2014/33/UE relativa agli ascensori e ai componenti di sicurezza degli ascensori nonché per l’esercizio degli ascensori” prevede la competenza del prefetto al rilascio del certificato di abilitazione per l’esercizio della professione di manutentore di ascensori e montacarichi, di cui all’articolo 15, comma 1, del DPR n. 162 del 1999, a seguito del superamento di apposita prova teorico-pratica da sostenere innanzi ad un’apposita Commissione esaminatrice, dal medesimo nominata.
Lo stesso articolo 23 della Legge n. 167 del 2017 ha disposto, al comma 3, l’abrogazione dell’articolo 7 del DPR n. 1767 del 1951, che individua i documenti da allegare all’istanza di abilitazione all’esercizio della professione di manutentore di ascensori e montacarichi e apparecchi di sollevamento, la cui velocità di spostamento non supera 0,15 m/s. La suddetta abrogazione, nel determinare un vuoto normativo, ha generato difficoltà operative per la piena funzionalità delle Commissioni d’esame di che trattasi, in particolare per quanto attiene alle modalità di presentazione dell’istanza per il rilascio dell’abilitazione in argomento.
Pertanto nelle more dell’emanazione del regolamento di cui all’articolo 23, comma 4, della citata legge n. 167 del 2017, considerata l’esigenza di garantire funzionalità ed omogeneità alla operatività delle succitate Commissioni, si precisa che per l’ammissione all’esame teorico-pratico per l’abilitazione all’esercizio della professione di manutentore di ascensori e montacarichi e apparecchi di sollevamento la cui velocità di spostamento non supera 0,15 m/s, l’aspirante deve presentare, o trasmettere mediante PEC, alla Prefettura UTG competente per territorio, domanda in carta legale di ammissione alla prova. Nella domanda il candidato, oltre ad indicare il recapito postale (indirizzo della residenza o dell’eventuale domicilio), presso il quale intende ricevere le comunicazioni, dovrà fornire un recapito telefonico ed un eventuale indirizzo di posta elettronica, nonché rilasciare le seguenti dichiarazioni:
a) dichiarazione sostitutiva di certificazione, ai sensi dell’articolo 46 del DPR n. 445 del 18 dicembre 2000, le quali risulti:
- la cittadinanza italiano o comunitaria ovvero la cittadinanza di un paese terzo, con il requisito, in tale ultimo caso, di essere titolare del permesso di soggiorno CE per soggiornanti di lungo periodo ovvero dello status di rifugiato ovvero di protezione sussidiaria (i cittadini comunitari ed extracomunitari devono dichiarare la conoscenza della lingua italiana);
- il compimento della maggiore età alla data della presentazione della domanda;
- la residenza;
b) eventuale dichiarazione di una ditta specializzata o autocertificazione, in caso di lavoratore autonomo, attestante la formazione pratica alle mansioni di manutentore di ascensori e montacarichi:
c) fotocopia di un documento di identità in corso di validità;
d) due fotografie formato tessera;
e) dichiarazione di atto di notorietà, ai sensi dell’articolo 47 del DPR n. 445 del 28 dicembre 2000, dalla quale risulti che l’interessato non ha in corso procedimenti penali nei quali sia stata già pronunziata una sentenza di condanna che comporti l’interdizione dalla professione e da un’arte.
La domanda pena di nullità della stessa deve essere sottoscritta dal candidato.[/box-note]
Schema 1 - Sintesi procedura esame / norme
[box-note]DPR n. 1767 del 1951
Art. 7. Domanda di abilitazione per il personale di manutenzione / Abrogato da Legge 20 novembre 2017 n. 167
L'aspirante al certificato di abilitazione, per essere ammesso all'esame teorico-pratico deve presentare al prefetto:
a) domanda in carta legale corredata del certificato di nascita da cui risulti di aver compiuto 18 anni;
b) certificato penale;
c) eventuale dichiarazione di una ditta specializzata attestante le mansioni in precedenza espletate presso di essa;
d) fotografia del candidato con firma autenticata dal sindaco o dal notaio.
Art. 8. Prova teorico-pratica da sostenersi dinanzi alla Commissione
L'aspirante sara' sottoposto ad un esame orale e ad una prova pratica.
L'esame orale deve accertare la conoscenza generale dello leggi e delle norme tecniche, dei principali tipi di ascensori del loro complesso elettrico e meccanico e delle relative parti, dei pericoli derivanti da cause elettriche o meccaniche nell'esercizio delle proprie mansioni.
La prova pratica tende ad accertare la conoscenza della manutenzione dei singoli organi, della verifica delle funi, della prova dei dispositivi di chiusura, di controllo, di fine corsa, di quelli paracadute, dello stato di isolamento dell'impianto elettrico. L'aspirante dovra' inoltre dimostrare di sapere operare la manovra di soccorso in caso di arresto della cabina fra piano e piano ed in caso di incidenti, di saper intervenire in caso di manomissione dell'impianto.
Art. 9. Certificato di abilitazione
Il certificato di abilitazione viene rilasciato dal prefetto a spese del titolare, a seguito del parere favorevole della Commissione d'esame. Il proprietario dello stabile o altro titolare della licenza di esercizio dello ascensore o montacarichi ed i funzionari preposti al controllo sono tenuti ad assicurarsi che il personale incaricato della manutenzione dell'impianto sia munito del certificato di cui sopra.
Art. 10. Intervento del prefetto nei casi di inosservanza
In caso di inosservanza delle disposizioni della legge 24 ottobre 1942, n. 1415, del decreto luogotenenziale 31 agosto 1945, n. 600, e di quelle di cui agli articoli precedenti, il prefetto dispone direttamente, o su proposta degli organi incaricati della vigilanza sull'esercizio e manutenzione degli ascensori e montacarichi, il fermo dell'apparecchio e l'adozione delle relative cautele. Le disposizioni impartite ed il verbale in conseguenza redatto vanno notificati al proprietario dell'ascensore o montacarichi e all'intestatario della licenza di esercizio. [/box-note]
...
segue in allegato
Certifico Srl - IT | Rev. 0.0 2022
©Copia autorizzata Abbonati
Collegati
[box-note]D.P.R. N. 162 del 30 Aprile 1999
Nuova Direttiva Ascensori: Direttiva 2014/33/UE
Legge 20 novembre 2017 n. 167
Circolare Ministero dell'Interno n. 29/2018
DPR 28 marzo 1994 n. 268
D.P.R. 24 dicembre 1951 n. 1767
Decreto Ministeriale 9 dicembre 1987 n. 587
Decreto Ministeriale 28 maggio 1979
Norme armonizzate Direttiva Ascensori 2014/33/UE
Libretto e documenti della manutenzione e verifiche ascensori
Verifiche periodiche ascensori
Certificato di abilitazione ascensoristi: in arrivo il Regolamento
Sicurezza ascensori: Norme della serie UNI EN 81-X
UNI 10411-X:20XX - La serie di norme modifiche ad ascensori[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Patentino ascensorista - Normativa e Procedura Rev. 00 2022.pdf Certifico S.r.l. Rev. 0.0 2022 |
224 kB | 117 |
Regolamento (UE) 2022/112
Regolamento (UE) 2022/112 / Modifica Regolamento DMD in vitro
Regolamento (UE) 2022/112 del Parlamento europeo e del Consiglio del 25 gennaio 2022 che modifica il regolamento (UE) 2017/746 per quanto riguarda le disposizioni transitorie per determinati dispositivi medico-diagnostici in vitro e l'applicazione differita delle condizioni concernenti i dispositivi fabbricati internamente
GU L 19/3 del 28.1.2022
Entrata in vigore: 28.01.2022
________
Il regolamento (UE) 2017/746 è così modificato:
1) l'articolo 110 è così modificato:
(a) il paragrafo 2 è così modificato:
i) al primo comma, la data «27 maggio 2024» è sostituita dalla data «27 maggio 2025»;
ii) al secondo comma, la data «27 maggio 2024» è sostituita dalla data «27 maggio 2025»;
(b) i paragrafi 3 e 4 sono sostituiti dai seguenti:
«3. In deroga all'articolo 5 del presente regolamento, i dispositivi di cui al secondo e terzo comma del presente paragrafo possono essere immessi sul mercato o messi in servizio fino alle date stabilite in tali commi, a condizione che, a decorrere dalla data di applicazione del presente regolamento, tali dispositivi continuino a essere conformi alla direttiva 98/79/CE e a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d'uso di detti dispositivi.
I dispositivi con un certificato rilasciato ai sensi della direttiva 98/79/CE e valido ai sensi del paragrafo 2 del presente articolo possono essere immessi sul mercato o messi in servizio fino al 26 maggio 2025.
I dispositivi per i quali la procedura di valutazione della conformità ai sensi della direttiva 98/79/CE non richiedeva l'intervento di un organismo notificato, per i quali è stata redatta una dichiarazione di conformità anteriormente al 26 maggio 2022 ai sensi di tale direttiva e per i quali la procedura di valutazione della conformità a norma del presente regolamento richiede l'intervento di un organismo notificato, possono essere immessi sul mercato o messi in servizio fino alle seguenti date:
a) 26 maggio 2025 per i dispositivi della classe D;
b) 26 maggio 2026 per i dispositivi della classe C;
c) 26 maggio 2027 per i dispositivi della classe B;
d) 26 maggio 2027 per i dispositivi della classe A immessi sul mercato in condizioni di sterilità.
Il regolamento (UE) 2017/746 è così modificato:
1) l'articolo 110 è così modificato:
(a) il paragrafo 2 è così modificato:
i) al primo comma, la data «27 maggio 2024» è sostituita dalla data «27 maggio 2025»;
ii) al secondo comma, la data «27 maggio 2024» è sostituita dalla data «27 maggio 2025»;
(b) i paragrafi 3 e 4 sono sostituiti dai seguenti:
«3. In deroga all'articolo 5 del presente regolamento, i dispositivi di cui al secondo e terzo comma del presente paragrafo possono essere immessi sul mercato o messi in servizio fino alle date stabilite in tali commi, a condizione che, a decorrere dalla data di applicazione del presente regolamento, tali dispositivi continuino a essere conformi alla direttiva 98/79/CE e a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d'uso di detti dispositivi.
I dispositivi con un certificato rilasciato ai sensi della direttiva 98/79/CE e valido ai sensi del paragrafo 2 del presente articolo possono essere immessi sul mercato o messi in servizio fino al 26 maggio 2025. I dispositivi per i quali la procedura di valutazione della conformità ai sensi della direttiva 98/79/CE non richiedeva l'intervento di un organismo notificato, per i quali è stata redatta una dichiarazione di conformità anteriormente al 26 maggio 2022 ai sensi di tale direttiva e per i quali la procedura di valutazione della conformità a norma del presente regolamento richiede l'intervento di un organismo notificato, possono essere immessi sul mercato o messi in servizio fino alle seguenti date:
a) 26 maggio 2025 per i dispositivi della classe D;
b) 26 maggio 2026 per i dispositivi della classe C;
c) 26 maggio 2027 per i dispositivi della classe B;
d) 26 maggio 2027 per i dispositivi della classe A immessi sul mercato in condizioni di sterilità.
Collegati
[box-note]Regolamento (UE) 2017/746[/box-note]
Report CE Regulation on Machinery Products - 18.11.2021
Report Regulation on Machinery Products on the state of play - 18.11.2021
Brussels, 18 November 2021 (13569/1/21 REV 1)
_____
I. INTRODUCTION
The European Commission proposal on Machinery Products was transmitted to the European Parliament and to the Council on 22 April 2021. The proposal was presented in the package together with the proposal for the Act on Artificial Intelligence. The two are aligned as the Machinery Products proposal aims to remain future-proof in light of new technologies. As the issue of artificial intelligence represents one of the priorities of the Presidency, the Presidency attributes an important role to the Machinery Products proposal.
The examination of the proposal in the Council Working Party on Technical Harmonisation started on 26 April 2021 under the Portuguese Presidency.
There were all-in-all 12 meeting days until 25 November 2021, eight of them under the Slovenian Presidency. The Commission`s impact assessment was examined with the help of an indicative questionnaire.
II. MAIN ISSUES
In general, the transmission of the Commission’s proposal has been welcomed as timely, necessary and in line with the good inter-institutional practice. Stakeholders have been heard sufficiently by the Commission and the objective of bringing products with digital content into the scope of the machinery regulation has been accepted.
During the discussions at the Working Party level some essential comments were raised.
Terminology regarding machinery/machinery products
The introduction of the term “machinery products” that partly replaces the currently used term “machinery” demands for considerable attention and the topic was addressed in the Working Party meetings on different occasions. Many Member States would prefer to keep the current wording (“machinery”) as they do not see the added value in the introduced changed wording. They claim that market surveillance authorities do not experience difficulties while using the current wording and they believe that the proposed change in wording could limit the clarity of the text and bring translation issues. On the basis of the Member States’ comments an alternative suggestion was formulated by the Commission where the term “machinery” was coupled with the term “machine/s” but such a solution also brought considerable reservations of many Member States particularly due to translation issues.
Exclusion of »vehicles which have as their only objective the transport of goods or persons by public road, air, water or rail network except for machinery mounted on those vehicles" from the scope of the regulation
Member States are very careful with the suggested exclusion particularly from the perspective of the exclusion of small transport vehicles for personal use or light electric vehicles such as escooters, e-bikes that are widely used but could, on the basis of this Proposal, remain unregulated and consequently potentially dangerous for users. Many Member States would therefore like to keep such vehicles in the scope of the Proposal even when road circulation risk is not covered by the Proposal as is the case with the current Machinery Directive. Some Member States also call for the introduction of the transition period until relevant legislation regulating the mentioned type of vehicles is passed.
Empowerment of the Commission to elaborate technical specifications when standards are not available
Member States expressed their support for the primary role of standards and are therefore rather reserved regarding such an empowerment of the Commission particularly in the area where no considerable issues regarding standardisation have been detected. They can potentially agree to a strengthened wording on the issue of such technical specification only representing the final resort option under specific circumstances.
The list of high-risk products in Annex I
Member States and the Commission agree that the mentioned list needs updating but Member States expect this update during the process of adoption of this Proposal while the Commission claims that they do not have enough data to do so but would adapt the list right after the adoption of this Proposal.
Third-party conformity assessment
Linked to the necessity to update the Annex I is also the newly introduced necessity for third-party conformity assessment procedure of high-risk products (use of module B). Such a requirement represents a considerable burden, particularly for SMEs, and some Member States therefore demand for either maintaining the currently relevant option of self-assessment type of conformity assessment (use of module A) or for a considerable adaptation of the Annex I where the high-risk machinery products are listed.
The recurrent issue in the Working Party meetings was also the issue of definitions that need to be properly specified and agreed upon (substantial modification, artificial intelligence) while the issue of alignment with the NLF was consistently addressed.
The Presidency aims to finish the first examination of the Proposal and intends to finalise it by an examination of the essential health and safety requirements of the machinery products in Annex III.
The length and complexity of this Annex will demand for considerable time for its examination.
The Presidency also strives to present the first partial Presidency compromise text of the Proposal.
III. OUTLOOK
The draft report by the rapporteur, Mr Ivan Štefanec (EPP), will be discussed in the Committee on the Internal Market and Consumer Protection (IMCO) of the European Parliament as from November 2021 and the vote on the draft amendments is expected to take place in March 2022. It will thus be for the incoming French Presidency to intensify contacts with the representatives of the European Parliament in order to find compromise solutions that are acceptable both to the Council and the European Parliament with a view to making an agreement at first reading possible.
The Slovenian Presidency thanks the Portuguese Presidency for starting the discussions, all delegations for their contributions to the file, and the European Commission for its collaborative attitude and fruitful comments necessary to improve the text of the proposal.
[...]
Fonte: EC
Collegati
[box-note]Proposal for a Regulation on machinery products
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Report CE Regulation on Machinery Products - 18.11.2021.pdf |
269 kB | 15 |
Decreto 10 novembre 2021
Decreto 10 novembre 2021 / Modifica Classificazione Nazionale dei Dispositivi medici (CND)
Modifiche ed aggiornamenti alla classificazione nazionale dei dispositivi medici (CND), di cui al decreto 20 febbraio 2007.
(GU n.18 del 24.01.2022 - SO n. 5)
[box-info]Modifiche:
- Decreto 18 ottobre 2022 Modifica dell'allegato 1 al decreto 10 novembre 2021 (GU n. 259 del 06.11.2023)[/box-info]
_______
Art. 1.
1. Alla Classificazione nazionale dei dispositivi medici (CND), approvata con decreto del Ministro della salute 20 febbraio 2007, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 63 del 16 marzo 2007, recante «Approvazione della Classificazione nazionale dei dispositivi medici (CND)», sono apportate le modifiche e gli aggiornamenti elencati negli allegati 1, 2 e 3, che costituiscono parte integrante del presente decreto, relativi rispettivamente ai codici della classificazione eliminati, ai codici aggiunti ed ai codici le cui descrizioni vengono modificate.
[....]
Allegato 1
Codici eliminati alla Classificazione nazionale dei dispositivi medici approvata con Decreto del Ministero della salute 20 febbraio 2007
Allegato 2
Codici aggiunti alla Classificazione nazionale dei dispositivi medici approvata con Decreto del Ministero della salute 20 febbraio 2007
Allegato 3
Codici la cui descrizione e' modificata rispetto a quella prevista nella Classificazione nazionale dei dispositivi medici approvata con Decreto del Ministero della Salute 20 febbraio 2007
...
Collegati
[box-note]Classificazione Nazionale Dispositivi medici
Decreto 20 febbraio 2007 | Classificazione Nazionale dispositivi medici
Decreto 8 giugno 2016
Decreto 13 marzo 2018 Modifiche CND [/box-note]
Stima del rischio con il metodo SCRAM (SICK)
Stima del rischio con il metodo SCRAM (SICK) Rev. 1.0 Settembre 2022
ID 15490 | 16.09.2022 / Documento completo (EN) in allegato
Risk assessment and risk reduction for machinery - Part 3: Conducting risk estimation. Scalable risk analysis and evaluation method (SCRAM)
[box-note]Update Rev. 1.0 2022
- SICK AG - WHITE PAPER 2022-05[/box-note]
….
Introduction
Scope
Machine risk assessment consists of a series of steps used to examine the hazards associated with machines and it consists of two stages, namely risk analysis and risk evaluation, as laid out in ISO 12100:2012. Risk analysis comprises three stages: determining the limits of the machine, identifying hazards, and estimating the risk.
After having completed the hazard identification phase, risk estimation is carried out for each identified hazard and hazardous situation. Risk is defined as a combination of the severity of harm and the probability of occurrence of that harm.
According to ISO 12100:2012, the probability of occurrence of harm can be estimated taking into account the frequency and duration of exposure to the hazard, the probability of occurrence of a hazardous event, and the technical and human possibilities to avoid or limit the harm. The combination of the severity of the possible harm with these three probability parameters will be used to estimate risk values which can then be used for comparison purposes. At the last stage of the assessment process, risk evaluation allows decisions on risk reduction measures to be applied to the machine.
The scope of this white paper is to provide a risk estimation methodology that has proved to be robust, and reliable while preventing errors when estimating risks.
Preface
This white paper is part of a series of papers describing the SICK process of risk assessment in combination with risk reduction:
[box-info]- Part 1: Defining the scope of the risk assessment
- Part 2: Identifying task/hazard pairs
- Part 3: Conducting risk estimation
- Part 4: Integrating protective devices into (existing) control systems
- Part 5: Implementing emergency operations
- Part 6: Carrying out substantial modifications[/box-info]
Risk reduction process
General
All products and systems include hazards and, therefore, some level of risk. However, the risk associated with those hazards shall be reduced to an acceptable or tolerable levela. The iterative process of risk assessment and risk reduction for each task and hazard combination is essential in achieving acceptable risk (level of risk that is accepted in a given context based on the current values of society).
The objective of risk reduction can be achieved by the elimination of significant hazards, or by reducing each of the two elements (separately or simultaneously) that determine the associated risk:
[box-note]- Severity of harm from the hazard under consideration
- Probability of occurrence of that harm[/box-note]
Fig. 1 - Overall risk reduction
a For the purpose of this document, the terms “acceptable risk” and “tolerable risk” are considered to be synonymous.
Three-step method
All risk reduction measures intended for reaching this objective shall be applied in the following sequence, referred to as the threestep method:
STEP 1: INHERENTLY SAFE DESIGN MEASURES
Inherently safe design measures are achieved by avoiding hazards or reducing risks by implementing a suitable choice of design features for the machine itself and/or interaction between the exposed persons and the machine.
Inherently safe design measures are the first and most important step in the risk reduction process. This is because risk reduction measures inherent to the characteristics of the machine are likely to remain effective, whereas experience has shown that even well-designed safeguarding can fail or be defeated and information for use may not be followed.
STEP 2: TECHNICAL PROTECTIVE MEASURES
Guards and protective devices (also known as “safeguarding” or “engineering controls”) shall be used to protect persons whenever an inherently safe design measure does not reasonably make it possible either to remove hazards or to sufficiently reduce risks (for details see chapter “Technical protective measures”). Complementary protective measures involving additional equipment (for example, emergency stop equipment) may also be necessary.
STEP 3: INFORMATION FOR USE
Information for use consists of communication means, such as texts, words, signs, signals, symbols, or diagrams, used separately or in combination to provide information to the user (employer and/or affected persons).
The information shall contain all directions required for safe and intended use of a machine. To achieve this purpose, it shall also inform and warn the user about residual risk.
The information shall indicate, as appropriate, the requirements for additional measures that the user shall implement:
- The possible need for additional guards or protective devices
- The consideration of regular inspections
- The consideration of safe work procedures and training
- The consideration of personal protective equipment
Information for use shall not be a substitute for the correct application of inherently safe design measures, technical protective measures, or complementary protective measures.
[...]
Progressive iterations in risk assessment
Key
|
MSE Mechanical safeguarding equipment |
M One or a combination of these measures is mandatory for this risk level |
[...]
ANNEX: Examples of the evaluation of harm severity, ANSI B11.0-2019 3rd edition
[...] Segue in allegato
Certifico Srl - EN | Rev. 1.0 2022
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 1.0 | 16.09.2022 | SICK AG - WHITE PAPER 2022-05 | Certifico Srl |
| 0.0 | 19.01.2022 | --- | Certifico Srl |
Fonte: SICK
Collegati
[box-note]Direttiva macchine 2006/42/CE
Guida direttiva macchine 2006/42/CE - Ed. 2019 EN
Tabelle raccordo Norme armonizzate B e RESS Conformi Appendice ZA/ZB
Valutazione dei rischi EN ISO 12100: Esempio operativo
EN ISO 12100 e ISO/TR 14121-2: Esempio Valutazione del rischio
ISO TR 14121-2: Metodi per l'analisi del rischio
Stima del Rischio ISO/TR 14121-2 p. 6.3 Metodo grafico - Esempio e scheda
Stima del rischio ISO/TR 14121-2 p. 6.4 Punteggio numerico - Esempio e scheda[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Stima del rischio con il metodo SCRAM - SICK Rev. 1.0 2022.pdf Certifico Srl - Rev. 1.0 2022 |
2400 kB | 89 | ||
| Stima del rischio con il metodo SCRAM - SICK Rev. 0.0 2022.pdf Certifico Srl - Rev. 0.0 2022 |
2553 kB | 253 |
RAPEX 2022
RAPEX: Rapid Alert System for non-food consumer products
Archivio prodotti pericolosi
Creato nel 1984, il RAPEX (Rapid Alert System for non-food consumer products) ha la funzione di prevenire i rischi per la salute e sicurezza dei consumatori relativa a prodotti non alimentari in commercio, con uno scambio rapido di informazioni tra gli Stati membri dell'UE.
Il sistema consente alle autorità nazionali di notificare alla Commissione la presenza sul mercato europeo di un prodotto non alimentare pericoloso, la cui vendita, una volta pervenuta la segnalazione a livello europeo, sarà vietata o condizionata.
Alcune notifiche del sistema RAPEX potrebbero essere sottoposte a rettifica, consultare il sito ufficiale.
Info RAPEX Certifico
RAPEX European Commission
Collegati
[box-note]Direttiva 2001/95/CE Sicurezza Generale Prodotti
Evoluzione Direttiva 2001/95/CE (DSGP): Il nuovo pacchetto "sicurezza dei prodotti e vigilanza del mercato
Decreto Legislativo 6 settembre 2005, n. 206
Codice del Consumo[/box-note]
Orientamenti applicazione art. 9 Regolamento (UE) 2019/1020
Orientamenti applicazione articolo 9 Regolamento (UE) 2019/1020
EU - 10.01.2022
Orientamenti sull'applicazione dell'articolo 9 del regolamento (UE) 2019/1020 riguardante le attività congiunte per promuovere la conformità
Le autorità di vigilanza del mercato di tutta l'UE partecipano a numerose iniziative differenti insieme ad altre autorità (comprese altre autorità di vigilanza), organizzazioni di consumatori, organizzazioni di categoria o rappresentanti dell'industria. Le attività di alcune iniziative possono comportare un intenso coinvolgimento e un'ampia cooperazione tra varie parti, mentre altre attività possono rientrare fra le responsabilità di una sola autorità di vigilanza del mercato, con limitati contributi di altre parti.
Nell'ambito di tali iniziative, le autorità di vigilanza del mercato possono realizzare "attività congiunte" ai sensi dell'articolo 9 del regolamento (UE) 2019/1020 sulla vigilanza del mercato e sulla conformità dei prodotti insieme ad altre autorità, organizzazioni che rappresentano gli operatori economici o gli utilizzatori finali per promuovere la conformità, identificando i casi di non conformità, sensibilizzando sulla normativa di armonizzazione dell'Unione e fornendo orientamenti in merito e per quanto riguarda categorie specifiche di prodotti, compresi quelli offerti per la vendita online.
Se un'autorità di vigilanza del mercato decide di svolgere tale "attività congiunta", deve adempiere agli obblighi stabiliti all'articolo 9. Si tratta dei due obblighi seguenti:
- [l]e autorità di vigilanza del mercato in questione e le parti [...] garantiscono che l'accordo sulle attività congiunte non comporti una concorrenza sleale tra gli operatori economici e non pregiudichi l'obiettività, l'indipendenza e l'imparzialità delle parti;
- [l]'autorità di vigilanza del mercato in questione mette tale accordo sulle attività congiunte, insieme ai nomi delle parti coinvolte, a disposizione del pubblico e lo inserisce nel sistema di informazione e comunicazione di cui all'articolo 341.
Il presente documento ha carattere non vincolante e si prefigge di fornire orientamenti per coadiuvare le autorità di vigilanza del mercato nell'attuazione dell'articolo 9 per quanto riguarda:
A. decidere se un'iniziativa sia considerata un'"attività congiunta" da svolgere in conformità dell'articolo 9 del regolamento (UE) 2019/1020 sulla vigilanza del mercato e sulla conformità dei prodotti;
B. evitare la concorrenza sleale e mantenere l'obiettività, l'indipendenza e l'imparzialità delle parti al momento di sottoscrivere un accordo di attività congiunta;
C. fornire criteri per tipi specifici di attività congiunte e
D. fornire alle parti interessate un modello di accordo di attività congiunta.
________
[panel]Regolamento (UE) 2019/1020
Articolo 9 Attività congiunte per promuovere la conformità
1. Le autorità di vigilanza del mercato possono stipulare accordi con altre autorità interessate, organizzazioni che rappresentano gli operatori economici o gli utilizzatori finali per la realizzazione di attività congiunte volte a promuovere la conformità, identificando i casi di non conformità, sensibilizzando sulla normativa di armonizzazione dell'Unione e fornendo orientamenti in merito e per quanto riguarda categorie specifiche di prodotti, in particolare le categorie di prodotti che spesso presentano un rischio grave, compresi i prodotti offerti per la vendita online.
2. Le autorità di vigilanza del mercato in questione e le parti di cui al paragrafo 1 garantiscono che l'accordo sulle attività congiunte non comporti una concorrenza sleale tra gli operatori economici e non pregiudichi l'obiettività, l'indipendenza e l'imparzialità delle parti.
3. Un'autorità di vigilanza del mercato ha facoltà di utilizzare qualsivoglia informazione derivante dalle attività congiunte svolte nell'ambito di un'indagine da essa condotta su un caso di non conformità.
4. L'autorità di vigilanza del mercato in questione mette tale accordo sulle attività congiunte, insieme ai nomi delle parti coinvolte, a disposizione del pubblico e lo inserisce nel sistema di informazione e comunicazione di cui all'articolo 34. La rete istituita a norma dell'articolo 29 fornisce, su richiesta di uno Stato membro, assistenza nell'elaborazione e nell'attuazione dell'accordo sulle attività congiunte.[/panel]
Fonte: EU
Collegati
[box-note]Guidelines of Art. 4 of Regulation (EU) 2019/1020
Regolamento (UE) 2019/1020
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Orientamenti applicazione art. 9 Regolamento UE 2019 1020.pdf EU 10.01.2022 |
1141 kB | 14 |
RAPEX Report 51 del 24/12/2021 N. 03 A11/00119/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 51 del 24/12/2021 N. 03 A11/00119/21 Repubblica Ceca
Approfondimento tecnico: Cric meccanico

Il prodotto, di marca Compass, mod. ST-105, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2006/42/CE Macchine ed alla norma tecnica EN 1494:2000+A1:2008 “Martinetti spostabili o mobili ed apparecchi di sollevamento associati”.
Il dispositivo non è sufficientemente resistente, potrebbe deformarsi e far cadere il veicolo.
Direttiva 2006/42/CE Macchine
Allegato I
1.3.2. Rischio di rottura durante il funzionamento
Gli elementi della macchina, nonché i loro organi di collegamento, devono resistere agli sforzi cui devono essere sottoposti durante l'utilizzazione.
I materiali utilizzati devono presentare caratteristiche di resistenza sufficienti ed adeguate all'ambiente di utilizzazione, previsto dal fabbricante o dal suo mandatario, in particolare per quanto riguarda i fenomeni di fatica, invecchiamento, corrosione e abrasione.
Nelle istruzioni devono essere indicati i tipi e le frequenze delle ispezioni e manutenzioni necessarie per motivi di sicurezza. Devono essere indicati dove appropriato gli elementi soggetti ad usura, nonché i criteri di sostituzione.
Se nonostante le precauzioni prese sussistono rischi di disintegrazione o di rottura, gli elementi in questione devono essere montati, disposti e/o protetti in modo che i loro eventuali frammenti vengano trattenuti evitando situazioni pericolose.
Le tubazioni rigide o elastiche contenenti fluidi, in particolare ad alta pressione, devono poter sopportare le sollecitazioni interne ed esterne previste e devono essere solidamente fissate e/o protette affinché, in caso di rottura, esse non presentino rischi.
In caso di alimentazione automatica del materiale da lavorare verso l'utensile, devono essere soddisfatte le seguenti condizioni per evitare rischi per le persone:
- al momento del contatto utensili/pezzo, l'utensile deve aver raggiunto le sue normali condizioni di lavoro,
- al momento dell'avviamento e/o dell'arresto dell'utensile (volontario o accidentale), il movimento di alimentazione e il movimento dell'utensile debbono essere coordinati.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 51 del 24_12_2021 N. 03 A11_00119_21 Repubblica Ceca.pdf Cric meccanico |
398 kB | 0 |
Decreto Legislativo 31 luglio 1997 n. 277
Decreto Legislativo 31 luglio 1997 n. 277
Modificazioni al decreto legislativo 25 novembre 1996, n. 626, recante attuazione della direttiva 93/68/CEE in materia di marcatura CE del materiale elettrico destinato ad essere utilizzato entro taluni limiti di tensione.
(GU n.193 del 20.08.1997)
Abrogato da: Decreto Legislativo 19 maggio 2016 n. 86
Collegati
[box-note]Decreto Legislativo 25 novembre 1996 n. 626
Direttiva 93/68/CEE [/box-note]
Direttiva 73/23/CEE
Direttiva 73/23/CEE
Direttiva 73/23/CEE del Consiglio, del 19 febbraio 1973, concernente il ravvicinamento delle legislazioni degli Stati Membri relative al materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
(GU L 77 del 26.3.1973)
Abrogata da: Direttiva 2006/95/CE
Collegati
[box-note]Direttiva 2006/95/CE Bassa Tensione[/box-note]
RAPEX Report 48 del 03/12/2021 N. 19 A12/01670/21 Slovacchia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 48 del 03/12/2021 N. 19 A12/01670/21 Slovacchia
Approfondimento tecnico: Fresatrice
Il prodotto, di marca HAAS MILL, modello 1161894, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE.
I dispositivi di sicurezza integrati nel sistema di comando della macchina (arresto di emergenza, interruttore principale, riparo interbloccato, selettore delle modalità di funzionamento) potrebbero non funzionare correttamente.
Direttiva 2006/42/CE
Allegato I
1.2. Sistemi di comando
1.2.1. Sicurezza ed affidabilità dei sistemi di comando
I sistemi di comando devono essere progettati e costruiti in modo da evitare l'insorgere di situazioni pericolose. In ogni caso essi devono essere progettati e costruiti in modo tale che:
- resistano alle previste sollecitazioni di servizio e agli influssi esterni,
- un'avaria nell'hardware o nel software del sistema di comando non crei situazioni pericolose,
- errori della logica del sistema di comando non creino situazioni pericolose,
- errori umani ragionevolmente prevedibili nelle manovre non creino situazioni pericolose.
Particolare attenzione richiede quanto segue:
- la macchina non deve avviarsi in modo inatteso,
- i parametri della macchina non devono cambiare in modo incontrollato, quando tale cambiamento può portare a situazioni pericolose,
- non deve essere impedito l'arresto della macchina, se l'ordine di arresto è già stato dato,
- nessun elemento mobile della macchina o pezzo trattenuto dalla macchina deve cadere o essere espulso,
- l'arresto manuale o automatico degli elementi mobili di qualsiasi tipo non deve essere impedito,
- i dispositivi di protezione devono rimanere pienamente efficaci o dare un comando di arresto,
- le parti del sistema di controllo legate alla sicurezza si devono applicare in modo coerente all'interezza di un insieme di macchine e/o di quasi macchine.
In caso di comando senza cavo deve essere attivato un arresto automatico quando non si ricevono i segnali di comando corretti, anche quando si interrompe la comunicazione.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 48 del 03_12_2021 N. 19 A12_01670_21 Slovacchia.pdf Fresatrice |
400 kB | 2 |
Regolamento di esecuzione (UE) 2021/2226
Regolamento di esecuzione (UE) 2021/2226 / Istruzioni d'uso elettroniche DM
Regolamento di esecuzione (UE) 2021/2226 della Commissione del 14 dicembre 2021 recante modalità di applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda le istruzioni per l’uso elettroniche dei dispositivi medici
(GU L 448/32 del 15.12.2021)
Entrata in vigore: 04.01.2022
[box-warning]Il regolamento (UE) n. 207/2012 della Commissione è abrogato. Esso continua tuttavia ad applicarsi ai dispositivi immessi sul mercato o messi in servizio conformemente all’articolo 120, paragrafo 3, del regolamento (UE) 2017/745 fino al 26 maggio 2024[/box-warning]
Articolo 1
Il presente regolamento stabilisce le condizioni alle quali le informazioni contenute nelle istruzioni per l’uso, definite all’articolo 2, punto 14, del regolamento (UE) 2017/745 e precisate all’allegato I, capo III, punto 23.4, del medesimo regolamento, possono essere fornite dai fabbricanti in forma elettronica, come indicato all’allegato I, capo III, punto 23.1, lettera f), del regolamento (UE) 2017/745.
Esso fissa inoltre alcuni requisiti relativi al contenuto e alla presentazione sui siti web delle istruzioni per l’uso in forma elettronica fornite in aggiunta alle istruzioni per l’uso su supporto cartaceo.
Il presente regolamento non disciplina i prodotti elencati nell’allegato XVI del regolamento (UE) 2017/745.
Articolo 2
Ai fini del presente regolamento si applicano le seguenti definizioni:
1) «istruzioni per l’uso in forma elettronica»: le istruzioni per l’uso visualizzabili in forma elettronica sul dispositivo, fornite dal fabbricante su un supporto elettronico portatile insieme al dispositivo o rese disponibili mediante un software o un sito web;
2) «utilizzatori professionali»: le persone che usano il dispositivo medico nell’esercizio della propria attività professionale nel settore sanitario;
3) «dispositivi medici fissi installati»: i dispositivi e i relativi accessori concepiti per essere installati, fissati o bloccati in altro modo in un luogo specifico all’interno di una struttura sanitaria, in modo tale che non possano essere spostati da tale luogo né smontati senza ricorrere a strumenti o apparecchiature, e che non sono specificamente destinati a essere usati in una struttura sanitaria mobile.
Articolo 3
1) I fabbricanti possono fornire istruzioni per l’uso in forma elettronica invece che su supporto cartaceo se tali istruzioni riguardano uno dei seguenti dispositivi:
a) i dispositivi medici impiantabili e i dispositivi medici impiantabili attivi e i relativi accessori, disciplinati dal regolamento (UE) 2017/745;
b) i dispositivi medici fissi installati e i relativi accessori, disciplinati dal regolamento (UE) 2017/745;
c) i dispositivi medici e i relativi accessori, disciplinati dal regolamento (UE) 2017/745 e muniti di un sistema integrato per la visualizzazione delle istruzioni per l’uso.
2) I fabbricanti possono fornire, per i dispositivi elencati al paragrafo 1, istruzioni per l’uso in forma elettronica invece che su supporto cartaceo alle seguenti condizioni:
a) i dispositivi e gli accessori sono destinati esclusivamente a utilizzatori professionali; e
b) l’uso da parte di altre persone non è ragionevolmente prevedibile.
3) Per i software disciplinati dal regolamento (UE) 2017/745 i fabbricanti possono fornire istruzioni per l’uso in forma elettronica mediante i software stessi invece che su supporto cartaceo.
Articolo 4
1) I fabbricanti dei dispositivi di cui all’articolo 3, paragrafi 1 e 3, che forniscono agli utilizzatori istruzioni per l’uso in forma elettronica invece che su supporto cartaceo, effettuano una valutazione documentata dei rischi vertente almeno sui seguenti aspetti:
a) le conoscenze e l’esperienza degli utilizzatori previsti, in particolare per quanto riguarda l’uso del dispositivo e le esigenze dell’utilizzatore;
b) le caratteristiche dell’ambiente in cui il dispositivo sarà usato;
c) le conoscenze e l’esperienza dell’utilizzatore previsto per quanto riguarda l’hardware e il software necessari per la visualizzazione delle istruzioni per l’uso in forma elettronica;
d) l’accesso dell’utilizzatore alle risorse elettroniche ragionevolmente prevedibili necessarie al momento dell’uso;
e) l’efficacia dei sistemi di sicurezza atti a garantire la protezione dei dati e dei contenuti elettronici da manomissioni;
f) i meccanismi di sicurezza e di back-up in caso di guasti all’hardware e al software, in particolare se le istruzioni per l’uso in forma elettronica sono integrate nel dispositivo;
g) le situazioni di emergenza medica prevedibili che richiedono la fornitura di informazioni su supporto cartaceo;
h) le ripercussioni di una temporanea indisponibilità del sito web specifico o di Internet in generale, o di un problema di accesso nella struttura sanitaria, nonché le misure di sicurezza disponibili per ovviare a tale situazione;
i) la valutazione relativa al periodo durante il quale le istruzioni per l’uso sono fornite su supporto cartaceo su richiesta dell’utilizzatore;
j) la valutazione della compatibilità del sito web che presenta le istruzioni elettroniche per l’uso con i vari dispositivi che potrebbero essere utilizzati per visualizzare dette istruzioni;
k) la gestione delle diverse versioni delle istruzioni per l’uso, se del caso conformemente all’articolo 5, paragrafo 8.
2) La valutazione dei rischi connessi alla fornitura di istruzioni per l’uso in forma elettronica è aggiornata alla luce dell’esperienza acquisita nella fase post-commercializzazione.
Articolo 5
I fabbricanti dei dispositivi di cui all’articolo 3, paragrafi 1 e 3, possono fornire agli utilizzatori istruzioni per l’uso in forma elettronica invece che su supporto cartaceo alle seguenti condizioni:
1) la valutazione dei rischi di cui all’articolo 4 dimostra che, fornendo istruzioni per l’uso in forma elettronica, essi mantengono o migliorano il livello di sicurezza offerto dalle istruzioni su supporto cartaceo;
2) forniscono istruzioni per l’uso in forma elettronica in tutti gli Stati membri nei quali il prodotto è reso disponibile o messo in servizio, fatte salve le situazioni debitamente giustificate nella valutazione dei rischi di cui all’articolo 4;
3) dispongono di un sistema che consente di fornire le istruzioni per l’uso su supporto cartaceo senza costi aggiuntivi per l’utilizzatore durante il periodo stabilito nella valutazione dei rischi di cui all’articolo 4, e al più tardi entro sette giorni di calendario dal ricevimento di una richiesta dell’utilizzatore, oppure all’atto della consegna del dispositivo, se una richiesta in tal senso è stata presentata al momento dell’ordine;
4) forniscono, sul dispositivo stesso o su un foglietto di accompagnamento, informazioni in merito alle situazioni di emergenza medica prevedibili e, per i dispositivi muniti di un sistema integrato per la visualizzazione delle istruzioni per l’uso, informazioni relative alla messa in funzione del dispositivo;
5) garantiscono la progettazione e il funzionamento corretti delle istruzioni per l’uso in forma elettronica e forniscono a tal fine la prova dei controlli e delle convalide;
6) per i dispositivi medici muniti di un sistema integrato per la visualizzazione delle istruzioni per l’uso, garantiscono che la visualizzazione delle istruzioni non impedisce l’uso sicuro del dispositivo, in particolare per quanto riguarda le funzioni di monitoraggio dei parametri vitali o di supporto vitale;
7) forniscono, nel catalogo o su altro adeguato supporto informativo del dispositivo, informazioni sui requisiti hardware e software per visualizzare le istruzioni per l’uso;
8) dispongono di un sistema atto a indicare chiaramente quando le istruzioni per l’uso sono state riviste e a informare in tal senso ciascun utilizzatore del dispositivo, qualora la revisione si sia resa necessaria per motivi di sicurezza;
9) per i dispositivi con data di scadenza definita, ad eccezione dei dispositivi impiantabili, mantengono a disposizione degli utilizzatori le istruzioni per l’uso in forma elettronica per 10 anni dalla data di immissione sul mercato dell’ultimo dispositivo e per almeno due anni dalla data di scadenza dell’ultimo dispositivo prodotto;
10) per i dispositivi senza data di scadenza definita e i dispositivi impiantabili, mantengono a disposizione degli utilizzatori le istruzioni per l’uso in forma elettronica per 15 anni dalla data di immissione sul mercato dell’ultimo dispositivo;
11) le istruzioni per l’uso sono disponibili sul loro sito web in una lingua ufficiale dell’Unione stabilita dallo Stato membro in cui il dispositivo è messo a disposizione dell’utilizzatore o del paziente;
12) sono posti in essere procedure e sistemi efficaci affinché gli utilizzatori dei dispositivi che hanno scaricato le istruzioni per l’uso dal sito web possano essere informati in caso di aggiornamenti o azioni correttive in relazione a tali istruzioni per l’uso;
13) tutte le precedenti versioni elettroniche delle istruzioni per l’uso sono disponibili sul sito web.
Articolo 6
1) I fabbricanti indicano chiaramente sull’etichetta che le istruzioni per l’uso del dispositivo sono fornite in forma elettronica invece che su supporto cartaceo.
Tali informazioni figurano sull’imballaggio di ciascuna unità o, se del caso, sul confezionamento commerciale. Nel caso dei dispositivi medici fissi installati, dette informazioni figurano anche sul dispositivo stesso.
Nel caso dei software, le informazioni sono fornite nel punto da cui è garantito l’accesso ai software.
2) I fabbricanti forniscono informazioni sulle modalità di accesso alle istruzioni per l’uso in forma elettronica.
Tali informazioni sono fornite conformemente al paragrafo 1, secondo comma, oppure, se ciò non è possibile, in un documento cartaceo fornito con ciascun dispositivo.
3) Le informazioni sulle modalità di accesso alle istruzioni per l’uso in forma elettronica comprendono:
a) qualunque informazione necessaria alla consultazione delle istruzioni per l’uso;
b) l’UDI-DI di base e/o l’UDI-DI del dispositivo, di cui rispettivamente all’articolo 27, paragrafo 6, e all’articolo 27, paragrafo 1, lettera a), punto i), del regolamento (UE) 2017/745, e qualunque ulteriore informazione che consenta l’identificazione del dispositivo, compresi il nome e, se del caso, il modello;
c) le coordinate del fabbricante, ad esempio nome, indirizzo, indirizzo di posta elettronica o altri mezzi di comunicazione online e sito web;
d) indicazioni su dove e come si possono richiedere le istruzioni per l’uso su supporto cartaceo e il termine entro cui ottenere tali istruzioni senza costi aggiuntivi, conformemente all’articolo 5, punto 3.
4) Nel caso in cui, per i dispositivi e gli accessori di cui all’articolo 3, paragrafo 1, lettera a), una parte delle istruzioni per l’uso sia destinata al paziente, questa parte non può essere fornita in forma elettronica.
5) Le istruzioni per l’uso in forma elettronica sono consultabili nella loro integralità come testo, che può comprendere simboli e grafici, e contengono almeno le stesse informazioni della versione su supporto cartaceo. In aggiunta al testo possono essere forniti file video o audio.
Articolo 7
1) Qualora i fabbricanti forniscano le istruzioni per l’uso in forma elettronica su un supporto elettronico portatile insieme al dispositivo, o qualora il dispositivo stesso sia munito di un sistema integrato per la visualizzazione delle istruzioni per l’uso, dette istruzioni per l’uso in forma elettronica sono rese accessibili agli utilizzatori anche mediante un sito web.
2) Il sito web in cui figurano le istruzioni per l’uso di un dispositivo fornite in forma elettronica invece che su supporto cartaceo è conforme ai seguenti requisiti:
a) le istruzioni per l’uso sono fornite in un formato comunemente usato che possa essere letto con un software liberamente disponibile;
b) è protetto dall’accesso non autorizzato e da manomissioni dei contenuti in conformità all’articolo 4, paragrafo 1, lettera e);
c) funziona in modo che le interruzioni e gli errori di visualizzazione del server siano ridotti per quanto possibile;
d) soddisfa i requisiti del regolamento (UE) 2016/679;
e) l’indirizzo Internet visualizzato conformemente all’articolo 6, paragrafo 2, è stabile e direttamente accessibile nei periodi di cui all’articolo 5, paragrafi 9 e 10;
f) tutte le versioni precedenti delle istruzioni per l’uso esistenti in forma elettronica, di cui all’articolo 5, paragrafo 13, e la loro data di pubblicazione sono disponibili sul sito web.
Articolo 8
Se del caso, il rispetto degli obblighi di cui agli articoli da 4 a 7 del presente regolamento è esaminato da un organismo notificato durante la procedura applicabile di valutazione della conformità di cui all’articolo 52 del regolamento (UE) 2017/745.
Articolo 9
Le istruzioni per l’uso in forma elettronica fornite in aggiunta ad istruzioni per l’uso complete su supporto cartaceo sono coerenti con il contenuto di queste ultime.
Qualora tali istruzioni per l’uso siano fornite mediante un sito web, quest’ultimo è conforme ai requisiti stabiliti all’articolo 7, paragrafo 2, lettere b), d), e) e f).
Articolo 10
Il regolamento (UE) n. 207/2012 della Commissione è abrogato.
Esso continua tuttavia ad applicarsi ai dispositivi immessi sul mercato o messi in servizio conformemente all’articolo 120, paragrafo 3, del regolamento (UE) 2017/745 fino al 26 maggio 2024.
I riferimenti al regolamento (UE) n. 207/2012 si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all’allegato.
Articolo 11
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
[...] Segue in allegato
Collegati
[box-note]Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Linee guida Regolamento Medical Devices (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
Rettifica del regolamento (UE) 2019/1020 | 09.12.2021
Rettifica del regolamento (UE) 2019/1020 | 09.12.2021
Rettifica del regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio, del 20 giugno 2019, sulla vigilanza del mercato e sulla conformità dei prodotti e che modifica la direttiva 2004/42/CE e i regolamenti (CE) n. 765/2008 e (UE) n. 305/2011.
GU L 440/11 del 9.12.2021
...
Articolo 3, punto 11), pagina 12:
anziché:
«11) “fornitore di servizi di logistica”: qualsiasi persona fisica o giuridica che offre, nell’ambito di un’attività commerciale, almeno uno dei due servizi seguenti: immagazzinamento, imballaggio, indirizzamento e spedizione, senza essere proprietario dei prodotti interessati, escludendo i servizi postali definiti all’articolo 2, punto 1 della direttiva 97/67/CE del Parlamento europeo e del Consiglio, i servizi di consegna dei pacchi come definiti all’articolo 2, punto 2 del regolamento (UE) 2018/644 del Parlamento europeo e del Consiglio, nonché qualsiasi altro servizio postale o di trasporto merci.
leggasi:
«11) “fornitore di servizi di logistica”: qualsiasi persona fisica o giuridica che offre, nell’ambito di un’attività commerciale, almeno due dei servizi seguenti: immagazzinamento, imballaggio, indirizzamento e spedizione, senza essere proprietaria dei prodotti interessati, escludendo i servizi postali definiti all’articolo 2, punto 1), della direttiva 97/67/CE del Parlamento europeo e del Consiglio (31), i servizi di consegna dei pacchi come definiti all’articolo 2, punto 2), del regolamento (UE) 2018/644 del Parlamento europeo e del Consiglio, nonché qualsiasi altro servizio postale o di trasporto merci;
________
Collegati
[box-note]Regolamento (UE) 2019/1020
Regolamento (CE) N. 765/2008
Direttiva COV
Regolamento Prodotti da Costruzione (UE) 305/2011 - CPR[/box-note]
RAPEX Report 46 del 19/11/2021 N. 01 A11/00100/21 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 46 del 19/11/2021 N. 01 A11/00100/21 Lituania
Approfondimento tecnico: Sonaglio a forma di gufo
Il prodotto, di marca Mega Creative, modello INDEX 460304, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
Il prodotto ha una parte sporgente. Se un bambino lo mette in bocca e cade a faccia in giù, la parte sporgente potrebbe ostruire le vie aeree, provocando soffocamento e lesioni nella zona della faringe o della trachea.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
I. Proprietà fisico-meccaniche
1. I giocattoli e le loro parti e, nel caso dei giochi fissi, i relativi ancoraggi devono avere la resistenza meccanica e, se del caso, la stabilità necessarie per sopportare - senza rompersi o deformarsi con il rischio di provocare lesioni fisiche - le sollecitazioni cui sono sottoposti durante l’uso.
2. I bordi, le sporgenze, le corde, i cavi e gli elementi di fissaggio dei giocattoli che siano accessibili debbono essere progettati e costruiti in modo da ridurre per quanto possibile i rischi per l’incolumità fisica dovuti al contatto con essi.
3. I giocattoli devono essere progettati e costruiti in modo da non presentare alcun rischio se non il rischio minimo intrinseco all’uso del giocattolo, che potrebbero essere causati dal movimento delle sue parti.
4. a) I giocattoli e le loro parti non devono comportare un rischio di strangolamento.
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili.
e) L’imballaggio in cui i giocattoli sono contenuti per la vendita al dettaglio non deve comportare un rischio di strangolamento o di asfissia conseguente all’ostruzione delle vie aeree all’esterno della bocca e del naso.
f) I giocattoli contenuti in alimenti o incorporati ad essi devono avere un loro imballaggio. L’imballaggio - come fornito - deve essere di dimensioni tali da impedirne l’ingestione e/o inalazione.
g) L’imballaggio dei giocattoli di cui alle lettere e) ed f) avente forma sferica, ovoidale o ellissoidale e ogni parte staccabile dell’imballaggio stesso o degli imballaggi cilindrici con estremità arrotondate, devono essere di dimensioni tali da non provocare l’ostruzione delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
h) Sono vietati i giocattoli che sono solidamente attaccati al prodotto alimentare al momento del consumo, tanto da richiedere la consumazione del prodotto alimentare perché si possa accedere direttamente al giocattolo. Le parti dei giocattoli direttamente attaccate a un prodotto alimentare in altro modo soddisfano i requisiti di cui alle lettere c) e d). […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 46 del 19_11_2021 N. 01 A11_00100_21 Lituania.pdf Sonaglio a forma di gufo |
371 kB | 0 |
Regolamento delegato (UE) 2021/2087
Regolamento delegato (UE) 2021/2087
Regolamento delegato (UE) 2021/2087 della Commissione del 6 luglio 2021 che modifica gli allegati II, III e IV del regolamento (UE) 2019/1009 del Parlamento europeo e del Consiglio al fine di aggiungere i materiali di ossidazione termica e i loro derivati come categoria di materiali costituenti nei prodotti fertilizzanti dell’UE
GU L 427/130 del 30.11.2021
Entrata in vigore: 20.12.2021
Applicazione a decorrere da 16.07.2022
________
Articolo 1
Il regolamento (UE) 2019/1009 è così modificato:
1) l’allegato II è modificato conformemente all’allegato I del presente regolamento;
2) l’allegato III è modificato conformemente all’allegato II del presente regolamento;
3) l’allegato IV è modificato conformemente all’allegato III del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 16 luglio 2022.
...
Collegati
[box-note]Regolamento (UE) 2019/1009
FAQs related to Regulation (EU) 2019/1009[/box-note]