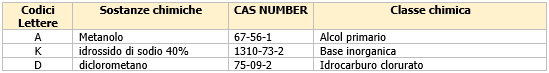
RAPEX Report 30 del 30/07/2021 N. 01 A11/00060/21 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 30 del 30/07/2021 N. 01 A11/00060/21 Ungheria
Approfondimento tecnico: Costume/maschera per bambini
Il prodotto di marca Jie Pai, mod. N0.1581, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-2:2020 “Sicurezza dei giocattoli - Infiammabilità”.
Il costume è facilmente infiammabile e la propagazione della fiamma è troppo veloce. Se prende fuoco, il bambino potrebbe ustionarsi.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
[…] II. Infiammabilità
1. I giocattoli non debbono costituire un pericoloso elemento infiammabile nell’ambiente del bambino. Devono pertanto essere costituiti da materiali conformi a una o più delle seguenti condizioni:
a) non bruciano se direttamente esposti all’azione di una fiamma, a una scintilla o a qualsiasi altra potenziale fonte di incendio;
b) non sono facilmente infiammabili (la fiamma si spegne non appena è rimossa la causa di incendio);
c) qualora prendano fuoco, bruciano lentamente, con una bassa velocità di propagazione della fiamma;
d) indipendentemente dalla composizione chimica del giocattolo, sono progettati in modo da ritardare meccanicamente il processo di combustione.
Tali materiali combustibili non debbono comportare rischi di accensione per altri materiali usati nel giocattolo. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 30 del 30_07_2021 N. 01 A11_00060_21 Ungheria.pdf Costume/maschera per bambini |
380 kB | 0 |
Anima - Position Paper proposta del Nuovo Regolamento Macchine
Anima - Position Paper proposta del Nuovo Regolamento Macchine
04.08.2021, ANIMA
Il nuovo Regolamento Macchine, una volta terminato il percorso di approvazione, sostituirà l’attuale Direttiva Macchine, l’atto legislativo che garantisce la libera circolazione delle macchine all'interno del mercato unico e un elevato livello di sicurezza dei lavoratori e dei cittadini dell'Unione utilizzatori di macchine. Anima Confindustria sta seguendo i lavori di revisione e ha pubblicato un Position Paper che commenta la proposta del Nuovo Regolamento Macchine in risposta alla consultazione pubblica aperta dalla Commissione Europea.
La priorità per la meccanica è garantire che il futuro regolamento mantenga un equilibrio tra gli aspetti legati alla sicurezza e quelli legati all’innovazione.
Nel Position Paper, Anima individua aspetti positivi, come l’adeguamento della legislazione al NLF e la conversione in un regolamento. Viene apprezzato inoltre il passo avanti in termini di digitalizzazione delle istruzioni e l’introduzione del concetto di modifica sostanziale accompagnata dal chiarimento degli obblighi in capo ai soggetti che modificano in modo sostanziale le macchine già in servizio.
Sono evidenziati, tuttavia, alcuni elementi preoccupanti di cui si propone una modifica o un miglioramento.
Anima chiede un alto livello di coordinamento e interazione tra il Regolamento Macchine e il Regolamento sull’Intelligenza Artificiale, per evitare requisiti contraddittori o sovrapposti (a oggi non è chiaro come sarà garantita la piena coerenza durante l'intero processo legislativo). È inoltre contraria alla certificazione obbligatoria da parte di enti terzi per le macchine ad alto rischio, un obbligo che comporterebbe un grande aggravio per i produttori dei macchinari interessati, in particolare le PMI, senza concreti benefici per la sicurezza degli utilizzatori.
Vengono inoltre sottolineati i rischi nel processo di standardizzazione, rispetto a quanto accade attraverso le tradizionali procedure, dovuti al potere della Commissione di adottare specifiche tecniche attraverso atti di esecuzione. Infine, Anima ritiene che alcuni dei nuovi requisiti essenziali di salute e sicurezza relativi alle tecnologie emergenti sarebbero meglio affrontati attraverso una legislazione orizzontale dedicata o norme per garantire la neutralità tecnologica.
...
Fonte: ANIMA
Collegati
[box-note]Proposal for a Regulation on machinery products
Direttiva macchine 2006/42/CE
Guida direttiva macchine 2006/42/CE - Ed. 2019 EN
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine
Tavola di concordanza estesa Direttiva/Regolamento Macchine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position Paper proposta del Nuovo Regolamento Macchine.pdf ANIMA 04.08.2021 |
665 kB | 31 |
Guanti di protezione rischi meccanici - EN 388:2016+A1:2018
Guanti di protezione rischi meccanici - EN 388:2016+A1:2018 / UNI EN 388:2019
ID 14243 | 08.08.2021 / Documento di lavoro completo in allegato (IT/EN)
Documento sui guanti di protezione da rischi meccanici DPI di cui alla norma EN 388:2016+A1:2018 (UNI EN 388:2019), norma armonizzata per il regolamento (UE) 2016/425 DPI, che prevede la marcatura CE, con l’illustrazione delle novità inerenti i metodi ed i livelli di prestazione al taglio ed alla marcatura specifica della norma.
[box-warning]Occorre effettuare la scelta del tipo dei guanti di protezione meccanica valutando i rischi della mansione.
I guanti di protezione dai rischi meccanici DPI, poiché presenti in diverse tipologie (livelli di prestazione e risposta all'uso) in relazione a parametri di:
- abrasione,
- taglio,
- lacerazione,
- perforazione,
devono essere scelti con cura ed in modo adeguato all'attività lavorativa/mansione (valutazione dei rischi) in accordo con la norma EN 388:2016+A1:2018.[/box-warning]
I guanti di protezione che tutelano dai rischi meccanici devono rispettare la EN 388. Questo standard era stato introdotto, per la prima volta, nel 2003, è stato poi integrato e sostituito nel 2016 ed emendato nel 2018 (A1 2018), ora UNI EN 388:2019.
La EN 388 specifica i requisiti per i guanti contro i rischi meccanici, i metodi di prova, la marcatura e tutte le informazioni relative necessarie.
I guanti di protezione contro i rischi meccanici devono essere resistenti all’abrasione, al taglio, allo strappo e alla perforazione.
La resistenza all'abrasione è testata sottoponendo il guanto ad una escoriazione causata da una pressione conosciuta.
La resistenza ai tagli, invece, viene testata attraverso il passaggio di una lama a velocità costante necessaria per tagliare il guanto (Ccoup Test), 2° Indice del codice di classificazione e dal 2016 anche attraverso il TDM test della EN ISO 13997:1999, che ha introdotto il 5° indice codice di classificazione dei guanti (vedi a seguire).
La resistenza allo strappo viene testata calcolando la forza necessaria per lacerare un guanto.
La resistenza alla perforazione viene valutata misurando la forza necessaria a provocare un foro con una punta di dimensioni standard.
Infine, la resistenza agli impatti può essere prevista se le prestazioni di prova soddisfano la EN 13594:2015
[box-warning]Resistenza al taglio: Coup Test e il Cut Test ISO (TDM test) conforme a EN ISO 13997:1999.
La EN 388:2016+A1:2018 prevede un Coup Test per calcolare il numero di cicli necessari per tagliare il guanto (Indici 1,2, 2,5, 5,0, 10,0 20,0 - Livelli da 1 a 5), e un TDM test (Test Lama Dritta test che utilizza un dispositivo chiamato Tomodynamometer (TDM).), definito dalla EN ISO 13997:1999, per valutare la resistenza ad un taglio effettuato da lama che si muove ad una distanza prefissata, soggetta a forza variabile (in Newton: 2, 5, 10, 15, 22, 30 - Livelli da A ad F.).[/box-warning]
[box-info]EN 388:2016+A1:2018 Guanti di protezione contro rischi meccanici
La norma EN 388:2016+A1:2018 è armonizzata per il regolamento (UE) 2016/425 (Decisione della Commissione del 18 maggio 2020 relativa alle norme armonizzate per i dispositivi di protezione individuale redatte a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. GU L 156/13 del 19.05.2020. Entrata in vigore: 19.05.2020).[/box-info]
...
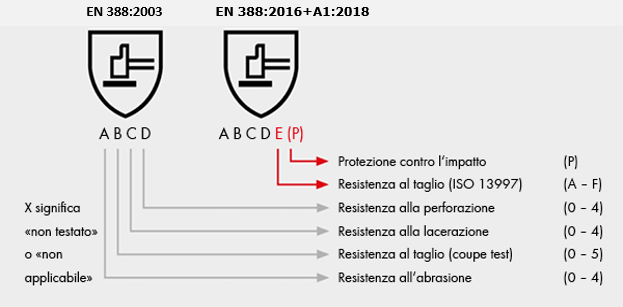
1. Nuova marcatura EN 388 (Ed. 2003 / Ed. 2018)
Scelta DPI: Guanti di protezioni meccaniche in base alla mansione svolta durante l’attività lavorativa
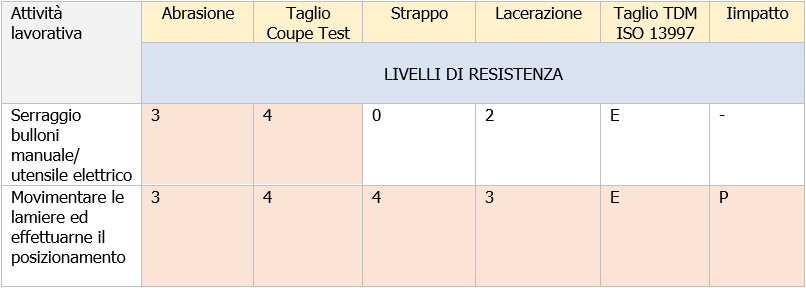
(*) Esempio: Addetto che svolge durante l’attività lavorativa la mansione i cui compiti sono:
- 50% dell’attività lavorativa consistente nel serraggio bulloni manuale/utensile elettrico e
- 50% consistente nel movimentare e posizionare lamiere
A. Categoria DPI
Categoria guanti DPI: I (lesioni meccaniche superficiali)
Tabella scelta DPI guanti di protezione meccanica in base ai livelli di resistenza
B. Livelli di resistenza e marcatura EN 388
In base alla valutazione effettuata all’addetto verrà assegnato il guanto contro i rischi meccanici, riportante il seguente pittogramma e marcatura (Classificazione minima)(**):
(*) Esempio e valutazione generica per la scelta di un tipo di guanto di protezione meccanica rispetto ad un'altro in relazione ai rischi della mansione
(**) Classificazione minima per il la mansione svolta, nel caso di utilizzo di sostanze chimiche o rischi termici / altro occorre scegliere anche guanti adeguati a tali rischi (marcatura combinata).
EN 374 - Guanti di protezione contro prodotti chimici e microorganismi
EN 407 - Guanti di protezione contro rischi termici
Altro
Normativa
La norma EN 388 NON è riportata nell’elenco delle norme presenti nel D.M. 2 maggio 2001 "Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI)", emanato nel 2001 in accordo con quanto previsto dall'articolo 45, comma 2, lettera a) del decreto legislativo n. 626 del 19 settembre 1994. Il decreto stabilisce i criteri per l'individuazione e l'uso dei dispositivi di protezione individuale (DPI), tenendo conto della natura, dell'attività e dei fattori specifici di rischio.
Con l'entrata in vigore del D.Lgs. 81/2008, le disposizioni inerenti i DPI oltre a quelle generali (....) sono previste al Titolo III USO DELLE ATTREZZATURE DI LAVORO E DEI DISPOSITIVI DI PROTEZIONE INDIVIDUALE, CAPO II - Uso dei dispositivi di protezione individuale (Art. 74÷79 e 87) ed i Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI) sono rimandati ad apposito decreto secondo quanto previsto dall'Art. 79 comma 2, non ancora emanato, ma nelle cui more di adozione restano ferme le disposizioni di cui al D.M. 2 maggio 2001.
[panel]D.Lgs. 81/2008
Art. 79 - Criteri per l'individuazione e l'uso
1. Il contenuto dell'allegato VIII, costituisce elemento di riferimento per l'applicazione di quanto previsto all'articolo 77, commi 1 e 4.
2. Con decreto del Ministro del lavoro, della salute e delle politiche sociali, di concerto con il Ministro dello sviluppo economico, sentita la Commissione consultiva permanente di cui all'articolo 6, tenendo conto della natura, dell'attività e dei fattori specifici di rischio sono indicati:
a) i criteri per l'individuazione e l'uso dei DPI;
b) le circostanze e le situazioni in cui, ferme restando le priorità delle misure di protezione collettiva, si rende necessario l'impiego dei DPI.
2-bis. Fino alla adozione del decreto di cui al comma 2 restano ferme le disposizioni di cui al decreto del Ministro del lavoro e della previdenza sociale in data 2 maggio 2001, pubblicato nella Gazzetta Ufficiale n. 126 del 1 ° giugno 2001.
....
ALLEGATO VIII
INDICAZIONI DI CARATTERE GENERALE RELATIVE A PROTEZIONI PARTICOLARI
[…]
Protezione delle mani
Nelle lavorazioni che presentano specifici pericoli di punture, tagli, abrasioni, ustioni, causticazioni alle mani, i lavoratori devono essere forniti di guanti o altri appropriati mezzi di protezione.
[…]
4. Indicazioni non esaurienti per la valutazione dei dispositivi di protezione individuale
1. Elementi di protezione per l’industria.
2. Occhiali protettivi e schermi per la protezione del viso.
3. Otoprotettori.
4. Autorespiratori.
5. Guanti di protezione.
6. Stivali e scarpe di sicurezza.
7. Indumenti di protezione.
8. Giubbotti di salvataggio per l’industria.
9. Dispositivi di protezione contro le cadute.
|
5. GUANTI DI PROTEZIONE |
||
|
RISCHI DA CUI PROTEGGERE |
||
|
Rischi |
Origine e forma dei rischi |
Criteri di sicurezza e prestazionali per la scelta del dispositivo |
|
Generali |
Contatto |
Zona della mano da proteggere |
|
Sollecitazioni connesse con l'utilizzo |
Resistenza allo strappo, allungamento, abrasione |
|
|
Meccanici |
Abrasivi, oggetti taglienti o appuntiti |
Resistenza alla penetrazione, al taglio |
|
Impatto |
Imbottitura |
|
|
Termici |
Materiali caldi o freddi, temperatura dell'ambiente |
Isolamento contro il caldo o il freddo |
|
Contatto con fiamme |
Non infiammabilità, resistenza alla fiamma |
|
|
Lavori di saldatura |
Protezione e resistenza alla radiazione e alle proiezioni di metalli fusi |
|
|
Elettrici |
Elettricità |
Isolamento elettrico |
|
Chimici |
Effetti dei prodotti chimici |
Impenetrabilità, resistenza |
|
Vibrazioni |
Vibrazioni meccaniche |
Attenuazione delle vibrazioni |
|
Contaminazioni |
Contatto con materiali radioattivi |
Impenetrabilità, facilità di decontaminazione, resistenza |
|
RISCHI DERIVANTI DAL DISPOSITIVO |
||
|
Rischi |
Origine e forma dei rischi |
Criteri di sicurezza e prestazionali per la scelta del dispositivo |
|
Disagio, interferenza con l'attività lavorativa |
Comfort inadeguato |
-Progetto ergonomico: |
|
Infortuni e rischi per la salute |
Scarsa compatibilità |
Qualità dei materiali |
|
Carenza di igiene |
Facilità di manutenzione |
|
|
Calzata insoddisfacente |
Progetto del modello |
|
|
Invecchiamento |
Esposizione a fenomeni atmosferici, condizioni dell'ambiente, pulizia, utilizzo |
-Resistenza del dispositivo alle condizioni di utilizzo industriali |
|
RISCHI DERIVANTI DALL'USO DEL DISPOSITIVO |
||
|
Rischi |
Origine e forma dei rischi |
Criteri di sicurezza e prestazionali per la scelta del dispositivo |
|
Protezione inadeguata |
Errata scelta del dispositivo |
- Scelta del dispositivo in relazione al tipo, entità dei rischi e condizioni di lavoro |
|
Uso non corretto del dispositivo |
-Impiego appropriato del dispositivo con attenzione al rischio |
|
|
Dispositivo sporco, logoro o deteriorato |
-Mantenimento del dispositivo in buono stato |
|
[/panel]
Regolamento (UE) 2016/425 (DPI)
Regolamento (UE) 2016/425 del Parlamento Europeo e del Consiglio del 9 marzo 2016 sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GU L 81/51 del 31 Marzo 2016)
…
Capo III Conformità del DPI
...
Allegato I Categorie di rischio dei DPI
Il presente allegato definisce le categorie di rischio da cui i DPI sono destinati a proteggere gli utilizzatori.
I Guanti di protezione contro i rischi meccanici possono rientrare in categoria 1, 2 o 3:
Categoria I
La categoria I comprende esclusivamente i seguenti rischi minimi:
a) lesioni meccaniche superficiali;
b) contatto con prodotti per la pulizia poco aggressivi o contatto prolungato con l'acqua;
c) contatto con superfici calde che non superino i 50 °C;
d) lesioni oculari dovute all'esposizione alla luce del sole (diverse dalle lesioni dovute all'osservazione del sole);
e) condizioni atmosferiche di natura non estrema.
Categoria II
La categoria II comprende i rischi diversi da quelli elencati nelle categorie I e III.
Categoria III
La categoria III comprende esclusivamente i rischi che possono causare conseguenze molto gravi quali morte o danni alla salute irreversibili con riguardo a quanto segue:
a) sostanze e miscele pericolose per la salute;
b) atmosfere con carenza di ossigeno;
c) agenti biologici nocivi;
d) radiazioni ionizzanti;
e) ambienti ad alta temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di almeno 100 °C;
f) ambienti a bassa temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di - 50 °C o inferiore;
g) cadute dall'alto;
h) scosse elettriche e lavoro sotto tensione;
i) annegamento;
j) tagli da seghe a catena portatili;
k) getti ad alta pressione;
l) ferite da proiettile o da coltello;
m) rumore nocivo.
_________
EN 388:2016+A1:2018 Guanti di protezione contro i rischi meccanici
Estratto (Traduzione IT non ufficiale)
3 Termini e definizioni
Ai fini del presente documento, si applicano i seguenti termini e definizioni.
3.1 guanto di protezione contro i rischi meccanici
guanto che fornisce protezione contro almeno uno dei seguenti rischi meccanici: abrasione, taglio da lama, strappo e perforazione
3.2 guanto che fornisce una protezione specifica
guanto progettato per fornire un'area di protezione migliorata per l'intera mano o parte di essa
Nota 1 alla voce: Ad esempio, stile di protezione del palmo o protezione contro gli urti.
3.3 serie di guanti
tipo di guanto singolo o tipo di guanto con lo stesso materiale del palmo fino alla linea del polso dove le uniche varianti sono taglia, lunghezza, mano sinistra/destra e colore.
3.4 braccio
parte del corpo tra il polso e la spalla
3.5 guanti composti da più strati
- strati non incollati: guanto costituito da 2 o più strati di materiali non collegati tra loro, previa preparazione del campione per il test;
- strati incollati: un guanto costituito da 2 o più strati di materiali collegati tra loro (ad esempio incollati, cuciti, immersi, impregnati) dopo aver preparato il campione per il test
3.6 ciclo di abrasione
completamento di tutti i movimenti di abrasione traslazionale tracciando una figura di Lissajous composta da 16 sfregamenti, ovvero 16 giri dei due motori esterni e 15 giri del motore interno dell'abrasimetro Martindale
[FONTE: EN ISO 12947-1]
Nota 1 alla voce:
Uno sfregamento da abrasione è un giro degli azionamenti esterni del tester di abrasione Martindale (vedi EN ISO 12947-1).
3.7 protezione del braccio
manica protettiva separata dal guanto o dall'abbigliamento che fornisce protezione contro almeno uno dei seguenti rischi meccanici: abrasione, taglio da lama, strappo e perforazione
[...]
7 Marcatura
7.1 Generale
La marcatura del guanto protettivo o della protezione per le braccia deve essere conforme alle clausole applicabili della EN 420.
7.2 Pittogrammi
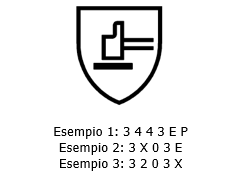
Per i guanti che soddisfano i requisiti della clausola 4, le proprietà meccaniche del guanto devono essere indicate dal pittogramma, vedere la Figura 10, per i rischi meccanici seguiti dai rispettivi livelli di prestazione di ciascuna prova meccanica (vedere la Figura 11).
Il primo numero corrisponde alla resistenza all'abrasione, il secondo alla resistenza al taglio della lama, il terzo alla resistenza allo strappo, il quarto alla resistenza alla perforazione e il quinto carattere (una lettera) alla resistenza al taglio EN ISO 13997:1999 (come mostrato nelle tabelle 1 e 2).
Il livello di taglio numerico come da 6.2 può essere facoltativamente riportato nella marcatura a fianco del livello alfabetico dato dai risultati della prova secondo il livello alfabetico del metodo EN ISO 13997:1999.
Il posizionamento del pittogramma e dei livelli di prestazione l'uno rispetto all'altro deve essere conforme alla EN 420.
Figura 10 - Pittogramma per rischi meccanici
7.3 Marcatura di requisiti aggiuntivi
Protezione dagli urti
Quando i requisiti forniti in 4.2.1 sono soddisfatti dai guanti, il codice di marcatura "P" viene aggiunto dopo il numero dei cinque livelli di prestazione (vedi esempio in Figura 11).
7.4 Esempi di marcatura
Figure 11 - Esempio di marcatura per i rischi meccanici
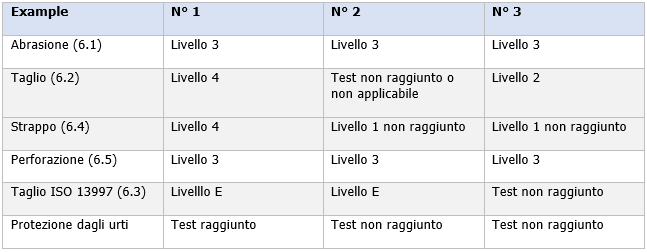
Tabella 4 - Spiegazione degli esempi forniti in Figura 11
...
segue in allegato
Certifico Srl - IT/EN | Rev. 0.0 2021
©Copia autorizzata Abbonati
Collegati
[box-note]UNI EN 388:2019
Regolamento (UE) 2016/425
Elenco norme armonizzate Regolamento DPI
D.Lgs. 81/2008
Decreto Legislativo n. 475 del 4 dicembre 1992
Dichiarazione di Conformita' UE DPI: Regolamento (UE) 2016/425
Guanti di protezione rischi chimici - EN 374-1:2016/A1:2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guanti di protezione rischi meccanici EN 388 2016 A1 2018 Rev. 0.0 2021.pdf Certifico Srl - Rev. 0.0 2021 |
336 kB | 730 |
Vademecum Guanti di Protezione / DPI mani e braccia
Vademecum Guanti di Protezione / DPI mani e braccia New 2022
ID 14234 | 03.04.2022 / Vademecum completo in allegato
Documento illustrativo sui dispositivi di protezione delle mani e delle braccia, DPI guanti atti a proteggere il più possibile i lavoratori dai rischi derivanti dall’attività lavorativa, indicandone i principi di progettazione e fabbricazione ed i criteri di scelta da parte del datore.
Il documento rielabora, anche per mezzo di schemi ed immagini, la normativa di riferimento e le seguenti norme tecniche.
1. Norma tecnica generale:
EN ISO 21420:2020 - Guanti protezione - Requisiti generali (sostituisce EN 420)
| EN ISO 21420 |
 |
2. Norme tecniche specifiche:
EN 388 - Guanti di protezione contro i rischi meccanici
EN ISO 374-1 - Guanti di protezione contro i prodotti chimici e microorganismi pericolosi
EN 511 - Guanti di protezione contro il freddo
EN 407 - Guanti di protezione/altri dispositivi di protezione delle mani contro rischi termici
EN 421 - Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattivà
EN 12477 - Guanti di protezione per saldatori
| EN 388 | EN ISO 374-1 | EN 511 | EN 407 | EN 421 | EN 12477 |
 |
 |
 |
 |
 |
 |
[box-warning]NB
Il Documento è aggiornato alle norme tecniche e riferimenti legislativi in vigore al 03.04.2022[/box-warning]
[panel]Vademecum (pagine documento: nr. 100), così strutturato:
Indice
1. Premessa
2. Normativa di riferimento
2.1 D.M. 2 maggio 2001
2.2 D.Lgs 81/2008
2.3 Regolamento (UE) 2016/425 (DPI)
2.4 Norme armonizzate Guanti DPI
3. Guanti di protezione - Requisiti generali e metodi di prova
4. Guanti di protezione contro i rischi meccanici (EN 388)
5. Guanti di protezione contro i prodotti chimici e microorganismi pericolosi (EN ISO 374-1)
6. Guanti di protezione contro il freddo (EN 511)
7. Guanti di protezione e altri dispositivi di protezione delle mani contro rischi termici (calore e/o fuoco) (EN 407)
8. Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattivà (EN 421)
9. Guanti di protezione per saldatori (EN 12477)
Fonti[/panel]
I guanti devono essere progettati secondo le condizioni d’impiego in modo da proteggere il più possibile i lavoratori dai rischi derivanti dall’attività lavorativa ed è cura del fabbricante, progettare e fabbricare guanti destinati a rischi specifici, mentre è cura del datore di lavoro effettuare una scelta oculata del guanto stesso in modo da ridurre il più possibile i rischi derivanti dall’attività lavorativa. Scelta che deve avvenire basandosi sulle indicazioni contenute nel Decreto legislativo 81/2008 e attraverso una idonea valutazione dei rischi.
I guanti devono essere impiegati quando i rischi non possono essere evitati o sufficientemente ridotti da misure tecniche di prevenzione, da mezzi di protezione collettiva, da misure, metodi o procedimenti di riorganizzazione del lavoro.
La scelta dei guanti dipende dalla mansione del lavoratore, dalle caratteristiche del guanto e dalla biocompatibilità. La “presa” deve essere sempre garantita. In commercio sono disponibili guanti di materiale diverso e con caratteristiche diverse, quindi il termine generico “guanto” non è indicativo della esclusività del dispositivo di protezione.
I DPI per le mani e per le braccia vengono classificati in funzione dei rischi per i quali sono progettati e costruiti:
[alert]- Meccanici (tagli, graffi, abrasioni ecc.);
- Biologici (schizzi, contatto con materiale biologico ecc);
- Fisici (freddo, caldo, radiazioni, tensioni elettriche, ecc);
- Chimici (contatti con prodotti e preparati pericolosi ecc.).
- Rischi termici;
- Rischi elettrici.[/alert]
La protezione da tali rischi si può ottenere tramite DPI di diversa conformazione anche in funzione della parte della mano e/o del braccio che si vuol proteggere.
Per affrontare al meglio i rischi specifici questi DPI sono costruiti nelle seguenti tipologie.
Guanti:
- a manopola,
- a tre dita,
- a cinque dita,
- a mezze dita.
Tabella - DPI modalità di progettazione
I requisiti generali e fondamentali sono:
Fabbricazione e design
- I guanti devono offrire il più alto grado possibile di protezione nello svolgimento del lavoro
- Le cuciture eventualmente presenti sul guanto non devono diminuire le prestazioni generali dello stesso
Innocuità
- I guanti non devono creare rischi per l’utilizzatore
- Il valore del PH del guanto deve essere fra 3,5 e 9,5.
Comfort
La confortevolezza è legata alla taglia, e quindi alla misura, delle mani e dei guanti. Le taglie dei guanti sono definite sulla base di due caratteristiche dimensionali delle mani:
- Circonferenza;
- Lunghezza.
Destrezza
La destrezza offerta dal guanto dovrebbe essere la massima possibile. Dipende da vari fattori quali lo spessore del materiale, la sua elasticità e la sua deformabilità.
Istruzioni per la pulizia
Nel caso in cui vengano fornite istruzioni per il lavaggio, il massimo numero di cicli di lavaggio raccomandati non deve pregiudicare i livelli di prestazione dei guanti.
Permeabilità e assorbimento del vapore acqueo
I guanti devo permettere la permeabilità al vapore acqueo. Qualora le caratteristiche del DPI impediscano o escludano la permeabilità al vapore acqueo, il DPI dovrà essere progettato per ridurre il più possibile gli effetti della traspirazione. L’assorbimento del vapore acqueo deve essere almeno 8 mg/cm2 per 8 ore.
Marcatura
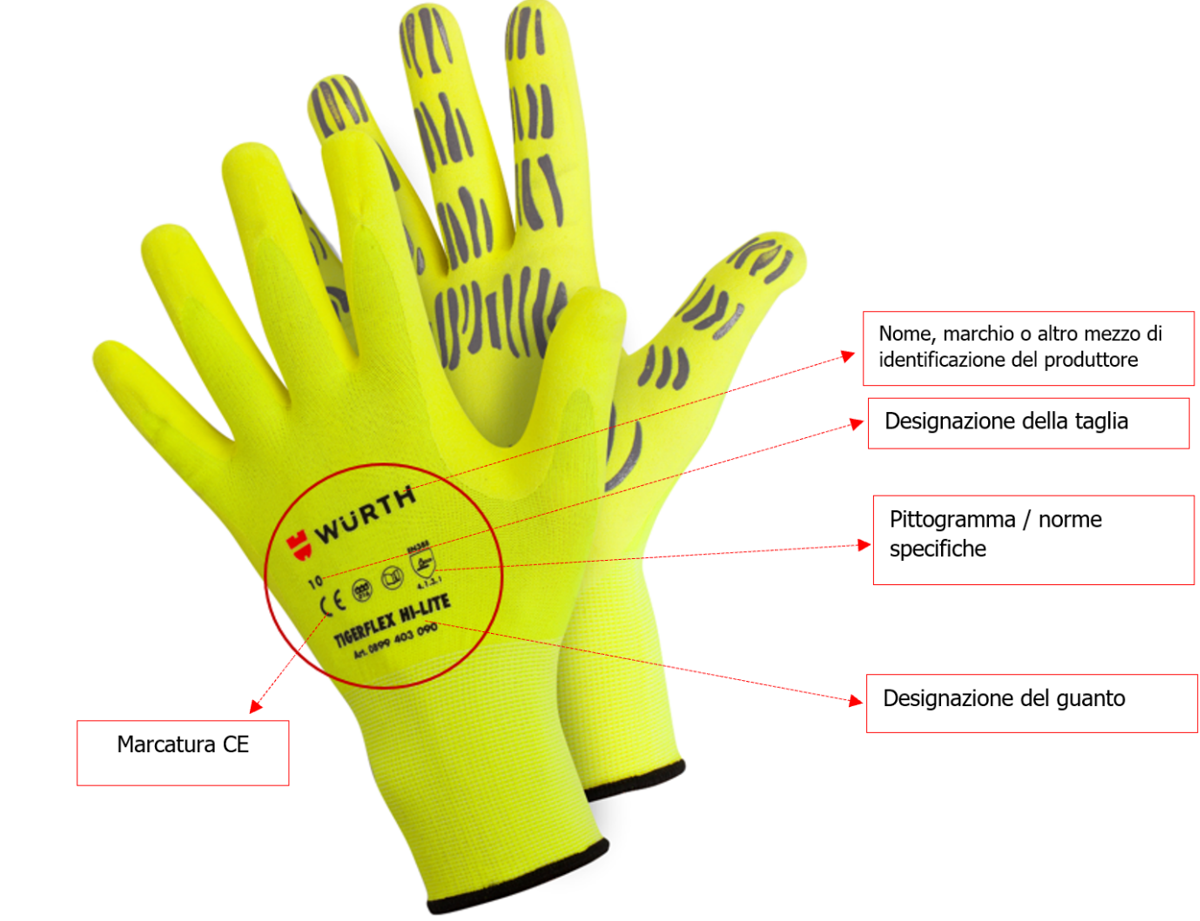
Ogni guanto di protezione deve essere marcato con le seguenti informazioni:
[box-info]a) Nome, marchio o altro mezzo di identificazione del produttore o del suo rappresentante autorizzato.
b) Designazione del guanto (nome commerciale o codice che consente all'utilizzatore di identificare chiaramente il prodotto all'interno della gamma del produttore/rappresentante autorizzato).
c) Designazione delle taglie.
d) Se il guanto è conforme a una o più norme specifiche, il pittogramma o i pittogrammi devono essere conformi a quanto specificato nell'appendice C. Ogni pittogramma deve essere accompagnato dal riferimento della norma specifica applicabile e dai livelli di prestazioni, che devono essere sempre riportati nella stessa sequenza fissa definita nella norma corrispondente.
e) Data di produzione, almeno il mese e l'anno (per esempio 11/2021), o qualsiasi mezzo che garantisca la tracciabilità del lotto di produzione.
f) Se applicabile, la data di obsolescenza, almeno il mese e l'anno (per esempio 11/2021), dietro il pittogramma della clessidra.[/box-info]
Normativa di riferimento
- D.M. 2 maggio 2001
- D.Lgs. 81/2008
- Regolamento (UE) 2016/425
- Decreto legislativo 4 dicembre 1992, n. 475
- Norma armonizzate Regolamento (UE) 2016/425
- Norme tecniche
Quadro normativo Dispositivi di protezione individuale (DPI), così articolato:
1. Entrata in vigore del nuovo Regolamento (UE) 2016/425 che stabilisce i requisiti per la progettazione e la fabbricazione dei dispositivi di protezione individuale (marcatura CE) in sostituzione della direttiva 89/686/CEE (GU L 81/51 del 31 Marzo 2016)
2. Pubblicazione del Decreto Legislativo 19 febbraio 2019 n. 17 di adeguamento della normativa nazionale alle disposizioni del Regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio, del 9 marzo 2016, sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio. (GU n.59 del 11.03.2019) (Modifiche al decreto legislativo 4 dicembre 1992, n. 475);
3. Un aggiornamento/nuovo decreto previsto nel D.M. 2 maggio 2001 "Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI)", e dal D.Lgs. 81/2008 Art. 79 c. 2, dovrebbe allineare la legislazione e normativa tecnica (o da prevedere una procedura di armonizzazione tra la normativa legislativa e normativa tecnica).
Il D.M. 2 maggio 2001 "Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI)" è stato emanato nel 2001 in accordo con quanto previsto dall'articolo 45, comma 2, lettera a) del decreto legislativo n. 626 del 19 settembre 1994, stabilisce i criteri per l'individuazione e l'uso dei dispositivi di protezione individuale (DPI), tenendo conto della natura, dell'attività e dei fattori specifici di rischio.
4. Con l'entrata in vigore del D.Lgs. 81/2008, le disposizioni inerenti i DPI oltre a quelle generali (....) sono previste al Titolo IIII USO DELLE ATTREZZATURE DI LAVORO E DEI DISPOSITIVI DI PROTEZIONE INDIVIDUALE, CAPO II Uso dei dispositivi di protezione individuale (Art. 74÷79 e 87) ed i Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI) è rimandata ad apposito decreto secondo l'Art. 79 comma 2, non ancora emanato, ma nelle cui more di emanazione restano ferme le disposizioni del D.M. 2 maggio 2001, aggiornato con le edizioni delle norme UNI più recenti (disposizione introdotta dalla Legge 17 dicembre 2021 n. 215 , conversione in legge, con modificazioni, del decreto-legge 21 ottobre 2021, n. 146, in quanto nel testo del D.M. 2 maggio 2001, erano riportati riferimenti alle norme UNI ormai non più in vigore).
Difatti, la Legge 17 dicembre 2021 n. 215, conversione in legge, con modificazioni, del decreto-legge 21 ottobre 2021, n. 146, recante misure urgenti in materia economica e fiscale, a tutela del lavoro e per esigenze indifferibili, in GU n.301 del 20.12.2021, con la lettera e-quinquies) interviene sull’articolo 79 del D.Lgs. 81/2008disponendo l’aggiornamento dei riferimenti alla normativa tecnica contenuta nel D.M. 2 maggio 2001.
[panel]Art. 77 - Obblighi del datore di lavoro D.Lgs. 81/2008
1. Il datore di lavoro ai fini della scelta dei DPI:
a) effettua l'analisi e la valutazione dei rischi che non possono essere evitati con altri mezzi;
b) individua le caratteristiche dei DPI necessarie affinché questi siano adeguati ai rischi di cui alla lettera a), tenendo conto delle eventuali ulteriori fonti di rischio rappresentate dagli stessi DPI;
c) valuta, sulla base delle informazioni e delle norme d'uso fornite dal fabbricante a corredo dei DPI, le caratteristiche dei DPI disponibili sul mercato e le raffronta con quelle individuate alla lettera b);
d) aggiorna la scelta ogni qualvolta intervenga una variazione significativa negli elementi di valutazione.
2. Il datore di lavoro, anche sulla base delle norme d'uso fornite dal fabbricante, individua le condizioni in cui un DPI deve essere usato, specie per quanto riguarda la durata dell'uso, in funzione di:
a) entità del rischio;
b) frequenza dell'esposizione al rischio;
c) caratteristiche del posto di lavoro di ciascun lavoratore;
d) prestazioni del DPI.
3. Il datore di lavoro, sulla base delle indicazioni del decreto di cui all'articolo 79, comma 2, fornisce ai lavoratori DPI conformi ai requisiti previsti dall'articolo 76.
4. Il datore di lavoro:
a) mantiene in efficienza i DPI e ne assicura le condizioni d'igiene, mediante la manutenzione, le riparazioni e le sostituzioni necessarie e secondo le eventuali indicazioni fornite dal fabbricante;
b) provvede a che i DPI siano utilizzati soltanto per gli usi previsti, salvo casi specifici ed eccezionali, conformemente alle informazioni del fabbricante;
c) fornisce istruzioni comprensibili per i lavoratori;
d) destina ogni DPI ad un uso personale e, qualora le circostanze richiedano l'uso di uno stesso DPI da parte di più persone, prende misure adeguate affinché tale uso non ponga alcun problema sanitario e igienico ai vari utilizzatori;
e) informa preliminarmente il lavoratore dei rischi dai quali il DPI lo protegge;
f) rende disponibile nell'azienda ovvero unità produttiva informazioni adeguate su ogni DPI;
g) stabilisce le procedure aziendali da seguire, al termine dell'utilizzo, per la riconsegna e il deposito dei DPI;
h) assicura una formazione adeguata e organizza, se necessario, uno specifico addestramento circa l'uso corretto e l'utilizzo pratico dei DPI.
5. In ogni caso l'addestramento è indispensabile:
a) per ogni DPI che, ai sensi del decreto legislativo 4 dicembre 1992, n. 475, appartenga alla terza categoria;
b) per i dispositivi di protezione dell'udito.
Art. 79 - Criteri per l’individuazione e l’uso
1. Il contenuto dell’allegato VIII, costituisce elemento di riferimento per l’applicazione di quanto previsto all’articolo 77, commi 1 e 4.
2. Con decreto del Ministro del lavoro, della salute e delle politiche sociali, di concerto con il Ministro dello sviluppo economico, sentita la Commissione consultiva permanente di cui all’articolo 6, tenendo conto della natura, dell’attività e dei fattori specifici di rischio sono indicati:
a) i criteri per l’individuazione e l’uso dei DPI;
b) le circostanze e le situazioni in cui, ferme restando le priorità delle misure di protezione collettiva, si rende necessario l’impiego dei DPI.
2-bis. Fino alla adozione del decreto di cui al comma 2 restano ferme le disposizioni di cui al decreto del Ministro del lavoro e della previdenza sociale in data 2 maggio 2001, pubblicato nella Gazzetta Ufficiale n. 126 del 1° giugno 2001.
ALLEGATO VIII
…
[...][/panel]
Regolamento (UE) 2016/425 (DPI)
Regolamento (UE) 2016/425 del Parlamento Europeo e del Consiglio del 9 marzo 2016 sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GU L 81/51 del 31 Marzo 2016)
…
Capo III Conformità del DPI
...
Allegato I Categorie di rischio dei DPI
Il presente allegato definisce le categorie di rischio da cui i DPI sono destinati a proteggere gli utilizzatori.
Categoria I
La categoria I comprende esclusivamente i seguenti rischi minimi:
a) lesioni meccaniche superficiali;
b) contatto con prodotti per la pulizia poco aggressivi o contatto prolungato con l'acqua;
c) contatto con superfici calde che non superino i 50 °C;
d) lesioni oculari dovute all'esposizione alla luce del sole (diverse dalle lesioni dovute all'osservazione del sole);
e) condizioni atmosferiche di natura non estrema.
Categoria II
La categoria II comprende i rischi diversi da quelli elencati nelle categorie I e III.
Categoria III
La categoria III comprende esclusivamente i rischi che possono causare conseguenze molto gravi quali morte o danni alla salute irreversibili con riguardo a quanto segue:
a) sostanze e miscele pericolose per la salute;
b) atmosfere con carenza di ossigeno;
c) agenti biologici nocivi;
d) radiazioni ionizzanti;
e) ambienti ad alta temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di almeno 100 °C;
f) ambienti a bassa temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di - 50 °C o inferiore;
g) cadute dall'alto;
h) scosse elettriche e lavoro sotto tensione;
i) annegamento;
j) tagli da seghe a catena portatili;
k) getti ad alta pressione;
l) ferite da proiettile o da coltello;
m) rumore nocivo
...
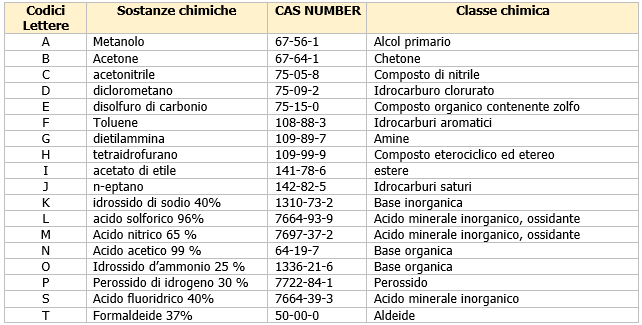
Norme armonizzate DPI guanti
I requisiti generali e fondamentali che “devono possedere tutti i tipi di guanti destinati alla protezione dai rischi lavorativi sono definiti nella norma EN ISO 21420:2020”.
Ad esempio sono definiti:
- i criteri di realizzazione del guanto;
- i requisiti generali di innocuità, di ergonomia, di funzionalità e di pulizia;
- le modalità di marcatura;
- le informazioni da applicare a tutti i tipi guanti di protezione.
UNI EN ISO 21420:2020 Guanti di protezione - Requisiti generali e metodi di prova (Sostituisce: UNI EN 420:2010)
La norma specifica i requisiti generali e i corrispondenti procedimenti di prova per la progettazione e la fabbricazione dei guanti, l'innocuità, la confortevolezza, l'efficienza, la marcatura e le informazioni fornite dal fabbricante, applicabili a tutti i guanti di protezione.
Essa può anche essere applicata ai protettori per le braccia e ai guanti permanentemente incorporati in camere di contenimento.
La norma non tratta le proprietà protettive dei guanti e pertanto non è utilizzata da sola, ma solo in combinazione con la norma specifica appropriata.
Un elenco non esaustivo di tali norme è fornito in bibliografia.
I guanti devono “essere progettati secondo le condizioni d’impiego in modo da proteggere il più possibile i lavoratori dai rischi derivanti dall’attività lavorativa”: è “cura del fabbricante, progettare e fabbricare guanti destinati a rischi specifici, mentre è cura del datore di lavoro effettuare una scelta oculata del guanto stesso in modo da ridurre il più possibile i rischi derivanti dall’attività lavorativa”. Scelta che deve avvenire basandosi sulle indicazioni contenute nel Decreto legislativo 81/2008 e attraverso una idonea valutazione dei rischi.
[box-info] Tra i guanti che possono essere utilizzati dai lavoratori vi sono:
- guanti di protezione contro i rischi meccanici: devono rispettare i requisiti della UNI EN 420/EN ISO 21420:2020 e della EN 388:2016+A1:2018);
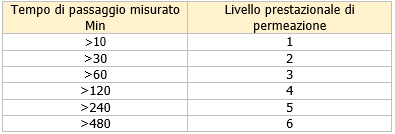
- guanti di protezione contro gli agenti chimici e i microrganismi (UNI EN 374-1:2019): la norma citata “fornisce i requisiti prestazionali dei guanti sottoposti all’azione degli agenti chimici e biologici”. Ad esempio fa riferimento alla penetrazione (“processo di diffusione di un prodotto chimico e/o di un microrganismo attraverso porosità, linee di saldatura, punti di spillo o altre imperfezioni del guanto di protezione”) e la permeazione (“il tempo impiegato dal prodotto chimico per passare dalla superficie esterna alla superficie interna al guanto; questo valore varia da 1 a 6 in funzione del tempo di passaggio”) di cui bisognerà tener conto quando si procede alla scelta del guanto più adatto. Queste informazioni “sono riportate sul foglietto informativo predisposto dal fabbricante e allegato al prodotto”. Inoltre in fase di scelta “oltre al tempo di permeazione, è necessario tenere conto anche del tasso di permeazione” e del livello di degradazione (“inteso come il tempo che occorre al materiale per perdere il 30% circa delle sue caratteristiche meccaniche iniziali”);
- guanti di protezione contro il freddo (UNI EN 511:2006): la norma “si applica ai guanti che proteggono le mani dal freddo convettivo e da contatto” e “l’efficacia della protezione termica contro il freddo e la penetrazione dell’acqua è indicata da un codice di tre cifre”;
- guanti di protezione contro i rischi termici (UNI EN 407:2020): la norma “definisce i metodi di prova, i requisiti generali, i livelli di prestazione termica e marcatura dei guanti di protezione contro il calore e/o fuoco” e “si applica a tutti i guanti che proteggono contro il calore e/o fiamme in una o più delle seguenti forme: fuoco, calore per contatto, radiante, convettivo, piccoli spruzzi o grandi proiezioni di metallo fuso”. Nel D.Lgs. 475/92 questi DPI “sono suddivisi in tre categorie in base al grado di rischio”;
- guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattiva (UNI EN 421): la norma “stabilisce i requisiti e i metodi di prova dei guanti per la protezione da radiazioni ionizzanti e contaminazione radioattiva e i guanti devono rispondere sia alla norma tecnica EN 421 (“per la protezione dalla contaminazione, l’efficienza di attenuazione e l’uniformità di distribuzione del materiale da protezione”) che agli “standard stabiliti dalla norma EN 374”.
- guanti di protezione per saldatori (UNI EN 12477:2006): la norma specifica requisiti e metodi di prova per guanti di protezione da utilizzare nella saldatura manuale dei metalli, nel taglio e nei procedimenti connessi.[/box-info]
[...]
[alert]Guanti di protezione - Requisiti generali e metodi di prova EN 21420
[/alert]
La norma UNI EN ISO 21420:2020 specifica i requisiti generali e i corrispondenti procedimenti di prova per la progettazione e la fabbricazione dei guanti, l'innocuità, la confortevolezza, l'efficienza, la marcatura e le informazioni fornite dal fabbricante, applicabili a tutti i guanti di protezione.
Essa può anche essere applicata ai protettori per le braccia e ai guanti permanentemente incorporati in camere di contenimento.
La norma non tratta le proprietà protettive dei guanti e pertanto non è utilizzata da sola, ma solo in combinazione con la norma specifica appropriata.
Un elenco non esaustivo di tali norme è fornito in bibliografia.
Il guanto di protezione deve essere progettato e fabbricato in modo che, nelle condizioni d'uso prevedibili, la persona che lo indossa possa svolgere l'attività nel modo più normale possibile con una protezione adeguata.
Il presente documento, insieme alle norme specifiche appropriate, deve essere utilizzato per verificare tale adeguatezza.
Se richiesto dalla norma specifica pertinente, il guanto deve essere progettato in modo da ridurre al minimo i tempi necessari a indossarlo e sfilarlo.
Per i guanti multistrato riutilizzabili, i guanti devono poter essere rimossi senza separazione degli strati delle dita. Quando la costruzione del guanto comprende le cuciture, il materiale e la resistenza delle cuciture devono essere tali che le prestazioni complessive del guanto non vengano significativamente ridotte, come richiesto dalle norme specifiche pertinenti.
[...]
La marcatura deve essere apposta in modo da essere visibile e leggibile per tutta la vita utile prevedibile del guanto. I marchi o le iscrizioni che potrebbero essere confusi con i marchi di cui sopra non devono essere apposti sul guanto.
Se non è possibile apporre la marcatura sul guanto date le caratteristiche del prodotto, la marcatura deve essere apposta sull'imballaggio o su qualsiasi documento fornito con il guanto.
Un pittogramma deve essere usato solo quando il guanto soddisfa almeno il requisito minimo della norma specifica pertinente.
Nota
La marcatura sul guanto, compresi i pittogrammi, non è di per sé sufficiente a trasmettere all'utilizzatore finale informazioni complete sulla protezione. Essa viene considerata solo congiuntamente alle informazioni fornite dal fabbricane.
Immagine - Esempio marcatura guanto
[...] Segue in allegato
[...]
[alert]Guanti di protezione contro i rischi meccanici EN 388
[/alert]
I guanti di protezione che tutelano dai rischi meccanici devono rispettare la EN 388. Questo standard era stato introdotto, per la prima volta, nel 2003 ed è stato poi integrato e sostituito nel 2016. La norma specifica i requisiti essenziali per dei guanti contro i rischi meccanici, i metodi di prova, la marcatura e tutte le informazioni relative necessarie.
I guanti di protezione contro i rischi meccanici devono essere resistenti all’abrasione, al taglio, allo strappo e alla perforazione. La tutela contro il rischio di abrasione è testata sottoponendo il guanto ad una escoriazione causata da una pressione conosciuta. Per la protezione contro i tagli, invece, viene calcolato il numero di passaggi di una lama a velocità costante necessari per tagliare l’attrezzatori.
La resistenza allo strappo viene testata calcolando la forza necessaria per lacerare un guanto. Infine, la resistenza alla perforazione viene valutata misurando la forza necessaria a provocare un foro con una punta di dimensioni standard.
La EN 388:2016+A1:2018 prevede un Coup Test per calcolare il numero di cicli necessari per tagliare il guanto, e un TDM test, definito dalla EN ISO 13997:1999, per valutare la resistenza ad un taglio effettuato da lama che si muove ad una distanza prefissata, soggetta a forza variabile.
[box-info]EN 388:2016+A1:2018 Guanti di protezione contro rischi meccanici
La norma è 388:2016+A1:2018 è armonizzata al regolamento (UE) 2016/425 (Decisione della Commissione del 18 maggio 2020 relativa alle norme armonizzate per i dispositivi di protezione individuale redatte a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. GU L 156/13 del 19.05.2020. Entrata in vigore: 19.05.2020)
La norma EN 388:2016 verrà ritirata il 19 novembre 2021.[/box-info]
...
Scelta DPI: Guanti di protezioni rischi chimici
Per essere certificati come "protettivi chimicamente" in conformità alla norma EN ISO 374-1 e recare uno dei pittogrammi della beuta, i guanti devono prima soddisfare i requisiti di resistenza alla penetrazione di cui alla norma EN 374-2:2014 clausole 7.2 e 7.3.
La penetrazione è il movimento di una sostanza chimica attraverso un'imperfezione, come un foro stenopeico o un altro difetto, ed è un fenomeno fisico in cui il liquido passa attraverso il materiale a livello non molecolare. La penetrazione viene valutata riempiendo il guanto separatamente con aria e acqua, seguita da una valutazione per determinare se vi sono perdite.
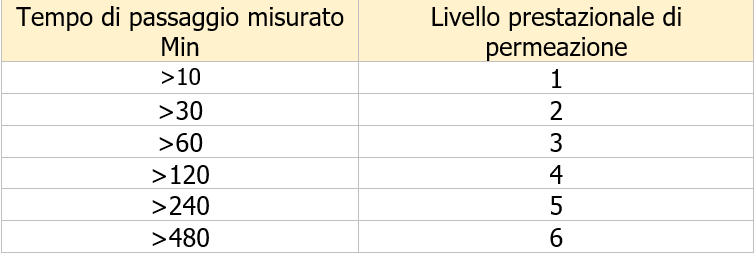
La resistenza alla permeazione è valutata secondo EN 16523-1.
Ci sono sei diversi livelli di prestazione:
Questo è il tempo che intercorre dall'inizio del test al momento in cui viene rilevato che la sostanza chimica si muove attraverso il materiale a una velocità definita di 1µg per cm 2 al minuto.
Nella norma EN ISO 374-1 è presente un elenco di 18 sostanze chimiche ed il livello di prestazione di un guanto rispetto a queste sostanze chimiche definisce il "tipo" di guanto resistente alle sostanze chimiche e, quindi, il pittogramma utilizzato nella marcatura dei guanti.
I guanti saranno classificati come "tipo C" se si ottiene almeno il "livello 1" di prestazione rispetto ad almeno una delle 18 sostanze chimiche elencate. La classificazione di "Tipo B" riguarda i guanti che soddisfano un minimo di "livello 2" rispetto ad almeno tre delle 18 sostanze chimiche e i guanti di "tipo A" sono quelli che raggiungono un livello minimo di prestazione 2 rispetto ad almeno sei delle 18 sostanze chimiche.
Pe quanto attiene inoltre la scelta dei guanti adeguati, indicazioni generali possono essere ricavate dall’allegato VIII del DLgs 81/08.
Inoltre si deve tenere conto della scheda di sicurezza che nella Sezione 8, punto 8.2.2.2, in riferimento alla protezione delle mani, il tipo di guanti da indossare durante la manipolazione della sostanza o della miscela, a seconda del rischio connesso e del potenziale di contatto, tenendo presenti l’entità e la durata dell’esposizione dermica; in particolare deve indicare:
- il tipo di materiale ed il suo spessore,
- tempi minimi di permeazione del materiale dei guanti.
[...]
[alert]Guanti di protezione contro il freddo EN 511
[/alert]
La norma EN 511:2006 specifica i requisiti e i metodi di prova per i guanti che proteggono contro il freddo trasmesso per convezione o conduzione fino a -50 °C. Tale temperatura può essere messa in relazione con le condizioni climatiche o un’attività industriale.
Nel processo di selezione di un guanto di protezione contro il freddo dovrebbero essere presi in considerazione diversi parametri, quali:
- ambiente (temperatura ambientale, condizioni atmosferiche e velocità del vento);
- condizioni individuali (salute e benessere della persona, effetto di altri indumenti di protezione indossati dalla persona);
- occupazione (tempo di esposizione, livello di attività, requisiti di destrezza, contatto con elementi freddi e contatto con oggetti bagnati o asciutti).
I valori specifici dei vari livelli di prestazione sono determinati dai requisiti speciali per ogni classe di rischio o dalle specifiche aree di applicazione. Le prove di prodotto possono solo fornire livelli di prestazione e non livelli di protezione.
La protezione contro il freddo è espressa dalla norma EN 511:2006 con un pittogramma seguito da una serie di 3 livelli di prestazione, riguardanti le proprietà di protezione specifiche dei guanti anti freddo:
a. Resistenza al freddo convettivo (livello di prestazione 0–4)
Si basa sulle proprietà di isolamento termico del guanto, che si ottengono misurando il trasferimento del freddo tramite convezione.
b. Resistenza al freddo da contatto (livello di prestazione 0–4)
Si fonda sulla resistenza termica del materiale che costituisce il guanto, se esposto al contatto con un oggetto freddo.
c. Penetrazione dell’acqua (0 o 1)
0 = penetrazione d’acqua
1 = nessuna penetrazione d’acqua
Immagine - Esempio pittogramma “pericolo di freddo”
[alert]Guanti di protezione e altri dispositivi di protezione delle mani contro rischi termici (calore e/o fuoco) EN 407
[/alert]
La norma EN 407:2020 definisce le proprietà di isolamento termico dei guanti che devono proteggere il lavoratore dal calore e/o fiamme. I materiali con cui sono prodotti i DPI devono far sì che il calore sia trasmesso assolutamente in maniera graduale, in modo da garantire protezione delle mani.
I livelli di prestazione sono indicati da una scala che va da 1 minor livello di protezione, ad un massimo di 4 maggior livello di protezione.
UNI EN 407:2020 - Guanti di protezione e altri dispositivi di protezione delle mani contro rischi termici (calore e/o fuoco)
Recepisce: EN 407:2020
Data entrata in vigore: 12 giugno 2020
Sostituisce: UNI EN 407:2004.
La norma EN 407:2004 Guanti di protezione e altri dispositivi di protezione delle mani contro rischi termici (calore e/o fuoco) è armonizzata per il regolamento (UE) 2016/425.
La norma EN 407:2020 è applicabile anche ai dispositivi di protezione delle braccia. Essa è utilizzata per tutti i guanti e gli altri dispositivi di protezione delle mani che proteggono le mani o parti di esse contro il calore e/o le fiamme in una o più delle seguenti forme: fuoco, calore per contatto, calore convettivo, calore radiante, piccoli spruzzi o grandi proiezioni di metallo fuso. La norma è applicabile solo congiuntamente alla UNI EN ISO 21420.
Il documento è sviluppato per trattare tutti i tipi di Dispositivi di Protezione Individuale che proteggono le mani, una parte della mano o una parte del braccio contro i rischi termici, indipendentemente dal luogo in cui vengono utilizzati (uso professionale, di consumo, domestico...).
I criteri di classificazione e distinzione di questi guanti di protezione sono molto scrupolosi a seconda dei rischi da cui devono proteggere.
- Propagazione limitata della fiamma:
Il guanto di lavoro, per superare il test, viene esposto a una fiamma di gas per 15 secondi. Successivamente viene misurato dopo quanto tempo il materiale di realizzazione del guanto smette di bruciare.
Per il livello di prestazione massimo è 4, il tempo di persistenza della fiamma 2 secondi; il tempo di incandescenza residua è invece di 5 secondi.
- Protezione dal calore da contatto:
In questo caso viene effettuata la misurazione della temperatura (da 100 °C a 500 °C) alla quale il guanto è chiamato a proteggere la mano per 15 secondi, senza un riscaldamento del lato interno di oltre 10 °C.
Il livello di prestazione massimo è 4 pari a più di 500 °C.
- Protezione dal calore convettivo
Per calore convettivo ci si riferisce a quello che penetra lentamente all’interno del guanto.
Per raggiungere i livelli di protezione stabiliti dalla norma si prende in considerazione la misurazione dell'intervallo di tempo durante il quale il DPI è in grado di rallentare l’aumento della temperatura del lato interno, attraverso la penetrazione del calore sprigionato da fiamme libere, di oltre 24 °C.
Il livello di prestazione massimo è 4.
- Protezione dal calore radiante:
Il guanto da lavoro è sottoposto a radiazione termica. Si misura il tempo impiegato dal calore per penetrare all'interno del guanto.
Livello di prestazione massimo 4 per una durata di almeno 150 secondi.
- Protezione dal gocciolamento di metallo fuso:
Viene misurato il numero di gocce di metallo fuso necessarie ad aumentare la temperatura tra il materiale del guanto e la pelle di 40 °C.
Il livello di prestazione massimo è 4 pari con oltre 35 gocce.
- Protezione da metallo fuso:
La misurazione riguarda la quantità di ferro fuso in grammi che va a danneggiare una pelle artificiale in PVC fissata sul lato interno del guanto, in modo da simulare la pelle umana.
Il livello di prestazione massimo è 4 pari a 200 grammi.
[...]
Immagine - Guanti di protezione contatto da calore livello 2
[...]
[alert]Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattivà EN 421
[/alert]
La norma EN 421:2010 specifica i requisiti e i metodi di prova per i guanti destinati a proteggere contro le radiazioni ionizzanti e la contaminazione radioattiva. La norma si applica ai guanti che forniscono protezione alla mano ed a varie parti del braccio e della spalla.
Essa si applica anche ai guanti destinati ad essere montati permanentemente su camere di contenimento.
Per camera di contenimento si intende la recinzione che impedisce la diffusione dei prodotti contenuti nell'ambiente interno verso l'ambiente esterno, o la penetrazione dell'atmosfera esterna nell'ambiente interno, o entrambi.
La presente norma europea si applica anche alle maniche intermedie utilizzate tra un guanto e una camera di contenimento permanente.
I requisiti della presente norma europea non si applicano ai guanti di protezione contro le radiazioni da raggi X.
La norma EN 421:2010 Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattiva è armonizzata per il regolamento (UE) 2016/425.
Questa norma stabilisce i requisiti e i metodi di prova dei guanti per la protezione da radiazioni ionizzanti e contaminazione radioattiva.
Questa tipologia di guanti di protezione è utilizzato per lo più in cardiologia, in oncologia, nella ricerca e nell’industria nucleare.
Secondo la norma EN 421, le qualità di protezione e protezione sono indicate da pittogrammi.
Il pittogramma EN 421 (Pittogramma ISO 7000 - 2484) indica la protezione contro le particelle radioattive.
Figura Pittogramma ISO 7000 - 2484 - Protezione contro la contaminazione da particolato radioattivo
Il pittogramma EN 421 (Pittogramma ISO 7000 - 2809) indica la protezione contro le radiazioni ionizzanti.
figura Pittogramma ISO 7000 - 2809 - Protezione contro le radiazioni ionizzanti
La natura della protezione e indicata da un pittogramma che riguarda proprietà protettive specifiche.
- Contaminazione radioattiva: Per proteggere contro la contaminazione radioattiva, il guanto deve essere impermeabile e superare il test di penetrazione di cui alla norma EN 374. Per l’uso in spazi confinati, il guanto deve superare un ulteriore test specifico di tenuta della pressione dell’aria. I materiali potrebbero macchiarsi a causa delle screpolature da ozono. Questo test e facoltativo e può contribuire quale aiuto nel selezionare i guanti.
- Radiazioni ionizzanti: Per proteggere dalle radiazioni ionizzanti, il guanto deve contenere una certa quantità di piombo o di metallo equivalente, riportata come equivalenza in piombo. Questa equivalenza in piombo deve essere marcata in ogni guanto.
Per proteggere dalla contaminazione radioattiva, il guanto protettivo deve essere a tenuta di liquidi e superare il test di penetrazione definito nella norma EN 374 (EN ISO 374 Guanti di protezione contro sostanze chimiche pericolose e microrganismi).
Inoltre, i guanti protettivi utilizzati negli involucri devono superare un test di tenuta della pressione dell'aria. Questi guanti dovrebbero fornire un alto livello di resistenza alla penetrazione del vapore acqueo. 1 indica la resistenza più alta, 4 indica la resistenza più bassa.
I materiali dei guanti protettivi sono modellati per la loro resistenza alla rottura dell'ozono, ma questo test è facoltativo e viene utilizzato come ausilio nella selezione dei guanti. 1 indica la resistenza più bassa, 4 la resistenza più alta.
Per la protezione dalle radiazioni ionizzanti, i guanti devono contenere determinate quantità di piombo o metalli equivalenti. L'equivalente di piombo deve essere contrassegnato su ogni guanto con una misura in millimetri e una descrizione delle condizioni di prova.
I guanti devono rispondere sia alla norma tecnica EN 421 (per la protezione dalla contaminazione, l’efficienza di attenuazione e l’uniformità di distribuzione del materiale da protezione) che agli standard stabiliti dalla norma EN 374.
La capacità del materiale del guanto di:
- assorbire le radiazioni in genere viene indicata come spessore equivalente di piombo (in mm variabili da 0 a 0,5);
- resistere alle criccature da ozono, viene indicata con un parametro variabile da 1 a 4 (che indica la resistenza all’invecchiamento del materiale se soggetto a radiazione ionizzante);
- impermeabilità all’acqua o al suo vapore, viene indicata con un parametro che va da 1 a 5.
[...] Segue in allegato
Pagine documento: 100
Certifico Srl - IT | Rev. 0.0 2022
©Copia autorizzata Abbonati
Collegati
[box-note]Regolamento (UE) 2016/425
Elenco norme armonizzate Regolamento DPI
D.Lgs. 81/2008
Decreto Legislativo n. 475 del 4 dicembre 1992
Dichiarazione di Conformita' UE DPI: Regolamento (UE) 2016/425
Guanti di protezione contro il freddo - EN 511:2006
Guanti di protezione contro le radiazioni ionizzanti - EN 421:2010
Guanti di protezione - Requisiti generali / EN ISO 21420:2020
UNI EN ISO 21420:2020 - Guanti di protezione
Guanti di protezione rischi termici (calore e/o fuoco) - EN 407:2020
Guanti di protezione per saldatori - EN 12477:2001/A1:2005
Guanti di protezione rischi chimici - EN 374-1:2016/A1:2018
Guanti di protezione rischi meccanici - EN 388:2016+A1:2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Vademecum guanti di protezione Rev. 0.0 2022.pdf Certifico Srl - Rev. 0.0 2022 |
2352 kB | 388 |
RAPEX Report 28 del 16/07/2021 N. 17 A12/01047/21 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 28 del 16/07/2021 N. 17 A12/01047/21 Svezia
Approfondimento tecnico: Crema schiarente per la pelle
Il prodotto, di marca AQSA Cosmetics, è stato sottoposto alla procedura di blocco dell’importazione perché non conforme al Regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio del 30 novembre 2009, sui prodotti cosmetici.
Il prodotto contiene mercurio (valore misurato: 10900 mg/kg).
Il mercurio si accumula nel corpo e può danneggiare i reni, il cervello e il sistema nervoso. Inoltre, può influire sulla riproduzione e sul nascituro.
Regolamento (CE) 1223/2009
Articolo 14
Restrizioni applicabili alle sostanze elencate negli allegati
1. Fatto salvo l'articolo 3, i prodotti cosmetici non possono contenere:
a) sostanze vietate:
- sostanze vietate di cui all'allegato II;
b) sostanze soggette a restrizioni:
- sostanze soggette a restrizioni non impiegate conformemente alle restrizioni indicate nell'allegato III; […]
Regolamento (CE) 1223/2009
Allegato II
Elenco delle sostanze vietate nei prodotti cosmetici
n. 221 Mercurio e suoi composti, ad eccezione di quelli inclusi nell'allegato V
Numero CAS 7439-97-6
Numero CE 231-106-7
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 28 del 16_07_2021 N. 17 A12_01047_21 Svezia.pdf Crema schiarente per la pelle |
397 kB | 0 |
Circolare Ministero della Salute n. 49052 dell'08/07/2021
Circolare Ministero della Salute n. 49052 dell'08/07/2021 | DM segnalazione di incidenti
ID 14097 | 21.07.2021
OGGETTO: Vigilanza sui Dispositivi medici - Indicazioni per la segnalazione di incidenti occorsi dopo l’immissione in commercio, alla luce degli articoli 87, 88, 89 e 90 del Regolamento UE 745/2017.
Il 26 maggio 2021 è divenuto pienamente applicabile il Regolamento (UE) 2017/745 del Parlamento Europeo e del Consiglio del 5 aprile 2017.
Pertanto si ritiene utile fornire indicazioni operative su modalità e tempistiche delle segnalazioni inerenti agli incidenti e agli incidenti gravi occorsi con i dispositivi medici, alle azioni correttive di sicurezza, nonché alle relazioni sulle tendenze, come disciplinati dagli articoli in oggetto. Le indicazioni sono rivolte agli operatori economici, agli operatori sanitari e agli utilizzatori profani.
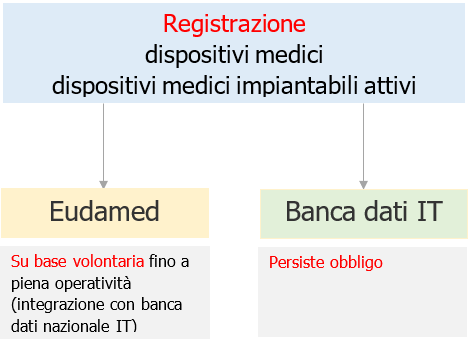
Le indicazioni potranno essere oggetto di revisione a seguito dell’adeguamento della normativa nazionale ai sensi di quanto previsto dall’art. 15 della legge 22 aprile 2021, n. 53, nonché in ragione della piena operatività del sistema EUDAMED, prevista per maggio 2022.
Il Ministero della Salute, in qualità di Autorità competente, tenuto conto di quanto previsto dal Regolamento UE 745/2017 (applicabile dal 26 maggio 2021), intende fornire indicazioni operative su modalità e tempistiche delle segnalazioni inerenti agli incidenti, agli incidenti gravi, alle azioni correttive di sicurezza, nonché alle relazioni sulle tendenze (concernenti incidenti diversi da quelli gravi o effetti collaterali indesiderati attesi).
La presente circolare è rivolta agli operatori economici (fabbricante, mandatario e distributore), agli operatori sanitari e agli utilizzatori profani, questi ultimi come definiti dal Regolamento UE 745/2017.
Le indicazioni che seguono potranno essere oggetto di revisione a seguito dell’adeguamento della normativa nazionale ai sensi di quanto previsto dall’art. 15 della legge 22 aprile 2021, n. 53, nonché in ragione della piena operatività del sistema EUDAMED, ad oggi prevista per maggio 2022.
Preliminarmente, si riportano alcune definizioni utili ai fini della vigilanza di cui all’articolo 2 del Regolamento UE 745/2017:
- «utilizzatore»: qualsiasi operatore sanitario o utilizzatore profano che utilizza un dispositivo;
- «utilizzatore profano»: una persona che non possiede qualifiche formali in un ambito pertinente dell'assistenza sanitaria o in una disciplina medica.
- «incidente»: qualsiasi malfunzionamento o alterazione delle caratteristiche o delle prestazioni di un dispositivo messo a disposizione sul mercato, compreso l'errore d'uso determinato dalle caratteristiche ergonomiche, come pure qualsiasi inadeguatezza nelle informazioni fornite dal fabbricante e qualsiasi effetto collaterale indesiderato;
- «incidente grave»: qualsiasi incidente che, direttamente o indirettamente, ha causato, può aver causato o può causare una delle seguenti conseguenze:
a. il decesso di un paziente, di un utilizzatore o di un'altra persona;
b. il grave deterioramento, temporaneo o permanente, delle condizioni di salute del paziente, dell'utilizzatore o di un'altra persona;
c. una grave minaccia per la salute pubblica;
- «grave minaccia per la salute pubblica»: un evento che potrebbe comportare un imminente rischio di decesso, un grave deterioramento delle condizioni di salute di una persona o una malattia grave che possa richiedere una tempestiva azione correttiva e che possa provocare un tasso significativo di morbilità o di mortalità umane o che è inusuale o inaspettata per quel dato luogo e momento;
- «azione correttiva»: un'azione volta a eliminare la causa di una non conformità potenziale o attuale o altre situazioni indesiderabili;
- «azione correttiva di sicurezza»: un'azione correttiva adottata da un fabbricante per motivi di ordine tecnico o medico al fine di prevenire o ridurre il rischio di incidenti gravi in relazione a un dispositivo messo a disposizione sul mercato;
- «avviso di sicurezza»: una comunicazione inviata da un fabbricante agli utilizzatori o ai clienti in relazione a un'azione correttiva di sicurezza.
[...] Segue in allegato
________
Indice:
A. Indicazioni per Fabbricanti e Operatori economici
1. SEGNALAZIONE DI INCIDENTI GRAVI AI SENSI DELL’ARTICOLO 87 DEL REGOLAMENTO – MANUFACTURER INCIDENT REPORT (MIR)
2. SEGNALAZIONE DI INCIDENTI DIVERSI DA QUELLI GRAVI O DI EFFETTI COLLATERALI ATTESI AI SENSI DELL’ART. 88 DEL REGOLAMENTO – TREND REPORT
3. SEGNALAZIONE DI AVVISI DI SICUREZZA AI SENSI DELL’ART. 87 PARAGRAFO 1, LETTERA B
B. Indicazioni per Operatori sanitari e utilizzatori profani
- SEGNALAZIONI AL MINISTERO DELLA SALUTE
- SEGNALAZIONI AL FABBRICANTE
- CONSERVAZIONE DEL DISPOSITIVO MEDICO COINVOLTO IN UN INCIDENTE
...
Fonte: Ministero della Salute
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Raccolta Linee guida MEDDEV Dispositivi medici[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare Ministero della Salute n. 49052 08.07.2021.pdf |
1539 kB | 46 |
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE / Update Aprile 2025
ID 14083 | Elenco Norme armonizzate Regolamento dispositivi medici 2017/745/CE ad Aprile 2025
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Elenco consolidato
1. Decisione di esecuzione (UE) 2021/1182 della Commissione del 16 luglio 2021 relativa alle norme armonizzate per i dispositivi medici redatte a sostegno del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio (GU L 256/100 del 19.07.2021). Entrata in vigore: 19.07.2021
2. Decisione di esecuzione (UE) 2022/6 della Commissione del 4 gennaio 2022 che modifica la Decisione di esecuzione (UE) 2021/1182 per quanto riguarda le norme armonizzate per la valutazione biologica dei dispositivi medici, la sterilizzazione dei dispositivi medici e dei prodotti per la cura della salute, il trattamento asettico dei prodotti per la cura della salute, i sistemi di gestione per la qualità, i simboli da utilizzare nelle informazioni che devono essere fornite da parte del fabbricante, il condizionamento dei prodotti per la cura della salute e gli apparecchi per fototerapia ad uso domiciliare (GU L 1/11 del 5.1.2022). Entrata in vigore: 05.01.2022
3. Decisione di esecuzione (UE) 2022/757 della Commissione del 11 maggio 2022 che modifica la Decisione di esecuzione (UE) 2021/1182 per quanto riguarda le norme armonizzate per i sistemi di gestione per la qualità, la sterilizzazione e l’applicazione della gestione dei rischi ai dispositivi medici. (GU L 138/27 del 17.5.2022). Entrata in vigore: 17.05.2022
4. Decisione di esecuzione (UE) 2023/1410 della Commissione del 4 luglio 2023 che modifica la Decisione di esecuzione (UE) 2021/1182 per quanto riguarda le norme armonizzate per la sterilizzazione dei dispositivi medici e la valutazione biologica dei dispositivi medici. (GU L 170/102 del 5.7.2023). Entrata in vigore: 05.07.2023
5. Decisione di esecuzione (UE) 2024/815 della Commissione, del 6 marzo 2024, che modifica la decisione di esecuzione (UE) 2021/1182 per quanto riguarda le norme armonizzate per i guanti medicali monouso, la valutazione biologica dei dispositivi medici, la sterilizzazione dei prodotti sanitari, gli imballaggi per dispositivi medici sterilizzati terminalmente e il condizionamento dei prodotti per la cura della salute (GU L 2024/815 08.03.2024). Entrata in vigore: 08.03.2024
6. Decisione di esecuzione (UE) 2024/2631 della Commissione, dell’8 ottobre 2024, che modifica la decisione di esecuzione (UE) 2021/1182 per quanto riguarda la norma armonizzata per il trattamento asettico dei prodotti per la cura della salute (GU L 2024/2631 9.10.2024). Entrata in vigore: 09.10.2024
7. Decisione di esecuzione (UE) 2025/681 della Commissione, dell’8 aprile 2025, che modifica la decisione di esecuzione (UE) 2021/1182 per quanto riguarda le norme armonizzate per i guanti medicali monouso, la sterilizzazione dei dispositivi medici e le attrezzature per il trasporto dei pazienti utilizzate nelle ambulanze. (GU L 2025/681 del 9.4.2025). Entrata in vigore: 09.04.2025
Conformemente all'articolo 8 del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, i dispositivi conformi alle norme armonizzate pertinenti, o a parti pertinenti di tali norme, i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell'Unione europea sono considerati conformi alle prescrizioni di detto regolamento contemplate da tali norme o parti di esse.
[box-warning]Il regolamento (UE) 2017/745 ha abrogato le direttive 90/385/CEE e 93/42/CEE del Consiglio con effetto dal 26 maggio 2021.
Norme armonizzate Direttiva DM impiantabili attivi (DMIA) 90/385/CEE
A norma dell'articolo 120, paragrafo 2, secondo comma, del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, i certificati rilasciati da organismi notificati conformemente alla direttiva 90/385/CEE a decorrere dal 25 maggio 2017 restano validi fino alla fine del periodo indicato sul certificato, che non supera cinque anni dal suo rilascio. Tuttavia essi perdono validità al più tardi il 27 maggio 2024. A norma dell'articolo 120, paragrafo 3, primo comma, del regolamento (UE) 2017/745, un dispositivo con un certificato rilasciato ai sensi della direttiva 90/385/CEE e valido in virtù dell'articolo 120, paragrafo 2, del regolamento (UE) 2017/745 può essere immesso sul mercato o messo in servizio fino al 26 maggio 2024 a condizione che a decorrere dal 26 maggio 2020 continui a essere conforme alla direttiva 90/385/CEE e a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d'uso.
I requisiti relativi ai dispositivi medici impiantabili attivi di cui alla direttiva 90/385/CEE sono diversi da quelli di cui al regolamento (UE) 2017/745. Le norme elaborate a sostegno della direttiva 90/385/CEE non dovrebbero pertanto essere utilizzate per dimostrare la conformità ai requisiti del regolamento (UE) 2017/745.
La comunicazione 2017/C 389/02 della Commissione è abrogata. Essa continua ad applicarsi fino al 30 settembre 2021 per quanto riguarda i riferimenti delle norme armonizzate figuranti nell'allegato II della Decisione di esecuzione(UE) 2020/438.
Le norme armonizzate per i dispositivi medici impiantabili attivi elaborate a sostegno della direttiva 90/385/CEE e figuranti negli allegati I e II della Decisione di esecuzione (UE) 2020/438 non possono essere utilizzate per conferire una presunzione di conformità ai requisiti del regolamento (UE) 2017/745.
La Decisione di esecuzione (UE) 2020/438 si applica fino al 26 maggio 2024.
Norme armonizzate Direttiva dispositivi medici (MD) 93/42/CEE
A norma dell'articolo 120, paragrafo 2, secondo comma, del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, i certificati rilasciati da organismi notificati conformemente alla direttiva 93/42/CEE a decorrere dal 25 maggio 2017 restano validi fino alla fine del periodo indicato sul certificato, che non supera cinque anni dal suo rilascio. Tuttavia essi perdono validità al più tardi il 27 maggio 2024. A norma dell'articolo 120, paragrafo 3, primo comma, del regolamento (UE) 2017/745, un dispositivo di classe I ai sensi della direttiva 93/42/CEE, per il quale è stata redatta una dichiarazione di conformità prima del 26 maggio 2020 e per il quale la procedura di valutazione della conformità ai sensi di tale regolamento richiede il coinvolgimento di un organismo notificato, e un dispositivo con un certificato rilasciato ai sensi della direttiva 93/42/CEE e valido in virtù dell'articolo 120, paragrafo 2, può essere immesso sul mercato o messo in servizio fino al 26 maggio 2024 a condizione che a decorrere dal 26 maggio 2020 continui a essere conforme alla direttiva 93/42/CEE e a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d'uso.
I requisiti relativi ai dispositivi medici di cui alla direttiva 93/42/CEE sono diversi da quelli di cui al regolamento (UE) 2017/745. Le norme elaborate a sostegno della direttiva 93/42/CEE non dovrebbero pertanto essere utilizzate per dimostrare la conformità ai requisiti del regolamento (UE) 2017/745.
La comunicazione 2017/C 389/03 della Commissione è abrogata. Essa continua ad applicarsi fino al 30 settembre 2021 per quanto riguarda i riferimenti delle norme figuranti nell'allegato II della Decisione di esecuzione (UE) 2020/437.
Le norme armonizzate per i dispositivi medici elaborate a sostegno della direttiva 93/42/CEE e figuranti negli allegati I e II della Decisione di esecuzione (UE) 2020/437 non possono essere utilizzate per conferire una presunzione di conformità ai requisiti del regolamento (UE) 2017/745.
La Decisione di esecuzione (UE) 2020/437 si applica fino al 26 maggio 2024.[/box-warning]
[box-download]In fondo all'articolo, scorrendo la pagina, allegato PDF dell'elenco delle norme armonizzate Reg. MD a Marzo 2024 riservato Abbonati Marcatura CE. [/box-download]
Certifico Srl - IT | Rev. 6.0 2025
©Copia autorizzata Abbonati
...
Elenco Norme armonizzate Regolamento (UE) 2017/745 al 09 Aprile 2025
Elenco Norme armonizzate Regolamento (UE) 2017/745 | 09.04.2025
1. Decisione di esecuzione (UE) 2021/1182
2. Decisione di esecuzione (UE) 2022/6
3. Decisione di esecuzione (UE) 2022/757
4. Decisione di esecuzione (UE) 2023/1410
5. Decisione di esecuzione (UE) 2024/815
6. Decisione di esecuzione (UE) 2024/2631
7. Decisione di esecuzione (UE) 2025/681
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Prima pubblicazione GU |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione |
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
|
CEN |
EN 285:2015+A1:2021 Sterilizzazione - Sterilizzatrici a vapore - Grandi sterilizzatrici |
17.05.2022 |
|
|
|
|
CEN |
EN 455-1:2020+A2:2024 Guanti medicali monouso - parte 1: Requisiti e prove per l’assenza di fori |
09.04.2025 |
|
|
|
|
CEN |
EN 455-2:2024 Guanti medicali monouso - parte 2: Requisiti e prove per le proprietà fisiche |
09.04.2025 |
|
|
|
|
CEN |
EN 455-3:2023 Guanti medicali monouso - parte 3: Requisiti e prove per la valutazione biologica
|
08.03.2024 |
|
|
|
|
CEN |
EN 556-1:2024 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l’indicazione «STERILE» - parte 1: Requisiti per i dispositivi medici sterilizzati terminalmente |
09.04.2025 |
|
|
|
|
CEN |
EN 556-2:2024 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l’indicazione «STERILE» - parte 2: Requisiti per i dispositivi medici preparati asetticamente |
09.04.2025 |
|
|
|
|
CEN |
EN 1865-2:2024 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - parte 2: Barelle a propulsione assistita |
09.04.2025 |
|
|
|
|
CEN |
EN 1865-6:2024 Attrezzature per il trasporto dei pazienti utilizzate nelle autoambulanze - parte 6: Sedie motorizzate |
09.04.2025 |
|
|
|
|
CEN |
EN ISO 10993-9:2021 Valutazione biologica dei dispositivi medici - Parte 9: Struttura per l'identificazione e la quantificazione dei prodotti potenziali di degradazione (ISO 10993-9:2019) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 10993-10:2023 Valutazione biologica dei dispositivi medici - parte 10: Prove di sensibilizzazione cutanea (ISO 10993-10:2021) |
05.07.2023 |
|
|
Decisione di esecuzione (UE) 2023/1410
|
|
CEN |
EN ISO 10993-12:2021 Valutazione biologica dei dispositivi medici - Parte 12: Preparazione dei campioni e materiali di riferimento (ISO 10993-12:2021) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 10993-15:2023 Valutazione biologica dei dispositivi medici - parte 15: Identificazione e quantificazione dei prodotti di degradazione da metalli e leghe (ISO 10993-15:2019) |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 10993-17:2023 Valutazione biologica dei dispositivi medici - parte 17: Valutazione del rischio tossicologico dei componenti dei dispositivi medici (ISO 10993-17:2023) |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 10993-18:2020 Valutazione biologica dei dispositivi medici - parte 18: Caratterizzazione chimica dei materiali di dispositivi medici all’interno di un processo di gestione del rischio (ISO 10993-18:2020) EN ISO 10993-18:2020/A1:2023 |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 10993-23:2021 |
19.07.2021 |
|
|
|
|
CEN |
EN ISO 11135:2014 |
19.07.2021 |
|
|
|
|
CEN |
EN ISO 11137-1:2015 |
19.07.2021 |
|
|
|
|
CEN |
EN ISO 11137-2:2015 Sterilizzazione dei prodotti sanitari - Radiazione - parte 2: Definizione della dose sterilizzante (ISO 11137-2:2013) EN ISO 11137-2:2015/A1:2023 |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 11607-1:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - parte 1: Requisiti per materiali, sistemi di barriera sterili e sistemi di imballaggio (ISO 11607-1:2019) EN ISO 11607-1:2020/A1:2023 |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 11607-2:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - parte 2: Requisiti di convalida per il formato, la tenuta e i processi di assemblaggio (ISO 11607-2:2019) EN ISO 11607-2:2020/A1:2023 |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 11737-1:2018 Sterilizzazione dei dispositivi medici - Metodi microbiologici - Parte 1: Determinazione di una popolazione di microrganismi sui prodotti (ISO 11737-1:2018) EN ISO 11737-1:2018/A1:2021 |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 11737-2:2020 |
19.07.2021 |
|
|
|
|
CEN |
EN ISO 13408-1:2024 Trattamento asettico dei prodotti per la cura della salute - Parte 1: Requisiti generali (ISO 13408-1:2023)
|
09.10.2024 |
|
|
Decisione di esecuzione (UE) 2024/2631
|
|
CEN |
EN ISO 13408-6:2021 Trattamento asettico dei prodotti per la cura della salute - Parte 6: Sistemi isolatori (ISO 13408-6:2021) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/A11:2021 |
05.01.2022 |
|
|
Decisione di esecuzione (UE) 2022/6 Sostituita con |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2018 EN ISO 13485:2016/A11:2021
|
05.01.2022 |
|
|
|
|
CEN |
EN ISO 14160:2021 Sterilizzazione dei prodotti per la cura della salute - Agenti sterilizzanti chimici liquidi per dispositivi medici monouso che utilizzano tessuti animali e loro derivati - Requisiti per la caratterizzazione, lo sviluppo, la convalida e il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 14160:2020) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 14971:2019 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (ISO 14971:2019) EN ISO 14971:2019/A11:2021 |
17.05.2022 |
|
|
|
|
CEN |
EN ISO 15223-1:2021 Dispositivi medici - Simboli da utilizzare nelle informazioni che devono essere fornite da Parte del fabbricante - Parte 1: Requisiti generali (ISO 15223-1:2021) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 17664-1:2021 Condizionamento dei prodotti per la cura della salute — Informazioni che devono essere fornite dal fabbricante del dispositivo medico per il condizionamento dei dispositivi medici — Parte 1: Dispositivi medici critici e semicritici (ISO 17664-1:2021) |
05.01.2022 |
|
|
|
|
CEN |
EN ISO 17664-2:2023 Condizionamento dei prodotti per la cura della salute - Informazioni che devono essere fornite dal fabbricante del dispositivo medico per il condizionamento dei dispositivi medici - parte 2: Dispositivi medici non critici (ISO 17664-2:2021) |
08.03.2024 |
|
|
|
|
CEN |
EN ISO 25424:2019 Sterilizzatrici a bassa temperatura a vapore e formaldeide - Requisiti per lo sviluppo, la convalida e il controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 25424:2018) EN ISO 25424:2019/A1:2022 |
05.07.2023 |
|
|
Decisione di esecuzione (UE) 2023/1410
|
|
CEN |
EN IEC 60601-2-83:2020 Apparecchi elettromedicali - Parte 2-83: Prescrizioni particolari relative alla sicurezza fondamentale e alle prestazioni essenziali degli apparecchi per fototerapia ad uso domiciliare EN IEC 60601-2-83:2020/A11:2021 |
05.01.2022 |
|
|
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata. La norma sostituita perciò consiste nella EN CCCCC:YYYY e nelle sue precedenti eventuali modifiche, ma senza la nuova modifica citata. Alla data stabilita, la norma sostituita cessa di fornire la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (2).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet:
http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
______
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, B-1040 Bruxelles, Telefono: +32 25500811; fax +32 25500819 (http://www.cen.eu)
- Cenelec: Rue de la Science 23, B-1040 Bruxelles, Telefono: +32 25500811; fax +32 25500819 (http://www.cenelec.eu)
- ETSI: 650, route des Lucioles, F-06921 Sophia Antipolis, tel.+33 492944200; fax +33 493654716, (http://www.etsi.eu)
(2) GU C 338 del 27.9.2014, pag. 31.
Vedi la nuova sezione 2019/2025 "Norme armonizzate click"
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Norme armonizzate Regolamento dispositivi medici MD Rev. 6.0 2025.pdf Certifico Srl - Rev. 6.0 2025 |
263 kB | 24 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 5.0 2024.pdf Certifico Srl - Rev. 5.0 2024 |
241 kB | 18 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 4.0 2024.pdf Certifico Srl - Rev. 4.0 2024 |
236 kB | 19 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
215 kB | 42 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 2.0 2022.pdf Certifico Srl - Rev. 2.0 2022 |
208 kB | 56 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 1.0 2022.pdf Certifico Srl - Rev. 1.0 2022 |
197 kB | 57 | ||
| Norme armonizzate Regolamento dispositivi medici MD Rev. 0.0 2021.pdf Certifico Srl - Rev. 0.0 2021 |
418 kB | 37 |
Giocattoli contenenti liquidi non a norma
Giocattoli contenenti liquidi: tra quelli contenenti liquidi uno su cinque non è a norma
ISS 12 luglio 2021
Su 256 giocattoli contenenti liquidi o gel (bolle di sapone, pupazzi, animaletti di gomma, palline anti-stress, yoyo, perle di gel, pitture a dita) commercializzati in Italia ed esaminati nel quinquennio 2016-2020 presso il Dipartimento di Ambiente e Salute dell’ISS, circa il 19% è risultato non conforme ai criteri per la sicurezza igienico-sanitaria stabiliti dalla relativa Linea guida europea. In pratica – se ne parla nell’ultimo Notiziario dell’ISS - in 48 di questi giocattoli, gli esperti hanno rintracciato batteri mesofili aerobi (16,4%), muffe e lieviti (3,9%), Pseudomonas aeruginosa (3,5%).
Negligenza nei processi di produzione, uso improprio di materie prime, imballaggi erroneamente sigillati, condizioni di conservazione inadeguate, perdita di efficacia dei conservanti, nonché atti di contraffazione possono essere alcune cause da cui derivano le non conformità osservate. Il pericolo associato è correlato alla possibilità che il liquido contenuto nei giocattoli sia microbiologicamente contaminato e che, qualora ingerito, inalato o entrato in contatto con la pelle o con le mucose, possa essere causa dell’insorgenza di infezioni e malattie. In Italia, per questi giocattoli, il Ministero della Salute richiede obbligatoriamente che siano eseguite verifiche microbiologiche per accertare il rispetto dei requisiti raccomandati dalla linea guida europea.
Una buona notizia è comunque quella che vede una riduzione della percentuale di non conformità dei giocattoli che, nel quinquennio considerato, è nettamente inferiore a quella ottenuta da analisi eseguite nel decennio precedente (66%). È infatti ipotizzabile una maggiore cura nelle diverse fasi di produzione di questi giocattoli con il possibile utilizzo di acqua con caratteristiche di qualità migliori o comunque con l’uso di disinfettanti, batteriostatici e conservanti che possono contribuire a mantenere basse le cariche microbiche, ma anche grazie ai valori limite dei parametri microbiologici meno stringenti della attuale Linea guida europea rispetto a quella precedente.
In realtà, si legge nel Notiziario, “nonostante le non conformità legate al superamento dei limiti raccomandati, le indagini analitiche hanno messo in evidenza che il rischio associato alle cariche microbiche riscontrate potrebbe non essere correlato a problemi diretti e/o immediati per la salute, almeno in una popolazione adulta e sana. D’altra parte, per motivi di ordine comportamentale, ben diverso è lo scenario espositivo dei bambini che possono fare del giocattolo un uso improprio. Inoltre, per motivi di ordine biologico riconducibili a un sistema immunitario in fase di sviluppo - e quindi non ancora del tutto competente - più elevata è la sensibilità dei bambini alle infezioni e maggiore è il rischio associato al contatto con giocattoli che non rispondono a criteri di sicurezza igienico-sanitaria. Pertanto, oltre ad attenti controlli prima dell’immissione sul mercato e prima della loro entrata sul territorio nazionale, soprattutto per alcuni tipi di giocattoli, è opportuno trasmettere e diffondere informazioni utili e facilmente comprensibili per un utilizzo corretto e consapevole di questi prodotti”.
La legislazione
In Europa la sicurezza dei giocattoli è disciplinata dalla Direttiva 2009/48/CE, recepita in Italia dal D.Lgs. 54/2011. In base ad essa, con il termine giocattoli si intende: prodotti progettati o destinati, in modo esclusivo o meno, a essere utilizzati per fini di gioco da bambini di età inferiore ai 14 anni. La marcatura CE dei giocattoli è una procedura obbligatoria per tutti i prodotti disciplinati dalla Direttiva Comunitaria Giocattoli e la dichiarazione di conformità deve essere attuata dal fabbricante che dichiara che il suo prodotto è conforme ai requisiti di sicurezza previsti da questa Direttiva.
Attualmente non esiste in Italia una normativa che stabilisca quali parametri microbiologici controllare nei liquidi contenuti nei giocattoli, né tantomeno valori soglia a cui riferire le concentrazioni rilevate. Per questa particolare tipologia di giocattoli si fa pertanto riferimento a una specifica linea guida europea, che pur avendo subìto negli anni varie revisioni, individua alcuni gruppi di microrganismi e alcune specie microbiche patogene, significativi ai fini della verifica della sicurezza microbiologica. L’attività di controllo e consulenza è svolta dall’ISS, ed ora, su indirizzo dell’ISS, alcune ARPA regionali sono in grado di eseguire le analisi.
Inoltre, in Europa il sistema di allerta rapido Safety Gate (precedentemente RAPEX) della Commissione Europea segnala i prodotti ritirati dal mercato perché pericolosi per la sicurezza e per la salute dei consumatori (ad eccezione di alimenti, farmaci e presidi medici), riportando anche segnalazioni relative ai rischi microbiologici.
In Italia, le informazioni sulle non conformità sono notificate dal Ministero della Salute Direzione Generale Prevenzione e validate dal focal point del Ministero dello Sviluppo Economico. Secondo le statistiche del Safety Gate i giocattoli risultano la categoria di prodotto maggiormente segnalata come pericolosa alle frontiere dei Paesi dell'UE (circa il 25% l’anno); anche a livello nazionale, nel periodo 2017-2020, risultano essere tra le categorie con maggiori segnalazioni. In tale periodo, la più elevata percentuale di segnalazioni per rischio microbiologico rilevata in Italia rispetto all’Europa è presumibilmente da ricondurre a una maggiore importazione sul territorio nazionale di prodotti provenienti dai Paesi extra-UE in cui c'è poca disponibilità di acqua con buone caratteristiche di qualità microbiologica, né esiste una legislazione che ne regolamenti la qualità.
...
segue in allegato
Collegati
[box-note]Direttiva 2009/48/CE giocattoli
Decreto Legislativo N. 54 del 11 Aprile 2011[/box-note]
RAPEX Report 27 del 09/07/2021 N. 17 A12/00999/21 Bulgaria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 27 del 09/07/2021 N. 17 A12/00999/21 Bulgaria
Approfondimento tecnico: Felpa per bambini
Il prodotto, di marca Akkuzu kids wear, mod. 57432, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica europea EN 14682:2015 “Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini - Specifiche”
Il laccio del cappuccio è troppo lungo e con le estremità libere, il bambino potrebbe restare intrappolato con conseguente strangolamento.
EN 14682:2015 Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini – Specifiche
[…]
3.3 - Zona testa, collo e parte superiore del torace nei capi di abbigliamento per bambini più grandi e ragazzi (figura 1, zona A)
I lacci non devono avere estremità libere.
I lacci passanti privi di estremità libere non devono avere passanti sporgenti quando il capo di abbigliamento è steso su una superficie piana, alla massima estensione. Quando il capo è steso in taglia, ossia con la chiusura regolata alla vestibilità prevista, la circonferenza massima dei passanti sporgenti non deve essere di 15 cm.
Quando sono utilizzati dei fermacorda per la regolazione dei lacci passanti privi di estremità, il fermacorda deve essere fissato al capo di abbigliamento. I cordoncini funzionali devono avere lunghezza non maggiore di 7.5 cm. I cordoncini funzionali non devono essere realizzati con cordoncini elastici.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 27 del 09_07_2021 N. 17 A12_00999_21 Bulgaria.pdf Felpa per bambini |
106 kB | 0 |
Regolamento di esecuzione (UE) 2021/1158
Regolamento di esecuzione (UE) 2021/1158
Regolamento di esecuzione (UE) 2021/1158 della Commissione, del 22 giugno 2021, relativo ai requisiti di progettazione, costruzione ed efficienza e alle norme di prova per l’equipaggiamento marittimo, che abroga il regolamento di esecuzione (UE) 2020/1170
GU L 254/1 del 16.7.2021
Entrata in vigore: 25.08.2021
[box-warning]Il Regolamento di esecuzione (UE) 2021/1158 è abrogato dal 15 agosto 2022 dal Regolamento di esecuzione (UE) 2022/1157[/box-warning]
_____
Articolo 1
I requisiti di progettazione, costruzione ed efficienza e le norme di prova previste negli strumenti internazionali definiti all’articolo 2, punto 5), della direttiva 2014/90/UE si applicano a ciascun elemento dell’equipaggiamento marittimo elencato nell’allegato del presente regolamento.
Articolo 2
Il regolamento di esecuzione (UE) 2020/1170 è abrogato.
Articolo 3
1. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione (UE) 2019/1397» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 3 ottobre 2019 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave UE fino al 3 ottobre 2022.
2. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione (UE) 2020/1170» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 1° settembre 2020 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave UE fino al 1° settembre 2023.
3. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione (UE) 2021/1158» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 25 agosto 2021 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave UE fino al 25 agosto 2024.
Articolo 4
Il presente regolamento entra in vigore il quarantesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
[...]
Collegati
[box-note]Regolamento di esecuzione (UE) 2020/1170
Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
Convenzione SOLAS[/box-note]
L’accertamento tecnico per la sicurezza delle macchine alimentari
L’accertamento tecnico per la sicurezza delle macchine alimentari
INAIL, 2021
Partendo dal patrimonio informativo che negli anni l’Istituto ha costituito e dalle competenze maturate nell’espletamento delle attività di accertamento tecnico, il documento raccoglie schede tecniche sulle macchine afferenti al comitato tecnico normativo - TC 153 macchine alimentari, trattando le più significative non conformità rilevate, al fine di illustrare, rispetto allo stato dell’arte di riferimento, le soluzioni costruttive ritenute accettabili, e promuovere un miglioramento dei livelli di sicurezza nei luoghi di lavoro, come previsto nella mission istituzionale.
Le schede tecniche collezionate trattano le principali non conformità rilevate sulle macchine alimentari evidenziando, rispetto allo stato dell’arte di riferimento, le soluzioni costruttive ritenute accettabili. Naturalmente i documenti sono stati resi anonimi, recuperando esclusivamente le informazioni tecnicamente utili senza alcun riferimento a dati sensibili (riferiti al fabbricante o alla circostanza in cui la macchina segnalata è stata rinvenuta), garantendo comunque un’informazione sufficiente a indirizzare eventuali interventi di approfondimento sulle attrezzature in verifica.
[box-note]Ciascuna scheda si compone di tre parti principali:
- una prima parte descrittiva, nella quale è individuata la tipologia di macchina, riportandone la denominazione specificata dal fabbricante nella dichiarazione CE di conformità e una sintetica descrizione che definisce la destinazione d’uso e le modalità di utilizzo; è inoltre specificato l’anno di fabbricazione della macchina (da intendersi coincidente con l’anno di immissione sul mercato) al fine di definire lo stato dell’arte di riferimento e quindi individuare le soluzioni che potrebbero ritenersi accettabili; l’indicazione di tale data è utile anche in relazione all’eventuale norma tecnica di riferimento disponibile;
- una parte dedicata alle norme tecniche armonizzate di riferimento: questa sezione non è sempre presente, perché ovviamente dipende dalla disponibilità di riferimenti tecnici pertinenti; si è riportata, ove disponibile, la norma armonizzata di tipo C (o eventualmente altre norme di ausilio alla definizione del parere tecnico illustrato nel seguito), indicandone la versione e la data di pubblicazione in gazzetta ufficiale.
- una parte denominata “accertamento tecnico”, che si compone a sua volta di due sotto sezioni:
- una dedicata alla segnalazione di presunta non conformità, nella quale viene descritta la situazione di pericolo ravvisata, evidenziando in modo chiaro e sintetico quanto riscontrato sull’esemplare oggetto di segnalazione, con riferimento alla parte della macchina coinvolta e alla situazione di utilizzo considerata. Per rendere maggiormente intellegibile la situazione riscontrata, ove disponibili, sono stati inseriti foto e/o schemi. Sempre in questa parte si è collegata la situazione pericolosa alla carenza rispetto al requisito essenziale di sicurezza prescritto dalla direttiva, cercando di correlare la problematica al mancato rispetto delle prescrizioni dell’allegato I alla direttiva macchine, indicando il requisito essenziale di sicurezza (RES) ritenuto non rispettato;
- un’altra incentrata sul parere tecnico, nella quale, limitatamente alle carenze segnalate e quindi ai requisiti essenziali di sicurezza (RES) ritenuti presumibilmente non conformi, si è illustrato l’esito dell’accertamento tecnico condotto da Inail, sulla base della documentazione fornita dai fabbricanti, di pareri già espressi dall’autorità di sorveglianza del mercato, di posizioni assunte nei consessi comunitari, nonché dello stato dell’arte di riferimento.[/box-note]
Nello specifico, il lavoro prodotto vorrebbe trasversalmente offrire spunti per:
- fabbricanti e distributori di macchine alimentari, evidenziando le carenze più ricorrenti anche in relazione alle norme tecniche di riferimento;
- organi di vigilanza territoriale, offrendo utili riferimenti per orientare l’attenzione in occasione di azioni di vigilanza o inchieste infortuni su specifiche criticità emerse nel corso dell’attività di accertamento tecnico;
- datori di lavoro, rappresentando carenze e problematiche ricorrenti di questa tipologia di attrezzature, in modo da offrire indicazioni utili nella scelta dei prodotti in fase di acquisizione, prima della messa a disposizione per i lavoratori (ex combinato disposto dell’art. 71 comma 1 e dell’art. 70 comma 1 del D.Lgs. 81/2008)
...
Indice
1. Introduzione
2. Il flusso della sorveglianza del mercato
3. Le norme armonizzate
4. Schede tecniche
Appendice - Documentazione
Fonte: INAIL
Collegati
[box-note]D.Lgs. 81/2008 Testo Unico Salute e Sicurezza Lavoro
Direttiva macchine 2006/42/CE
9° Rapporto attività sorveglianza del mercato Direttiva macchine
TUSSL / Link[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Accertamento tecnico per la sicurezza delle macchine alimentari.pdf INAIL 2021 |
5536 kB | 183 |
Decreto 15 ottobre 1999
Decreto 15 ottobre 1999
Norme relative alla punzonatura ed alle iscrizioni sui recipienti per gas compressi, liquefatti o disciolti.
(GU n.271 del 18.11.1999)
Collegati
[box-note]Direttiva 2010/35/UE[/box-note]
Decreto 16 gennaio 2001
Decreto 16 gennaio 2001
Periodicita' delle verifiche e revisioni di bombole, tubi, fusti a pressione, incastellature di bombole e recipienti criogenici.
(GU n.25 del 31.01.2001)
Collegati
[box-note]Decreto 15 ottobre 1999
Direttiva 2010/35/UE[/box-note]
RAPEX Report 24 del 18/06/2021 N. 09 A12/00896/21 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 24 del 18/06/2021 N. 09 A12/00896/21 Polonia
Approfondimento tecnico: Altalena per neonati
Il prodotto 2-in-1 Soothe ‘n Play Glider, di marca Fisher Price, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti.
I neonati che vengono lasciati sull’altalena senza essere bloccati dalla cintura di sicurezza, se si trovano a faccia in giù, corrono il rischio di soffocare.
Direttiva 2001/95/CE
Articolo 3
1. I produttori sono tenuti ad immettere sul mercato soltanto prodotti sicuri.
2. Un prodotto è considerato sicuro, per quanto concerne gli aspetti disciplinati dalla pertinente normativa nazionale, quando in mancanza di disposizioni comunitarie specifiche che ne disciplinano la sicurezza, è conforme alle normative nazionali specifiche dello Stato membro nel cui territorio è commercializzato, che sono stabilite nel rispetto del trattato, in particolare degli articoli 28 e 30, e che fissano i requisiti cui deve rispondere il prodotto sul piano sanitario e della sicurezza per poter essere commercializzato.
Si presume che un prodotto sia sicuro, per quanto concerne i rischi e le categorie di rischi disciplinati dalla pertinente normativa nazionale, quando è conforme alle norme nazionali non cogenti che recepiscono le norme europee, i cui riferimenti sono stati pubblicati dalla Commissione nella Gazzetta ufficiale delle Comunità europee a norma dell'articolo 4. Gli Stati membri pubblicano i riferimenti di tali norme nazionali.
3. In circostanze diverse da quelle di cui al paragrafo 2, si valuta la conformità di un prodotto all'obbligo generale di sicurezza tenendo conto in particolare, se esistono, dei seguenti elementi:
a) norme nazionali non cogenti che recepiscono norme europee pertinenti diverse da quelle di cui al paragrafo 2;
b) norme in vigore nello Stato membro in cui il prodotto è commercializzato;
c) raccomandazioni della Commissione relative ad orientamenti sulla valutazione della sicurezza dei prodotti;
d) codici di buona condotta in materia di sicurezza dei prodotti vigenti nel settore interessato;
e) ultimi ritrovati della tecnica;
f) sicurezza che i consumatori possono ragionevolmente attendere.
4. La conformità di un prodotto ai criteri volti a garantire l'obbligo generale di sicurezza, in particolare alle disposizioni di cui ai paragrafi 2 o 3 non vieta alle autorità competenti degli Stati membri di adottare le opportune misure per limitarne l'immissione sul mercato o chiederne il ritiro dal mercato o il richiamo qualora, nonostante tale conformità, il prodotto si riveli pericoloso.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 24 del 18_06_2021 N. 09 A12_00896_21 Polonia.pdf Altalena per neonati |
112 kB | 0 |
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
ID 13955 | 08.07.2021 / Documento allegato
Attualmente, tutte le imprese che ricoprono ruoli individuati dai Regolamenti per i quali sussiste l'obbligo di registrazione in Eudamed, possono procedere alla registrazione su base volontaria al fine di ottenere il Single Registration Number (SRN).
Tuttavia, la registrazione in Eudamed e l'ottenimento dell'SRN non sostituiscono l'obbligo di adempiere alla registrazione nella banca dati nazionale.
Nei prossimi mesi di uso del sistema su base volontaria, è prevista la doppia registrazione in Eudamed e nella banca dati Italiana. A tal proposito, si ricorda quanto previsto dal Regolamento (UE) 2017/745 nell’art.123.3(d) "Fino a quando Eudamed non sarà pienamente operativa (previsione Maggio 2022), le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti”; per l’Italia tale circostanza è relativa agli obblighi di registrazione nella banca dati nazionale dei dispositivi medici del Ministero della Salute. Analoghe disposizioni sono previste per il settore IVD.
Nel corso di questa fase, il Ministero sta lavorando all’impostazione e gestione integrata dei sistemi di registrazione di livello nazionale ed europeo.
[box-warning]Registrazione in Eudamed e banca dati nazionale Art.123.3(d) Regolamento (UE) 2017/745
"Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione".[/box-warning]
Fig. 1 – Applicazione di Eudamed e Banca dati nazionale IT
3. In deroga al paragrafo 2:
a) gli articoli da 35 a 50 si applicano a decorrere dal 26 novembre 2017. Tuttavia, a decorrere da tale data fino al 26 maggio 2021, gli obblighi degli organismi notificati a norma degli articoli da 35 a 50 si applicano solo agli organismi che presentano una domanda di designazione a norma dell'articolo 38;
b) gli articoli 101 e 103 si applicano a decorrere dal 26 novembre 2017;
c) l'articolo 102 si applica a decorrere dal 26 maggio 2018;
d) fatti salvi gli obblighi della Commissione ai sensi dell'articolo 34, qualora, a causa di circostanze che non avrebbero potuto essere ragionevolmente previste alla stesura del piano di cui all'articolo 34, paragrafo 1, Eudamed non sia pienamente operativa il 26 maggio 2021, gli obblighi e le prescrizioni relativi a Eudamed si applicano a decorrere dalla data corrispondente a sei mesi dalla data di pubblicazione dell'avviso di cui all'articolo 34, paragrafo 3.
— articolo 29,
— articolo 31,
— articolo 32,
— articolo 33, paragrafo 4,
— articolo 40, paragrafo 2, seconda frase,
— articolo 42, paragrafo 10,
— articolo 43, paragrafo 2,
— articolo 44, paragrafo 12, secondo comma,
— articolo 46, paragrafo 7, lettere d) ed e),
— articolo 53, paragrafo 2,
— articolo 54, paragrafo 3,
— articolo 55, paragrafo 1,
— articoli da 70 a 77,
— articolo 78, paragrafi da 1 a 13,
— articoli da 79 a 82,
— articolo 86, paragrafo 2,
— articoli 87 e 88,
— articolo 89, paragrafi 5 e 7, e articolo 89, paragrafo 8, terzo comma,
— articolo 90,
— articolo 93, paragrafi 4, 7 e 8,
— articolo 95, paragrafi 2 e 4,
— articolo 97, paragrafo 2, ultima frase,
— articolo 99, paragrafo 4,
— articolo 120, paragrafo 3, primo comma, seconda frase.
Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione.[/box-info]
[box-note]Regolamento (UE) 2017/745
Articolo 34 Funzionalità di Eudamed
1. La Commissione, in collaborazione con l'MDCG, elabora le specifiche funzionali di Eudamed. La Commissione elabora un piano per l'attuazione di tali specifiche entro il 26 maggio 2018. Il piano cerca di garantire la piena operatività di Eudamed in una data che consenta alla Commissione di pubblicare l'avviso di cui al paragrafo 3 del presente articolo entro il 25 marzo 2021 nonché il rispetto di tutti gli altri termini pertinenti stabiliti nell'articolo 123 del presente regolamento e nell'articolo 113 del regolamento (UE) 2017/746.
2. La Commissione, sulla base di una relazione di valutazione contabile indipendente, informa l'MDCG di aver verificato la piena funzionalità di Eudamed e la conformità di Eudamed alle specifiche funzionali elaborate a norma del paragrafo 1.
3. La Commissione, dopo aver consultato l'MDCG e aver appurato che le condizioni di cui al paragrafo 2 sono state soddisfatte, pubblica un avviso a tal fine nella Gazzetta ufficiale dell'Unione europea.[/box-note][box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Eudamed - Banca Dati EUropea sui Dispositivi MEdici[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dispositivi medici - Registrazione in Eudamed e banca dati nazionale Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
156 kB | 76 |
Circolare Min Salute n. 42343 11 giugno 2021
Circolare Min Salute n. 42343 dell'11 giugno 2021: Purificatori e sanificatori d’aria non sono dispositivi medici
ID 13950 | 08.07.2021
La Circolare del Ministero della Salute dell’11 giugno 2021 ha chiarito che purificatori e sanificatori d’aria non possono presentare la marcatura CE come dispositivo medico e la relativa Dichiarazione di Conformità UE dispositivo medico. La posizione ha corpo dalla linea guida europea “Manual on Borderline and Classification in the Community Regulatory Framework for medical devices”.
_______
Il Ministero fa presente che questi prodotti, alla luce della loro destinazione d’uso e modalità d’azione (sanificazione, igienizzazione, purificazione dell’aria degli ambienti), non rientrano nella definizione di dispositivo medico.
Il Ministero ha richiesto di conseguenza alle aziende fabbricanti, che hanno marcato CE questi prodotti, di non qualificarli come dispositivi medici e di cancellarli dalla Banca Dati dei dispositivi medici.
I prodotti impiegati per la sanificazione, l’igienizzazione e la purificazione dell’aria degli ambienti potranno essere introdotti sul mercato sulla base delle disposizioni generali sulla sicurezza dei prodotti immessi in commercio, secondo il Codice del consumo (D.L.gs. 206/2005), presentando eventualmente la marcatura CE ai sensi di altri atti di armonizzazione dell'Unione che riguardano aspetti trasversali, ad esempio:
- Direttiva macchine 2006/42/CE
- Direttiva BT 2014/35/UE
- Direttiva EMC 2014/30/UE
Perché non sono dispositivi medici
Esistono sul mercato vari tipi di purificatori d'aria e prodotti per la decontaminazione della stessa. Alcuni di questi sistemi contengono filtri per rimuovere le particelle presenti nell'aria, mentre altri possono distruggere i microrganismi presenti nell’aria. In entrambi i casi l'aria purificata viene immessa negli ambienti ma non è collegata direttamente ai singoli pazienti.
Questi prodotti hanno quindi lo scopo di "controllare l'ambiente" rimuovendo gli allergeni o la contaminazione dall'aria, ma non agiscono direttamente su un singolo paziente e non c'è contatto diretto con esso.
Analogamente esistono lampade germicide a flusso UV che hanno lo scopo di diminuire il livello di carica microbica negli ambienti e sebbene il mantenimento di aria pulita possa contribuire a mantenere un paziente in un ambiente appropriato, questo non è considerato uno "scopo medico". Informazioni dettagliate, anche su sistemi con raggi UV-C, sono contenute nel documento: Rapporto ISS COVID-19 n. 25/2020 - Raccomandazioni ad interim sulla sanificazione di strutture non sanitarie nell’attuale emergenza COVID-19: superfici, ambienti interni e abbigliamento.
La posizione dell’Unione Europea
La linea guida europea “Manual on Borderline and Classification in the Community Regulatory Framework for medical devices” version 1.22 (05-2019), alla monografia “1.13 - Air purifiers/Air decontamination units/Mobile air decontamination units” e alla monografia “1.23. UV flow germicidal lamp” indica che i prodotti impiegati per la sanificazione, l’igienizzazione e la purificazione dell’aria degli ambienti non rientrano nella definizione di dispositivo medico.
Anche il Regolamento (UE) 2017/745 (MDR), in applicazione dal 26 maggio 2021, pur non affrontando direttamente la questione, ha esplicitamente incluso nell’ambito di applicazione soltanto quei prodotti destinati alla pulizia, alla disinfezione e alla sterilizzazione dei dispositivi medici. (cfr. art. 2, par. 1 MDR).
Sulla base di questi riferimenti normativi, il Ministero ha emanato la Circolare di chiarimento.
Collegati
[box-note]Medical devices | Manual on borderline and classification
Raccomandazioni sanificazione strutture non sanitarie
[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare Min Salute n. 42343 del 11 giugno 2021.pdf Min Salute 2021 |
333 kB | 33 |
Position Paper CEN-CENELEC draft Machinery Regulation July 2021
Position Paper CEN-CENELEC draft Machinery Regulation July 2021
ID 13933 | 07.07.2021 / In allegato Position paper
Position Paper CEN-CENELEC response to the European Commission’s Public Consultation on the draft Machinery Regulation July 2021
Il 21 aprile 2021, la Commissione Europea (CE) ha adottato la sua proposta di Regolamento Macchine che sostituirà la Direttiva Macchine 2006/42/CE.
Allo stesso tempo, la CE ha avviato una consultazione pubblica per ottenere un feedback sul progetto di regolamento macchine. Con questo documento, CEN e CENELEC forniscono la loro posizione su questa proposta.
Consultazione Revisione Direttiva macchine - Timeline data articolo
Questo documento è il risultato delle consultazioni che sono state effettuate nel Forum di settore CEN-CENELEC sulle macchine e nei Consigli tecnici CEN e CENELEC e tra i TC responsabili delle norme armonizzate ai sensi della Direttiva Macchine.
Nel dicembre 2020, CEN-CENELEC ha fornito la sua risposta alla prima consultazione CE sul regolamento macchine che era stata presentata alla riunione dell'EC Machinery Working Group, tenutasi il 9-10 novembre 2020.
Il CEN e il CENELEC si rammaricano che la maggior parte delle richieste non sia stata presa in considerazione e quindi non si rifletta nella proposta della CE del 21 aprile 2021 (COM(2021) 202 definitivo).
Impatto sugli standard
Gli elementi della proposta della CE che creeranno un impatto immediato per CEN-CENELEC sono i seguenti:
[alert]- competenze di esecuzione CE per l'elaborazione delle specifiche tecniche (articolo 17.3 della proposta di regolamento macchine), cfr. anche commento specifico 1.;
- la modifica della procedura di valutazione della conformità per le macchine ad alto rischio di cui all'attuale Allegato IV – ovvero la proposta di eliminare l'opzione di controllo interno in caso di applicazione di norme armonizzate (Articolo 21.2), cfr. anche specifico commento 3;
- il collegamento tra l'Allegato III della proposta di regolamento Macchine e il “sistema di IA ad alto rischio” nel regolamento di IA, si veda anche il commento specifico 4;
- la moltitudine di cambiamenti nei Requisiti Essenziali di Salute e Sicurezza (EHSR) (Allegato III) si veda anche il commento specifico 5. & 6.;[/alert]
Considerando quest'ultimo aspetto si prevede che le modifiche introdotte dalla proposta CE avranno un forte impatto sulla maggior parte delle norme armonizzate se non su tutte.
...
Fonte: EC
Collegati
[box-note]Proposal for a Regulation on machinery products
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Direttiva macchine 2006/42/CE
Direttiva macchine 2021: la proposta di revisione[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position Paper CEN-CENELEC draft Machinery Regulation July 2021.pdf |
349 kB | 37 |
Decreto Dirigenziale n. 172 del 18 Giugno 2021
Decreto Dirigenziale n. 172 del 18 Giugno 2021 | Specifiche tecniche impianti a fune
Disposizioni e specificazioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone.
GU n. 150 del 25.06.2021
Entrata in vigore: 10.07.2021
...
Articolo 1
1. Sono approvate le disposizioni e specificazioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone contenute nell’Allegato Tecnico, che del presente decreto costituisce parte integrante.
2. Le disposizioni e le specificazioni contenute nell’Allegato Tecnico al presente decreto costituiscono l’articolazione in forma organica delle norme europee, integrate con le norme nazionali vigenti in materia.
3. Gli impianti realizzati in conformità alle disposizioni ed alle specificazioni contenute nell’Allegato Tecnico al presente decreto si presumono conformi ai requisiti essenziali di cui all’Allegato II del Regolamento (UE) 2016/424.
4. Resta ferma la possibilità di utilizzare soluzioni tecniche diverse da quelle prospettate dalle stesse disposizioni e prescrizioni, a condizione che venga dimostrata la conformità ai requisiti essenziali di cui all’Allegato II del Regolamento (UE) 2016/424.
Articolo 2
I progetti degli impianti a fune adibiti al trasporto di persone, elaborati secondo il Regolamento (UE) 2016/424 e presentati alle competenti Amministrazioni successivamente alla data di entrata in vigore del presente decreto, sono redatti in conformità alle disposizioni e prescrizioni contenute nell’Allegato Tecnico del presente decreto, fatto salvo quanto disposto dall’art. 1, comma 4, del presente decreto.
Articolo 3
Entro tre anni dall’entrata in vigore del presente decreto, le disposizioni e le prescrizioni di cui all’art. 1, comma 1, del presente decreto sono sottoposte a verifica al fine di accertare l’eventuale necessità di aggiornamento o revisione.
Articolo 4
È abrogato il decreto dirigenziale 16 novembre 2012 concernente «Disposizioni e prescrizioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone » a far data dalle disposizioni del successivo art.5 del presente decreto.
_________
DISPOSIZIONI E SPECIFICAZIONI TECNICHE PER LE INFRASTRUTTURE DEGLI IMPIANTI A FUNE ADIBITI AL TRASPORTO DI PERSONE.
1. CAMPO DI APPLICAZIONE E SCOPO DELLE NORME
1.1 Oggetto
1.2 Campo di applicazione
1.3 Commissione funicolari aeree e terrestri
1.4 Soluzioni tecniche alternative
1.5 Soluzioni tecniche innovative
2. DOCUMENTAZIONE TECNICA E PROCEDURE
2.1 Documentazione tecnica
2.1.1 Documenti funiviari contenuti nel progetto di cui all’articolo 23 comma 6 del d.lgs. 50/2016
2.1.2 Progetto definitivo funiviario finalizzato all’ottenimento del nullaosta di cui all’art. 3 del D.P.R. 753/80
2.1.3 Progetto strutturale esecutivo dell’opera
2.2 Figure professionali
2.3 Procedure per l’esame dei progetti
2.3.1 Procedure relative al progetto di cui al punto 2.1.1
2.3.2 Procedure relative all’esame del progetto di cui al punto 2.1.2
2.3.3 Procedure per le soluzioni diverse o innovative di cui ai punti 1.4 e 1.5.
3. DISPOSIZIONI GENERALI
3.1 Tracciato e profilo della linea
3.1.1 Scelta del tracciato
3.1.2 Tracciato delle funicolari
3.1.3 Tracciato delle funivie
3.1.4 Tracciato delle sciovie e delle slittinovie
3.2 Profilo limite
3.2.1 Profilo limite delle funicolari
3.2.2 Profilo limite delle funivie
3.2.3 Profilo limite delle sciovie
3.2.4 Profilo limite delle funi dei circuiti di linea o portanti i conduttori di tali circuiti, delle funi di ancoraggio, di segnalazione e simili
3.2.5 Profilo limite delle funi di soccorso
3.3 Sagoma limite e distanza di sicurezza
3.3.1 Generalità
3.3.2 Distanze di sicurezza nelle funicolari
3.3.3 Distanze di sicurezza da elementi appartenenti alla funivia
3.3.4 Intervia delle funivie
3.3.5 Distanze di sicurezza da oggetti non appartenenti all’impianto ed al terreno
3.3.6 Sagoma limite, distanze di sicurezza nelle sciovie
3.4 Distanza massima dal terreno
3.4.1 Generalità
3.4.2 Funivie con veicoli chiusi
3.4.3 Funivie con veicoli aperti
3.5 Velocità di marcia e intervallo in tempo tra i veicoli
3.5.1 Velocità di marcia delle funicolari e delle funivie, generalità
3.5.2 Velocità di marcia delle funicolari e delle funivie
3.5.3 Intervallo minimo e distanza minima tra i veicoli nelle funivie a moto unidirezionale
3.5.4 Velocità di marcia e intervallo delle sciovie e delle slittinovie
4. NORME COMUNI ALLE STAZIONI
4.1 Vie di transito e aree di lavoro
4.1.1 Generalità
4.1.2 Aree d’imbarco delle seggiovie
4.1.3 Aree di sbarco delle seggiovie
4.1.4 Aree d’imbarco e di sbarco nelle stazioni intermedie delle seggiovie
4.1.5 Aree d’imbarco e di sbarco delle sciovie
4.1.6 Stazioni intermedie delle sciovie
4.1.7 Aree d’imbarco e sbarco delle cabinovie
4.2 Immagazzinamento dei veicoli d’impianti a collegamento temporaneo
4.3 Requisiti ulteriori
4.3.1 Norme comuni alle stazioni
4.3.2 Requisiti per impianti gemelli
5. STAZIONE MOTRICE
5.1 Caratteristiche generali
5.2 Argano e freni
5.2.1 Argano di funicolari e funivie
5.2.2 Sistemi frenanti di funicolari e funivie
5.2.3 Argano e freni delle sciovie
6. TENSIONE E GUIDA DELLE FUNI
6.1 Tensione delle funi
6.1.1 Generalità
6.1.2 Corsa del carrello tenditore
6.1.3 Fine corsa
6.1.4 Indicatori di posizione
6.1.5 Contrappeso e carrello di tensione
6.1.6 Dispositivi per la ripresa della tensione
6.2 Attacchi di estremità
6.3 Area di spostamento dei contrappesi
6.4 Dispositivi di ammortizzazione
6.5 Requisiti dei sistemi idraulici per il tensionamento delle funi
6.5.1 Aspetti costruttivi
6.5.2 Mantenimento e sorveglianza dei valori limite della tensione nominale
6.6 Requisiti dei sistemi di tensionamento fissi
6.6.1 Controllo della tensione delle funi
6.6.2 Regolazione della tensione delle funi
6.7 Requisiti degli altri dispositivi di tensionamento
6.8 Requisiti dei dispositivi di tensionamento delle sciovie
6.8.1 Generalità
6.8.2 Requisiti specifici per le sciovie
6.9 Guida e supporto delle funi – Generalità
6.10 Guida e supporto delle funi traenti delle funicolari
6.11 Guida e supporto delle funi delle funivie bifune
6.12 Guida della fune portante-traente delle funivie monofune
6.13 Guida della fune portante-traente delle sciovie
7. RECUPERO ED EVACUAZIONE
7.1 Generalità
7.1.1 Modalità di evacuazione
7.2 Piano di evacuazione
7.3 Tempi di recupero e di evacuazione
7.4 Percorsi di evacuazione delle funicolari
7.5 Evacuazione verticale
7.6 Evacuazione dei viaggiatori mediante veicoli di soccorso
7.7 Soccorso integrato
8. PREVENZIONE INCENDI
8.1 Generalità
8.2 Documentazione
8.2.1 Valutazione del rischio d’incendio
9. SEGNALAZIONE AL VOLO
9.1 Segnalazione agli enti e alle autorità
9.2 Dimensionamento
10. VENTO MASSIMO DI ESERCIZIO
10.1 Definizione di vento massimo di esercizio
10.2 Rilevazione del vento
10.3 Segnalazione del vento
10.4 Esclusioni
11. SISTEMI DI COMUNICAZIONE E INFORMAZIONE
11.1 Rete telefonica pubblica
11.2 Collegamenti telefonici interni
11.3 Comunicazioni ai viaggiatori
12. POSIZIONE DELLA SEGNALETICA PER I VIAGGIATORI SUGLI IMPIANTI A FUNE
12.1 Generalità
12.2 Posizione dei pittogrammi
12.2.1 Segnali di informazione
12.2.2 Segnali di obbligo
12.2.3 Segnali di divieto
12.2.4 Segnali di pericolo
12.3 Ulteriori precisazioni
13. FUNICOLARI AD ESERCIZIO AUTOMATICO
13.1 Generalità
13.2 Sorveglianza dell’esercizio
13.3 Recinzione del tracciato
13.4 Accesso al tracciato
13.5 Evacuazione
13.6 Accesso ai veicoli
13.7 Sorveglianza del tracciato
14. FUNIVIE BIFUNE SENZA FRENO SULLA PORTANTE
14.1 Premessa
14.2 Provvedimenti per assicurare l'integrità dell'anello trattivo
14.3 Misure intese a prevenire incidenti con anello integro
14.3.1 Limitazione della libertà di oscillazione
14.3.2 Assenza di accavallamenti
15. CALCOLI FUNIVIARI E AZIONI CORRELATE
15.1 Indicazioni generali per i calcoli
15.1.1 Generalità
15.1.2 Metodi di calcolo
15.1.3 Presentazione dei calcoli
15.1.4 Giustificazioni mediante prove sperimentali
15.1.5 Azioni
15.2 Calcoli giustificativi delle funi
15.2.1 Generalità
15.2.2 Azioni per il calcolo di linea e la verifica delle funi
15.3 Grado di sicurezza – Generalità
15.4 Funi portanti
15.4.1 Tensioni e frecce delle funi
15.4.2 Grado di sicurezza
15.4.3 Sollecitazione di flessione
15.4.4 Forze di appoggio minime
15.5 Funi traenti e funi zavorra
15.5.1 Tensioni e frecce delle funi
15.5.2 Grado di sicurezza
15.5.3 Sollecitazione di flessione
15.5.4 Forze di appoggio minime
15.6 Funi portanti-traenti delle funivie
15.6.1 Tensioni e frecce delle funi
15.6.2 Grado di sicurezza
15.6.3 Sollecitazione a flessione
15.6.4 Forze di appoggio minime
15.7 Funi portanti-traenti delle sciovie
15.7.1 Tensioni e frecce delle funi
15.7.2 Grado di sicurezza
15.7.3 Sollecitazione a flessione
15.7.4 Forze di appoggio minime
15.8 Funi tenditrici .
15.8.1 Tensioni delle funi
15.8.2 Grado di sicurezza
15.8.3 Sollecitazione di flessione
15.9 Funi soccorso
15.9.1 Tensioni delle funi, frecce, forze di appoggio, sollecitazioni di flessione
15.9.2 Grado di sicurezza
15.10Funi dei circuiti di linea o portanti i conduttori di tali circuiti, funi di ancoraggio, di segnalazione e simili
15.10.1 Grado di sicurezza
15.10.2 Sollecitazione di flessione
15.11 Trasmissione della forza periferica alla puleggia motrice
15.11.1 Verifica dell’aderenza
15.11.2 Coefficiente d’attrito ammissibile sulla puleggia motrice
15.11.3 Condizioni di carico
15.12 Calcolo della potenza motrice
15.12.1 Generalità
15.12.2 Potenza continuativa in caso di velocità di marcia e/o forza periferica variabili
15.12.3 Potenza continuativa in caso di velocità di marcia e/o forza periferica costanti
15.12.4 Potenza in accelerazione
15.13 Documentazione tecnica da presentare per la giustificazione del calcolo di linea
15.13.1 Per le funicolari
15.13.2 Per le funivie
15.13.3 Per le sciovie
16. OPERE CIVILI D’INFRASTRUTTURE FUNIVIARIE
16.1 Campo di applicazione
16.2 Normativa di riferimento
16.3 Vita nominale e classe d’uso
16.4 Materiali .
16.4.1 Generalità
16.4.2 Materiali diversi dall'acciaio
16.5 Azioni
16.5.1 Pesi propri e azioni di carattere prettamente civile
16.5.2 Azioni variabili funiviarie agenti sulle opere civili
16.5.3 Azioni variabili ambientali
16.5.4 Azioni sismiche
16.5.5 Azioni derivanti dalla valanga
16.5.6 Azioni eccezionali funiviarie agenti sulle opere civili
16.6 Combinazione delle azioni
16.7 Verifiche
16.7.1 Verifiche geotecniche allo SLU in combinazione sismica
16.7.2 Verifiche allo SLE
16.7.3 Verifiche a fatica
16.7.4 Rotazione dei sostegni in caso di scarrucolamento
16.8 Prescrizioni particolari
16.8.1 Tiranti di ancoraggio
16.8.2 Collegamenti
17. ELETTROTECNICA DI IMPIANTO
17.1 Oggetto, requisiti generali e definizioni
17.1.1 Oggetto
17.1.2 Requisiti generali
17.1.3 Definizioni
17.2 Sorgenti di energia e sistemi di distribuzione: criteri realizzativi
17.2.1 Interruttori generali funiviari
17.2.2 Ulteriori caratteristiche degli interruttori generali
17.2.3 Caratteristiche dei sistemi di distribuzione
17.2.4 Condizioni per l’allacciamento di utenze diverse
17.2.5 Criteri per la disponibilità dell’azionamento di riserva
17.2.6 Criteri per la disponibilità degli azionamenti di recupero o di soccorso
17.2.7 Sorgenti di energia per la marcia di recupero e soccorso
17.2.8 Illuminazione
17.2.9 Illuminazione notturna
17.2.10 Telecomando della marcia da stazioni non motrici
17.3 Protezione contro i contatti diretti e indiretti ed equipotenzialità delle masse metalliche
17.3.1 Norme di riferimento per le protezioni contro i contatti diretti e indiretti
17.3.2 Impianto di terra locale
17.3.3 Equipotenzialità
17.3.4 Messa a terra delle funi
17.4 Protezione delle strutture contro i fulmini
17.4.1 Norme di riferimento per la protezione delle strutture contro i fulmini
17.4.2 Protezione dei sostegni
17.4.3 Scaricatori
17.5 Ulteriori requisiti
17.5.1 Norme sui locali che alloggiano quadri elettrici
17.5.2 Ubicazione quadri elettrici
17.5.3 Protezione dai contatti accidentali
17.5.4 Disposizione degli interruttori di manutenzione e arresto di emergenza
17.5.5 Ubicazione minima interruttori di manutenzione
17.5.6 Ubicazione minima pulsanti di arresto di emergenza
17.5.7 Arresto per rottura delle funi ausiliarie
17.6 Registratore dei dati di arresto e di rallentamento per vento
18. ATTRAVERSAMENTI E PARALLELISMI
18.1 Documentazione
18.2 Nulla osta o autorizzazione
18.3 Dichiarazione del direttore dei lavori di opere di attraversamento
18.4 Disposizioni tecniche
18.4.1 Attraversamenti con percorsi stradali
18.4.2 Attraversamenti con corsi d’acqua navigabili
18.4.3 Attraversamenti con altri sistemi di trasporto ad impianti fissi
18.4.4 Attraversamenti superiori da parte di teleferiche, impianti similari e funivie
destinate al trasporto privato
18.4.5 Parallelismi con altri impianti a fune
18.4.6 Attraversamenti e parallelismi con linee elettriche e telefoniche
18.4.7 Attraversamenti e parallelismi di canali e condotte
18.4.8 Attraversamenti e parallelismi di condotte d’acqua in pressione
19. RIPOSIZIONAMENTI
19.1 Generalità
19.2 Condizioni per il riposizionamento
19.2.1 Condizioni temporali
19.2.2 Esecutore del riposizionamento
19.3 Procedure per lo smontaggio e il contestuale riposizionamento
19.3.1 Domanda per il riposizionamento
19.3.2 Verifica delle scadenze
19.3.3 Individuazione dell’esecutore del riposizionamento
19.3.4 Sopralluogo
19.3.5 Termini temporali per lo smontaggio e l’immagazzinamento
19.3.6 Inventario dei componenti
19.4 Procedure per il solo smontaggio
19.4.1 Domanda di smontaggio
19.4.2 Verifica delle scadenze e sopralluogo
19.4.3 Individuazione ditta incaricata dello smontaggio
19.4.4 Smontaggio ed inventario dei componenti
19.5 Progetto di riposizionamento
19.5.1 Termini per la presentazione del progetto di riposizionamento
19.5.2 Documentazione di impianto
19.5.3 Norme di riferimento per la progettazione
19.5.4 Contenuti del progetto
19.5.5 Ammissibilità all’utilizzo di componenti diversi
19.5.6 Azioni
19.5.7 Funi
19.5.8 Ulteriori richieste per impianti certificati
19.5.9 Competenza sui progetti
19.6 Fine lavori
19.7 Scadenziario
19.8 Manuale d’uso e manutenzione
20. DISPOSIZIONI PROGETTUALI SPECIFICHE DA ADOTTARE NELL’INFRASTRUTTURA PER LA SICUREZZA DEL PERSONALE
20.1 Normativa di settore e specificità funiviarie
20.2 Requisiti generali per la protezione del personale
20.3 Requisiti di sicurezza per la protezione del personale
20.3.1 Accesso ai dispositivi di tensionamento della fune
20.3.2 Attrezzamenti specifici per l’evacuazione
20.3.3 Aree di lavoro e di passaggio e piattaforme di lavoro
20.3.4 Accesso alle piattaforme di lavoro
20.3.5 Parapetti nelle aree di lavoro e di passaggio e nelle piattaforme di lavoro
20.3.6 Rotaie per i veicoli nei magazzini e nei luoghi di manutenzione
20.3.7 Punti di attacco per i dispositivi per le operazioni sollevamento e abbassamento delle funi o altri componenti di impianto
20.3.8 Punti di ancoraggio per la messa fuori tensione delle funi
20.3.9 Dispositivi di movimentazione dei carichi pesanti
Collegati
[box-note]Decreto 11 maggio 2017
D.D. n. 288 del 17 settembre 2014
Decreto 18 febbraio 2011
Decreto Dirigenziale n. 189 del 29 maggio 2019
La sezione legislazione "Impianti a fune trasporto persone"
Regolamento (UE) 2016/424: Impianti a fune[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Decreto Dirigenziale n. 172 del 18 Giugno 2021.pdf |
2037 kB | 16 |
Guanti di protezione rischi chimici - EN 374-1:2016/A1:2018
Guanti di protezione rischi chimici - EN 374-1:2016/A1:2018 / UNI EN 374-1:2018
ID 14278 | 13.08.2021 / Documento di lavoro completo in allegato (IT/EN)
Documento sui guanti di protezione da rischi chimici DPI di cui alla norma EN ISO 374-1:2016/A1:2018 (UNI EN ISO 374-1:2018), norma armonizzata per il regolamento (UE) 2016/425 DPI, che specifica i requisiti dei guanti destinati a proteggere l'utilizzatore contro i prodotti chimici pericolosi e definisce i termini da utilizzare.
[alert]La norma EN ISO 374-1:2016 Guanti di protezione contro i prodotti chimici e microorganismi pericolosi Parte 1: Terminologia e requisiti prestazionali per rischi chimici (ISO 374-1:2016) è armonizzata per il regolamento (UE) 2016/425.[/alert]
I guanti protettivi contro agenti chimici devono soddisfare i requisiti della norma europea EN ISO 374-1.
Questa norma è stata sottoposta a modifiche fondamentali per quanto riguarda la certificazione.
[box-info]La nuova EN ISO 374-1:2016/A1:2018 contiene delle novità importanti e precisamente:
- ampliamento degli agenti chimici di prova da 12 a 18.
- eliminazione del vetro dei bicchieri per "guanti protettivi resistenti all'acqua con ridotta protezione contro i pericoli chimici".
- tipizzazione dei guanti protettivi nel tipo A, B o C.
- modifica della marcatura sul prodotto: Pittogramma della beuta di Erlenmeyer con numero diverso di lettere per agenti chimici di prova a seconda del tipo.[/box-info]
Nella scelta dei guanti per la protezione dagli agenti chimici pericolosi, è di primaria importanza la resistenza che il materiale di cui sono costituiti offre al passaggio degli stessi. Questa resistenza è descritta dal tempo di permeazione, cioè il tempo che trascorre tra il contatto iniziale dell’inquinante con la superficie esterna del guanto ed il momento in cui tale inquinante può essere individuato sulla sua superficie interna.
Il fattore che influenza principalmente il tempo di permeazione è ovviamente la natura chimica del materiale che costituisce il guanto in relazione all’agente chimico considerato.
Hanno però importanza anche i seguenti fattori:
- spessore del materiale costituente il guanto;
- concentrazione dell’agente chimico con cui il guanto viene a contatto;
- quantità dell’agente chimico con cui il guanto viene a contatto;
- tempo in cui il guanto è a contatto con l’agente chimico;
- frequenza dei contatti;
- tipo di contatto (immersione, schizzi, contatto con superficie contaminata, nebbiolina ecc.);
- temperatura.
La fonte principale di informazioni per quanto riguarda la scelta dei materiali costituenti il guanto dovrebbe essere la scheda di sicurezza dell’agente chimico impiegato. In realtà, le informazioni riportate su tali schede sono spesso insufficienti, generiche ed in rari casi addirittura fuorvianti.
In alternativa alle schede di sicurezza, informazioni utili alla scelta dei materiali e sui tempi di permeazione possono essere ricavate per molte sostanze dal National Institute for Occupational Safety & Health (NIOSH) o dai produttori di guanti.
________
Scelta DPI: Guanti di protezioni rischi chimici
Per essere certificati come "protettivi chimicamente" in conformità alla norma EN ISO 374-1 e recare uno dei pittogrammi della beuta, i guanti devono prima soddisfare i requisiti di resistenza alla penetrazione di cui alla norma EN 374-2:2014 clausole 7.2 e 7.3.
La penetrazione è il movimento di una sostanza chimica attraverso un'imperfezione, come un foro stenopeico o un altro difetto, ed è un fenomeno fisico in cui il liquido passa attraverso il materiale a livello non molecolare. La penetrazione viene valutata riempiendo il guanto separatamente con aria e acqua, seguita da una valutazione per determinare se vi sono perdite.
La resistenza alla permeazione è valutata secondo EN 16523-1.
Ci sono sei diversi livelli di prestazione:
Questo è il tempo che intercorre dall'inizio del test al momento in cui viene rilevato che la sostanza chimica si muove attraverso il materiale a una velocità definita di 1µg per cm 2 al minuto.
Nella norma EN ISO 374-1 è presente un elenco di 18 sostanze chimiche ed il livello di prestazione di un guanto rispetto a queste sostanze chimiche definisce il "tipo" di guanto resistente alle sostanze chimiche e, quindi, il pittogramma utilizzato nella marcatura dei guanti.
I guanti saranno classificati come "tipo C" se si ottiene almeno il "livello 1" di prestazione rispetto ad almeno una delle 18 sostanze chimiche elencate. La classificazione di "Tipo B" riguarda i guanti che soddisfano un minimo di "livello 2" rispetto ad almeno tre delle 18 sostanze chimiche e i guanti di "tipo A" sono quelli che raggiungono un livello minimo di prestazione 2 rispetto ad almeno sei delle 18 sostanze chimiche.
Pe quanto attiene inoltre la scelta dei guanti adeguati, indicazioni generali possono essere ricavate dall’allegato VIII del DLgs 81/08.
Inoltre si deve tenere conto della scheda di sicurezza che nella Sezione 8, punto 8.2.2.2, in riferimento alla protezione delle mani, il tipo di guanti da indossare durante la manipolazione della sostanza o della miscela, a seconda del rischio connesso e del potenziale di contatto, tenendo presenti l’entità e la durata dell’esposizione dermica; in particolare deve indicare:
- il tipo di materiale ed il suo spessore,
- tempi minimi di permeazione del materiale dei guanti.
...
Esempio: Scelta DPI guanti di protezione rischio chimico per un tecnico di laboratorio che manipola durante la sua attività tre tipologie di sostanze chimiche, quali:
- Metanolo
- Idrossido di sodio 40%
- Diclorometano
Scelta per step
a. Analisi delle schede di sicurezza [...omissis]
b. Livelli di prestazione del materiale dei guanti
Scelta pertanto di un guanto di “Tipo B” riportante il pittogramma seguente
c. Individuazione del guanto in base al livello di prestazionale di permeazione e pittogramma
Nel caso di specie la prestazione di permeazione deve essere almeno di livello 2 rispetto a un minimo di tre sostanze chimiche in esame. I prodotti chimici testati devono essere identificati dalla loro lettera di codice nel pittogramma.
Immagine 1 - Pittogramma
_____
Normativa
La norma EN 374 NON è riportata nell’elenco delle norme presenti nel D.M. 2 maggio 2001 "Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI)", emanato nel 2001 in accordo con quanto previsto dall'articolo 45, comma 2, lettera a) del decreto legislativo n. 626 del 19 settembre 1994. Il decreto stabilisce i criteri per l'individuazione e l'uso dei dispositivi di protezione individuale (DPI), tenendo conto della natura, dell'attività e dei fattori specifici di rischio.
Con l'entrata in vigore del D.Lgs. 81/2008, le disposizioni inerenti i DPI oltre a quelle generali (....) sono previste al Titolo III USO DELLE ATTREZZATURE DI LAVORO E DEI DISPOSITIVI DI PROTEZIONE INDIVIDUALE, CAPO II - Uso dei dispositivi di protezione individuale (Art. 74÷79 e 87) ed i Criteri per l’individuazione e l’uso dei dispositivi di protezione individuale (DPI) sono rimandati ad apposito decreto secondo quanto previsto dall'Art. 79 comma 2, non ancora emanato, ma nelle cui more di adozione restano ferme le disposizioni di cui al D.M. 2 maggio 2001.
[panel]
Art. 77 - Obblighi del datore di lavoro D.Lgs. 81/2008
DPI Terza categoria: obbligo addestramento
5. In ogni caso l'addestramento è indispensabile:
a) per ogni DPI che, ai sensi del decreto legislativo 4 dicembre 1992, n. 475, appartenga alla terza categoria;
b) per i dispositivi di protezione dell'udito.
Art. 78 - Obblighi dei lavoratori
...
Art. 79 – Criteri per l’individuazione e l’uso
1. Il contenuto dell’allegato VIII, costituisce elemento di riferimento per l’applicazione di quanto previsto all’articolo 77, commi 1 e 4.
2. Con decreto del Ministro del lavoro, della salute e delle politiche sociali, di concerto con il Ministro dello sviluppo economico, sentita la Commissione consultiva permanente di cui all’articolo 6, tenendo conto della natura, dell’attività e dei fattori specifici di rischio sono indicati:
a) i criteri per l’individuazione e l’uso dei DPI;
b) le circostanze e le situazioni in cui, ferme restando le priorità delle misure di protezione collettiva, si rende necessario l’impiego dei DPI.
2-bis. Fino alla adozione del decreto di cui al comma 2 restano ferme le disposizioni di cui al decreto del Ministro del lavoro e della previdenza sociale in data 2 maggio 2001, pubblicato nella Gazzetta Ufficiale n. 126 del 1 ° giugno 2001.
ALLEGATO VIII[/panel]
Regolamento (UE) 2016/425 (DPI)
Regolamento (UE) 2016/425 del Parlamento Europeo e del Consiglio del 9 marzo 2016 sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GU L 81/51 del 31 Marzo 2016)
…
Capo III Conformità del DPI
...
Allegato I Categorie di rischio dei DPI
Il presente allegato definisce le categorie di rischio da cui i DPI sono destinati a proteggere gli utilizzatori.
Categoria I
La categoria I comprende esclusivamente i seguenti rischi minimi:
a) lesioni meccaniche superficiali;
b) contatto con prodotti per la pulizia poco aggressivi o contatto prolungato con l'acqua;
c) contatto con superfici calde che non superino i 50 °C;
d) lesioni oculari dovute all'esposizione alla luce del sole (diverse dalle lesioni dovute all'osservazione del sole);
e) condizioni atmosferiche di natura non estrema.
Categoria II
La categoria II comprende i rischi diversi da quelli elencati nelle categorie I e III.
Categoria III
La categoria III comprende esclusivamente i rischi che possono causare conseguenze molto gravi quali morte o danni alla salute irreversibili con riguardo a quanto segue:
a) sostanze e miscele pericolose per la salute;
b) atmosfere con carenza di ossigeno;
c) agenti biologici nocivi;
d) radiazioni ionizzanti;
e) ambienti ad alta temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di almeno 100 °C;
f) ambienti a bassa temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di - 50 °C o inferiore;
g) cadute dall'alto;
h) scosse elettriche e lavoro sotto tensione;
i) annegamento;
j) tagli da seghe a catena portatili;
k) getti ad alta pressione;
l) ferite da proiettile o da coltello;
m) rumore nocivo
Norme tecniche
[panel]
UNI EN ISO 374-1:2018
Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - Parte 1: Terminologia e requisiti prestazionali per rischi chimici
Recepisce: EN ISO 374-1:2016/A1:2018
EN ISO 374-1:2016
Adotta: ISO 374-1:2016/Amd 1:2018
ISO 374-1:2016
Data entrata in vigore: 22 novembre 2018
La norma specifica i requisiti dei guanti destinati a proteggere l'utilizzatore contro i prodotti chimici pericolosi e definisce i termini da utilizzare.
Sostituisce: UNI EN ISO 374-1:2017
UNI EN ISO 374-2:2020
Guanti di protezione contro i prodotti chimici pericolosi e i microorganismi - Parte 2: Determinazione della resistenza alla penetrazione
Recepisce: EN ISO 374-2:2019
Adotta: ISO 374-2:2019
Data entrata in vigore: 06 febbraio 2020
La norma specifica un metodo di prova per la resistenza alla penetrazione di guanti di protezione contro i prodotti chimici pericolosi e/o i microorganismi.
Sostituisce: UNI EN 374-2:2015
UNI EN 16523-1:2019
Determinazione della resistenza dei materiali alla permeazione dei prodotti chimici - Parte 1: Permeazione dei prodotti chimici liquidi potenzialmente pericolosi in condizioni di contatto continuo
Recepisce: EN 16523-1:2015+A1:2018
Data entrata in vigore: 21 febbraio 2019
La norma specifica un metodo di prova per la determinazione della resistenza dei materiali degli indumenti di protezione, dei guanti e delle calzature alla permeazione di prodotti chimici liquidi potenzialmente pericolosi in condizioni di contatto continuo.
Il metodo non è applicabile alla valutazione delle miscele chimiche, tranne che per le soluzioni acquose.
UNI EN ISO 374-4:2020
Guanti di protezione contro prodotti chimici pericolosi e microorganismi - Parte 4: Determinazione della resistenza alla degradazione per i prodotti chimici
Recepisce: EN ISO 374-4:2019
Adotta: ISO 374-4:2019
Data entrata in vigore: 06 febbraio 2020
La norma specifica il metodo di prova per la determinazione della resistenza dei materiali dei guanti di protezione alla degradazione per contatto continuo con prodotti chimici pericolosi.
Sostituisce: UNI EN 374-4:2014
UNI EN ISO 374-5:2017
Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - Parte 5: Terminologia e requisiti prestazionali per rischi da microorganismi
Recepisce: EN ISO 374-5:2016
Adotta: ISO 374-5:2016
Data entrata in vigore: 02 marzo 2017
La norma specifica i requisiti e i metodi di prova dei guanti destinati a proteggere l'utilizzatore contro i microorganismi.[/panel]
EN ISO 374-1:2016/A1:2018
Guanti di protezione contro i prodotti chimici e microorganismi pericolosi
Parte 1: Terminologia e requisiti prestazionali per rischi chimici
Estratto / Traduzione in IT non ufficiale
[...]
In base alla loro capacità di permeazione, i guanti di protezione chimica sono classificati in tre tipi: tipo A, tipo B o tipo C.
5.4.2 Tipo A
La prestazione di permeazione deve essere almeno di livello 2 rispetto a un minimo di sei sostanze chimiche in esame elencate nella tabella 2.
5.4.3 Tipo B
La prestazione di permeazione deve essere almeno di livello 2 rispetto a un minimo di tre sostanze chimiche in esame elencate nella tabella 2.
5.4.4 Tipo C
La prestazione di permeazione deve essere almeno di livello 1 rispetto al minimo di una sostanza chimica in esame elencata nella tabella 2.
Tabella 2 - Elenco delle sostanze chimiche in esame
...
Marcatura
I guanti di protezione contro le sostanze chimiche pericolose devono essere contrassegnati in conformità con i requisiti per i guanti di protezione in EN 420 e con i seguenti.
Marcatura dei guanti di tipo A
Per i guanti protettivi conformi ai requisiti di tipo A indicati in 5.5, i pittogrammi nella Figura 2 devono essere utilizzati con riferimento a questa parte della ISO 374.
Le sei sostanze chimiche testate devono essere identificate dalla loro lettera di codice che deve essere contrassegnata sotto il pittogramma come mostrato nella Figura 2.
Se sono state testate altre sostanze chimiche non presenti nell'elenco, le informazioni sui livelli di prestazione devono essere fornite nelle istruzioni per l'utente.
...
segue in allegato
Certifico Srl - IT/EN | Rev. 0.0 2021
©Copia autorizzata Abbonati
Collegati
[box-note]Regolamento (UE) 2016/425
Elenco norme armonizzate Regolamento DPI
D.Lgs. 81/2008
Decreto Legislativo n. 475 del 4 dicembre 1992
Dichiarazione di Conformita' UE DPI: Regolamento (UE) 2016/425
Guanti di protezione rischi meccanici - EN 388:2016+A1:2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guanti di protezione rischi chimici EN ISO 374-1 2016 A1 2018 Rev. 0.0 2021.pdf Certifico Srl - Rev. 0.0 2021 |
477 kB | 677 |
Legge 11 agosto 1991 n. 273
Legge 11 agosto 1991 n. 273
Istituzione del sistema nazionale di taratura.
Entrata in vigore della legge: 10.09.1991
(GU n.199 del 26.08.1991)
L’infrastruttura metrologica nazionale
Collegati
[box-note]UNI CEI EN ISO/IEC 17025:2018 in IT[/box-note]
RAPEX Report 29 del 23/07/2021 N. 10 A12/01106/21 Belgio

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 29 del 23/07/2021 N. 10 A12/01106/21 Belgio
Approfondimento tecnico: Fuochi d'artificio
Il prodotto, di marca Zena, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2013/29/UE del Parlamento Europeo e del Consiglio del 12 giugno 2013 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di articoli pirotecnici ed alla norma tecnica EN 16263-2:2015 “Articoli pirotecnici - Altri articoli pirotecnici - Parte 2: Requisiti”.
Il prodotto è etichettato in modo errato, nonostante gli articoli pirotecnici siano soggetti a misure specifiche a tal riguardo. Un consumatore che utilizza i fuochi d'artificio per divertimento potrebbe ferirsi.
Direttiva 2013/29/UE
Articolo 10
Etichettatura degli articoli pirotecnici diversi dagli articoli pirotecnici per i veicoli
1. I fabbricanti assicurano che gli articoli pirotecnici diversi dagli articoli pirotecnici per i veicoli siano etichettati, in modo visibile, leggibile e indelebile, nella lingua ufficiale o nelle lingue ufficiali dello Stato membro in cui l’articolo pirotecnico è messo a disposizione del consumatore. Tale etichettatura deve essere chiara, comprensibile e intelligibile.
2. L’etichetta degli articoli pirotecnici comprende almeno le informazioni sul fabbricante di cui all’articolo 8, paragrafo 6, e, qualora il fabbricante non sia stabilito nell’Unione, le informazioni sul fabbricante e sull’importatore di cui, rispettivamente, all’articolo 8, paragrafo 6, e all’articolo 12, paragrafo 3, il nome e il tipo dell’articolo pirotecnico, il suo numero di registrazione e il suo numero di prodotto, di lotto o di serie, i limiti minimi d’età di cui all’articolo 7, paragrafi 1 e 2, la categoria pertinente e le istruzioni per l’uso, l’anno di produzione per i fuochi d’artificio delle categorie F3 e F4 nonché, se del caso, una distanza minima di sicurezza. L’etichetta comprende il contenuto esplosivo netto (NEC).
3. I fuochi d’artificio sono inoltre corredati delle seguenti informazioni minime:
a) categoria F1: se del caso, «da usarsi soltanto in spazi aperti» e indicazione della distanza minima di sicurezza;
b) categoria F2: «da usarsi soltanto in spazi aperti» e, se del caso, indicazione della distanza minima o delle distanze minime di sicurezza;
c) categoria F3: «da usarsi soltanto in spazi aperti» e indicazione della distanza minima o delle distanze minime di sicurezza;
d) categoria F4: «può essere usato esclusivamente da persone con conoscenze specialistiche» e indicazione della distanza minima o delle distanze minime di sicurezza.
4. Gli articoli pirotecnici teatrali indicano le seguenti informazioni minime:
a) categoria T1: se del caso, «da usarsi soltanto in spazi aperti» e indicazione della distanza minima o delle distanze minime di sicurezza;
b) categoria T2: «può essere usato esclusivamente da persone con conoscenze specialistiche» e indicazione della distanza minima o delle distanze minime di sicurezza.
5. Se l’articolo pirotecnico non presenta uno spazio sufficiente per soddisfare i requisiti di etichettatura di cui ai paragrafi 2, 3 e 4 le informazioni sono riportate sulla confezione minima di vendita.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 29 del 23_07_2021 N. 10 A12_01106_21 Belgio .pdf Fuochi d\'artificio |
349 kB | 0 |
ISO 7010 Raccolta segnaletica di sicurezza - Ed. 2021
ISO 7010 Raccolta dei Segnali di sicurezza previsti dalla norma / Ed. 2021 Amd 4 Dicembre 2021
ID 14201 | Ed. 8.0 del 03 Dicembre 2021 / File immagini PNG e Lista segnaletica allegata
Aggiornata la raccolta segnaletica ISO 7010:2019, con altri segnali pubblicati con l'emendamento 4 di Dicembre 2021, in allegato:
- Raccolta immagini segnaletica Ed. 8.0 aggiornata con l'emendamento n. 4 di Dicembre 2021
[box-info]Nuovi Pittogrammi Emendamento A4 Dicembre 2021
F018: Fire alarm flashing light,
M059: Wear laboratory coat,
W073: Warning; Large-scale fire zone,
W074: Warning; Tornado zone,
W075: Warning; Active volcano zone,
W076: Warning; Debris flow zone,
W077: Warning; Flood zone,
W078: Warning; Landslide zone.[/box-info]
[box-info]Nuovi Pittogrammi Emendamento A3 Luglio 2021
E067 - Evacuation mattress
E068 - Lifebuoy with light and smoke
E069 - Person overboard call point
F019 - Unconnected fire hose[/box-info]
[box-info]Segnaletica EN ISO 7010 e Segnaletica allegato XXV del TUS
In relazione all'uso della segnaletica di sicurezza di cui all'Allegato XXV D.Lgs n. 81/2008 e s.m.i, che non è aggiornata e armonizzata rispetto alla segnaletica EN ISO 7010 si è espresso il MLPS con la:
- Circolare n. 30 del 16.07.2013
Segnaletica di sicurezza - D.Lgs n. 81/2008 e s.m.mi. allegato XXV - Prescrizioni generali. Uso e rispondenza dei pittogrammi con la Norma UNI EN ISO 7010:2017 - Chiarimenti[/box-info]
ISO 7010:2019
Graphical symbols - Safety colours and safety signs - Registered safety signs
Corrigenda/Amendments:
ISO 7010:2011/Amd 1:2012
ISO 7010:2011/Amd 2:2012
ISO 7010:2011/Amd 3:2012
ISO 7010:2011/Amd 4:2013
ISO 7010:2011/Amd 5:2014
ISO 7010:2011/Amd 6:2014
ISO 7010:2011/Amd 7:2016
ISO 7010:2011/Amd 8:2017
ISO 7010:2011/Amd 9:2018
ISO 7010:2019/Amd 1:2020
ISO 7010:2019/Amd 2:2020
ISO 7010:2019/Amd 3:2021
ISO 7010:2019/Amd 4:2021
ISO 7010:2019: https://www.iso.org/standard/72424.html
[alert]Lista Norme ISO
ISO 7010:2011
ISO 7010:2011/Amd 1:2012
ISO 7010:2011/Amd 2:2012
ISO 7010:2011/Amd 3:2012
ISO 7010:2011/Amd 4:2013
ISO 7010:2011/Amd 5:2014
ISO 7010:2011/Amd 6:2014
ISO 7010:2011/Amd 7:2016
ISO 7010:2011/Amd 8:2017
ISO 7010:2011/Amd 9:2018
ISO 7010:2019
ISO 7010:2019/Amd 1:2020
ISO 7010:2019/Amd 2:2020
ISO 7010:2019/Amd 3:2021
ISO 7010:2019/Amd 4:2021[/alert]
Dim.: 800 x 800 px
Formato: png
Raccolta Elaborata su norma Licenza ISO
[box-note]Versioni precedenti:
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2012
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2015
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2017
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2018
La Raccolta dei Segnali di sicurezza EN ISO 7010 - Ed. 2020[/box-note]
Maggiori Info e acquisto Documento
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ISO 7010 2020 Amd 4 2021.zip Certifico Srl - Ed. 8.0 Dicembre 2021 |
18022 kB | 177 | ||
| ISO 7010 2019 Amd 3 2021.zip Certifico Srl - Ed. 7.0 Agosto 2021 |
17815 kB | 156 |
Direttiva delegata (UE) 2021/1206
Direttiva delegata (UE) 2021/1206
Direttiva delegata (UE) 2021/1206 della Commissione del 30 aprile 2021 che modifica l’allegato III della direttiva 2014/90/UE del Parlamento europeo e del Consiglio sull’equipaggiamento marittimo per quanto riguarda la norma applicabile ai laboratori utilizzati dagli organismi di valutazione della conformità per l’equipaggiamento marittimo
(GU L 261/45 del 22.7.2021)
Entrata in vigore: 11.08.2021
...
Articolo 1
Nell’allegato III, punto 19, della direttiva 2014/90/UE, il riferimento alla norma «EN ISO/IEC 17025:2005» è sostituito dal riferimento alla norma «EN ISO/IEC 17025:2017».
Articolo 2
1. Gli Stati membri mettono in vigore le disposizioni legislative, regolamentari e amministrative necessarie per conformarsi alla presente direttiva entro e non oltre il 31 gennaio 2022. Essi comunicano immediatamente alla Commissione il testo di tali disposizioni.
Le disposizioni adottate dagli Stati membri contengono un riferimento alla presente direttiva o sono corredate di tale riferimento all’atto della pubblicazione ufficiale. Le modalità del riferimento sono stabilite dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni principali di diritto interno che adottano nel settore disciplinato dalla presente direttiva.
...
Collegati
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
ISO/IEC 17025:2017 - Testing and calibration laboratories[/box-note]
Norme armonizzate Regolamento dispositivi medici-diagnostici in vitro 2017/746/UE
Norme armonizzate Regolamento DMD in vitro 2017/746/UE / Update Aprile 2025
ID 14084 | Elenco Norme armonizzate Regolamento dispositivi medici diagnostici in vitro 2017/746/UE ad Aprile 2025
Norme armonizzate Regolamento dispositivi medici diagnostici in vitro 2017/746/UE
Elenco consolidato
- Decisione di esecuzione (UE) 2021/1195 della Commissione del 19 luglio 2021 relativa alle norme armonizzate per i dispositivi medico-diagnostici in vitro redatte a sostegno del regolamento (UE) 2017/746 del Parlamento europeo e del Consiglio.(GU L 258/50 del 20.07.2021) Entrata in vigore: 20.07.2021
- Decisione di esecuzione (UE) 2022/15 della Commissione del 6 gennaio 2022 che modifica la Decisione di esecuzione (UE) 2021/1195 per quanto riguarda le norme armonizzate per la sterilizzazione dei dispositivi medici, il trattamento asettico dei prodotti per la cura della salute, i sistemi di gestione per la qualità, i simboli da utilizzare nelle informazioni che devono essere fornite da parte del fabbricante e i requisiti per definire la tracciabilità metrologica dei valori assegnati ai calibratori e ai materiali di controllo della giustezza e campioni umani (GU L 4/16 del 7.1.2022). Entrata in vigore: 07.01.2022
- Decisione di esecuzione (UE) 2022/729 della Commissione dell'11 maggio 2022 che modifica la decisione di esecuzione (UE) 2021/1195 per quanto riguarda le norme armonizzate per i sistemi di gestione per la qualità e per l’applicazione della gestione dei rischi ai dispositivi medici. (GU L 135/31 del 12.5.2022). Entrata in vigore: 12.05.2022
- Decisione di esecuzione (UE) 2023/1411 della Commissione del 4 luglio 2023 che modifica la decisione di esecuzione (UE) 2021/1195 per quanto riguarda una norma armonizzata per la sterilizzazione dei dispositivi medici. (GU L 170/105 del 5.7.2023). Entrata in vigore: 05.07.2023
- Decisione di esecuzione (UE) 2024/817 della Commissione, del 6 marzo 2024, che modifica la decisione di esecuzione (UE) 2021/1195 per quanto riguarda le norme armonizzate per la sterilizzazione dei prodotti sanitari e gli imballaggi per dispositivi medici sterilizzati terminalmente. (GU L 2024/817 08.03.2024). Entrata in vigore: 08.03.2024
- Decisione di esecuzione (UE) 2024/2625 della Commissione, dell'8 ottobre 2024, che modifica la decisione di esecuzione (UE) 2021/1195 per quanto riguarda le norme armonizzate per il trattamento asettico dei prodotti per la cura della salute e gli studi di prestazione clinica che utilizzano campioni provenienti da soggetti umani (GU L 2024/2625 9.10.2024). Entrata in vigore: 09.10.2024
- Decisione di esecuzione (UE) 2025/679 della Commissione, dell’8 aprile 2025, che modifica la decisione di esecuzione (UE) 2021/1195 per quanto riguarda le norme armonizzate per la sterilizzazione dei dispositivi medici. (GU L 2025/679 del 10.4.2025). Entrata in vigore: 10.04.2025
Conformemente all’articolo 8 del regolamento (UE) 2017/746 del Parlamento europeo e del Consiglio, i dispositivi conformi alle norme armonizzate pertinenti, o a parti pertinenti di tali norme, i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell’Unione europea, sono considerati conformi alle prescrizioni di detto regolamento contemplate da tali norme o parti di esse.
[box-warning]Il regolamento (UE) 2017/746 ha abrogato la direttiva 98/79/CE del Consiglio con effetto dal 26 maggio 2022.
Norme armonizzate Direttiva dispositivi medico-diagnostici in vitro (IVD) 98/79/CE
A norma dell'articolo 110, paragrafo 2, secondo comma, del regolamento (UE) 2017/746 del Parlamento europeo e del Consiglio, i certificati rilasciati da organismi notificati conformemente alla direttiva 98/79/CE a partire dal 25 maggio 2017 perdono validità al più tardi il 27 maggio 2024. A norma dell'articolo 110, paragrafo 3, primo comma, del regolamento (UE) 2017/746, un dispositivo con un certificato rilasciato ai sensi della direttiva 98/79/CE e valido ai sensi dell'articolo 110, paragrafo 2, del regolamento (UE) 2017/746 può essere immesso sul mercato o messo in servizio a condizione che a decorrere dal 26 maggio 2022 continui a essere conforme alla direttiva 98/79/CE e a condizione che non ci siano cambiamenti significativi nella progettazione e nella destinazione d'uso. La presente decisione dovrebbe pertanto applicarsi solo fino al 26 maggio 2024.
I requisiti relativi ai dispositivi medico-diagnostici in vitro di cui alla direttiva 98/79/CE sono diversi da quelli di cui al regolamento (UE) 2017/746. Le norme elaborate a sostegno della direttiva 98/79/CE non dovrebbero pertanto essere utilizzate per dimostrare la conformità ai requisiti del regolamento (UE) 2017/746.
La comunicazione 2017/C 389/04 della Commissione è abrogata. Essa continua ad applicarsi fino al 30 settembre 2021 per quanto riguarda i riferimenti delle norme armonizzate figuranti nell'allegato II della presente decisione.
Le norme armonizzate per i dispositivi medico-diagnostici in vitro elaborate a sostegno della direttiva 98/79/CE e figuranti negli allegati I e II della Decisione di esecuzione 2020/439 non possono essere utilizzate per conferire una presunzione di conformità ai requisiti del regolamento (UE) 2017/746.
La Decisione di esecuzione 2020/439 si applica fino al 26 maggio 2024.[/box-warning]
[box-download]In fondo all'articolo, scorrendo la pagina, allegato PDF dell'elenco delle norme armonizzate Reg. DMD in vitro ad Aprile 2025 riservato Abbonati Marcatura CE. [/box-download]
Certifico Srl - IT | Rev. 6.0 2025
©Copia autorizzata Abbonati
...
Elenco Norme armonizzate regolamento (UE) 2017/746 al 10 Aprile 2025
Elenco consolidato:
1. Decisione di esecuzione (UE) 2021/1195
2. Decisione di esecuzione (UE) 2022/15
3. Decisione di esecuzione (UE) 2022/729
4. Decisione di esecuzione (UE) 2023/1411
5. Decisione di esecuzione (UE) 2024/817
6. Decisione di esecuzione (UE) 2024/2625
7. Decisione di esecuzione (UE) 2025/679
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Prima pubblicazione GU |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Dec. di esecuzione |
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
| CEN |
EN 556-1:2024 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l’indicazione “STERILE” - Parte 1: Requisiti per i dispositivi medici sterilizzati terminalmente |
10.04.2025 | Decisione di esecuzione (UE) 2025/679 | ||
|
CEN |
EN 556-2:2024 Sterilizzazione dei dispositivi medici - Requisiti per i dispositivi medici che recano l’indicazione “STERILE” - Parte 2: Requisiti per i dispositivi medici preparati asetticamente |
10.04.2025 |
|||
|
CEN |
EN ISO 11135:2014 Sterilizzazione dei prodotti sanitari - Ossido di etilene - Requisiti per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 11135:2014) EN ISO 11135:2014/A1:2019
|
20.07.2021 |
|
|
Decisione di esecuzione (UE) 2021/1195
|
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari - Radiazione - parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006, comprensiva della modifica 1:2013) EN ISO 11137-1:2015/A2:2019
|
20.07.2021 |
|
|
Decisione di esecuzione (UE) 2021/1195
|
| CEN |
EN ISO 11137-2:2015 Sterilizzazione dei prodotti sanitari - Radiazione - parte 2: Definizione della dose sterilizzante (ISO 11137-2:2013) EN ISO 11137-2:2015/A1:2023 |
08.03.2024 | Decisione di esecuzione (UE) 2024/817 | ||
| CEN |
EN ISO 11607-1:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - parte 1: Requisiti per materiali, sistemi di barriera sterili e sistemi di imballaggio (ISO 11607-1:2019) EN ISO 11607-1:2020/A1:2023 |
08.03.2024 | Decisione di esecuzione (UE) 2024/817 | ||
|
CEN |
EN ISO 11607-2:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - parte 2: Requisiti di convalida per il formato, la tenuta e i processi di assemblaggio (ISO 11607-2:2019) EN ISO 11607-2:2020/A1:2023 |
08.03.2024 |
|||
|
CEN |
EN ISO 11737-1:2018 Sterilizzazione dei dispositivi medici - Metodi microbiologici - Parte 1: Determinazione di una popolazione di microrganismi sui prodotti (ISO 11737-1:2018) EN ISO 11737-1:2018/A1:2021 |
07.01.2022 |
|
|
|
|
CEN |
EN ISO 11737-2:2020 Sterilizzazione dei dispositivi medici - Metodi microbiologici - parte 2: Prove di sterilità eseguite nel corso della definizione, della convalida e del mantenimento di un processo di sterilizzazione (ISO 11737-2:2019)
|
20.07.2021 |
|
|
Decisione di esecuzione (UE) 2021/1195
|
|
CEN |
EN ISO 13408-1:2024 |
09.10.2024 |
Decisione di esecuzione (UE) 2024/2625 | ||
|
CEN |
EN ISO 13408-6:2021 Trattamento asettico dei prodotti per la cura della salute - Parte 6: Sistemi isolatori (ISO 13408-6:2021) |
07.01.2022 |
|
|
|
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/A11:2021 |
07.01.2022 |
|
|
Decisione di esecuzione (UE) 2022/15 Decisione di esecuzione (UE) 2022/729: sostituita dal 07.01.2022 |
|
CEN |
EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2018 EN ISO 13485:2016/A11:2021 |
12.05.2022 |
|
|
|
|
CEN |
EN ISO 14971:2019 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (ISO 14971:2019) EN ISO 14971:2019/A11:2021 |
12.05.2022 |
|
|
|
|
CEN |
EN ISO 15223-1:2021 Dispositivi medici - Simboli da utilizzare nelle informazioni che devono essere fornite da parte del fabbricante - Parte 1: Requisiti generali (ISO 15223-1:2021) |
07.01.2022 |
|
|
|
|
CEN |
EN ISO 17511:2021 Dispositivi medico-diagnostici in vitro - Requisiti per definire la tracciabilità metrologica dei valori assegnati ai calibratori e ai materiali di controllo della giustezza e campioni umani (ISO 17511:2020) |
07.01.2022 |
|
|
|
| CEN |
EN ISO 20916:2024 Dispositivi medico-diagnostici in vitro - Studi di prestazione clinica che utilizzano campioni provenienti da soggetti umani - Buone pratiche di studio (ISO 20916:2019) |
09.10.2024 | Decisione di esecuzione (UE) 2024/2625 | ||
|
CEN |
EN ISO 25424:2019 Sterilizzatrici a bassa temperatura a vapore e formaldeide - Requisiti per lo sviluppo, la convalida e il controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 25424:2018)
|
05.07.2023 |
|
|
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata. La norma sostituita perciò consiste nella EN CCCCC:YYYY e nelle sue precedenti eventuali modifiche, ma senza la nuova modifica citata. Alla data stabilita, la norma sostituita cessa di fornire la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (2).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet:
http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
__________
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, B-1040 Bruxelles, Telefono: +32 25500811; fax +32 25500819 (http://www.cen.eu)
- Cenelec: Rue de la Science 23, B-1040 Bruxelles, Telefono: +32 25500811; fax +32 25500819 (http://www.cenelec.eu)
- ETSI: 650, route des Lucioles, F-06921 Sophia Antipolis, tel.+33 492944200; fax +33 493654716, (http://www.etsi.eu)
(2) GU C 338 del 27.9.2014, pag. 31.
Vedi la nuova sezione 2019/2025 "Norme armonizzate click"
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 6.0 2025.pdf Certifico Srl - Rev. 6.0 2025 |
205 kB | 3 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 5.0 2024.pdf Certifico Srl - Rev. 5.0 2024 |
195 kB | 0 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 4.0 2024.pdf Certifico Srl - Rev. 4.0 2024 |
187 kB | 3 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
181 kB | 2 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 2.0 2022.pdf Certifico Srl - Rev. 2.0 2022 |
175 kB | 2 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 1.0 2022.pdf Certifico Srl - Rev. 1.0 2022 |
166 kB | 3 | ||
| Norme armonizzate Reg. dispositivi medici diagnostici in vitro Rev. 0.0 2021.pdf Certifico Srl - Rev. 0.0 2021 |
399 kB | 2 |
Norme armonizzate Direttiva DM impiantabili attivi (DMIA) 90/385/CEE
Norme armonizzate Direttiva dispositivi medici impiantabili attivi 90/385/CEE
ID 14081 | Elenco Norme armonizzate Direttiva dispositivi medici impiantabili attivi (DMIA) 90/385/CEE ad Aprile 2021
[box-warning]Come consultare i riferimenti alle norme armonizzate 2021
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi della Direttiva 90/385/CEE sono contenuti nelle:
1. Comunicazione della Commissione nell’ambito dell’applicazione della direttiva 90/385/CEE del Consiglio, del 20 giugno 1990, per il ravvicinamento delle legislazioni degli Stati membri relative ai dispositivi medici impiantabili attivi (Comunicazione 2017/C 389/02 del 17 Novembre 2017). GUUE C389/22 del 17.11.2017
2. Decisione di esecuzione(UE) 2020/438 della Commissione del 24 marzo 2020 relativa alle norme armonizzate per i dispositivi medici impiantabili attivi elaborate a sostegno della direttiva 90/385/CEE del Consiglio. (GU LI 90/25 del 25.03.2020) Applicazione fino al 26 maggio 2024. (*)
3. Decisione di esecuzione (UE) 2021/611 della Commissione del 14 aprile 2021 che modifica la decisione di esecuzione (UE) 2020/438 per quanto riguarda le norme armonizzate sulla valutazione biologica dei dispositivi medici, sugli imballaggi per dispositivi medici sterilizzati terminalmente, sulla sterilizzazione dei dispositivi medici e sull'indagine clinica dei dispositivi medici per soggetti umani (GU L 129/158 del 15.04.2021)
e devono essere letti insieme, tenendo conto che l'ultima decisione modifica alcuni riferimenti pubblicati nella comunicazione e nelle decisioni precedenti pubblicate.
(*) La comunicazione 2017/C 389/02 della Commissione è abrogata. Essa continua ad applicarsi fino al 30 settembre 2021 per quanto riguarda i riferimenti delle norme armonizzate figuranti nell'allegato II della Decisione di esecuzione(UE) 2020/438.
Le norme armonizzate per i dispositivi medici impiantabili attivi elaborate a sostegno della direttiva 90/385/CEE e figuranti negli allegati I e II della Decisione di esecuzione(UE) 2020/438 non possono essere utilizzate per conferire una presunzione di conformità ai requisiti del regolamento (UE) 2017/745.[/box-warning]
[box-download]In fondo all'articolo, scorrendo la pagina, allegato PDF dell'elenco consolidato delle norme armonizzate DMIA ad Aprile 2021 riservato Abbonati Marcatura CE. [/box-download]
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
...
Elenco consolidato Norme armonizzate Direttiva 90/385/CEE DMIA al 15 Aprile 2021
Elenco consolidato che tiene conto delle:
1. Comunicazione 2017/C 389/02 del 17 Novembre 2017
2. Decisione di esecuzione(UE) 2020/438
3. Decisione di esecuzione (UE) 2021/611
|
OEN (1)
|
Riferimento e titolo della norma (e documento di riferimento) |
Prima pubblicazione GU |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione Nota 4 |
||
|
CEN
|
EN 556-1:2001 Sterilizzazione dei dispositivi medici — Requisiti per i dispositivi medici che recano l’indicazione «STERILE» — Requisiti per i dispositivi medici sterilizzati terminalmente |
31.7.2002 |
EN 556:1994 + A1:1998 Nota 2.1 |
30.4.2002 |
|
||
|
EN 556-1:2001/AC:2006 |
15.11.2006 |
|
|
|
|||
|
CEN
|
EN 556-2:2015 Sterilizzazione dei dispositivi medici — Requisiti per i dispositivi medici che recano l’indicazione «STERILE» — Parte 2: Requisiti per i dispositivi medici preparati asetticamente |
13.5.2016 |
EN 556-2:2003 Nota 2.1 |
30.6.2016 |
|
||
|
CEN
|
EN 1041:2008 Informazioni fornite dal fabbricante di dispositivi medici |
19.2.2009 |
EN 1041:1998 Nota 2.1 |
31.8.2011 |
|
||
|
CEN
|
EN ISO 10993-1:2009 Valutazione biologica dei dispositivi medici — Parte 1: Valutazione e prove all’interno di un processo di gestione del rischio (ISO 10993- 1:2009) |
2.12.2009 |
EN ISO 10993-1:2009 Nota 2.1 |
21.3.2010 |
|
||
|
EN ISO 10993-1:2009/AC:2010 |
18.1.2011 |
|
|
|
|||
|
CEN
|
EN ISO 10993-3:2014 Valutazione biologica dei dispositivi medici — Parte 3: Prove di genotossicità, carcinogenicità e tossicità sulla riproduzione (ISO 10993-3:2014) |
10.7.2015 |
|
|
|
||
|
CEN
|
EN ISO 10993-4:2009 Valutazione biologica dei dispositivi medici — Parte 4: Scelta delle prove relative alla interazione col sangue |
2.12.2009 |
EN ISO 10993-4:2002 Nota 2.1 |
21.3.2010 |
|
||
|
CEN |
EN ISO 10993-5:2009 Valutazione biologica dei dispositivi medici — Parte 5: Prove per la citotossicità in vitro (ISO 10993-5:2009) |
2.12.2009 |
EN ISO 10993-5:1999 Nota 2.1 |
31.12.2009 |
|
||
|
CEN |
EN ISO 10993-6:2009 Valutazione biologica dei dispositivi medici — Parte 6: Prove relative agli effetti locali dopo l’impianto (ISO 10993-6:2007) |
2.12.2009 |
EN ISO 10993-6:2007 Nota 2.1 |
21.3.2010 |
|
||
|
CEN |
EN ISO 10993-7:2008 Valutazione biologica dei dispositivi medici — Parte 7: Residui della sterilizzazione a ossido di etilene (ISO 10993-7:2008) |
7.7.2010 |
|
|
|
||
|
EN ISO 10993-7:2008/AC:2009 |
7.7.2010 |
|
|
|
|||
|
CEN |
EN ISO 10993-9:2009 Valutazione biologica dei dispositivi medici — Parte 9: Struttura per l’identificazione e la quantificazione dei prodotti potenziali di degra- dazione (ISO 10993-9:2009) |
2.12.2009 |
EN ISO 10993-9:2009 Nota 2.1 |
21.3.2010 |
|
||
|
CEN |
EN ISO 10993-11:2018 Valutazione biologica dei dispositivi medici - Parte 11: Prove di tossicità sistematica (ISO 10993-11:2017) |
25.03.2020 |
|
|
Con dec. di esec. (UE) 2020/438 la norma è pubblicata dal 25.03.2020 |
||
|
CEN |
EN ISO 10993-12:2012 Valutazione biologica dei dispositivi medici — Parte 12: Preparazione dei campioni e materiali di riferimento (ISO 10993-12:2012) |
24.1.2013 |
EN ISO 10993- 12:2009 Nota 2.1 |
31.1.2013 |
|
||
|
CEN |
EN ISO 10993-13:2010 Valutazione biologica dei dispositivi medici — Parte 13: Identificazione e quantificazione di prodotti di degradazione di dispositivi medici a base di polimeri (ISO 10993-13:2010) |
18.1.2011 |
EN ISO 10993- 13:2009 Nota 2.1 |
31.12.2010 |
|
||
|
CEN |
EN ISO 10993-16:2017 Valutazione biologica dei dispositivi medici - Parte 16: Concezione di studi tossicocinetici per i prodotti di degradazione e le sostanze rilasciabili (ISO 10993-16:2017) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||
|
CEN |
EN ISO 10993-17:2009 Valutazione biologica dei dispositivi medici — Parte 17: Definizione dei limiti ammissibili per le sostanze rilasciabili (ISO 10993-17:2002) |
2.12.2009 |
EN ISO 10993- 17:2002 Nota 2.1 |
21.3.2010 |
|
||
|
CEN |
EN ISO 10993-18:2020 Valutazione biologica dei dispositivi medici - Parte 18: Caratterizzazione chimica dei materiali di dispositivi medici all'interno di un processo di gestione del rischio (ISO 10993-18:2020) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||
|
CEN |
EN ISO 11135-1:2007 Sterilizzazione dei prodotti sanitari — Ossido di etilene — Requisiti per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizzazione per dispositivi medici (ISO 11135- 1:2007) |
9.8.2007 |
EN 550:1994 Nota 2.1 |
31.5.2010 |
|
||||||
|
CEN |
EN ISO 11137-1:2015 Sterilizzazione dei prodotti sanitari — Radiazio- ne — Parte 1: Requisiti per lo sviluppo, la convalida e il controllo sistematico dei processi di sterilizzazione per i dispositivi medici (ISO 11137-1:2006) |
13.5.2016 |
EN ISO 11137-1:2006 Nota 2.1 |
30.6.2016 |
|
||||||
|
CEN |
EN ISO 11137-2:2015 Sterilizzazione dei prodotti sanitari — Radiazio- ne — Parte 2: Definizione della dose sterilizzante (ISO 11137-2:2013) |
13.5.2016 |
EN ISO 11137-2:2013 Nota 2.1 |
30.6.2016 |
|
||||||
|
CEN |
EN ISO 11138-2:2009 Sterilizzazione dei prodotti sanitari — Indicatori biologici — Parte 2: Indicatori biologici per processi di sterilizzazione a ossido di etilene (ISO 11138-2:2006) |
2.12.2009 |
EN ISO 11138-2:2006 Nota 2.1 |
21.3.2010 |
|
||||||
|
CEN |
EN ISO 11138-3:2009 Sterilizzazione dei prodotti sanitari — Indicatori biologici — Parte 3: Indicatori biologici per processi di sterilizzazione a calore umido (ISO 11138-3:2006) |
2.12.2009 |
EN ISO 11138-3:2006 Nota 2.1 |
21.3.2010 |
|
||||||
|
CEN |
EN ISO 11140-1:2009 Sterilizzazione dei prodotti sanitari — Indicatori chimici — Parte 1: Requisiti generali (ISO 11140- 1:2005) |
2.12.2009 |
EN ISO 11140-1:2005 Nota 2.1 |
21.3.2010 |
|
||||||
|
CEN |
EN ISO 11607-1:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - Parte 1: Requisiti per materiali, sistemi di barriera sterili e sistemi di imballaggio (ISO 11607-1:2019) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||||||
|
CEN |
EN ISO 11607-2:2020 Imballaggi per dispositivi medici sterilizzati terminalmente - Parte 2: Requisiti di convalida per il formato, la tenuta e i processi di assemblaggio (ISO 11607-2:2019) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||||||
|
CEN |
EN ISO 11737-1:2006 Sterilizzazione dei dispositivi medici — Metodi microbiologici — Parte 1: Determinazione di una popolazione di microrganismi sui prodotti (ISO 11737-1:2006) |
7.9.2006 |
EN 1174-1:1996 EN 1174-2:1996 EN 1174-3:1996 Nota 2.1 |
31.10.2006 |
|
||||||
|
EN ISO 11737-1:2006/AC:2009 |
2.12.2009 |
|
|
|
|||||||
|
CEN |
EN ISO 11737-2:2020 Sterilizzazione dei dispositivi medici - Metodi microbiologici - Parte 2: Prove di sterilità eseguite nel corso della definizione, della convalida e del mantenimento di un processo di sterilizzazione (ISO 11737-2:2019) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||||||
|
CEN |
EN ISO 13408-1:2015 Trattamento asettico dei prodotti per la cura della salute — Parte 1: Requisiti generali (ISO 13408- 1:2008) |
13.5.2016 |
EN ISO 13408-1:2011 Nota 2.1 |
30.6.2016 |
|
||||||
|
CEN |
EN ISO 13408-2:2018 Trattamento asettico dei prodotti per la cura della salute - Parte 2: Filtrazione sterilizzante (ISO 13408- 2:2018) |
25.03.2020 |
|
|
Con dec. di esec. (UE) 2020/438 la norma è pubblicata dal 25.03.2020 |
||||||
|
CEN |
EN ISO 13408-3:2011 Trattamento asettico dei prodotti per la cura della salute — Parte 3: Liofilizzazione (ISO 13408- 3:2006) |
19.8.2011 |
EN 13824:2004 Nota 2.1 |
31.12.2011 |
|
||||||
|
CEN |
EN ISO 13408-4:2011 Trattamento asettico dei prodotti per la cura della salute — Parte 4: Tecnologie per la pulizia in loco (ISO 13408-4:2005) |
19.8.2011 |
EN 13824:2004 Nota 2.1 |
31.12.2011 |
|
||||||
|
CEN |
EN ISO 13408-5:2011 Trattamento asettico dei prodotti per la cura della salute — Parte 5: Sterilizzazione in loco (ISO 13408-5:2006) |
19.8.2011 |
EN 13824:2004 Nota 2.1 |
31.12.2011 |
|
||||||
|
CEN |
EN ISO 13408-6:2011 Trattamento asettico dei prodotti per la cura della salute — Parte 6: Sistemi isolatori (ISO 13408- 6:2005) |
19.8.2011 |
EN 13824:2004 Nota 2.1 |
31.12.2011 |
|
||||||
|
CEN |
EN ISO 13408-7:2015 Trattamento asettico dei prodotti per la cura della salute — Parte 7: Processi alternativi per dispositivi medici e prodotti di combinazione (ISO 13408-7:2012) |
13.5.2016 |
|
|
|
||||||
|
CEN |
EN ISO 13485:2016 Dispositivi medici — Sistemi di gestione per la qualità — Requisiti per scopi regolamentari (ISO 13485:2016) |
17.11.2017 |
EN ISO 13485:2012 Nota 2.1 |
31.3.2019 |
|
||||||
|
EN ISO 13485:2016/AC:2018 |
25.03.2020 |
|
|
Con dec. di esec. (UE) 2020/438 la norma è pubblicata dal 25.03.2020 |
|||||||
|
CEN |
EN ISO 14155:2020 Indagine clinica dei dispositivi medici per soggetti umani - Buona pratica clinica (ISO 14155:2020) |
15.04.2021 |
|
|
Con dec. di esec. (UE) 2021/611 la norma è pubblicata dal 15.04.2021 |
||||||
|
CEN |
EN ISO 14937:2009 Sterilizzazione dei prodotti sanitari — Requisiti generali per la caratterizzazione di un agente sterilizzante e per lo sviluppo, la convalida ed il controllo sistematico di un processo di sterilizza- zione per dispositivi medici (ISO 14937:2009) |
7.7.2010 |
EN ISO 14937:2000 Nota 2.1 |
21.3.2010 |
|
|
CEN |
EN ISO 14971:2012 Dispositivi medici — Applicazione della gestione dei rischi ai dispositivi medici (ISO 14971:2007, Corrected version 2007-10-01) |
30.8.2012 |
EN ISO 14971:2009 Nota 2.1 |
30.8.2012 |
|
|
CEN |
EN ISO 15223-1:2016 Dispositivi medici — Simboli da utilizzare nelle etichette del dispositivo medico, nell’etichettatura e nelle informazioni che devono essere fornite — Parte 1: Requisiti generali (ISO 15223-1:2016, Corrected version 2017-03) |
17.11.2017 |
EN 980:2008 Nota 2.1 |
31.12.2017 |
|
|
CEN |
EN ISO 17665-1:2006 Sterilizzazione dei prodotti sanitari — Calore umido — Sviluppo, validazione e controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 17665-1:2006) |
15.11.2006 |
EN 554:1994 Nota 2.1 |
31.8.2009 |
|
|
CEN |
EN ISO 25424:2019 Sterilizzatrici a bassa temperatura a vapore e formaldeide - Requisiti per lo sviluppo, la convalida e il controllo di routine di un processo di sterilizzazione per dispositivi medici (ISO 25424:2018) |
25.03.2020 |
|
|
Con dec. di esec. (UE) 2020/438 la norma è pubblicata dal 25.03.2020 |
|
CEN |
EN 45502-1:1997 Dispositivi medici impiantabili attivi — Requisiti generali per la sicurezza, la marcatura e le informazioni fornite dal fabbricante |
27.8.1998 |
|
|
|
|
Cenelec |
EN 45502-2-1:2003 Dispositivi medici impiantabili attivi — Parte 2-1: Requisiti particolari per dispositivi medici im- piantabili attivi destinati al trattamento della bradiaritmia (stimolatori cardiaci) |
8.7.2004 |
|
|
|
|
(*): Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE.
|
|||||
|
|
EN 45502-2-2:2008 Dispositivi medici impiantabili attivi - Parte 2-2: Requisiti particolari per dispositivi medici impiantati attivi destinati al trattamento della tachicardia (inclusi i defibrillatori impiantabili) EN 45502-2-2:2008/AC:2009 Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
|
|
|
|
|
Cenelec |
EN 45502-2-3:2010 Dispositivi medici impiantabili attivi — Parte 2-3: Requisiti particolari per sistemi di impianto cocleare e sistemi di impianto uditivo del tronco encefalico |
18.1.2011 |
|
|
|
|
(*): Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE.
|
|
||||
|
Cenelec |
EN 60601-1:2006 Apparecchi elettromedicali — Parte 1: Prescri- zioni generali relative alla sicurezza fondamentale e alle prestazioni essenziali
|
27.11.2008 |
EN 60601-1:1990 + A13:1996 + A1:1993 + A2:1995 Nota 2.1 |
1.6.2012 |
|
|
EN 60601-1:2006/AC:2010 |
18.1.2011 |
|
|
|
|
|
EN 60601-1:2006/A1:2013 (IEC 60601-1:2005/A1:2012) |
10.7.2015 |
Nota 3 |
31.12.2017 |
|
|
|
Addendum alla nota 1 e alla nota 3 per quanto riguarda la data di cessazione della presunzione di conformità nell’applicazione della norma EN 60601-1:2006. |
|||||
|
Cenelec |
EN 60601-1-6:2010 Apparecchi elettromedicali — Parte 1: Norme generali per la sicurezza — Norma collaterale: Usabilità IEC 60601-1-6:2010 |
18.1.2011 |
|
|
|
|
(*): Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
|||||
|
Cenelec |
EN 62304:2006 Software per dispositivi medici — Processi relativi al ciclo di vita del software IEC 62304:2006 |
27.11.2008 |
|
|
|
|
EN 62304:2006/AC:2008 |
18.1.2011 |
|
|
|
|
|
(*): Questa norma europea non copre necessariamente i requisiti introdotti dalla direttiva 2007/47/CE. |
|||||
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, 1040 Bruxelles, tel. +32 2 55008 11; fax +32 2 550 0819 (http://www.cen.eu)
- CENELEC: Rue de la Science 23, 1040 Bruxelles, tel. +32 2 55008 11; fax +32 2 550 0819 (http://www.cenelec.eu)
- ETSI: 650, route des Lucioles, 06921 Sophia Antipolis, tel. +33 492 944200; fax +33 493 654716 (http://www.etsi.eu)
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata. La norma sostituita perciò consiste nella EN CCCCC:YYYY e nelle sue precedenti eventuali modifiche, ma senza la nuova modifica citata. Alla data stabilita, la norma sostituita cessa di fornire la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 4: Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione. (Vedasi Com.(2018) 764 EC).
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui l'elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (1).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet: http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
______
Collegati:
Vedi la nuova sezione 2019/2020/2021 "Norme armonizzate click"
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Elenco consolidato Norme armonizzate Direttiva DMIA Aprile 2021.pdf Certifico Srl - Rev. 0.0 2021 |
495 kB | 5 |
Banca dati dei Dispositivi medici. Manuale utente profilo fabbricante
Banca dati dei Dispositivi medici. Manuale utente profilo fabbricante | Agg. dicembre 2021
Ministero della Salute - Versione 9.2 01/07/2021
Il sistema “Banca Dati e Repertorio dei Dispositivi Medici (BD/RDM)”, in accordo con quanto stabilito dalla vigente normativa in tema di dispositivi medici, fornisce le funzionalità utili ai fini della:
- registrazione ed iscrizione in repertorio dei dispositivi di classe, impiantabili attivi e medicodiagnostici in Vitro da parte dei Fabbricanti, Mandatari ed altri soggetti da essi validamente delegati,
- aggiornamento e modifica dei dati di tali dispositivi da parte dei suddetti soggetti,
- consultazione dei dati da parte di vari attori del SSN nell’ambito delle proprie finalità e competenze,
- registrazione ed eventuale modifica dei dispositivi medico – diagnostici in vitro destinati inizialmente alla valutazione delle prestazioni prima dello loro immissione in commercio.
Scopo di questo documento è di fornire la descrizione di dettaglio delle singole funzionalità previste nel sistema per il profilo applicativo “Fabbricante”, ovvero per i Fabbricanti, Mandatari ed altri soggetti da essi validamente delegati.
Per una migliore comprensione delle stesse è utile sapere che la registrazione dei dati dei dispositivi passa attraverso una serie di stati:
- “In lavorazione”, attribuito al primo inserimento dei dati e all’eventuale modifica degli stessi,
- “Consolidato”, attribuito nel caso di superamento dell’operazione di Consolidamento (vd. Glossario),
- “Validato”, attribuito in caso di Validazione dei dati. E’ l’ultimo stato direttamente legato all’attività del dichiarante,
- “Pubblicato”, attribuito automaticamente dal sistema alla Pubblicazione dei dati. Si evidenzia che ad ogni stato è associata una caratteristica/modalità di modificabilità dei dati.
[...]
Fonte: Ministero della Salute
Collegati
[box-note]Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
Direttiva Dispositivi medici 93/42/CEE
Decreto Legislativo N. 46 del 24 Febbraio 1997
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Classificazione Nazionale Dispositivi medici
Direttiva 98/79/CE [/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Banca dati dei Dispositivi medici. Manuale utente profilo fabbricante Ver. 9.2 2021.pdf Versione 9.2 Dicembre 2021 |
7464 kB | 15 | ||
| Banca dati dei Dispositivi medici. Manuale utente profilo fabbricante.pdf Versione 9.1 Luglio 2021 |
6521 kB | 6 |
RAPEX Report 26 del 02/07/2021 N. 08 A12/00961/21 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 26 del 02/07/2021 N. 08 A12/00961/21 Finlandia
Approfondimento tecnico: Macchinina in legno
Il prodotto, di marca Sostrene Grene, mod. 146864, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
Delle piccole parti del giocattolo (parti in legno e la pallina) possono staccarsi, Di conseguenza, il bambino mettendole in bocca potrebbe soffocare.
La Direttiva 2009/48/CE, all’Allegato II, contenente i Requisiti Particolari di Sicurezza, stabilisce che:
4. […]
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili. […]
Inoltre, in accordo alla norma tecnica EN 71-1:2018, ogni giocattolo o suo componente deve superare la prova del cilindro per le piccole parti (Rif. paragrafo 8.2).
Ogni giocattolo o componente non deve entrare completamente nel cilindro di prova previsto dalla norma.
Figura 1 – Cilindro di prova
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 26 del 02_07_2021 N. 08 A12_00961_21 Finlandia .pdf Macchinina in legno |
143 kB | 0 |
Sintesi CE e Stati membri sull'applicazione della Direttiva giocattoli
Sintesi CE e Stati membri sull'applicazione della Direttiva giocattoli
CE, 15.07.2021
L'articolo 48 della direttiva 2009/48/CE sulla sicurezza dei giocattoli dispone che, entro il 20 luglio 2014 e successivamente ogni cinque anni, gli Stati membri trasmettano alla Commissione una relazione sull'applicazione della direttiva sulla sicurezza dei giocattoli.
Il 29 maggio 2019 la Commissione ha inviato agli Stati membri un questionario da compilare nelle rispettive lingue ufficiali ai fini della relazione. Lo stesso giorno il questionario è stato messo a disposizione del gruppo di esperti sulla sicurezza dei giocattoli, composto dagli Stati membri, dai paesi dello Spazio economico europeo (SEE) e dai paesi candidati e da rappresentanti dell'industria dei giocattoli, di associazioni di consumatori, di organismi di normalizzazione e laboratori di prova ("organismi notificati"), in tutte le lingue ufficiali, per essere opportunamente compilato.
27 Stati membri e due paesi del SEE hanno trasmesso il questionario compilato e la stragrande maggioranza ha inviato la propria risposta in una lingua nazionale. Anche varie organizzazioni delle parti interessate, l'ANEC, (Associazione europea per il coordinamento della rappresentanza dei consumatori in materia di normalizzazione), l'UEUC (Ufficio europeo delle unioni dei consumatori) e l'Associazione europea delle industrie del giocattolo (TIE), hanno apportato il loro contributo, esponendo il proprio punto di vista sull'applicazione della direttiva sulla sicurezza dei giocattoli.
Nel dicembre 2020 un primo progetto della sintesi della Commissione è stato condiviso con i membri del gruppo ADCO; una versione riveduta è stata distribuita al gruppo di esperti per la discussione e l'approvazione in occasione della riunione del gruppo di esperti del 24 marzo 2021.
Il gruppo di esperti è stato invitato a inviare osservazioni scritte alla Commissione entro il 16 aprile 2021. Tali osservazioni sono state prese in considerazione nella stesura definitiva della sintesi della Commissione.
La presente sintesi della Commissione rispecchia le informazioni presentate dagli Stati membri, da altri paesi e dalle parti interessate. I riferimenti ad atti legislativi, ad altri atti o pratiche non devono essere interpretati come riconoscimento della conformità di tali normative, altri atti o pratiche alla direttiva sulla sicurezza dei giocattoli.
Attuazione della direttiva sulla sicurezza dei giocattoli
Invitati a condividere le esperienze maturate durante l'attuazione della direttiva sulla sicurezza dei giocattoli in generale, solo quattro dei 27 Stati membri hanno dichiarato di non aver riscontrato alcuna difficoltà sul piano dell'attuazione. La maggioranza degli Stati membri ha però convenuto che la direttiva funziona correttamente.
Quattro Stati membri hanno segnalato una mancanza di coerenza nell'attuazione/applicazione della direttiva negli Stati membri, nel senso che alcuni paesi sono più restrittivi rispetto a quanto
imposto dalle disposizioni della direttiva sulla sicurezza dei giocattoli. In nessun paese sono state riscontrate vistose deviazioni rispetto alle disposizioni.
Il motivo più diffuso all'origine delle difficoltà di attuazione della direttiva è rappresentato, secondo quanto riportato, dalla mancanza di conoscenza da parte degli operatori economici dei requisiti stabiliti dalla direttiva. A giudizio di cinque Stati membri, gli operatori hanno scarsa conoscenza dei requisiti (in particolare di quelli connessi alla documentazione prescritta, quale la dichiarazione CE di conformità, o di quelli relativi alle sostanze chimiche) e in alcuni casi non li rispettano completamente. Due Stati membri hanno sottolineato che i piccoli operatori considerano i requisiti della direttiva sulla sicurezza dei giocattoli troppo complessi e costosi, data la necessità di far svolgere prove a laboratori esterni. In tali due paesi, i piccoli partecipanti al mercato che producono giocattoli artigianali (in stoffa o in legno) ritengono che i propri prodotti non rientrino nell'ambito di applicazione della normativa.
Cinque Stati membri hanno segnalato difficoltà pratiche in merito alla definizione di giocattolo data dalla direttiva, e tre di essi hanno incontrato criticità legate alle cosiddette "zone grigie" che ne derivano. Queste zone comprendono prodotti come fasce decorative per capelli, borse, libri, matite o gomme da cancellare o abiti da travestimento destinati a bambini.
Un altro importante problema segnalato riguardava lo svolgimento di una valutazione della sicurezza dei giocattoli e dei materiali di cui erano fatti, nonché della valutazione dei rischi per la salute connessi al loro utilizzo. La valutazione ha posto problemi nei casi in cui mancavano dati validi per le opportune stime dell'esposizione. In particolare, tale criticità è stata avvertita per quanto attiene alla sicurezza chimica e microbiologica, settore in cui si registrano la mancanza o l'incompletezza di norme tecniche o di requisiti armonizzati dettagliati (tre Stati membri). Uno Stato membro che confina con paesi terzi ha segnalato tentativi di importare giocattoli che, pur recando la marcatura CE, non sono conformi alle norme in materia di salute e sicurezza.
È stato altresì riferito che i requisiti per determinate sostanze chimiche sono problematici. Uno Stato membro ha osservato che la direttiva sulla sicurezza dei giocattoli contempla solo una parte delle disposizioni di legge. Vi sono difficoltà specifiche concernenti la valutazione di sostanze altamente volatili come i solventi o di sostanze fortemente odorose (tre Stati membri) e delle CMR (sostanze cancerogene, mutagene o tossiche per la riproduzione), poiché i valori limite generali stabiliti per tali sostanze sono considerati troppo elevati. Cinque Stati membri segnalano problemi in relazione alle prove, e lamentano che, per alcune sostanze chimiche pericolose, non esistono metodi di prova armonizzati. Uno Stato membro ha precisato che, a causa della carenza di risorse tecniche e umane, non tutti i laboratori di prova utilizzano gli stessi criteri o metodi di prova; si registrano pertanto casi in cui la decisione sull'eventuale conformità di un giocattolo dipende dal laboratorio in cui è stata svolta la prova.
Due Stati membri hanno rilevato problemi connessi ai requisiti in materia di rintracciabilità, segnalando casi in cui la rintracciabilità non si poteva stabilire poiché era impossibile identificare i giocattoli tramite i documenti di origine (fatture); uno Stato membro ha riportato un rilevante numero di casi in cui erano stati presentati documenti falsi. Due Stati membri hanno inoltre manifestato preoccupazioni per lo sviluppo del commercio elettronico e della vendita online di giocattoli; nella relazione del 2015 soltanto uno Stato membro aveva espresso preoccupazioni di tal genere. Gli Stati membri hanno rilevato anche un sensibile aumento delle vendite online di giocattoli, circostanza che pone nuove sfide all'applicazione della direttiva sulla sicurezza dei giocattoli.
Due Stati membri hanno segnalato difficoltà inerenti all'indicazione della data di immissione sul mercato di un giocattolo, poiché ciò determina il momento in cui la direttiva sulla sicurezza dei giocattoli inizia ad applicarsi. Un altro Stato membro ha menzionato problemi connessi al flusso di informazioni nel sistema comunitario d'informazione rapida "RAPEX Safety gate" dell'Unione europea: cooperazione insufficiente tra gli Stati membri nei casi di non conformità e assenza di feedback sui risultati delle procedure di controllo. Altri tuttavia hanno espresso una valutazione molto positiva sul sistema comunitario d'informazione rapida.
[...] Segue in allegato
Fonte: CE
Collegati
[box-note]Dichiarazione CE di Conformità | Direttiva 2009/48/CE Giocattoli
Giocattoli | Direttiva 2009/48/CE e NTA
Norme armonizzate Direttiva 2009/48/CE Giocattoli[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Sintesi CE e Stati membri sull'applicazione della Direttiva giocattoli.pdf CE, 15.07.2021 |
611 kB | 2 |
FEM Position Paper on the Proposal for a Machinery Regulation
FEM Position Paper on the Proposal for a Machinery Regulation
FEM, 07.07.2021
The Machinery Directive is arguably the single most important piece of legislation for our manufacturers. Since its adoption, it has been an effective and successful internal market legislation. Not only has it provided the highest level of machinery safety in the world, but it has also enabled the material handling industry to continue innovating, thriving and taking the lead in many segments.
In this context, our industry’s very first priority is to ensure that the future Regulation maintains such a balance between safety and innovation whilst offering the necessary predictability for manufacturers and users alike.
Whilst FEM welcomes the increased uniformity resulting from the conversion into a Regulation and the flexibility offered by digital documentation, some other aspects of the Commission’s proposal are extremely worrying.
FEM fundamentally disagrees with the mandatory third party certification for high-risk machinery – an obligation that is unjustified and disproportionate in the absence of any identified safety need nor gains of third-party certification compared to self-assessment.
As the Machinery proposal was released together with the AI package, we call for the highest level of coordination in order to avoid contradicting or overlapping requirements between the two pieces of legislation that are connected.
Moreover, the Commission empowerment to adopt technical specifications via implementing acts is undermining the standardisation process, which ought to remain industry-driven.
Finally, some of the new essential health and safety requirements related to emerging technologies would be better addressed through dedicated horizontal legislation (cybersecurity) or standards, in particular to ensure technology neutrality.
...
Fonte: FEM
Collegati
[box-note]Proposal for a Regulation on machinery products
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Direttiva macchine 2006/42/CE
Direttiva macchine 2021: la proposta di revisione[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| FEM Position Paper on the Proposal for a Machinery Regulation.pdf 07.07.2021 |
243 kB | 9 |
Decreto 19 aprile 2001
Decreto 19 aprile 2001
Progettazione, costruzione e verifiche di approvazione e revisione delle bombole in acciaio senza saldatura di capacita' compresa tra 0,5 e 5 litri.
(GU n.109 del 12.05.2001)
1. Alle bombole in acciaio ed in alluminio senza saldatura di capacità uguale o superiore a 0,5 litri e inferiore a 3 litri, costruite successivamente all'entrata in vigore del presente decreto, si applicano le prescrizioni previste dalla legislazione nazionale vigente per le bombole di maggior capacità, relative alla progettazione, ai materiali, alla fabbricazione, alle punzonature e iscrizioni, alla codificazione del colore, nonché alle verifiche e certificazioni di approvazione.
2. Qualora per le dimensioni della bombola sia difficoltoso mantenere la disposizione delle punzonature previste dagli allegati al decreto ministeriale 15 ottobre 1999, le punzonature sull'ogiva possono essere limitate a identificazione del fabbricante, numero di serie di fabbricazione, data di collaudo, punzone dell'ispettore, e pressione di prova. Le rimanenti punzonature obbligatorie possono essere applicate in altra posizione o su una etichetta/piastrina o qualsiasi altra parte fissata in modo permanente alla bombola. La loro disposizione deve comunque essere tale da non creare confusione di interpretazione.
...
Collegati
[box-note]Decreto 15 ottobre 1999
Direttiva 2010/35/UE[/box-note]
RAPEX Report 25 del 25/06/2021 N. 14 A12/00930/21 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 25 del 25/06/2021 N. 14 A12/00930/21 Ungheria
Approfondimento tecnico: Lampada
Il prodotto, di marca STRÜHM, mod. EMO E14, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60598-1:2015 “Apparecchi di illuminazione Parte 1: Prescrizioni generali e prove”.
La lampada, attraente per i bambini, non è dotata di trasformatore e le parti in tensione e le superfici calde possono essere toccate direttamente. Inoltre, ha una bassa resistenza meccanica e rompendosi può causare dei tagli all’utilizzatore.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 25 del 25_06_2021 N. 14 A12_00930_21 Ungheria.pdf Lampada |
356 kB | 0 |
Regolamento di esecuzione (UE) 2021/1121
Regolamento di esecuzione (UE) 2021/1121
Regolamento di esecuzione (UE) 2021/1121 della Commissione dell'8 luglio 2021 che specifica i dati statistici che devono essere trasmessi dagli Stati membri per quanto riguarda i controlli sui prodotti che entrano nel mercato dell’Unione, in materia di sicurezza e conformità dei prodotti
GU L 243/37 del 9.7.2021
Entrata in vigore: 12.07.2021
Applicazione: dal 16.07.2021
...
Articolo 1
1. I dati statistici che devono essere trasmessi a norma dell’articolo 25, paragrafo 6, del regolamento (UE) 2019/1020 comprendono i seguenti dettagli relativi agli interventi nell’ambito dei controlli sui prodotti soggetti alla normativa dell’Unione, in materia di sicurezza e conformità dei prodotti:
a) il numero totale di interventi;
b) il numero totale di interventi che hanno comportato una sospensione dell’immissione in libera pratica a norma dell’articolo 26, paragrafo 1, del regolamento (UE) 2019/1020;
c) per ciascun intervento a seguito del quale le autorità competenti hanno imposto agli operatori economici interessati di portare a termine azioni specifiche oppure un’autorità di vigilanza del mercato ha imposto di non immettere un prodotto in libera pratica a norma dell’articolo 28, paragrafi 1 e 2, del regolamento (UE) 2019/1020:
i) la data in cui le autorità doganali hanno accettato la dichiarazione doganale;
ii) un indicatore del tipo di dichiarazione doganale in caso di dichiarazione doganale con una serie di dati ridotta a norma degli articoli 143 bis e 144 del regolamento delegato (UE) 2015/2446 della Commissione;
iii) il paese di origine (dato 16 08 000 000) o, se non disponibile, il paese dell’esportatore (sottodato 13 01 018 020);
iv) il codice della sottovoce del sistema armonizzato (sottodato 18 09 056 000);
v) se disponibile, il codice della nomenclatura combinata (sottodato 18 09 057 000);
vi) le unità supplementari (dato 18 02 000 000) o, se non disponibili, la massa netta (dato 18 01 000 000);
vii) il modo di trasporto fino alla frontiera (dato 19 03 000 000);
viii) la principale categoria di prodotti interessata;
ix) la principale normativa dell’Unione violata secondo quanto stabilito dalle autorità di vigilanza del mercato;
x) un indicatore che illustri la possibilità o meno del prodotto di essere immesso in libera pratica se gli operatori economici interessati portano a termine azioni specifiche imposte dalle autorità competenti.
2. I dati di cui al paragrafo 1 comprendono i dati relativi a tutti i controlli, ad eccezione dei controlli effettuati esclusivamente mediante tecniche elettroniche di elaborazione dati.
3. Ai fini del paragrafo 1, qualora una dichiarazione doganale riguardi prodotti che rientrano in due o più articoli di tale dichiarazione doganale, gli interventi su ciascuno degli articoli sono considerati interventi distinti.
4. Ai fini del paragrafo 1, lettera c), punti da iii) a vii), del presente articolo, i dati che devono essere trasmessi sono le informazioni disponibili nella dichiarazione doganale relative al dato corrispondente di cui all’allegato B del regolamento delegato (UE) 2015/2446. Tuttavia, qualora gli Stati membri, a norma degli articoli 2, 143 bis e 144 del regolamento delegato (UE) 2015/2446 o di altre disposizioni transitorie di cui al medesimo regolamento, applicano alla dichiarazione doganale requisiti diversi in materia di dati, i dati da presentare sono le informazioni equivalenti disponibili nella dichiarazione doganale soggetta a tali requisiti in materia di dati.
Articolo 2
Il presente regolamento entra in vigore il terzo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 16 luglio 2021.
...
Collegati
[box-note]Regolamento (UE) 2019/1020[/box-note]
Medical Devices - EUDAMED
Medical Devices - EUDAMED
ID 13951 | 09.07.2021 / Documentazione allegata
EUDAMED is the IT system developed by the European Commission to implement Regulation (EU) 2017/745 on medical devices and Regulation (EU) 2017/746 on in vitro diagnosis medical devices.
The new Regulations contain important improvements including a much larger EUDAMED database than the one that currently exists under the Medical Devices Directives (Eudamed2).
EUDAMED will improve transparency and coordination of information regarding medical devices available on the EU market.
The system will be multipurpose. It will function as a registration system, a collaborative system, a notification system and a dissemination system (open to the public) and will be interoperable.
EUDAMED is structured around 6 interconnected modules and a public website:
[alert] Actors registration
[box-note]On 1 December 2020 the European Commission has made available the Actor registration module.
It is the first of six EUDAMED modules.
- EUDAMED restricted
- EUDAMED public
The Commission is not in a position to require the use of the Actor registration module until EUDAMED is fully functional according to the Medical Device Regulation and additional national requirements on registrations can therefore not be excluded.[/box-note]
UDI/Devices registration
Notified Bodies and Certificates
Clinical Investigations and performance studies
Vigilance and post-market surveillance
Market Surveillance[/alert]
What is the state of play of the implementation of EUDAMED?
The development and implementation of EUDAMED is a high priority for the Commission
The module on Actor registration is available since December 2020
The module on UDI/device registration (second module) and the module on Certificates and Notified Bodies (third module) will become available in September 2021 except for the mechanism for scrutiny and the clinical evaluation consultation procedure (CECP) functionalities. Afterwards, the remaining modules as well as the mechanism for scrutiny and the CECP will be released when EUDAMED is fully functional.
Functional specifications
The Eudamed functional specifications have been public since February 2019. These functional specifications might be subject to possible changes as some issues are still under discussion.
MDR/IVDR UDI and device
Overview of the MDR UDI and device data sets and IVDR UDI and device data set to provide for their registration in EUDAMED.
EUDAMED UDI device data dictionary. This document clarifies the data that you should provide to EUDAMED for the UDI device registration module.
Management of Legacy devices in EUDAMED - Updated version (1.2) - February 2021
Data exchange
Data exchange guidelines
Machine-to-machine (M2M) data exchange documentation for economic operators
- M2M data exchange services and entity models introduction
- M2M data exchange services definition
- Service entity model XSD
- Service entity model UML diagrams
- xml samples
...
Fonte: EC
Collegati
[box-note]MDR Eudamed Functional Specifications
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
Linee guida Regolamento Medical Devices (UE) 2017/745
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| xml samples.zip |
56 kB | 8 | ||
| Service entity model UML diagrams.zip |
931 kB | 8 | ||
| Service entity model XSD.zip |
76 kB | 6 | ||
| M2M data exchange services definition.pdf |
591 kB | 8 | ||
| M2M data exchange services and entity models introduction.pdf |
1446 kB | 12 | ||
| Data exchange guidelines.pdf |
124 kB | 4 | ||
| Management of Legacy devices in EUDAMED.pdf |
1137 kB | 6 | ||
| UDI device data dictionary.xlsx |
147 kB | 6 | ||
| IVDR UDI and device data sets.pdf |
220 kB | 4 | ||
| MDR UDI and device data sets.pdf |
259 kB | 10 | ||
| Eudamed functional specifications.pdf |
2494 kB | 9 |
Rettifica regolamento (UE) 2017/745 | 08.07.2021
Rettifica regolamento (UE) 2017/745 | 08.07.2021
Rettifica del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio
GU L 241/7 del 8.7.2021
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Linee guida Regolamento Medical Devices (UE) 2017/745[/box-note]
Regolamento (UE) 2021/1068
Regolamento (UE) 2021/1068
Regolamento (UE) 2021/1068 del Parlamento europeo e del Consiglio del 24 giugno 2021 che modifica il regolamento (UE) 2016/1628 per quanto riguarda le disposizioni transitorie per alcune macchine munite di motori nell’intervallo di potenza pari o superiore a 56 kW e inferiore a 130 kW e pari o superiore a 300 kW, al fine di far fronte agli effetti della crisi COVID-19
GU L 230/1 del 30.6.2021
...
Articolo 1
L’articolo 58 del regolamento (UE) 2016/1628 è così modificato:
1) al paragrafo 5 è aggiunto il comma seguente:
«Per i motori di tutte le sottocategorie per i quali la data di cui all’allegato III per l’immissione sul mercato dei motori della fase V è il 1° gennaio 2020, a eccezione dei motori di cui al secondo comma e al terzo comma, il periodo di transizione è prorogato di nove mesi e il periodo di 18 mesi di cui al primo comma è prorogato di sei mesi.»;
2) al paragrafo 7 è aggiunta la lettera seguente:
«e) 33 mesi a decorrere dalla data applicabile all’immissione sul mercato dei motori di cui all’allegato III, nel caso di cui al paragrafo 5, sesto comma.
...
Collegati
[box-note]Regolamento (UE) 2016/1628 NRMM[/box-note]
Rapporto attività di vigilanza sui dispositivi medici Ed. 2020/1
Rapporto attività di vigilanza sui dispositivi medici Ed. Dicembre 2020
Il rapporto contiene un'analisi dei dati relativi all'anno 2019 sugli incidenti con dispositivi medici, raccolti nella banca dati del sistema di vigilanza del Ministero
La vigilanza sui dispositivi medici, svolta dal Ministero della Salute, costituisce un’attività di fondamentale importanza al fine di garantire la circolazione sul territorio nazionale di prodotti sicuri ed efficaci per i pazienti, gli utilizzatori e gli operatori sanitari. Il sistema di vigilanza si esplica attraverso un costante monitoraggio degli incidenti che avvengono con i dispositivi medici successivamente alla loro immissione in commercio, grazie anche alla collaborazione con tutti gli stakeholders coinvolti nel sistema. In particolare, il Ministero monitora le attività dei fabbricanti/distributori di dispositivi medici e degli operatori sanitari raccogliendo e analizzando tutti i dati che confluiscono nel sistema di vigilanza. Inoltre il Ministero effettua una valutazione puntuale degli incidenti segnalati e se del caso, divulga le informazioni al fine di ridurre la possibilità che lo stesso tipo di incidente si ripeta.
Il report 2019 si amplia rispetto alla versione 2018 con lo scopo di consentire al lettore, sia esso un utente/paziente del SSN, un fabbricante o un operatore sanitario di acquisire elementi informativi rilevanti per le proprie conoscenze e attività professionali.
Il documento è strutturato in due sezioni: la prima riguarda la descrizione dei dati sugli incidenti verificatisi nell’anno 2019, e pone particolare attenzione alle categorie di dispositivi medici con maggiore frequenza di incidente; la seconda fornisce un quadro su alcune tematiche di particolare interesse emerse nell’anno 2019, che sono state oggetto di approfondimento da parte del Ministero.
Sono stati inoltre introdotte interessanti sezioni relative ai dispositivi del settore ortopedico, e al settore dei dispositivi da somministrazione, prelievo e raccolta.
Un capitolo è dedicato al tema delle falsificazioni e, in vista dell’applicazione del nuovo Regolamento Europeo 745/2017 si è dedicata una sezione a tutte le iniziative in corso in materia di vigilanza da parte dei gruppi dedicati della Commissione Europea.
Inoltre nel presente Rapporto è inserita una sezione dedicata alla analisi dei dati relativi agli incidenti con i dispositivi medici diagnostici in vitro. In allegato, oltre alla normativa di riferimento, è stato inserito un glossario al fine di aiutare nella lettura delle numerose sigle presenti nel documento.
L’obiettivo del documento è quello di condividere, con tutti gli attori coinvolti nel settore, i risultati delle analisi derivanti dall’attività di vigilanza, in maniera trasparente e con finalità informativa.
L’informazione trasparente e condivisa è infatti considerata tra le priorità del Ministero della Salute, in quanto punto di partenza per una vigilanza attiva ed a tutela della salute pubblica.
___
Sommario
1 Introduzione
2 Il Sistema di Vigilanza del Ministero della Salute
3 Segnalazioni di incidente
Analisi delle segnalazioni di incidente per Classi di Rischio
Analisi delle segnalazioni di incidente per categoria CND
Analisi delle segnalazioni di incidente per categoria di CND e per classificazione dell’incidente
Analisi delle segnalazioni di incidente che hanno portato al decesso per categoria di CND
Analisi delle segnalazioni di incidente che hanno portato ad un inaspettato peggioramento dello stato
di salute e/o serio pericolo per la salute pubblica per Categoria di CND
Trend delle segnalazioni di incidenti nel triennio 2016-2019
Segnalazioni degli incidenti per Regione e Provincia Autonoma
Analisi dei rapporti operatore e fabbricante pervenuti per Regione e Provincia Autonoma
Rapporti di Sintesi Periodica (Periodic Summary Report)
4 Avvisi di sicurezza
5 I dispositivi medico diagnostici in vitro (IVD)
Analisi delle segnalazioni di incidente per gli IVD
5.1.1 Analisi delle segnalazioni di incidente per Gruppi della Categoria CND W
5.1.2 Analisi delle segnalazioni di incidente per classe di rischio
5.1.3 Analisi del numero di Avvisi di Sicurezza diffusi sul territorio nazionale per tipologia
6 Approfondimenti
Le Protesi mammarie
Le Apparecchiature sanitarie e relativi componenti e accessori
I dispositivi medici del settore cardiocircolatorio
I dispositivi medici del settore cardiovascolare
I dispositivi da somministrazione, prelievo e raccolta
I dispositivi medici del settore ortopedico
La rete della dispositivo-vigilanza
Nuove attività della Vigilanza sui dispositivi medici: lotta alle falsificazioni
L’Italia nel sistema di vigilanza europeo
Allegato 1 - Glossario
Allegato 2 - Riferimenti Normativi
Allegato 3 - Elenco delle Tabelle
Allegato 4 - Elenco delle Figure
...
Fonte: Ministero della Salute
Collegati
[box-note]Rapporto attività di vigilanza sui dispositivi medici Ed. 2020
Linee guida Regolamento Medical Devices (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dispositivi medici - rapporto sulle attività di vigilanza 2019.pdf |
3330 kB | 34 |