Regolamento delegato (UE) 2022/2387
Regolamento delegato (UE) 2022/2387
ID 18311 | 08.12.2022
Regolamento delegato (UE) 2022/2387 della Commissione del 30 agosto 2022 che modifica il regolamento delegato (UE) 2017/655 per quanto riguarda l’adeguamento delle disposizioni sul monitoraggio delle emissioni di inquinanti gassosi da motori a combustione interna in servizio installati su macchine mobili non stradali per includervi i motori di potenza inferiore a 56 kW e superiore a 560 kW.
(GU L 316/1 dell'8.12.2022)
Entrata in vigore: 28.12.2022
________
Articolo 1 Modifiche del regolamento delegato (UE) 2017/655
Il regolamento delegato (UE) 2017/655 è così modificato:
1) all’articolo 2, il paragrafo 1 è sostituito dal seguente:
«1. Il presente regolamento si applica al monitoraggio delle emissioni di inquinanti gassosi dalle seguenti categorie di motori in servizio della fase V per le emissioni, installati su macchine mobili non stradali, indipendentemente da quando è stata rilasciata l’omologazione UE di tali motori:
a) NRE e NRG (tutte le sottocategorie);
b) NRS-vi-1b, NRS-vr-1b, NRS-v-2a, NRS-v-2b e NRS-v-3;
c) IWP e IWA (tutte le sottocategorie);
d) RLL e RLR (tutte le sottocategorie);
e) ATS;
f) SMB;
g) NRSh (tutte le sottocategorie);
h) NRS-vi-1a e NRS-vr-1a.»;
2) l’articolo 3 è sostituito dal seguente:
«Articolo 3 Procedure e requisiti per il monitoraggio delle emissioni dei motori in servizio
Le emissioni di inquinanti gassosi da motori in servizio di cui all’articolo 19, paragrafo 1, del regolamento (UE) 2016/1628 sono monitorate come segue:
a) per i motori di cui all’articolo 2, paragrafo 1, lettere da a) a f), il monitoraggio deve essere eseguito conformemente all’allegato del presente regolamento;
b) per i motori di cui all’articolo 2, paragrafo 1, lettere g) e h):
i) non si applica l’allegato del presente regolamento;
ii) la procedura di invecchiamento adoperata per stabilire il fattore di deterioramento (FD) per il tipo di motore o, se del caso, per la famiglia di motori, come da allegato III, punto 4.3, del regolamento delegato (UE) 2017/654 della Commissione, con inclusione di qualsiasi elemento automatizzato, è tale da consentire al costruttore di prevedere adeguatamente il deterioramento delle emissioni durante l’uso nel periodo di durabilità delle emissioni (EDP) di tali motori in caso di uso normale.
iii) in collaborazione con i costruttori, la Commissione svolge ogni 5 anni un programma pilota riguardante i tipi di motore più recenti al fine di garantire che la procedura per determinare i FD di cui all’allegato III, punto 4, del regolamento delegato (UE) 2017/654 rimanga idonea ed efficace ai fini del controllo delle emissioni di inquinanti nel corso della vita utile dei motori.
3) all’articolo 3 bis è aggiunto il seguente paragrafo 3:
«3. Non è necessario rivedere o estendere le omologazioni UE dei tipi di motore o delle famiglie di motori omologate in conformità al presente regolamento prima del 26 dicembre 2022 a seguito delle prove effettuate in conformità alle prescrizioni dell’allegato.»;
4) l’allegato del regolamento delegato (UE) 2017/655 è modificato conformemente all’allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
[...]
Collegati
[box-note]Regolamento (UE) 2016/1628 NRMM[/box-note]
Linee guida per applicazione del DM 1 dicembre 2004 n 329
Modalità operative per l’applicazione del decreto 1 dicembre 2004 n. 329
ID 18309 | 08.12.2022 / In allegato
Regolamento recante norme per la messa in servizio ed utilizzazione delle attrezzature a pressione e degli insiemi di cui all’articolo 19 del decreto legislativo 25 febbraio 2000 n. 93.
Nel testo del D.M. vengono ripetutamente indicati con la dizione “soggetti verificatori” o “soggetti preposti”, i soggetti cui compete l’effettuazione delle verifiche, sia di primo impianto ovvero di messa in servizio, sia di controllo periodico. Sebbene non siano espressamente individuati tali “soggetti”, è fatto esplicito riferimento, nelle premesse al testo, al D.L. 30 giugno 1982, n. 390, convertito con modificazioni, nella Legge 12 agosto 1982, n. 597 “Disciplina delle funzioni prevenzionali ed omologative delle Unità sanitarie locali e dell’Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro”, che attribuisce all’ISPESL ed alle USL (oggi ASL), le funzioni di verifica che il D.M. prevede.
In assenza pertanto di diverse valutazioni o interpretazioni, ovvero di altri successivi decreti esplicativi delle funzioni di cui sopra, si ritiene che le verifiche di controllo periodico debbano essere effettuate dai Servizi Sicurezza Impiantistica delle ASL/ARPA in coerenza col principio di delega delle funzioni attribuite con le suddette disposizioni e per garanzia di continuità dell’attività prevenzionistica sinora svolta. Parimenti si reputa che laddove si cita il “soggetto verificatore” deputato alla verifica di primo impianto o alla verifica di messa in servizio, la competenza sia da attribuire all’ISPESL territorialmente competente, come peraltro determinato dallo stesso Istituto con nota Prot. n. 370/05, a firma del Direttore del Dipartimento omologazione e certificazione di Roma, datata 7 Febbraio 2005.
Collegati
[box-note]Decreto-Legge 30 giugno 1982 n. 390
Decreto Legislativo n. 93 del 25 Febbraio 2000
Decreto 1 dicembre 2004 n. 329
INAIL: Moduli e modelli relativi certificazione e verifica
Recipienti a pressione - Istruzioni prima verifica periodica d.m. 11 aprile 2011[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Linee guida per applicazione del DM 1 dicembre 2004 n 329.pdf |
646 kB | 31 |
Decreto ministeriale 21 novembre 2022
DM 21 novembre 2022 / Giocattoli: Valori limite anilina
ID 18306 | 30.12.2022 / In allegato DM pubblicato in GU
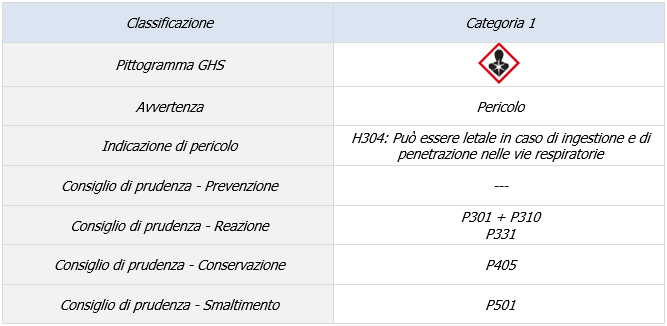
Recepimento direttiva n. 2021/903/UE (valori limite specifici per l’anilina in determinati giocattoli)
Il decreto 21 novembre 2022 recepisce la direttiva 2021/903/UE, che modifica l’elenco delle sostanze chimiche contenute nell’Allegato II della direttiva 2009/48/CE sulla sicurezza dei giocattoli, adeguando le disposizioni alla normativa dell’Unione europea in materia dei valori limite specifici per l’anilina in determinati giocattoli.
In particolare, il decreto introduce, alla luce della classificazione quale sostanza CMR, l’anilina fra le sostanze chimiche contenute nell’appendice C dell’Allegato II della direttiva 2009/48/CE.
(GU n. 304 del 30.12.2022)
Entrata in vigore: 05.12.2022
_______
Decreto Ministero delle Imprese e del Made in Italy 21 novembre 2022
VISTA la direttiva 2009/48/CE del Parlamento Europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli;
VISTO il decreto legislativo 11 aprile 2011, n. 54 e successive modificazioni, recante “Attuazione della direttiva 2009/48/CE sulla sicurezza dei giocattoli.”;
VISTO l’art. 32 del predetto decreto legislativo 11 aprile 2011, n. 54 che dispone: “All'aggiornamento e alla modifica delle disposizioni degli allegati al presente decreto legislativo derivanti da aggiornamenti e modifiche della direttiva 2009/48/CE si provvede con decreto del Ministro dello sviluppo economico ai sensi dell'articolo 11, comma 5, della legge 4 febbraio 2005, n. 11;
VISTO l’art. 35, comma 3, della legge 24 dicembre 2012, n. 234;
VISTA la direttiva n. 2021/903/UE della Commissione del 3 giugno 2021 che modifica la direttiva 2009/48/CE del Parlamento europeo e del Consiglio per quanto riguarda i valori limite specifici per l’anilina in determinati giocattoli;
TENUTO CONTO della classificazione dell’anilina quale sostanza CMR, delle conclusioni della relazione di valutazione dei rischi dell’Unione europea, dei pareri del RAC e del CSRSA e dei pareri del gruppo di esperti sulla sicurezza dei giocattoli e del relativo sottogruppo «prodotti chimici», nonché degli studi sulla presenza di anilina nei tessili;
RITENUTO necessario procedere alla modifica dell’allegato II, di cui al decreto legislativo 11 aprile 2011, n. 54, aggiornandone il contenuto in conformità alle disposizioni prescritte dalla direttiva 2021/903/UE;
VISTO l'art. 3, comma 1, lettera c), della legge 14 gennaio 1994, n. 20, recante disposizioni in materia di giurisdizione e controllo della Corte dei conti;
DECRETA
Articolo 1 (Modifiche all’allegato II di cui al decreto legislativo 11 aprile 2011, n. 54)
1. All’allegato II, appendice C, del decreto legislativo 11 aprile 2011, nr. 54, nella tabella è aggiunta la voce seguente:
|
Sostanza |
Numero CAS |
Valore limite |
|
Anilina |
62-53-3 |
30 mg/kg dopo scissione riduttiva nei materiali tessili per giocattoli e nei materiali di cuoio per giocattoli 10 mg/kg come anilina libera nei colori a dita 30 mg/kg dopo scissione riduttiva nei colori a dita |
Articolo 2 (Entrata in vigore)
1. Le disposizioni di cui al presente decreto si applicano a decorrere dal 5 dicembre 2022.
2. Il presente decreto viene trasmesso agli Organi di controllo.
3. Il presente decreto sarà pubblicato nella Gazzetta Ufficiale della Repubblica Italiana e ne sarà data comunicazione alla Commissione Europea
...
Fonte: Ministero delle Imprese e del Made in Italy
Collegati
[box-note]Direttiva 2009/48/CE giocattoli
Giocattoli | Direttiva 2009/48/CE e NTA
Norme armonizzate Direttiva 2009/48/CE Giocattoli[/box-note]
Direttiva (UE) 2022/2380
Direttiva (UE) 2022/2380 / Modifica Direttiva RED 2014/53/UE
ID 18303 | 07.12.2022
Direttiva (UE) 2022/2380 del Parlamento europeo e del Consiglio del 23 novembre 2022 che modifica la direttiva 2014/53/UE, concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di apparecchiature radio
GU L 315/30 del 7.12.2022
Entrata in vigore: 27.12.2022
Recepimento: entro il 28 dicembre 2023
Applicazione: a decorrere dal 28 dicembre 2024 per le categorie o classi di apparecchiature radio di cui all’allegato I bis, parte I, punti da 1.1. a 1.12., e dal 28 aprile 2026 per le categorie o classi di apparecchiature radio di cui all’allegato I bis, parte I, punto 1.13.
______
[panel]Il Parlamento Europeo e il Consiglio dell'Unione Europea,
visto il trattato sul funzionamento dell’Unione europea, in particolare l’articolo 114,
vista la proposta della Commissione europea,
previa trasmissione del progetto di atto legislativo ai parlamenti nazionali,
visto il parere del Comitato economico e sociale europeo,
deliberando secondo la procedura legislativa ordinaria,
considerando quanto segue:
(1) Uno degli obiettivi della direttiva 2014/53/UE del Parlamento europeo e del Consiglio è assicurare il corretto funzionamento del mercato interno. A norma dell’articolo 3, paragrafo 3, lettera a), di tale direttiva, uno dei requisiti essenziali che le apparecchiature radio devono soddisfare è che interagiscano con accessori, in particolare con caricabatteria standardizzati. A tal proposito la direttiva 2014/53/UE indica che l’interoperabilità tra le apparecchiature radio e gli accessori quali i caricabatteria semplifica l’uso delle apparecchiature radio e riduce i rifiuti e i costi inutili e che è necessario sviluppare un caricabatteria standardizzato per particolari categorie o classi di apparecchiature radio a vantaggio, in particolare, dei consumatori e di altri utilizzatori finali.
(2) Dal 2009 sono stati compiuti sforzi a livello dell’Unione per limitare la frammentazione delle interfacce di ricarica dei telefoni cellulari e di apparecchiature radio analoghe. Sebbene le recenti iniziative volontarie abbiano aumentato il livello di convergenza dei dispositivi di ricarica, che sono la parte dell’alimentatore esterno dei caricabatteria, e ridotto il numero delle diverse soluzioni di ricarica disponibili sul mercato, tali iniziative non soddisfano pienamente gli obiettivi strategici dell’Unione di garantire la convenienza dei consumatori, ridurre i rifiuti elettronici ed evitare la frammentazione del mercato dei dispositivi di ricarica.
(3) L’Unione è impegnata a promuovere l’uso efficiente delle risorse passando a un’economia pulita e circolare mediante iniziative quali la direttiva 2012/19/UE del Parlamento europeo e del Consiglio e, più di recente, attraverso l’introduzione del Green Deal europeo, illustrato dalla Commissione nella comunicazione dell’11 dicembre 2019. La presente direttiva mira a ridurre i rifiuti elettronici generati dalla vendita di apparecchiature radio e a ridurre l’estrazione di materie prime e le emissioni di CO2 generate dalla produzione, dal trasporto e dallo smaltimento dei caricabatteria, promuovendo in tal modo un’economia circolare.
(4) Il piano d’azione per l’economia circolare della Commissione, illustrato nella comunicazione dell’11 marzo 2020, ha previsto iniziative che interessano l’intero ciclo di vita dei prodotti e riguardano la progettazione, promuovono processi di economia circolare, favoriscono il consumo sostenibile e mirano a garantire che le risorse utilizzate siano mantenute il più a lungo possibile nell’economia dell’Unione.
(5) La Commissione ha completato una valutazione d’impatto, che ha dimostrato che il mercato interno non sta sfruttando appieno il suo potenziale, in quanto la persistente frammentazione del mercato delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica di telefoni cellulari e altre apparecchiature radio analoghe comporta una mancanza di convenienza per i consumatori e un aumento dei rifiuti elettronici.
(6) L’interoperabilità tra le apparecchiature radio e gli accessori, come i caricabatteria, è ostacolata dal fatto che esistono diverse interfacce di ricarica per determinate categorie o classi di apparecchiature radio che sono ricaricate con cavo quali telefoni cellulari, tablet, fotocamere digitali, cuffie o cuffie microfono, console portatili per videogiochi, altoparlanti portatili, lettori elettronici, tastiere, mouse, sistemi di navigazione portatili, auricolari e laptop. Esistono inoltre diversi tipi di protocolli di comunicazione per la ricarica rapida per i quali non sempre è garantito un livello minimo di prestazioni. Di conseguenza è necessaria un’azione dell’Unione per promuovere un livello comune di interoperabilità e la fornitura ai consumatori e agli altri utenti finali di informazioni relative alle caratteristiche di ricarica delle apparecchiature radio. È pertanto necessario introdurre nella direttiva 2014/53/UE requisiti adeguati per quanto riguarda i protocolli di comunicazione per la ricarica e le interfacce di ricarica, ossia la presa di ricarica, di determinate categorie o classi di apparecchiature radio, nonché le informazioni da fornire ai consumatori e agli altri utenti finali in merito alle caratteristiche di ricarica di tali categorie o classi di apparecchiature radio, ad esempio le informazioni sulla potenza minima e massima necessaria per caricare l’apparecchiatura radio. La potenza minima dovrebbe corrispondere alla somma della potenza necessaria all’apparecchiatura radio per mantenere il funzionamento e della potenza minima richiesta dalla relativa batteria per avviare la ricarica. La potenza massima dovrebbe corrispondere alla somma della potenza richiesta dall’apparecchiatura radio per mantenere il funzionamento e della potenza necessaria per raggiungere la massima velocità di ricarica.
(7) L’assenza di armonizzazione delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica può portare a sostanziali differenze tra gli Stati membri per quanto riguarda le disposizioni legislative, regolamentari e amministrative o le prassi relative all’interoperabilità dei telefoni cellulari e di categorie o classi analoghe di apparecchiature radio con i relativi dispositivi di ricarica e relative alla fornitura di apparecchiature radio senza dispositivi di ricarica.
(8) Le dimensioni del mercato interno dei telefoni cellulari e di categorie o classi analoghe di apparecchiature radio ricaricabili, la proliferazione di diversi tipi di dispositivi di ricarica per tali apparecchiature radio, la mancanza di interoperabilità tra le apparecchiature radio e i dispositivi di ricarica e il significativo commercio transfrontaliero di tali prodotti richiedono un’azione legislativa più incisiva a livello dell’Unione piuttosto che misure volontarie o a livello nazionale, al fine di conseguire il buon funzionamento del mercato interno, garantendo nel contempo la convenienza dei consumatori e riducendo i rifiuti ambientali.
(9) È pertanto necessario armonizzare le interfacce di ricarica e i protocolli di comunicazione per la ricarica di categorie o classi specifiche di apparecchiature radio ricaricabili mediante cavo. È inoltre necessario fornire la base per l’adeguamento a qualsiasi progresso scientifico e tecnologico futuro o agli sviluppi di mercato, che saranno costantemente monitorati dalla Commissione. In particolare, l’introduzione dell’armonizzazione delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica dovrebbe essere considerata in futuro anche in relazione alle apparecchiature radio che potrebbero essere caricate con mezzi diversi dal cavo, compresa la ricarica mediante onde radio (ricarica senza fili). Inoltre, l’inclusione di ulteriori categorie o classi di apparecchiature radio ricaricabili mediante cavo dovrebbe essere sistematicamente presa in considerazione nel contesto del futuro adeguamento delle soluzioni di ricarica armonizzate, a condizione che l’integrazione delle soluzioni di ricarica armonizzate per tali categorie o classi aggiuntive di apparecchiature radio sia tecnicamente fattibile. L’armonizzazione dovrebbe perseguire gli obiettivi di garantire la convenienza dei consumatori, ridurre i rifiuti ambientali, ed evitare la frammentazione del mercato tra le diverse interfacce di ricarica e i diversi protocolli di comunicazione per la ricarica, nonché tra le iniziative a livello nazionale che potrebbero creare ostacoli agli scambi nel mercato interno. Il futuro adeguamento dell’armonizzazione delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica dovrebbe continuare a perseguire tali obiettivi garantendo di integrare le soluzioni tecniche più appropriate per le interfacce di ricarica e i protocolli di comunicazione per qualsiasi mezzo di ricarica. Le soluzioni di ricarica armonizzate dovrebbero riflettere la combinazione più appropriata dell’accettazione da parte del mercato con gli obiettivi di garantire la convenienza dei consumatori, ridurre i rifiuti ambientali ed evitare la frammentazione del mercato. Per la scelta di tali soluzioni di ricarica dovrebbero essere utilizzate principalmente norme tecniche pertinenti che soddisfino tali obiettivi e siano state elaborate a livello europeo o internazionale. In casi eccezionali in cui sia necessario introdurre, aggiungere o modificare una specifica tecnica esistente in assenza di norme europee o internazionali accessibili al pubblico che soddisfino tali obiettivi, la Commissione dovrebbe poter stabilire altre specifiche tecniche, a condizione che tali specifiche tecniche siano state elaborate in linea con i criteri di apertura, consenso e trasparenza e che soddisfino i requisiti di neutralità e stabilità di cui all’allegato II del regolamento (UE) n. 1025/2012 del Parlamento europeo e del Consiglio. Occorre che tutti i pertinenti portatori di interessi settoriali rappresentati nel gruppo di esperti della Commissione sulle apparecchiature radio siano coinvolti nel processo durante l’adeguamento delle soluzioni di ricarica armonizzate.
Tale armonizzazione sarebbe tuttavia incompleta senza requisiti relativi alla vendita combinata di apparecchiature radio e dei relativi caricabatteria e alle informazioni da fornire ai consumatori e agli altri utenti finali. Una frammentazione delle impostazioni tra gli Stati membri per quanto riguarda la commercializzazione delle categorie o delle classi di apparecchiature radio interessate e dei relativi dispositivi di ricarica ostacolerebbe il commercio transfrontaliero di tali prodotti, ad esempio obbligando gli operatori economici a riconfezionare i loro prodotti a seconda dello Stato membro in cui devono essere forniti. Ciò comporterebbe a sua volta maggiori disagi per i consumatori e genererebbe rifiuti elettronici inutili, annullando così i benefici derivanti dall’armonizzazione delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica. È pertanto necessario imporre requisiti affinché i consumatori e gli altri utenti finali non siano obbligati ad acquistare un nuovo dispositivo di ricarica ogni volta che acquistano un nuovo telefono cellulare o un’apparecchiatura radio analoga. La vendita separata (unbundling) dei dispositivi di ricarica dalla vendita delle apparecchiature radio offrirebbe ai consumatori e agli altri utenti finali scelte sostenibili, disponibili, attraenti e convenienti. Sulla base dell’esperienza acquisita nell’applicazione dei requisiti, delle tendenze del mercato emergenti e degli sviluppi tecnologici, la Commissione dovrebbe valutare la possibilità di estendere ai cavi il requisito relativo alla fornitura di dispositivi di ricarica insieme alle apparecchiature radio e/o di introdurre la vendita separata obbligatoria al fine di garantire che gli obiettivi di assicurare la convenienza per i consumatori e di ridurre i rifiuti ambientali siano perseguiti nel modo più efficace possibile. Per garantire l’efficacia di tali requisiti, i consumatori e gli altri utenti finali dovrebbero ricevere le informazioni necessarie riguardanti le caratteristiche di ricarica al momento dell’acquisto di un telefono cellulare o di un’apparecchiatura radio analoga. Un pittogramma dedicato consentirebbe ai consumatori e agli altri utenti finali di determinare prima dell’acquisto se l’apparecchiatura radio includa o meno un dispositivo di ricarica. Il pittogramma dovrebbe figurare in tutte le forme di fornitura, compresa la vendita a distanza.
(11) È tecnicamente fattibile indicare la tecnologia USB tipo C quale presa di ricarica standardizzata per le pertinenti categorie o classi di apparecchiature radio, in particolare perché sono già in grado di integrare tale presa. La tecnologia USB tipo C, utilizzata a livello mondiale, è stata adottata a livello di normazione internazionale e recepita nel sistema europeo dal Comitato europeo di normazione elettrotecnica (Cenelec) nell’ambito della norma europea EN IEC 62680-1-3:2021 «Interfacce del Bus Seriale Universale (Universal Serial Bus) per dati e alimentazione - parte 1-3: Componenti comuni - Specifica del cavo e del connettore USB tipo C®».
(12) La tecnologia USB tipo C è già comune a molte categorie o classi di apparecchiature radio in quanto consente ricarica e trasferimento dati di elevata qualità. La presa di ricarica USB tipo C, se combinata con il protocollo di comunicazione per la ricarica USB Power Delivery, è in grado di fornire fino a 100 watt di potenza e lascia quindi un ampio margine per l’ulteriore sviluppo di soluzioni di ricarica rapida, consentendo nel contempo al mercato di soddisfare le esigenze dei telefoni di fascia bassa che non necessitano di ricarica rapida. I telefoni cellulari e le apparecchiature radio analoghe che supportano una ricarica rapida possono integrare le caratteristiche USB Power Delivery descritte nella norma europea EN IEC 62680-1-2:2021 «Interfacce per bus universali seriali per dati e alimentazione elettrica - parte 1-2: Componenti comuni - Specifiche di alimentazione tramite USB». Le specifiche USB sono oggetto di continuo sviluppo. A tale riguardo, l’USB Implementers Forum ha sviluppato una versione aggiornata della specifica di alimentazione tramite USB, che consente di supportare fino a 240 watt di potenza. Sono stati inoltre apportati adeguamenti alla specifica USB tipo C, che estenderanno i requisiti per i connettori e i cavi per supportare fino a 240 W di potenza. Ciò consentirà di prendere in considerazione l’eventuale inclusione delle apparecchiature radio che richiedono tali livelli di potenza nell’elenco delle apparecchiature radio disciplinate dalla presente direttiva.
(13) Per quanto riguarda la ricarica con mezzi diversi dal cavo, è possibile che in futuro siano sviluppate soluzioni divergenti, che potrebbero avere ripercussioni negative sull’interoperabilità, sulla convenienza dei consumatori e sull’ambiente. Sebbene sia prematuro in questa fase imporre requisiti specifici a tali soluzioni, la Commissione dovrebbe intervenire per promuoverle e armonizzarle al fine di evitare la futura frammentazione del mercato interno.
(14) La direttiva 2014/53/UE dovrebbe essere modificata al fine di includere disposizioni sulle interfacce di ricarica e sui protocolli di comunicazione per la ricarica. Le categorie o le classi di apparecchiature radio specificamente contemplate da tali nuove disposizioni dovrebbero essere ulteriormente specificate in un nuovo allegato di tale direttiva. Nell’ambito di tali categorie o classi di apparecchiature radio sono interessate solo le apparecchiature radio che dispongono di una batteria ricaricabile amovibile o incorporata. Per quanto riguarda le fotocamere digitali, le apparecchiature radio interessate sono tutte le fotocamere e le videocamere digitali, comprese quelle d’azione. Per le fotocamere digitali progettate esclusivamente per il settore audiovisivo o per il settore della sicurezza e sorveglianza non dovrebbe sussistere l’obbligo di integrare la soluzione di ricarica armonizzata. Per quanto riguarda gli auricolari, l’apparecchiatura radio interessata è considerata insieme al vano o alla custodia di ricarica appositi, dato che gli auricolari sono raramente o non sono mai dissociati dal vano o dalla custodia di ricarica a causa delle loro dimensioni e della loro forma specifiche. Il vano o la custodia di ricarica per questo tipo specifico di apparecchiatura radio non sono considerati parte del dispositivo di ricarica. Per quanto riguarda i laptop, l’apparecchiatura radio interessata è qualsiasi computer portatile, tra cui laptop, notebook, pc ultraportatili, dispositivi ibridi o convertibili e netbook.
(15) La direttiva 2014/53/UE dovrebbe inoltre essere modificata al fine di introdurre i requisiti relativi alla fornitura di determinate categorie o classi di apparecchiature radio senza dispositivi di ricarica. Le categorie o le classi di apparecchiature radio interessate e le specifiche relative alle soluzioni di ricarica dovrebbero essere specificate in un nuovo allegato di tale direttiva.
(16) La direttiva 2014/53/UE prevede che le informazioni siano incluse nelle istruzioni che accompagnano le apparecchiature radio e, pertanto, nel pertinente articolo di tale direttiva dovrebbero essere inseriti requisiti di informazione supplementari. I contenuti dei nuovi requisiti dovrebbero essere specificati in un nuovo allegato di tale direttiva. Determinate informazioni dovrebbero essere fornite in forma visiva per tutte le forme di fornitura, compresa la vendita a distanza. Un’etichetta apposita indicante le specifiche relative alle capacità di ricarica e ai caricabatteria compatibili consentirebbe ai consumatori e agli altri utenti finali di scegliere il dispositivo di ricarica più appropriato necessario per ricaricare le loro apparecchiature radio. Al fine di fornire una fonte di riferimento utile durante l’intero ciclo di vita dell’apparecchiatura radio, le informazioni sulle specifiche relative alle capacità di ricarica e sui dispositivi di ricarica compatibili dovrebbero essere incluse anche nelle istruzioni e nelle informazioni sulla sicurezza che accompagnano l’apparecchiatura radio. Dovrebbe essere possibile adattare tali requisiti di informazione in futuro per tener conto di eventuali modifiche dei requisiti di etichettatura, in particolare per i dispositivi di ricarica, che potrebbero essere introdotti a norma della direttiva 2009/125/CE del Parlamento europeo e del Consiglio. Tali requisiti di informazione dovrebbero, in particolare, riflettere lo sviluppo delle soluzioni di ricarica armonizzate e dovrebbero essere adeguati di conseguenza. In tale contesto, si potrebbe prendere in considerazione anche l’introduzione di un sistema di codici cromatici.
(17) Considerando che gli importatori e i distributori potrebbero anche fornire apparecchiature radio direttamente ai consumatori e agli altri utenti finali, essi dovrebbero essere soggetti a obblighi identici a quelli applicabili ai fabbricanti in relazione alle informazioni da fornire o da esporre. Tutti gli operatori economici dovrebbero essere tenuti ad adempiere l’obbligo per quanto riguarda il pittogramma che indica se un dispositivo di ricarica è incluso o meno nell’apparecchiatura radio quando rendono disponibile l’apparecchiatura radio ai consumatori e agli altri utenti finali. Gli importatori e i distributori potrebbero quindi offrire pacchetti, comprensivi dell’apparecchiatura radio e del relativo dispositivo di ricarica, anche quando tale apparecchiatura radio è fornita senza dispositivo di ricarica dal fabbricante, a condizione che gli importatori e i distributori offrano ai consumatori e agli altri utenti finali anche la possibilità di acquistare l’apparecchiatura radio senza alcun dispositivo di ricarica.
(18) La direttiva 2014/53/UE stabilisce le procedure di valutazione della conformità. Essa dovrebbe essere modificata al fine di aggiungere riferimenti ai nuovi requisiti essenziali. I fabbricanti dovrebbero quindi poter scegliere di usare la procedura di controllo interno della produzione per dimostrare la conformità ai nuovi requisiti essenziali.
(19) Al fine di garantire che le autorità nazionali di vigilanza del mercato dispongano dei mezzi procedurali per far applicare i nuovi requisiti riguardanti le interfacce di ricarica e i protocolli di comunicazione di ricarica armonizzati e quelli relativi alla fornitura delle apparecchiature radio oggetto di tale armonizzazione, è opportuno adeguare di conseguenza la direttiva 2014/53/UE. In particolare, dovrebbe essere inserito un riferimento esplicito alla mancanza di conformità ai requisiti essenziali, che comprendono anche le nuove disposizioni sulle specifiche relative alla capacità di ricarica e ai dispositivi di ricarica compatibili. Dato che tali nuove disposizioni riguardano gli aspetti dell’interoperabilità, l’obiettivo sarebbe di evitare interpretazioni divergenti in merito alla possibilità di attivare la procedura prevista dalla direttiva 2014/53/UE anche per le apparecchiature radio che non presentano rischi per la salute o l’incolumità delle persone o per altri aspetti della protezione del pubblico interesse.
(20) La direttiva 2014/53/UE indica i casi di non conformità formale. Dato che la presente direttiva introduce nuovi requisiti applicabili a determinate categorie o classi di apparecchiature radio, la direttiva 2014/53/UE dovrebbe essere modificata al fine di consentire alle autorità nazionali di vigilanza del mercato di assicurare efficacemente l’osservanza dei nuovi requisiti.
(21) La direttiva 2014/53/UE dovrebbe essere modificata per adeguare i riferimenti ivi contenuti ai nuovi requisiti introdotti dalla presente direttiva.
(22) È necessario garantire l’interoperabilità minima comune tra le apparecchiature radio e i dispositivi di ricarica per tali apparecchiature radio e affrontare eventuali sviluppi futuri del mercato, come l’emergere di nuove categorie o classi di apparecchiature radio in relazione alle quali è osservato un grado significativo di frammentazione delle interfacce di ricarica e dei protocolli di comunicazione per la ricarica, nonché a eventuali sviluppi delle tecnologie di ricarica. È inoltre necessario tener conto delle future modifiche dei requisiti di etichettatura, ad esempio per i dispositivi o cavi di ricarica, o di altri progressi tecnologici. È opportuno pertanto delegare alla Commissione il potere di adottare atti conformemente all’articolo 290 del trattato sul funzionamento dell’Unione europea riguardo alla modifica delle categorie o delle classi di apparecchiature radio e delle specifiche relative alle interfacce di ricarica e ai protocolli di comunicazione per la ricarica per ciascuna di esse e riguardo alla modifica dei requisiti di informazione per le interfacce di ricarica e i protocolli di comunicazione per la ricarica. È di particolare importanza che durante i lavori preparatori la Commissione svolga adeguate consultazioni, anche a livello di esperti, nel rispetto dei principi stabiliti nell’accordo interistituzionale «Legiferare meglio» del 13 aprile 2016. In particolare, al fine di garantire la parità di partecipazione alla preparazione degli atti delegati, il Parlamento europeo e il Consiglio ricevono tutti i documenti contemporaneamente agli esperti degli Stati membri, e i loro esperti hanno sistematicamente accesso alle riunioni dei gruppi di esperti della Commissione incaricati della preparazione di tali atti delegati.
(23) È pertanto opportuno modificare di conseguenza la direttiva 2014/53/UE.
(24) Agli operatori economici dovrebbe essere concesso un periodo di tempo sufficiente per procedere ai necessari adattamenti delle apparecchiature radio che rientrano nell’ambito di applicazione della presente direttiva e che intendono immettere sul mercato dell’Unione,[/panel]
HANNO ADOTTATO LA PRESENTE DIRETTIVA:
Articolo 1 La direttiva 2014/53/UE è così modificata:
1) l’articolo 3 è così modificato:
a) al paragrafo 3, primo comma, la lettera a) è sostituita dalla seguente:
«a) le apparecchiature radio interagiscono con accessori diversi dai dispositivi di ricarica per le categorie o le classi di apparecchiature radio di cui all’allegato I bis, parte I, che sono specificamente menzionati al paragrafo 4 del presente articolo;»;
b) è aggiunto il paragrafo seguente:
«4. Le apparecchiature radio che rientrano nelle categorie o nelle classi di cui all’allegato I bis, parte I, sono costruite in modo da essere conformi alle specifiche relative alle capacità di ricarica di cui a tale allegato per la pertinente categoria o classe di apparecchiature radio.
Per quanto riguarda le apparecchiature radio che possono essere ricaricate mediante cavo, alla Commissione è conferito il potere di adottare atti delegati conformemente all’articolo 44 al fine di modificare la parte I dell’allegato I bis alla luce del progresso scientifico e tecnologico o degli sviluppi del mercato per garantire un’interoperabilità minima comune tra le apparecchiature radio e i relativi dispositivi di ricarica, nonché migliorare la convenienza dei consumatori, ridurre i rifiuti ambientali ed evitare la frammentazione del mercato, mediante:
a) la modifica, l’aggiunta o l’eliminazione di categorie o classi di apparecchiature radio;
b) la modifica, l’aggiunta o l’eliminazione di specifiche tecniche, compresi riferimenti e descrizioni, in relazione alla presa o alle prese di ricarica e al protocollo o ai protocolli di comunicazione per la ricarica, per ciascuna categoria o classe di apparecchiature radio interessata.
La Commissione valuta costantemente gli sviluppi del mercato, la frammentazione del mercato e il progresso tecnologico al fine di individuare le categorie o le classi di apparecchiature radio che possono essere ricaricate mediante cavo per le quali l’inclusione nella parte I dell’allegato I bis comporterebbe una notevole convenienza dei consumatori e una riduzione dei rifiuti ambientali.
La Commissione presenta una relazione sulla valutazione di cui al terzo comma al Parlamento europeo e al Consiglio, per la prima volta entro il 28 dicembre 2025 e successivamente ogni cinque anni, e adotta di conseguenza atti delegati a norma del secondo comma, lettera a).
Per quanto riguarda le apparecchiature radio che possono essere ricaricate tramite mezzi diversi dal cavo, alla Commissione è conferito il potere di adottare atti delegati conformemente all’articolo 44 al fine di modificare la parte I dell’allegato I bis alla luce del progresso scientifico e tecnologico o degli sviluppi del mercato per garantire un’interoperabilità minima comune tra le apparecchiature radio e i relativi dispositivi di ricarica, nonché migliorare la convenienza dei consumatori, evitare la frammentazione del mercato e ridurre i rifiuti ambientali, mediante:
a) l’introduzione, la modifica, l’aggiunta o l’eliminazione di categorie o classi di apparecchiature radio;
b) l’introduzione, la modifica, l’aggiunta o l’eliminazione di specifiche tecniche, compresi riferimenti e descrizioni, in relazione all’interfaccia o alle interfacce di ricarica e al protocollo o ai protocolli di comunicazione per la ricarica, per ciascuna categoria o classe di apparecchiature radio interessata.
La Commissione chiede, conformemente all’articolo 10, paragrafo 1, del regolamento (UE) n. 1025/2012, ed entro il 28 dicembre 2024, a una o più organizzazioni europee di normazione di elaborare norme armonizzate che stabiliscano specifiche tecniche per l’interfaccia o le interfacce di ricarica e il protocollo o i protocolli di comunicazione per le apparecchiature radio che possono essere ricaricate mediante mezzi diversi dal cavo. Conformemente alla procedura di cui all’articolo 10, paragrafo 2, del regolamento (UE) n. 1025/2012, la Commissione consulta il comitato istituito a norma dell’articolo 45, paragrafo 1, della presente direttiva. I requisiti relativi al contenuto delle norme armonizzate richieste si basano su una valutazione, effettuata dalla Commissione, dello stato delle tecnologie di ricarica senza fili per le apparecchiature radio, riguardante in particolare gli sviluppi del mercato, la penetrazione nel mercato, la frammentazione del mercato, le prestazioni tecnologiche, l’interoperabilità, l’efficienza energetica e le prestazioni di ricarica.
Nel preparare gli atti delegati di cui al presente articolo per quanto riguarda le apparecchiature radio che possono essere ricaricate mediante cavo nonché le apparecchiature radio che possono essere ricaricate tramite mezzi diversi dal cavo, la Commissione tiene conto del grado di accettazione da parte del mercato delle specifiche tecniche in esame, della conseguente convenienza dei consumatori e dell’entità della riduzione dei rifiuti ambientali e della frammentazione del mercato che ci si può aspettare da tali specifiche tecniche. Le specifiche tecniche basate sulle pertinenti norme europee o internazionali disponibili sono considerate conformi agli obiettivi di cui alla frase precedente. Tuttavia, qualora tali norme europee o internazionali non esistano o qualora stabilisca, sulla base di una sua valutazione tecnica, che esse non soddisfano tali obiettivi in modo ottimale, la Commissione può stabilire altre specifiche tecniche che rispondano meglio a tali obiettivi.»;
2) è inserito l’articolo seguente:
«Articolo 3 bis
Possibilità per i consumatori e gli altri utenti finali di acquistare determinate categorie o classi di apparecchiature radio senza dispositivo di ricarica
1. Se un operatore economico offre ai consumatori e agli altri utenti finali la possibilità di acquistare apparecchiature radio di cui all’articolo 3, paragrafo 4, insieme a un dispositivo di ricarica, l’operatore economico offre ai consumatori e agli altri utenti finali anche la possibilità di acquistare tale apparecchiatura radio senza dispositivi di ricarica.
2. Gli operatori economici provvedono affinché le informazioni sull’inclusione o meno di un dispositivo di ricarica con l’apparecchiatura radio di cui all’articolo 3, paragrafo 4, siano esposte in forma grafica utilizzando un pittogramma di facile utilizzo e facilmente accessibile come indicato nell’allegato I bis, parte III, quando tale apparecchiatura radio è messa a disposizione dei consumatori e degli altri utenti finali. Il pittogramma è stampato sull’imballaggio o apposto sull’imballaggio come autoadesivo. Quando l’apparecchiatura radio è messa a disposizione dei consumatori e degli altri utenti finali, il pittogramma è esposto in modo visibile e leggibile e, in caso di vendita a distanza, vicino all’indicazione del prezzo.
Alla Commissione è conferito il potere di adottare atti delegati conformemente all’articolo 44 al fine di modificare l’allegato I bis, parte III, a seguito di modifiche delle parti I e II di tale allegato o a seguito di future modifiche dei requisiti di etichettatura, o alla luce del progresso tecnologico, mediante l’introduzione, la modifica, l’aggiunta o l’eliminazione di elementi grafici o testuali.»;
3) all’articolo 10, il paragrafo 8 è sostituito dal seguente:
«8. I fabbricanti provvedono affinché l’apparecchiatura radio sia accompagnata da istruzioni e informazioni sulla sicurezza. Le istruzioni contengono le informazioni necessarie per l’uso dell’apparecchiatura radio conformemente alla sua destinazione d’uso. Tali informazioni comprendono, se del caso, una descrizione degli accessori e componenti, compreso il software, che consentono all’apparecchiatura radio di funzionare come previsto. Tali istruzioni e informazioni sulla sicurezza, al pari di qualunque etichettatura, devono essere chiare, comprensibili e intelligibili.
Per le apparecchiature radio che emettono intenzionalmente onde radio, nelle istruzioni sono inoltre fornite le seguenti informazioni:
a) bande di frequenza di funzionamento dell’apparecchiatura radio;
b) massima potenza a radiofrequenza trasmessa nelle bande di frequenza in cui opera l’apparecchiatura radio.
Nel caso di apparecchiature radio di cui all’articolo 3, paragrafo 4, le istruzioni contengono informazioni sulle specifiche relative alle capacità di carica delle apparecchiature radio e ai dispositivi di ricarica compatibili, come indicato nell’allegato I bis, parte II. Quando i fabbricanti mettono tali apparecchiature radio a disposizione dei consumatori e degli altri utenti finali, oltre a essere incluse nelle istruzioni le informazioni figurano anche su un’etichetta, come indicato nell’allegato I bis, parte IV. L’etichetta è stampata nelle istruzioni e sull’imballaggio o apposta sull’imballaggio come autoadesivo. In assenza di imballaggio, l’autoadesivo con l’etichetta è apposto sull’apparecchiatura radio. Quando l’apparecchiatura radio è messa a disposizione dei consumatori e degli altri utenti finali, l’etichetta è esposta in modo visibile e leggibile e, in caso di vendita a distanza, vicino all’indicazione del prezzo. Se le dimensioni o la natura dell’apparecchiatura radio non consentono altrimenti, l’etichetta può essere stampata come documento separato che accompagna l’apparecchiatura radio.
Le istruzioni e le informazioni sulla sicurezza di cui al primo, secondo e terzo comma del presente paragrafo sono redatte in una lingua facilmente comprensibile per i consumatori e per gli altri utenti finali, secondo quanto stabilito dallo Stato membro interessato.
Alla Commissione è conferito il potere di adottare atti delegati conformemente all’articolo 44 al fine di modificare l’allegato I bis, parti II e IV, a seguito di modifiche della parte I di tale allegato o a seguito di future modifiche dei requisiti di etichettatura o alla luce del progresso tecnologico, mediante l’introduzione, la modifica, l’aggiunta o l’eliminazione di particolari in relazione agli elementi informativi, grafici o testuali, come indicato nel presente articolo.»;
4) all’articolo 12, paragrafo 4, è aggiunto il comma seguente:
«Quando mettono a disposizione dei consumatori e degli altri utenti finali le apparecchiature radio di cui all’articolo 3, paragrafo 4, gli importatori provvedono affinché:
a) tali apparecchiature radio espongano un’etichetta conformemente all’articolo 10, paragrafo 8, terzo comma, o ne siano munite;
b) tale etichetta sia esposta in modo visibile e leggibile e, in caso di vendita a distanza, vicino all’indicazione del prezzo.»;
5) all’articolo 13, paragrafo 2, è aggiunto il comma seguente:
«Quando mettono a disposizione dei consumatori e degli altri utenti finali le apparecchiature radio di cui all’articolo 3, paragrafo 4, i distributori provvedono affinché:
a) tali apparecchiature radio espongano un’etichetta conformemente all’articolo 10, paragrafo 8, terzo comma, o ne siano munite;
b) tale etichetta sia esposta in modo visibile e leggibile e, in caso di vendita a distanza, vicino all’indicazione del prezzo.»;
6) all’articolo 17, paragrafo 2, parte introduttiva, i termini «articolo 3, paragrafo 1» sono sostituiti dai termini «articolo 3, paragrafi 1 e 4»;
7) l’articolo 40 è così modificato:
a) il titolo è sostituito dal seguente:
«Procedura a livello nazionale per le apparecchiature radio che presentano rischi o non sono conformi ai requisiti essenziali»;
b) al paragrafo 1, il primo comma è sostituito dal seguente:
«Le autorità di vigilanza del mercato di uno Stato membro, qualora abbiano motivi sufficienti per ritenere che un’apparecchiatura radio disciplinata dalla presente direttiva presenti un rischio per la salute o l’incolumità delle persone o per altri aspetti della protezione del pubblico interesse di cui alla presente direttiva, o non sia conforme ad almeno uno dei requisiti essenziali applicabili di cui all’articolo 3, effettuano una valutazione dell’apparecchiatura radio interessata che investa tutte le prescrizioni pertinenti di cui alla presente direttiva. A tal fine, gli operatori economici interessati cooperano ove necessario con le autorità di vigilanza del mercato.»;
8) all’articolo 43, il paragrafo 1 è così modificato:
a) dopo la lettera f) sono inserite le lettere seguenti:
«f bis) il pittogramma di cui all’articolo 3 bis, paragrafo 2, o l’etichetta di cui all’articolo 10, paragrafo 8, non sono stati elaborati correttamente;
f ter) l’etichetta di cui all’articolo 10, paragrafo 8, non accompagna l’apparecchiatura radio interessata;
f quater) il pittogramma o l’etichetta non sono apposti o non sono esposti in conformità, rispettivamente, dell’articolo 3 bis, paragrafo 2, o dell’articolo 10, paragrafo 8;»;
b) la lettera h) è sostituita dalla seguente:
«h) le informazioni di cui all’articolo 10, paragrafo 8, la dichiarazione di conformità UE di cui all’articolo 10, paragrafo 9, o le informazioni sulle restrizioni d’uso di cui all’articolo 10, paragrafo 10, non accompagnano l’apparecchiatura radio;»;
c) la lettera j) è sostituita dalla seguente:
«j) l’articolo 3 bis, paragrafo 1, o l’articolo 5 non sono rispettati.»;
9) l’articolo 44 è così modificato:
a) al paragrafo 2, dopo la prima frase è inserita la frase seguente:
«Il potere di adottare atti delegati di cui all’articolo 3, paragrafo 4, all’articolo 3 bis, paragrafo 2, secondo comma, e all’articolo 10, paragrafo 8, quinto comma, è conferito alla Commissione per un periodo di cinque anni a decorrere dal 27 dicembre 2022»;
b) al paragrafo 3, la prima frase è sostituita dalla seguente:
«La delega di potere di cui all’articolo 3, paragrafo 3, secondo comma, all’articolo 3, paragrafo 4, all’articolo 3 bis, paragrafo 2, secondo comma, all’articolo 4, paragrafo 2, all’articolo 5, paragrafo 2, e all’articolo 10, paragrafo 8, quinto comma, può essere revocata in qualsiasi momento dal Parlamento europeo o dal Consiglio.»;
c) è inserito il paragrafo seguente:
«3 bis. Prima dell’adozione dell’atto delegato la Commissione consulta gli esperti designati da ciascuno Stato membro nel rispetto dei principi stabiliti nell’accordo interistituzionale “Legiferare meglio” del 13 aprile 2016.
d) il paragrafo 5 è sostituito dal seguente:
«5. L’atto delegato adottato ai sensi dell’articolo 3, paragrafo 3, secondo comma, dell’articolo 3, paragrafo 4, dell’articolo 3 bis, paragrafo 2, secondo comma, dell’articolo 4, paragrafo 2, dell’articolo 5, paragrafo 2, o dell’articolo 10, paragrafo 8, quinto comma, entra in vigore solo se né il Parlamento europeo né il Consiglio hanno sollevato obiezioni entro il termine di due mesi dalla data in cui esso è stato notificato al Parlamento europeo e al Consiglio o se, prima della scadenza di tale termine, sia il Parlamento europeo che il Consiglio hanno informato la Commissione che non intendono sollevare obiezioni. Tale termine è prorogato di due mesi su iniziativa del Parlamento europeo o del Consiglio.»;
10) all’articolo 47 è aggiunto il paragrafo seguente:
«3. Entro il 28 dicembre 2026, la Commissione presenta al Parlamento europeo e al Consiglio una relazione sull’impatto della possibilità di acquistare apparecchiature radio senza dispositivi di ricarica e cavi, in particolare per quanto riguarda la convenienza dei consumatori, la riduzione dei rifiuti ambientali, i cambiamenti comportamentali e lo sviluppo delle pratiche di mercato. Tale relazione è corredata, se del caso, di una proposta legislativa di modifica della presente direttiva al fine di introdurre l’obbligo di separazione della vendita dei dispositivi di ricarica e dei cavi dalla vendita delle apparecchiature radio.»;
11) il testo figurante nell’allegato della presente direttiva è inserito come allegato I bis.
Articolo 2
1. Gli Stati membri adottano e pubblicano entro il 28 dicembre 2023 le disposizioni legislative, regolamentari e amministrative necessarie per conformarsi alla presente direttiva. Essi comunicano immediatamente alla Commissione il testo di tali disposizioni.
Essi applicano tali disposizioni a decorrere dal 28 dicembre 2024 per le categorie o classi di apparecchiature radio di cui all’allegato I bis, parte I, punti da 1.1. a 1.12., e dal 28 aprile 2026 per le categorie o classi di apparecchiature radio di cui all’allegato I bis, parte I, punto 1.13.
Le disposizioni adottate dagli Stati membri contengono un riferimento alla presente direttiva o sono corredate di tale riferimento all’atto della pubblicazione ufficiale. Le modalità del riferimento sono stabilite dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni principali di diritto interno che adottano nel settore disciplinato dalla presente direttiva.
Articolo 3
La presente direttiva entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
...
ALLEGATO
ALLEGATO I bis
SPECIFICHE E INFORMAZIONI RELATIVE ALLA RICARICA APPLICABILI A DETERMINATE CATEGORIE O CLASSI DI APPARECCHIATURE RADIO
[...]
Collegati
[box-note]Nuova Direttiva R&TTE 2014/53/UE (Direttiva RED)
Proposta di Direttiva di modifica della Direttiva 2014/53/UE (RED)
Norme armonizzate Apparecchiature Radio Direttiva 2014/53/UE (RED)[/box-note]
RAPEX Report 45 del 11/11/2022 N. 04 A12/01599/22 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 45 dell'11/11/2022 N. 04 A12/01599/22 Germania
Approfondimento tecnico: Scatola musicale
Il prodotto, di marca Musicbox Kingdom, mod. 43832, è stato sottoposto alla procedura che ne impone il divieto di commercializzazione perché non conforme Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
Delle piccole parti potrebbero staccarsi dal giocattolo ed i bambini piccoli potrebbero metterle in bocca e soffocare.
La Direttiva 2009/48/CE, all’Allegato II, contenente i Requisiti Particolari di Sicurezza, stabilisce che:
4. […]
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili. […]
Inoltre, in accordo alla norma tecnica EN 71-1:2018, ogni giocattolo o suo componente deve superare la prova del cilindro per le piccole parti (Rif. paragrafo 8.2).
Ogni giocattolo o componente non deve entrare completamente nel cilindro di prova previsto dalla norma.
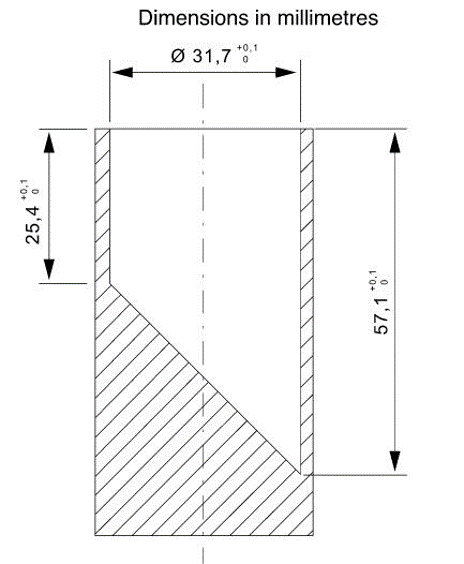
Figura 1 – Cilindro di prova
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 45 del 11_11_2022 N. 04 A12_01599_22 Germania.pdf Scatola musicale |
146 kB | 0 |
Regolamento di esecuzione (UE) 2022/2346
Regolamento di esecuzione (UE) 2022/2346 / Specifiche comuni prodotti Allegato XVI Reg. DM
ID 18253 | 22.07.2023 / In allegato testo consolidato Giugno 2023
Regolamento di esecuzione (UE) 2022/2346 della Commissione del 1° dicembre 2022 che stabilisce specifiche comuni per i gruppi di prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio relativo ai dispositivi medici
GU L 311/60 del 02.12.2022
Entrata in vigore: 22.12.2022
Applicazione: a decorrere dal 22 giugno 2023. Tuttavia l’articolo 2, paragrafo 3, si applica a decorrere dal 22 dicembre 2022.
[box-info]Regolamento di esecuzione (UE) 2023/1194 - Modifica del regolamento di esecuzione (UE) 2022/2346
Regolamento di esecuzione (UE) 2023/1194 della Commissione del 20 giugno 2023 che modifica il regolamento di esecuzione (UE) 2022/2346 per quanto riguarda le disposizioni transitorie per determinati prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio. (GU L 158/62 del 21.6.2023)
Entrata in vigore: 21.06.2023
Applicazione dal 22.06.2023
In allegato testo consolidato 22.06.2023[/box-info]
________
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio, in particolare l’articolo 1, paragrafo 2, in combinato disposto con l’articolo 9, paragrafo 1,
considerando quanto segue:
(1) Il regolamento (UE) 2017/745 stabilisce le norme relative all’immissione sul mercato, la messa a disposizione sul mercato o la messa in servizio dei dispositivi medici per uso umano e degli accessori per tali dispositivi nell’Unione. Il regolamento (UE) 2017/745 prevede inoltre che la Commissione adotti, per i gruppi di prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento stesso, specifiche comuni riguardanti almeno l’applicazione della gestione del rischio enunciata nei requisiti generali di sicurezza e prestazione di cui all’allegato I del regolamento e, qualora necessario, la valutazione clinica relativa alla sicurezza.
(2) A decorrere dalla data di applicazione delle specifiche comuni, il regolamento (UE) 2017/745 si deve applicare anche a tali gruppi di prodotti che non hanno una destinazione d’uso medica.
(3) Per consentire ai fabbricanti di dimostrare la conformità dei prodotti che non hanno una destinazione d’uso medica per quanto riguarda l’applicazione della gestione del rischio, le specifiche comuni dovrebbero contemplare l’applicazione della gestione del rischio di cui all’allegato I, punto 1, seconda frase, e punti da 2 a 5, 8 e 9, del regolamento (UE) 2017/745. Di conseguenza, a norma dell’articolo 9, paragrafo 2, del regolamento (UE) 2017/745, i prodotti che non hanno una destinazione d’uso medica e sono conformi alle specifiche comuni sono considerati conformi alle prescrizioni contenute in tali disposizioni.
(4) In linea di principio le specifiche comuni dovrebbero essere stabilite per tutti i gruppi di prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento (UE) 2017/745. Tuttavia, dal momento che il regolamento (UE) 2017/745 disciplina l’immissione sul mercato, la messa a disposizione sul mercato o la messa in servizio nell’Unione, per i prodotti per i quali non si dispone di informazioni in merito alla commercializzazione nell’Unione non sono necessarie specifiche comuni. Ad esempio non vi sono informazioni sulla commercia lizzazione nell’Unione dei prodotti seguenti: lenti a contatto contenenti strumenti, come antenne o microchip, lenti a contatto che sono dispositivi attivi; prodotti impiantabili attivi destinati a essere introdotti totalmente o parzialmente nel corpo umano mediante strumenti invasivi di tipo chirurgico allo scopo di modificare l’anatomia o fissare una parte del corpo; dispositivi attivi destinati a essere utilizzati per filling facciali o altri filling cutanei o per le mucose attraverso iniezione sottocutanea, sottomucosa o intradermica o un altro tipo di introduzione; apparecchiature impiantabili attive destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo. Per alcuni prodotti, inoltre, le informazioni disponibili non sono sufficienti per consentire alla Commissione di redigere specifiche comuni. È il caso, per esempio, di alcuni altri elementi destinati a essere introdotti nell’occhio o sull’occhio.
(5) I lettini solari e le apparecchiature che utilizzano radiazioni ottiche infrarosse per riscaldare il corpo o parti del corpo, destinate al trattamento di tessuti o parti del corpo sotto la pelle, non dovrebbero essere considerati prodotti per trattamento dermico ai fini dell’allegato XVI del regolamento (UE) 2017/745. È pertanto opportuno escluderle dall’ambito di applicazione del presente regolamento.
(6) Il gruppo di prodotti elencati nell’allegato XVI, punto 6, del regolamento (UE) 2017/745 è destinato alla stimolazione cerebrale effettuata soltanto con l’applicazione di correnti elettriche o campi magnetici o elettromagnetici che attraversano il cranio. È opportuno escludere dall’ambito di applicazione del presente regolamento i dispositivi invasivi destinati alla stimolazione cerebrale, come elettrodi o sensori introdotti parzialmente o totalmente nel corpo umano.
(7) Il regolamento (UE) 2017/745 impone che i prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento stesso, se utilizzati alle condizioni e per i fini previsti, non presentino alcun rischio o un rischio non superiore a quello massimo accettabile connesso all’uso del prodotto, che è coerente con un elevato livello di protezione della salute e della sicurezza delle persone.
(8) I gruppi di prodotti che non hanno una destinazione d’uso medica elencati nell’allegato XVI del regolamento (UE) 2017/745 comprendono una vasta gamma di dispositivi, con applicazioni e destinazioni d’uso differenti. È opportuno redigere una metodologia comune per la gestione del rischio, al fine di assicurare un approccio armonizzato da parte dei fabbricanti dei diversi gruppi di dispositivi e di agevolare un’attuazione coerente delle specifiche comuni.
(9) Per garantire un’adeguata gestione del rischio, è necessario individuare fattori di rischio specifici da analizzare e ridurre al minimo, nonché specifiche misure di controllo del rischio da attuare per ciascun gruppo di prodotti elencati nell’allegato XVI del regolamento (UE) 2017/745.
(10) Per facilitare l’attuazione della gestione del rischio da parte dei fabbricanti sia di dispositivi medici sia di prodotti che non hanno una destinazione d’uso medica, la gestione del rischio dovrebbe basarsi sui medesimi principi armonizzati per entrambi i gruppi di prodotti e i requisiti dovrebbero essere compatibili. Le norme sull’applicazione della gestione del rischio dovrebbero pertanto essere in linea con le linee guida internazionali consolidate nel settore, tra cui la norma internazionale ISO 14971:2019 sull’applicazione della gestione del rischio ai dispositivi medici.
(11) Ai sensi del regolamento (UE) 2017/745 la valutazione clinica dei prodotti che non hanno una destinazione d’uso medica deve basarsi su dati clinici pertinenti, riguardanti le prestazioni e la sicurezza. Tali dati devono comprendere informazioni tratte dalla sorveglianza post-commercializzazione, dal follow-up clinico post-commercializzazione e, se del caso, dall’indagine clinica specifica. Poiché in generale non è possibile dimostrare l’equivalenza tra un dispositivo medico e un prodotto che non ha una destinazione d’uso medica, qualora tutti i risultati disponibili sulle indagini cliniche riguardino soltanto dispositivi medici, si dovrebbero effettuare indagini cliniche per i prodotti che non hanno una destinazione d’uso medica.
(12) Qualora siano effettuate indagini cliniche per confermare il rispetto dei pertinenti requisiti generali di sicurezza e prestazione, non sarà possibile completare le indagini cliniche e la valutazione della conformità entro sei mesi. Per tali casi dovrebbero essere previste disposizioni transitorie.
(13) Qualora nella procedura di valutazione della conformità sia necessaria la partecipazione di un organismo notificato, non sarà possibile per i fabbricanti completare la valutazione della conformità entro sei mesi. Per tali casi dovrebbero essere previste disposizioni transitorie.
(14) È opportuno stabilire disposizioni transitorie anche per i prodotti di cui all’allegato XVI del regolamento (UE) 2017/745 per i quali gli organismi notificati hanno rilasciato certificati conformemente alla direttiva 93/42/CEE del Consiglio (2). Anche per tali prodotti, non sarà possibile per i fabbricanti completare le indagini cliniche e la valutazione della conformità entro sei mesi.
(15) Al fine di garantire la sicurezza di un prodotto durante il periodo transitorio, dovrebbe essere consentito continuare a immettere i prodotti sul mercato e metterli a disposizione sul mercato oppure metterli in servizio, a condizione che i prodotti in questione fossero già legalmente commercializzati nell’Unione prima della data di applicazione del presente regolamento, che essi continuino a soddisfare i requisiti della normativa nazionale e dell’Unione applicabile prima della data di applicazione del presente regolamento e che non vi siano cambiamenti significativi nella loro progettazione e destinazione d’uso. Poiché l’introduzione delle disposizioni transitorie è intesa a concedere ai fabbricanti un tempo sufficiente per svolgere le indagini cliniche e le procedure di valutazione della conformità necessarie, tali disposizioni transitorie dovrebbero interrompersi qualora i fabbricanti non procedano con le indagini cliniche o la procedura di valutazione della conformità, a seconda dei casi, entro un periodo di tempo ragionevole.
(16) Il gruppo di coordinamento per i dispositivi medici è stato consultato.
(17) La data di applicazione del presente regolamento dovrebbe essere posticipata come previsto nel regolamento (UE) 2017/745.
(18) Le misure di cui al presente regolamento sono conformi al parere del comitato per i dispositivi medici,
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1 Specifiche comuni
1. Il presente regolamento stabilisce specifiche comuni per i gruppi di prodotti che non hanno una destinazione d’uso medica, elencati nell’allegato XVI del regolamento (UE) 2017/745.
L’allegato I stabilisce specifiche comuni per tutti i gruppi di prodotti che non hanno una destinazione d’uso medica. L’allegato II stabilisce specifiche comuni per le lenti a contatto, di cui al punto 1 di tale allegato.
L’allegato III stabilisce specifiche comuni per i prodotti destinati a essere introdotti totalmente o parzialmente nel corpo umano mediante strumenti invasivi di tipo chirurgico allo scopo di modificare l’anatomia, a eccezione dei prodotti per tatuaggi e piercing, di cui al punto 1 di tale allegato.
L’allegato IV stabilisce specifiche comuni per le sostanze, le associazioni di sostanze o gli elementi destinati a essere utilizzati per filling facciali o altri filling cutanei o per le mucose attraverso iniezione sottocutanea, sottomucosa o intradermica o un altro tipo di introduzione, eccetto quelli per i tatuaggi, di cui al punto 1 di tale allegato.
L’allegato V stabilisce specifiche comuni per le apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo, quali apparecchiature per la liposuzione, lipolisi o lipoplastica, di cui al punto 1 di tale allegato.
L’allegato VI stabilisce specifiche comuni per le apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità (ad esempio infrarossi, luce visibile e ultravioletti) destinate a essere utilizzate sul corpo umano, comprese fonti coerenti e non coerenti, monocromatiche e ad ampio spettro, come laser e apparecchiature a luce pulsata ad alta intensità per fotoringiovanimento cutaneo, rimozione di tatuaggi o epilazione o altro trattamento dermico, di cui al punto 1 di tale allegato.
L’allegato VII stabilisce specifiche comuni per le attrezzature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che attraversano il cranio per modificare l’attività neuronale del cervello, di cui al punto 1 di tale allegato.
2. Le specifiche comuni stabilite nel presente regolamento si riferiscono ai requisiti di cui all’allegato I, punto 1, seconda frase, e punti da 2 a 5, 8 e 9, del regolamento (UE) 2017/745.
Articolo 2 Disposizioni transitorie
1. Un prodotto per il quale il fabbricante intenda effettuare o stia effettuando un’indagine clinica volta a generare dati clinici per la valutazione clinica al fine di confermarne la conformità ai pertinenti requisiti generali di sicurezza e prestazione di cui all’allegato I del regolamento (UE) 2017/745 e alle specifiche comuni di cui al presente regolamento, e nella cui valutazione della conformità debba intervenire un organismo notificato conformemente all’articolo 52 di tale regolamento, può essere immesso sul mercato o messo in servizio fino al 22 giugno 2028, purché siano soddisfatte le seguenti condizioni:
a) il prodotto era già legalmente commercializzato nell’Unione prima del 22 giugno 2023 e continua a soddisfare i requisiti della normativa nazionale e dell’Unione che erano applicabili ad esso prima del 22 giugno 2023;
b) non vi sono cambiamenti significativi nella progettazione e destinazione d’uso del prodotto.
In deroga al primo comma del presente paragrafo, dal 22 giugno 2024 fino al 22 dicembre 2024, un prodotto che soddisfa le condizioni di cui a tale comma può essere immesso sul mercato o messo in servizio solo se lo sponsor ha ricevuto dallo Stato membro interessato una notifica, conformemente all’articolo 70, paragrafo 1 o 3, delregolamento (UE) 2017/745, in cui si confermi che la domanda di indagine clinica del prodotto è completa e che l’indagine clinica rientra nell’ambito di applicazione del regolamento (UE) 2017/745.
In deroga al primo comma, dal 23 dicembre 2024 fino al 22 giugno 2026, un prodotto che soddisfa le condizioni di cui a tale comma può essere immesso sul mercato o messo in servizio solo se lo sponsor ha iniziato l’indagine clinica.
In deroga al primo comma, dal 23 giugno 2026 fino al 22 giugno 2028, un prodotto che soddisfa le condizioni di cui a tale comma può essere immesso sul mercato o messo in servizio solo se l’organismo notificato e il fabbricante hanno firmato un accordo scritto per lo svolgimento della valutazione della conformità.
2. Un prodotto per il quale il fabbricante non intenda effettuare un’indagine clinica, ma nella cui valutazione della conformità debba intervenire un organismo notificato conformemente all’articolo 52 di tale regolamento, può essere immesso sul mercato o messo in servizio fino al 22 giugno 2025, purché siano soddisfatte le seguenti condizioni:
a) il prodotto era già legalmente commercializzato nell’Unione prima del 22 giugno 2023 e continua a soddisfare i requisiti della normativa nazionale e dell’Unione che erano applicabili ad esso prima del 22 giugno 2023;
b) non vi sono cambiamenti significativi nella progettazione e destinazione d’uso del prodotto.
In deroga al primo comma, dal 22 settembre 2023 fino al 22 giugno 2025, un prodotto che soddisfa le condizioni di cui a tale comma può essere immesso sul mercato o messo in servizio solo se l’organismo notificato e il fabbricante hanno firmato un accordo scritto per lo svolgimento della valutazione della conformità.
3. Un prodotto cui si applica il presente regolamento e che è coperto da un certificato rilasciato da un organismo notificato conformemente alla direttiva 93/42/CEE può essere immesso sul mercato o messo in servizio fino alle date di cui al paragrafo 1, primo comma, e al paragrafo 2, primo comma, a seconda dei casi, anche dopo la data di scadenza di tale certificato, purché siano soddisfatte le seguenti condizioni:
a) il prodotto era già legalmente commercializzato nell’Unione prima del 22 giugno 2023 e continua a soddisfare i requisiti della direttiva 93/42/CEE, ad eccezione dell’obbligo di essere coperto da un certificato valido rilasciato da un organismo notificato se il certificato scade dopo il 26 maggio 2021;
b) non vi sono cambiamenti significativi nella progettazione e destinazione d’uso del prodotto;
c) dopo la data di scadenza del certificato rilasciato da un organismo notificato conformemente alla direttiva 93/42/CEE, l’appropriata sorveglianza della conformità alle condizioni di cui alle lettere a) e b) del presente paragrafo è assicurata mediante un accordo scritto firmato dall’organismo notificato che ha rilasciato il certificato conformemente alla direttiva 93/42/CEE o da un organismo notificato designato conformemente al regolamento (UE) 2017/745 e dal fabbricante.
Articolo 3 Entrata in vigore e data di applicazione
1. Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
2. Esso si applica a decorrere dal 22 giugno 2023. Tuttavia l’articolo 2, paragrafo 3, si applica a decorrere dal 22 dicembre 2022.
...
Collegati
[box-note]Tavole di corrispondenza CEI UNI EN ISO 13485:2022 e Reg. (UE) 2017/745
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Regolamento di esecuzione (UE) 2022_2346 Testo consolidato 22.06.2023.pdf |
711 kB | 1 |
Decreto 13 ottobre 2022 n. 182
Decreto 13 ottobre 2022 n. 182 / Regolamento sistemi di alimentazione GPL su unità da diporto
ID 18225 | 29.11.2022
Decreto 13 ottobre 2022 n. 182 - Regolamento recante procedure per l'approvazione e l'installazione di sistemi di alimentazione con gas di petrolio liquefatto (GPL) su unita' da diporto e relativi motori di propulsione.
(GU Serie Generale n. 279 del 29.11.2022)
Entrata in vigore del provvedimento: 14/12/2022
Applicazione dal 27.02.2023
...
Art. 1. Finalità e ambito di applicazione
1. Il presente regolamento disciplina i sistemi di alimentazione a gas di petrolio liquefatto su unità da diporto e i relativi motori di propulsione definiti all’articolo 3 del decreto legislativo 11 gennaio 2016, n. 5.
[...]
Art. 2. Definizioni
Art. 3. Impresa installatrice e sistema di qualità
Art. 4. Unità di nuova costruzione
Art. 5. Motori di propulsione di nuova costruzione
Art. 6. Conversione a GPL di prodotti già immessi sul mercato
Art. 7. Operazioni di controllo periodico
Art. 8. Disposizioni finali e clausola di invarianza finanziaria
_______
Collegati
[box-note]Decreto Legislativo n. 5 del 11 gennaio 2016[/box-note]
Circolare INAIL 60202 del 27 Novembre 2015
Circolare INAIL 60202 del 27 Novembre 2015
OGGETTO: Dichiarazione di messa in servizio di Generatori di vapore marcati CE ai sensi dell'art 6 del DM 329/04 ed esclusi dal controllo obbligatorio di messa in servizio - Chiarimenti procedurali.
La presente nota, a parziale modifica ed integrazione della precedente lettera circolare Ex ISPESL n. 4/05, riguarda le modalità per la dichiarazione di messa in servizio (ai sensi dell'art 6 del OM 329/04) dei generatori di vapore (a fuoco diretto e non, adibiti alla produzione di vapore saturo o surriscaldato} e generatori di acqua surriscaldata con camera di vapore costituiti da una o più attrezzature a pressione, da accessori a pressione e da accessori di sicurezza, marcati globalmente CE (ai sensi della direttiva 2014/68/UE) come insiemi.
Per tafi insiemi, qualora rientranti nella fattispecie di cui all'art.5, comma 1, lettera d) del DM 329/04, non è prevista la verifica obbligatoria di messa in servizio di cui all'art. 4 dello stesso decreto
Per tali insiemi, inoltre, la dichiarazione di messa in servizio di cui all'art. 6 del DM 329/04 consente di attivare l'insieme stesso a condizione che l'utilizzatore ne attesti la debita installazione, la rnanutenzione in efficienza, la conformità alla destinazione d'uso e che non sia pregiudicata la salute e la sicurezza delle persona o degli animali domestici nonché la sicurezza dei beni.
In tale contesto, ai fini di quanta previsto dall'art.6 de! DM 329/04, tenendo canto di quanto previsto dalle norme nazionali vigenti (RD. 12 maggio 1927 n. 824 e s.m.i. - D.M. 22 aprile 1935 - DPR 5/09/66, n.1208 - D.M. 21/5/74) nelle parti non in contrasto con i contenuti del DM 329/04 e del D Lgs. 93/2000, si ritiene che all'atto della messa in servizio utilizzatore del Generatore debba inviare alla UOT INAIL competente per territorio una dichiarazione di messa in servizio, contenente:
1. l'elenco delle singole attrezzature, con i rispettivi valori di pressione, temperatura, capacita e fluido di esercizio;
2. una relazione tecnica, con lo schema dell'impianto, recante le condizioni d'installazione e dl esercizio, le misure di sicurezza, protezione e controllo adottate;
3. espressa dichiarazione, redatta ai sensi dell'articolo 2 del decreto del Presidente della Repubblica del 20 ottobre 1998, n. 403, attestante che:
- l'installazione e stata eseguita in conformità a quanto indicate nel rnanuale d'uso;
- l"insieme sia stato debitamente installato, mantenuto in efficienza e utilizzato conformemente alla sua destinazione, non pregiudichi la salute e la sicurezza delle persona o degli animali domestici o la sicurezza dei beni.
4. un elenco degli eventuali componenti operanti in regime di scorrimento viscoso, o sottoposti a fatica oligociclica.
La relazione tecnica di cui al precedente punto 2) dovrà essere integrata dalla seguente documentazione.
...
segue in allegato
Collegati
[box-note]RD 12 maggio 1927 n. 824
DPR 5 Settembre 1966 n.1208
Decreto Ministeriale 22 aprile 1935
DM 21 maggio 1974
Esonero conduzione generatori di vapore / Note
Decreto Legislativo n. 93 del 25 Febbraio 2000
Decreto 1 dicembre 2004 n. 329[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare INAIL 60202 del 27 Novembre 2015.PDF |
342 kB | 44 |
RAPEX Report 43 del 28/10/2022 N. 09 A12/01508/22 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 43 del 28/10/2022 N. 09 A12/01508/22 Francia
Approfondimento tecnico: Affumicatore per barbecue
Il prodotto, di marca VOUNOT, mod. SKU:2518146154596, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 1860-1:2013+A1:2017 “Apparecchi, combustibili solidi e accenditori per barbecue - Parte 1: Barbecue alimentati con combustibili solidi - Requisiti e metodi di prova”.
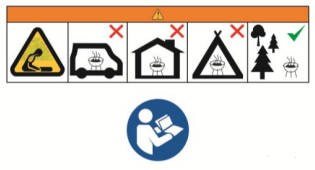
La superficie orizzontale su cui viene posizionato il barbecue raggiunge una temperatura troppo elevata, superiore di 130 gradi alla temperatura ambiente (il limite è di 50 gradi). Le persone si possono, pertanto, ustionare durante l’uso e il prodotto può causare un incendio. Inoltre, etichettatura, avvertenze, pittogrammi e istruzioni sono assenti o non rispettano i requisiti previsti.
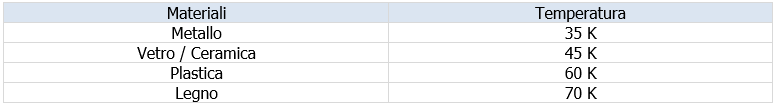
In accordo alla norma EN 1860-1:2013+A1:2017 le temperature superficiali delle parti accessibili possono superare la temperatura ambiente entro i limiti stabiliti nella tabella seguente:
Tabella 3 EN 1860-1:2013+A1:2017 - Temperatura superficiale rispetto alla temperatura ambiente
In accordo alla norma, inoltre, l’oggetto dovrebbe avere dei pittogrammi di sicurezza che ne indichino i rischi principali e delle istruzioni conformi al capitolo 7 della norma.
Figura 14 a) EN 1860-1:2013+A1:2017 - Pittogramma di sicurezza
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 43 del 28_10_2022 N. 09 A12_01508_22 Francia.pdf Affumicatore per barbecue |
111 kB | 0 |
Non compatibile la certificazione volontaria su prodotti soggetti a norme armonizzate EC
Non compatibile la certificazione volontaria su prodotti soggetti a norme armonizzate EC
ID 18051 | 11.11.2022 / In allegato
A seguito della diffusione nel Mercato Unico di “certificati volontari” riguardanti prodotti soggetti alla legislazione di armonizzazione tecnica dell’Unione, la Commissione europea ha diffuso una nota per chiarire che la prassi della “certificazione volontaria” non è autorizzata ed è sanzionabile, quando viene svolta nei settori in cui operano gli Organismi Notificati e quando fa riferimento alle norme tecniche armonizzate.
La nota è stata inviata dalla DG GROW “Direzione Generale del Mercato interno, dell’industria, dell’imprenditoria e delle PMI” alle Autorità di sorveglianza sul mercato e alle Autorità di notifica di tutti gli Stati membri, ed è pubblicata sul sito del Ministero dello Sviluppo Economico nella sezione “Normativa tecnica”.
L’obiettivo è sanare una situazione critica nata con l’emergenza COVID-19, quando gli Organismi Notificati hanno cominciato a rilasciare “certificati volontari” per prodotti e settori per i quali non erano in possesso della notifica in base alla legislazione armonizzata applicabile: dai prodotti soggetti alle Direttive DPI, Dispositivi Medici, ATEX, RED e PED, fino a quelli molto pericolosi (macchine utilizzate in ambienti esplosivi, esplosivi per uso civile o articoli pirotecnici) per i quali la valutazione della conformità è sempre obbligatoria e non c’è alcun margine per la certificazione volontaria.
I “certificati volontari” riportavano spesso anche il simbolo della marcatura CE che, ai sensi del Regolamento CE 765/2008 (art. 30, par. 2) può essere apposta esclusivamente sui prodotti e solo dopo aver eseguito i test di prodotto e le procedure di valutazione della conformità prescritte secondo la normativa armonizzata dell’Unione Europea applicabile. In realtà la Decisione 768/2008/CE, all’art. R12, par. 1, prevede la possibilità di apporre la marcatura CE sugli imballaggi o sui documenti di accompagnamento, ma solo nel caso in cui non è possibile applicarla al prodotto o alla sua targhetta e se la legislazione di prodotto prevede tali documenti.
Con la nota della DG GROW, la Commissione ha dunque confermato che la prassi della “certificazione volontaria” in ambito notificato non è compatibile con la legislazione dell’Unione europea sui prodotti, poiché crea fraintendimenti e incomprensioni sul valore effettivo dei relativi “certificati volontari”, generando anche incertezze sull’effettiva sicurezza e conformità dei prodotti stessi.
Si ammette che un Organismo Notificato svolga attività in ambiti che esulano dalla legislazione per la quale è notificato, ma nel rispetto di specifici requisiti e indicazioni, volti a evitare ogni confusione sul mercato e fraintendimento da parte degli utilizzatori. In tali circostanza, l’Organismo Notificato deve:
- chiarire in maniera inequivocabile che tali attività non rientrano negli ambiti coperti dalla propria notifica ai sensi della legislazione di prodotto armonizzata dell’Unione
- non utilizzare il proprio numero di notifica per valutazioni, prove, certificati
- non sovrapporre, e distinguere chiaramente, le attività notificate e quelle “non notificate” che devono essere esplicitamente indicate come tali.
A fronte di eventuali violazioni delle nuove disposizioni sulla prassi della “certificazione volontaria” da parte degli Organismi Notificati, la Commissione europea si è riservata il diritto di intraprendere ogni azione necessaria per contestare la l’attività di certificazione, o di revocare la notifica, e ha formulato specifiche raccomandazioni alle Autorità degli Stati membri:
- Le Autorità di sorveglianza del mercato devono verificare nei loro mercati la presenza di prodotti accompagnati da documentazione errata e intraprendere le azioni appropriate, fino al ritiro dal mercato dei prodotti per i quali non sono state rispettate le procedure di valutazione della conformità previste dalla rispettiva legislazione.
- Le Autorità di notifica/designazione devono assicurarsi che gli organismi da loro notificati o designati non stiano compiendo attività ingannevoli tramite la notifica e che utilizzino correttamente il numero di notifica e solo per i settori applicabili e in caso di uso improprio possono valutare la revoca della notizia.
Fonte Accredia
Collegati
[box-note]Norme armonizzate
Direttiva click
Linee Guida per la vigilanza del mercato “Direttiva Macchine”[/box-note]
Guidances relating to the Regulation (EU) 2016/426 Gas Appliances (GAR) / 09.2022
Guidances relating to the Regulation (EU) 2016/426 Gas Appliances (GAR) / September 2022
ID 18010 | 07.11.2022 / In allegato Linee guida
Gas Appliances Regulation (GAR): Guidance Sheets - Version 2 - September 2022
A. Interpretations relating to the articles of the Regulation (EU) 2016/426
A1 Appliances and its fittings covered by the Regulation
A3 Regulators and Connecting hoses used to connect appliances to the fuel source; Other components affecting gas safety
B. Interpretations relating to the Essential Requirements of the Regulation (EU) 2016/426 (Annex I)
B2 * Gas Appliances incorporating electrical and/or electronic components
B3 * Boiler body / forced draught burner matching
B6 Failure of a safety, controlling or regulating devices
B8 * Ignition and combustion
B11 * Rational use of energy, state of the art
B12 * Remote operation of Gas appliances
B13 Electronic distribution of instructions and manuals (through the internet or by CD/DVD)
B15 Reference to national, regional and local regulations
C. Interpretations relating to the procedures of the Regulation (EU) 2016/426 (Annex II)
C1 Acceptance of manufacturers test results
C2 On-site checks
C3 On-site checks surveillance
C4 Quality system
C5 Examination and evaluation of the quality system
C6 Uncertainty of Measurements
C7 * EC Surveillance during extra-ordinary circumstances with travelling restrictions
*= new in version September 2022
...
Fonte: CE
Collegati
[box-note]Guidances Regulation (EU) Gas Appliances 2016/426 | Oct. 2021
Regolamento GAR | Regolamento (UE) 2016/426
Regulation (EU) 2016/426: Questions & Answers[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidances relating to the Regulation EU 2016_426 September 2022.pdf CE September 2022 |
714 kB | 23 |
UNI EN ISO 16090-1: Sicurezza macchine utensili taglio a freddo metalli
UNI EN ISO 16090-1:2019 / Sicurezza macchine utensili taglio a freddo metalli
ID 17982 | 03.11.2022 / Download Scheda
UNI EN ISO 16090-1:2019
Sicurezza delle macchine utensili - Centri di lavoro, fresatrici, macchine transfer - Parte 1: Requisiti di sicurezza
La UNI EN ISO 16090-1:2019 (tipo C ai sensi della EN ISO 12100), specifica i requisiti tecnici di sicurezza e le misure di protezione per la progettazione, la costruzione e la fornitura delle macchine utensili utilizzate per il taglio a freddo di metalli e materiali non combustibili (alesatrici, fresatrici, centri di lavoro, macchine transfer e macchine speciali. La norma, alla data, non è armonizzata per la Direttiva macchine 2006/42/CE.
Documenti d'interesse per i Costruttori (Direttiva macchine 2006/42/CE) e Utilizzatori (D.Lgs. 81.2008).
Elaborati sulla norma i Documenti:
P1. Suddivisione in gruppi
Collegati
[box-note]ISO 16090-1:2017[/box-note]
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, transfer - P.2 Istruzioni
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.2 Istruzioni
ID 17927 | Rev. 1.0 del 20.06.2023 / Documento in allegato
La UNI EN ISO 16090-1:2023 (tipo C ai sensi della EN ISO 12100:2010), specifica i requisiti tecnici di sicurezza e le misure di protezione per la progettazione, la costruzione e la fornitura delle macchine utensili utilizzate per il taglio a freddo di metalli e materiali non combustibili (alesatrici, fresatrici, centri di lavoro, macchine transfer e macchine speciali.
La norma non è armonizzata per la Direttiva macchine 2006/42/CE.
LaUNI EN ISO 16090-1:2023sostituisce la UNI EN ISO 16090-1:2019. Le principali novità della nuova edizione sono:
- introduzione nuove funzioni di sicurezza (Allegato J);
- modifica della MSO (modalità di funzionamento sicuro) in MO (modalità di funzionamento);
- introduzione obbligo uso di un comando di abilitazione nella modalità di funzionamento MO 3;
- aggiunta delle cabine operatore mobili.
Documento d'interesse per i Costruttori (Direttiva macchine 2006/42/CE) e Utilizzatori (D.Lgs. 81/2008).
Doc. 2.Istruzioni per l’uso
Questo secondo Documento esamina quali istruzioni per l’uso debbano essere fornite dal Fabbricante all’Utilizzatore della macchina.
[box-note]Della norma UNI EN ISO 16090-1:2023 sono state elaborate due parti:
- UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.1 Suddivisione in gruppi
- UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.2 Istruzioni[/box-note]
[box-note]UNI EN ISO 16090-1:2023
Sicurezza delle macchine utensili - Centri di lavoro, fresatrici, macchine transfer - Parte 1: Requisiti di sicurezza
La norma specifica i requisiti tecnici di sicurezza e le misure di protezione per la progettazione, la costruzione e la fornitura (inclusi l'installazione e lo smantellamento, le modalità di trasporto e manutenzione) di fresatrici fisse, incluse le macchine in grado di eseguire operazioni di alesatura, centri di lavoro e macchine transfer progettate per l'uso in produzione continua, che sono destinate a tagliare a freddo metalli e altri materiali non combustibili ad eccezione del legno o materiali con caratteristiche fisiche simili a quelle del legno come definito nella norma UNI EN ISO 19085-1, e vetro, pietra e materiali lapidei agglomerati come definiti nella UNI EN 14618. La norma si applica alle seguenti macchine:
a) alesatrici e fresatrici a comando manuale senza controllo numerico;
b) alesatrici e fresatrici a comando manuale con controllo numerico limitato;
c) centri di lavoro e fresatrici a controllo numerico;
d) macchine transfer e macchine per impieghi speciali;
e) macchine dotate dei seguenti dispositivi/attrezzature, i cui rischi sono stati affrontati:
- magazzino utensili;
- cambiautensili;
- meccanismi di movimentazione dei pezzi;
- meccanismo/i di bloccaggio del/dei pezzo alimentato/i;
- trasportatore/i di trucioli;
- porte ad azionamento elettrico;
- cabina/e operatore mobile/i;
- attrezzature aggiuntive per la tornitura;
- attrezzature aggiuntive per la molatura.[/box-note]
[...]
Estratto parti UNI EN ISO 16090-1:2023specifiche per le istruzioni per l’uso.
6 Information for use
6.1 General
Information for use shall be provided in accordance with ISO 12100:2010, 6.4.
[...]
6.2.2 Symbols of operating modes (MO) on machines
For identification of the mode of operation (MO), the letter code (e.g. MO 0 or manual mode) or the following standardized symbols shall be used on the command devices and if necessary, on the HMI or the mode selection device:
Table 4 - Symbols for displaying modes of operation on machines
[...]
6.3 Instruction for use
6.3.1 General
An instruction handbook in accordance with ISO 12100:2010, 6.4.5, completed with the specific information for the stated machine, shall be provided with the machine.
The instructions for use shall provide all necessary information regarding transport, assembly/disassembly, operation, setting, maintenance, cleaning, etc., to train or qualify the staff sufficiently in intended and safe use of the machine.
The instruction handbook shall specify that it is essential that operators be adequately trained in the safe use, adjustment and operation of the machine. At least the following information shall be given:
a) specifications on machining processes and modes of operation for which the machine is suited. For all modes of operation, detailed descriptions for the intended use of these modes of operation shall be defined:
1) information about reasonably foreseeable misuse;
2) possible residual risks, e.g. through any provided mode of operation;
3) the necessary qualification of operators in MO 1, in particular if the machine provides the mode of operation MO 2, MO 3 which, for example, requires experience in:
i) adjusting and clamping of workpieces and devices;
ii) setting, operating and monitoring of machining centres, milling machines and transfer machines;
iii) selection, use and mounting of tools;
iv) data input for the machining of workpieces and optimization of the machining process;
v) specific hazards and required protective measures;
vi) use of personal protective equipment (PPE)
4) if the machine provides MO Service in accordance with 5.2.4.7, the manufacturer of the machine shall additionally specify:
i) the details of the application(s) of service mode;
ii) the required skills and the skill level for the operator(s) to operate service mode;
iii) the following safety instructions in the instructions for use:
- Before selecting MO Service, a chain or barrier with warning sign shall be set up to prevent unintended access to the machine. The warning sign indicates that service operations are being conducted on the machine and that unauthorized persons are not permitted to pass beyond the point of the chain or barrier;
- instructions for use need to give clear indication about the kind and setup of the chains or barriers to be used;
[...]
6.3.7 Residual risks to be addressed to the machinery user
Information shall be provided stating that guards supplied with the machine minimize the risks of ejection only in combination with all other measures described in the instruction for use.
Advice shall be provided stating that processing substances such as aluminium, titanium or magnesium can cause additional hazards, e.g. fire and explosion or noxious dust.
Information shall be provided to the user for the utilization of appropriate inert gas or dry powder in the extinguishing system if it is foreseeable that machining leads to the existence of combustible dust, e.g. machining of aluminium, titanium or magnesium.
Instructions shall be provided on the necessary checks following the exchange of components, removal of equipment or change of software where these may affect safety functions (see also 6.3.1).
...
segue in allegato
Certifico Srl - IT | Rev. 1.0 2023
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 1.0 | 20.06.2023 | Aggiornamento normativo | Certifico Srl |
| 0.0 | 27.10.2022 | -- | Certifico Srl |
Collegati:
[box-note]UNI EN ISO 16090-1:2023
UNI EN ISO 16090-1: Sicurezza macchine utensili taglio a freddo metalli
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, transfer - P.1 Gruppi
Direttiva macchine 2006/42/CE
Norme armonizzate Direttiva macchine 2006/42/CE (DM)
D.Lgs. 81/2008 Testo Unico salute e sicurezza lavoro
https://tussl.it/[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer - P.2 Istruzioni Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
216 kB | 136 | ||
| UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer - P.2 Istruzioni Rev. 00 2022.pdf Certifico Srl - Rev. 0.0 2022 |
181 kB | 108 |
RAPEX Report 39 del 30/09/2022 N. 25 A12/01341/22 Bulgaria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 39 del 30/09/2022 N. 25 A12/01341/22 Bulgaria
Approfondimento tecnico: Sedia
Il prodotto, di marca MILANO, mod. EMILIO, è stata sottoposto alla procedura di blocco dell’importazione perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tenica EN 12520:2015 - Mobili - Resistenza, durata e sicurezza - Requisiti per sedute domestiche.
La sedia ha una resistenza insufficiente e potrebbe rompersi durante l’uso.
La sedia deve essere sottoposta alle prove descritte nella norma tecnica EN 1728:2012.
A seguito delle prove i requisiti di resistenza e durata sono soddisfatti quando:
a) non vi sono rotture in alcun elemento, giunto o componente;
b) non vi è allentamento dei giunti che devono essere rigidi;
c) la seduta svolge le sue funzioni dopo la rimozione dei carichi di prova;
d) la seduta soddisfa i requisiti di stabilità.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 39 del 30_09_2022 N. 25 A12_01341_22 Bulgaria.pdf Sedia |
105 kB | 0 |
Circolare Min. della Salute n. 73279 dell'11 Ottobre 2022
Circolare Min. della Salute n. 73279 dell'11 Ottobre 2022 / Indicazioni in materia di vigilanza Dispositivi medici
ID 17871 | 18.10.2022 / In allegato circolare ed indicazioni
Il 28 settembre è entrato in vigore il decreto legislativo 5 agosto 2022, n.137 recante “Disposizioni per l'adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio, nonché per l'adeguamento alle disposizioni del regolamento (UE) 2020/561 del Parlamento europeo e del Consiglio, del 23 aprile 2020, che modifica il regolamento (UE) 2017/745 relativo ai dispositivi medici, per quanto riguarda le date di applicazione di alcune delle sue disposizioni ai sensi dell'articolo 15 della legge 22 aprile 2021, n. 53.” (22G00145) (GU Serie Generale n.214 del 13.09.2022), che all’articolo 10 dispone adempimenti per i fabbricanti di dispositivi medici e per gli operatori sanitari in caso di incidenti gravi, incidenti non gravi e reclami che vedono coinvolti dispositivi medici successivamente alla loro immissione sul mercato.
Nelle more dell’adozione dei decreti ministeriali attuativi previsti dal citato art. 10, si ritiene utile fornire indicazioni operative sulle modalità e tempistiche delle segnalazioni, inerenti ai dispositivi medici, di incidenti gravi, di incidenti diversi da quelli gravi, dei reclami, delle azioni correttive di sicurezza, nonché delle relazioni di sintesi periodiche e delle relazioni sulle tendenze.
Le indicazioni sono rivolte agli operatori economici (fabbricante, mandatario, importatore e distributore) e agli utilizzatori (operatore sanitario, utilizzatore profano e paziente).
...
Indicazioni in materia di vigilanza ai sensi degli artt. 87, 88, 89 e 90 del regolamento (UE) 2017/745 e dell’art.10 del decreto legislativo 5 agosto 2022, n.137
Il Ministero della salute, in qualità di Autorità competente per i dispositivi medici in Italia, tenuto conto di quanto previsto dal regolamento (UE) 2017/745 e dall’art.10 del decreto legislativo 5 agosto 2022, n.137, intende fornire indicazioni operative su modalità e tempistiche delle segnalazioni relative agli incidenti gravi, agli incidenti non gravi, ai reclami, alle azioni correttive di sicurezza, nonché alle relazioni di sintesi periodiche (c.d. Periodic Summary Report – PSR) e alle relazioni sulle tendenze (c.d. Trend Report).
La presente circolare è rivolta agli operatori economici (fabbricante, mandatario, importatore e distributore) e agli utilizzatori (operatore sanitario, utilizzatore profano e paziente).
Le indicazioni in materia di vigilanza riportate nella presente circolare si applicano ai dispositivi medici, dispositivi che non hanno destinazione d’uso medica elencati nell’allegato XVI del regolamento (UE) 2017/745, dispositivi su misura, dispositivi medici forniti a titolo gratuito, dispositivi medici oggetto di indagini PMCF di cui all’art.74 par.1 del regolamento (UE) 2017/745.
Le indicazioni riportate potranno essere oggetto di successiva revisione a seguito degli sviluppi operativi del sistema EUDAMED e della messa a regime del sistema informativo a supporto della rete della dispositivo- vigilanza di cui al Decreto Ministeriale 31 marzo 2022.
Preliminarmente, si riportano alcune definizioni utili ai fini della vigilanza di cui all’art. 2 del regolamento (UE) 2017/745 e art. 2 del decreto legislativo 5 agosto 2022, n.137:
- «operatore economico»: un fabbricante, un mandatario, un importatore, un distributore o la persona di cui all'articolo 22, paragrafi 1 e 3 del regolamento (UE) 2017/745;
- «fabbricante»: la persona fisica o giuridica che fabbrica o rimette a nuovo un dispositivo oppure lo fa progettare, fabbricare o rimettere a nuovo, e lo commercializza apponendovi il suo nome o marchio commerciale;
- «mandatario»: qualsiasi persona fisica o giuridica stabilita nell'Unione, che ha ricevuto e accettato dal fabbricante, avente sede fuori dall'Unione, un mandato scritto che la autorizza ad agire per conto del fabbricante in relazione a determinate attività con riferimento agli obblighi del medesimo ai sensi del presente regolamento;
- «importatore»: qualsiasi persona fisica o giuridica stabilita nell'Unione che immette sul mercato dell'Unione un dispositivo originario di un paese terzo;
- «distributore»: qualsiasi persona fisica o giuridica nella catena di fornitura, diversa dal fabbricante o dall'importatore, che mette a disposizione sul mercato un dispositivo, fino al momento della messa in servizio;
- «utilizzatore»: qualsiasi operatore sanitario o utilizzatore profano che utilizza un dispositivo;
- «utilizzatore profano»: una persona che non possiede qualifiche formali in un ambito pertinente dell'assistenza sanitaria o in una disciplina medica.
- «incidente»: qualsiasi malfunzionamento o alterazione delle caratteristiche o delle prestazioni di un dispositivo messo a disposizione sul mercato, compreso l'errore d'uso determinato dalle caratteristiche ergonomiche, come pure qualsiasi inadeguatezza nelle informazioni fornite dal fabbricante e qualsiasi effetto collaterale indesiderato;
- «incidente grave»: qualsiasi incidente che, direttamente o indirettamente, ha causato, può aver causato o può causare una delle seguenti conseguenze:
a. il decesso di un paziente, di un utilizzatore o di un'altra persona;
b. il grave deterioramento, temporaneo o permanente, delle condizioni di salute del paziente, dell'utilizzatore o di un'altra persona;
c. una grave minaccia per la salute pubblica;
- «grave minaccia per la salute pubblica»: un evento che potrebbe comportare un imminente rischio di decesso, un grave deterioramento delle condizioni di salute di una persona o una malattia grave che possa richiedere una tempestiva azione correttiva e che possa provocare un tasso significativo di morbilità o di mortalità umane o che è inusuale o inaspettata per quel dato luogo e momento;
- «azione correttiva»: un'azione volta a eliminare la causa di una non conformità potenziale o attuale o altre situazioni indesiderabili;
- «azione correttiva di sicurezza»: un'azione correttiva adottata da un fabbricante per motivi di ordine tecnico o medico al fine di prevenire o ridurre il rischio di incidenti gravi in relazione a un dispositivo messo a disposizione sul mercato;
- «avviso di sicurezza»: una comunicazione inviata da un fabbricante agli utilizzatori o ai clienti in relazione a un'azione correttiva di sicurezza.
- «reclamo»: comunicazione scritta, in formato elettronico o orale che dichiara carenze correlate a identità, qualità, durabilità, affidabilità, usabilità, sicurezza o prestazioni di un dispositivo medico o relative a un servizio che influisce sulle prestazioni di tali dispositivi medici.
________
Indice
1. INDICAZIONI PER GLI OPERATORI ECONOMICI
1.1 OBBLIGHI DEL FABBRICANTE
1.1.A SEGNALAZIONE DI INCIDENTI GRAVI
1.1.B SEGNALAZIONE DI INCIDENTI NON GRAVI O DI EFFETTI COLLATERALI INDESIDERATI ATTESI – TREND REPORT
1.1.C. SEGNALAZIONE DELLE AZIONI CORRETTIVE DI SICUREZZA
2. INDICAZIONI PER GLI UTILIZZATORI (OPERATORI SANITARI, UTILIZZATORI PROFANI E PAZIENTI)
2.1 SEGNALAZIONE DI INCIDENTI GRAVI E INCIDENTI NON GRAVI
2.1.A SEGNALAZIONI AL MINISTERO DELLA SALUTE
2.1.B. SEGNALAZIONI AL FABBRICANTE
2.2 RECLAMI
CONSERVAZIONE DEL DISPOSITIVO MEDICO COINVOLTO IN UN INCIDENTE
...
Fonte: Ministero della Salute
Collegati
[box-note]Dichiarazione di conformità UE Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare Min. della Salute n. 73279 11 Ottobre 2022.pdf |
737 kB | 29 |
Linee Guida per la vigilanza del mercato “Direttiva Macchine”
Linee Guida per la vigilanza del mercato “Direttiva Macchine” / Update Dicembre 2024
ID 17865 | Update Rev. 1.0 2024 / MIMIT 19.12.2024: In allegato Linee guida e Scheda segnalazione NC
INDICE
Introduzione
Iter procedurale
Note per la compilazione della segnalazione
INSIEME DI MACCHINE
ESEMPLARI UNICI
Istruzioni per la compilazione della segnalazione
DATI RELATIVI ALLA MACCHINA
DATI RELATIVI AL FABBRICANTE
DATI RELATIVI AL MANDATARIO
PERSONA AUTORIZZATA A COSTITUIRE IL FASCICOLO TECNICO
DATI IDENTIFICATIVI DEL LUOGO DOVE È STATA RINVENUTA
DATI IDENTIFICATIVI DI CHI HA FATTO L’ACCERTAMENTO
CIRCOSTANZA DELL’ACCERTAMENTO
DESCRIZIONE DELLA MACCHINA
DESCRIZIONE DETTAGLIATA DELLE SITUAZIONI DI PERICOLO
SEGNALAZIONE DI PRESUNTA NON CONFORMITÀ
1. VIOLAZIONE DELLE PROCEDURE DI IMMISSIONE SUL MERCATO
2. VIOLAZIONE DEI REQUISITI ESSENZIALI DI SICUREZZA DELL'ALLEGATO I
Modalità trasmissione della segnalazione al Ministero delle Imprese e del Made in Italy
Allegato I - Modulistica
Allegato II – Schema riassuntivo iter procedurale
[box-note]Update 08.01.2025
In allegato:
- Linee Guida vigilanza del mercato “Direttiva Macchine” Rev. 1 del 19.12.2024
Allegato I - Modulistica Rev. 1 del 19.12.2024
Allegato II – Schema riassuntivo iter procedurale Rev. 1 del 19.12.2024
- Linee Guida vigilanza del mercato “Direttiva Macchine” Rev. 0 del 11.10.2022
Allegato I - Modulistica
Allegato II – Schema riassuntivo iter procedurale[/box-note]
Introduzione
Il settore dei macchinari costituisce una parte fondamentale dell’industria metalmeccanica italiana nonché uno dei pilastri dell’economia dell’Unione Europea (UE). In tale contesto, la Direttiva Macchine definisce un quadro normativo armonizzato per l’immissione delle macchine sul mercato unico, garantendone la libera circolazione all’interno dell’UE e fornendo i requisiti essenziali che tali prodotti devono rispettare per garantire la tutela della salute e della sicurezza nonché salvaguardare gli ulteriori interessi pubblici connessi.
L’attività inerente le funzioni di controllo della conformità delle macchine e delle quasi-macchine, già immesse sul mercato, alle disposizioni di cui alla Direttiva 2006/42/CE (recepita in Italia con il d.lgs. n. 17/2010) e/o alla precedente Direttiva 98/37/CE - c.d. Direttiva Macchine - “(…) sono svolte dal Ministero dello sviluppo economico [oggi, Ministero delle Imprese e del Made in Italy] e dal Ministero del lavoro e delle politiche sociali, che operano (…) in coordinamento permanente fra loro” (cfr. art. 6, co.1 del d.lgs. n. 17/2010).
Il presente documento nasce dall’esigenza di ottimizzare la modalità di redazione e trasmissione delle segnalazioni che pervengono al Ministero delle Imprese e del Made in Italy dagli Organi di Vigilanza Territoriali (OVT)1 in merito alla presunta non rispondenza di macchinari industriali ai requisiti essenziali di sicurezza e tutela della salute (RES) di cui all’Allegato I alla Direttiva Macchine, a seguito delle attività ispettive svolte dai suddetti organi (cfr. art. 6 co. 3 del d.lgs. n. 17/2010).
Le presenti Linee Guida hanno come principale obiettivo quello di sensibilizzare i soggetti segnalanti sull’attività in parola, anche al fine di migliorare la qualità delle segnalazioni tramesse, nell’ottica di riorganizzazione e ottimizzazione dell’iter procedurale.
Il presente documento, pertanto, fornisce agli OVT indicazioni operative per l’espletamento delle proprie funzioni relativamente all’attività in parola, e fornisce un quadro sintetico dell’intero iter procedurale, nonché l’aggiornamento della specifica modulistica, necessaria alla trasmissione della segnalazione e delle relative note e istruzioni per la compilazione della stessa.
Iter procedurale
Ai sensi dell’art. 6, co. 3 del d.lgs. 17/2010 “qualora gli organi di vigilanza sui luoghi di lavoro e loro pertinenze, nell’espletamento delle loro funzioni ispettive in materia di salute e sicurezza sul lavoro, rilevino che una macchina marcata CE o una quasi-macchina, sia in tutto o in parte non rispondente a uno o più requisiti essenziali di sicurezza, ne informano immediatamente il Ministero dello sviluppo economico [Ministero delle Imprese e del Made in Italy] e il Ministero del lavoro e delle politiche sociali”.
Gli organi di vigilanza territorialmente competenti, pertanto, qualora constatino una presunta non rispondenza di una macchina (o di una quasi-macchina) ai requisiti essenziali di sicurezza di cui alla Direttiva Macchine, sono tenuti, ai sensi dell’art. 70 co. 4 del d.lgs. 81/08, ad inviare una segnalazione di presunta non conformità al Ministero delle Imprese e del Made in Italy utilizzando e compilando in tutte le sue parti il modello unificato riportato in Allegato I.
La segnalazione è oggetto di analisi preliminare da parte del Ministero delle Imprese e del Made in Italy, al fine di valutare la corretta compilazione della modulistica nonché la presenza della documentazione tecnica minima per l’attivazione dell’azione di Sorveglianza del mercato (Dichiarazione CE di conformità e marcatura CE, descrizione generale della macchina, con particolare riguardo alla situazione di pericolo, indicazione dei RES presunti non conformi e motivazioni a supporto, altro).
In caso di esito positivo, il Ministero delle Imprese e del Made in Italy avvia la c.d. Indagine Tecnica Preliminare (ITP) con la quale chiede al fabbricante di:
- trasmettere le parti del fascicolo tecnico connesse ai RES segnalati, assicurandone la conformità all’originale, coevi con l’anno di fabbricazione della macchina oggetto di segnalazione (nonché eventuali aggiornamenti a seguito di successive modifiche) che devono, comunque, comprendere:
-- il disegno complessivo della macchina, quotato, datato ed accompagnato, ove necessario, da una descrizione generale della macchina e dai disegni di dettaglio dei componenti interessati, corredati dalle note di calcolo e dai risultati dei test per la verifica della conformità delle macchine ai RES segnalati;
-- la documentazione relativa alla valutazione dei rischi effettuata, corredata dall’elenco dei RES applicabili alla macchina e dalle misure di protezione attuate per eliminare i pericoli identificati e ridurre i rischi;
-- la certificazione rilasciata da un Organismo Notificato (esame CE del tipo), nel caso in cui la macchina sia ricompresa nell’elenco di cui all’Allegato IV;
-- gli schemi dei circuiti di comando e le relative descrizioni di funzionamento;
-- l’elenco delle norme armonizzate ed eventuali altre specifiche tecniche applicate;
-- la dichiarazione CE di conformità e le istruzioni per l’uso, come previsto dalla Direttiva di prodotto applicabile;
-- ogni eventuale altra documentazione ritenuta utile al caso di specie;
- trasmettere le proprie motivate controdeduzioni ovvero indicare le azioni che intende adottare per la messa in conformità della macchina e di tutti gli esemplari della stessa immessi sul mercato nonché delle macchine similari caratterizzate dalla medesima gestione dei rischi segnalati per l’istruttoria;
- fornire l’elenco di tutte le macchine dello stesso modello immesse sul mercato.
Nel caso in cui il fabbricante, in riscontro alla nota di ITP, dichiari di non avere più a disposizione il fascicolo tecnico di costruzione della macchina necessario ai fini dell’accertamento dei RES segnalati, si possono manifestare due possibili scenari:
- nel caso in cui siano trascorsi più di dieci anni dalla data di fabbricazione della macchina o dell’ultima unità prodotta nel caso di fabbricazione in serie, in assenza della documentazione tecnica pertinente, non risulta possibile procedere all’accertamento tecnico dei RES segnalati e, pertanto, per quanto di competenza del Ministero delle Imprese e del Made in Italy la pratica viene archiviata e demandata all’OVT segnalante nonché al Coordinamento Tecnico Interregionale e all’Ispettorato Nazionale del Lavoro per gli adempimenti e le determinazioni di rispettiva competenza;
- nel caso in cui, al momento della richiesta da parte dell’Autorità, non siano trascorsi dieci anni dalla data di fabbricazione della macchina o dell’ultima unità prodotta nel caso di fabbricazione in serie la mancata presentazione della documentazione tecnica pertinente costituisce motivo per ritenere che la macchina sia non conforme alle disposizioni della Direttiva applicabile e, pertanto, si invita il fabbricante a porre in essere le azioni ritenute idonee a conformare la macchina ai RES accertati non conformi (cfr. Allegato VII, parte A, punto 3 della Direttiva 2006/2/CE, già Allegato V, punto 3, lett. b) della Direttiva 98/37/CE).
Conformemente a quanto previsto dall’art. 6, co. 2 del d.lgs. 17/2010, la documentazione esibita dal fabbricante viene trasmessa all’Istituto Nazionale per l’Assicurazione contro gli Infortuni sul Lavoro (INAIL) - Dipartimento Innovazioni Tecnologiche e Sicurezza degli Impianti prodotti e insediamenti antropici, per l’accertamento di carattere tecnico con l’emissione di un parere in ordine alla conformità della macchina - limitatamente alla situazione di pericolo segnalata e con riferimento ai RES indicati dall’OVT – sottoscritta dal funzionario referente della pratica, dal Responsabile dell’Unità Accertamenti Tecnici e dal Responsabile del Dipartimento.
Il predetto parere tecnico viene analizzato e approfondito in seno al Gruppo di Lavoro Macchine (GdL), istituito presso il Ministero delle Imprese e del Made in Italy e composto da rappresentanti del Ministero delle Imprese e del Made in Italy, del Ministero del Lavoro e delle Politiche Sociali, dell’INAIL, del Coordinamento Tecnico delle Regioni e dell’Ispettorato Nazionale del Lavoro, con l’emissione di un parere in ordine all’esito dell’accertamento tecnico in esame.
Tale parere, viene comunicato dal Ministero delle Imprese e del Made in Italy al fabbricante, all’OVT segnalante, al Ministero del Lavoro e delle Politiche Sociali, all’INAIL e, ove necessario, al Coordinamento Tecnico Interregionale e all’Ispettorato Nazionale del Lavoro, nonché all’Organismo Notificato che ha rilasciato la certificazione CE di tipo, nel caso di macchine comprese nell’Allegato IV. Nel caso di accertata conformità, la pratica viene archiviata ovvero, in caso di non conformità rilevata, si chiede al fabbricante di porre in essere tutte le azioni correttive necessarie per la conformazione della macchina e di tutti gli esemplari della stessa immessi e/o da immettere sul mercato, demandano all’OVT segnalante per le opportune determinazioni e gli adempimenti di propria competenza, anche in merito alla valutazione circa l’opportunità di verificare l’effettiva implementazione delle predette azioni correttive. Per completezza d’informazione, si riporta in Allegato II, uno schema riassuntivo dell’iter procedurale fin qui descritto.
Note per la compilazione della segnalazione
L’Allegato I al presente documento costituisce il modello unificato che i soggetti segnalanti sono tenuti ad utilizzare per la trasmissione della segnalazione di presunta non conformità. Preme specificare che, in considerazione del principio di presunzione di conformità di cui all’art. 4 del D.lgs. 17/2010, “le macchine provviste della marcatura CE e accompagnate dalla Dichiarazione CE di conformità i cui elementi sono previsti dall’allegato II, parte 1 sezione A (..)” sono ritenute rispondenti alle disposizioni di cui alla Direttiva Macchine e che “le macchine costruite in conformità di una norma armonizzata, il cui riferimento è stato pubblicato nella Gazzetta Ufficiale dell’Unione europea, si presumono conformi ai requisiti essenziali di sicurezza e di tutela della salute coperti da tale norma armonizzata”. Sulla base di quanto precede, tali elementi risultano essenziali per la trasmissione della segnalazione al Ministero delle Imprese e del Made in Italy e propedeutici all’attivazione dell’ITP, in quanto servono ad attestare che la macchina o la quasi-macchina di cui trattasi è presunta conforme a tutte (o a parte, per le quasi macchine) le disposizioni della Direttiva. Di seguito, vengono specificatamente riportate e descritte alcune casistiche comuni che necessitano di chiarimenti e indicazioni più dettagliate, al fine di facilitare e favorire l’invio di segnalazioni complete e pertinenti. Si precisa che, eventuali segnalazioni pervenute con modalità diverse da quelle previste o carenti dei dati e delle informazioni come specificati nell’Allegato I al presente documento, saranno dichiarate non procedibili e, pertanto, il Ministero delle Imprese e del Made in Italy non darà avvio all’iter procedurale.
...
[box-note]Decreto Legislativo 27 Gennaio 2010 n. 17
Art. 4 (Presunzione di conformità e norme armonizzate)
1. Le macchine provviste della marcatura ‘CE’ e accompagnate dalla dichiarazione CE di conformità, i cui elementi sono previsti dall’allegato II, parte 1 sezione A, sono ritenute rispondenti alle disposizioni del presente decreto legislativo.
2. Le macchine costruite in conformità di una norma armonizzata, il cui riferimento è stato pubblicato nella Gazzetta Ufficiale dell'Unione europea, si presumono conformi ai requisiti essenziali di sicurezza e di tutela della salute coperti da tale norma armonizzata.
3. I riferimenti delle norme nazionali che traspongono le norme armonizzate sono pubblicati, con decreto del Ministro dello sviluppo economico, nella Gazzetta Ufficiale della Repubblica italiana.
...
Art. 6 (Sorveglianza del mercato)
1. Riguardo alle macchine e alle quasi-macchine, già immesse sul mercato, le funzioni di autorità di sorveglianza per il controllo della conformità alle disposizioni del presente decreto legislativo, sono svolte dal Ministero dello sviluppo economico e dal Ministero del lavoro e delle politiche sociali, che operano attraverso i propri organi ispettivi in coordinamento permanente fra loro al fine di evitare duplicazioni dei controlli.
2. Le amministrazioni di cui al comma 1 si avvalgono per gli accertamenti di carattere tecnico, in conformità alla legislazione vigente e senza nuovi o maggiori oneri per il bilancio dello Stato, dell’Istituto superiore di prevenzione e sicurezza del lavoro (ISPESL).
3. Qualora gli organi di vigilanza sui luoghi di lavoro e loro pertinenze, nell’espletamento delle loro funzioni ispettive in materia di salute e sicurezza sul lavoro, rilevino che una macchina marcata CE o una quasi-macchina, sia in tutto o in parte non rispondente a uno o più requisiti essenziali di sicurezza, ne informano immediatamente il Ministero dello sviluppo economico e il Ministero del lavoro e delle politiche sociali.
4. Qualora sia constatato che una macchina provvista della marcatura «CE», accompagnata dalla dichiarazione CE di conformita' e utilizzata conformemente alla sua destinazione o in condizioni ragionevolmente prevedibili rischia di compromettere la salute o la sicurezza delle persone o, se del caso, degli animali domestici o dei beni, o, qualora applicabile, dell'ambiente, il Ministero dello sviluppo economico, con provvedimento motivato e notificato all'interessato, previa verifica dell'esistenza dei rischi segnalati, ordina il ritiro della macchina dal mercato, ne vieta l'immissione sul mercato ovvero la messa in servizio o ne limita la libera circolazione, indicando i mezzi di impugnativa avverso il provvedimento stesso ed il termine entro cui e' possibile ricorrere; gli oneri relativi al ritiro dal mercato delle macchine o ad altra limitazione alla loro circolazione sono a carico del fabbricante o del suo mandatario.
5. Qualora sia constatato, nel corso degli accertamenti di cui al comma 3, che una quasi-macchina, accompagnata dalla dichiarazione di incorporazione, già immessa sul mercato, non sia conforme alle disposizioni di cui al presente decreto legislativo, il Ministero dello sviluppo economico ne vieta l'immissione sul mercato, con provvedimento motivato e notificato all’interessato, con l’indicazione dei mezzi di impugnativa avverso il provvedimento stesso e del termine entro cui è possibile ricorrere.
6. Qualora le misure di cui ai commi 4 e 5 sono motivate da una lacuna delle norme armonizzate, il Ministero dello sviluppo economico, ove intenda mantenerle anche all’esito delle consultazioni di cui all’articolo 7, comma 2, avvia la procedura di cui all'articolo 5.
7. Il Ministero dello sviluppo economico comunica i provvedimenti di cui al presente articolo al Ministero del lavoro e delle politiche sociali ed agli organi segnalanti la presunta non conformità. Nel caso in cui la segnalazione pervenga da Organismi di vigilanza locali, quali ASL o ARPA, i provvedimenti sono comunicati anche ai competenti uffici regionali eventualmente tramite il coordinamento regionale di settore costituito nell’ambito di attività della Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano.
8. Il Ministero dello sviluppo economico coopera, secondo gli indirizzi dati dalla Commissione europea, con le autorità di sorveglianza del mercato degli altri Stati membri. [/box-note]
...
segue in allegato
Fonte: MIMIT
Collegati
[box-note]Decreto Legislativo 27 Gennaio 2010 n. 17
Direttiva macchine 2006/42/CE
Direttiva 98/37/CE
D.Lgs. 81/2008 Testo Unico Salute e Sicurezza Lavoro
www.tussl.it[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Linee Guida per la Vigilanza del Mercato – direttiva macchine Rev. 1.0 2024.pdf MIMIT 19.12.2024 |
401 kB | 98 | ||
| Allegato I - Modulistica.docx Linee Guida per la vigilanza del mercato “Direttiva Macchine” Rev. 1.0 2024 |
22 kB | 47 | ||
| Allegato II – Schema riassuntivo iter procedurale.pdf Linee Guida per la vigilanza del mercato “Direttiva Macchine”' Rev. 1.0 2024 |
537 kB | 55 | ||
| Linee Guida vigilanza del mercato “Direttiva Macchine” Rev. 0 del 11.10.2022.pdf |
1158 kB | 203 | ||
| Linee Guida vigilanza mercato “Direttiva Macchine” Rev. 0 del 11.10.22 - All. 2.pdf |
421 kB | 112 | ||
| Linee Guida vigilanza del mercato “Direttiva Macchine” Rev. 0 del 11.10.2022 - Allegato I.docx |
21 kB | 89 | ||
| Linee Guida vigilanza del mercato “Direttiva Macchine” Rev. 0 del 11.10.2022 - Allegato I.pdf |
441 kB | 102 |
Decreto interministeriale del 3 ottobre 2022
Decreto interministeriale del 3 ottobre 2022
ID 17807 | 10.10.2022
Individuazione delle tariffe da corrispondere al Ministero dello sviluppo Economico e al Ministero dell’interno da parte degli organismi di certificazione della conformità per il Regolamento (UE) 2016/426.
Il decreto individua le tariffe da corrispondere al Ministero dello sviluppo Economico e al Ministero dell’interno da parte degli organismi di certificazione della conformità per il Regolamento (UE) 2016/426 sugli apparecchi che bruciano carburanti gassosi (GAR).
Entrata in vigore: 05.10.2022
_______
Art. 1 Ambito di applicazione
1. Il presente decreto si applica, in attuazione dell'art.47, comma 4 della legge 6 febbraio 1996, n.52, alle attività effettuate dal Ministero dello Sviluppo Economico e dal Ministero dell’Interno, finalizzate all'autorizzazione, al rinnovo, all’estensione, alla riduzione o all’aggiornamento dei decreti e alla relativa notifica sul sistema informativo della Commissione europea NANDO, riferiti agli organismi di valutazione della conformità, di cui al Regolamento (UE) 2016/426 individuato nella Convenzione del 12 settembre 2020 citata in premessa tra i citati Ministeri e l’Ente Unico di accreditamento nazionale.
Art.2 Tariffe
Gli importi delle tariffe relative ai servizi di cui all’art. 1 del presente decreto da versare a favore del Ministero dello Sviluppo Economico sono indicate negli allegati I, II, III del presente decreto, che costituiscono parte del presente decreto.
Gli importi delle tariffe relative ai servizi di cui all’art. 1 del presente decreto da versare a favore del Ministero dell'Interno sono indicate nell’allegato IV che costituisce parte integrante del presente decreto.
Art. 3 Modalità di pagamento
Il pagamento degli importi dovuti per le attività relative al servizio reso ai sensi dell’art. 1 si effettua presso la Sezione di Tesoreria Provinciale dello Stato competente per territorio, in cui ha sede legale la società richiedente, ovvero tramite versamento presso il relativo conto corrente della Banca d’Italia.
Per la tariffa a favore del Ministero dello Sviluppo Economico, nella causale di versamento occorre specificare: il riferimento all'art.47 della legge 6 febbraio 1996, n.52; l’Amministrazione che effettua la prestazione; l’imputazione della somma al capitolo d’entrata 3592, capo XVIII, articolo 33; il Regolamento (UE) 2016/426 per il quale si richiede l'autorizzazione, il rinnovo, l’estensione, la riduzione o l’aggiornamento e la relativa notifica sul sistema informativo NANDO.
Per le tariffe a favore del Ministero dell’Interno, le somme spettanti sono versate sul capitolo di capo XIV, n.2439, art.34. <Proventi derivanti dalle tariffe versate per le procedure di certificazione e/o attestazioni finalizzate alla marcatura CE, da riassegnare al Ministero dell’interno ai sensi dell'art. 47, comma 3 della legge 6 febbraio 1996, n.52>. Nella causale di versamento il richiedente specifica il riferimento all'art.47 della legge 6 febbraio 1996 n.52 e al Regolamento (UE) 2016/426 per il quale si richiede l’autorizzazione, l’estensione, la riduzione o l’aggiornamento.
La Divisione competente della Direzione Generale per il Mercato, la Concorrenza, la Tutela del Consumatore e la Normativa Tecnica del Ministero dello Sviluppo Economico avvia l’attività istruttoria dell’istanza di rilascio, rinnovo, estensione, riduzione o l’aggiornamento delle autorizzazioni e la relativa notifica sul sistema informativo NANDO, subordinatamente all’avvenuto versamento degli importi dovuti, da comprovare, all’atto dell’istanza, mediante presentazione dell’attestazione di versamento.
L’Ufficio per la regolamentazione comunitaria – del Dipartimento dei Vigili del fuoco, del Soccorso pubblico e della Difesa civile – Direzione Centrale per la Prevenzione e la Sicurezza Tecnica – Ministero dell’interno, conclude l’istruttoria dietro attestazione di versamento di quanto dovuto a fini di rilascio del concerto.
Art. 4 Utilizzo dei proventi
1. I proventi derivanti dalle tariffe di cui agli allegati I, II, III e IV del presente decreto sono versati all'entrata del bilancio dello Stato, per essere riassegnati, con decreto del Ministro dell'economia e finanze, agli stati di previsione del Ministero dello sviluppo economico e del Ministero dell’interno sugli appositi capitoli destinati al funzionamento dei servizi preposti per lo svolgimento delle attività di autorizzazione e notifica degli organismi di valutazione della conformità.
Art. 5 Disposizioni transitorie e finali
1. Gli importi delle tariffe di cui agli allegati I, II e III sono soggetti ad aggiornamento almeno ogni biennio successivo alla data di entrata in vigore del presente decreto.
2. Gli importi delle tariffe di cui all’allegato IV per le prestazioni rese dal Corpo nazionale dei vigili del fuoco, sono soggetti a modifiche correlate con l’aggiornamento degli importi di cui al decreto del Ministro dell’interno del 2 marzo 2012.
Art. 6 Entrata in vigore
Il presente decreto viene pubblicato sui siti istituzionali del Ministero dello Sviluppo Economico e del Ministero dell’Interno, ai sensi dell’articolo 32, comma 1, della legge 18 giugno 2009, n.69 ed entra in vigore il giorno successivo alla sua pubblicazione.
...
Allegato I
Tariffa di rilascio dell’autorizzazione, rinnovo, estensione
L’importo dovuto per il rilascio dell’autorizzazione, il rinnovo, l’estensione della stessa e per la relativa notifica sul sistema informativo europeo NANDO è pari a: € 349,00 (trecentoquarantanove/00)
Allegato II
Tariffa di sospensione o rinuncia dell’autorizzazione
L’importo dovuto per la sospensione o per la rinuncia dell’autorizzazione su istanza dell’organismo e per la relativa denotifica sul sistema informativo europeo NANDO è pari a: € 222,92 (duecentoventidue/92).
Allegato III
Tariffa di modifica dei decreti di autorizzazione
L’importo dovuto per la modifica di decreti di autorizzazione a seguito di variazioni quali: cambio di sede legale/operativa, di indirizzo, di ragione sociale, di forma societaria, riduzione dell’autorizzazione e per la relativa notifica sul sistema informativo europeo NANDO è pari a: € 178,16 (centosettantotto/16).
Allegato IV
Tariffe inerenti i servizi prestati dal Corpo nazionale dei vigili del fuoco
|
Servizio |
Ore impiegate |
Importo (euro) |
|
Rilascio autorizzazione |
4 |
€ 200,00 |
|
Sospensione e rinuncia autorizzazione |
4 |
€ 200,00 |
|
Modifica dei decreti di autorizzazione |
3 |
€ 150,00 |
...
Collegati
[box-note]Regolamento GAR | Regolamento (UE) 2016/426[/box-note]
RAPEX Report 36 del 09/09/2022 N. 01 A11/00102/22 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 36 del 09/09/2022 N. 01 A11/00102/22 Polonia
Approfondimento tecnico: Pistola giocattolo
Il prodotto, di marca PRO KIDS, mod. 1208-1209 A252120, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2014+A1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
L'energia cinetica delle frecce espulse è troppo elevata, superando i livelli consentiti. Ciò può causare lesioni al bambino, in particolare agli occhi.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
[..] 8. La forma e la composizione dei proiettili e l’energia cinetica che questi possono generare all’atto del lancio da un giocattolo avente questa finalità devono essere tali da non comportare - tenuto conto della natura del giocattolo - alcun rischio per l’incolumità dell’utilizzatore o dei terzi. […]
In accordo alla norma tecnica EN 71-1:2014+A1:2018, i proiettili lanciati da un giocattolo, con un'energia cinetica superiore a 0,08 j, devono avere un'energia cinetica per unità di superficie non superiore a 2500 j/m2.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 36 del 09_09_2022 N. 01 A11_00102_22 Polonia.pdf Pistola giocattolo |
133 kB | 0 |
Circolare prot. n. 370/05 del 7 febbraio 2005
Circolare prot. n. 370/05 del 7 febbraio 2005
Oggetto: Decreto del Ministero delle Attività Produttive 1 dicembre 2004, n. 329.
In data 28 gennaio 2005 è stato pubblicato sulla Gazzetta Ufficiale (Serie Generale n.22) il decreto di cui all’oggetto, di attuazione dell’art. 19 del D. Lgs. n. 93/2000, la cui entrata in vigore è pertanto fissata al 12 febbraio 2005.
Disciplinando il predetto decreto ministeriale un ambito di verifiche e controlli finora svolti dall’ISPESL, con procedure tecnico amministrative di rilevante novità rispetto alle norme al momento in vigore, si è ritenuto opportuno emettere le Lettere Circolari tecniche n. 3/05, 4/05, 5/05, 6/05 tutte del 7/2/05, finalizzate a disciplinare in maniera omogenea e coerente con il succitato decreto n. 329, l’attività omologativa delle sedi territoriali dell’ISPESL.
Come riportato in premessa delle lettere circolari, le stesse sono state emesse, nelle more della pubblicazione delle Specifiche tecniche di esercizio previste dall’art. 3 del decreto in oggetto, allo scopo di non interrompere i servizi tecnici di prevenzione svolti dalle sedi territoriali, anche ai fini del controllo obbligatorio da esse svolto in relazione a prescrizioni di sicurezza afferenti a altre disposizioni di legge.
Si ritiene opportuno far rilevare come i soggetti previsti per le verifiche di cui al decreto ministeriale n. 329, denominati con la generica dizione di “soggetti verificatori” o “soggetti preposti” devono ritenersi al momento individuati esclusivamente nell’ISPESL e nelle ASL a seconda delle rispettive competenze, come espressamente richiamato nella premessa del testo del decreto con il riferimento al D.L. 30 giugno 1982 n. 390 convertito con modificazioni nella Legge 12 agosto 1982 n. 597 “Disciplina delle funzioni prevenzionali ed omologative delle Unità Sanitarie Locali e dell’Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro”.
Si comunica infine che le circolari n. 40/02 (np.7563 del 1.7.02), n. 30/03 (np.5026 del 26.5.03) e le lettere circolari np.8528 del 17.7.02 e np.1780 del 24.5.04, emesse nelle more della pubblicazione del DM 1 dicembre 2004 n. 329, sono da considerarsi a tutti gli effetti abrogate.
In particolare in relazione alla lettera circolare np.8528 del 17.7.02, relativa alle riparazioni e modifiche di apparecchi omologati Ispesl, i relativi contenuti potranno essere applicati alle richieste di riparazioni e modifiche pervenute all’ISPESL entro e non oltre il termine del 12 febbraio 2005. Si pregano i Direttori dei Dipartimenti periferici di inviare eventuali commenti ed osservazioni alle citate lettere circolari a questo Dipartimento via posta elettronica entro il 14/2/2005; che potranno essere esaminati a breve in una opportuna Commissione Tecnica Ispesl.
...
Collegati
[box-note]Circolare ISPESL Prot. N. 366/05 del 07/02/2005
Decreto Legislativo n. 93 del 25 Febbraio 2000
Decreto 1 dicembre 2004 n. 329
INAIL: Moduli e modelli relativi certificazione e verifica
Recipienti a pressione - Istruzioni prima verifica periodica d.m. 11 aprile 2011[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare prot. n. 370 del 7 febbraio 2005.pdf |
52 kB | 0 |
Circolare 2 marzo 2005 n. 12117
Circolare MAP 2 marzo 2005 n. 12117
ID 18307 | 07.12.2022
[box-warning]Illegittima
La Circolare è illegittima per la parte in cui è interpretabile che la messa in servizio (denuncia/verifica) possa essere effettuata da altri Soggetti ON o Ispettorato degli utilizzatori - anziché solo dell'INAIL (art.4, 5 e 6 del D.M. 01.12.2004, n.329).
All’atto della messa in servizio di un recipiente a pressione, l’utilizzatore invia comunicazione di messa in servizio dell’attrezzatura all’Inail.
Tale comunicazione si configura, ai sensi dell’art. 6 del d.m. 329/04, come dichiarazione di messa in servizio.
La suddetta dichiarazione deve essere inoltrata utilizzando la procedura telematica Inail di Certificazione e Verifica di Impianti e Attrezzature - CIVA. Il sistema provvede all’assegnazione di una matricola identificativa.[/box-warning]
Il decreto legislativo 25 febbraio 2000, n. 93, attuativo della direttiva 97/23/CE (PED) ha sostituito la legislazione previgente. La circolare di questa Amministrazione n. 12117 del 2 marzo 2005 (Gazzetta Ufficiale n. 58 dell'11 marzo 2005) ha chiarito alcuni aspetti relativi alla legislazione pregressa.
Tuttavia a seguito della pubblicazione del regolamento 1° dicembre 2004, n. 329 (Supplemento ordinario alla Gazzetta Ufficiale n. 22 del 28 gennaio 2005) sono sorti alcuni problemi interpretativi circa l'individuazione dei soggetti preposti alle verifiche periodiche successive alla prima, quando l'attuale legislazione lo prescrive.
Al riguardo si osserva che l'art. 5, comma 1, lettera d), considera la possibilita' che, quando richiesto, il controllo della messa in servizio - prima verifica - possa essere effettuato, a determinate condizioni, da un organismo notificato o da un ispettorato degli utilizzatori.
Il richiamo allo stesso punto d) di una documentazione da trasmettere per verificare l'efficienza degli accessori di sicurezza e dei dispositivi di controllo, presuppone un esame del progetto dell'insieme in quanto elemento indispensabile per una valutazione tecnica.
Il rispetto delle condizioni di funzionamento fissate dal progetto, e' contemplato altresi' all'art. 6, comma 4, come obbligo da parte dell'utilizzatore.
In questo quadro di applicazione della legislazione derivante dalla direttiva 87/404/CEE; 90/408/CEE e 97/23/CEE, le verifiche periodiche a diverso titolo contemplate negli articoli 9, 10, 11, 12 e 14 nonche' le verifiche di funzionamento in occasione delle verifiche periodiche o le verifiche conseguenti ad una attivita' di riparazione, configurano un'attivita' che si puo' comparare alla prima verifica e richiede simile livello di professionalita' da parte dei tecnici di parte terza utilizzati.
Pertanto nelle more della emanazione di un apposito regolamento che espliciti in forma piu' specifica i soggetti preposti citati dal regolamento 1° dicembre 2004, n. 329, definendone le caratteristiche, gli organismi notificati e gli ispettorati degli utilizzatori, gia' individuati ai sensi degli articoli 12 e 14 del decreto legislativo 25 febbraio 2000, n. 93, possono operare come soggetto verificatore.
L'ISPESL come organismo notificato puo' operare liberamente sul mercato alla stregua di altri soggetti notificati.
Restano ovviamente invariate le competenze delle unita' sanitarie locali, delle aziende sanitarie locali e delle ARPA derivando le stesse da una normativa specifica non vincolata al precedente quadro legislativo sulle attrezzature a pressione.
...
Collegati
[box-note]Circolare ISPESL Prot. N. 366/05 del 07/02/2005
Decreto Legislativo n. 93 del 25 Febbraio 2000
Decreto 1 dicembre 2004 n. 329
INAIL: Moduli e modelli relativi certificazione e verifica
Recipienti a pressione - Istruzioni prima verifica periodica d.m. 11 aprile 2011[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare 2 marzo 2005 n. 12117.pdf |
40 kB | 3 |
Linee guida nuova direttiva ATEX 2014/34/UE | Novembre 2022
Linee guida nuova direttiva ATEX 2014/34/UE / 4a Edizione Novembre 2022
ID 18304 | 07.12.2022 / In allegato Linee guida Direttiva ATEX
4rd Edition November 2022
Guida alla applicazione della direttiva 2014/34/UE del Parlamento europeo e del Consiglio, del 26 febbraio 2014, relativa all'armonizzazione della legge degli Stati membri relative agli apparecchi e sistemi di protezione destinati ad essere utilizzati in atmosfera potenzialmente esplosiva.
Queste Linee Guida ATEX sono destinate ad essere un manuale per tutte le parti direttamente o indirettamente interessate dalla direttiva 2014/34/UE, comunemente indicata come ATEX ("Atmosfere EXplosibles") direttiva di "prodotto", applicabile dal 20 aprile 2016, in sostituzione della precedente direttiva 94/9/CE applicabile dal 1 luglio 2003 fino al 19 aprile 2016.
L'Attenzione dei lettori è richiamata sul fatto che queste linee guida hanno il solo scopo di facilitare l'applicazione della direttiva 2014/34/UE, ed è la trasposizione nazionale pertinente del testo della direttiva che è giuridicamente vincolante.
Tuttavia, il documento rappresenta un punto di riferimento per garantire l'applicazione coerente della direttiva per tutte le parti interessate.
Le linee guida ATEX hanno lo scopo di contribuire a garantire la libera circolazione dei prodotti nell'ambito di applicazione della direttiva ATEX nell'Unione europea tra gli esperti Stati membri e le altre parti interessate.
_________
Versioni Precedenti:
3rd Edition May 2020
2nd Edition - December 2017
1st Edition - April 2016
Draft 0.4 - September 2015
Fonte: Commissione Europea
Collegati:
[box-note]Guida al passaggio dalla Direttiva ATEX 94/9/CE alla nuova Direttiva ATEX 2014/34/UE
Nuova Direttiva ATEX Prodotti 2014/34/UE
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Linee guida ATEX 2014 34 UE 4 edizione Novembre 2022.pdf 4a Edizione Novembre 2022 |
5631 kB | 233 |
ANSI B11.0 2020 | Allegato M - Istruzioni per l'uso
ANSI B11.0 2020 | Allegato M - Istruzioni per l'uso
ID 18300 | Rev. 0.0 del 07.12.2022 / Documento di approfondimento in allegato
Documento di approfondimento sul contenuto che un manuale di istruzioni di un prodotto, rientrante nel campo di applicazione della Direttiva 2006/42/CE, dovrebbe avere secondo quanto previsto dall’allegato M della norma ANSI B11.0 2020.
[panel]ANSI B11.0 2020 Safety of Machinery
Approved: 16 December 2019 by the American National Standards Institute[/panel]
Ogni prodotto rientrante nel campo di applicazione della Direttiva 2006/42/CE Macchine deve essere accompagnato dalle istruzioni per l’uso prima dell’immissione sul mercato e messa in servizio.
[panel]Articolo 5 - Direttiva 2006/42/CE
Immissione sul mercato e messa in servizio
1. Il fabbricante o il suo mandatario, prima di immettere sul mercato e/o mettere in servizio una macchina:
a) si accerta che soddisfi i pertinenti requisiti essenziali di sicurezza e di tutela della salute indicati dall'allegato I;
b) si accerta che il fascicolo tecnico di cui all'allegato VII, parte A, sia disponibile;
c) fornisce in particolare le informazioni necessarie, quali ad esempio le istruzioni;
d) espleta le appropriate procedure di valutazione della conformità ai sensi dell'articolo 12;
e) redige la dichiarazione CE di conformità ai sensi dell'allegato II, parte 1, sezione A, e si accerta che accompagni la macchina;
f) appone la marcatura «CE» ai sensi dell'articolo 16.
2. Il fabbricante o il suo mandatario, prima di immettere sul mercato una quasi-macchina, si accerta che sia stata espletata la procedura di cui all'articolo 13.
3. Il fabbricante o il suo mandatario, ai fini delle procedure di cui all'articolo 12, dispone o può usufruire dei mezzi necessari ad accertare la conformità della macchina ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato I.
4. Qualora le macchine siano disciplinate anche da altre direttive relative ad aspetti diversi e che prevedono l'apposizione della marcatura «CE», questa marcatura indica ugualmente che le macchine sono conformi alle disposizioni di queste altre direttive.
Tuttavia, nel caso in cui una o più di dette direttive lascino al fabbricante o al suo mandatario la facoltà di scegliere il regime da applicare durante un periodo transitorio, la marcatura «CE»[/panel]
Le istruzioni fornite dal Fabbricante dovranno essere conformi, relativamente al loro contenuto, a quanto previsto nell’allegato I, p. 1.7.4.2 della Direttiva 2006/42/CE.
[panel]Allegato I - Direttiva 2006/42/CE
[...]1.7.4.2. Contenuto delle istruzioni
Ciascun manuale di istruzioni deve contenere, se del caso, almeno le informazioni seguenti:
a) la ragione sociale e l'indirizzo completo del fabbricante e del suo mandatario;
b) la designazione della macchina, come indicato sulla macchina stessa, eccetto il numero di serie (cfr. punto 1.7.3);
c) la dichiarazione di conformità CE o un documento che riporta il contenuto della dichiarazione di conformità CE, i dati relativi alla macchina ma non necessariamente il numero di serie e la firma;
d) una descrizione generale della macchina;
e) i disegni, i diagrammi, le descrizioni e le spiegazioni necessari per l'uso, la manutenzione e la riparazione della macchina e per verificarne il corretto funzionamento;
f) una descrizione del o dei posti di lavoro che possono essere occupati dagli operatori;
g) una descrizione dell'uso previsto della macchina;
h) le avvertenze concernenti i modi nei quali la macchina non deve essere usata e che potrebbero, in base all'esperienza, presentarsi;
i) le istruzioni per il montaggio, l'installazione e il collegamento, inclusi i disegni e i diagrammi e i sistemi di fissaggio e la designazione del telaio o dell'installazione su cui la macchina deve essere montata;
j) le istruzioni per l'installazione e il montaggio volte a ridurre il rumore e le vibrazioni prodotti;
k) le istruzioni per la messa in servizio e l'uso della macchina e, se necessario, le istruzioni per la formazione degli operatori;
l) le informazioni in merito ai rischi residui che permangono, malgrado siano state adottate le misure di protezione integrate nella progettazione della macchina e malgrado le protezioni e le misure di protezione complementari adottate;
m) le istruzioni sulle misure di protezione che devono essere prese dall'utilizzatore, incluse, se del caso, le attrezzature di protezione individuale che devono essere fornite;
n) le caratteristiche essenziali degli utensili che possono essere montati sulla macchina;
o) le condizioni in cui la macchina soddisfa i requisiti di stabilità durante l'utilizzo, il trasporto, il montaggio, lo smontaggio, in condizioni di fuori servizio, durante le prove o le avarie prevedibili;
p) le istruzioni per effettuare in condizioni di sicurezza le operazioni di trasporto, movimentazione e stoccaggio, indicanti la massa della macchina e dei suoi vari elementi allorché devono essere regolarmente trasportati separatamente;
q) il metodo operativo da rispettare in caso di infortunio o avaria; se si può verificare un blocco, il metodo operativo da rispettare per permettere di sbloccare la macchina in condizioni di sicurezza;
r) la descrizione delle operazioni di regolazione e manutenzione che devono essere effettuate dall'utilizzatore nonché le misure di manutenzione preventiva da rispettare;
s) le istruzioni per effettuare in condizioni di sicurezza la regolazione e la manutenzione, incluse le misure
di protezione che dovrebbero essere prese durante tali operazioni;
t) le specifiche dei pezzi di ricambio da utilizzare, se incidono sulla salute e la sicurezza degli operatori;
u) le seguenti informazioni relative all'emissione di rumore aereo:
- il livello di pressione acustica dell'emissione ponderato A nei posti di lavoro, se supera 70 dB(A); se tale livello non supera 70 dB(A), deve essere indicato,
- il valore massimo della pressione acustica istantanea ponderata C nei posti di lavoro, se supera 63 Pa (130 dB rispetto a 20 µPa),
- il livello di potenza acustica ponderato A emesso dalla macchina, se il livello di pressione acustica dell'emissione ponderato A nei posti di lavoro supera 80 dB(A).
I suddetti valori devono essere o quelli misurati effettivamente sulla macchina in questione, oppure quelli stabiliti sulla base di misurazioni effettuate su una macchina tecnicamente comparabile e rappresentativa della macchina da produrre.
Quando si tratta di una macchina di grandissime dimensioni, invece del livello di potenza acustica ponderato A possono essere indicati livelli di pressione acustica dell'emissione ponderati A in appositi punti intorno alla macchina.
Allorché non sono applicate le norme armonizzate, i dati acustici devono essere misurati utilizzando il codice di misurazione più appropriato adeguato alla macchina. Ogniqualvolta sono indicati i valori dell'emissione acustica, devono essere specificate le incertezze relative a tali valori. Devono essere descritte le condizioni di funzionamento della macchina durante la misurazione e i metodi utilizzati per effettuarla.
Se il posto o i posti di lavoro non sono o non possono essere definiti, i livelli di pressione acustica ponderati A devono essere misurati a 1 m dalla superficie della macchina e a 1,60 m di altezza dal suolo o dalla piattaforma di accesso. Devono essere indicati la posizione e il valore della pressione acustica massima.
Qualora vi siano specifiche direttive comunitarie che prevedono altre indicazioni per la misurazione del livello di pressione acustica o del livello di potenza acustica, esse vanno applicate e non si applicano le prescrizioni corrispondenti del presente punto;
v) se la macchina può emettere radiazioni non ionizzanti che potrebbero nuocere alle persone, in particolare se portatrici di dispositivi medici impiantabili attivi o non attivi, le informazioni riguardanti le radiazioni emesse per l'operatore e le persone esposte. [...][/panel]
Istruzioni per l’uso norme armonizzate
In merito ai contenuti da riportare all’interno di un manuale di istruzioni, per prodotti rientranti in Direttiva 2006/42/CE, possono essere consultate, come riferimento ufficiale, due norme armonizzate per la direttiva stessa:
- EN ISO 12100:2010 Sicurezza del macchinario - Principi generali di progettazione - Valutazione del rischio e riduzione del rischio
- EN ISO 20607:2019 Sicurezza del macchinario - Manuale di istruzioni - Principi generali di redazione
[...]
[...] 5 Contenuto e struttura del manuale di istruzioni
5.1 Generalità
Le informazioni essenziali e pertinenti per l’utilizzatore devono essere strutturate in un manuale di istruzioni (per un esempio, vedere prospetto 1). Il prospetto 1 non tiene conto di tutti i differenti gruppi di destinazione, ma rappresenta un modello informativo integrabile all’interno del manuale di istruzioni della macchina interessata. Partendo da questo punto, un redattore può creare un manuale di istruzioni per un particolare gruppo di destinazione. Non è necessario che un manuale di istruzioni per utilizzatore/operatore contenga tutte le sezioni del prospetto 1.
[...]
Istruzioni per l’uso | Altre norme
Un’altra norma che fornisce principi e requisiti generali per la redazione delle informazioni per l'uso dei prodotti è la EN IEC IEEE 82079-1:2020 “Preparazione di informazioni per l’uso (istruzioni per l’uso) dei prodotti Parte 1: Principi e prescrizioni generali”.
Nella tabella seguente viene riportato in sintesi l’elenco degli argomenti che le istruzioni d’uso dovrebbero contenere in accordo alla norma EN IEC IEEE 82079-1:2020.
[...]
Si ritiene a questo punto interessante il confronto di quanto sopra riportato con l’allegato M (Informazioni per l’uso – Schema contenuto del manuale) della norma ANSI B11.0 2020.
L’allegato M è stato aggiornato con l’edizione 2020 della ANSI B11.0.
Segue traduzione non ufficiale IT della norma ANSI B11.0 2020 - Allegato M.
Allegato M - Istruzioni per l’uso - Schema contenuti manuale
La tabella 21 riporta i capitoli generalmente presenti nei manuali delle macchine. I manuali devono contenere le seguenti o simili intestazioni di sezioni o capitoli, se applicabili. L'ordine delle informazioni mostrato di seguito è consigliato ma non obbligatorio. Il manuale dovrebbe contenere informazioni sui rischi residui.
[...] segue in allegato
Fonti
ANSI B11.0 2020
Direttiva 2006/42/CE
IEC IEEE 82079-1:2019
ISO 20607:2019 Safety of machinery Instruction handbook
Certifico Srl - IT | Rev. 0.0 2022
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 0.0 | 07.12.2022 | --- | Certifico Srl |
Collegati
[box-note]ISO 20607:2019 Redazione manuale di istruzioni
Direttiva macchine: Il Manuale di Istruzioni, redazione e validazione
ANSI B11.0 e ISO 12100 Valutazione rischi macchine / Note
ANSI B11.0 2020 | Allegato N - Linee guida formazione operatore
EN IEC IEEE 82079-1:2020 | Istruzioni Per L’uso Di Un Prodotto
Focus EN ISO 12100: Come deve essere redatto il Manuale di Istruzioni
Certifico MIUM & MIA SUITE 2021
ANSI B11.0 2020
Direttiva 2006/42/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ANSI B11.0 2020 Allegato M - Istruzioni per l'uso Rev. 0.0 2022.pdf Certifico Srl - Rev. 0.0 2022 |
234 kB | 122 |
Regolamento di esecuzione (UE) 2022/2347
Regolamento di esecuzione (UE) 2022/2347
ID 18254 | 02.12.2022
Regolamento di esecuzione (UE) 2022/2347 della Commissione del 1° dicembre 2022 recante modalità di applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda la riclassificazione di gruppi di determinati prodotti attivi che non hanno una destinazione d’uso medica
GU L 311/94 del 02.12.2022
Entrata in vigore: 22.12.2022
________
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
visto il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio, in particolare l’articolo 51, paragrafo 3, lettera b),
considerando quanto segue:
(1) Le regole di classificazione 9 e 10 relative ai dispositivi attivi di cui all’allegato VIII, punti 6.1 e 6.2, del regolamento (UE) 2017/745 fanno riferimento a una destinazione d’uso medica, rispettivamente a scopo terapeutico e diagnostico, e pertanto non possono essere applicate ai prodotti attivi che non hanno una destinazione d’uso medica di cui all’articolo 1, paragrafo 2, del suddetto regolamento. Tali prodotti rientrano pertanto nella classe I conformemente alla regola 13 di cui all’allegato VIII, punto 6.5, del regolamento (UE) 2017/745.
(2) Con lettera del 28 luglio 2022 alcuni Stati membri hanno chiesto congiuntamente la riclassificazione di diversi prodotti attivi che non hanno una destinazione d’uso medica in deroga all’allegato VIII del regolamento (UE) 2017/745 al fine di garantire un’adeguata valutazione della conformità di tali prodotti attivi che sia coerente con i relativi rischi intrinseci prima della loro immissione sul mercato.
(3) Secondo i dati scientifici disponibili sulle apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità di cui all’allegato XVI, punto 5, del regolamento (UE) 2017/745 destinate a essere utilizzate sul corpo umano, come laser e apparecchiature a luce pulsata ad alta intensità (intense pulsed light, «IPL»), l’uso di tali apparecchiature può causare effetti collaterali, ad esempio ustioni superficiali, infiammazione, dolore, alterazione della pigmentazione, eritema, formazione di cicatrici ipertrofiche e bolle. Gli effetti collaterali sono spesso indicati come temporanei, ad esempio le infiammazioni, ma sono segnalati anche effetti importanti e duraturi, quali le alterazioni della pigmentazione della pelle.
(4) Le apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità e che non hanno una destinazione d’uso medica destinate a essere utilizzate sul corpo umano per l’epilazione, come laser e apparecchiature IPL che forniscono energia al corpo umano o scambiano energia con il corpo umano o forniscono energia che sarà assorbita dal corpo umano, dovrebbero pertanto rientrare nella classe IIa. Tale classificazione corrisponde anche alla classificazione dei dispositivi attivi analoghi che hanno una destinazione d’uso medica e il cui funzionamento e profilo di rischio sono simili a quelli delle apparecchiature che non hanno una destinazione d’uso medica in questione.
(5) Le apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità e che non hanno una destinazione d’uso medica destinate a essere utilizzate sul corpo umano per trattamento dermico, come laser o apparecchiature IPL per fotoringiovanimento cutaneo, rimozione di cicatrici, rimozione di tatuaggi o per trattamenti di nevi vinosi, emangiomi, teleangectasie e pigmentazioni dermiche che forniscono energia al corpo umano o scambiano energia con il corpo umano o forniscono energia che sarà assorbita dal corpo umano in forma potenzialmente pericolosa, tenuto conto della natura, della densità e del punto in cui è applicata l’energia, dovrebbero pertanto rientrare nella classe IIb. Tale classificazione corrisponde anche alla classificazione dei dispositivi attivi analoghi che hanno una destinazione d’uso medica e il cui funzionamento e profilo di rischio sono simili a quelli delle apparecchiature che non hanno una destinazione d’uso medica in questione.
(6) Secondo i dati scientifici disponibili sulle apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo di cui all’allegato XVI, punto 4, del regolamento (UE) 2017/745, quali apparecchiature per liposuzione, lipolisi con radiofrequenza, lipolisi ultrasonica, criolipolisi, laserlipolisi, lipolisi con infrarossi ed elettrostimolazione, terapia con onde d’urto acustiche o lipoplastica, l’utilizzo di tali prodotti può causare effetti collaterali, ad esempio infiammazione locale, eritema, ematoma e gonfiore. Gli effetti collaterali sono spesso indicati come temporanei, ma sono segnalati anche effetti importanti e duraturi, quali l’iperplasia adiposa paradossa a seguito di trattamento di criolipolisi. I suddetti prodotti dovrebbero pertanto rientrare nella classe IIb. Tale classificazione corrisponde anche alla classificazione dei dispositivi attivi terapeutici il cui funzionamento e profilo di rischio sono simili a quelli delle apparecchiature che non hanno una destinazione d’uso medica in questione, destinate a fornire energia al corpo umano o a scambiare energia con il corpo umano o a fornire energia che sarà assorbita dal corpo umano in forma potenzialmente pericolosa, tenuto conto della natura, della densità e del punto in cui è applicata l’energia.
(7) Secondo i dati scientifici disponibili sulle attrezzature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che attraversano il cranio per modificare l’attività neuronale del cervello di cui all’allegato XVI, punto 6, del regolamento (UE) 2017/745, come quelle per la stimolazione transcranica magnetica o la stimolazione transcranica elettrica, l’utilizzo di tali prodotti può causare effetti collaterali, ad esempio sviluppo cerebrale atipico, modelli anomali di attività cerebrale, aumento del consumo metabolico, stanchezza, ansia, irritabilità, cefalea, spasmi muscolari, tic, convulsioni, vertigini e irritazione della pelle nei punti di applicazione degli elettrodi. Sebbene le suddette attrezzature non siano chirurgicamente invasive, le correnti elettriche o i campi magnetici o elettromagnetici attraversano il cranio per modificare l’attività neuronale del cervello. Tali modifiche possono avere effetti duraturi e può essere difficile invertire gli eventuali effetti non previsti. I suddetti prodotti dovrebbero pertanto rientrare nella classe III.
(8) A seguito della riclassificazione a norma del presente regolamento, conformemente all’articolo 52 del regolamento (UE) 2017/745, un organismo notificato deve partecipare alla valutazione della conformità dei prodotti in questione per valutare e confermare che, tra i pertinenti requisiti generali di sicurezza e prestazione, il prodotto fornisca le prestazioni previste e che i rischi presentati dal prodotto siano stati eliminati o ridotti per quanto possibile.
(9) Il gruppo di coordinamento per i dispositivi medici è stato consultato.
(10) Le misure di cui al presente regolamento sono conformi al parere del comitato per i dispositivi medici,
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
In deroga all’allegato VIII, punto 6.5, del regolamento (UE) 2017/745 i seguenti gruppi di prodotti attivi che non hanno una destinazione d’uso medica elencati nell’allegato XVI di tale regolamento sono riclassificati come segue:
a) le apparecchiature che emettono radiazioni elettromagnetiche ad alta intensità di cui all’allegato XVI, punto 5, del regolamento (UE) 2017/745 destinate a essere utilizzate sul corpo umano per trattamento dermico sono riclassificate nella classe IIb, a meno che non siano destinate unicamente all’epilazione, nel qual caso sono riclassificate nella classe IIa;
b) le apparecchiature destinate a essere utilizzate per ridurre, rimuovere o distruggere il tessuto adiposo di cui all’allegato XVI, punto 4, del regolamento (UE) 2017/745 sono riclassificate nella classe IIb;
c) le attrezzature destinate alla stimolazione cerebrale che applicano correnti elettriche o campi magnetici o elettromagnetici che attraversano il cranio per modificare l’attività neuronale del cervello di cui all’allegato XVI, punto 6, del regolamento (UE) 2017/745 sono riclassificate nella classe III.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
...
Collegati
[box-note]Tavole di corrispondenza CEI UNI EN ISO 13485:2022 e Reg. (UE) 2017/745
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
ANSI B11.0 2020 | Allegato N - Linee guida formazione operatore
ANSI B11.0 2020 | Allegato N - Linee guida formazione operatore
ID 18242 | Rev. 0.0 del 02.12.2022 / Documento di approfondimento e questionario operatore in allegato
Documento di approfondimento sulla formazione degli operatori, per consentire ai Datori di Lavoro di soddisfare i loro obblighi in termini di formazione adeguata, mediante l’uso del questionario per la formazione (norma ANSI B11.0 2020 - Allegato N).
[box-info]ANSI B11.0 2020 Safety of Machinery
Approved: 16 December 2019 by the American National Standards Institute[/box-info]
In accordo al D.lgs. 81/08, il Datore di Lavoro deve provvedere alla formazione dei lavoratori in materia di salute e sicurezza e, in particolare, secondo quanto riportato all’art. 73, alla formazione sulle attrezzature di lavoro messe a disposizione.
[panel]D.lgs. 81/08
Art. 37 - Formazione dei lavoratori e dei loro rappresentanti
1. Il datore di lavoro assicura che ciascun lavoratore riceva una formazione sufficiente ed adeguata in materia di salute e sicurezza, anche rispetto alle conoscenze linguistiche, con particolare riferimento a:
a) concetti di rischio, danno, prevenzione, protezione, organizzazione della prevenzione aziendale, diritti e doveri dei vari soggetti aziendali, organi di vigilanza, controllo, assistenza;
b) rischi riferiti alle mansioni e ai possibili danni e alle conseguenti misure e procedure di prevenzione e protezione caratteristici del settore o comparto di appartenenza dell'azienda.
2. La durata, i contenuti minimi e le modalità della formazione di cui al comma 1 sono definiti mediante accordo in sede di Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano adottato, previa consultazione delle parti sociali, entro il termine di dodici mesi dalla data di entrata in vigore del presente decreto legislativo.
Entro il 30 giugno 2022, la Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano adotta un accordo nel quale provvede all’accorpamento, alla rivisitazione e alla modifica degli accordi attuativi del presente decreto in materia di formazione, in modo da garantire:
a) l’individuazione della durata, dei contenuti minimi e delle modalità della formazione obbligatoria a carico del datore di lavoro;
b) l’individuazione delle modalità della verifica finale di apprendimento obbligatoria per i discenti di tutti i percorsi formativi e di aggiornamento obbligatori in materia di salute e sicurezza sul lavoro e delle modalità delle verifiche di efficacia della formazione durante lo svolgimento della prestazione lavorativa.
3. Il datore di lavoro assicura, altresì, che ciascun lavoratore riceva una formazione sufficiente ed adeguata in merito ai rischi specifici di cui ai titoli del presente decreto successivi al I.
Ferme restando le disposizioni già in vigore in materia, la formazione di cui al periodo che precede è definita mediante l'accordo di cui al comma 2.
4. La formazione e, ove previsto, l'addestramento specifico devono avvenire in occasione:
a) della costituzione del rapporto di lavoro o dell'inizio dell'utilizzazione qualora si tratti di somministrazione di lavoro;
b) del trasferimento o cambiamento di mansioni;
c) della introduzione di nuove attrezzature di lavoro o di nuove tecnologie, di nuove sostanze e miscele pericolose.
5. L'addestramento viene effettuato da persona esperta e sul luogo di lavoro. L’addestramento consiste nella prova pratica, per l’uso corretto e in sicurezza di attrezzature, macchine, impianti, sostanze, dispositivi, anche di protezione individuale; l’addestramento consiste, inoltre, nell’esercitazione applicata, per le procedure di lavoro in sicurezza. Gli interventi di addestramento effettuati devono essere tracciati in apposito registro anche informatizzato.
6. La formazione dei lavoratori e dei loro rappresentanti deve essere periodicamente ripetuta in relazione all'evoluzione dei rischi o all'insorgenza di nuovi rischi.
7. Il datore di lavoro, i dirigenti e i preposti ricevono un’adeguata e specifica formazione e un aggiornamento periodico in relazione ai propri compiti in materia di salute e sicurezza sul lavoro, secondo quanto previsto dall’accordo di cui al comma 2, secondo periodo.
7-bis. La formazione di cui al comma 7 può essere effettuata anche presso gli organismi paritetici di cui all'articolo 51 o le scuole edili, ove esistenti, o presso le associazioni sindacali dei datori di lavoro o dei lavoratori.
7-ter. Per assicurare l’adeguatezza e la specificità della formazione nonché l’aggiornamento periodico dei preposti ai sensi del comma 7, le relative attività formative devono essere svolte interamente con modalità in presenza e devono essere ripetute con cadenza almeno biennale e comunque ogni qualvolta sia reso necessario in ragione dell’evoluzione dei rischi o all’insorgenza di nuovi rischi.
8. I soggetti di cui all'articolo 21, comma 1, possono avvalersi dei percorsi formativi appositamente definiti, tramite l'accordo di cui al comma 2, in sede di Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano.
9. I lavoratori incaricati dell'attività di prevenzione incendi e lotta antincendio, di evacuazione dei luoghi di lavoro in caso di pericolo grave ed immediato, di salvataggio, di primo soccorso e, comunque, di gestione dell'emergenza devono ricevere un'adeguata e specifica formazione e un aggiornamento periodico; in attesa dell'emanazione delle disposizioni di cui al comma 3 dell'articolo 46, continuano a trovare applicazione le disposizioni di cui al decreto del Ministro dell'interno in data 10 marzo 1998, pubblicato nel S.O. alla Gazzetta Ufficiale n. 81 del 7 aprile 1998, attuativo dell'articolo 13 del decreto legislativo 19 settembre 1994, n. 626.
10. Il rappresentante dei lavoratori per la sicurezza ha diritto ad una formazione particolare in materia di salute e sicurezza concernente i rischi specifici esistenti negli ambiti in cui esercita la propria rappresentanza, tale da assicurargli adeguate competenze sulle principali tecniche di controllo e prevenzione dei rischi stessi.
11. Le modalità, la durata e i contenuti specifici della formazione del rappresentante dei lavoratori per la sicurezza sono stabiliti in sede di contrattazione collettiva nazionale, nel rispetto dei seguenti contenuti minimi:
a) principi giuridici comunitari e nazionali;
b) legislazione generale e speciale in materia di salute e sicurezza sul lavoro;
c) principali soggetti coinvolti e i relativi obblighi;
d) definizione e individuazione dei fattori di rischio;
e) valutazione dei rischi;
f) individuazione delle misure tecniche, organizzative e procedurali di prevenzione e protezione;
g) aspetti normativi dell'attività di rappresentanza dei lavoratori;
h) nozioni di tecnica della comunicazione.
La durata minima dei corsi è di 32 ore iniziali, di cui 12 sui rischi specifici presenti in azienda e le conseguenti misure di prevenzione e protezione adottate, con verifica di apprendimento. La contrattazione collettiva nazionale disciplina le modalità dell'obbligo di aggiornamento periodico, la cui durata non può essere inferiore a 4 ore annue per le imprese che occupano dai 15 ai 50 lavoratori e a 8 ore annue per le imprese che occupano più di 50 lavoratori.
12. La formazione dei lavoratori e quella dei loro rappresentanti deve avvenire, in collaborazione con gli organismi paritetici, ove presenti nel settore e nel territorio in cui si svolge l'attività del datore di lavoro, durante l'orario di lavoro e non può comportare oneri economici a carico dei lavoratori.
13. Il contenuto della formazione deve essere facilmente comprensibile per i lavoratori e deve consentire loro di acquisire le conoscenze e competenze necessarie in materia di salute e sicurezza sul lavoro. Ove la formazione riguardi lavoratori immigrati, essa avviene previa verifica della comprensione e conoscenza della lingua veicolare utilizzata nel percorso formativo.
14. Le competenze acquisite a seguito dello svolgimento delle attività di formazione di cui al presente decreto sono registrate nel libretto formativo del cittadino di cui all'articolo 2, comma 1, lettera i), del decreto legislativo 10 settembre 2003, n. 276,e successive modificazioni, se concretamente disponibile in quanto attivato nel rispetto delle vigenti disposizioni. Il contenuto del libretto formativo è considerato dal datore di lavoro ai fini della programmazione della formazione e di esso gli organi di vigilanza tengono conto ai fini della verifica degli obblighi di cui al presente decreto.
14-bis. In tutti i casi di formazione ed aggiornamento, previsti dal presente decreto legislativo per dirigenti, preposti, lavoratori e rappresentanti dei lavoratori per la sicurezza in cui i contenuti dei percorsi formativi si sovrappongano, in tutto o in parte, è riconosciuto il credito formativo per la durata e per i contenuti della formazione e dell'aggiornamento corrispondenti erogati.
Le modalità di riconoscimento del credito formativo e i modelli per mezzo dei quali è documentata l'avvenuta formazione sono individuati dalla Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano, sentita la Commissione consultiva permanente di cui all'articolo 6. Gli istituti di istruzione e universitari provvedono a rilasciare agli allievi equiparati ai lavoratori, ai sensi dell'articolo 2, comma 1, lettera a), e dell'articolo 37, comma 1, lettere a) e b), del presente decreto, gli attestati di avvenuta formazione sulla salute e sicurezza sul lavoro.[/panel]
[panel]D.lgs. 81/08
Art. 73- Informazione, formazione e addestramento
1. Nell'ambito degli obblighi di cui agli articoli 36 e 37 il datore di lavoro provvede, affinché per ogni attrezzatura di lavoro messa a disposizione, i lavoratori incaricati dell'uso dispongano di ogni necessaria informazione e istruzione e ricevano una formazione e un addestramento adeguati, in rapporto alla sicurezza relativamente:
a) alle condizioni di impiego delle attrezzature;
b) alle situazioni anormali prevedibili.
2. Il datore di lavoro provvede altresì a informare i lavoratori sui rischi cui sono esposti durante l'uso delle attrezzature di lavoro, sulle attrezzature di lavoro presenti nell'ambiente immediatamente circostante, anche se da essi non usate direttamente, nonché sui cambiamenti di tali attrezzature.
3. Le informazioni e le istruzioni d'uso devono risultare comprensibili ai lavoratori interessati.
4. Il datore di lavoro provvede affinché i lavoratori incaricati dell'uso delle attrezzature che richiedono conoscenze e responsabilità particolari di cui all'articolo 71, comma 7, ricevano una formazione, informazione ed addestramento adeguati e specifici, tali da consentire l'utilizzo delle attrezzature in modo idoneo e sicuro, anche in relazione ai rischi che possano essere causati ad altre persone.
5. In sede di Conferenza permanente per i rapporti tra Stato, le regioni e le province autonome di Trento e di Bolzano sono individuate le attrezzature di lavoro per le quali è richiesta una specifica abilitazione degli operatori nonché le modalità per il riconoscimento di tale abilitazione, i soggetti formatori, la durata, gli indirizzi ed i requisiti minimi di validità della formazione e le condizioni considerate equivalenti alla specifica abilitazione.
5-bis. Al fine di garantire la continuità e l'efficienza dei servizi di soccorso pubblico e di prevenzione ed estinzione degli incendi, la formazione e l'abilitazione del personale del Corpo nazionale dei vigili del fuoco all'utilizzo delle attrezzature di cui al comma 5 possono essere effettuate direttamente dal Corpo nazionale medesimo, con le risorse umane, strumentali e finanziarie disponibili a legislazione vigente.[/panel]
[panel]D.lgs. 81/08
Art. 71 - Obblighi del datore di lavoro
1. Il datore di lavoro mette a disposizione dei lavoratori attrezzature conformi ai requisiti di cui all'articolo precedente, idonee ai fini della salute e sicurezza e adeguate al lavoro da svolgere o adattate a tali scopi che devono essere utilizzate conformemente alle disposizioni legislative di recepimento delle direttive comunitarie.
2. All'atto della scelta delle attrezzature di lavoro, il datore di lavoro prende in considerazione:
a) le condizioni e le caratteristiche specifiche del lavoro da svolgere;
b) i rischi presenti nell'ambiente di lavoro;
c) i rischi derivanti dall'impiego delle attrezzature stesse;
d) i rischi derivanti da interferenze con le altre attrezzature già in uso.
3. Il datore di lavoro, al fine di ridurre al minimo i rischi connessi all'uso delle attrezzature di lavoro e per impedire che dette attrezzature possano essere utilizzate per operazioni e secondo condizioni per le quali non sono adatte, adotta adeguate misure tecniche ed organizzative, tra le quali quelle dell'allegato VI.
4. Il datore di lavoro prende le misure necessarie affinché:
a) le attrezzature di lavoro siano:
1) installate ed utilizzate in conformità alle istruzioni d'uso;
2) oggetto di idonea manutenzione al fine di garantire nel tempo la permanenza dei requisiti di sicurezza di cui all'articolo 70 e siano corredate, ove necessario, da apposite istruzioni d'uso e libretto di manutenzione;
3) assoggettate alle misure di aggiornamento dei requisiti minimi di sicurezza stabilite con specifico provvedimento regolamentare adottato in relazione alle prescrizioni di cui all'articolo 18, comma 1, lettera z);
b) siano curati la tenuta e l'aggiornamento del registro di controllo delle attrezzature di lavoro per cui lo stesso è previsto.
5. Le modifiche apportate alle macchine quali definite all'articolo 1, comma 2, del decreto del Presidente della Repubblica 24 luglio 1996, n. 459, per migliorarne le condizioni di sicurezza in rapporto alle previsioni del comma 1, ovvero del comma 4, lettera a), numero 3), non configurano immissione sul mercato ai sensi dell'articolo 1, comma 3, secondo periodo, sempre che non comportino modifiche delle modalità di utilizzo e delle prestazioni previste dal costruttore.
6. Il datore di lavoro prende le misure necessarie affinché il posto di lavoro e la posizione dei lavoratori durante l'uso delle attrezzature presentino requisiti di sicurezza e rispondano ai principi dell'ergonomia.
7. Qualora le attrezzature richiedano per il loro impiego conoscenze o responsabilità particolari in relazione ai loro rischi specifici, il datore di lavoro prende le misure necessarie affinché:
a) l'uso dell'attrezzatura di lavoro sia riservato ai lavoratori allo scopo incaricati che abbiano ricevuto una informazione, formazione ed addestramento adeguati;
b) in caso di riparazione, di trasformazione o manutenzione, i lavoratori interessati siano qualificati in maniera specifica per svolgere detti compiti.
8. Fermo restando quanto disposto al comma 4, il datore di lavoro, secondo le indicazioni fornite dai fabbricanti ovvero, in assenza di queste, dalle pertinenti norme tecniche o dalle buone prassi o da linee guida, provvede affinché:
a) le attrezzature di lavoro la cui sicurezza dipende dalle condizioni di installazione siano sottoposte a un controllo iniziale (dopo l'installazione e prima della messa in esercizio) e ad un controllo dopo ogni montaggio in un nuovo cantiere o in una nuova località di impianto, al fine di assicurarne l'installazione corretta e il buon funzionamento;
b) le attrezzature soggette a influssi che possono provocare deterioramenti suscettibili di dare origine a situazioni pericolose siano sottoposte:
1. ad interventi di controllo periodici, secondo frequenze stabilite in base alle indicazioni fornite dai fabbricanti, ovvero dalle norme di buona tecnica, o in assenza di queste ultime, desumibili dai codici di buona prassi;
2. ad interventi di controllo straordinari al fine di garantire il mantenimento di buone condizioni di sicurezza, ogni volta che intervengano eventi eccezionali che possano avere conseguenze pregiudizievoli per la sicurezza delle attrezzature di lavoro, quali riparazioni, trasformazioni, incidenti, fenomeni naturali o periodi prolungati di inattività;
c) Gli interventi di controllo di cui alle lettere a) e b) sono volti ad assicurare il buono stato di conservazione e l'efficienza a fini di sicurezza delle attrezzature di lavoro e devono essere effettuati da persona competente.
9. I risultati dei controlli di cui al comma 8 devono essere riportati per iscritto e, almeno quelli relativi agli ultimi tre anni, devono essere conservati e tenuti a disposizione degli organi di vigilanza.
10. Qualora le attrezzature di lavoro di cui al comma 8 siano usate al di fuori della sede dell'unità produttiva devono essere accompagnate da un documento attestante l'esecuzione dell'ultimo controllo con esito positivo.
11. Oltre a quanto previsto dal comma 8, il datore di lavoro sottopone le attrezzature di lavoro riportate nell’allegato VII a verifiche periodiche volte a valutarne l’effettivo stato di conservazione e di efficienza ai fini di sicurezza, con la frequenza indicata nel medesimo allegato. Per la prima verifica il datore di lavoro si avvale dell’INAIL, che vi provvede nel termine di quarantacinque giorni dalla richiesta. Una volta decorso inutilmente il termine di quarantacinque giorni sopra indicato, il datore di lavoro può avvalersi, a propria scelta, di altri soggetti pubblici o privati abilitati secondo le modalità di cui al comma 13. Le successive verifiche sono effettuate su libera scelta del datore di lavoro dalle ASL o, ove ciò sia previsto con legge regionale, dall’ARPA, o da soggetti pubblici o privati abilitati che vi provvedono secondo le modalità di cui al comma 13. Per l’effettuazione delle verifiche l’INAIL può avvalersi del supporto di soggetti pubblici o privati abilitati. I verbali redatti all’esito delle verifiche di cui al presente comma devono essere conservati e tenuti a disposizione dell’organo di vigilanza. Le verifiche di cui al presente comma sono effettuate a titolo oneroso e le spese per la loro effettuazione sono poste a carico del datore di lavoro.
12. Per l'effettuazione delle verifiche di cui al comma 11, le ASL e l'ISPESL possono avvalersi del supporto di soggetti pubblici o privati abilitati. I soggetti privati abilitati acquistano la qualifica di incaricati di pubblico servizio e rispondono direttamente alla struttura pubblica titolare della funzione.
13. Le modalità di effettuazione delle verifiche periodiche di cui all'allegato VII, nonché i criteri per l'abilitazione dei soggetti pubblici o privati di cui al comma precedente sono stabiliti con decreto del Ministro del lavoro, della salute e delle politiche sociali e del Ministro del lavoro, della salute e delle politiche sociali, di concerto con il Ministro dello sviluppo economico, sentita la Conferenza permanente per i rapporti tra Stato, le regioni e le province autonome di Trento e di Bolzano, da adottarsi entro dodici mesi dalla data di entrata in vigore del presente decreto.
13-bis. Al fine di garantire la continuità e l'efficienza dei servizi di soccorso pubblico e di prevenzione ed estinzione degli incendi, il Corpo nazionale dei vigili del fuoco può effettuare direttamente le verifiche periodiche di cui al comma 11, relativamente alle attrezzature riportate nell'allegato VII di cui dispone a titolo di proprietà o comodato d'uso. Il Corpo nazionale dei vigili del fuoco provvede a tali adempimenti con le risorse umane, strumentali e finanziarie disponibili a legislazione vigente.
14. Con decreto del Ministro del lavoro, della salute e delle politiche sociali, di concerto con il Ministro dello sviluppo economico, d'intesa con la Conferenza permanente per i rapporti tra Stato, Regioni e province autonome di Trento e di Bolzano e sentita la Commissione consultiva di cui all'articolo 6, vengono apportate le modifiche all'allegato VII relativamente all'elenco delle attrezzature di lavoro da sottoporre alle verifiche di cui al comma 11.[/panel]
Anche il Fabbricante dovrebbe fornire, se necessario, delle istruzioni per la corretta formazione degli operatori in accordo al punto 1.7.4.2, lettera k) dell’allegato I della Direttiva 2006/42/CE.
[panel]Direttiva 2006/42/CE
Allegato I
[...] 1.7.4.2 Contenuto delle istruzioni
Ciascun manuale di istruzioni deve contenere, se del caso, almeno le informazioni seguenti:
a) la ragione sociale e l'indirizzo completo del fabbricante e del suo mandatario;
b) la designazione della macchina, come indicato sulla macchina stessa, eccetto il numero di serie (cfr. punto 1.7.3);
c) la dichiarazione di conformità CE o un documento che riporta il contenuto della dichiarazione di conformità CE, i dati relativi alla macchina ma non necessariamente il numero di serie e la firma;
d) una descrizione generale della macchina;
e) i disegni, i diagrammi, le descrizioni e le spiegazioni necessari per l'uso, la manutenzione e la riparazione della macchina e per verificarne il corretto funzionamento;
f) una descrizione del o dei posti di lavoro che possono essere occupati dagli operatori;
g) una descrizione dell'uso previsto della macchina;
h) le avvertenze concernenti i modi nei quali la macchina non deve essere usata e che potrebbero, in base all'esperienza, presentarsi;
i) le istruzioni per il montaggio, l'installazione e il collegamento, inclusi i disegni e i diagrammi e i sistemi di fissaggio e la designazione del telaio o dell'installazione su cui la macchina deve essere montata;
j) le istruzioni per l'installazione e il montaggio volte a ridurre il rumore e le vibrazioni prodotti;
k) le istruzioni per la messa in servizio e l'uso della macchina e, se necessario, le istruzioni per la formazione degli operatori;
l) le informazioni in merito ai rischi residui che permangono, malgrado siano state adottate le misure di protezione integrate nella progettazione della macchina e malgrado le protezioni e le misure di protezione complementari adottate;
m) le istruzioni sulle misure di protezione che devono essere prese dall'utilizzatore, incluse, se del caso, le attrezzature di protezione individuale che devono essere fornite;
n) le caratteristiche essenziali degli utensili che possono essere montati sulla macchina;
o) le condizioni in cui la macchina soddisfa i requisiti di stabilità durante l'utilizzo, il trasporto, il montaggio, lo smontaggio, in condizioni di fuori servizio, durante le prove o le avarie prevedibili;
p) le istruzioni per effettuare in condizioni di sicurezza le operazioni di trasporto, movimentazione e stoccaggio, indicanti la massa della macchina e dei suoi vari elementi allorché devono essere regolarmente trasportati separatamente;
q) il metodo operativo da rispettare in caso di infortunio o avaria; se si può verificare un blocco, il metodo operativo da rispettare per permettere di sbloccare la macchina in condizioni di sicurezza;
r) la descrizione delle operazioni di regolazione e manutenzione che devono essere effettuate dall'utilizzatore nonché le misure di manutenzione preventiva da rispettare;
s) le istruzioni per effettuare in condizioni di sicurezza la regolazione e la manutenzione, incluse le misure di protezione che dovrebbero essere prese durante tali operazioni;
t) le specifiche dei pezzi di ricambio da utilizzare, se incidono sulla salute e la sicurezza degli operatori;
u) le seguenti informazioni relative all'emissione di rumore aereo:
- il livello di pressione acustica dell'emissione ponderato A nei posti di lavoro, se supera 70 dB(A); se tale livello non supera 70 dB(A), deve essere indicato,
- il valore massimo della pressione acustica istantanea ponderata C nei posti di lavoro, se supera 63 Pa (130 dB rispetto a 20 μPa),
- l livello di potenza acustica ponderato A emesso dalla macchina, se il livello di pressione acustica dell'emissione ponderato A nei posti di lavoro supera 80 dB(A).
I suddetti valori devono essere o quelli misurati effettivamente sulla macchina in questione, oppure quelli stabiliti sulla base di misurazioni effettuate su una macchina tecnicamente comparabile e rappresentativa della macchina da produrre.
Quando si tratta di una macchina di grandissime dimensioni, invece del livello di potenza acustica ponderato A possono essere indicati livelli di pressione acustica dell'emissione ponderati A in appositi punti intorno alla macchina.
Allorché non sono applicate le norme armonizzate, i dati acustici devono essere misurati utilizzando il codice di misurazione più appropriato adeguato alla macchina. Ogniqualvolta sono indicati i valori dell'emissione acustica, devono essere specificate le incertezze relative a tali valori. Devono essere descritte le condizioni di funzionamento della macchina durante la misurazione e i metodi utilizzati per effettuarla.
Se il posto o i posti di lavoro non sono o non possono essere definiti, i livelli di pressione acustica ponderati A devono essere misurati a 1 m dalla superficie della macchina e a 1,60 m di altezza dal suolo o dalla piattaforma di accesso. Devono essere indicati la posizione e il valore della pressione acustica massima.
Qualora vi siano specifiche direttive comunitarie che prevedono altre indicazioni per la misurazione del livello di pressione acustica o del livello di potenza acustica, esse vanno applicate e non si applicano le prescrizioni corrispondenti del presente punto;
v) se la macchina può emettere radiazioni non ionizzanti che potrebbero nuocere alle persone, in particolare se portatrici di dispositivi medici impiantabili attivi o non attivi, le informazioni riguardanti le radiazioni emesse per l'operatore e le persone esposte.[/panel]
Non è previsto che il fabbricante fornisca il programma completo di formazione o un manuale di addestramento con le istruzioni. Tuttavia, le istruzioni possono riportare aspetti importanti da considerare durante la formazione dell’operatore, per consentire ai datori di lavoro di soddisfare i loro obblighi in termini di formazione adeguata degli operatori.
Oltre alle informazioni di base sulla formazione fornite con le istruzioni, taluni fabbricanti offrono anche un servizio di formazione dell’operatore agli utilizzatori.
Questi servizi non rientrano nel campo di applicazione della direttiva macchine.
L’ANSI B11.0 2020 stabilisce che il fornitore della macchina deve inserire delle informazioni nel manuale che l’utilizzatore possa usare per creare dei programmi di formazione (rif. cap. 10 Training). Nel caso in cui queste informazioni non siamo fornite con la macchina, l’utilizzatore dovrà creare ugualmente un programma di formazione adeguato a ridurre i rischi degli operatori che dovranno usarla.
Per aiutare l’utilizzatore nello sviluppo di un programma di formazione, l’allegato N della ANSI B11.0 2020 riporta un’utile linea guida.
Segue traduzione non ufficiale IT della norma ANSI B11.0 2020- Allegato N.
[...]
Allegato N
Linee guida generali per la formazione dell’operatore
Per la formazione dell’operatore si raccomanda di seguire i suggerimenti seguenti:
1. "Dillo all'operatore" - Chiedere all'operatore di leggere e comprendere il manuale. Fornire adeguate istruzioni verbali e scritte all'operatore o agli operatori. Valutare la comprensione dell'istruzione da parte dell'operatore prima di procedere.
2. "Mostra l'operatore" - Chiedere all'operatore o agli operatori di osservare un operatore o un supervisore esperto che utilizza l'apparecchiatura.
3. "Fai fare all'operatore" - Dopo che i passaggi 1 e 2 sono stati completati in modo soddisfacente, lasciare che l'operatore (o gli operatori) faccia funzionare l’attrezzatura sotto stretta supervisione.
[...]
Questionario per la formazione dell’operatore
Le seguenti domande generiche possono essere somministrate agli operatori delle macchine come strumento di analisi delle loro conoscenze. Questo questionario può essere somministrato per iscritto o oralmente. Le aziende possono ampliare questo contenuto di base con domande relative a specifici compiti o procedure. Si suggerisce di usare questo questionario durante la formazione iniziale dell'operatore e, in seguito, ogni anno.
La X indica le risposte corrette.
[...] segue in allegato
Fonti
ANSI B11.0 2020
D.lgs. 81/08
Direttiva 2006/42/CE
Certifico Srl - IT | Rev. 0.0 2022
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 0.0 | 02.12.2022 | --- | Certifico Srl |
Collegati
[box-note]ANSI B11.0 e ISO 12100 Valutazione rischi macchine / Note
EN ISO 12100: La sequenza per la Valutazione del Rischio e la documentazione prevista
Valutazione dei rischi EN ISO 12100: Esempio operativo
EN ISO 12100 e ISO/TR 14121-2: Esempio Valutazione del rischio
Direttiva macchine: Il Manuale di Istruzioni, redazione e validazione
Formazione generale sicurezza lavoratori
Certifico MIUM & MIA SUITE 2021
ANSI B11.0 2020
D.lgs. 81/08
Direttiva 2006/42/CE
www.tussl.it[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ANSI B11.0 2020 Allegato N - Questionario per la formazione dell’operatore Rev. 0.0 2022.docx Certifico Srl - Rev. 0.0 2022 |
24 kB | 203 | ||
| ANSI B11.0 2020 Allegato N - Linee guida formazione operatore Rev. 0.0 2022.pdf Certifico Srl - Rev. 0.0 2022 |
257 kB | 281 |
RAPEX Report 44 del 04/11/2022 N. 01 A11/00125/22 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 44 del 04/11/2022 N. 01 A11/00125/22 Finlandia
Approfondimento tecnico: Smerigliatrice angolare
Il prodotto, di marca Brücke, mod. S1M-HW03-115I, è stato sottoposto alla procedura che ne blocca la vendita perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE ed alla norma tecnica EN 60745-2-3:2011 “Utensili elettrici manuali a motore - Sicurezza”.
L'interruttore principale può staccarsi lasciando esposte le parti sotto tensione.
Direttiva 2006/42/CE
Allegato I
1.5.1. Energia elettrica
Se la macchina è alimentata con energia elettrica, essa deve essere progettata, costruita ed equipaggiata in modo da prevenire o da consentire di prevenire tutti i pericoli dovuti all'energia elettrica. Gli obiettivi di sicurezza fissati dalla Direttiva 73/23/CEE si applicano alle macchine.
Tuttavia gli obblighi concernenti la valutazione della conformità e l'immissione sul mercato e/o la messa in servizio di macchine in relazione ai pericoli dovuti all'energia elettrica sono disciplinati esclusivamente dalla presente direttiva.
Il punto 1.5.1 tratta i rischi dovuti all’uso dell’energia elettrica. L’energia elettrica può essere trasformata in energia meccanica da un motore elettrico o utilizzata, ad esempio, per generare calore o radiazioni per la lavorazione. L’elettricità statica è utilizzata anche in taluni processi quali, ad esempio, la verniciatura, la separazione di materiali o la precipitazione delle emissioni.
I rischi principali associati all’energia elettrica sono quelli di elettrocuzione dovuta al contatto diretto con elementi in tensione (contatto accidentale con elementi che sono normalmente in tensione) o al contatto indiretto (contatto con elementi che non sono normalmente in tensione ma lo sono a causa di un guasto), di ustione, incendio o esplosione dovuti a scintille elettriche o a causa del surriscaldamento delle attrezzature elettriche.
Il primo paragrafo del punto 1.5.1 prevede che il fabbricante della macchina adotti le misure necessarie per evitare tutti i pericoli di natura elettrica. Questo requisito generale si applica a prescindere dalla tensione dell’alimentazione elettrica.
La Direttiva 73/23/CEE è stata abrogata dalla Direttiva 2006/95/CE, a sua volta abrogata dalla Direttiva 2014/35/UE.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 44 del 04_11_2022 N. 01 A11_00125_22 Finlandia.pdf Smerigliatrice angolare |
101 kB | 0 |
Marchio UKCA: estensione del periodo di transizione al 31.12.2024
Marchio UKCA e marcatura CE: estensione del periodo di transizione al 31.12.2024
ID 18131 | 21.11.2022 / Comunicato in allegato
Il marchio UKCA è entrato in vigore il 1° gennaio 2021, tuttavia il governo britannico ha previsto un periodo di transizione per consentire alle aziende di conformarsi ai nuovi requisiti di marchio UKCA. Attualmente, la Gran Bretagna riconosce ancora il marchio CE come valido e le aziende possono continuare a immettere sul mercato del Regno Unito i propri prodotti e apparecchiature con marchio CE in base alle direttive UE applicabili.
Il 14 novembre 2022 il governo ha deciso di prorogare di due anni il termine del periodo transitorio (precedentemente fissato al 31 dicembre 2022). Secondo la nuova tempistica, la marcatura CE sarà accettata per immettere i prodotti sul mercato del Regno Unito fino al 31 dicembre 2024.
Ciò significa che dal 1° gennaio 2025 solo i prodotti con marchio UKCA potranno entrare nel mercato del Regno Unito.
...
Fonte: Gov.UK
Collegati
[box-note]Guidance UKCA marking: conformity assessment and documentation
Il marchio UKCA - Vademecum Dicembre 2021
Guida marcatura UKCA[/box-note]
RAPEX Report 42 del 21/10/2022 N. 08 A12/01464/22 Repubblica Popolare Cinese

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 42 del 21/10/2022 N. 08 A12/01464/22 Repubblica Popolare Cinese
Approfondimento tecnico: Sandali per bambini
Il prodotto, di marca R-Island, mod. X22302, è stato sottoposto alla procedura di divieto di commercializzazione perché non conforme Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il materiale plastico del prodotto contiene ftalato di diisobutile (DIBP), ftalato di dibutile (DBP) e bis(2-etilesil) ftalato (DEHP) (valori misurati rispettivamente pari a 0,65%, 15,8% e 20,9% in peso).
Questi ftalati possono nuocere alla salute dei bambini, provocando danni al loro sistema riproduttivo e al fegato.
Regolamento (CE) n .1907/2006
Allegato XVII | Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. Bis(2-etilesil) ftalato (DEHP) | Dibutilftalato (DBP) | Benzilbutilftalato (BBP) | Diisobutilftalato (DIBP)
1. Non possono essere utilizzati nei giocattoli e negli articoli di puericultura, come sostanze o in miscele, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
2. Non possono essere immessi sul mercato nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
Inoltre, il DIBP non può essere immesso sul mercato dopo il 7 luglio 2020 nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
3. Non possono essere immessi sul mercato dopo il 7 luglio 2020 in articoli, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato contenuto nell'articolo. […]
52. Diisononilftalato (DINP) | Diisodecilftalato (DIDP) | Ftalato di diottile (DNOP)
1. Non possono essere utilizzati come sostanze o in miscele in concentrazioni superiori allo 0,1 % in peso del materiale plastificato nei giocattoli e negli articoli di puericultura che possono essere messi in bocca dai bambini.
2. Tali giocattoli e articoli di puericultura contenenti tali ftalati in concentrazione superiore allo 0,1 % in peso del materiale plastificato non possono essere immessi sul mercato.
4. Ai fini della presente voce, per «articoli di puericultura» si intende qualsiasi prodotto destinato a conciliare il sonno, il rilassamento, l’igiene, il nutrimento e il succhiare dei bambini.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 42 del 21_10_2022 N. 08 A12_01464_22 Repubblica Popolare Cinese.pdf Sandali per bambini |
137 kB | 0 |
CEI UNI EN ISO 14971/A11:2022
CEI UNI EN ISO 14971/A11:2022 Dispositivi medici - Gestione dei rischi dispositivi medici (Variante A.11 RESS / P. Norma)
ID 18043 | 10.11.2022 / In allegato
La Variante A11 (2022 IT) della Norma CEI UNI EN ISO 14971:2021 contiene gli Allegati ZA e ZB che riportano rispettivamente la relazione tra questa Norma Europea e i requisiti generali di sicurezza e prestazione del regolamento (UE) 2017/745 e del regolamento (UE) 2017/746 che si intendono coprire.
Con la variante A11(2022), la norma è ora codificata come UNI CEI EN ISO 14971:2022 o CEI UNI EN ISO 14971:2022.
________
CEI UNI EN ISO 14971/A11:2022
Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici
Data Pubblicazione: 10.2022
Classificazione CEI: 62-121;V1
________
La presente Variante della Norma CEI UNI EN ISO 14971:2020 contiene gli Allegati ZA e ZB che riportano rispettivamente la relazione tra questa Norma Europea e i requisiti generali di sicurezza e prestazione del regolamento (UE) 2017/745 e del regolamento (UE) 2017/746 che si intendono coprire.
La presente Variante riporta la traduzione completa della EN ISO 14971/A11; la versione inglese è riportata nel fascicolo 18779E di agosto 2022.
________
APPENDICE ZA
RAPPORTO TRA LA PRESENTE NORMA EUROPEA E I REQUISITI GENERALI DI SICUREZZA E PRESTAZIONE DEL REGOLAMENTO (UE) 2017/745 DA SODDISFARE (informativa)
La presente norma europea è stata elaborata nell'ambito di una richiesta di normazione da parte della Commissione M/575 per fornire uno strumento di conformità volontario ai requisiti generali di sicurezza e prestazione del Regolamento (UE) 2017/745 del 5 aprile 2017 relativo ai dispositivi medici [GU L 117].
Una volta che la presente norma è stata citata nella Gazzetta Ufficiale dell'Unione Europea come rientrante in quel Regolamento, la conformità ai punti della presente norma elencati nell’appendice ZA.1 conferisce, entro i limiti dello scopo e campo di applicazione della presente norma, una presunzione di conformità con i corrispondenti requisiti generali di sicurezza e prestazione di tale Regolamento e regolamenti EFTA associati.
Per l'applicazione della presente norma europea ai sensi del Regolamento (EU) 2017/745,
1) il campo di applicazione è limitato ai dispositivi medici e agli accessori per dispositivi medici come definiti in tale Regolamento e ai prodotti regolamentati come dispositivi ai sensi di tale Regolamento;
2) in caso di differenze tra i termini definiti nella presente norma europea e quelli definiti nel Regolamento, prevalgono i termini definiti nel Regolamento;
3) la politica del fabbricante per la definizione dei criteri di accettabilità del rischio (vedere punto 4.2 della presente norma europea) deve garantire che i criteri siano conformi ai requisiti generali di sicurezza e prestazione di tale Regolamento.
Il prospetto ZA.1 contiene spiegazioni sulla corrispondenza tra la norma e i requisiti generali di sicurezza e prestazione.
...
Prospetto ZA.1
Corrispondenza tra la presente norma europea e l'Appendice I del Regolamento (UE) 2017/ 745 [OJ L 117]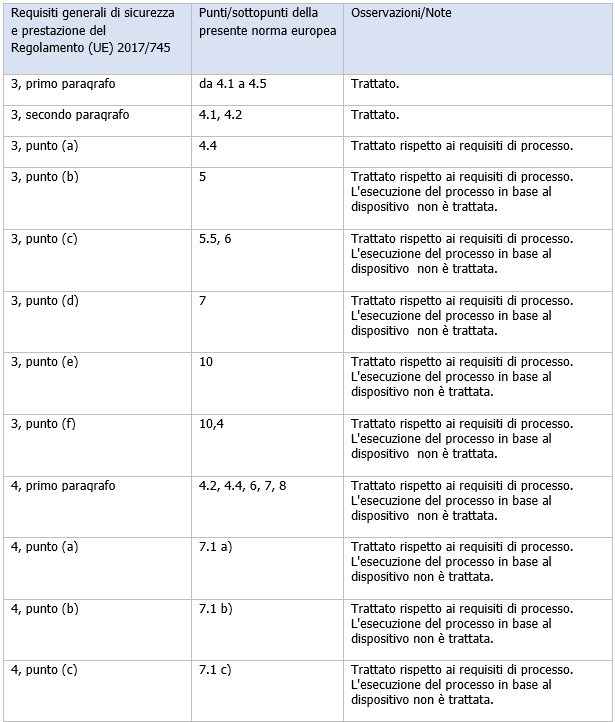
...
APPENDICE ZB
RAPPORTO TRA LA PRESENTE NORMA EUROPEA E I REQUISITI GENERALI DI SICUREZZA E PRESTAZIONE DEL REGOLAMENTO (UE) 2017/746 DA SODDISFARE (informativa)
La presente norma europea è stata elaborata in base alla richiesta di normazione della Commissione M/575 per fornire un mezzo volontario di conformità ai requisiti generali di sicurezza e prestazione del Regolamento (UE) 2017/746 del 5 aprile 2017 relativo ai dispositivi medici diagnostici in vitro [GU L 117].
...
Si veda documento completo:
Collegati
[box-note]Regolamento (UE) 2017/745
Regolamento (UE) 2017/746
UNI CEI EN ISO 14971:2022 - Gestione dei rischi dispositivi medici
UNI CEI EN ISO 14971:2020 | Dispositivi medici Gestione dei rischi
ISO 14971:2019
EN ISO 14971 Dispositivi medici: Gestione e Valutazione del rischio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| CEI UNI EN ISO 14971 Variante A11 2022.pdf Certifico Srl - Rev. 0.0 2022 |
175 kB | 52 |
RAPEX Report 41 del 14/10/2022 N. 39 A12/01425/22 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 41 del 14/10/2022 N. 39 A12/01425/22 Germania
Approfondimento tecnico: Cellulare per uso in atmosfera esplosiva
Il prodotto, di marca Realix, mod. RFEx1.1, è stato sottoposto alla procedura di ritiro dalla vendita online perché non conforme alla Direttiva 2014/34/UE del Parlamento Europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative agli apparecchi e sistemi di protezione destinati a essere utilizzati in atmosfera potenzialmente esplosiva ed alla norma tecnica EN 60079-11:2012 Atmosfere esplosive - parte 11: Apparecchiature con modo di protezione a sicurezza intrinseca «i».
Il dispositivo non soddisfa i requisiti di progettazione per la "Sicurezza intrinseca" richiesti per l'uso in atmosfere potenzialmente esplosive. La potenza erogata è eccessiva e la batteria non è sufficientemente protetta e questo aumenta il rischio di innesco di un’esplosione.
Direttiva 2014/34/UE
Allegato II
Requisiti essenziali in materia di salute e di sicurezza per la progettazione e la costruzione di apparecchi e sistemi di protezione destinati ad essere utilizzati in atmosfera potenzialmente esplosiva
[…] 1.0.1. Principi della sicurezza integrata contro le esplosioni
Gli apparecchi e i sistemi di protezione destinati ad essere utilizzati in atmosfera potenzialmente esplosiva
devono essere progettati secondo il principio della sicurezza integrata contro le esplosioni.
A tal fine il fabbricante prende le misure necessarie per:
- evitare anzitutto, per quanto possibile, che gli apparecchi e i sistemi di protezione producano o liberino essi stessi atmosfere esplosive,
- impedire l’innesco all’interno di un’atmosfera esplosiva tenendo conto della natura di ciascuna sorgente potenziale di innesco, elettrica e non elettrica,
- qualora, malgrado tutto, si produca un’esplosione che può mettere in pericolo persone e, eventualmente, animali domestici o beni con un effetto diretto o indiretto, soffocarla immediatamente e/o circoscrivere la zona colpita dalle fiamme e dalla pressione derivante dall’esplosione, secondo un livello di sicurezza sufficiente.
1.0.2. Gli apparecchi e i sistemi di protezione devono essere progettati e costruiti tenendo presenti eventuali difetti di funzionamento, per evitare al massimo le situazioni pericolose.
Qualunque uso errato, che sia ragionevolmente prevedibile, deve essere preso in considerazione.
[…] 1.3. Sorgenti potenziali di innesco di esplosione
1.3.1. Pericoli derivanti da varie sorgenti di innesco di esplosione
Si devono evitare sorgenti potenziali di innesco quali scintille, fiamme, archi elettrici, temperature superficiali elevate, emissioni di energia acustica, radiazioni ottiche, onde elettromagnetiche o altre sorgenti.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 41 del 14_10_2022 N. 39 A12_01425_22 Germania.pdf Cellulare per uso in atmosfera esplosiva |
111 kB | 0 |
RAPEX Report 40 del 07/10/2022 N. 27 A12/01367/22 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 40 del 07/10/2022 N. 27 A12/01367/22 Francia
Approfondimento tecnico: Lubrificante
Il prodotto, di marca Boeshield, mod. Boeshield T9, è stato sottoposto alle procedure di richiamo presso i consumatori e ritiro dal mercato perchè non conforme al al Regolamento (CE) n. 1272/2008 del Parlamento Europeo e del Consiglio del 16 dicembre 2008 relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le direttive 67/548/CEE e 1999/45/CE e che reca modifica al Regolamento (CE) n.1907/2006 REACH.
L'imballo non è provvisto di chiusure a prova di bambino, né di avvertenza tattile. Inoltre, l'etichetta non riporta la dicitura "Pericolo", né l'indicazione di pericolo "Può essere letale in caso di ingestione e di penetrazione nelle vie respiratorie". L’utilizzatore non è, quindi, adeguatamente informato sui pericoli in caso di aspirazione.
Regolamento (CE) n. 1272/2008
Titolo IV
Imballaggio
Articolo 35
Imballaggio
[...] Se contiene una sostanza o miscela conforme alle disposizioni dell'allegato II, punto 3.1.1, l'imballaggio è munito di una chiusura di sicurezza per i bambini conforme alle disposizioni dell'allegato II, punti 3.1.2, 3.1.3 e 3.1.4.2.
Se contiene una sostanza o miscela conforme alle disposizioni dell'allegato II, punto 3.2.1, l'imballaggio è munito di un'indicazione di pericolo riconoscibile al tatto conforme alle disposizioni dell'allegato II, punto 3.2.2.
ALLEGATO I
Disposizioni relative alla classificazione e all’etichettatura delle sostanze e delle miscele pericolose
[...] 3.10.4. Comunicazione del pericolo
3.10.4.1. Sull'etichetta delle sostanze o miscele che corrispondono ai criteri di classificazione in questa classe di pericolo figurano gli elementi indicati nella tabella 3.10.2.
Tabella 3.10.2 Tossicità in caso di aspirazione - Elementi dell’etichetta
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 40 del 07_10_2022 N. 27 A12_01367_22 Francia.pdf Lubrificante |
133 kB | 2 |
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, transfer - P.1 Gruppi
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.1 Suddivisione in gruppi
ID 17927 | Rev. 1.0 del 20.06.2023 / Documento in allegato
La UNI EN ISO 16090-1:2023 (tipo C ai sensi della EN ISO 12100:2010), specifica i requisiti tecnici di sicurezza e le misure di protezione per la progettazione, la costruzione e la fornitura delle macchine utensili utilizzate per il taglio a freddo di metalli e materiali non combustibili (alesatrici, fresatrici, centri di lavoro, macchine transfer e macchine speciali.
La norma non è armonizzata per la Direttiva macchine 2006/42/CE.
La UNI EN ISO 16090-1:2023 sostituisce la UNI EN ISO 16090-1:2019. Le principali novità della nuova edizione sono:
- introduzione nuove funzioni di sicurezza (Allegato J);
- modifica della MSO (modalità di funzionamento sicuro) in MO (modalità di funzionamento);
- introduzione obbligo uso di un comando di abilitazione nella modalità di funzionamento MO 3;
- aggiunta delle cabine operatore mobili.
Documento d'interesse per i Costruttori (Direttiva macchine 2006/42/CE) e Utilizzatori (D.Lgs. 81.2008).
Doc. 1. Suddivisione in gruppi
Questo primo Documento esamina la suddivisione in 4 gruppi delle macchine in relazione alle applicazioni ed ai relativi pericoli.
[box-note]Della norma UNI EN ISO 16090-1:2023 sono state elaborate due parti:
- UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.1 Suddivisione in gruppi
- UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer / Taglio a freddo metalli - P.2 Istruzioni[/box-note]
[box-note]UNI EN ISO 16090-1:2023
Sicurezza delle macchine utensili - Centri di lavoro, fresatrici, macchine transfer - Parte 1: Requisiti di sicurezza
La norma specifica i requisiti tecnici di sicurezza e le misure di protezione per la progettazione, la costruzione e la fornitura (inclusi l'installazione e lo smantellamento, le modalità di trasporto e manutenzione) di fresatrici fisse, incluse le macchine in grado di eseguire operazioni di alesatura, centri di lavoro e macchine transfer progettate per l'uso in produzione continua, che sono destinate a tagliare a freddo metalli e altri materiali non combustibili ad eccezione del legno o materiali con caratteristiche fisiche simili a quelle del legno come definito nella norma UNI EN ISO 19085-1, e vetro, pietra e materiali lapidei agglomerati come definiti nella UNI EN 14618. La norma si applica alle seguenti macchine:
a) alesatrici e fresatrici a comando manuale senza controllo numerico;
b) alesatrici e fresatrici a comando manuale con controllo numerico limitato;
c) centri di lavoro e fresatrici a controllo numerico;
d) macchine transfer e macchine per impieghi speciali;
e) macchine dotate dei seguenti dispositivi/attrezzature, i cui rischi sono stati affrontati:
- magazzino utensili;
- cambiautensili;
- meccanismi di movimentazione dei pezzi;
- meccanismo/i di bloccaggio del/dei pezzo alimentato/i;
- trasportatore/i di trucioli;
- porte ad azionamento elettrico;
- cabina/e operatore mobile/i;
- attrezzature aggiuntive per la tornitura;
- attrezzature aggiuntive per la molatura.[/box-note]
[...]
Estratto parti UNI EN ISO 16090-1:2023 specifiche per i gruppi.
Introduction
This document is a type-C standard as stated in ISO 12100.
This document is of relevance, in particular for the following stakeholder groups representing the market players with regard to machinery safety:
- machine manufacturers (small, medium and large enterprises);
- health and safety bodies (regulators, accident prevention organisations, market surveillance, etc.).
Others can be affected by the level of machinery safety achieved with the means of the document by the above-mentioned stakeholder groups:
- machine users/employers (small, medium and large enterprises);
- machine users/employees (e.g. trade unions, organizations for people with special needs);
- service providers, e.g. for maintenance (small, medium and large enterprises);
- consumers (in case of machinery intended for use by consumers).
The above-mentioned stakeholder groups have been given the possibility to participate at the drafting process of this document.
The machinery concerned and the extent to which hazards, hazardous situations or hazardous events are covered are indicated in the Scope of this document.
When requirements of this type-C standard are different from those stated in type-A or type-B standards, the requirements of this type-C standard take precedence over the requirements of the other standards for machines that have been designed and built according to the requirements of this type-C standard.
Machining centres, milling machines and transfer machines present a wide range of hazards. Protection of operators and other persons from contact with moving cutting tools, especially when being rapidly rotated in the spindle or being swung from a tool magazine to the spindle during power-operated tool changing, or from contact with fast–moving workpieces, is of great importance.
When power-operated mechanisms are provided for workpiece transfer, they can also create hazardous situations during loading/unloading and workpiece alignment, clamping or releasing of the workpiece.
The significant hazards covered by this document are those listed in Clause 4. The safety requirements and/or protective measures to prevent or minimize those hazards identified in Table 1 and procedures for verification of these requirements or measures are found in 5.17.
Figures D.1 to D.8 are examples only and are not intended to illustrate the only interpretation of the text.
1 Scope
This document specifies the technical safety requirements and protective measures for the design, construction and supply (including installation and dismantling, with arrangements for transport and maintenance) of:
- milling machines (see 3.1.1), including machines capable of performing boring operations (see 3.1.2);
- machining centres; and
- transfer machines (see 3.1.3)
designed for continuous production use, which are intended to cut cold metal and other noncombustible cold materials, except wood or materials with physical characteristics similar to those of wood as defined in ISO 19085-1 and glass, stone and engineered/agglomerated materials as defined in EN 14618.
This document covers the following machines (referred to as "machines" in this document):
a) manually, without numerical control, operated boring and milling machines (see 3.2.1, Group 1), e.g. knee and column type milling machines (see Figures C.1 and C.2);
b) manually, with limited numerical control, operated boring and milling machines (see 3.2.2, Group 2), e.g. profile and contouring milling machines (see Figures C.3 and C.4);
c) numerically controlled milling machines and machining centres (see 3.2.3, Group 3), e.g. automatic milling machines and milling centres, e.g. multi-spindle milling machines, gear-milling machines (see Figures C.5 to C.7);
d) transfer and special-purpose machines (see 3.2.4, Group 4), which are designed to process only pre-specified workpieces or limited range of similar workpieces by means of a predetermined sequence of machining operations and process parameters (see Figures C.8 to C.13).
e) machines fitted with the following devices/facilities, whose hazards have been dealt with:
- tool magazine(s);
- tool changer(s);
- workpiece handling mechanism(s);
- powered workpiece clamping mechanism(s);
- swarf/chip conveyor(s);
- power-operated door(s);
- moveable operator cabin(s);
- additional equipment for turning;
- additional equipment for grinding.
This document deals with all significant hazards, hazardous situations and events relevant to this type of machinery which can occur during transportation, assembly and installation, setting, operation, cleaning and maintenance, troubleshooting, dismantling or disabling according to ISO 12100, when the machinery is used as intended and under conditions of misuse which are reasonably foreseeable by the manufacturer (see Clause 4).
This document presumes accessibility to the machine from all directions and specifies access conditions to operator positions. It also applies to workpiece transfer devices including transport devices for loading/unloading when they form an integral part of the machine.
[...]
3.2 Groups of machines
With regard to the applications and the relevant hazards, machines are subdivided into four different groups.
3.2.1 Group 1 machine: Manually controlled boring and milling machine without numerical control
machine where axis motion is controlled by actuation of a mechanical handwheel or where powered single-axis motion is controlled by mechanical, electrical or other means but without the capability for programmed multiple axes movement
Note 1 to entry: For an illustration, see Figures C.1 and C.2.
3.2.2 Group 2 machine: Manually controlled boring and milling machine with limited numerical controlled capability
machine that can be operated like a Group 1 machine by the use of mechanical or electronic handwheelsor as a machine with limited NC capabilities which are not capable of automatic program start, automatic initiated tool change, unlimited rapid axis movement and automatic workpiece change or bar feed system
Note 1 to entry: For an illustration, see Figures C.3 and C.4.
Note 2 to entry: This group of machines can be equipped with some or all of the features of Group 1 machines (manual machines without NC) and a limited numeric control system (NC) that enables the machine to provide:
- a constant surface speed (CSS);
- an axis interpolation (i.e. copying/predefined profiling);
- thread cutting cycles.
3.2.3 Group 3 machine: Numerically controlled boring-, milling machine and machining centre
numerically controlled machine capable of performing programmed multiple axis movements
Note 1 to entry: For an illustration, see Figures C.5, C.6, and C.7.
Note 2 to entry: Such machines may incorporate facilities for manual control in varying degrees.
Note 3 to entry: Machining centres can accommodate different machining processes, e.g. turning, grinding, etc.
3.2.4 Group 4 machine: Numerical controlled transfer and special purpose machine
numerically controlled machine capable to process only pre-specified workpieces or family of workpieces by means of a pre-determined sequence of machining operations
Note 1 to entry: For illustration, see Annex C, Figures C.8 to C.13 and Figures D.7 to D.8.
[...]
5.2.4 Mode of operation (MO)
Table 2 assigns the various, in this document standardised, modes of operation (MO) to the machine groups defined in this document (Group 1 to Group 4 machines). Standardized modes of operation may be:
- inherent: the MO is, due to technical limitations or lack of automatic control capability, the only possible mode of operation;
- mandatory: the MO shall be provided;
- optional: the MO may be provided; or
- not allowed: the MO shall not be provided to operate a machine belonging to a particular group.
Table 2 - Overview of machine groups and modes of operation
If a machine provides more than one mode of operation, the machine shall be equipped with a MO selection system.
The selected MO shall be displayed on the machine according to 6.2.2.
[...]
Annex C
(informative)
Illustrative figures as examples of machines
C.1 Group 1 machines
See Figures C.1 and C.2.
Figure C.1 - Example of a horizontal knee-type milling machine
Figure C.2 - Example of a vertical knee-type machine
C.2 Group 2 machines
See Figures C.3 and C.4.
Figure C.3 - Example of a single column bed-type milling machine with vertical spindle
Figure C.4 - Example of a double column bed-type milling machine (portal milling machine)
[...]
Annex D
(informative)
Illustrative figures as examples of guards
D.1 Examples of adjustable guards for milling machined.es; Group 1 (manual machines)
See Figure D.1.
c) Guard for vertical milling machine
Figure D.1 - Examples of adjustable guards for manually controlled milling machines
D.2 Examples of guards for Group 2 machines (machines with limited NC capability)
See Figure D.2.
[...]
b) Hinged door type guard
[...]
Figure D.2 - Examples of guards for Group 2 milling machines
[...]
D.3 Examples of guards for Group 3 machines (automatic machines)
See Figure D.3 to D.6.
a) Guard open
[...]
Key
1 machine column (Y axis)
2 Y slide X slide (X axis)
3 slewing rotary table (SRT)/rigid table
4 cutting fluid system
5 machine enclosure
6 spindle head with motor spindle (Z axis)
7 electrical cubicle
8 tool change
9 cooling unit
10 control panel
Figure D.3 - Examples of guards for Group 3 machines (automatic machines)
...
segue in allegato
Certifico Srl - IT | Rev. 1.0 2023
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 1.0 | 20.06.2023 | Aggiornamento normativo | Certifico Srl |
| 0.0 | 25.10.2022 | -- | Certifico Srl |
Collegati:
[box-note]UNI EN ISO 16090-1:2023
UNI EN ISO 16090-1: Sicurezza macchine utensili taglio a freddo metalli
UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, transfer - P.2 Istruzioni
Direttiva macchine 2006/42/CE
Norme armonizzate Direttiva macchine 2006/42/CE (DM)
D.Lgs. 81/2008 Testo Unico salute e sicurezza lavoro
https://tussl.it/[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer - P.1 Gruppi Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
1165 kB | 160 | ||
| UNI EN ISO 16090-1 Sicurezza Centri di lavoro, fresatrici, macchine transfer - P.1 Gruppi Rev. 00 2022.pdf Certifico Srl - Rev. 0.0 2022 |
1390 kB | 168 |
Decreto Legislativo 12 ottobre 2022 n. 157
Decreto Legislativo 12 ottobre 2022 n. 157 / Vigilanza del mercato IT
Adeguamento della normativa nazionale alle disposizioni del regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio, del 20 giugno 2019, e semplificazione e riordino del relativo sistema di vigilanza del mercato.
(GU n.248 del 22.10.2022)
Entrata in vigore del provvedimento: 23/10/2022
________
Art. 1 Oggetto e finalita'
1. Le disposizioni del presente decreto sono adottate al fine di adeguare la normativa nazionale a quanto disposto dal regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio, del 20 giugno 2019, sulla vigilanza del mercato e sulla conformita' dei prodotti, soggetti alla normativa di armonizzazione dell'Unione europea di cui all'allegato I del medesimo regolamento, in attuazione della delega legislativa di cui all'articolo 30 della legge 5 agosto 2022, n. 118.
...
Art. 3. Autorità di vigilanza del mercato
1. Le autorità di vigilanza del mercato sono individuate, ai sensi dell’articolo 10 del regolamento, nel rispetto dei princìpi di competenza, adeguatezza, sussidiarietà, differenziazione e unitarietà dei processi decisionali, nelle autorità designate ai sensi della vigente disciplina normativa di recepimento delle norme europee di armonizzazione di cui all'allegato I al regolamento, come di seguito elencate:
a) il Ministero dello sviluppo economico, per le attivita' di cui all'allegato I del presente decreto;
b) il Ministero della salute, per le attivita' di cui all'allegato II del presente decreto;
c) il Ministero del lavoro e delle politiche sociali, per le attivita' di cui all'allegato III del presente decreto;
d) il Ministero dell'interno, per le attivita' di cui all'allegato IV del presente decreto;
e) il Ministero della transizione ecologica, per le attivita' di cui all'allegato V del presente decreto;
f) il Ministero delle infrastrutture e della mobilita' sostenibili, per le attivita' di cui all'allegato VI del presente decreto;
g) il Ministero delle politiche agricole alimentari e forestali, per le attivita' di cui all'allegato VII del presente decreto;
h) l'Ente nazionale per l'aviazione civile (ENAC), per le attivita' di cui all'allegato VIII del presente decreto.
2. Le autorita' di vigilanza del mercato svolgono le relative funzioni, ai sensi dell'articolo 3, numero 4, del regolamento, con i poteri di cui al capo V del medesimo regolamento e svolgono i controlli previsti dalla normativa armonizzata dell'Unione europea nell'ambito delle rispettive competenze, anche mediante i propri uffici territoriali, le autorita' incaricate del controllo di cui all'articolo 4 e gli altri enti ai quali e' demandato lo svolgimento delle attivita' di vigilanza. Restano ferme le attribuzioni delle autorita' di pubblica sicurezza, quali autorita' di controllo del mercato in materia di esplosivi per uso civile e articoli pirotecnici.
3. Le autorita' di vigilanza del mercato cooperano al fine dello svolgimento delle attivita' di rispettiva competenza, anche mediante lo scambio di informazioni, elementi o dati in proprio possesso. 4. I siti internet delle autorita' di vigilanza forniscono agli operatori e utilizzatori finali, senza ulteriori oneri e in un'apposita sezione facilmente individuabile, l'accesso relativo alle informazioni relative ai prodotti, alle procedure e alle normative applicabili. Sono fatte salve le disposizioni in materia di pubblica sicurezza.
...
segue in allegato
Collegati
[box-note]Regolamento (UE) 2019/1020
Legge 5 agosto 2022 n. 118[/box-note]
Decreto ministeriale 19 ottobre 2016
Decreto ministeriale 19 ottobre 2016
Decreto di individuazione delle tariffe a carico degli organismi di valutazione della conformità. (Convenzione del 06 luglio 2015 tra Ministero dello Sviluppo economico e Accredia e successivi rinnovi).
Tariffe per i servizi resi dal Ministero agli organismi di valutazione della conformità (Direttive europee di prodotto delegate ad Accredia).
RAPEX Report 38 del 23/09/2022 N. 05 A12/01322/22 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 38 del 23/09/2022 N. 05 A12/01322/22 Lituania
Approfondimento tecnico: Silicone sigillante
Il prodotto, di marca MANNOLO, mod. 991405, è stato sottoposto alla procedura di ritiro dal mercarto perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE ed al Regolamento (CE) n. 1272/2008 del Parlamento Europeo e del Consiglio del 16 dicembre 2008 relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le direttive 67/548/CEE e 1999/45/CE e che reca modifica al Regolamento (CE) n.1907/2006 REACH.
Secondo quanto riportato nella scheda di sicurezza, il prodotto contiene una concentrazione eccessiva di tris(2-metossietosi)vinilsilano (valore dichiarato: fino al 3%). Il tris(2-metossietossi)vinilsilano può essere nocivo per la fertilità ed al feto.
Il tris(2-metossietosi)vinilsilano è presente nell’elenco delle sostanze pericolose di cui all’allegato VI, parte 3 del Regolamento (CE) n. 1272/2008, ma non è indicato alcun limite entro il quale possa essere usato.
La sostanza è classificata nell’appendice 6 del Regolamento (CE) n. 1272/2008 come sostanza tossica per la riproduzione: categoria 1B.
Regolamento (CE) n.1907/2006 REACH
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
30. Sostanze classificate come tossiche per la riproduzione di categoria 1 A o 1B nella parte 3 dell'allegato VI del regolamento (ce) n. 1272/2008 ed elencate rispettivamente nell'appendice 5 o nell'appendice 6
Fatte salve le disposizioni di cui alle altre parti del presente allegato, alle voci da 28 a 30 si applicano le norme seguenti.
1. Non sono ammessi l’immissione sul mercato o l’uso:
- come sostanze,
- come componenti di altre sostanze, o
- nelle miscele,
per la vendita al pubblico quando la concentrazione singola nella sostanza o nella miscela è pari o superiore:
- al pertinente limite di concentrazione specifico indicato nell’allegato VI, parte 3, del regolamento (ce) n. 1272/2008, o
- al limite di concentrazione generico pertinente indicato nell'allegato I, parte 3, del regolamento (ce) n. 1272/2008.
Fatta salva l’applicazione di altre disposizioni comunitarie relative alla classificazione, all’imballaggio e all’etichettatura di sostanze e miscele, i fornitori devono garantire prima dell’immissione sul mercato che l’imballaggio di tali sostanze e miscele rechi in maniera visibile, leggibile ed indelebile la seguente dicitura:
«Uso ristretto agli utilizzatori professionali».
2. A titolo di deroga, il paragrafo 1 non si applica:
a) ai medicinali per uso umano o veterinario quali definiti nella direttiva 2001/82/CE e nella direttiva 2001/83/CE;
b) ai prodotti cosmetici quali definiti nella direttiva 76/768/CEE;
c) ai seguenti combustibili e prodotti derivati da olii minerali:
- ai combustibili per motori che sono soggetti alla direttiva 98/70/CE,
- agli articoli derivati dagli olii minerali, impiegati come combustibili o carburanti negli impianti di combustione mobili o fissi,
- ai combustibili venduti in sistemi chiusi (ad esempio: bombole di gas liquido);
d) ai colori per artisti di cui al regolamento (ce) n. 1272/2008;
e) alle sostanze elencate nell'appendice 11, colonna 1, per le applicazioni o gli usi elencati nell'appendice 11, colonna 2. Qualora nella colonna 2 dell'appendice 11 è specificata una data, la deroga si applica fino a tale data; f) ai dispositivi di cui al regolamento (UE) 2017/745.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 38 del 23_09_2022 N. 05 A12_01322_22 Lituania.pdf Silicone sigillante |
135 kB | 0 |
RAPEX Report 37 del 16/09/2022 N. 04 A11/00104/22 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 37 del 16/09/2022 N. 04 A11/00104/22 Ungheria
Approfondimento tecnico: Altalena in legno
Il prodotto LEAGAN MARE / NAGY HINTA, barcode 6426495929338, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-8:2018 “Sicurezza dei giocattoli - Parte 8: Giocattoli di attività per uso domestico”
Le funi sono fissate all’altalena con nodi che possono allentarsi facilmente.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
I. Proprietà fisico-meccaniche
[…] 11. I giochi di attività devono essere costruiti in modo da ridurre, per quanto possibile, il rischio di schiacciare parti del corpo, intrappolare parti del corpo o indumenti, nonché di cadute, di urti e di annegamento. In particolare, ogni superficie di tale giocattolo accessibile a uno o più bambini che vi giochino sopra, deve essere progettata in modo da sopportarne il peso. […]
In accordo alla norma tecnica EN 71-8:2018 non sono consentiti metodi di fissaggio che richiedono operazioni di annodamento. Sono consentiti solo:
1) sistemi non smontabili, nei quali uno smontaggio forzato provocherebbe la distruzione del prodotto, e
2) sistemi inviolabili, come saldature o arresto a iniezione.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 37 del 16_09_2022 N. 04 A11_00104_22 Ungheria.pdf Altalena in legno |
127 kB | 0 |
RAPEX Report 35 del 02/09/2022 N. 31 INFO/00119/22 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 35 del 02/09/2022 N. 31 INFO/00119/22 Germania
Approfondimento tecnico: Coperta per bambini
Il prodotto, di marca Queen West Trading Co., mod. 714019 e mod. 714022, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti.
Le dita di un bambino possono rimanere intrappolate in nodi e fili allentati o sfilacciati del prodotto. I fili possono attorcigliarsi attorno a parti del corpo causando l'intrappolamento delle dita delle mani e dei piedi o possono avvolgersi attorno al collo del bambino provocandone lo strangolamento. Il bambino può anche metterli in bocca e soffocare.
Direttiva 2001/95/CE
CAPO II
Obbligo generale di sicurezza, valutazione di conformità, criteri e norme europee
Articolo 3
1. I produttori sono tenuti ad immettere sul mercato soltanto prodotti sicuri.
2. Un prodotto è considerato sicuro, per quanto concerne gli aspetti disciplinati dalla pertinente normativa nazionale, quando in mancanza di disposizioni comunitarie specifiche che ne disciplinano la sicurezza, è conforme alle normative nazionali specifiche dello Stato membro nel cui territorio è commercializzato, che sono stabilite nel rispetto del trattato, in particolare degli articoli 28 e 30, e che fissano i requisiti cui deve rispondere il prodotto sul piano sanitario e della sicurezza per poter essere commercializzato.
Si presume che un prodotto sia sicuro, per quanto concerne i rischi e le categorie di rischi disciplinati dalla pertinente normativa nazionale, quando è conforme alle norme nazionali non cogenti che recepiscono le norme europee, i cui riferimenti sono stati pubblicati dalla Commissione nella Gazzetta ufficiale delle Comunità europee a norma dell'articolo 4. Gli Stati membri pubblicano i riferimenti di tali norme nazionali.
3. In circostanze diverse da quelle di cui al paragrafo 2, si valuta la conformità di un prodotto all'obbligo generale di sicurezza tenendo conto in particolare, se esistono, dei seguenti elementi:
a) norme nazionali non cogenti che recepiscono norme europee pertinenti diverse da quelle di cui al paragrafo 2;
b) norme in vigore nello Stato membro in cui il prodotto è commercializzato;
c) raccomandazioni della Commissione relative ad orientamenti sulla valutazione della sicurezza dei prodotti;
d) codici di buona condotta in materia di sicurezza dei prodotti vigenti nel settore interessato;
e) ultimi ritrovati della tecnica;
f) sicurezza che i consumatori possono ragionevolmente attendere.
4. La conformità di un prodotto ai criteri volti a garantire l'obbligo generale di sicurezza, in particolare alle disposizioni di cui ai paragrafi 2 o 3 non vieta alle autorità competenti degli Stati membri di adottare le opportune misure per limitarne l'immissione sul mercato o chiederne il ritiro dal mercato o il richiamo qualora, nonostante tale conformità, il prodotto si riveli pericoloso.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 35 del 02_09_2022 N. 31 INFO_00119_22 Germania.pdf Coperta per bambini |
133 kB | 0 |