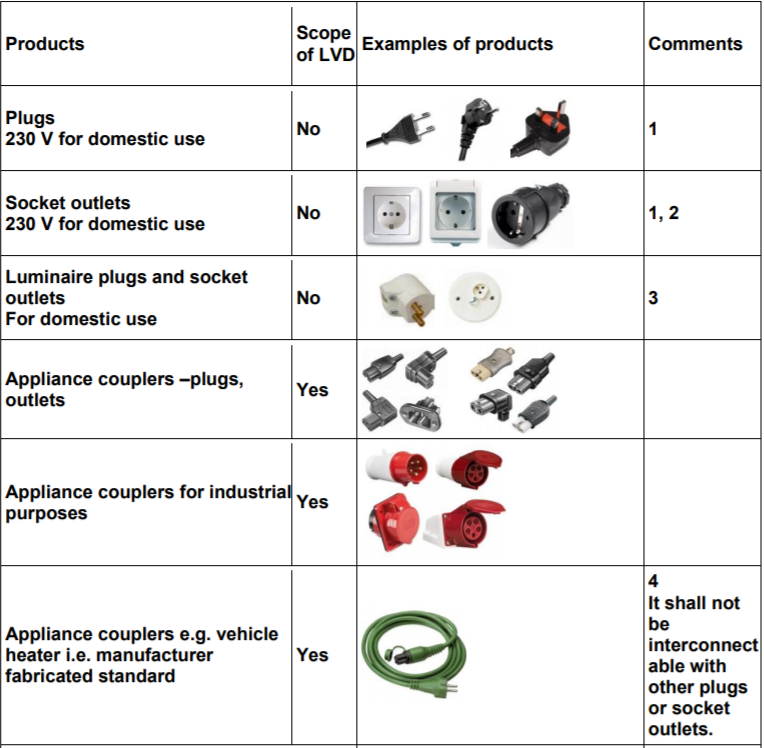
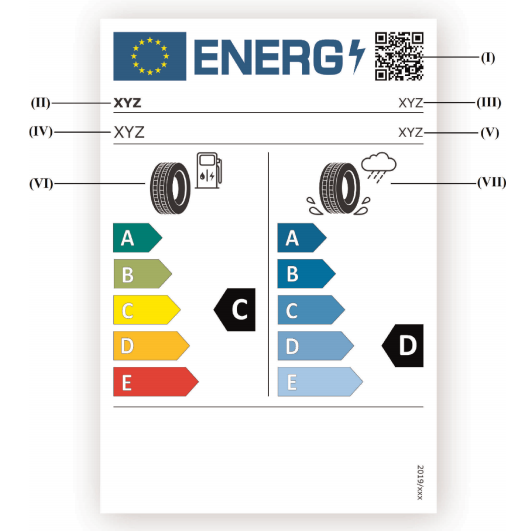
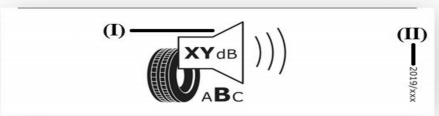
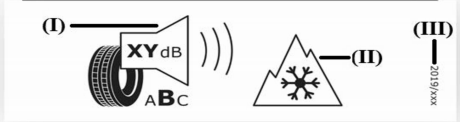
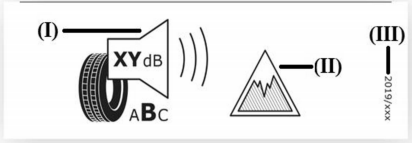
Prodotti elettrici esclusi Direttiva 2014/35/UE Bassa Tensione: Esempi
Prodotti elettrici esclusi Direttiva 2014/35/UE Bassa Tensione: Esempi
ID 11179 | 11.07.2020
La direttiva 2014/35/UE (BT) si applica al materiale elettrico destinato ad essere adoperato ad una tensione nominale compresa fra 50 e 1 000 V in corrente alternata e fra 75 e 1 500 V in corrente continua, fatta eccezione per i materiali e per i fenomeni di cui all’allegato II.
ALLEGATO II
MATERIALI E FENOMENI ESCLUSI DALL’AMBITO DI APPLICAZIONE DELLA PRESENTE DIRETTIVA
Materiali elettrici destinati ad essere usati in ambienti esposti a pericoli di esplosione.
Materiali elettrici per radiologia e uso clinico.
Parti elettriche di ascensori e montacarichi.
Contatori elettrici.
Prese di corrente (basi e spine) a uso domestico.
Dispositivi di alimentazione di recinti elettrici.
Disturbi radioelettrici.
Materiali elettrici speciali, destinati ad essere usati sulle navi o sugli aeromobili e per le ferrovie, conformi alle disposizioni di sicurezza stabilite da organismi internazionali cui partecipano gli Stati membri.
Kit di valutazione su misura per professionisti, destinati ad essere utilizzati unicamente in strutture di ricerca e sviluppo a tali fini.
...
Esempi
...
segue in allegato
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]Nuova Direttiva Bassa Tensione 2014/35/UE
Guidelines LVD 2014/35/EU - August 2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Prodotti elettrici esclusi BT Rev. 00.2020.pdf Certifico S.r.l. Rev. 00 2020 |
1646 kB | 86 |
General Safety and Performance Requirements (Annex I) MDR
General Safety and Performance Requirements (Annex I) in the New Medical Device Regulation
Comparison with the Essential Requirements of the Medical Device Directive and Active Implantable Device Directive
As compliance with the ‘Essential Requirements (ERs)’ is the keystone for establishing conformity with the Medical Device Directive (MDD, 93/42/EEC) and Active Implantable Medical Device Directive (AIMDD, 90/385/EEC), so too is compliance with the ‘General Safety and Performance Requirements (SPRs)’ in establishing conformity with the recently published Medical Device Regulation – EU Regulation 2017/745 (MDR). The Regulation’s date of publication was 5 May 2017 and date for Entry into Force was 25 May 2017 with a 3-year transition period (postponed 25 May 2021).
The purpose of this white paper is to compare the ERs in the MDD and AIMDD to the SPRs in Annex I of the new MDR. Where there are 13 ERs in the MDD and 16 in the AIMDD, there are 23 SPRs in the new MDR. The overall text and requirements are expanded, but the scope and topics are consistent overall with the previous directives with a few notable exceptions. Some topics such as clinical evaluation and medicinal consultation have moved from the requirements list into the articles, while other topics are new to the requirements list, including devices without a medical purpose and requirements for devices used by lay persons. A number of areas now have increased emphasis and more explicit requirements, which in many cases align with harmonized standards and industry guidances. Importantly, all of these points will now become European law under this Regulation.
The areas in Annex I considered to have highest impact to manufacturers are:
- medicinal substances (and substances absorbed or locally dispersed);
- devices incorporating materials of biological origin;
- substances of concern;
- labelling requirements;
- emphasis on cybersecurity.
Other key areas of impact in the MDR outside Annex I include:
- clinical data and evaluation requirements;
- reclassification of some device types;
- post-market requirements.
These topics outside Annex I are beyond the scope of the current white paper, but manufacturers should be aware that these important areas are also changing in comparison to the directives. An updated white paper will follow focusing on the implications of the MDR and MEDDEV 2.7.1 Rev. 4 for clinical data and evaluation.
The paper is organized in order of the new safety and performance requirements by number, with the goal that the readers begin to become familiar with the new numbering and organization. The intent is not to reproduce each requirement, but to highlight areas of particular similarity and difference between the ERs and SPRs.
While many of the SPRs (namely numbers 10-23) have explicit headings or titles, others have been added here in an attempt to highlight the theme of each requirement. Cross-references to ERs and other documents with similar text have been identified for each requirement.
In addition, each SPR has been graded (low, medium or high) relative to the expected impact of the changes to the manufacturer (see Appendix 1 for SPR/ER Cross-reference Mapping Guide). Understanding the SPRs will be an important aspect of manufacturers’ transition plans from the directives to the MDR.
Add more in attachment
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| General Safety and Performance Requirements (Annex I) MDR.pdf BSI 2017 |
228 kB | 13 |
Ingegnere biomedico: elenco nazionale certificato
Ingegnere biomedico: elenco nazionale certificato / Documento e Nominativi Update Dicembre 2022
ID 11150 | Rev. 3.0 del 29.12.2022
Normativa, Regolamento CNI e Circolari sulla figura dell'Ingegnere biomedico e clinico istituito con la Legge 11 gennaio 2018 n. 3: elenco nazionale certificato. Elenco nominativi - Update Dicembre 2022
[box-note]Rev. 3.0 del 29.12.2022
Allegato:
1. Elenco nazionale certificato - Update Dicembre 2022[/box-note]
[box-note]Rev. 2.0 del 25.11.2022
Allegato:
1. Elenco nazionale certificato - Update Novembre 2022
Inseriti Rif:
1. Circolare CNI n. 680/XIX Sess./2021
Modalità di iscrizione all’Elenco nazionale certificato degli Ingegneri biomedici e clinici di cui all’art. 10, comma 1, della legge 11 gennaio 2018, n.3
2. Circolare CNI n. 626/XIX Sess./2020
Elenco nazionale certificato degli ingegneri biomedici e clinici di cui all’art.10, comma 1, della legge 11 gennaio 2018, n.3 – PROCEDURE PER ISCRIZIONE.[/box-note]
[box-note]Rev. 1.0 del 10.07.2020
Inserita la Circolare CNI n. 589/XIX Sess./2020 avente ad oggetto le osservazioni in merito all’Atto del Governo 157 alla luce del D.M. 27 febbraio 2020, n. 60[/box-note]
Istituita la nuova figura dell'Ingegnere biomedico / clinico "certificato", competenze certificate dal CNI.
Nella gazzetta ufficiale n.155 del 20-06-2020, è stato pubblicato il decreto ministero della giustizia del 27 febbraio 2020, n. 60 – “Regolamento recante l’individuazione dei requisiti per l’iscrizione nell’elenco nazionale certificato degli ingegneri biomedici e clinici ai sensi dell’art. 10, co. 2, della Legge 11 gennaio 2018 n. 3”, in vigore dal 5 luglio 2020.
Per l'iscrizione nell'elenco, l'ingegnere biomedico e clinico deve avere competenza professionale nelle attivita' tipiche documentabili di:
- pianificazione, progettazione, sviluppo, direzione lavori, stima, attivita' di installazione, icollaudo, gestione, controllo, manutenzione, verifiche e valutazione di appropriatezza tecnologica di progetti-prodotti-processi, formazione e assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute, sia nella libera professione sia nelle imprese manifatturiere o di servizi che nelle amministrazioni pubbliche, enti privati e istituti di ricerca.
Nello svolgimento di tali attivita', l'ingegnere biomedico e clinico e' legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.
______
Circolare CNI n. 589/XIX Sess./2020
Oggetto: Osservazioni in merito all’Atto del Governo 157 alla luce del D.M. 27 febbraio 2020, n. 60 - GU n. 155 del 20/06/2020
La nota riporta le integrazioni proposte dal Consiglio Nazionale all’Atto del Governo n. 157 relativo allo schema di decreto legislativo recante attuazione della direttiva 2013/59/EURATOM, che stabilisce norme fondamentali di sicurezza relative alla protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti.
Tali proposte di integrazione sono volte ad una armonizzazione con il Decreto Ministeriale 27 febbraio 2020 n.60 (GU n. 155 del 20/06/2020), che istituisce l’elenco nazionale certificato degli ingegneri biomedici e clinici, al fine, tra l’altro, di evitare una disparità di trattamento tra la figura dell’ingegnere biomedico nell’ordinamento italiano rispetto agli altri paesi europei relativamente alle sue competenze.
Il Decreto Ministeriale 27 febbraio 2020 n.60 disciplina altresì le competenze dell’ingegnere biomedico e clinico iscritto nella sezione A dell’elenco nazionale tra cui si annovera: “la pianificazione, la progettazione, lo sviluppo, la direzione lavori, la stima, l'attività di installazione, il collaudo, la gestione, il controllo, la manutenzione, le verifiche e la valutazione di appropriatezza tecnologica di progetti-prodotti-processi, la formazione e l'assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute”.
Nello svolgimento delle attività su indicate, l'ingegnere biomedico e clinico “è legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.”[...]
...
I Requisiti di iscrizione per l'iscrizione nell'elenco sono riportati all'Art. 3 del Decreto 27 febbraio 2020 n. 60, richiesto possesso di competenze in materia di ingegneria biomedica e clinica certificate dal Consiglio nazionale degli ingegneri.
[box-info]Regolamenti MD e IVDR / Persona responsabile del rispetto della normativa
Gli Ingegneri biomedici (certificati) possono avere requisiti adeguati per la nuova Figura della “Persona responsabile del rispetto della normativa” (PR o PRRC da Person Responsible for Regulatory Compliance), introdotta dal Regolamento (UE) 2017/745 (MD), e dal Regolamento (UE) 2017/746 IDVR.[/box-info]
______
[box-note]Legge 11 gennaio 2018 n. 3
Art. 10 Elenco nazionale degli ingegneri biomedici e clinici
1. E' istituito presso l'Ordine degli ingegneri l'elenco nazionale certificato degli ingegneri biomedici e clinici.
2. Con regolamento del Ministro della giustizia, di concerto con il Ministro della salute, da adottare entro novanta giorni dalla data di entrata in vigore della presente legge ai sensi dell'articolo 17, comma 3, della legge 23 agosto 1988, n. 400, sono stabiliti i requisiti per l'iscrizione, su base volontaria, all'elenco nazionale di cui al comma 1.
3. Dall'attuazione del presente articolo non devono derivare nuovi o maggiori oneri a carico della finanza pubblica.[/box-note]
[box-note]Decreto 27 febbraio 2020 n. 60
Regolamento recante l'individuazione dei requisiti per l'iscrizione nell'elenco nazionale certificato degli ingegneri biomedici e clinici ai sensi dell'articolo 10, comma 2, della legge 11 gennaio 2018, n. 3.
...
Art. 1 Tenuta dell'elenco nazionale certificato degli ingegneri biomedici e clinici
1. L'elenco nazionale certificato degli ingegneri biomedici e clinici, istituito a norma dell'articolo 10, comma 1, della legge 11 gennaio 2018, n. 3, e' tenuto dal Consiglio nazionale degli ingegneri, che ne cura la pubblicazione e l'aggiornamento periodico. 2. L'elenco di cui al comma 1 e' suddiviso nelle sezioni A e B.
Art. 2 Ambito di competenza professionale
1. E' iscritto nella sezione A dell'elenco di cui all'articolo 1 l'ingegnere biomedico e clinico che ha competenza professionale nelle seguenti attivita' tipiche documentabili: la pianificazione, la progettazione, lo sviluppo, la direzione lavori, la stima, l'attivita' di installazione, il collaudo, la gestione, il controllo, la manutenzione, le verifiche e la valutazione di appropriatezza tecnologica di progetti-prodotti-processi, la formazione e l'assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute, sia nella libera professione sia nelle imprese manifatturiere o di servizi che nelle amministrazioni pubbliche, enti privati e istituti di ricerca.
2. Nello svolgimento delle attivita' di cui al comma 1, l'ingegnere biomedico e clinico e' legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.
3. E' iscritto nella sezione B dell'elenco di cui all'articolo 1 l'ingegnere biomedico e clinico iunior che ha competenza professionale nelle seguenti attivita' tipiche documentabili: il concorso e la collaborazione alle attivita' di pianificazione, progettazione, sviluppo, direzione lavori, stima, attivita' di installazione, collaudo, gestione, controllo, manutenzione, verifiche e valutazione di appropriatezza tecnologica di progetti-prodotti-processi, formazione e assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per salute, sia nella libera professione e nelle imprese manifatturiere o di servizi, sia nelle amministrazioni pubbliche, enti privati e istituti di ricerca, nonche' direttamente le attivita' di cui sopra che implichino l'uso di metodologie standardizzate o di sistemi e processi di tipologia semplice o ripetitiva.
Art. 3 Requisiti di iscrizione
1. Costituiscono requisiti necessari per l'iscrizione nella sezione A dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea magistrale nella classe LM-21 di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea specialistica nella classe 26/S, di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509 in ingegneria biomedica, ovvero di laurea in ingegneria biomedica conseguita secondo le previsioni dell'ordinamento degli studi universitari previgente al citato decreto n. 509 del 1999;
b) l'iscrizione attiva all'Albo degli ingegneri nella sezione A dei settori dell'ingegneria industriale o dell'ingegneria dell'informazione, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328.
2. Quando il possesso di competenze afferenti alla disciplina dell'ingegneria biomedica e clinica sono certificate dal Consiglio nazionale degli ingegneri ai sensi dell'articolo 5, costituiscono requisiti necessari per l'iscrizione nella sezione A dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea magistrale di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea specialistica di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509, diversi dai titoli di cui al comma 1, lettera a), in materie che consentono l'iscrizione all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione A, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328, ovvero il possesso di laurea in ingegneria conseguita precedentemente all'entrata in vigore del citato decreto n. 509 del 1999;
b) l'iscrizione attiva all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione A, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328.
3. Costituiscono requisiti necessari per l'iscrizione nella sezione B dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea nelle classi L-8 (ingegneria dell'informazione) e L-9 (ingegneria industriale) di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea nelle classi 9 (ingegneria dell'informazione) e 10 (ingegneria industriale), di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509;
b) l'iscrizione attiva all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione B, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328;
c) il possesso di competenze in materia di ingegneria biomedica e clinica certificate dal Consiglio nazionale degli ingegneri ai sensi dell'articolo 5.
...
(GU n.155 del 20-06-2020)[/box-note]
...
segue in allegato
Certifico Srl - IT Rev. 3.0.2022
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 3.0 | 29.12.2022 | Elenco nominatici Update Dicembre 2022 | Certifico Srl |
| 2.0 | 25.11.2022 | Elenco nominativi Update Novembre 2022 Circolare CNI n. 680/XIX Sess./2021 Circolare CNI n. 626/XIX Sess./2020 |
Certifico Srl |
| 1.0 | 10.07.2020 | Circolare CNI n. 589/XIX Sess./2020 | Certifico Srl |
| 0.0 | 07.07.2020 | -- | Certifico Srl |
Collegati
[box-note]Circolare CNI n. 680/XIX Sess./2021
Circolare CNI n. 626/XIX Sess./2020
Circ.CNI n. 589/XIX Sess./2020
Legge 11 gennaio 2018 n. 3
Decreto 27 febbraio 2020 n. 60[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Ingegnere biomedico - Elenco nazionale certificato Rev. 3.0 2022.pdf Certifico Srl - Rev. 3.0 2022 |
185 kB | 3 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 2.0 2022.pdf Certifico Srl - Rev. 2.0 2022 |
186 kB | 9 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 1.0 2020.pdf Certifico Srl - Rev. 1.0 2020 |
418 kB | 23 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 00 2020.pdf Certifico Srl - Rev. 0.0 2020 |
146 kB | 16 |
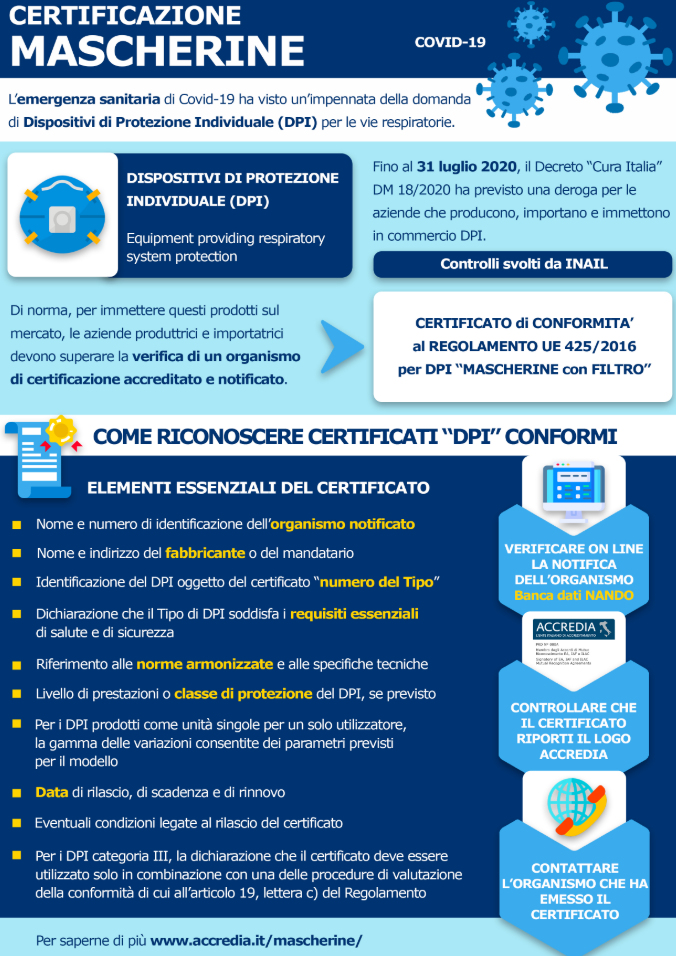
ACCREDIA | Mascherine: Come riconoscere un'attestazione valida
ACCREDIA | Mascherine: Come riconoscere un'attestazione valida
ID 11103 | 29.06.2020
Di fronte all’emergenza sanitaria da Coronavirus, con la necessità di garantire una tempestiva ed elevata disponibilità di Dispositivi di Protezione Individuale (DPI) e dispositivi medici e ridurre i tempi di attesa della produzione e commercializzazione, è stata disposta una deroga alla procedura ordinaria di valutazione della conformità di questi prodotti.
Durante la normale produzione di DPI, le aziende sono sottoposte a un’attività di valutazione della conformità da parte degli organismi accreditati e notificati alla Commissione europea. Sulla base di tali verifiche, i produttori, gli importatori e chi commercializza possono apporre la marcatura CE sui prodotti e immetterli sul mercato.
I DPI possono circolare ed essere commercializzati solo se accompagnati da documenti corretti e validi, dal momento che devono attestarne la conformità alle norme applicabili, in materia di salute, sicurezza e protezione degli utilizzatori.
Verificare la validità di un certificato di conformità di un DPI
Nel seguito, Accredia fornisce alcune indicazioni per riconoscere un certificato valido di attestazione della conformità di un DPI, emesso ai sensi del Regolamento UE 425/2016 da un organismo notificato.
CONTROLLARE GLI ELEMENTI ESSENZIALI CHE IL CERTIFICATO DEVE CONTENERE
Se il documento da verificare è un certificato UE, emesso ai sensi del Regolamento UE 425/2016 sui DPI da un organismo notificato, questo deve contenere almeno le seguenti informazioni:
[alert]a) nome e numero di identificazione dell’organismo notificato;
b) nome e indirizzo del fabbricante e, qualora la domanda sia presentata dal mandatario, nome e indirizzo di quest’ultimo;
c) identificazione del DPI oggetto del certificato (numero del Tipo);
d) dichiarazione in cui si attesta che il Tipo di DPI soddisfa i requisiti essenziali di salute e di sicurezza applicabili;
e) se le norme armonizzate sono state applicate in tutto o in parte, i riferimenti di tali norme o parti di esse;
f) se sono state applicate altre specifiche tecniche, i loro riferimenti;
g) se del caso, il livello di prestazioni o la classe di protezione del DPI;
h) per i DPI prodotti come unità singole per adattarsi a un singolo utilizzatore, la gamma delle variazioni consentite dei parametri pertinenti sulla base del modello di base approvato;
i) la data di rilascio, la data di scadenza e, se del caso, la data o le date di rinnovo;
j) le eventuali condizioni connesse al rilascio del certificato;
k) per i DPI della categoria III, una dichiarazione secondo cui il certificato deve essere utilizzato solo in combinazione con una delle procedure di valutazione della conformità di cui all’articolo 19, lettera c).[/alert]
NOTA BENE
Le informazioni di cui ai punti e), f), g), h) potrebbero anche non essere sempre presenti in base alle scelte progettuali e costruttive dei diversi fabbricanti.
VERIFICARE ON LINE LA NOTIFICA DELL’ORGANISMO CHE HA EMESSO IL CERTIFICATO
Per essere sicuri che il certificato che contiene gli elementi sopra riportati sia stato emesso da un organismo notificato per tale tipologia di DPI, si può effettuare un controllo sul database della Commissione europea che riporta l’elenco degli organismi notificati in Europa per il Regolamento UE 425/2016.
LINK –> Database NANDO
Bisogna verificare se nella specifica notifica è riportato il DPI oggetto della ricerca (Equipment providing respiratory system protection).
NOTA BENE
Se il documento su cui si vogliono eseguire accertamenti, non contiene le informazioni sopra riportate o non è stato emesso da un organismo notificato per lo specifico DPI, quel documento non è un certificato per marcatura CE di un DPI.
In questo periodo di emergenza è possibile che – benché non marcati CE – alcuni DPI siano immessi in commercio in forza di quanto previsto dall’art. 15 del DL 18/2020 “Cura Italia”. L’elenco di tali DPI è pubblico e consultabile sul sito di Inail.
Qualora il DPI oggetto di approfondimento non dovesse risultare correttamente marcato CE e non “validato” da INAIL, è possibile segnalarlo alle Autorità preposte alla Sorveglianza del mercato. Per i DPI le segnalazioni vanno inviate al Ministero dello Sviluppo Economico e al Ministero del Lavoro e delle Politiche Sociali agli indirizzi pubblicati sui relativi siti.
Per i Dispositivi Medici (mascherine chirurgiche) si specifica che le Autorità preposte alla Sorveglianza del mercato sono il Ministero della Salute e l’Istituto Superiore di Sanità.
CONTROLLARE CHE IL CERTIFICATO RIPORTI IL LOGO ACCREDIA E CONTATTARE L’ORGANISMO CHE HA EMESSO IL CERTIFICATO
Per accertarsi della reale emissione di un certificato (che deve riportare il nostro logo nel caso di DPI certificati da parte di organismi accreditati da Accredia) si deve in ogni caso contattare il soggetto che lo ha emesso ed è l’unico che può dichiararne l’emissione, lo stato di vigenza, la corrispondenza al DPI oggetto della certificazione o addirittura la falsità.
Tale verifica può essere generalmente eseguita direttamente on line sul sito web dell’organismo interessato o inviando una e-mail.
ATTENZIONE A DOCUMENTI SOMIGLIANTI MA CHE NON SONO CERTIFICATI AI SENSI DEL REGOLAMENTO UE 425/2016 DPI
Stanno circolando documenti simili a dei certificati del Tipo di DPI ai sensi del Regolamento UE 425/2016 DPI ma che non lo sono.
Diciture generiche sui facsimili di certificati presentati a supporto di DPI del tipo FFP2 e FFP3 che contengano diciture come “Qualified Certificate”, “Protective Mask” o “Contrasto COVID-19” non sono previste dalla legislazione vigente e anzi rappresentano un elemento che può confondere i consumatori finali e di cui bisogna diffidare ponendo la massima attenzione alla reale conformità del DPI che viene proposto.
ESEMPI DI DOCUMENTI CHE NON SONO CERTIFICATI DI CONFORMITA' DI DPI
Caso 1

Caso 4*
*certificato FALSO, non emesso dall’organismo ISET s.r.l. (visita il sito http://odc.iset-italia.eu/)
Caso 5*
*certificato pubblicato su richiesta e autorizzazione dell’organismo CELAB SRL.
Caso 6
________
Infografica
Fonte: ACCREDIA
Collegati:
[box-note]UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Classificazione Mascherine DPI NIOSH (US)
ISS | Procedure per richiesta produzione mascherine
Coronavirus: Corretto uso delle mascherine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ACCREDIA Mascherine Come riconoscere un'attestazione valida.pdf Certifico Srl - Rev. 0.0 2020 |
1110 kB | 27 |
Utilizzo in sicurezza delle macchine ATS Brianza
Utilizzo in sicurezza delle macchine ATS Brianza
ID 11098 | 29.06.2020 / Documenti allegati
Guida per le imprese 2020 | ATS Brianza Rev. 25a del19.06.2020
La presente guida è rivolta a tutte le aziende che rientrano nel campo di applicazione del D.Lgs. 81/2008 e che utilizzano macchine così come definite all’art. 2 comma 2 lett. a) del D.Lgs. 17/2010. Non sono, quindi, ricompresi i fabbricanti di macchine, se non coloro che si auto costruiscono attrezzature esclusivamente per uso interno.
Il documento fornisce indicazioni utili per l’utilizzo in sicurezza delle macchine. Tale condizione si verifica quando il rischio residuo è considerato accettabile in funzione del fatto che le macchine possiedono caratteristiche di sicurezza intrinseca (cioè sono “a norma”), sono installate in un ambiente di lavoro idoneo e sono utilizzate in modo conforme alle istruzioni del fabbricante, sotto il controllo di un preposto.
La responsabilità del raggiungimento di questo obiettivo è condivisa tra vari soggetti a partire dai progettisti, dai fabbricanti e dai venditori, sino ad arrivare al datore di lavoro, ai dirigenti, ai preposti e ai lavoratori. Le tematiche sviluppate nella guida sono state suddivise in tre capitoli, all’interno dei quali sono stati definiti i ruoli delle figure del sistema di prevenzione aziendale:
1. la scelta, l’acquisto, la messa in servizio e/o dismissione/vendita delle macchine;
2. la valutazione del rischio macchine;
3. la gestione delle macchine per il mantenimento dei requisiti di sicurezza nel tempo. Sono inoltre allegati alcuni modelli (schede e check list) da adattare alla propria realtà aziendale.
A conclusione del documento sono riportate le più frequenti inosservanze riscontrate dall’organo di vigilanza (rif. Allegato R – “Violazioni più frequenti in ambito di vigilanza”), la sintesi 9° e 10° rapporto INAIL relativi alla sorveglianza del mercato in merito alla direttiva macchine (rif. Allegato S – “Attività di sorveglianza del mercato ai sensi del D.Lgs. 17/2010 per i prodotti rientranti nel campo di applicazione della direttiva macchine”) e la bibliografia/sitografia utili per approfondire i diversi aspetti trattati.
...
segue in allegato
ATS Brianza Rev. 25a del19.06.2020
Documento elaborato dal Comitato di Coordinamento Territoriale ex art. 7 D.Lgs. 81/2008
[box-info]D.Lgs. 81/2008
Art. 7. Comitati regionali di coordinamento
1. Al fine di realizzare una programmazione coordinata di interventi, nonché uniformità degli stessi ed il necessario raccordo con il Comitato di cui all'articolo 5 e con la Commissione di cui all'articolo 6, presso ogni regione e provincia autonoma opera il comitato regionale di coordinamento di cui al decreto del Presidente del Consiglio dei Ministri in data 21 dicembre 2007, pubblicato nella Gazzetta Ufficiale n. 31 del 6 febbraio 2008.[/box-info]
Collegati
[box-note]D.Lgs. 81/2008 Testo Unico Salute e Sicurezza Lavoro
Direttiva macchine 2006/42/CE
Decreto Legislativo 27 Gennaio 2010 n. 17
DPCM 17 Dicembre 2007[/box-note]
Direttiva 2008/28/CE
Direttiva 2008/28/CE
Direttiva 2008/28/CE del Parlamento europeo e del Consiglio, dell’11 marzo 2008, che modifica la direttiva 2005/32/CE relativa all’istituzione di un quadro per l’elaborazione di specifiche per la progettazione ecocompatibile dei prodotti che consumano energia, nonché la direttiva 92/42/CEE del Consiglio e le direttive del Parlamento europeo e del Consiglio 96/57/CE e 2000/55/CE, per quanto riguarda le competenze di esecuzione conferite alla Commissione
GU L 81 del 20.3.2008
Collegati
[box-note]Direttiva 2005/32/CE[/box-note]
RAPEX Report 24 del 12/06/2020 N. 03 A12/00857/20 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 24 del 12/06/2020 N. 03 A12/00857/20 Finlandia
Approfondimento tecnico: Sollevatore per veicoli a pantografo
Il prodotto, di marca Biltema, mod. 15-8406, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2006/42/CE Macchineed alla norma tecnica EN 1493:2010 “Sollevatori per veicoli”.
Il dispositivo è privo di protezione contro lo schiacciamento di mani e piedi e non vi è nessuna protezione per ridurre i rischi derivanti dell’eiezione del fluido in pressione in caso di rottura del tubo. Inoltre, il manometro e la valvola limitatrice di pressione non funzionano correttamente.
Infine, il dispositivo non è stabile. Di conseguenza, mentre si abbassa un veicolo, si potrebbe spostare inavvertitamente.
Direttiva 2006/42/CE Macchine
Allegato I
1.3.1. Rischio di perdita di stabilità
La macchina, elementi ed attrezzature compresi, deve avere una stabilità tale da evitare il rovesciamento, la caduta o gli spostamenti non comandati durante il trasporto, il montaggio, lo smontaggio e tutte le altre azioni che interessano la macchina. Se la forma stessa della macchina o la sua installazione prevista non garantiscono sufficiente stabilità, devono essere previsti ed indicati nelle istruzioni appositi mezzi di fissaggio.
1.3.7. Rischi dovuti agli elementi mobili
Gli elementi mobili della macchina devono essere progettati e costruiti per evitare i rischi di contatto che possono provocare infortuni oppure, se i rischi persistono, essere muniti di ripari o dispositivi di protezione.
Devono essere prese tutte le disposizioni necessarie per impedire un bloccaggio improvviso degli elementi mobili di lavoro. Nei casi in cui, malgrado le precauzioni prese, possa verificarsi un bloccaggio, dovranno essere previsti, ove opportuno, i dispositivi di protezione specifici e gli utensili specifici necessari per permettere di sbloccare la macchina in modo sicuro.
Le istruzioni e, ove possibile, un'indicazione sulla macchina devono individuare tali dispositivi di protezione specifici e la modalità di impiego.
1.5.3. Energie diverse dall'energia elettrica
Se la macchina è alimentata da fonti di energia diverse da quella elettrica, essa deve essere progettata, costruita ed equipaggiata in modo da prevenire tutti i rischi che possono derivare da tali fonti di energia.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 24 del 12_06_2020 N. 03 A12_00857_20 Finlandia.pdf Sollevatore per veicoli a pantografo |
109 kB | 0 |
RAPEX Report 23 del 05/06/2020 N. 22 A12/00828/20 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 23 del 05/06/2020 N. 22 A12/00828/20 Finlandia
Approfondimento tecnico: Montatura occhiali da vista
Il prodotto, di marca Burberry, mod. OBE1313Q, colore 1240, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE ed alla norma europea EN 16128:2015 “Ottica oftalmica - Metodo di prova di riferimento relativo al rilascio di nichel da montature per occhiali e occhiali da sole”
I bordi, il ponte, le decorazioni e le aste del prodotto rilasciano una quantità eccessiva di nichel (valore misurato fino a: 9,7 µg/cm2/settimana). Il nichel è un forte sensibilizzante e provoca reazioni allergiche se presente in articoli che entrano in contatto diretto e prolungato con la pelle.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
27. Nichel
1. Non è consentito l’uso:
a) in tutti gli oggetti metallici che vengono inseriti negli orecchi perforati o in altre parti perforate del corpo umano, a meno che il tasso di cessione di nickel da tali oggetti metallici sia inferiore a 0,2 μg/cm2 per settimana (limite di migrazione);
b) in articoli destinati ad entrare in contatto diretto e prolungato con la pelle, quali:
- orecchini,
- collane, bracciali e catenelle, cavigliere, anelli,
- casse di orologi da polso, cinturini per orologi e chiusure di orologi,
- bottoni automatici, fermagli, rivetti, cerniere lampo e marchi metallici, se sono applicati agli indumenti,
se il tasso di cessione di nickel dalle parti di questi articoli che vengono a contatto diretto e prolungato con la pelle è superiore a 0,5 μ/cm2/settimana;
c) negli articoli di cui alla lettera b) se hanno un rivestimento senza nickel, a meno che tale rivestimento sia sufficiente a garantire che il tasso di cessione di nickel dalle parti di tali articoli che sono a contatto diretto e prolungato con la pelle non superi 0,5 μg/cm2/settimana per un periodo di almeno due anni di uso normale dell’articolo.
2. Gli articoli che sono oggetto del paragrafo 1 non possono essere immessi sul mercato se non sono conformi alle prescrizioni di tale paragrafo.
3. Le norme adottate dal Comitato europeo di normalizzazione (CEN) sono utilizzate come metodi di prova per dimostrare la conformità degli articoli ai paragrafi 1 e 2.
EN 16128:2015
“Ottica oftalmica - Metodo di prova di riferimento relativo al rilascio di nichel da montature per occhiali e occhiali da sole”
La presente norma europea specifica il metodo di prova di riferimento relativo al rilascio di nichel da parte di montature per occhiali, occhiali premontati, occhiali da sole e altri articoli per la protezione degli occhi e del viso.
Il metodo di riferimento supporta la dimostrazione della conformità al valore limite per il rilascio di nichel di 0,5 μg/cm2/settimana definito dal Regolamento (CE) n. 1907/2006 .
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 23 del 05_06_2020 N. 22 A12_00828_20 Finlandia.pdf Montatura occhiali da vista |
387 kB | 2 |
Decreto Legislativo 12 maggio 2020 n. 42
Decreto Legislativo 12 maggio 2020 n. 42
Attuazione della direttiva (UE) 2017/2102 del Parlamento europeo e del Consiglio del 15 novembre 2017, recante modifica della direttiva 2011/65/UE sulla restrizione dell'uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
(GU Serie Generale n.144 del 08-06-2020)
Entrata in vigore del provvedimento: 23/06/2020
...
Art. 1. Modifiche al decreto legislativo 4 marzo 2014, n. 27
1. Al decreto legislativo 4 marzo 2014, n. 27, sono apportate le seguenti modifiche:
a) all’articolo 2, comma 2, dopo la lettera i) è aggiunta la seguente:
«i -bis ) agli organi a canne;»;
b) all’articolo 3, comma 1, la lettera gg) è sostituita dalla seguente:
« gg) “macchine mobili non stradali destinate ad esclusivo uso professionale”, le macchine dotate di una fonte di alimentazione a bordo o con dispositivo di trazione collegato ad una fonte di alimentazione esterna, il cui funzionamento richiede mobilità o movimento continuo o semicontinuo, durante il lavoro, tra una serie di postazioni di lavoro fisse e che sono destinate a esclusivo uso professionale.»;
c) all’articolo 4, comma 3, lettera c), il segno di interpunzione «.» è sostituito dal seguente: «;» e dopo la lettera c) è inserita la seguente: «c -bis ) a tutte le altre AEE che non rientravano nell’ambito di applicazione della direttiva 2002/95/CE immesse sul mercato dal 22 luglio 2019.»;
d) all’articolo 4, comma 4, dopo la lettera e) è inserita la seguente:
«e -bis ) tutte le altre AEE che non rientravano nell’ambito di applicazione della direttiva 2002/95/CE immesse sul mercato prima del 22 luglio 2019;»
e) all’articolo 4, il comma 5 è sostituito dal seguente:
«5. Purché il riutilizzo avvenga in sistemi controllabili di restituzione a circuito chiuso da impresa a impresa e che la presenza di parti di ricambio sia comunicata al consumatore, il comma 1 non si applica al riutilizzo dei pezzi di ricambio:
a) recuperati da AEE immesse sul mercato anteriormente al 1° luglio 2006 e utilizzati nelle AEE immesse sul mercato prima del 1° luglio 2016;
b) recuperati da dispositivi medici e strumenti di monitoraggio e controllo immessi sul mercato anteriormente al 22 luglio 2014 e utilizzati nelle AEE immesse sul mercato prima del 22 luglio 2024;
c) recuperati da dispositivi medico-diagnostici in vitro immessi sul mercato anteriormente al 22 luglio 2016 e utilizzati nelle AEE immesse sul mercato prima del 22 luglio 2026;
d) recuperati da strumenti industriali di monitoraggio e controllo immessi sul mercato anteriormente al 22 luglio 2017 e utilizzati nelle AEE immesse sul mercato prima del 22 luglio 2027;
e) recuperati da tutte le AEE che non rientravano nell’ambito di applicazione della direttiva 2002/95/CE immesse sul mercato anteriormente al 22 luglio 2019 e utilizzati nelle AEE immesse sul mercato prima del 22 luglio 2029.»;
f) all’articolo 5, comma 5, la lettera b) è sostituita dalla seguente:
« b) per le esenzioni di cui all’allegato III della direttiva 2011/65/UE, vigente alla data del 21 luglio 2011, il periodo di validità massima, che può essere prorogato, è di cinque anni per le categorie da 1 a 7 e 10 dell’allegato I, a decorrere dal 21 luglio 2011, di sette anni per le categorie 8 e 9 dell’allegato I, a decorrere dalle date pertinenti di cui all’articolo 4, comma 3, e di cinque anni per la categoria 11 dell’allegato I, a decorrere dal 22 luglio 2019, salvo che non sia specificato un periodo più breve;»;
g) l’articolo 24 è abrogato.
...
Collegati:
[box-note]Direttiva RoHS: Open Scope dal 22 luglio 2019
Direttiva RoHS III | Testo consolidato[/box-note]
RAPEX Report 22 del 29/05/2020 N. 01 A12/00770/20 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 22 del 29/05/2020 N. 01 A12/00770/20 Lituania
Approfondimento tecnico: Additivo per carburante
Il prodotto, di marca Bioline, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme Regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio del 16 dicembre 2008 relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le Direttive 67/548/CEE e 1999/45/CE e che reca modifica al Regolamento (CE) n. 1907/2006.
Secondo quanto riportato sull'imballaggio, il prodotto contiene sostanze chimiche dannose e pericolose ma manca di una chiusura a prova di bambino, delle indicazioni di pericolo e di precauzione e del nome delle sostanze in questione.
Titolo III Regolamento (CE) n. 1272/2008
Comunicazione dei pericoli per mezzo dell'etichettatura
Capo I
Contenuto dell’etichetta
Articolo 17 Disposizioni generali
1. Una sostanza o miscela classificata come pericolosa e contenuta in un imballaggio è provvista di un'etichetta in cui figurano gli elementi seguenti:
a) nome, indirizzo e numero di telefono del fornitore o dei fornitori;
b) la quantità nominale della sostanza o miscela contenuta nel collo messo a disposizione dal pubblico, se tale quantità non è indicata altrove nel collo;
c) gli identificatori del prodotto specificati all'articolo 18;
d) se del caso, i pittogrammi di pericolo conformemente all'articolo 19;
e) se del caso, le avvertenze conformemente all'articolo 20;
f) se del caso, le indicazioni di pericolo conformemente all'articolo 21;
g) se del caso, gli opportuni consigli di prudenza conformemente all'articolo 22;
h) se del caso, una sezione per informazioni supplementari conformemente all'articolo 25.
2. L'etichetta è scritta nella lingua o nelle lingue ufficiali dello Stato membro o degli Stati membri in cui la sostanza o miscela è immessa sul mercato salvo altrimenti previsto dallo Stato membro o dagli Stati membri in questione.
I fornitori possono utilizzare nell'etichetta più lingue di quelle prescritte dagli Stati membri, purché in tutte le lingue utilizzate siano riportate le stesse informazioni.
Allegato II
Disposizioni particolari relative all'etichettatura e all'imballaggio di talune sostanze e miscele
Parte 3 - Disposizioni particolari relative all’imballaggio
3.1. Disposizioni riguardanti le chiusure di sicurezza per bambini
3.1.1. Imballaggi che devono essere muniti di chiusura di sicurezza per bambini
3.1.1.1. Imballaggi di qualunque capienza contenenti sostanze o miscele fornite al pubblico e classificate per la tossicità acuta (categorie da 1 a 3), STOT — esposizione singola (categoria 1), STOT — esposizione ripetuta (categoria 1) o corrosione della pelle (categoria 1) sono muniti di chiusura di sicurezza per bambini.
3.1.1.2. Gli imballaggi di qualunque capienza contenenti sostanze o miscele fornite al pubblico che presentano un pericolo in caso di aspirazione, classificate secondo i punti 3.10.2 e 3.10.3 dell’allegato I ed etichettate secondo il punto 3.10.4.1 dell'allegato I, ad eccezione delle sostanze e delle miscele immesse sul mercato sotto forma di aerosol o in un recipiente munito di un dispositivo di nebulizzazione sigillato, sono muniti di chiusura di sicurezza per bambini.
3.1.1.3. Quando in una sostanza o miscela è presente almeno una delle sostanze sottoindicate, in concentrazione uguale o superiore alla massima concentrazione specificata per ciascuna sostanza, l'imballaggio, di qualunque capienza, è munito di chiusura di sicurezza per bambini.
Metanolo CAS 67-56-1 >= 3%
Diclometano CAS 75-09-2 >= 1%
3.1.2. Imballaggi richiudibili
Le chiusure di sicurezza per bambini utilizzate per imballaggi non richiudibili rispondono alla norma EN ISO 8317 modificata «Imballaggi di sicurezza per bambini — Requisiti e procedure di prova degli imballaggi richiudibili» adottata dal Comitato europeo di normalizzazione (CEN) e dall'Organizzazione internazionale di normazione (ISO).
3.1.3. Imballaggi non richiudibili
Le chiusure di sicurezza per bambini utilizzate per imballaggi non richiudibili rispondono alla norma CEN EN 862 modificata «Imballaggi — Imballaggi di sicurezza per bambini — Requisiti e procedure di prova degli imballaggi non richiudibili per prodotti non farmaceutici» adottata dal Comitato europeo di normazione (CEN).
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 22 del 29_05_2020 N. 01 A12_00770_20 Lituania.pdf Additivo per carburante |
451 kB | 2 |
Manuale d'istruzioni macchine: position paper Orgalime formato elettronico
Manuale d'istruzioni macchine: Position paper Orgalime sul formato elettronico
ID 10902 | 01.06.2020 - Position paper Orgalim allegato
Orgalim, nel Position paper allegato, fornisce alcuni chiarimenti inerenti la "forma", elettronica o cartacea richiesta per la consegna del manuale d'istruzioni (paragrafo §255 della Guida direttiva macchine 2006/42/CE - Ed. 2019 EN), in particolare sono riportati, con esempi pratici, vantaggi e svantaggi delle due forme, in relazione all'operatore economico interessato nella filiera.
L'attuale direttiva macchine 2006/42/CE, all'allegato I, cap. 1.7.4. non specifica se le istruzioni debbano essere rese disponibili in formato cartaceo o elettronico. Tuttavia, la Guida all'interpretazione della direttiva macchine (edizione Ottobre 2019) afferma che l'operatore economico ha la possibilità di fornirli in un archivio elettronico, ma senza fornire ulteriori chiarimenti.
[panel]Guida direttiva macchine 2006/42/CE - Ed. 2019 EN
...
§255 The form of the instructions
Section 1.7.4 does not specify the form of the instructions. It is generally agreed that all health and safety related instructions must be supplied in paper form, since it cannot be assumed that the user has access to the means of reading instructions supplied in electronic form or made available on an Internet site.
However, it is often useful for the instructions to be made available in electronic form and on the Internet as well as in paper form, since this enables the user to download the electronic file if he so wishes and to recover the instructions if the paper copy has been lost. This practice also facilitates the updating of the instructions when this is necessary.[/panel]
In questo documento, Orgalim, interpreta alcune spiegazioni fornite nella guida, fornisce esempi pratici sui diversi formati in cui le istruzioni possono essere consegnate dal fabbricante e giustifica i vantaggi di ciascuno dei mezzi alternativi per fornire le istruzioni. Infine, è presentato un "nuovo testo sul formato delle Istruzioni" da inserire nella prossima revisione della guida.
In linea con l'opinione espressa dalle altre parti interessate nell'ultima riunione del gruppo di lavoro macchine, Orgalim ritiene che gli operatori economici necessitino di un approccio flessibile su questo tema poiché una soluzione unica per tutte non è presente, sia per la possibilità di fornire istruzioni in formato elettronico con i suoi vantaggi o in formato cartaceo che offre molte opportunità in termini di usabilità per tutte le parti coinvolte.
Quando si immettono macchine sul mercato, le informazioni e in particolare le istruzioni fornite dall'operatore economico sull'uso sicuro delle macchine possono assumere varie forme. In effetti, nella maggior parte dei casi, la macchina viene consegnata a un cliente finale - datore di lavoro - che mette in servizio la macchina e la utilizza da sola o, in alternativa, mette la macchina a disposizione dei propri dipendenti per svolgere il proprio lavoro.
Un punto importante è che all'operatore economico dovrebbe essere offerta la flessibilità di decidere insieme al soggetto successivo nella filiera dei soggetti interessati, in quale forma le istruzioni soddisfino meglio le sue esigenze. Questa flessibilità dovrebbe essere estesa lungo l'intera filiera a tutti i soggetti.
Orgalim 2019
[box-info]Orgalim
Orgalim rappresenta le industrie tecnologiche europee: 770.000 aziende innovative che abbracciano i settori dell'ingegneria meccanica, dell'ingegneria elettrica, dell'elettronica e della tecnologia dei metalli. Insieme rappresentano il più grande settore manifatturiero dell'UE, generando un fatturato annuo di oltre 2.100 miliardi di euro, producendo un terzo di tutte le esportazioni europee e fornendo 11,5 milioni di posti di lavoro diretti.[/box-info]
Collegati
[box-note]Direttiva macchine 2006/42/CE
Guida direttiva macchine 2006/42/CE - Ed. 2019 EN[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position paper digital instructions machinery Orgalime 2019.pdf Orgalim 2019 |
209 kB | 100 |
RAPEX Report 21 del 22/05/2020 N. 01 A12/00737/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 21 del 22/05/2020 N. 01 A12/00737/20 Germania
Approfondimento tecnico: Orecchini
Il prodotto, di marca Tedi, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
La quantità di nichel rilasciato dagli orecchini è troppo alta (valore misurato: 18.3 mg/cm²/settimana).
Il nichel può causare reazioni allergiche se presente in articoli che entrano in contatto diretto e prolungato con la pelle.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
27. Nickel
1. Non è consentito l’uso:
a) in tutti gli oggetti metallici che vengono inseriti negli orecchi perforati o in altre parti perforate del corpo umano, a meno che il tasso di cessione di nickel da tali oggetti metallici sia inferiore a 0,2 μg/cm2 per settimana (limite di migrazione);
b) in articoli destinati ad entrare in contatto diretto e prolungato con la pelle, quali:
- orecchini,
- collane, bracciali e catenelle, cavigliere, anelli,
- casse di orologi da polso, cinturini per orologi e chiusure di orologi,
- bottoni automatici, fermagli, rivetti, cerniere lampo e marchi metallici, se sono applicati agli indumenti,
se il tasso di cessione di nickel dalle parti di questi articoli che vengono a contatto diretto e prolungato con la pelle è superiore a 0,5 μ/cm2/settimana;
c) negli articoli di cui alla lettera b) se hanno un rivestimento senza nickel, a meno che tale rivestimento sia sufficiente a garantire che il tasso di cessione di nickel dalle parti di tali articoli che sono a contatto diretto e prolungato con la pelle non superi 0,5 μg/cm2/settimana per un periodo di almeno due anni di uso normale dell’articolo.
2. Gli articoli che sono oggetto del paragrafo 1 non possono essere immessi sul mercato se non sono conformi alle prescrizioni di tale paragrafo.
3. Le norme adottate dal Comitato europeo di normalizzazione (CEN) sono utilizzate come metodi di prova per dimostrare la conformità degli articoli ai paragrafi 1 e 2.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 21 del 22_05_2020 N. 01 A12_00737_20 Germania.pdf Orecchini |
374 kB | 1 |
Linee guida nuova direttiva ATEX 2014/34/UE | Maggio 2020
Linee guida nuova direttiva ATEX 2014/34/UE
3rd Edition May 2020
Guida alla applicazione della direttiva 2014/34/UE del Parlamento europeo e del Consiglio, del 26 febbraio 2014, relativa all'armonizzazione della legge degli Stati membri relative agli apparecchi e sistemi di protezione destinati ad essere utilizzati in atmosfera potenzialmente esplosiva.
Queste Linee Guida ATEX sono destinate ad essere un manuale per tutte le parti direttamente o indirettamente interessate dalla direttiva 2014/34/UE, comunemente indicata come ATEX ("Atmosfere EXplosibles") direttiva di "prodotto", applicabile dal 20 aprile 2016, in sostituzione della precedente direttiva 94/9/CE applicabile dal 1 luglio 2003 fino al 19 aprile 2016.
L'Attenzione dei lettori è richiamata sul fatto che queste linee guida hanno il solo scopo di facilitare l'applicazione della direttiva 2014/34/UE, ed è la trasposizione nazionale pertinente del testo della direttiva che è giuridicamente vincolante.
Tuttavia, il documento rappresenta un punto di riferimento per garantire l'applicazione coerente della direttiva per tutte le parti interessate.
Le linee guida ATEX hanno lo scopo di contribuire a garantire la libera circolazione dei prodotti nell'ambito di applicazione della direttiva ATEX nell'Unione europea tra gli esperti Stati membri e le altre parti interessate.
_________
Versioni Precedenti:
2nd Edition - December 2017
1st Edition - April 2016
Draft 0.4 - September 2015
Fonte: Commissione Europea
Collegati:
[box-note]Guida al passaggio dalla Direttiva ATEX 94/9/CE alla nuova Direttiva ATEX 2014/34/UE
Nuova Direttiva ATEX Prodotti 2014/34/UE
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Linee guida ATEX 2014 34 UE Terza edizione Maggio 2020.pdf Terza edizione Maggio 2020 |
5527 kB | 215 |
Decreto 13 febbraio 2020 n. 72
Decreto 13 febbraio 2020 n. 72
Procedure di autorizzazione degli organismi di valutazione della conformita' e di controllo degli organismi notificati ai sensi del decreto del Presidente della Repubblica n. 239/2017, recante attuazione della direttiva 2014/90/UE sull'equipaggiamento marittimo. (Decreto n. 72/2020).
(GU Serie Generale n.130 del 21-05-2020)
...
Art. 1. Applicazione
1. In attuazione dell’art. 19, comma 2 del decreto del Presidente della Repubblica 20 dicembre 2017, n. 239 sono individuate le procedure di autorizzazione degli organismi di valutazione della conformità e di controllo sugli organismi notificati in allegato 1 al presente decreto.
2. Le procedure di cui al comma 1 del presente articolo sono indirizzate alle attività autorizzazione degli organismi di valutazione della conformità e per il controllo sugli organismi notificati.
Collegati:
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
D.P.R. 20 dicembre 2017 n. 239 | Equipaggiamento marittimo
MISE Circolare 2/2017 equipaggiamento marittimo
Decreto MIT 31 luglio 2015 Equipaggiamento marittimo[/box-note]
Dispositivi diagnostici in vitro per COVID-19
Dispositivi diagnostici in vitro per COVID-19
Update 15.06.2020 - Versione del 23 Maggio 2020
Rapporti ISS COVID-19 n. 46/2020 - Dispositivi diagnostici in vitro per COVID-19. Parte 2: evoluzione del mercato e informazioni per gli stakeholder. Versione del 23 maggio 2020
I dispositivi diagnostici in vitro (IVD) rappresentano strumenti essenziali per un’efficace gestione dell’epidemia di COVID-19. È tuttavia cruciale comprendere appieno quali informazioni possano fornire i differenti test disponibili sul mercato e quale livello di prestazioni mostrino. Questi aspetti hanno infatti notevole impatto sull’identificazione delle persone con infezione in corso e sul monitoraggio del decorso clinico e, quindi, sul controllo della pandemia.
Il 15 aprile 2020 la Commissione Europea ha pubblicato le linee guida sui dispositivi diagnostici in vitro per COVID-19.
Nel presente rapporto vengono diffusi i contenuti relativi (i) agli aspetti normativi che regolano l’uso e la commercializzazione degli IVD per COVID-19 in Italia e nei paesi dell’Unione Europea e (ii) alle diverse tipologie di IVD che possono essere rinvenute sul mercato.
_______
Indice
Introduzione
Dispositivi diagnostici in vitro: il contesto normativo dell’Unione Europea
Direttiva 98/79/CE
Regolamento UE 2017/746
Tipologie di dispositivi per la diagnosi di COVID-19
Classificazione in base all’uso o meno di apparecchiature
Classificazione in base alla tipologia di marcatore rilevato
Saggi che rilevano la presenza di componenti del virus (RNA o antigene): metodi diretti
Saggi sierologici (o anticorpali) che rilevano l’avvenuta esposizione al virus: metodi indiretti
Classificazione in base all’utilizzatore previsto
Test ad uso professionale
Test auto-diagnostici (self-test)
Bibliografia
Fonte: ISS
Collegati:
[box-note]Regolamento (UE) 2017/746
COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
Certifico | Sezione Covid-19[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Rapporti ISS COVID-19 n. 46 2020 - Dispositivi diagnostici in vitro per COVID-19.pdf Rapporti ISS 46/2020 |
1707 kB | 1 | ||
| Dispositivi diagnostici in vitro per COVID-19.pdf Rapporto ISS 28/2020 |
1533 kB | 23 |
Norme armonizzate Regolamento (UE) 2016/425 DPI
Norme armonizzate Regolamento (UE) 2016/425 DPI / Maggio 2025
ID 10807 | Rev. 10.0 del 16 Maggio 2025
Elenco consolidato Norme armonizzate al 16 Maggio 2025 a seguito della pubblicazione della Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti delle norme armonizzate pubblicati ai sensi del Regolamento 2016/425/UE sono contenuti nelle:
1. Comunicazione 2018/C 209/03 della Commissione nell'ambito dell'applicazione del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GUUE 2018/C 209/17 del 15.06.2018). Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
Essa continua tuttavia ad applicarsi ai riferimenti delle norme armonizzate che figurano nell’allegato II della Decisione di esecuzione (UE) 2023/941 fino alle date di ritiro di tali riferimenti indicate nel medesimo allegato.
2. Rettifica della comunicazione della Commissione nell'ambito dell'attuazione del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GU C 222/30 del 26.06.2018). N.B Comunicazione 2018/C 209/03. Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
3. Decisione di esecuzione (UE) 2020/668della Commissione del 18 maggio 2020 relativa alle norme armonizzate per i dispositivi di protezione individuale redatte a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio (GU L 156/13 del 19.05.2020). Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
4. Decisione di esecuzione (UE) 2021/395 della Commissione del 4 marzo 2021 che modifica la Decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sulle proprietà elettrostatiche degli indumenti di protezione, sugli indumenti di protezione per vigili del fuoco e sugli indumenti protettivi per motociclisti, sugli indumenti di protezione per l’utilizzo nello snowboard, sugli indumenti di protezione indossati da operatori che applicano prodotti pesticidi e lavoratori esposti a questi pesticidi applicati, sull’attrezzatura di visibilità migliorata per situazioni a medio rischio, sull’attrezzatura per alpinismo e sugli indumenti di protezione contro i pericoli termici da arco elettrico. (GU L 77/35 del 5.3.2021). N.B. Decisione di esecuzione (UE) 2020/668Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
5. Decisione di esecuzione (UE) 2021/1201 della Commissione del 16 luglio 2021 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui protettori dell’udito. (GU L 259/8 del 21.7.2021). N.B. Decisione di esecuzione (UE) 2020/668 abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
6. Decisione di esecuzione (UE) 2022/1914 della Commissione del 6 ottobre 2022 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui dispositivi individuali di galleggiamento - aiuti al galleggiamento, giubbotti di salvataggio e accessori (GU L 261/60 del 7.10.2022). N.B. Decisione di esecuzione (UE) 2020/668 abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
7. Decisione di esecuzione (UE) 2022/2414 della Commissione del 6 dicembre 2022 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui requisiti, le prove e la marcatura dei filtri antiparticolato per i dispositivi di protezione delle vie respiratorie, sui requisiti generali per gli indumenti di protezione, sui requisiti per le protezioni per gli occhi per lo squash e le protezioni per gli occhi per il racquetball e lo squash 57 e sui requisiti e i metodi di prova per le calzature di protezione contro i rischi presenti nelle fonderie e durante le operazioni di saldatura e i procedimenti connessi. (GU L 317/136 del 9.12.2022). N.B. Decisione di esecuzione (UE) 2020/668 Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
8. Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 relativa alle norme armonizzate per i dispositivi di protezione individuale elaborate a sostegno del regolamento (UE) 2016/425del Parlamento europeo e del Consiglio. (GU L 125/37 dell'11.5.2023). Entrata in vigore: 11.5.2023
9. Decisione di esecuzione (UE) 2023/2752 della Commissione, del 7 dicembre 2023, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per l’attrezzatura per alpinismo, gli elmetti per attività equestri e i guanti elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2023/2752 del 11.12.2023). Entrata in vigore: 11.12.2023
10. Decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 della Commissione per quanto riguarda le norme armonizzate relative ai dispositivi individuali per la protezione contro le cadute, agli elettrorespiratori a filtro per la protezione delle vie respiratorie, alle calzature, agli elmetti isolanti e alle protezioni degli occhi e del viso per uso professionale elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2024/2599 dell'8.10.2024). Entrata in vigore: 08.10.2024
11. Rettifica della decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 della Commissione per quanto riguarda le norme armonizzate relative ai dispositivi individuali per la protezione contro le cadute, agli elettrorespiratori a filtro per la protezione delle vie respiratorie, alle calzature, agli elmetti isolanti e alle protezioni degli occhi e del viso per uso professionale elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio (GU L 2024/90712 dell'8.11.2024)
12. Decisione di esecuzione (UE) 2025/286 della Commissione, del 13 febbraio 2025, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per i protettori dell’udito, i dispositivi individuali per la protezione contro le cadute e gli equipaggiamenti di protezione degli occhi e del viso elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2025/286 del 14.02.2025). Entrata in vigore: 14.2.2025
13. Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per i protettori dell’udito, i dispositivi di protezione individuale contro le cadute, i protettori delle ginocchia, gli indumenti di protezione contro le punture di zecche e gli elmetti isolanti elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2025/895 del 16.5.2025). Entrata in vigore: 16.05.2025
e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione.
[box-download]In Allegato Documento PDF con l'elenco consolidato delle norme armonizzate DPI a Maggio 2025 riservato Abbonati.[/box-download]
Certifico Srl - IT | Rev. 10.0 2025
©Copia autorizzata Abbonati
Vedi la nuova sezione 2019/2025 "Norme armonizzate click"
...
Elenco consolidato Norme armonizzate Regolamento (UE) 2016/425 DPI al 16 Maggio 2025
Consolidato con:
- la Comunicazione 2018/C 209/03, abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023).
Essa continua tuttavia ad applicarsi ai riferimenti delle norme armonizzate che figurano nell’allegato II della Decisione di esecuzione (UE) 2023/941 fino alle date di ritiro di tali riferimenti indicate nel medesimo allegato.
- la Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 relativa alle norme armonizzate per i dispositivi di protezione individuale elaborate a sostegno del regolamento (UE) 2016/425del Parlamento europeo e del Consiglio. (GU L 125/37 dell'11.5.2023). Entrata in vigore: 11.5.2023
- Decisione di esecuzione (UE) 2023/2752 della Commissione, del 7 dicembre 2023 (GU L 2023/2752 del 11.12.2023). Entrata in vigore: 11.12.2023
- Decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024 (GU L 2024/2599 dell'8.10.2024). Entrata in vigore: 08.10.2024
- Rettifica della decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 (GU L 2024/90712 dell'8.11.2024)
- Decisione di esecuzione (UE) 2025/286 della Commissione, del 13 febbraio 2025 (GU L 2025/286 del 14.02.2025). Entrata in vigore: 14.2.2025
- Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025 (GU L 2025/895 del 16.5.2025). Entrata in vigore: 16.05.2025
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Data di inizio della presunzione di conformità Nota 0 |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione Nota 4 |
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
|
CEN |
EN 136:1998 Apparecchi di protezione delle vie respiratorie - Maschere intere - Requisiti, prove, marcatura EN 136:1998/AC:2003 |
11.05.2023 |
|
|
|
|
CEN |
EN 137:2006 Dispositivi di protezione delle vie respiratorie - Autorespiratori a circuito aperto ad aria compressa con maschera intera - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 140:1998 Apparecchi di protezione delle vie respiratorie - Semimaschere e quarti di maschera - Requisiti, prove, marcatura EN 140:1998/AC:1999 |
11.05.2023 |
|
|
|
|
CEN |
EN 142:2002 Apparecchi di protezione delle vie respiratorie - Boccaglio completo - Requisiti, prove, marcatura |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 143:2000 Apparecchi di protezione delle vie respiratorie - Filtri antipolvere - Requisiti, prove, marcatura |
21.4.2018 |
|
|
Con dec. di esec. (UE) 2022/2414 la norma è ritirata dal 09.06.2024 Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 09.06.2024 |
|
EN 143:2000/AC:2005 |
|
|
|
||
|
EN 143:2000/A1:2006 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 143:2021 Dispositivi di protezione delle vie respiratorie - Filtri antiparticolato - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 144-1:2000 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 1: Raccordo filettato per gambo di collegamento EN 144-1:2000/A1:2003 EN 144-1:2000/A2:2005 |
11.05.2023 |
|
|
|
|
CEN |
EN 144-2:1998 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 2: Raccordi di uscita |
11.05.2023 |
|
|
|
|
CEN |
EN 144-3:2003 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 3: Raccordi di uscita per gas per l’immersione subacquea, Nitrox e ossigeno EN 144-3:2003/AC:2003 |
11.05.2023 |
|
|
|
|
CEN |
EN 145:1997 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito chiuso ad ossigeno compresso o ad ossigeno-azoto compressi - Requisiti, prove, marcatura EN 145:1997/A1:2000 |
11.05.2023 |
|
|
|
|
CEN |
EN 148-1:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 1: Raccordo filettato normalizzato |
11.05.2023 |
|
|
|
|
CEN |
EN 148-2:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 2: Raccordo con filettatura centrale |
11.05.2023 |
|
|
|
|
CEN |
EN 148-3:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 3: Raccordo filettato M 45 x 3 |
11.05.2023 |
|
|
|
|
CEN |
EN 149:2001+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere filtranti antipolvere - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 166:2001 Protezione personale degli occhi - Specifiche |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 169:2002 Protezione personale degli occhi - Filtri per la saldatura e tecniche connesse - Requisiti di trasmissione e utilizzazioni raccomandate |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 170:2002 Protezione personale degli occhi - Filtri ultravioletti - Requisiti di trasmissione e utilizzazioni raccomandate |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 172:1994 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
EN 172:1994/A1:2000 |
21.4.2018 |
Nota 3 |
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
|
EN 172:1994/A2:2001 |
21.4.2018 |
Nota 3 |
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
|
CEN |
EN 174:2001 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’11.11.2024 |
|
CEN |
EN 175:1997 Protezione personale - Equipaggiamenti di protezione degli occhi e del viso durante la saldatura e i procedimenti connessi |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dall’11.11.2025
|
|
CEN |
EN 207:2017 Equipaggiamento di protezione personale degli occhi - Filtri e protettori dell’occhio contro radiazioni laser (protettori dell’occhio per laser) |
11.05.2023 |
|
|
|
|
CEN |
EN 208:2009 Protezione personale degli occhi - Protettori dell’occhio per i lavori di regolazione sui laser e sistemi laser (protettori dell’occhio per regolazioni laser) |
11.05.2023 |
|
|
|
|
CEN |
EN 250:2014 Equipaggiamento per la respirazione - Autorespiratori per uso subacqueo a circuito aperto ad aria compressa - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 342:2017 Indumenti di protezione - Completi e capi di abbigliamento per la protezione contro il freddo |
11.05.2023 |
|
|
|
|
CEN |
EN 343:2019 |
11.05.2023 |
|
|
|
|
CEN |
EN 352-1:2002 Protettori dell'udito - Requisiti generali - Parte 1: Cuffie |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-1:2020 Protettori dell’udito - Requisiti generali - parte 1: Cuffie Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN 352-2:2002 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-2:2020 Protettori dell’udito - Requisiti generali - parte 2: Inserti Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026
|
|
CEN |
EN 352-2:2020+A1:2024 Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425 |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 352-3:2002 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-3:2020 Protettori dell’udito - Requisiti generali - parte 3: Cuffie montate su dispositivi di protezione della testa e/o dispositivi di protezione del viso Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 352-4:2001 Protettori auricolari - Requisiti di sicurezza e prove - Cuffie con risposta in funzione del livello sonoro |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
EN 352-4:2001/A1:2005 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 352-4:2020 Protettori dell’udito - Requisiti di sicurezza - parte 4: Cuffie con risposta in funzione del livello sonoro |
11.05.2023 |
|
|
|
|
CEN |
EN 352-5:2002
|
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
EN 352-5:2002/A1:2005 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 352-5:2020 Protettori dell’udito - Requisiti di sicurezza - parte 5: Cuffie con controllo attivo della riduzione del rumore |
11.05.2023 |
|
|
|
|
CEN |
EN 352-6:2020 Protettori dell’udito - Requisiti di sicurezza - parte 6: Cuffie con comunicazione audio legata alla sicurezza |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-6:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 6: Cuffie con comunicazione audio legata alla sicurezza |
14.02.2025 |
|
|
|
|
CEN |
EN 352-7:2020 Protettori dell’udito - Requisiti di sicurezza - parte 7: Inserti con attenuazione in funzione del livello sonoro |
11.05.2023 |
|
|
|
|
CEN |
EN 352-8:2020 Protettori dell’udito - Requisiti di sicurezza - parte 8: Cuffie con possibilità di ascolto audio non legato al lavoro |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-8:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 8: Cuffie con possibilità di ascolto audio non legato al lavoro |
14.02.2025 |
|
|
|
|
CEN |
EN 352-9:2020 Protettori dell’udito - Requisiti di sicurezza - parte 9: Inserti con comunicazione audio legata alla sicurezza |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-9:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 9: Inserti con comunicazione audio legata alla sicurezza |
14.02.2025 |
|
|
|
|
CEN |
EN 352-10:2020 Protettori dell’udito - Requisiti di sicurezza - parte 10: Inserti con possibilità di ascolto audio non legato al lavoro |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
N 352-10:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 10: Inserti con possibilità di ascolto audio non legato al lavoro |
14.02.2025 |
|
|
|
|
CEN |
EN 353-1:2014+A1:2017 Dispositivi individuali per la protezione contro le cadute - Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio - parte 1: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio rigida |
11.05.2023 |
|
|
|
|
CEN |
EN 353-2:2002 Dispositivi di protezione individuale contro le cadute dall’alto - parte 2: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio flessibile |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 353-2:2024 Dispositivi di protezione individuale contro le cadute - parte 2: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio flessibile |
16.05.2025 |
|
|
|
|
CEN |
EN 354:2010 Dispositivi individuali per la protezione contro le cadute - Cordini |
11.05.2023 |
|
|
|
|
CEN |
EN 355:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Assorbitori di energia |
11.05.2023 |
|
|
|
|
CEN |
EN 358:2018 Dispositivi di protezione individuale per il posizionamento sul lavoro e la prevenzione delle cadute dall’alto - Cinture e cordini di posizionamento sul lavoro o trattenuta |
11.05.2023 |
|
|
|
|
CEN |
EN 360:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Dispositivi anticaduta di tipo retrattile |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 360:2023 Dispositivi individuali per la protezione contro le cadute – Dispositivi anticaduta di tipo retrattile |
08.10.2024 |
|
|
|
|
CEN |
EN 361:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Imbracature per il corpo |
11.05.2023 |
|
|
|
|
CEN |
EN 362:2004 Dispositivi di protezione individuale contro le cadute dall’alto - Connettori |
11.05.2023 |
|
|
|
|
CEN |
EN 365:2004 Dispositivi di protezione individuale contro le cadute dall’alto - Requisiti generali per le istruzioni per l’uso, la manutenzione, l’ispezione periodica, la riparazione, la marcatura e l’imballaggio EN 365:2004/AC:2006 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 374-1:2016 Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - parte 1: Terminologia e requisiti prestazionali per rischi chimici (ISO 374-1:2016) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 374-5:2016 Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - parte 5: Terminologia e requisiti prestazionali per rischi da microorganismi (ISO 374-5:2016) |
11.05.2023 |
|
|
|
|
CEN |
EN 379:2003+A1:2009 Protezione personale degli occhi - Filtri automatici per saldatura |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 388:2016+A1:2018 Guanti di protezione contro rischi meccanici |
11.05.2023 |
|
|
|
|
CEN |
EN 397:2012+A1:2012 Elmetti di protezione per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 402:2003 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito aperto ad aria compressa con dosatore automatico e con maschera intera o boccaglio completo per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 403:2004 Apparecchi di protezione delle vie respiratorie per autosalvataggio - Dispositivi filtranti con cappuccio per la fuga dal fuoco - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 404:2005 Dispositivi di protezione delle vie respiratorie per autosalvataggio - Filtri per autosalvataggio da monossido di carbonio con boccaglio completo |
11.05.2023 |
|
|
|
|
CEN |
EN 405:2001+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere filtranti antigas o antigas e antipolvere dotate di valvole - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 407:2004 Guanti di protezione contro rischi termici (calore e/o fuoco) |
11.05.2023 |
|
|
|
|
CEN |
EN 420:2003+A1:2009 Guanti di protezione - Requisiti generali e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 421:2010 Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattiva |
11.05.2023 |
|
|
|
|
CEN |
EN 443:2008 Elmi per la lotta contro l’incendio in edifici e in altre strutture |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 469:2020 Indumenti di protezione per vigili del fuoco - Requisiti prestazionali per indumenti di protezione per le attività di lotta contro l’incendio |
11.05.2023 |
|
|
|
|
CEN |
EN 510:2019 Specifiche per indumenti di protezione da utilizzare in presenza di rischio di impigliamento con parti in movimento |
11.05.2023 |
|
|
|
|
CEN |
EN 511:2006 Guanti di protezione contro il freddo |
11.05.2023 |
|
|
|
|
CEN |
EN 564:2014 Attrezzatura per alpinismo - Cordino - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 564:2023 Attrezzatura per alpinismo - Cordino - Requisiti di sicurezza e metodi di prova |
08.01.2024 |
|
|
|
|
CEN |
EN 565:2017 Attrezzatura per alpinismo - Fettuccia - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 566:2017 Attrezzatura per alpinismo - Anelli - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 567:2013 Attrezzatura per alpinismo - Bloccanti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 568:2015 Attrezzatura per alpinismo - Ancoraggi da ghiaccio - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 569:2007 Attrezzatura per alpinismo - Chiodi - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 659:2003+A1:2008 Guanti di protezione per vigili del fuoco EN 659:2003+A1:2008/AC:2009 |
11.05.2023 |
|
|
|
|
CEN |
EN 795:2012 Dispositivi individuali per la protezione contro le cadute - Dispositivi di ancoraggio Attenzione: la presente pubblicazione non riguarda l’equipaggiamento descritto in: - tipo A (dispositivi di ancoraggio con uno o più punti di ancoraggio fissi e con la necessità di ancoraggi strutturali o elementi di fissaggio da assicurare alla struttura) di cui ai punti 3.2.1, 4.4.1, 5.3; - tipo C (dispositivi di ancoraggio che utilizzano linee di ancoraggio flessibili orizzontali) di cui ai punti 3.2.3, 4.4.3 e 5.5; - tipo D (dispositivi di ancoraggio che utilizzano linee di ancoraggio rigide orizzontali) di cui ai punti 3.2.4, 4.4.4 e 5.6; - qualunque combinazione degli elementi di cui sopra. Per i tipi A, C e D, la presente pubblicazione non riguarda neppure i punti: 4.5, 5.2.2, 6, 7; Allegati A e ZA. Non vi è di conseguenza alcuna presunzione di conformità alle disposizioni del regolamento (UE) 2016/425 per i tipi di equipaggiamento di cui sopra, in quanto non sono considerati DPI. |
11.05.2023 |
|
|
|
|
CEN |
EN 812:2012 Copricapo antiurto per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 813:2008 Dispositivi individuali per la protezione contro le cadute - Cinture con cosciali |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 813:2024 Dispositivi individuali per la protezione contro le cadute - Cinture con cosciali |
14.02.2025 |
|
|
|
|
CEN |
EN 892:2012+A3:2023 |
11.12.2023 |
|
|
|
|
CEN |
EN 893:2019 Attrezzatura per alpinismo - Ramponi - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 943-1:2015+A1:2019 Indumenti di protezione contro prodotti chimici pericolosi solidi, liquidi e gassosi, inclusi aerosol liquidi e solidi - parte 1: Requisiti prestazionali per tute di protezione chimica di Tipo 1 (a tenuta di gas) |
11.05.2023 |
|
|
|
|
CEN |
EN 943-2:2019 Indumenti di protezione contro prodotti chimici pericolosi solidi, liquidi e gassosi, inclusi aerosol liquidi e solidi - parte 2: Requisiti prestazionali per tute di protezione chimica di Tipo 1 (a tenuta di gas) per squadre di emergenza (ET) |
11.05.2023 |
|
|
|
|
CEN |
EN 958:2017 Attrezzatura per alpinismo - Sistemi di assorbimento di energia utilizzati nelle ascensioni per via ferrata - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 958:2024 Attrezzatura per alpinismo - Sistemi di assorbimento di energia utilizzati nelle ascensioni per via ferrata - Requisiti di sicurezza e metodi di prova |
16.05.2025 |
|
|
|
|
CEN |
EN 966:2012+A1:2012 Caschi per sport aerei |
11.05.2023 |
|
|
|
|
CEN |
EN 1073-1:2016+A1:2018 Indumenti di protezione contro particolati solidi aerotrasportati inclusa la contaminazione radioattiva - parte 1: Requisiti e metodi di prova per indumenti di protezione ventilati con aria compressa dalla linea che proteggono il corpo e i tratti respiratori |
11.05.2023 |
|
|
|
|
CEN |
EN 1073-2:2002 Indumenti di protezione contro la contaminazione radioattiva - parte 2: Requisiti e metodi di prova per indumenti di protezione non ventilati contro la contaminazione radioattiva sotto forma di particelle |
11.05.2023 |
|
|
|
|
CEN |
EN 1077:2007 Caschi per la pratica dello sci alpino e per lo snowboard |
11.05.2023 |
|
|
|
|
CEN |
EN 1078:2012+A1:2012 Caschi per ciclisti e per utilizzatori di tavole a rotelle (skateboards) e pattini a rotelle |
11.05.2023 |
|
|
|
|
CEN |
EN 1080:2013 Caschi di protezione contro gli urti per bambini |
11.05.2023 |
|
|
|
|
CEN |
EN 1082-1:1996 Indumenti di protezione - Guanti e proteggi-braccia contro tagli e coltellate causati da coltelli a mano - parte 1: Guanti e proteggi-braccia di maglia metallica |
11.05.2023 |
|
|
|
|
CEN |
EN 1082-2:2000 Indumenti di protezione - Guanti e proteggi-braccia contro tagli e coltellate causati da coltelli a mano - parte 2: Guanti e proteggi-braccia costruiti con materiale diverso dalla maglia metallica |
11.05.2023 |
|
|
|
|
CEN |
EN 1146:2005 Dispositivi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con cappuccio, per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 1149-5:2018 Indumenti di protezione - Proprietà elettrostatiche - parte 5: Requisiti prestazionali dei materiali e di progettazione |
11.05.2023 |
|
|
|
|
CEN |
EN 1384:2023 Elmetti per attività equestri |
11.12.2023 |
|
|
|
|
CEN |
EN 1385:2012 Elmetti per canoa-kayak e sport in acque torrentizie |
11.05.2023 |
|
|
|
|
CEN |
EN 1486:2007 Indumenti di protezione per vigili del fuoco - Metodi di prova e requisiti per indumenti riflettenti per operazioni speciali di lotta contro l’incendio |
11.05.2023 |
|
|
|
|
CEN |
EN 1497:2007 Dispositivi individuali per la protezione contro le cadute - Imbracature di salvataggio |
11.05.2023 |
|
|
|
|
CEN |
EN 1731:2006 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 1827:1999+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere senza valvole di inspirazione e con filtri smontabili per la protezione contro gas o gas e particelle o solamente particelle - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 1891:1998 Dispositivi di protezione individuale per la prevenzione delle cadute dall’alto - Corde con guaina a basso coefficiente di allungamento |
11.05.2023 |
|
|
|
|
CEN |
EN 1938:2010 Protezione personale degli occhi - Occhiali a visiera per utilizzatori di motocicli e ciclomotori |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 10819:2013 Vibrazioni meccaniche e urti - Vibrazioni al sistema mano-braccio - Metodo per la misurazione e la valutazione della trasmissibilità delle vibrazioni dai guanti al palmo della mano (ISO 10819:2013) EN ISO 10819:2013/A1:2019 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2023/2752 la norma è soppressa dall’11.06.2025 |
|
CEN |
EN ISO 10819:2013 Vibrazioni meccaniche e urti - Vibrazioni al sistema mano-braccio - Metodo per la misurazione e la valutazione della trasmissibilità delle vibrazioni dai guanti al palmo della mano (ISO 10819:2013) |
11.12.2023 |
|
|
|
|
CEN |
EN ISO 10862:2009 Unità di piccole dimensioni - Sistema di sgancio rapido per imbracatura a trapezio (ISO 10862:2009) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-2:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 2: Requisiti prestazionali e metodi di prova per protettori delle gambe (ISO 11393-2:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-4:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 4: Requisiti prestazionali e metodi di prova per guanti di protezione (ISO 11393-4:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-5:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 5: Requisiti prestazionali e metodi di prova per ghette di protezione (ISO 11393-5:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-6:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 6: Requisiti prestazionali e metodi di prova per protettori per la parte superiore del corpo (ISO 11393-6:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN 12021:2014 Equipaggiamento per la respirazione - Gas compressi per respiratori |
11.05.2023 |
|
|
|
|
CEN |
EN 12083:1998 Apparecchi di protezione delle vie respiratorie - Filtri con tubi di respirazione (filtri non montati su maschera) - Filtri antipolvere, filtri antigas e filtri combinati - Requisiti, prove, marcatura EN 12083:1998/AC:2000 |
11.05.2023 |
|
|
|
|
CEN |
EN 12270:2013 Attrezzatura per alpinismo - Blocchi da incastro - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12275:2013 Attrezzatura per alpinismo - Connettori - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12276:2013 Attrezzatura per alpinismo - Ancoraggi regolabili - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12277:2015+A1:2018 Attrezzatura per alpinismo - Imbracature - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12278:2007 Attrezzatura per alpinismo - Pulegge - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12312-1:2013 Protezione degli occhi e del viso - Occhiali da sole e dispositivi similari - parte 1: Occhiali da sole per uso generale (ISO 12312-1:2013) EN ISO 12312-1:2013/A1:2015 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12312-2:2015 Protezione degli occhi e del viso - Occhiali da sole e dispositivi similari - parte 2: Filtri per l’osservazione diretta del sole (ISO 12312-2:2015) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12401:2009 Unità di piccole dimensioni - Imbracatura di sicurezza da ponte e nastro di sicurezza - Requisiti di sicurezza e metodi di prova (ISO 12401:2009) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-2:2020 Dispositivi individuali di galleggiamento - parte 2: Giubbotti di salvataggio, livello prestazionale 275 - Requisiti di sicurezza (ISO 12402-2:2020) Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-3:2020 Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-4:2020 Dispositivi individuali di galleggiamento - parte 4: Giubbotti di salvataggio, livello prestazionale 100 - Requisiti di sicurezza (ISO 12402-4:2020) Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-5:2020 Dispositivi individuali di galleggiamento - parte 5: Aiuti al galleggiamento (livello 50) - Requisiti di sicurezza (ISO 12402-5:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-6:2020 Dispositivi individuali di galleggiamento - parte 6: Giubbotti di salvataggio e aiuti al galleggiamento per applicazioni speciali - Requisiti di sicurezza e metodi di prova supplementari (ISO 12402-6:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-8:2020 Dispositivi individuali di galleggiamento - parte 8: Accessori - Requisiti di sicurezza e metodi di prova (ISO 12402-8:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN 12477:2001 Guanti di protezione per saldatori EN 12477:2001/A1:2005 |
11.05.2023 |
|
|
|
|
CEN |
EN 12492:2012 Attrezzature per alpinismo - Caschi per alpinisti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12841:2006 Dispositivi individuali per la protezione contro le cadute - Sistemi di accesso con fune - Dispositivi di regolazione della fune |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 12841:2024 Dispositivi individuali per la protezione contro le cadute - Sistemi di accesso con fune - Dispositivi di regolazione della fune |
08.10.2024 |
|
|
|
|
CEN |
EN 12941:1998 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di elmetto o cappuccio - Requisiti, prove, marcatura EN 12941:1998/A1:2003 EN 12941:1998/A2:2008 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.10.2026 |
|
CEN |
EN 12941:2023 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di facciali non ermetici - Requisiti, prove, marcatura |
08.10.2024 |
|
|
|
|
CEN |
EN 12942:1998 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di maschere intere, semimaschere o quarti di maschere - Requisiti, prove, marcatura EN 12942:1998/A1:2002 EN 12942:1998/A2:2008 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.10.2026 |
|
CEN |
EN 12942:2023 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di maschere intere, semimaschere o quarti di maschere - Requisiti, prove, marcatura |
08.10.2024 |
|
|
|
|
CEN |
EN 13034:2005+A1:2009 Indumenti di protezione contro agenti chimici liquidi - Requisiti prestazionali per indumenti di protezione chimica che offrono una protezione limitata contro agenti chimici liquidi (equipaggiamento tipo 6 e tipo PB [6]) |
11.05.2023 |
|
|
|
|
CEN |
EN 13061:2009 Indumenti di protezione - Parastinchi per giocatori di calcio - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13089:2011+A3:2023 Attrezzatura per alpinismo - Utensili da ghiaccio – Requisiti di sicurezza e metodi di prova |
11.12.2023 |
|
|
|
|
CEN |
EN 13138-1:2021 Aiuti al galleggiamento per l’apprendimento delle tecniche di nuoto - parte 1: Requisiti di sicurezza e metodi di prova per aiuti al galleggiamento destinati ad essere indossati EN 13138-1:2021/AC:2022 |
11.05.2023 |
|
|
|
|
CEN |
EN 13158:2018 Indumenti di protezione - Giacche di protezione, protettori del corpo e delle spalle per uso equestre, per cavalieri e persone che lavorano con cavalli e per conducenti di cavalli - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13178:2000 Protezione personale degli occhi - Protettori dell’occhio per utilizzatori di motoslitte |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-1:2000 Equipaggiamento di protezione per arti marziali - parte 1: Requisiti e metodi di prova generali |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-2:2000 Equipaggiamento di protezione per arti marziali - parte 2: Requisiti e metodi di prova supplementari per protettori del collo del piede, per protettori della tibia e per protettori dell’avambraccio |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-3:2013 Equipaggiamento di protezione per arti marziali - parte 3: Requisiti e metodi di prova supplementari per protettori del torso |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-4:2001 Equipaggiamento di protezione per arti marziali - parte 4: Requisiti e metodi di prova supplementari per protettori della testa EN 13277-4:2001/A1:2007 |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-5:2002 Equipaggiamenti di protezione per arti marziali - parte 5: Requisiti e metodi di prova supplementari per conchiglie e protettori addominali |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-6:2003 Equipaggiamenti di protezione per arti marziali — parte 6: Requisiti e metodi di prova supplementari per protettori del petto per donne |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-7:2009 Equipaggiamento di protezione per arti marziali - parte 7: Requisiti e metodi di prova supplementari per protettori delle mani e dei piedi |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-8:2017 Equipaggiamento di protezione per arti marziali - parte 8: Requisiti e metodi di prova supplementari per protettori del viso per karate |
11.05.2023 |
|
|
|
|
CEN |
EN 13484:2012 Caschi per utilizzatori di slittini |
11.05.2023 |
|
|
|
|
CEN |
EN 13546:2002+A1:2007 Indumenti di protezione - Protettori delle mani, delle braccia, del torace, dell’addome, delle gambe, dei piedi e conchiglie per portieri di hockey su prato e protettori della tibia per giocatori - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13567:2002+A1:2007 Indumenti di protezione - Protettori delle mani, delle braccia, del torace, dell’addome, delle gambe, del viso e conchiglie per schermidori - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13688:2013 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 09.06.2024 |
|
CEN |
EN 13594:2015 Guanti di protezione per motociclisti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13634:2017 Calzature di protezione per motociclisti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13688:2013 Indumenti di protezione - Requisiti generali (ISO 13688:2013) EN ISO 13688:2013/A1:2021 |
11.05.2023 |
|
|
|
|
CEN |
EN 13781:2012 Caschi di protezione per conducenti e passeggeri di motoslitte e bob |
11.05.2023 |
|
|
|
|
CEN |
EN 13794:2002 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito chiuso per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 13832-2:2018 Calzature di protezione contro agenti chimici - parte 2: Requisiti per il contatto limitato con gli agenti chimici |
11.05.2023 |
|
|
|
|
CEN |
EN 13832-3:2018 Calzature di protezione contro agenti chimici - parte 3: Requisiti per il contatto prolungato con gli agenti chimici |
11.05.2023 |
|
|
|
|
CEN |
EN 13949:2003 Equipaggiamento per la respirazione - Autorespiratori per uso subacqueo a circuito aperto per uso con Nitrox e ossigeno compressi - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13982-1:2004 Indumenti di protezione per l’utilizzo contro particelle solide - parte 1: Requisiti prestazionali per indumenti di protezione contro prodotti chimici che offrono protezione all’intero corpo contro particelle solide disperse nell’aria (indumenti tipo 5) (ISO 13982-1:2004) EN ISO 13982-1:2004/A1:2010 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13998:2003 Indumenti di protezione - Grembiuli, pantaloni e giubbetti di protezione contro tagli e coltellate causati da coltelli a mano (ISO 13998:2003) |
11.05.2023 |
|
|
|
|
CEN |
EN 14021:2003 Pettorina per il motociclismo fuoristrada adatta a proteggere il motociclista da pietre e detriti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14052:2012+A1:2012 Elmetti ad elevate prestazioni per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 14058:2017 Indumenti di protezione - Capi di abbigliamento per la protezione contro gli ambienti freddi |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 14058:2017+A1:2023 Indumenti di protezione - Capi di abbigliamento per la protezione contro gli ambienti freddi |
08.10.2024 |
|
|
|
|
CEN |
EN 14120:2003+A1:2007 Indumenti di protezione - Protettori di polsi, palme, ginocchia e gomiti per utilizzatori di attrezzature per sport su rotelle - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14126:2003 Indumenti di protezione - Requisiti prestazionali e metodi di prova per gli indumenti di protezione contro gli agenti infettivi EN 14126:2003/AC:2004 |
11.05.2023 |
|
|
|
|
CEN |
EN 14143:2013 Equipaggiamento per la respirazione - Autorespiratori a circuito chiuso per uso subacqueo |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-1:2017 Tute per immersione - parte 1: Tute umide - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-2:2017 Tute per immersione - parte 2: Tute stagne - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-3:2017 Tute per immersione - parte 3: Tuta con sistemi attivi di riscaldamento o di raffreddamento - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14328:2005 Indumenti di protezione - Guanti e proteggi-braccia contro tagli causati da coltelli motorizzati - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14387:2004+A1:2008 Dispositivi di protezione delle vie respiratorie - Filtri antigas e filtri combinati - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14404-2:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 2: Requisiti per i protettori del ginocchio indossabili (tipo 1) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14404-3:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 3: Requisiti per la combinazione individuale di ginocchiere e indumenti (tipo 2) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
Avvertenza: oltre che ai punti 5.5.1.1, 5.5.1.2, 5.5.5.1 e 5.5.5.2, è necessaria anche la conformità al punto 5.5.1.3 per conferire una presunzione di conformità ai requisiti essenziali di cui all’allegato II, punto 1.3.1, del regolamento (UE) 2016/425. |
|||||
|
CEN |
EN 14404-4:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 4: Requisiti per la combinazione di ginocchiere e indumenti interoperabili (tipo 2) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14404-6:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 6: Requisiti per i sistemi di inginocchiamento (tipo 4) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14435:2004 Apparecchi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con semimaschera, progettati per essere utilizzati solamente con pressione positiva - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14458:2018 Equipaggiamento individuale per gli occhi - Visiere ad alte prestazioni destinate all’uso con caschi/elmetti di protezione |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 14460:1999 Indumenti di protezione per piloti di automobili - Protezione contro calore e fuoco - Requisiti prestazionali e metodi di prova (ISO 14460:1999) EN ISO 14460:1999/AC:1999 EN ISO 14460:1999/A1:2002 |
11.05.2023 |
|
|
|
|
CEN |
EN 14529:2005 Dispositivi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con semimaschera, progettati per comprendere un dosatore automatico a pressione positiva, solamente per scopi di fuga |
11.05.2023 |
|
|
|
|
CEN |
EN 14593-1:2005 Apparecchi di protezione delle vie respiratorie - Respiratori ad aria compressa alimentati dalla linea con erogatore a domanda - parte 1: Apparecchi con maschera intera - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14594:2018 Apparecchi di protezione delle vie respiratorie - Respiratori ad aria compressa, a flusso continuo, alimentati dalla linea - Requisiti, prove e marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14605:2005+A1:2009 Indumenti di protezione contro agenti chimici liquidi - Requisiti prestazionali per indumenti con collegamenti a tenuta di liquido (Tipo 3) o a tenuta di spruzzi (Tipo 4), inclusi gli articoli che proteggono solamente parti del corpo (Tipi PB [3] e PB [4]) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 14877:2002 Indumenti di protezione per operazioni di sabbiatura con abrasivi in grani (ISO 14877:2002) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 15027-1:2012 Tute di protezione termica in caso di immersione - parte 1: Tute da indossare permanentemente, requisiti inclusa la sicurezza (ISO 15027-1:2012) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 15027-2:2012 Tute di protezione termica in caso di immersione - parte 2: Tute per abbandono, requisiti inclusa la sicurezza (ISO 15027-2:2012) |
11.05.2023 |
|
|
|
|
CEN |
EN 15090:2012 Calzature per vigili del fuoco |
11.05.2023 |
|
|
|
|
CEN |
EN 15151-1:2012 Attrezzatura per alpinismo - Dispositivi di frenatura - parte 1: Dispositivi di frenatura con bloccaggio manuale assistito, requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 15333-1:2008 Equipaggiamento per la respirazione - Apparecchi subacquei a circuito aperto a gas compresso alimentati tramite ombelicale - parte 1: Apparecchi a domanda EN 15333-1:2008/AC:2009 |
11.05.2023 |
|
|
|
|
CEN |
EN 15333-2:2009 Equipaggiamento per la respirazione - Apparecchi subacquei a circuito aperto a gas compresso alimentati tramite ombelicale - parte 2: Apparecchi a flusso continuo |
11.05.2023 |
|
|
|
|
CEN |
EN 15613:2008 Protettori di ginocchia e gomiti per sport all’interno (indoor) - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 16027:2011 Indumenti di protezione - Guanti con effetto di protezione per i portieri di calcio |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-1:2022 Protezione degli occhi e del viso per uso professionale - parte 1: Requisiti generali (ISO 16321-1:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-2:2021 Protezione degli occhi e del viso per uso professionale - parte 2: Requisiti aggiuntivi per protezioni utilizzate durante la saldatura e tecniche correlate (ISO 16321-2:2021) Avvertenza: questa norma rinvia al riferimento normativo EN ISO 16321-1:2020, la cui data non è corretta. Esso deve invece essere inteso come EN ISO 16321-1:2022. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-3:2022 Protezione degli occhi e del viso per uso professionale - parte 3: Requisiti aggiuntivi per protezioni a maglia (ISO 16321-3:2021) Avvertenza: questa norma rinvia al riferimento normativo EN ISO 16321-1:2020, la cui data non è corretta. Esso deve invece essere inteso come EN ISO 16321-1:2022. |
11.05.2023 |
|
|
|
|
CEN |
EN 16350:2014 Guanti di protezione - Proprietà elettrostatiche |
11.05.2023 |
|
|
|
|
CEN |
EN 16473:2014 Elmi per vigili del fuoco - Elmi per soccorsi tecnici |
11.05.2023 |
|
|
|
|
CEN |
EN 16716:2017 Attrezzatura per alpinismo - Sistemi di airbag da valanga - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-2:2020 Indumenti protettivi per motociclisti - parte 2: Indumenti di classe AAA - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-3:2020 Indumenti protettivi per motociclisti - parte 3: Indumenti di classe AA - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-4:2020 Indumenti protettivi per motociclisti - parte 4: Indumenti di classe A - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-5:2020 Indumenti protettivi per motociclisti - parte 5: Indumenti di classe B - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-6:2020 Indumenti protettivi per motociclisti - parte 6: Indumenti di classe C - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17109:2020 Attrezzatura per alpinismo - Sistemi di sicurezza individuali per percorsi acrobatici - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 17109:2020+A1:2024 Attrezzatura per alpinismo - Sistemi di sicurezza individuali per percorsi acrobatici - Requisiti di sicurezza e metodi di prova |
16.05.2025 |
|
|
|
|
CEN |
EN ISO 17249:2013 Calzature di sicurezza con resistenza al taglio da sega a catena (ISO 17249:2013) EN ISO 17249:2013/AC:2014 |
11.05.2023 |
|
|
|
|
CEN |
EN 17353:2020 Indumenti di protezione - Attrezzatura di visibilità migliorata per situazioni a medio rischio - Metodi di prova e requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17487:2024 Indumenti di protezione - Indumenti trattati con permetrina come articoli che supportano la protezione contro le punture di zecche |
16.05.2025 |
|
|
|
|
CEN |
EN 17520:2021 Attrezzatura per alpinismo - Cordini autoassicuranti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 18527-1:2022 Dispositivi di protezione degli occhi e del viso per utilizzo sportivo - parte 1: Requisiti delle maschere per lo sci da discesa e lo snowboard (ISO 18527-1:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 18527-2:2021 Protezione degli occhi e del viso per uso sportivo - parte 2: Requisiti per le protezioni per gli occhi per lo squash e le protezioni per gli occhi per il racquetball e lo squash 57 (ISO 18527-2:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20320:2020 Indumenti di protezione per l’utilizzo nello snowboard - Protettori del polso - Requisiti e metodi di prova (ISO 20320:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20345:2011 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’11.11.2024 |
|
CEN |
EN ISO 20345:2022 Dispositivi di protezione individuale - Calzature di sicurezza (ISO 20345:2021) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20345:2022 Dispositivi di protezione individuale – Calzature di sicurezza (ISO 20345:2021) EN ISO 20345:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20346:2014 Dispositivi di protezione individuale - Calzature di protezione (ISO 20346:2014) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20346:2022 Dispositivi di protezione individuale – Calzature di protezione (ISO 20346:2021) EN ISO 20346:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20347:2012 Dispositivi di protezione individuale - Calzature da lavoro (ISO 20347:2012) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20347:2022 Dispositivi di protezione individuale - Calzature da lavoro (ISO 20347:2021) EN ISO 20347:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20349-1:2017 Dispositivi di protezione individuale - Calzature di protezione contro i rischi presenti nelle fonderie e nelle operazioni di saldatura - parte 1: Requisiti e metodo di prova per la protezione contro i rischi presenti nelle fonderie (ISO 20349-1:2017) EN ISO 20349-1:2017/A1:2020 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20349-2:2017 Dispositivi di protezione individuale - Calzature di protezione contro i rischi presenti nelle fonderie e nelle operazioni di saldatura - parte 2: Requisiti e metodi di prova per la protezione contro i rischi presenti nelle operazioni di saldatura e nei procedimenti connessi (ISO 20349-2:2017) EN ISO 20349-2:2017/A1:2020 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20471:2013 Indumenti ad alta visibilità - Metodi di prova e requisiti (ISO 20471:2013, versione rettificata 2013-06-01) EN ISO 20471:2013/A1:2016 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 27065:2017 Indumenti di protezione - Requisiti prestazionali per indumenti di protezione indossati da operatori che applicano prodotti pesticidi e lavoratori esposti a questi pesticidi applicati (ISO 27065:2017) EN ISO 27065:2017/A1:2019 |
11.05.2023 |
|
|
|
|
CEN |
EN 50321-1:2018 Lavori sotto tensione - Calzature di protezione dielettrica - Calzature e sovrastivali isolanti EN 50321-1:2018/AC:2018-08 |
11.05.2023 |
|
|
|
|
CEN |
EN 50365:2023 Lavori sotto tensione – Elmetti isolanti da utilizzare su impianti di media e bassa tensione EN 50365:2023/AC:2024-09 |
08.10.2024 |
|
|
Decisione di esecuzione (UE) 2024/2599 Norma sostituita dalla Decisione di esecuzione (UE) 2025/895 |
|
CEN |
EN 61482-2:2020 Lavori sotto tensione - Indumenti protettivi contro l’effetto termico dell’arco elettrico - parte 2: Prescrizioni (IEC 61482-2:2018, modificata) |
11.05.2023 |
|
|
|
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, 1040 Bruxelles, Tel. + 32 25500811; Fax + 32 25500819 (http://www.cen.eu)
- CENELEC: Rue de la Science 23, 1040 Bruxelles, Tel. + 32 25500811; Fax + 32 25500819 (http://www.cenelec.eu)
- ETSI: 650 route des Lucioles, 06921 Sophia Antipolis, Tel.+33 492944200; Fax + 33 493654716, (http://www.etsi.eu)
(2) GU C 338 del 27.9.2014, pag. 31.
Nota 0: questa è la data a partire dalla quale il rispetto della norma armonizzata o di parti di essa conferisce una presunzione di conformità alle prescrizioni pertinenti della legislazione dell'Unione
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata.
Nota 4: Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione. (Vedasi Com.(2018) 764 EC).
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui l’elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (2).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet: http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
_______
Collegati:
[box-note]Vedi la nuova sezione 2019/2020/2021/2022/2023/2024 "Norme armonizzate click"[/box-note]
Decreto 20 febbraio 2020 n. 32

Decreto 20 febbraio 2020 n. 32
Regolamento recante modifica dell'Allegato II del decreto legislativo 4 settembre 2002, n. 262.
(GU Serie Generale n.124 del 15-05-2020)
Entrata in vigore del provvedimento: 30/05/2020
...
Articolo unico
Modifiche all’Allegato II del decreto legislativo 4 settembre 2002, n. 262.
1. All’Allegato II del decreto legislativo 4 settembre 2002, n. 262, sono apportate le seguenti modificazioni:
a) le parole: «rinvio al presente decreto» sono sostituite dalle seguenti: «rinvio alla direttiva n. 2000/14/CE»;
b) le parole: «dichiarazione di conformità ai requisiti del presente decreto» sono sostituite dalle seguenti:
«dichiarazione di conformità ai requisiti della direttiva n. 2000/14/CE»
...
Collegati:
[box-note]Decreto Legislativo n. 262 del 4 settembre 2002
Decreto Legislativo 17 febbraio 2017 n. 41
ebook Direttiva rumore macchine all'aperto (OND)
Decreto 4 ottobre 2011[/box-note]
Regolamento di esecuzione (UE) 2020/639
Regolamento di esecuzione (UE) 2020/639
della Commissione del 12 maggio 2020 che modifica il regolamento di esecuzione (UE) 2019/947 per quanto riguarda gli scenari standard per le operazioni effettuate entro o oltre la distanza di visibilità
GU L 150/1 del 13.05.2020
Entrata in vigore: 02.06.2020
...
Articolo 1 Modifiche del regolamento di esecuzione (UE) 2019/947
Il regolamento di esecuzione (UE) 2019/947 è così modificato:
1) All’articolo 2 sono aggiunti i seguenti punti da 24) a 34):
«24) “osservatore dell’aeromobile senza equipaggio”: una persona, posta a fianco del pilota remoto, che, mediante l’osservazione visiva senza strumenti dell’aeromobile senza equipaggio, aiuta il pilota remoto a mantenere l’aeromobile senza equipaggio in VLOS e ad effettuare il volo in sicurezza;
25) “osservatore dello spazio aereo”: una persona che assiste il pilota remoto mediante una scansione visiva senza strumenti dello spazio aereo in cui opera l’aeromobile senza equipaggio, al fine di prevenire potenziali rischi in volo;
26) “unità di comando” (“CU”, command unit): il dispositivo o il sistema di dispositivi di controllo remoto di aeromobili senza equipaggio quale definito all’articolo 3, punto 32), del regolamento (UE) 2018/1139, che supporta il controllo o il monitoraggio degli aeromobili senza equipaggio in tutte le fasi del volo, ad eccezione delle infrastrutture di supporto al servizio di collegamento per le funzioni di comando e controllo (C2);
27) “servizio di collegamento C2”: un servizio di comunicazione fornito da un terzo, che assicura le funzioni di comando e controllo tra gli aeromobili senza equipaggio e la CU;
28) “geografia di volo”: il volume dello spazio aereo definito nello spazio e nel tempo, in cui l’operatore UAS prevede di effettuare l’operazione secondo le normali procedure di cui all’appendice 5, punto 6, lettera c), dell’allegato;
29) “area della geografia di volo”: la proiezione della geografia di volo sulla superficie terrestre;
30) “volume di contingenza”: il volume di spazio aereo al di fuori della geografia di volo, in cui si applicano le procedure di contingenza di cui all’appendice 5, punto 6, lettera d), dell’allegato;
31) “area di contingenza”: la proiezione del volume di contingenza sulla superficie terrestre;
32) “volume delle operazioni”: la combinazione della geografia di volo e del volume di contingenza;
33) “buffer contro i rischi a terra”: un’area sulla superficie terrestre, che circonda il volume operativo ed è specificamente designata per ridurre al minimo i rischi a terra per i terzi nei casi in cui gli aeromobili senza equipaggio lascino il volume delle operazioni;
34) “notte”: le ore comprese tra la fine del crepuscolo serale civile e l’inizio del crepuscolo mattutino civile, quale definita nel regolamento di esecuzione (UE) n. 923/2012 della Commissione (*)..
_____________
(*) Regolamento di esecuzione (UE) n. 923/2012 della Commissione, del 26 settembre 2012, che stabilisce regole dell’aria comuni e disposizioni operative concernenti servizi e procedure della navigazione aerea e che modifica il regolamento di esecuzione (UE) n. 1035/2011 e i regolamenti (CE) n. 1265/2007, (CE) n. 1794/2006, (CE) n. 730/2006, (CE) n. 1033/2006 e (UE) n. 255/2010 (GU L 281 del 13.10.2012, pag. 1).»;
2) all’articolo 5, il paragrafo 5 è sostituito dal seguente:
«5. L’operatore UAS che presenti una dichiarazione all’autorità competente dello Stato membro di immatricolazione in conformità alla parte B, punto UAS.SPEC.020, dell’allegato, per un’operazione conforme a uno scenario standard di cui all’appendice 1 di tale allegato, non è tenuto a ottenere un’autorizzazione operativa in conformità ai paragrafi da 1 a 4 del presente articolo e si applica la procedura di cui all’articolo 12, paragrafo 5. L’operatore UAS si avvale della dichiarazione di cui all’appendice 2 di tale allegato.»;
3) all’articolo 13 è aggiunto un nuovo paragrafo 4:
«4. Qualora intenda effettuare un’operazione nella categoria “specifica”, da svolgersi in tutto o in parte nello spazio aereo di uno Stato membro diverso dallo Stato membro di immatricolazione, l’operatore UAS titolare di un LUC con privilegi in conformità al punto UAS.LUC.060 dell’allegato fornisce all’autorità competente dello Stato membro dell’operazione prevista le seguenti informazioni:
a) una copia delle condizioni di approvazione ricevute in conformità al punto UAS.LUC.050 dell’allegato; e
b) il luogo o i luoghi dell’operazione prevista in conformità al paragrafo 1, lettera b), del presente articolo.»;
4) all’articolo 14 è aggiunto il seguente paragrafo 9:
«9. In aggiunta ai dati di cui al paragrafo 2, gli Stati membri possono raccogliere ulteriori informazioni sull’identità presso gli operatori UAS.»;
5) all’articolo 15, paragrafo 1, la lettera a) è sostituita dalla seguente:
«a) vietare alcune o tutte le operazioni UAS, richiedere particolari condizioni per alcune o per tutte le operazioni UAS o richiedere un’autorizzazione di volo preventiva per alcune o per tutte le operazioni UAS;»;
6) l’articolo 22 è sostituito dal seguente:
«Articolo 22
Fatto salvo l’articolo 20, l’uso di UAS nella categoria “aperta” che non siano conformi ai requisiti di cui alle parti da 1 a 5 dell’allegato del regolamento delegato (UE) 2019/945 della Commissione (*) è consentito per un periodo transitorio di due anni a decorrere da un anno dalla data di entrata in vigore del presente regolamento, nel rispetto delle seguenti condizioni:
a) gli aeromobili senza equipaggio con una massa al decollo inferiore a 500 g sono utilizzati conformemente ai requisiti operativi di cui alla parte A, punto UAS.OPEN.020, punto 1, dell’allegato, da un pilota remoto con un livello di competenza definito dallo Stato membro interessato;
b) gli aeromobili senza equipaggio con una massa al decollo inferiore a 2 kg sono utilizzati mantenendo una distanza minima orizzontale di 50 metri dalle persone e i piloti remoti devono avere un livello di competenza almeno equivalente a quello di cui alla parte A, punto UAS.OPEN.030, punto 2, dell’allegato;
c) gli aeromobili senza equipaggio con una massa al decollo inferiore a 25 kg sono utilizzati rispettando i requisiti operativi di cui al punto UAS.OPEN.040, punti 1 e 2, e i piloti remoti hanno un livello di competenza almeno equivalente a quello di cui alla parte A, punto UAS.OPEN.020, punto 4, lettera b), dell’allegato.
_____________
(*) Regolamento delegato (UE) 2019/945 della Commissione, del 12 marzo 2019, relativo ai sistemi aeromobili senza equipaggio e agli operatori di paesi terzi di sistemi aeromobili senza equipaggio (GU L 152 dell’11.6.2019, pag. 1).»;
7) l’articolo 23 è sostituito dal seguente:
«Articolo 23
1. Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 1° luglio 2020.
2. L’articolo 5, paragrafo 5, e il punto UAS.SPEC.050, punto 1, lettera l), si applicano a decorrere dal 2 dicembre 2021.
3. Il punto UAS.OPEN.060, punto 2, lettera g), si applica a decorrere dal 1° luglio 2022.
4. Fatto salvo l’articolo 21, paragrafo 1, fino al 2 dicembre 2021 gli Stati membri possono accettare dichiarazioni rese dagli operatori UAS in conformità all’articolo 5, paragrafo 5, sulla base di scenari standard nazionali o equivalenti, se tali scenari nazionali soddisfano i requisiti di cui al punto UAS.SPEC.020 dell’allegato.
Tali dichiarazioni cessano di essere valide dal 2 dicembre 2023.
5. L’articolo 15, paragrafo 3, si applica a decorrere dal 1° luglio 2021.»;
8) l’allegato è sostituito dall’allegato del presente regolamento.
...
Collegati:
[box-note]Regolamento delegato (UE) 2019/945
Droni: il Nuovo Regolamento Unico Europeo e marcatura CE a breve
Regolamento di esecuzione (UE) 2019/947[/box-note]
EN IEC IEEE 82079-1:2020 | Istruzioni per l’uso di un prodotto
EN IEC IEEE 82079-1:2020 | Istruzioni per l’uso di un prodotto
ID 11177 | Rev. 1.0 del 19.05.2025 / Documento di approfondimento in allegato
La norma EN IEC IEEE 82079 fornisce principi e requisiti generali per la redazione delle informazioni per l'uso dei prodotti. Le informazioni per l'uso sono:
- necessarie per l'uso sicuro di un prodotto;
- utili per l'uso efficiente ed efficace di un prodotto; e
- spesso necessarie per adempiere agli obblighi di mercato, legali e regolamentari.
[box-note]Rev. 1.0 2025
Aggiornamento in accordo alla versione in lingua italiana della norma CEI UNI EN IEC/IEEE 82079-1.[/box-note]
I prodotti per cui può essere presa come riferimento questa norma includono, ad esempio:
[panel]- prodotti industriali (ad esempio macchine, componenti, dispositivi e apparecchiature);
- prodotti di consumo (ad esempio apparecchi elettrodomestici, dispositivi audio video, dispositivi di comunicazione e prodotti fai-da-te);
- dispositivi, apparecchiature e sistemi medici;
- sistemi complessi contenuti all’interno di altri sistemi (ad esempio impianti industriali, raffinerie, siti di produzione e data center);
- mezzi di trasporto (ad esempio automobili, camion, navi e aeroplani);
- software applicativi (ad esempio software per ufficio e applicazioni web);
- software per il funzionamento e controllo automatico dei sistemi; e
- servizi tecnici.[/panel]
[box-info]IEC/IEEE 82079-1:2019 - Preparation of information for use (instructions for use) of products - Part 1: Principles and general requirements (Data di pubblicazione: 20 Maggio 2019)
EN IEC/IEEE 82079-1:2020 - Preparation of information for use (instructions for use) of products - Part 1: Principles and general requirements (Data di pubblicazione: 10 Marzo 2020)
CEI UNI EN IEC/IEEE 82079-1 - Preparazione di informazioni per l’uso (istruzioni per l’uso) dei prodotti - Parte 1: Principi e prescrizioni generali (CEI: 3-65) (Data di pubblicazione: Agosto 2021)) - Versione in lingua Italiana[/box-info]
Le informazioni per l’uso dei prodotti si applicano alle fasi del ciclo di vita del prodotto, come trasporto, assemblaggio, installazione, messa in servizio, funzionamento, monitoraggio, troubleshooting, manutenzione, riparazione, dismissione e smaltimento, e alle specifiche attività svolte da personale qualificato e non qualificato.
La norma EN IEC IEEE 82079 si applica alle informazioni per l’uso fornite come prodotti informativi, sia in formato elettronico che cartaceo, ad esempio:
[panel]- informazioni per l’ assistenza alle macchine, fornite come PDF da scaricare via web e ad uso dei tecnici qualificati per l’assistenza;
- informazioni per l’uso dei software, fornite in formato elettronico insieme al software come help online;
- informazioni per il troubleshooting ad uso dell’ operatore, visibili sul display della macchina; - descrizione sul funzionamento di un dispositivo medico presente sul sito web;
- informazioni per l’ assemblaggio, stampate e fornite nell’imballo di un mobile destinato ai consumatori;
- informazioni cartacee per la manutenzione di una macchina da caffè automatica;
- informazioni per l’installazione di un sensore di sicurezza, scaricabili da un sito web ad uso degli ingegneri meccanici;
- tutorial di prodotto come supporto alla formazione basata sul web
- materiali per la formazione on site sui prodotti; e
- etichette per il personale addetto al trasporto, stampate sull’imballaggio di un recipiente per contenere prodotti pesanti.[/panel]
La norma è destinata all'uso di tutte le parti responsabili o coinvolte nella progettazione, creazione, manutenzione, traduzione, localizzazione, integrazione del contenuto, produzione, fornitura e valutazione, acquisizione e distribuzione di informazioni per l’uso. Le parti interessate alle informazioni per l’uso comprendono:
- acquirenti e fornitori dei prodotti;
- manager con responsabilità di processo o prodotto;
- titolari e creatori di contenuti, come redattori tecnici, sviluppatori di informazioni e illustratori;
- traduttori tecnici, esperti in localizzazione e terminologia; e
- autorità, agenzie ed esperti autorizzati.
Lo scopo della norma è fornire a queste parti le basi comuni e le basi per lo sviluppo delle informazioni per l’ uso di prodotti supportati, della qualità richiesta.
[panel]Indice
1. Premessa
2. Soddisfacimento dei requisiti per le informazioni per l'Uso
2.1 Valutazione delle informazioni per l’uso di un prodotto destinato ai consumatori
2.2 Evidenza documentale della valutazione
3. Principi
3.1 Scopo delle informazioni per l'uso
3.2 Informazioni per l'uso come parte del prodotto
3.3 Orientamento del pubblico destinatario
3.4 Uso sicuro del prodotto supportato
3.5 Conformità del prodotto per mezzo delle informazioni per l'uso
3.6 Qualità delle informazioni
3.7 Completezza
3.8 Minimalismo
3.9 Correttezza
3.10 Sintesi
3.11 Coerenza
3.12 Comprensibilità
3.13 Accessibilità
3.14 Uso di processi ripetibili
4. Processo di gestione delle informazioni
4.1 Analisi e pianificazione delle informazioni
4.2 Destinatari
4.3 Supporti
4.4 Lingue
4.5 Fonti dell'informazione
4.6 Mantenimento delle informazioni
4.7 Gestione del rischio
4.8 Accordi contrattuali e vincoli legali
4.9 Gestione e controllo del progetto
4.10 Gestione della configurazione
4.11 Gestione delle risorse umane
4.12 Assicurazione qualità
4.13 Progettazione e sviluppo, inclusi revisione, editing e verifica
4.14 Progettazione, raccolta delle informazioni e sviluppo
4.15 Revisione, modifica e test
4.6 Produzione e distribuzione
4.7 Sostegno, manutenzione e miglioramento
5. Contenuto delle istruzioni
6. Dimensioni minime raccomandate per il font e altezze dei segnali di sicurezza e dei simboli grafici
7. Guida alla valutazione
7.1 Verifica della comprensibilità
7.2 Ispezione per la verifica dell’efficacia (desk check)
7.3 Verifica empirica dell’efficacia
7.4 Controllo dei rischi residui
7.5 Controllo delle Norme specifiche del prodotto
7.6 Valutazione del processo
7.7 Valutazione delle competenze
7.8 Risultato della valutazione e azioni correttive
7.9 Valutazione di informazioni simili per l'uso[/panel]
[...]
3.1 Scopo delle informazioni per l'uso
Le informazioni per l’uso devono fornire le informazioni necessarie per un uso sicuro, efficiente ed efficace di un prodotto supportato, da parte dei destinatari.
Per soddisfare questo obiettivo, le informazioni per l’uso forniscono i seguenti tipi di informazione:
a) informazioni di carattere concettuale: concetti, spiegazioni e descrizioni necessari per consentire ai destinatari di svolgere le attività, comprendendo lo scopo e i principi di funzionamento del prodotto supportato;
b) informazioni di tipo istituzionale: procedure e istruzioni passo-passo per svolgere le attività; e
c) informazioni di riferimento: informazioni dettagliate che devono essere recuperate occasionalmente come quelle relative al troubleshooting , ai comandi o ai codici.
3.2 Informazioni per l'uso come parte del prodotto
Le informazioni per l’uso sono parte integrante del prodotto supportato a cui si deve attribuire la stessa attenzione e importanza di qualsiasi altra parte del prodotto.
Se le informazioni per l’uso sono carenti (ad esempio non soddisfano i requisiti), il prodotto nel suo insieme è difettoso. Le informazioni per l’uso devono essere chiaramente e facilmente identificabili insieme al prodotto supportato.
3.3 Orientamento del pubblico destinatario
Le informazioni per l’uso devono essere utilizzabili e rilevanti per i destinatari rispetto alle attività e agli obiettivi prefissati.
NOTA La ISO/IEC 26514 fornisce maggiori informazioni sull’analisi dei destinatari.
[...]
4.15 Revisione, modifica e test
La revisione e la verifica delle informazioni per l’uso dovrebbero essere eseguite durante l’intero processo di sviluppo delle informazioni. Le valutazioni dovrebbero essere eseguite utilizzando metodi quali le revisioni tra pari, le procedure passo passo e le ispezioni eseguite da esperti esterni al team responsabile dello sviluppo del prodotto supportato. La valutazione empirica interattiva delle informazioni per l’uso dovrebbe essere eseguita da un gruppo rappresentativo della varietà di destinatari interessati. Dovrebbero essere effettuate anche prove informali o di tipo controllato sull’usabilità. L’ editing dovrebbe essere eseguito da persone diverse da quelle coinvolte nella redazione o traduzione delle informazioni per l’uso.
Il testo di origine dovrebbe essere revisionato per verificarne l’accuratezza, la coerenza e l’usabilità prima di essere tradotto. Le traduzioni dovrebbero essere revisionate dal punto di vista dell’accuratezza e della chiarezza tecnica e linguistica da persone competenti. I dettagli sono riportati in 10.4.
La valutazione empirica (ad esempio la verifica dell’usabilità) dovrebbe essere eseguita come mezzo per determinare se le informazioni per l’uso raggiungono lo scopo. La Tabella 1 mostra esempi di metodi empirici.
Tabella 1 - Esempi di metodi empirici
[...]
5. Contenuto delle istruzioni
Le istruzioni per l’uso devono contenere le informazioni sugli argomenti riportati in tabella.
6. Dimensioni minime raccomandate per il font e altezze dei segnali di sicurezza e dei simboli grafici
[...] segue in allegato
Certifico Srl - IT | Rev. 1.0 2025
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 1.0 | 19.05.2025 | Aggiornato in accordo alla versione in lingua italiana della norma CEI UNI EN IEC/IEEE 82079-1 | Certifico Srl |
| 0.0 | 16.07.2020 | -- | Certifico Srl |
Collegati
[box-note]UNI EN ISO 20607:2019 | Manuale di istruzioni
ISO 20607:2019 Redazione manuale di istruzioni
ISO 20607:2019 Safety of machinery Instruction handbook
IEC IEEE 82079-1:2019
Direttiva macchine: Il Manuale di Istruzioni, redazione e validazione
Focus Direttiva macchine - Il Manuale di Istruzioni
EN ISO 12100 Valutazione del Rischio | File CEM
Direttiva macchine 2006/42/CE
Certifico MIUM & MIA SUITE Ed. 14.0 2023[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| EN IEC IEEE 82079 1 2020 Redazione delle istruzioni per l'uso di un prodotto Rev. 1.0 2025 IT.pdf Certifico Srl - Rev. 1.0 2025 |
948 kB | 72 | ||
| EN IEC IEEE 82079 1 2020 Redazione delle istruzioni per l'uso di un prodotto Rev. 00 2020 IT.pdf Certifico Srl - Rev. 00 2020 |
450 kB | 246 |
Regolamento MD: casi pratici in cui il Distributore non assume il ruolo di Fabbricante
Regolamento UE 2017/745: casi pratici in cui il Distributore non assume il ruolo di Fabbricante del DM
Position Paper Assogastecnici
A differenza della precedente regolamentazione relativa ai Dispositivi Medici (Direttiva 93/42/CEE), il nuovo Regolamento (UE) 2017/745 identifica e definisce alcune responsabilità di gestione del DM anche a carico dei “distributori”, oltre che per i “fabbricanti”, “importatori” ecc. definiti nel Regolamento come “Operatori Economici”.
Il presente documento intende fornire un contributo alle Aziende Associate relativamente alle possibili interpretazioni dell’articolo 16, indicando al HCP che egli può sostenere il proprio ruolo senza assumere gli obblighi del fabbricante o, come l’adattamento di più DM per la prosecuzione del trattamento ospedaliero a domicilio del paziente, possa non rientrare nella definizione di “sistema o kit”, come disciplinato dall’ art. 22.
[box-note]Articolo 16 Casi in cui gli obblighi dei fabbricanti si applicano agli importatori, ai distributori o ad altre persone
1. Un Distributore, un Importatore o un'altra persona fisica o giuridica assume gli obblighi dei fabbricanti in relazione a uno dei seguenti casi:
a) se mette un dispositivo a disposizione sul mercato con il proprio nome, la propria denominazione commerciale o il proprio marchio registrato, tranne nei casi in cui un Distributore o un importatore conclude un accordo con un fabbricante in base al quale il fabbricante è indicato come tale sull'etichetta ed è responsabile del rispetto degli obblighi che incombono ai fabbricanti a norma del presente regolamento;
b) se modifica la destinazione d'uso di un dispositivo già immesso sul mercato o messo in servizio;
c) se modifica un dispositivo già immesso sul mercato o messo in servizio in modo tale che la sua conformità alle prescrizioni applicabili possa risultare compromessa. Il primo comma non si applica ai soggetti che, pur non essendo considerati un fabbricante secondo la definizione di cui all'articolo 2, punto 30, montano o adattano per un paziente specifico un dispositivo già presente sul mercato senza modificarne la destinazione d'uso.
2. Ai fini del paragrafo 1, lettera c), non sono considerate modifiche di un dispositivo tali da compromettere la sua conformità alle prescrizioni applicabili:
a) la fornitura, compresa la traduzione, delle informazioni date dal fabbricante conformemente all'allegato I, punto 23, in merito a un dispositivo già immesso sul mercato e di ulteriori informazioni necessarie per commercializzare il dispositivo nello Stato membro in questione;
b) le modifiche del confezionamento esterno di un dispositivo già immesso sul mercato, compresa la modifica delle dimensioni del confezionamento, se il riconfezionamento è necessario per commercializzare il dispositivo nello Stato membro in questione e se è effettuato in condizioni tali da non alterare lo stato originale del dispositivo. Nel caso di dispositivi immessi sul mercato in condizioni di sterilità, si presume che lo stato originale del dispositivo sia compromesso se il confezionamento che è necessario per mantenerne la sterilità è aperto, danneggiato o intaccato in altro modo dal riconfezionamento.
3. Un Distributore o un importatore che effettui una qualsiasi delle attività di cui al paragrafo 2, lettere a) e b), indica sul dispositivo o, qualora ciò sia impossibile, sul suo confezionamento o in un documento che accompagna il dispositivo, l'attività svolta insieme al proprio nome, denominazione commerciale o marchio registrato, alla sede e all'indirizzo presso cui può essere contattato, in modo tale da poter essere localizzato. 9 I distributori e gli importatori assicurano di disporre di un sistema di gestione della qualità comprendente procedure destinate a garantire che la traduzione delle informazioni sia esatta e aggiornata e che le attività di cui al paragrafo 2, lettere a) e b), siano realizzate con mezzi e in condizioni tali da preservare lo stato originale del dispositivo e che confezionamento del dispositivo riconfezionato non sia difettoso, di scarsa qualità o poco curato. Il sistema di gestione della qualità comprende tra l'altro procedure atte a garantire che il Distributore o l'importatore sia informato delle eventuali azioni correttive adottate dal fabbricante in relazione al dispositivo in questione al fine di rispondere a problemi di sicurezza o per renderlo conforme al presente regolamento.
4. Almeno 28 giorni prima di procedere alla messa a disposizione sul mercato del dispositivo rietichettato o riconfezionato, i distributori o gli importatori che svolgono una delle attività di cui al paragrafo 2, lettere a) e b), informano il fabbricante e l'autorità competente dello Stato membro in cui intendono mettere a disposizione il dispositivo dell'intenzione di rendere disponibile il dispositivo rietichettato o riconfezionato e, su richiesta, forniscono al fabbricante e all'autorità competente un campione o un modello del dispositivo rietichettato o riconfezionato, comprese le eventuali etichette e istruzioni per l'uso tradotte. Entro lo stesso termine di 28 giorni il Distributore o l'importatore presenta all'autorità competente un certificato, rilasciato da un organismo notificato e designato per la tipologia di dispositivi oggetto delle attività di cui al paragrafo 2, lettere a) e b), in cui si attesta che il sistema di gestione della qualità del Distributore o dell'importatore è conforme alle prescrizioni di cui al paragrafo 3.
Articolo 22 Sistemi e kit procedurali
1. Ogni persona fisica o giuridica deve redigere una dichiarazione che combina dispositivi recanti la marcatura CE con i seguenti altri dispositivi o prodotti, in maniera compatibile con la destinazione d'uso dei dispositivi o degli altri prodotti e nei limiti di utilizzo previsti dai loro fabbricanti, per immetterli sul mercato come sistema o kit procedurale:
a) altri dispositivi recanti la marcatura CE;
b) dispositivi medico-diagnostici in vitro recanti la marcatura CE conformemente al regolamento (UE) 2017/746;
c) altri prodotti conformi alla normativa a essi applicabile solo qualora siano utilizzati nell'ambito di una procedura medica o ne sia altrimenti giustificata la presenza nel sistema o kit procedurale.
2. Nella dichiarazione a norma del paragrafo 1, la persona fisica o giuridica in questione indica:
a) di aver verificato la compatibilità reciproca dei dispositivi e, se del caso, degli altri prodotti secondo le istruzioni dei fabbricanti e di aver effettuato le sue attività secondo tali istruzioni;
b) di aver imballato il sistema o kit procedurale e fornito agli utilizzatori le relative informazioni, comprese le informazioni che devono essere fornite dai fabbricanti dei dispositivi o degli altri prodotti che sono stati assemblati;
c) che l'attività di combinare dispositivi e, se del caso, altri prodotti come sistemi o kit procedurali è stata sottoposta a metodi adeguati di controllo interno, verifica e convalida.
3. Ogni persona fisica o giuridica che, ai fini della loro immissione sul mercato, sterilizza i sistemi o kit procedurali di cui al paragrafo 1 applica, a sua scelta, una delle procedure di cui all'allegato IX o la procedura di cui all'allegato XI, parte A. L'applicazione di tali procedure e l'intervento dell'organismo notificato si limitano agli aspetti della procedura che riguardano il 10 mantenimento della sterilità fino a quando la confezione sterile non sia aperta o danneggiata. La persona fisica o giuridica redige una dichiarazione in cui afferma che la sterilizzazione è stata eseguita secondo le istruzioni del fabbricante.
4. Se il sistema o kit procedurale contiene dispositivi che non recano la marcatura CE o se la combinazione di dispositivi scelta non è compatibile con la destinazione d'uso originaria, o se la sterilizzazione non è stata eseguita secondo le istruzioni del fabbricante, il sistema o kit procedurale è considerato un dispositivo a sé stante ed è soggetto alla pertinente procedura di valutazione della conformità di cui all'articolo 52. La persona fisica o giuridica assume gli obblighi dei fabbricanti. I sistemi o kit procedurali di cui al paragrafo 1 del presente articolo non recano una nuova marcatura CE, bensì il nome, la denominazione commerciale o il marchio registrato della persona di cui ai paragrafi 1 e 3 del presente articolo e l'indirizzo presso il quale tale persona può essere contattata, in modo tale che essa possa essere localizzata. I sistemi o kit procedurali sono corredati delle informazioni di cui all'allegato I, punto 23. La dichiarazione di cui al paragrafo 2 del presente articolo è tenuta a disposizione delle autorità competenti, dopo l'assemblaggio del sistema o kit procedurale, per il periodo applicabile ai dispositivi combinati conformemente all'articolo 10, paragrafo 8. In caso di periodi di durata diversa, si applica quello di maggior durata.[/box-note]
Assogastecnici 2020
Collegati
[box-note]Regolamento (UE) 2017/745
Regolamento (UE) 2017/746[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position Paper Aprile 2020.pdf Assogastecnici 2020 |
477 kB | 31 |
RAPEX Report 26 del 26/06/2020 N. 01 A12/00929/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 26 del 26/06/2020 N. 01 A12/00929/20 Germania
Approfondimento tecnico: Fermagli per capelli
Il prodotto, di marca Tedi, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una quantità eccessiva di cadmio (valore misurato: 91,6% in peso).
Il cadmio è dannoso per la salute umana perché si accumula nel corpo, può danneggiare i reni e le ossa e può provocare il cancro.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
23. Cadmium
[…] 10. Sono vietati l'uso o l'immissione sul mercato se il tenore è pari o superiore allo 0,01 % in peso del metallo in:
i) monili di metallo e altri componenti di metallo impiegati nella fabbricazione di oggetti di gioielleria;
ii) parti di metallo di articoli di gioielleria e di bigiotteria e accessori per capelli, compresi:
- braccialetti, collane e anelli
- gioielli per piercing,
- orologi da polso e cinturini,
- spille e gemelli per polsini. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 26 del 26_06_2020 N. 01 A12_00929_20 Germania.pdf Fermagli per capelli |
350 kB | 1 |
RAPEX Report 25 del 19/06/2020 N. 01 A12/00891/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 25 del 19/06/2020 N. 01 A12/00891/20 Germania
Approfondimento tecnico: Tubo flessibile a LED
Il prodotto, di marca Salcar, mod. X000QNN1B9, è stato sottoposto al divieto di commercializzazione, all’obbligo di distruzione ed al ritiro dal mercato perché non conforme al Regolamento (UE) 2019/1021 (POPS).
Il prodotto contiene paraffine clorurate a catena corta (SCCP) (misurate fino allo 0,710% in peso).
Gli SCCP persistono nell'ambiente, sono tossici per gli organismi acquatici a basse concentrazioni e si bioaccumulano nella fauna selvatica e nell'uomo, rappresentando un rischio per la salute umana e l'ambiente.
Regolamento (UE) 2019/1021 (POPS)
Allegato I
Alcani, C10-C13, cloro (paraffine clorurate a catena corta) (SCCP)
1. In deroga a quanto sopra, si consente la produzione, la commercializzazione e l'uso di sostanze o miscele contenenti SCCP in concentrazioni inferiori all'1 % in peso o di articoli contenenti SCCP in concentrazioni inferiori allo 0,15 % in peso.
2. L'uso è consentito per quanto concerne:
a) i nastri trasportatori per il settore minerario e i sigillanti per dighe contenenti SCCP già in uso al 4 dicembre 2015 o anteriormente; e
b) gli articoli contenenti SCCP diversi da quelli di cui alla lettera a) già in uso al 10 luglio 2012 o anteriormente.
3. Agli articoli di cui al punto 2 si applica l'articolo 4, paragrafo 2, terzo e quarto comma.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 25 del 19_06_2020 N. 01 A12_00891_20 Germania.pdf Tubo flessibile a LED |
155 kB | 0 |
Direttiva 2006/32/CE
Direttiva 2006/32/CE
Direttiva 2006/32/CE del Parlamento europeo e del Consiglio, del 5 aprile 2006, concernente l'efficienza degli usi finali dell'energia e i servizi energetici e recante abrogazione della direttiva 93/76/CEE del Consiglio (Testo rilevante ai fini del SEE)
GU L 114 del 27.4.2006
Abrogata da: Direttiva 2012/27/UE
Collegati
[box-note]Direttiva 2012/27/UE[/box-note]
Decisione 2012/757/UE
Decisione 2012/757/UE
Decisione della Commissione del 14 novembre 2012 relativa alla specifica tecnica di interoperabilità per il sottosistema «Esercizio e gestione del traffico» del sistema ferroviario nell’Unione europea e che modifica la decisione 2007/756/CE
[notificata con il numero C(2012) 8075]
(2012/757/UE)
....
Articolo 1
1. La specifica tecnica di interoperabilità (STI) relativa al sottosistema «Esercizio e gestione del traffico» del sistema ferroviario dell’Unione di cui all’allegato I è adottata.
2. La STI di cui all’allegato I della presente decisione si applica al sottosistema «Esercizio e gestione del traffico» come indicato al punto 2.5 dell’allegato II della direttiva 2008/57/CE.
Articolo 2
Gli Stati membri notificano alla Commissione i seguenti tipi di accordi entro e non oltre il 30 giugno 2014, purché non siano già stati notificati ai sensi della decisione 2006/920/CE della Commissione, della decisione 2008/231/CE o della decisione 2011/314/UE:
a) accordi nazionali tra gli Stati membri e imprese ferroviarie o gestori dell’infrastruttura, convenuti in via permanente o temporanea e imposti dalla natura molto specifica o locale del servizio di trasporto previsto;
b) accordi bilaterali o multilaterali tra imprese ferroviarie, gestori dell’infrastruttura o autorità preposte alla sicurezza che comportino livelli significativi di interoperabilità a livello locale o regionale;
c) accordi internazionali tra uno o più Stati membri e almeno un paese terzo, oppure tra imprese ferroviarie o gestori dell’infrastruttura di Stati membri e almeno un’impresa ferroviaria o un gestore dell’infrastruttura di un paese terzo che comportino livelli significativi di interoperabilità a livello locale o regionale.
Articolo 3
Ciascuno Stato membro, agendo in conformità al capitolo 7 dell’allegato I della presente decisione, aggiorna i piani nazionali di attuazione della STI stabiliti conformemente all’articolo 4 della decisione 2006/920/CE, all’articolo 4 della decisione 2008/231/CE e all’articolo 5 della decisione 2011/314/UE.
Ciascuno Stato membro trasmette il piano di attuazione aggiornato agli altri Stati membri e alla Commissione entro il 31 dicembre 2014.
Articolo 4
Le decisioni 2008/231/CE e 2011/314/UE sono abrogate a decorrere dal 1o gennaio 2014.
Articolo 5
La decisione 2007/756/CE è così modificata:
a) dopo l’articolo 1 è inserito il seguente articolo:
«Articolo 1 bis
L’appendice 6 dell’allegato della presente decisione si applica a partire dal 1° gennaio 2014.»;
b) l’allegato è modificato conformemente all’allegato II della presente decisione.
Articolo 6
1. L’Agenzia pubblica nel suo sito web l’elenco dei codici di cui alle parti 9, 10, 11, 12 e 13 dell’appendice 6 dell’allegato della decisione 2007/756/CE.
2. L’Agenzia tiene aggiornati gli elenchi di codici di cui al paragrafo 1 e informa la Commissione circa eventuali modifiche ad essi apportate. La Commissione informa gli Stati membri sull’evoluzione di detti elenchi attraverso il comitato istituito a norma dell’articolo 29 della direttiva 2008/57/CE.
Articolo 7
La presente decisione si applica a decorrere dal 1° gennaio 2014.
Articolo 8
Gli Stati membri sono destinatari della presente decisione.
...
In allegato Testo consoildato Decisione 2012/757/UE al 2015, riservato abbonati
Modificato da:
DECISIONE DELLA COMMISSIONE del 2 dicembre 2013
REGOLAMENTO (UE) 2015/995 DELLA COMMISSIONE dell'8 giugno 2015
Rettificato da:
Rettifica, GU L 101, 4.4.2014, pag. 15 (2012/757/UE)
________
Collegati:
[box-note]Direttiva 2008/57/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Decisione 2012 757 UE Testo consolidato 2015.pdf |
917 kB | 1 |
Norme armonizzate Click: i testi consolidati delle norme pubblicate Gennaio 2020 / Luglio 2020

Norme armonizzate Click | Gennaio 2020 / Luglio 2020
ID 11008 | 30.07.2020
I testi consolidati dell'elenco delle norme armonizzate per Direttiva / Regolamento UE pubblicate Gennaio 2020 / Luglio 2020.
Download Norme armonizzate Click Gennaio 2020 - Luglio 2020
Download Norme armonizzate Click Gennaio 2020 - Giugno 2020
Come consultare i riferimenti delle norme armonizzate 2019/2020.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi delle Direttive nuovo approccio UE devono essere letti in relazione alle pubblicazioni precedenti.
Per facilitare la consultazione sono stati realizzati dei "testi consolidati" che saranno aggiornati nel tempo, dove sono riporti l'elenco dei titoli delle norme armonizzate pubblicate per Direttiva/Regolamento UE.
I testi consolidati Gennaio 2020 / Luglio 2020:

18 Maggio 2020
Direttiva EMC
Norme armonizzate Direttiva RoHS
Norme armonizzate Direttiva RED

20 Aprile 2020
Norme armonizzate Direttiva PED

02 Aprile 2020
Direttiva Macchine

26 Febbraio 2020
Direttiva ATEX
Direttiva Imbarcazioni da diporto
Collegati
[box-note]Norme armonizzate Click
Direttiva click
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Agosto 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Settembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Ottobre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Novembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020[/box-note]
Guida per lo sdoganamento delle mascherine
Guida per lo sdoganamento delle mascherine
ADM, aprile 2020
Il materiale si distingue in tre categorie:
1) Dispositivi Medici (le così dette “mascherine chirurgiche”) o DM
2) Dispositivi di Protezione Individuale o DPI (FFP2 e FFP3)
3) Mascherine Generiche (o “filtranti”) che apparentemente sembrano “mascherine chirurgiche” DM ma in realtà non sono né testate né certificate
Documentazione per le diverse categorie
Distinguiamo diversi casi in base alle categorie di cui al primo paragrafo:
Dispositivi Medici:
1) se marchio CE è presente e valido, il dispositivo è sdoganabile immediatamente (mascherine chirurgiche)
2) se marchio CE non è presente o non è valido occorre inviare apposita autocertificazione all’Istituto Superiore di Sanità (ISS) come da art. 15, comma 2 del D.L. 17 marzo 2020, n. 18 e attendere la pronuncia di quest’ultimo per immettere i prodotti in commercio. In questo caso il prodotto può essere solo “sdoganato condizionatamente”, con prescrizioni, obbligo di tracciabilità e con l’impegno a non metterlo in commercio prima del rilascio delle autorizzazioni https://www.iss.it/procedure-per-richiesta-produzione-mascherine se il prodotto non ottiene la certificazione, viene declassato a “mascherina generica” e, se non può essere rietichettato come generico (perché ad esempio il finto marchio CE è impresso sul tessuto e non sulla confezione), viene distrutto.
Per questo tipo di dispositivo è utilizzabile la procedura di svincolo diretto se il destinatario finale rientra tra quelli previsti dall’Ordinanza 6/2020 del Commissario straordinario.
DPI:
A) se marchio è presente e valido, il dispositivo è sdoganabile immediatamente (FFP2 e FFP3)
B) se marchio non è presente o non è valido occorre inviare apposita autocertificazione all’INAIL come da art. 15, comma 3 del D.L. 17 marzo 2020, n. 18 e attendere la pronuncia di quest’ultimo per immettere i prodotti in commercio. In questo caso il prodotto può essere solo “sdoganato condizionatamente”, con prescrizioni, obbligo di tracciabilità e con l’impegno a non metterlo in commercio prima del rilascio delle autorizzazioni https://bit.ly/2S3dflm se il prodotto non ottiene la certificazione, viene declassato a “mascherina generica” e, se non può essere rietichettato come generico (perché ad esempio il finto marchio CE è impresso sul tessuto e non sulla confezione), viene distrutto.
Per questo tipo di dispositivo è utilizzabile la procedura di svincolo diretto se il destinatario finale rientra tra quelli previsti dall’Ordinanza 6/2020 del Commissario straordinario
Mascherine Generiche: le mascherine generiche (o filtranti) possono essere sdoganate solo se soddisfino le condizioni di produzione e messa in commercio richiamate, da ultimo, nella Circolare MISE 107886 del 23 aprile 2020:
a) non devono recare la marcatura,
b) le confezioni devono indicare espressamente che non si tratta di un Dispositivo Medico (DM) o Dispositivo di Protezione Individuale (DPI),
c) devono essere accompagnate da una avvertenza che indichi chiaramente che non garantiscono in alcun modo la protezione delle vie respiratorie di chi le indossa, che non sono utilizzabili quando sia prescritto l’uso di Dispositivi Medici o Dispositivi di Protezione Individuale (per uso sanitario o sui luoghi di lavoro) bensì, solo a titolo di esempio, quando sia ritenuta comunque utile la copertura di naso e bocca a fini igienico ambientali e per uso della collettività.
d) Il Produttore DEVE dichiarare che i Dispositivi Generici non arrecano danni e non determinano rischi aggiuntivi per gli utilizzatori, secondo la destinazione del prodotto.
Nel caso in cui queste condizioni non siano soddisfatte il prodotto, qualora sia possibile rietichettarlo, può essere solo “sdoganato condizionatamente” con prescrizioni, obbligo di tracciabilità e con l’impegno a non metterlo in commercio prima di aver sostituito le etichette non a norma con quelle a norma
Per questo tipo di dispositivo non è utilizzabile né la procedura di svincolo diretto né di svincolo celere e le stesse non possono essere importate in deroga alle vigenti disposizioni sulla produzione e messa in commercio.
L’ art. 16 comma 2 del D.L. 18/2020 consente l’utilizzo (e non l’importazione) solo sino al perdurare dello stato di emergenza, di mascherine generiche prodotte in deroga alle norme vigenti per l’immissione in commercio.
Pertanto in base alla predetta disposizione sarà possibile declassare e utilizzare come mascherine generiche i prodotti importati come DPI che non ottengano le autorizzazioni previste, qualora gli stessi soddisfino comunque i requisiti di cui alle lettere a,b,c,d, di cui al presente paragrafo, ma non sarà invece possibile importare, invocando la predetta norma, mascherine generiche prodotte in deroga alle vigenti norme di messa in commercio richiamate dalle lettere a,b,c,d.
È consentita la vendita singola delle mascherine a condizione che dette informazioni siano chiaramente intellegibili nel luogo di vendita e gli acquirenti ne abbiano consapevolezza al momento dell’acquisto
La Dogana deve verificare (nota MISE 107886 del 23 aprile 2020) che le condizioni di cui sopra ricorrano all’atto dell’importazione. Ove il riscontro sia negativo, vigilerà sulla conformazione, anche mediante sospensione dello svincolo, con contestuale informativa al MISE e rilascio della merce con bolletta A20 (solo nei casi previsti).
Nell’impossibilità di conformare i prodotti secondo quanto descritto dalle citate disposizioni questi saranno distrutti.
[...segue in allegato]
Fonte: ADM
_____
Collegati:
[box-note]UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Classificazione Mascherine DPI NIOSH (US)
ISS | Procedure per richiesta produzione mascherine
Coronavirus: Corretto uso delle mascherine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guida per lo sdoganamento delle mascherine.pdf ADM 2020 |
266 kB | 18 |
Proroga dei termini adempimenti impianti a fune in servizio pubblico
Proroga dei termini adempimenti impianti a fune in servizio pubblico
ID 10950 | 07.06.2020
La Legge 5 giugno 2020 n. 40, conversione in legge, con modificazioni, del decreto-legge 8 aprile 2020, n. 23 (decreto liquidità) ha disposto, con l'introduzione dell'art. 14-ter, la proroga di dodici mesi dei termini degli adempimenti tecnici e amministrativi relativi agli impianti a fune in servizio pubblico.
[panel]Art. 14 - ter decreto-legge 8 aprile 2020, n. 23 Proroga dei termini degli adempimenti tecnici e amministrativi relativi agli impianti a fune in servizio pubblico
1. Al fine di garantire la continuità del servizio di pubblico trasporto mediante impianti a fune, le scadenze relative alle revisioni generali e speciali quinquennali nonché quelle relative agli scorrimenti e alle sostituzioni delle funi e al rifacimento dei loro attacchi di estremità sono prorogate di dodici mesi, qualora sia trasmessa prima delle suddette scadenze all’Autorità di sorveglianza, da parte del direttore o del responsabile dell’esercizio, una dettagliata e completa relazione in merito ai controlli effettuati, ai provvedimenti adottati e all’esito delle verifiche e delle prove eseguite, contenente l’attestazione della sussistenza delle condizioni di sicurezza per l’esercizio pubblico.
2. Ai fini di cui al comma 1, per l’anno 2020 non è obbligatoria la partecipazione dell’Autorità di sorveglianza alle verifiche e alle prove periodiche da effettuare da parte del direttore o del responsabile dell’esercizio o dell’assistente tecnico.
3. Le scadenze relative ai termini di inizio e di conclusione delle opere di realizzazione di impianti a fune per le quali è già stata rilasciata l’approvazione dei progetti sono prorogate di dodici mesi.
4. Le procedure per l’attuazione di quanto disposto dai commi 1, 2 e 3 sono stabilite mediante regolamento adottato con decreto del Ministro delle infrastrutture e dei trasporti, entro due mesi dalla data di entrata in vigore della legge di conversione del presente decreto. 5. L’articolo 62 -bis del decreto-legge 17 marzo 2020, n. 18, convertito, con modificazioni, dalla legge 24 aprile 2020, n. 27, è abrogato.[/panel]
_______
Collegati:
[box-note]Esercizio e manutenzione impianti a fune trasporto pubblico persone
D.P.R. 11 luglio 1980 n. 753
D.D. n. 288 del 17 settembre 2014
Decreto 18 febbraio 2011
Decreto 11 maggio 2017
D.D. n. 337 del 16 Novembre 2012[/box-note]
Regolamento (UE) 2020/740
Regolamento (UE) 2020/740
del Parlamento Europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009
GU L 177/1 del 05.06.2020
Entrata in vigore: 25.06.2020
_____
Articolo 1 Oggetto
Il presente regolamento istituisce un quadro relativo alle informazioni armonizzate sui parametri dei pneumatici da fornire mediante l’etichettatura per consentire agli utenti finali di fare una scelta consapevole al momento dell’acquisto dei pneumatici, al fine di aumentare la sicurezza, la protezione della salute e l’efficienza economica e ambientale dei trasporti su strada promuovendo l’uso di pneumatici sicuri, silenziosi, durevoli e atti a ridurre il consumo di carburante.
[...]
Articolo 4 Obblighi dei fornitori di pneumatici
1. I fornitori garantiscono che i pneumatici di classe C1, i pneumatici di classe C2 e i pneumatici di classe C3 che vengono immessi sul mercato siano corredati a titolo gratuito:
a) per ciascun singolo pneumatico, di un’etichetta dei pneumatici, in forma di autoadesivo, che è conforme ai requisiti di cui all’allegato II, che riporta le informazioni e la categoria di ciascuno dei parametri di cui all’allegato I, e una scheda informativa del prodotto; oppure
b) per ciascun lotto di uno o più pneumatici identici, in forma cartacea, di un’etichetta dei pneumatici, che è conforme ai requisiti di cui all’allegato II, che riporta le informazioni e la categoria di ciascuno dei parametri di cui all’allegato I, e una scheda informativa del prodotto.
2. Per i pneumatici venduti od offerti in vendita mediante vendita a distanza, i fornitori garantiscono che l’etichetta dei pneumatici sia esposta vicino all’indicazione del prezzo e che la scheda informativa del prodotto sia accessibile, anche in forma cartacea su richiesta dell’utente finale. Le dimensioni dell’etichetta dei pneumatici sono tali da renderla chiaramente visibile e leggibile e sono proporzionate alle dimensioni indicate al punto 2.1 dell’allegato II.
Per i pneumatici venduti od offerti in vendita su internet, i fornitori possono rendere l’etichetta dei pneumatici per un tipo specifico di pneumatico disponibile in una visualizzazione annidata.
3. I fornitori garantiscono che i messaggi pubblicitari visivi per un tipo specifico di pneumatico riportino l’etichetta del pneumatico. Se i messaggi pubblicitari riportano il prezzo di tale tipo di pneumatico, l’etichetta dei pneumatici è esposta vicino all’indicazione del prezzo.
Per quanto riguarda i messaggi pubblicitari visivi su internet, i fornitori possono rendere l’etichetta dei pneumatici disponibile in una visualizzazione annidata.
4. I fornitori garantiscono che qualsiasi materiale tecnico-promozionale relativo a un tipo specifico di pneumatico esponga l’etichetta di tale tipo di pneumatici e comprenda le informazioni di cui all’allegato IV.
5. I fornitori forniscono a un’autorità nazionale competente quale definita all’articolo 3, punto 37, del regolamento (UE) 2018/858, i valori usati per determinare le relative classi e le ulteriori informazioni sulle prestazioni che il fornitore dichiara nell’etichetta dei pneumatici dei tipi di pneumatici, conformemente all’allegato I del presente regolamento, nonché l’etichetta dei pneumatici che soddisfi i requisiti di cui all’allegato II del presente regolamento. Tali informazioni sono presentate all’autorità nazionale competente sulla base dell’articolo 5, paragrafi 1 e 2, del presente regolamento, prima dell’immissione sul mercato dei tipi di pneumatici in questione, in modo che l’autorità possa verificare la precisione dell’etichetta dei pneumatici.
6. I fornitori garantiscono la precisione delle etichette dei pneumatici e delle schede informative del prodotto da essi fornite.
7. I fornitori possono mettere la documentazione tecnica a disposizione delle autorità degli Stati membri diverse dalle autorità indicate al paragrafo 5 o dei pertinenti organismi nazionali accreditati su richiesta.
8. I fornitori collaborano con le autorità di vigilanza del mercato e intervengono immediatamente, di propria iniziativa o su richiesta delle autorità di vigilanza del mercato, per rettificare i casi di inosservanza del presente regolamento di cui sono responsabili.
9. I fornitori non forniscono né espongono altre etichette, marchi, simboli o iscrizioni che non siano conformi al presente regolamento e che possano indurre in errore o confondere gli utenti finali per quanto riguarda i parametri di cui all’allegato I.
10. I fornitori non forniscono né espongono etichette che imitano l’etichetta dei pneumatici prevista a norma del presente regolamento.
...
Articolo 16 Modifica del regolamento (UE) 2017/1369
All’articolo 12, paragrafo 2, del regolamento (UE) 2017/1369, la lettera a) è sostituita dalla seguente:
«a) assistere le autorità di vigilanza del mercato nello svolgimento dei loro compiti a norma del presente regolamento e dei pertinenti atti delegati, inclusa la loro applicazione, e a norma del regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio (*).
_____________
(*) Regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio, del 25 maggio 2020, sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009 (GU L 177 del 5.6.2020, pag. 1).».
...
Articolo 17 Abrogazione del regolamento (CE) n. 1222/2009
Il regolamento (CE) n. 1222/2009 è abrogato con effetto a decorrere dal 1° maggio 2021.
I riferimenti al regolamento abrogato si intendono fatti al presente regolamento e vanno letti secondo la tavola di concordanza di cui all’allegato VIII del presente regolamento.
...
ALLEGATO II
CONTENUTO E FORMATO DELL’ETICHETTA DEI PNEUMATICI
1. Contenuto dell’etichetta dei pneumatici
1.1. Informazioni che devono figurare nella parte superiore dell’etichetta dei pneumatici:
I. Codice QR;
II. Denominazione commerciale o marchio del fornitore;
III. Identificativo del tipo di pneumatico;
IV. Designazione della misura del pneumatico, indice di capacità di carico e simbolo della categoria di velocità, come indicato al regolamento n. 30 della Commissione economica per l’Europa delle Nazioni Unite (UN/ECE), nella sua versione più aggiornata applicabile all’Unione (regolamento UNECE n. 30) e al regolamento n. 54 della Commissione economica per l’Europa delle Nazioni Unite Nazioni (UNECE), nella sua versione più aggiornata applicabile all’Unione (regolamento UNECE n. 54) per i pneumatici di classe C1, i pneumatici di classe C2 e i pneumatici di classe C3, se del caso; V. Classe di pneumatici, vale a dire C1, C2 o C3;
VI. Pittogramma, scala e categoria di prestazioni relativi al consumo di carburante;
VII. Pittogramma, scala e categoria di prestazioni relativi all’aderenza sul bagnato.
1.2. Informazioni che devono figurare nella parte inferiore dell’etichetta dei pneumatici per tutti i pneumatici diversi da quelli che rispettano i valori minimi dell’indice di aderenza sulla neve di cui al regolamento UNECE n. 117, o i pertinenti valori minimi dell’indice di aderenza sul ghiaccio, o entrambi.
I. Pittogramma, valore (espresso in dB(A) e arrotondato alla cifra intera più vicina) e categoria di prestazioni relativi al rumore esterno di rotolamento;
II. Numero di serie del presente regolamento: « 2020/740».
1.3. Informazioni che devono figurare nella parte inferiore dell’etichetta dei pneumatici per i pneumatici che rispettano i valori minimi dell’indice di aderenza sulla neve di cui al regolamento UNECE n. 117:
I. Pittogramma, valore [espresso in dB(A) e arrotondato alla cifra intera più vicina] e categoria di prestazioni relativi al rumore esterno di rotolamento;
II. Pittogramma aderenza sulla neve;
III. Numero di serie del presente regolamento: «2020/740».
1.4. Informazioni che devono figurare nella parte inferiore dell’etichetta dei pneumatici per i pneumatici che rispettano i pertinenti valori minimi dell’indice di aderenza sul ghiaccio;
I. Pittogramma, valore [espresso in dB(A) e arrotondato alla cifra intera più vicina] e categoria di prestazioni relativi al rumore esterno di rotolamento;
II. Pittogramma aderenza sul ghiaccio;
III. Numero di serie del presente regolamento: «2020/740».
1.5. Informazioni che devono figurare nella parte inferiore dell’etichetta dei pneumatici per i pneumatici che rispettano i pertinenti valori minimi dell’indice di aderenza sulla neve di cui al regolamento UNECE n. 117 e i valori minimi dell’indice di aderenza sul ghiaccio:
I. Pittogramma, valore [espresso in dB(A) e arrotondato alla cifra intera più vicina] e categoria di prestazioni relativi al rumore esterno di rotolamento;
II. Pittogramma aderenza sulla neve;
III. Pittogramma aderenza sul ghiaccio;
IV. Numero di serie del presente regolamento; «2020/740».
2. Formato dell’etichetta dei pneumatici
2.1. Formato della parte superiore dell’etichetta dei pneumatici:
Modifiche/rettifiche:
Rettifica del regolamento (UE) 2020/740 | 30.04.2021
Rettifica del regolamento (UE) 2020/740 - 28.10.2021
[...] Segue in allegato
Collegati:
[box-note] Regolamento (UE) 2017/1369[/box-note]
EN 10204:2004 | Documenti di controllo prodotti metallici
EN 10204:2004 | Documenti di controllo prodotti metallici
ID 10895 | 02.06.2020
Documenti e Dichiarazioni per le forniture di acciaio (e non), per le quali non sussista l’obbligo della Marcatura CE (la norma è armonizzata per la Direttiva 2014/68/UE "PED" e quindi ne fornisce Presunzione di Conformità), le Dichiarazioni sono usualmente utilizzate anche per prodotti non di interesse PED:
- Dichiarazione di conformità all'ordine / Declaration of compliance with the order (Tipo 2.1)
- Rapporto di prova / Test report (Tipo 2.2)
- Certificato di controllo 3.1 / Inspection certificate 3.1 (Tipo 3.1)
- Certificato di controllo 3.2 / Inspection certificate 3.2 (Tipo 3.2)
La norma EN 10204:2004 “Prodotti metallici - Tipi di documenti di controllo” specifica i differenti tipi di documenti di controllo forniti al committente, in accordo con i requisiti dell'ordine, per la consegna di tutti i prodotti metallici, per esempio lamiere, fogli, barre, forgiati, getti, indipendentemente dal loro metodo di produzione. La Norma è armonizzata per la Direttiva 2014/68/UE "PED".
I codici assegnati dalla norma collegata EN 10168:2004 hanno lo scopo di contribuire all’eliminazione delle difficoltà di comunicazione negli scambi europei.
La norma può essere utilizzata anche per prodotti non metallici.
[panel]EN 10204:2004 “Prodotti metallici - Tipi di documenti di controllo”
Data entrata in vigore: 20 ottobre 2004
Sostituisce: EN 10204:1991 | EN 10204:1991/A1:1995
Recepita in Italia: 01 marzo 2005 | UNI EN 10204:2005
Norma armonizzata per la Direttiva PED 2014/68/UE [/panel]
[panel]La norma EN 10204:2004 “Prodotti metallici - Tipi di documenti di controllo” viene richiamata anche dal Decreto 17 Gennaio 2018 (NTC 2018)
11.3.1.5 FORNITURE E DOCUMENTAZIONE DI ACCOMPAGNAMENTO
Tutte le forniture di acciaio, per le quali non sussista l’obbligo della Marcatura CE, devono essere accompagnate dalla copia dell’attestato di qualificazione del Servizio Tecnico Centrale e dal certificato di controllo interno tipo 3.1, di cui alla norma UNI EN 10204, dello specifico lotto di materiale fornito.
Tutte le forniture di acciaio, per le quali sussista l’obbligo della Marcatura CE, devono essere accompagnate dalla “Dichiarazione di prestazione” di cui al Regolamento UE 305/2011, dalla prevista marcatura CE nonché dal certificato di controllo interno tipo 3.1, di cui alla norma UNI EN 10204, dello specifico lotto di materiale fornito. Il riferimento agli attestati comprovanti la qualificazione del prodotto deve essere riportato sul documento di trasporto. Le forniture effettuate da un distributore devono essere accompagnate da copia dei documenti rilasciati dal fabbricante e completati con il riferimento al documento di trasporto del distributore stesso. Nel caso di fornitura in cantiere non proveniente da centro di trasformazione, il Direttore dei Lavori, prima della messa in opera, è tenuto a verificare quanto sopra indicato ed a rifiutare le eventuali forniture non conformi, ferme restando le responsabilità del fabbricante.[/panel]
Tabella 1 - Corrispondenza fra la presente norma europea e la Direttiva 97/23/CE
Confrontando la EN 10204:2004 con la norma sostituita EN 10204:1991, i principali cambiamenti della sono:
[panel]- le nuove definizioni: "fabbricante", "intermediario", "specifica di prodotto";
- la riduzione del numero di documenti di controllo:
- il tipo 2.3 della precedente edizione è stato annullato;
- il tipo 3.1 sostituisce il tipo 3.1.B della precedente edizione;
- il tipo 3.2 sostituisce i tipi 3.1.A, 3.1.C e il verbale di collaudo 3.2*) della precedente edizione.
*) Il termine "verbale di collaudo 3.2" richiamato nella precedente edizione della norma, in base alle modifiche apportate al testo della norma attualmente in vigore, è diventato "certificato di controllo 3.2 tipo 3.2" come definito nel punto 4.2 della nuova edizione.[/panel]
La Direttiva PED 2014/68/UE è entrata in vigore il 17 Luglio 2014 ed ha sostituito la Direttiva 97/23/CE dal 19 Luglio 2016.
Note
a Un controllo non specifico può essere sostituito da un controllo specifico se specificato sulla norma relativa al materiale o sull'ordine.
b Sistema di gestione per la qualità del fabbricante del materiale, certificato da un organismo competente con sede all'interno della Comunità e che è stato sottoposto a una specifica valutazione relativa ai materiali.
Figura 1 - Conformità con l'Allegato I, sezione 4.3 della Direttiva 97/23/CE
_________
6. Riepilogo
Tabella 2 - Riepilogo dei documenti di controllo
7. Informazioni che possono figurare nei documenti di controllo definiti dalla EN 10204:2004
La norma EN 10168:2004 fornisce una breve descrizione delle informazioni che possono figurare nei documenti di controllo definiti dalla EN 10204:2004.
Tutti i documenti di controllo definiti dalla EN 10204:2004 hanno come elemento comune gruppi di informazioni che permettono di associare in maniera chiara il documento di controllo alla corrispondente fornitura.
Tutti i documenti di controllo, ad eccezione del tipo 2.1, contengono informazioni su prove specifiche o non specifiche, eseguite in base alla relativa specifica di prodotto.
[panel]I codici assegnati dalla EN 10168:2004 hanno lo scopo di contribuire all’eliminazione delle difficoltà di comunicazione negli scambi europei.[/panel]
L’organizzazione responsabile di un documenti di controllo può adattare l’ordine di presentazione delle informazioni e cancellare gli elementi inutili in funzione del prodotto.In tutti i tipo di documenti di controllo si deve attestare la conformità della fornitura con i requisiti dell’ordine.
Le informazioni indicate nei prospetti seguenti dovrebbero essere riportate nelle sezioni corrispondenti dei documenti di controllo (anche in forma abbreviata, purché non ne risulti compromessa la comprensione). Se manca lo spazio per l’inserimento delle informazioni si può far riferimento ad un allegato o ad una sezione libera del documento di controllo.
_________
_________
_________
...
segue in allegato
Fonti
EN 10204:2004
EN 10168:2004
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]Nuova Direttiva PED 2014/68/UE
Rettifica della direttiva PED 2014/68/UE del 23.10.2015
Guidelines related to the Pressure Equipment Directive 2014/68/EU (PED)
Nuova Direttiva PED 2014/68/UE: file CEM
Norme armonizzate Direttiva 2014/68/UE PED
Direttiva PED | Dichiarazione corretta prassi costruttiva
Decreto 17 gennaio 2018
PED e materiali: Norme / RES[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| EN 10204 2004 - Documenti di controllo prodotti metallici Rev. 00 2020.pdf Certifico S.r.l. Rev. 00 2020 |
529 kB | 223 | ||
| Certificato di controllo Tipo 3.2.docx EN 10204:2004 | Tipo 3.2 |
21 kB | 77 | ||
| Certificato di controllo Tipo 3.1.docx EN 10204:2004 | Tipo 3.1 |
21 kB | 84 | ||
| Rapporto di prova Tipo 2.2.docx EN 10204:2004 | Tipo 2.2 |
21 kB | 74 | ||
| Dichiarazione di conformità all'ordine Tipo 2.1.docx EN 10204:2004 | Tipo 2.1 |
16 kB | 73 |
Faq COVID-19 | Verifica immissione sul mercato MD e DPI
Faq - COVID-19 | Verifica immissione sul mercato MD e DPI
EU, 25.05.2020
How to verify that medical devices and personal protective equipment can be lawfully placed on the EU market and thus purchased and used – also in the COVID-19 context
The purpose of this guidance document is to provide basic indications to allow those interested parties who are unfamiliar with the regulated sectors of medical devices and personal protective equipment to identify whether a product is lawfully placed on the EU market and can continue to be made available, thus purchased and used.
Such clarification has proven especially necessary in the context of the COVID-19 pandemic. The related extraordinary circumstances have rapidly increased the need and demand for certain devices and equipment: this has resulted in the involvement of economic operators and other interested parties not previously in the supply and verification chain of these products. In addition, recent experience indicates the need to be attentive to misleading or falsified documents as well as to counterfeit products.
Question 1: What is the applicable regulatory framework for medical devices and personal protective equipment in the EU?
[panel]Medical devices within the EU are currently regulated by the following Directives:
- Council Directive 90/385/EEC of 20 June 1990 on the approximation of the laws of the Member States relating to active implantable medical devices (hereafter referred to as AIMDD)
- Council Directive 93/42/EEC of 14 June 1993 concerning medical devices (hereafter referred to as MDD)
- Directive 98/79/EC of the European Parliament and of the Council of 27 October 1998 on in vitro diagnostic medical devices (hereafter referred to as IVDD)[/panel]
Medical devices can also already be placed on the EU market if they comply with the following new Regulations which entered into force in May 2017:
[panel]- Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC (hereafter referred to as MDR, fully applicable as from 26 May 2021)
- Regulation (EU) 2017/746 of the European Parliament and of the Council of 5 April 2017 on in vitro diagnostic medical devices and repealing Directive 98/79/EC and Commission Decision 2010/227/EU (hereafter referred to as IVDR, fully applicable as from 26 May 2022)
The temporal scope and the conditions of applicability of the relevant legal requirements to devices, from the AIMDD, the MDD and the IVDD (hereafter referred to as Directives) to the MDR and the IVDR (hereafter referred to as new Regulations on medical devices), are governed by specific transitional provisions.
On the other hand, personal protective equipment within the EU is currently regulated by Regulation (EU) 2016/425 of the European Parliament and of the Council of March 2016 on personal protective equipment and repealing Council Directive 89/686/EEC (hereafter referred to as PPER).[/panel]
Question 2: How can a product be lawfully placed on the EU market?
[panel]In order to lawfully place on the EU market medical devices under the scope of the Directives or the new Regulations, as well as personal protective equipment under the scope of the PPER, these products must be CE-marked with the EC or EU declaration of conformity signed and issued by the manufacturer.
In the EC or EU declaration of conformity, manufacturers must declare that their products comply with the applicable EU legislative act(s) and requirements. There are however no obligations in the EU legal framework to separately draw up declarations of compliance with national legislation, as well as with national, European or international standards.
The Directives and the new Regulations on medical devices, and the PPER, in line with the main pieces of the EU legislation concerning the internal market for goods, lay down essential safety and performance requirements and health and safety requirements, respectively, but do not prescribe any specific mandatory technical solutions for the manufacturing and design of the products. Therefore, the manufacturer can choose which technical solution(s) to use to comply with these legal requirements. Manufacturers can use those offered in harmonised European standards or in other standards or technical specifications, or can come up with their own technical solution(s).
The use of harmonised European standards is a voluntary means to comply with the legal requirements. These standards, developed by the relevant European standardisation organisations, contain specific technical solutions that can be used to comply with the legal requirements. When the reference of a harmonised European standard is cited in the Official Journal of the European Union (OJEU), the use of such standard confers on the product a presumption of conformity with the legal requirements it aims to cover (as listed in the relevant Annex Z). In practice, where a manufacturer chooses to follow a harmonised European standard to which the reference is cited in the OJEU, the product is presumed to be in conformity with the applicable legal requirements covered by such standard. On the contrary, where a manufacturer chooses not to follow a harmonised European standard, it must demonstrate that the alternative technical solution applied is adequate to ensure compliance of the product with the applicable legal requirements.
The manufacturer must also prepare and maintain the relevant technical documentation for the product, in support to the compliance claimed in the EC or EU declaration of conformity. Such technical documentation has to be kept and made available to national competent authorities upon their request.
For medical devices, manufacturers outside the EU must designate a single authorised representative in the EU. Information on the authorised representative must be available at least on the EC or EU declaration of conformity, on the certificate where applicable, and on the labelling of the device.
For certain medical devices and personal protective equipment, the manufacturer needs to involve a notified body in the prescribed conformity assessment procedure(s).
Once the notified body assesses the compliance of the product with the relevant requirements of the applicable EU legislation, it will issue the appropriate certificate (as for example an EC or EU type-examination certificate, a design-examination certificate or a quality management system certificate). Such product must be CE-marked followed by the 4-digits identification number (NB xxxx) of the notified body. Conformity assessment procedures can include audits of manufacturers and/or critical suppliers/subcontractors, testing or review of technical documentation (such as test reports, manufacturer’s risk assessment and/or management process, drawings and clinical data) in support of compliance of the product with the applicable legal requirements.[/panel]
Question 3: Can other documents be valid to lawfully place a product on the EU market?
[panel]Only documents which are explicitly referred to in the applicable EU legislation (namely the EC or EU declaration of conformity and, where needed, certificates issued according to the relevant conformity assessment procedures) may be drawn up and used for the purpose of lawfully placing a product on the EU market. Therefore, any other document is not valid for such a purpose. In practice there are several examples of documents which have no legal status according to the applicable EU legislation, for instance the so-called “certificate of compliance”, “attestation of compliance”, “certificate of conformity”, “certificate of notification”, “certificate of registration”, “documentation review” or similar, which do not comply with the requirements of an EC or EU declaration of conformity issued by the manufacturer or a certificate issued by a notified body.
Those “other documents” with no legal status according to the applicable EU legislation are issued by different kinds of entities, for instance non-notified conformity/certification bodies but also bodies notified under other EU legislative acts, or testing houses or laboratories, or even authorised representatives, etc. Even if such documents may include some elements of a declaration of conformity or a certificate, they are usually voluntary statements that manufacturers request from third parties but do not provide any legal basis to place products on the EU market. These statements may address different issues such as compliance with legislation or standards, appropriateness of the technical documentation and so on, but do not constitute “declarations of conformity” (because valid declarations of conformity can only be issued by manufacturers) nor “certificates” (because valid certificates can only be issued by notified bodies designated for the specific legislative act) within the meaning of the applicable EU legislation.
These voluntary statements may be included in the technical documentation as supporting documents to provide evidence of compliance with certain applicable requirements. However, they can never replace the EC or EU declaration of conformity issued by the manufacturer, or the certificate(s) issued by notified bodies, as prescribed by the applicable EU legislation.[/panel]
Question 4: Which are the main characteristics of a valid declaration of conformity?
[panel]A valid EC or EU declaration of conformity must be drafted and signed by the manufacturer, and include as a minimum:
- the identification and description of the product;
- the EU legislative act(s) to which conformity is claimed;
- the name and address of the manufacturer, and/or of the authorised representative, where applicable;
- a statement that the declaration is issued under the sole responsibility of the manufacturer;
- the conformity assessment procedure(s) applied;
- references to the relevant harmonised European standard(s) or common specification(s) used, where applicable;
- the name and the 4-digits identification number (NB xxxx) of the notified body and reference to the certificate(s) issued, where applicable;
- date of issue of the declaration, identification and signature of the manufacturer.
The minimum contents of the EU declaration of conformity according to the new Regulations on medical devices are laid down in the respective Annexes IV.
The minimum contents of the EU declaration of conformity according to the PPER are laid down in Annex IX.
If a product falls under the scope of two or more EU legislative acts providing for the CE marking, a single EU declaration of conformity must be drafted and signed by the manufacturer, declaring conformity with the applicable two or more pieces of legislation. This is the case, for instance, of “double-purpose” medical protective equipment, such as some types of face masks or gloves, providing protection to both users and patients: they fall under the scope of both the MDD and the PPER, therefore their EU declaration of conformity will refer to both pieces of legislation.[/panel]
[...] Segue in allegato
Fonte: EU
Collegati:
[box-note]COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
Regolamento DPI | Regolamento (UE) 2016/425
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Rischio biologico Coronavirus | Titolo X D.Lgs. 81/08
Certifico | Sezione Covid-19[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| FaQ - COVID-19 Verifica immissione sul mercato MD e DPI.pdf EU 25.05.2020 |
392 kB | 22 |
RAPEX Report 20 del 15/05/2020 N. 01 A12/00713/20 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 20 del 15/05/2020 N. 01 A12/00713/20 Ungheria
Approfondimento tecnico: Catena luminosa
Il prodotto 188 LED FÉNY, di marca sconosciuta, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60598-1:2015 “Apparecchi di illuminazione Parte 1: Prescrizioni generali e prove”.
Il cavo è troppo sottile e potrebbe surriscaldarsi causando un incendio ed i fili hanno un isolamento inadeguato. Il prodotto non è protetto contro l’umidità ma è consigliato per l'uso all'aperto. L'acqua potrebbe penetrare nel prodotto e l'utente toccando delle parti sotto tensione potrebbe ricevere una scossa elettrica.
Direttiva 2014/35/UE - ALLEGATO I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 20 del 15_05_2020 N. 01 A12_00713_20 Ungheria.pdf Catena luminosa |
375 kB | 1 |
Linee guida deroghe a livello dell'Unione per i dispositivi medici
Linee guida della Commissione sulle deroghe a livello dell'Unione per i dispositivi medici
Orientamenti sull’adozione di deroghe a livello dell’Unione relative ai dispositivi medici in conformità all’articolo 59 del regolamento (UE) 2017/745
(2020/C 171/01)
________
1. Contesto
Il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio relativo ai dispositivi medici è stato adottato il 5 aprile 2017. Questo nuovo quadro normativo stabilisce standard elevati di qualità e sicurezza per i dispositivi medici e mira a garantire il corretto funzionamento del mercato interno.
In risposta alla pandemia di Covid-19, e avendo come principio guida la salute e la sicurezza dei pazienti, il Parlamento europeo e il Consiglio, su proposta della Commissione, il 23 aprile 2020, hanno adottato il regolamento (UE) 2020/561, che rinvia di un anno, al 26 maggio 2021, la data di applicazione del regolamento (UE) 2017/745. Nel contempo il regolamento (UE) 2020/561 rinvia anche l’applicazione della disposizione che abroga la direttiva 90/385/CEE del Consiglio relativa ai dispositivi medici impiantabili attivi e la direttiva 93/42/CEE del Consiglio concernente i dispositivi medici.
Le direttive 90/385/CEE e 93/42/CEE e il regolamento (UE) 2017/745 conferiscono alle autorità nazionali competenti la facoltà di autorizzare, su richiesta debitamente motivata, l’immissione sul mercato di dispositivi medici per i quali le pertinenti procedure di valutazione della conformità non sono state espletate, ma il cui impiego è nell’interesse della salute pubblica o della sicurezza o salute dei pazienti («deroga nazionale»).
Il regolamento (UE) 2017/745 conferisce inoltre alla Commissione, in casi eccezionali, la facoltà di estendere per un periodo di tempo limitato la validità di una deroga nazionale al territorio dell’Unione («deroga a livello dell’Unione»). Tali deroghe a livello dell’Unione dovrebbero essere ritenute una misura di ultima istanza, da considerare solo in casi eccezionali per garantire la salute o la sicurezza dei pazienti o per proteggere la salute pubblica. La misura consente alla Commissione e agli Stati membri di affrontare in modo efficace le potenziali carenze a livello dell’Unione di dispositivi medici di vitale importanza.
I presenti orientamenti forniscono informazioni sull’adozione di tali deroghe a livello dell’Unione, in particolare sui criteri di cui la Commissione terrà conto per stabilire se l’estensione di una deroga nazionale al territorio dell’Unione sia necessaria e giustificata per un dispositivo medico. Il presente documento fornisce inoltre informazioni sulla procedura di adozione e sulle condizioni generali che la Commissione dovrebbe stabilire per le deroghe a livello dell’Unione mediante atti di esecuzione.
2. Base giuridica
A norma dell’articolo 59 del regolamento (UE) 2017/745 le autorità nazionali competenti possono autorizzare, su richiesta debitamente motivata, l’immissione sul mercato e la messa in servizio all’interno del territorio dello Stato membro interessato di un dispositivo specifico per il quale le procedure di valutazione della conformità di cui all’articolo 52 del regolamento (UE) 2017/745 o, per il periodo a decorrere dal 24 aprile 2020 al 25 maggio 2021, all’articolo 9, paragrafi 1 e 2, della direttiva 90/385/CEE, o all’articolo 11, paragrafi da 1 a 6, della direttiva 93/42/CEE non sono state espletate ma il cui impiego è nell’interesse della salute pubblica o della sicurezza o salute dei pazienti.
A norma dell’articolo 59, paragrafo 2, del regolamento (UE) 2017/745, gli Stati membri informano la Commissione e gli altri Stati membri in merito a ogni deroga nazionale concessa per un dispositivo medico. Per agevolare tale procedura e rafforzare il coordinamento tra gli Stati membri, la Commissione istituirà e gestirà un archivio centrale (6) che consentirà alle autorità nazionali competenti di condividere con la Commissione e con le altre autorità nazionali le informazioni sulle deroghe concesse.
Non vi è alcun obbligo giuridico di informare la Commissione e gli altri Stati membri delle deroghe nazionali adottate prima del 24 aprile 2020. L’articolo 59, paragrafo 2, secondo comma, stabilisce tuttavia che gli Stati membri possono trasmettere una notifica alla Commissione al fine di garantire che tali deroghe nazionali possano essere prese in considerazione per l’adozione di deroghe a livello dell’Unione. In tal caso le notifiche nazionali dovrebbero essere trasmesse all’archivio centrale di cui sopra.
A norma dell’articolo 59, paragrafo 3, del regolamento (UE) 2017/745, la Commissione può, in casi eccezionali connessi alla salute pubblica o alla sicurezza o alla salute dei pazienti, mediante atti di esecuzione, estendere per un periodo di tempo limitato la validità di una deroga nazionale concessa da uno Stato membro a norma delle disposizioni di cui sopra al territorio dell’Unione e fissare le condizioni alle quali il dispositivo può essere immesso sul mercato o messo in servizio.
La Commissione può adottare deroghe a livello dell’Unione solo in risposta a deroghe nazionali notificatele da uno Stato membro.
3. Prescrizioni generali
Nel considerare l’adozione di una deroga a livello dell’Unione, in una prima fase la Commissione consulterà gli Stati membri, mediante il gruppo di coordinamento per i dispositivi medici (MDCG) istituito a norma del regolamento (UE) 2017/745, per stabilire se una deroga nazionale notificata per un determinato dispositivo medico possa essere rilevante per l’Unione.
Qualora sia stabilito che potrebbe esservi una rilevanza per l’Unione, in una seconda fase la Commissione valuterà se gli obblighi procedurali di cui alla sottosezione A sono stati soddisfatti. In una terza fase la Commissione, sulla base delle prescrizioni di cui alla sottosezione B, stabilirà se l’adozione di una deroga a livello dell’Unione sia debitamente giustificata nel caso in questione.
A. Obblighi procedurali
1. Per il dispositivo medico in questione è stata concessa e notificata alla Commissione almeno una deroga nazionale.
2. Per ogni deroga nazionale notificata sono state messe a disposizione della Commissione e di tutti gli altri Stati membri tutte le motivazioni di cui si è tenuto conto al momento di concedere detta deroga.
3. Il contenuto di ciascuna deroga nazionale notificata, in termini di periodo di validità, condizioni o prescrizioni specifiche, nonché l’esito di eventuali attività di sorveglianza o di monitoraggio, sono stati messi a disposizione della Commissione e di tutti gli altri Stati membri.
4. Ogni deroga nazionale notificata identifica chiaramente il dispositivo medico per il quale è concessa e include una descrizione del dispositivo, la destinazione d’uso e le informazioni del fabbricante.
5. Qualsiasi documentazione (tecnica) presentata da uno o più fabbricanti relativa al dispositivo medico che beneficia di una o più deroghe nazionali notificate, nonché il risultato della valutazione di tale documentazione effettuata dall’autorità nazionale competente, sono stati messi a disposizione della Commissione e di tutti gli altri Stati membri.
B. Debita giustificazione
1. La documentazione di cui alla sottosezione A dimostra che il fabbricante ha fatto quanto può essere ragionevolmente previsto per completare la valutazione della conformità entro i termini stabiliti o, se del caso, vi sono prove sufficienti che il fabbricante non ha potuto completare o iniziare la valutazione della conformità a causa di circostanze eccezionali e imprevedibili.
2. Il dispositivo o i dispositivi medici in questione sono di vitale importanza per la salute pubblica o la sicurezza o la salute dei pazienti.
3. Mancano i sostituti adeguati.
4. Se del caso, nel fascicolo tecnico, o in seguito ad attività di sorveglianza o di vigilanza del mercato, non vi sono, riguardo ai dispositivi delle generazioni precedenti o con caratteristiche simili, indicazioni secondo cui il dispositivo possa nuocere alla salute o alla sicurezza dei pazienti o alla salute pubblica.
5. Ciascuna deroga nazionale notificata ha carattere temporaneo e il suo periodo di validità è limitato a quanto può essere ragionevolmente ritenuto necessario per completare la procedura di valutazione della conformità applicabile o, in alternativa, per garantire la sicurezza o la salute dei pazienti o la protezione della salute pubblica.
6. È chiaramente rilevante per l’Unione estendere la validità di una o più deroghe nazionali notificate al territorio dell’Unione.
Le informazioni di cui ai punti da 1 a 5 della sottosezione B sono richieste per consentire alla Commissione di valutare se l’adozione di una deroga a livello dell’Unione sia debitamente motivata. Tale ulteriore documentazione completerà le informazioni inizialmente notificate alla Commissione nel quadro delle deroghe nazionali in questione. Dovrebbero essere contenute, in particolare, le seguenti informazioni:
a) una spiegazione dei motivi per cui la valutazione della conformità non è stata avviata o completata prima dell’immissione sul mercato; una spiegazione dell’importanza vitale dell’uso del dispositivo medico; un piano dettagliato sulle modalità per garantire la conformità o il ritiro del dispositivo dal mercato dopo la scadenza della deroga temporanea;
b) una spiegazione dell’importanza vitale dell’uso del dispositivo medico nel rispettivo Stato membro dovrebbe essere corredata da una o più dichiarazioni delle istituzioni sanitarie, compresi i motivi per cui il dispositivo non può essere sostituito.
Ai fini del punto 6 della sottosezione B, la Commissione intende consultare gli Stati membri mediante il gruppo MDCG. La Commissione stabilirà se l’estensione della deroga nazionale sia nell’interesse dell’Unione, tenendo conto dei riscontri ricevuti dal gruppo MDCG.
4. Procedura di adozione
La Commissione deciderà in merito alla necessità di adottare una deroga a livello dell’Unione sulla base delle informazioni di cui alle sottosezioni A e B della sezione 3. Ciò è necessario per garantire la sicurezza o la salute dei pazienti o la protezione della salute pubblica, salvaguardando nel contempo il corretto funzionamento del mercato interno.
A norma dell’articolo 59, paragrafo 3, primo comma, del regolamento (UE) 2017/745, la Commissione adotta deroghe a livello dell’Unione mediante atti di esecuzione. Tali atti di esecuzione sono adottati secondo la procedura di esame stabilita dal regolamento (UE) n. 182/2011 del Parlamento europeo e del Consiglio (8).
Per motivi imperativi di urgenza debitamente giustificati connessi alla salute e alla sicurezza delle persone, l’articolo 59, paragrafo 3, secondo comma, del regolamento (UE) 2017/745 stabilisce che la Commissione adotti atti di esecuzione immediatamente applicabili, senza previa presentazione al pertinente comitato di comitatologia secondo quanto disposto all’articolo 8, in combinato disposto con l’articolo 5 del regolamento (UE) n. 182/2011. In tali casi, al massimo quattordici giorni dopo la sua adozione, la Commissione sottoporrà l’atto di esecuzione al comitato competente al fine di ottenerne il parere, tenendo conto delle informazioni di cui alla sezione 3. Nel caso in cui il comitato presenti un parere negativo, la Commissione abrogherà immediatamente l’atto di esecuzione.
5. Condizioni generali
L’articolo 59, paragrafo 3, del regolamento (UE) 2017/745 prevede che la Commissione stabilisca le condizioni di una deroga a livello dell’Unione adottata mediante un atto di esecuzione. Nel definire tali condizioni, la Commissione baserà la propria decisione, in particolare sulle informazioni presentate conformemente alla sottosezione A della sezione 3. La Commissione può inoltre prendere in considerazione altre osservazioni presentate, ad esempio, dagli Stati membri nell’ambito del gruppo MDCG.
Le deroghe a livello dell’Unione possono stabilire condizioni più rigorose per l’immissione temporanea sul mercato di un dispositivo medico rispetto a quelle stabilite mediante le deroghe nazionali già in vigore per il dispositivo. Gli Stati membri dovrebbero invece poter introdurre, mediante misure nazionali, condizioni più rigorose di quelle previste dalle deroghe a livello dell’Unione. In tali casi dovrebbero prevalere le condizioni più rigorose.
Salvo diversa decisione, le deroghe a livello dell’Unione dovrebbero rimanere in vigore per un periodo non superiore a sei mesi. Eventuali modifiche sostanziali delle circostanze o delle informazioni di cui alla sezione 3 o di altre informazioni a disposizione della Commissione o degli Stati membri, in particolare attraverso la vigilanza del mercato, dovrebbero giustificare una nuova valutazione della deroga a livello dell’Unione e delle relative condizioni. In tali casi la Commissione può proporre di modificare o, se del caso, abrogare l’atto di esecuzione mediante il quale ha stabilito la deroga a livello dell’Unione. Tale procedura sarà oggetto di una consultazione degli Stati membri nell’ambito del gruppo MDCG.
Collegati:
[box-note]Linee guida Regolamento Medical Devices (UE) 2017/745
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Certifico | Sezione Covid-19[/box-note]
CEI EN IEC 63000:2021 - Documentazione tecnica conformità restrizione sostanze pericolose
CEI EN IEC 63000:2021 - Documentazione tecnica conformità restrizione sostanze pericolose
ID 10814 | Rev. 1.0 del 30.06.2021
La norma CEI EN IEC 63000:2021, traduzione in IT della EN IEC 63000, specifica la documentazione tecnica che il costruttore deve compilare per dichiarare la conformità con le restrizioni applicabili alle sostanze.
La Norma sostituisce completamente la Norma CEI EN 50581:2013-05, che rimane applicabile fino al 07-12-2023.
[box-note]Rev. 1.0 del 30.06.2021
CEI EN IEC 63000:2021-03 – Traduzione in lingua italiana della EN IEC 63000[/box-note]
Alcune sostanze contenute nei prodotti elettrici ed elettronici sono soggette a limitazioni di legge e/o indicate nelle specifiche del cliente.
Pertanto i fabbricanti di prodotti finiti devono essere in grado di dimostrare che i loro prodotti rispettano le limitazioni di sostanze. Per quanto attiene alle limitazioni applicabili a livello di componente o materiale, la verifica di tutti i materiali contenuti nel prodotto finito, condotta dai fabbricanti di prodotti elettrici ed elettronici, è impraticabile. I fabbricanti, invece, lavorano con i loro fornitori per la gestione della conformità e compilano una documentazione tecnica a dimostrazione della stessa.
Tale approccio è riconosciuto sia all’interno del settore che dalle autorità di controllo.
Scopo del presente documento è quello di indicare la documentazione tecnica da compilare a cura del fabbricante per dichiarare la conformità alle limitazioni di sostanze, ai sensi dei diversi regolamenti sull’uso di sostanze a livello mondiale.
Il presente documento è basato sulla Norma Europea EN 50581:2012, che supporta la Direttiva 2011/65/UEdel Parlamento Europeo e del Consiglio dell’8 giugno 2011 sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche (RoHS).
___
La norma EN IEC 63000:2018 è stata pubblicata in GU L 155/12 del 18.05.2020. Il riferimento alla norma EN 50581:2012 è ritirato a decorrere dal 18 novembre 2021.
[panel]Decisione di Esecuzione (UE) 2020/659 della Commissione del 15 maggio 2020 sulla norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche elaborata a sostegno della direttiva 2011/65/UE del Parlamento europeo e del Consiglio
GU L 155/12 del 18.05.2020
Entrata in vigore: 18.05.2020
Articolo 1
Il riferimento della norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche redatta a sostegno della Direttiva 2011/65/UE, elencata nell'allegato I della presente decisione, è pubblicata nella Gazzetta ufficiale dell'Unione europea.
Articolo 2
Il riferimento alla norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche redatta a sostegno della Direttiva 2011/65/UE, elencata nell'allegato II della presente decisione, è ritirato dalla Gazzetta ufficiale delle Comunità europee Unione a decorrere dalla data indicata in tale allegato.
Allegato I
EN IEC 63000:2018 Documentazione tecnica per la valutazione di prodotti elettrici ed elettronici rispetto alla restrizione delle sostanze pericolose (IEC 63000:2016)
Allegato II
EN 50581:2012 Documentazione tecnica per la valutazione di prodotti elettrici ed elettronici rispetto alla restrizione delle sostanze pericolose
Data di ritiro: 18 novembre 2021[/panel]
[panel]Decreto Legislativo n.27 del 4 Marzo 2014
Attuazione della Direttiva 2011/65/UE sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche
GU n.62 del 15-3-2014
Entrata in vigore: 30.03.2014
…
Art. 14 Documentazione del prodotto
1. La documentazione tecnica di cui all'articolo 7, comma 2, è redatta secondo la norma armonizzata EN 50581:2012, e successive modificazioni.
2. La documentazione tecnica è redatta in una delle lingue ufficiali dell'Unione.
3. In seguito ad una richiesta motivata dell’autorità di vigilanza nazionale del mercato di cui all'articolo 19, il fabbricante fornisce una traduzione delle parti pertinenti della documentazione tecnica in italiano. Qualora a un fabbricante sia richiesta la documentazione tecnica o la traduzione di parti di essa dalla predetta autorità di vigilanza, questa può fissare un termine pari a trenta giorni.
4. Nel caso il fabbricante non osservi gli obblighi di cui ai commi 1, 2 e 3, la predetta autorità di vigilanza può richiedere che il fabbricante faccia effettuare a proprie spese una prova, entro un termine determinato, da parte di un organismo notificato per verificare la conformità alle norme armonizzate e ai requisiti di cui all'articolo 4.[/panel]
__________
1. Campo di applicazione
Il presente documento specifica la documentazione tecnica compilata a cura del fabbricante per dichiarare la conformità alle restrizioni applicabili alle sostanze. La documentazione del sistema di gestione del fabbricante esula dal campo di applicazione del presente documento.
2 Riferimenti normativi
I documenti seguenti* sono citati nel testo in modo tale che il loro contenuto costituisca, in tutto o in parte, prescrizioni per il presente documento. Per quanto riguarda i riferimenti datati, si applica esclusivamente l’edizione citata. Per quanto riguarda i riferimenti non datati, si applica l’ultima edizione del documento al quale viene fatto riferimento (comprese eventuali Modifiche).
* N.d.R. Per l’elenco delle Pubblicazioni, si rimanda all’Allegato ZA.
3. Termini e definizioni
- sostanza soggetta a limitazioni sostanza il cui uso in un prodotto, un sottoassieme, una parte, o un materiale è limitato
- fabbricante persona fisica o giuridica che fabbrica oppure fa progettare o costruire un prodotto e lo commercializza con il proprio nome o marchio
- fornitore organizzazione che fornisce al fabbricante materiali, parti e/o sottoassiemi
4 Documentazione tecnica
4.1 Panoramica
Il fabbricante deve compilare la documentazione tecnica per dimostrare la conformità dei prodotti elettrici ed elettronici alle restrizioni sulle sostanze (si veda 0 e 4.3).
4.2 Contenuto della documentazione tecnica
La documentazione tecnica deve comprendere almeno i seguenti elementi:
- una descrizione generale del prodotto;
NOTE La descrizione del prodotto insieme all’uso previsto è uno degli elementi che determinano le (eventuali) esenzioni applicabili.
- documenti relativi a materiali, parti e/o sottoassiemi (si veda 4.3);
- informazioni che mostrano la relazione tra i documenti tecnici individuati in 4.3 e i materiali, le parti e/o i sottoassiemi del prodotto corrispondenti;
- elenco delle Norme e/o delle altre specifiche tecniche utilizzate per definire, o alle quali si riferiscono, i documenti tecnici individuati in 4.3.
4.3 Informazioni su materiali, parti e/o sottoassiemi
4.3.1 Compiti da svolgere a cura del fabbricante
Il fabbricante deve svolgere le seguenti quattro azioni:
- determinare le informazioni necessarie (si veda 4.3.2);
- raccogliere le informazioni (si veda 4.3.3);
- valutare la qualità e l’affidabilità delle informazioni e deciderne l’inclusione nella documentazione tecnica (si veda 4.3.4);
- garantire il mantenimento della validità della documentazione tecnica (si veda 4.3.5).
La Fig. 1 mostra il processo di creazione della documentazione tecnica:
Figura 1 - Rappresentazione schematica del processo per la creazione della documentazione tecnica
...Segue in allegato
Fonti
EN IEC 63000:2021
Certifico Srl - IT | Rev. 1.0 2021
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto |
| 1.0 | 30 Giugno 2021 | CEI EN IEC 63000:2021 |
| 0.0 | 20 Maggio 2020 | EN IEC 63000:2018Traduzione non ufficiale IT |
Collegati
[box-note]CEI EN IEC 63000:2021
Decisione di Esecuzione (UE) 2020/659
Direttiva RoHS: Open Scope dal 22 luglio 2019
Dichiarazione UE di Conformità RoHS III - Modello
Direttiva RoHS: Evoluzioni
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| EN IEC 63000 2021 - Documentazione tecnica conformità restrizione sostanze pericolose Rev. 1.0 2021.pdf Certifico Srl - Rev. 1.0 2021 |
507 kB | 186 | ||
| EN IEC 63000 2018 Documentazione tecnica valutazione RoHS Rev. 0.0 2020.pdf Certifico Srl - Rev. 00 2020 |
193 kB | 135 |
RAPEX Report 19 del 08/05/2020 N. 01 A12/00682/20 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 19 del 08/05/2020 N. 01 A12/00682/20 Lituania
Approfondimento tecnico: Liquido per sigarette elettroniche
Il prodotto, di marca Vampire Vape, mod. Heidelberg, è stato sottoposto alla procedura di ritiro dal mercato perché non perché non conforme alla Direttiva 2014/40/UE del Parlamento Europeo e del Consiglio del 3 aprile 2014 sul ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri relative alla lavorazione, alla presentazione e alla vendita dei prodotti del tabacco e dei prodotti correlati e che abroga la direttiva 2001/37/CE.
Il prodotto contiene una quantità eccessiva di nicotina (valore misurato: 24,3 mg/ml). La nicotina è altamente tossica e può mettere in pericolo la sicurezza dell'utilizzatore, in particolare se il prodotto viene a contatto con la pelle o viene ingerito.
TITOLO III
Sigarette elettroniche e prodotti da fumo a base di erbe
Articolo 20
Sigarette elettroniche
[…] 3. Gli Stati membri provvedono affinché:
a) il liquido contenente nicotina sia immesso sul mercato solo in contenitori di liquido di ricarica appositi il cui volume non superi i 10 ml, in sigarette elettroniche usa e getta o in cartucce monouso con cartucce o serbatoi di volume non superiore a 2 ml;
b) il liquido contenente nicotina non presenti un contenuto di nicotina superiore a 20 mg/ml;
c) il liquido contenente nicotina non contenga gli additivi elencati all’articolo 7, paragrafo 6;
d) per produrre il liquido contenente nicotina siano usati solo ingredienti di elevata purezza. Le sostanze diverse dagli ingredienti di cui al secondo comma del paragrafo 2, lettera b), del presente articolo sono presenti nel liquido contenente nicotina solo a livello di tracce, se tali tracce sono tecnicamente inevitabili durante la produzione;
e) ad eccezione della nicotina, nel liquido contenente nicotina siano usati solo ingredienti che non
presentano, anche se riscaldati, pericoli per la salute umana;
f) le sigarette elettroniche rilascino le dosi di nicotina a livelli costanti in condizioni normali d’uso;
g) le sigarette elettroniche e i contenitori di liquido di ricarica siano a prova di bambino e manomissione,
siano protetti contro la rottura e le perdite e muniti di un meccanismo per una ricarica senza perdite. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 19 del 08_05_2020 N. 01 A12_00682_20 Lituania.pdf Liquido per sigarette elettroniche |
356 kB | 1 |
Circolare Ministero della Salute del 05 Maggio 2020 n. 26342
Circolare Ministero della Salute del 05 Maggio 2020 n. 26342
OGGETTO: Richieste di Autorizzazioni in deroga ai sensi dell’art. 11, comma 14 del D.Lgs. n. 46/97 ed Emergenza COVID 19
In merito alla possibilità di ricorrere ad autorizzazioni in deroga per la valutazione della conformità ai fini della immissione in commercio di dispositivi medici ai sensi dell’art. 11, comma 14, del D.Lgs. n. 46/97, si ritiene opportuno fornire alcuni chiarimenti, anche in ragione dell’attuale stato di emergenza dovuto alla pandemia da COVID-19, nonché in considerazione della necessità di ribadire, che sebbene nell’ambito di un contesto emergenziale come l’attuale, è comunque imprescindibile garantire la sicurezza dei dispositivi medici utilizzati. La normativa nazionale a cui fare riferimento è Il D.Lgs. n. 46/97 (che recepisce la direttiva 2007/47/CE) e che stabilisce, all’articolo 11, comma 14: “14. Il Ministero della salute autorizza, su richiesta motivata, l'immissione in commercio e la messa in servizio, nel territorio nazionale, di singoli dispositivi per i quali le procedure di cui ai commi da 1 a 6 non sono state espletate o completate, il cui impiego è nell'interesse della protezione della salute. La domanda di autorizzazione deve contenere la descrizione del dispositivo, dell'azione principale cui è destinato e dei motivi per i quali la domanda è stata presentata. Il Ministero della salute comunica, entro trenta giorni, il provvedimento in merito all'autorizzazione.”
La Commissione europea ha adottato la Raccomandazione UE n. 2020/403, sulle procedure di valutazione della conformità e di vigilanza del mercato nel contesto della minaccia rappresentata dalla COVID-19 e ha pubblicato la Guidance on medical devices, active implantable medical devices and in vitro diagnostic medical devices in the COVID-19 context.
Il documento da ultimo citato, sotto forma di domande e risposte, fornisce una guida su vari punti relativi ai dispositivi medici tra cui: requisiti legali per l'immissione sul mercato e verifica della conformità, procedure di deroga ed uso delle norme armonizzate. In allegato alla linea guida è inoltre presente un elenco delle più rilevanti norme armonizzate per i dispositivi medici pertinenti a COVID19, il cui rispetto conferisce ai dispositivi stessi presunzione di conformità ai requisiti essenziali fissati nelle direttive.
Risulta chiaro dal tenore delle norme e degli altri documenti ora richiamati, che la deroga di cui trattasi, oltre ad essere limitata esclusivamente a quei dispositivi medici indispensabili per il contrasto all’emergenza COVID-19, e rispetto ai quali vi sia una oggettiva carenza, afferisce ai passaggi procedurali richiesti in via ordinaria per l’immissione in commercio e la messa in servizio di singoli dispositivi medici, ferma restando l’imprescindibile necessità che il richiedente produca una domanda di autorizzazione in deroga corredata dei documenti necessari per consentire al Ministero della salute ed agli organismi tecnici competenti di valutare l’effettiva rispondenza del dispositivo ai requisiti di salute e sicurezza che in nessun modo possono essere derogati. Per tale ragione si suggerisce che il richiedente, parallelamente all’avvio della procedura in deroga, presenti ad un Organismo Notificato la documentazione comprovante i requisiti di salute e sicurezza per cui richiede la deroga, dandone evidenza nella domanda di deroga presentata al Ministero.
Tanto premesso, ai fini dell’autorizzazione all’immissione in commercio in Italia in deroga ai sensi dell’art. 11, comma 14 del D.Lgs. n. 46/97, i fabbricanti di dispositivi medici inviano al Ministero della salute, Direzione generale dei dispositivi medici e del servizio farmaceutico un’istanza i cui elementi minimi sono:
[alert]- la motivazione della richiesta;
- l’indicazione circa la ragione del mancato completamento delle ordinarie procedure (laddove già avviate);
- la descrizione del dispositivo;
- l’azione principale cui il dispositivo è destinato.[/alert]
Unitamente alla domanda, i fabbricanti autocertificano, ai sensi del D.P.R. 445/2000:
[alert]- informazioni sul fabbricante e sul suo eventuale rappresentante autorizzato stabilito in Italia o nella UE (per i fabbricanti stabiliti al di fuori dell’Unione europea);
- denominazione, sede sociale e indirizzo PEC del fabbricante, estremi di identificazione del suo legale rappresentante;
- denominazione, sede sociale e indirizzo PEC del mandatario, estremi di identificazione del suo legale rappresentante;
- informazioni relative al dispositivo medico da autorizzare: denominazione, modello, destinazione d’uso, descrizione, azione principale, motivi di presentazione della domanda, estremi di eventuali autorizzazioni all’immissione in commercio come dispositivo medico al di fuori dell’Unione europea, e ogni altra informazione ritenuta utile per la valutazione del dispositivo;
- informazioni per l’etichettatura del dispositivo che dovrà essere in lingua italiana;
- informazioni in merito alle attività già intraprese ai fini della valutazione della conformità (documentazione tecnica, valutazione clinica, analisi rischio/beneficio per l’utilizzo, includendo informazioni rilasciate dall’organismo notificato, ove prescritto, cui il fabbricante si è rivolto circa i tempi previsti per il completamento della valutazione della conformità);
- informazioni in merito alle norme tecniche armonizzate applicate durante i processi di progettazione e fabbricazione;
- informazioni in merito alle modalità con cui il dispositivo soddisfa i requisiti essenziali di sicurezza e prestazione di cui all’allegato I del D.Lgs. 46/97.[/alert]
Nel ribadire che la deroga di cui trattasi, oltre ad essere limitata esclusivamente a quei dispositivi medici indispensabili per il contrasto all’emergenza COVID-19, e rispetto ai quali vi sia una oggettiva carenza, si precisa che la stessa, laddove accordata nell'interesse della protezione della salute, sarà temporanea e il periodo di validità limitato a quanto è strettamente necessario per rendere il dispositivo conforme alle prescrizioni formali previste dalla legislazione o in attesa di sostituti adeguati e comunque non oltre la fine dell’emergenza di cui alla Delibera del Consiglio dei Ministri del 31 gennaio 2020.
I fabbricanti dei dispositivi medici autorizzati in deroga devono assicurare la conformità di tutti i dispositivi da essi messi a disposizione alle caratteristiche descritte nelle informazioni fornite ai fini dell’autorizzazione e alle prescrizioni emesse dal Ministero con l’autorizzazione, e sono soggetti agli obblighi di vigilanza previsti dalle vigenti norme.
...
Fonte: Ministero della Salute
Collegati:
[box-note]COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
Certifico | Sezione Covid-19[/box-note]
RAPEX Report 18 del 01/05/2020 N. 50 INFO/00051/20 Danimarca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 18 del 01/05/2020 N. 50 INFO/00051/20 Danimarca
Approfondimento tecnico: Mascherina di protezione
Il prodotto, di marca sconosciuta, è stato sottoposto al divieto di commercializzazione perché non conforme al Regolamento (UE) 2016/425 del Parlamento Europeo e del Consiglio del 9 marzo 2016 sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio.
Il prodotto ha un marchio CE ma non è certificato come DPI (Dispositivi di Protezione Individuale) da nessun Organismo Notificato.
Di conseguenza, il prodotto potrebbe non soddisfare i requisiti di salute e sicurezza del Regolamento (UE) 2016/425 e proteggere adeguatamente le vie respiratorie.
Il Regolamento (UE) 2016/425 classifica i DPI (Dispositivi di Protezione Individuale) in tre categorie in base alla gravità del rischio da cui devono proteggere l’utilizzatore.
I dispositivi di protezione delle vie respiratorie, come le mascherine, sono DPI (Dispositivi di Protezione Individuale) di III Categoria.
Regolamento (UE) 2016/425
Articolo 17
Regole e condizioni per l'apposizione della marcatura CE
1. La marcatura CE è apposta sul DPI in modo visibile, leggibile e indelebile. Se ciò fosse impossibile o ingiustificato a causa della natura del DPI, la marcatura CE è apposta sull'imballaggio o sui documenti di accompagnamento del DPI.
2. La marcatura CE è apposta sul DPI prima della sua immissione sul mercato.
3. Per i DPI della categoria III, la marcatura CE è seguita dal numero di identificazione dell'organismo notificato che interviene nella procedura di cui agli allegati VII o VIII. Il numero di identificazione dell'organismo notificato è apposto dall'organismo stesso o, in base alle sue istruzioni, dal fabbricante o dal suo mandatario.
4. La marcatura CE e, se del caso, il numero di identificazione dell'organismo notificato possono essere seguiti da un pittogramma o da un'altra marcatura con l'indicazione del rischio dal quale il DPI è destinato a proteggere.
5. Gli Stati membri si avvalgono dei meccanismi esistenti per garantire un'applicazione corretta del regime che disciplina la marcatura CE e promuovono le azioni opportune contro l'uso improprio di tale marcatura.
Regolamento (UE) 2016/425
Articolo 19
Procedure di valutazione della conformità
Le procedure di valutazione della conformità da seguire, per ognuna delle categorie di rischio di cui all'allegato I, sono le seguenti:
a) categoria I: controllo interno della produzione (modulo A) di cui all'allegato IV;
b) categoria II: esame UE del tipo (modulo B) di cui all'allegato V seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) di cui all'allegato VI;
c) categoria III: esame UE del tipo (modulo B) di cui all'allegato V e una delle seguenti:
i) conformità al tipo basata sul controllo interno della produzione unito a prove del prodotto sotto controllo ufficiale effettuate ad intervalli casuali (modulo C2) di cui all'allegato VII;
ii) conformità al tipo basata sulla garanzia di qualità del processo di produzione (modulo D) di cui all'allegato VIII.
A titolo di deroga, per i DPI prodotti come unità singole per adattarsi ad un singolo utilizzatore e classificati secondo la categoria III, può essere seguita la procedura di cui alla lettera b).
Regolamento (UE) 2016/425
ALLEGATO I
Categorie di rischio dei DPI
[...] Categoria III
La categoria III comprende esclusivamente i rischi che possono causare conseguenze molto gravi quali morte o danni alla salute irreversibili con riguardo a quanto segue:
a) sostanze e miscele pericolose per la salute;
b) atmosfere con carenza di ossigeno;
c) agenti biologici nocivi;
d) radiazioni ionizzanti;
e) ambienti ad alta temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di almeno 100 °C;
f) ambienti a bassa temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di – 50 °C o inferiore;
g) cadute dall'alto;
h) scosse elettriche e lavoro sotto tensione;
i) annegamento;
j) tagli da seghe a catena portatili;
k) getti ad alta pressione;
l) ferite da proiettile o da coltello;
m) rumore nocivo. [...]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 18 del 01_05_2020 N. 50 INFO_00051_20 Danimarca.pdf Mascherina di protezione |
370 kB | 2 |