// Documenti disponibili n: 46.592
// Documenti scaricati n: 36.658.932
Orientamenti sull’adozione di deroghe a livello dell’Unione relative ai dispositivi medici in conformità all’articolo 59 del regolamento (UE) 2017/745
(2020/C 171/01)
________
1. Contesto
Il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio relativo ai dispositivi medici è stato adottato il 5 aprile 2017. Questo nuovo quadro normativo stabilisce standard elevati di qualità e sicurezza per i dispositivi medici e mira a garantire il corretto funzionamento del mercato interno.
In risposta alla pandemia di Covid-19, e avendo come principio guida la salute e la sicurezza dei pazienti, il Parlamento europeo e il Consiglio, su proposta della Commissione, il 23 aprile 2020, hanno adottato il regolamento (UE) 2020/561, che rinvia di un anno, al 26 maggio 2021, la data di applicazione del regolamento (UE) 2017/745. Nel contempo il regolamento (UE) 2020/561 rinvia anche l’applicazione della disposizione che abroga la direttiva 90/385/CEE del Consiglio relativa ai dispositivi medici impiantabili attivi e la direttiva 93/42/CEE del Consiglio concernente i dispositivi medici.
Le direttive 90/385/CEE e 93/42/CEE e il regolamento (UE) 2017/745 conferiscono alle autorità nazionali competenti la facoltà di autorizzare, su richiesta debitamente motivata, l’immissione sul mercato di dispositivi medici per i quali le pertinenti procedure di valutazione della conformità non sono state espletate, ma il cui impiego è nell’interesse della salute pubblica o della sicurezza o salute dei pazienti («deroga nazionale»).
Il regolamento (UE) 2017/745 conferisce inoltre alla Commissione, in casi eccezionali, la facoltà di estendere per un periodo di tempo limitato la validità di una deroga nazionale al territorio dell’Unione («deroga a livello dell’Unione»). Tali deroghe a livello dell’Unione dovrebbero essere ritenute una misura di ultima istanza, da considerare solo in casi eccezionali per garantire la salute o la sicurezza dei pazienti o per proteggere la salute pubblica. La misura consente alla Commissione e agli Stati membri di affrontare in modo efficace le potenziali carenze a livello dell’Unione di dispositivi medici di vitale importanza.
I presenti orientamenti forniscono informazioni sull’adozione di tali deroghe a livello dell’Unione, in particolare sui criteri di cui la Commissione terrà conto per stabilire se l’estensione di una deroga nazionale al territorio dell’Unione sia necessaria e giustificata per un dispositivo medico. Il presente documento fornisce inoltre informazioni sulla procedura di adozione e sulle condizioni generali che la Commissione dovrebbe stabilire per le deroghe a livello dell’Unione mediante atti di esecuzione.
2. Base giuridica
A norma dell’articolo 59 del regolamento (UE) 2017/745 le autorità nazionali competenti possono autorizzare, su richiesta debitamente motivata, l’immissione sul mercato e la messa in servizio all’interno del territorio dello Stato membro interessato di un dispositivo specifico per il quale le procedure di valutazione della conformità di cui all’articolo 52 del regolamento (UE) 2017/745 o, per il periodo a decorrere dal 24 aprile 2020 al 25 maggio 2021, all’articolo 9, paragrafi 1 e 2, della direttiva 90/385/CEE, o all’articolo 11, paragrafi da 1 a 6, della direttiva 93/42/CEE non sono state espletate ma il cui impiego è nell’interesse della salute pubblica o della sicurezza o salute dei pazienti.
A norma dell’articolo 59, paragrafo 2, del regolamento (UE) 2017/745, gli Stati membri informano la Commissione e gli altri Stati membri in merito a ogni deroga nazionale concessa per un dispositivo medico. Per agevolare tale procedura e rafforzare il coordinamento tra gli Stati membri, la Commissione istituirà e gestirà un archivio centrale (6) che consentirà alle autorità nazionali competenti di condividere con la Commissione e con le altre autorità nazionali le informazioni sulle deroghe concesse.
Non vi è alcun obbligo giuridico di informare la Commissione e gli altri Stati membri delle deroghe nazionali adottate prima del 24 aprile 2020. L’articolo 59, paragrafo 2, secondo comma, stabilisce tuttavia che gli Stati membri possono trasmettere una notifica alla Commissione al fine di garantire che tali deroghe nazionali possano essere prese in considerazione per l’adozione di deroghe a livello dell’Unione. In tal caso le notifiche nazionali dovrebbero essere trasmesse all’archivio centrale di cui sopra.
A norma dell’articolo 59, paragrafo 3, del regolamento (UE) 2017/745, la Commissione può, in casi eccezionali connessi alla salute pubblica o alla sicurezza o alla salute dei pazienti, mediante atti di esecuzione, estendere per un periodo di tempo limitato la validità di una deroga nazionale concessa da uno Stato membro a norma delle disposizioni di cui sopra al territorio dell’Unione e fissare le condizioni alle quali il dispositivo può essere immesso sul mercato o messo in servizio.
La Commissione può adottare deroghe a livello dell’Unione solo in risposta a deroghe nazionali notificatele da uno Stato membro.
3. Prescrizioni generali
Nel considerare l’adozione di una deroga a livello dell’Unione, in una prima fase la Commissione consulterà gli Stati membri, mediante il gruppo di coordinamento per i dispositivi medici (MDCG) istituito a norma del regolamento (UE) 2017/745, per stabilire se una deroga nazionale notificata per un determinato dispositivo medico possa essere rilevante per l’Unione.
Qualora sia stabilito che potrebbe esservi una rilevanza per l’Unione, in una seconda fase la Commissione valuterà se gli obblighi procedurali di cui alla sottosezione A sono stati soddisfatti. In una terza fase la Commissione, sulla base delle prescrizioni di cui alla sottosezione B, stabilirà se l’adozione di una deroga a livello dell’Unione sia debitamente giustificata nel caso in questione.
A. Obblighi procedurali
1. Per il dispositivo medico in questione è stata concessa e notificata alla Commissione almeno una deroga nazionale.
2. Per ogni deroga nazionale notificata sono state messe a disposizione della Commissione e di tutti gli altri Stati membri tutte le motivazioni di cui si è tenuto conto al momento di concedere detta deroga.
3. Il contenuto di ciascuna deroga nazionale notificata, in termini di periodo di validità, condizioni o prescrizioni specifiche, nonché l’esito di eventuali attività di sorveglianza o di monitoraggio, sono stati messi a disposizione della Commissione e di tutti gli altri Stati membri.
4. Ogni deroga nazionale notificata identifica chiaramente il dispositivo medico per il quale è concessa e include una descrizione del dispositivo, la destinazione d’uso e le informazioni del fabbricante.
5. Qualsiasi documentazione (tecnica) presentata da uno o più fabbricanti relativa al dispositivo medico che beneficia di una o più deroghe nazionali notificate, nonché il risultato della valutazione di tale documentazione effettuata dall’autorità nazionale competente, sono stati messi a disposizione della Commissione e di tutti gli altri Stati membri.
B. Debita giustificazione
1. La documentazione di cui alla sottosezione A dimostra che il fabbricante ha fatto quanto può essere ragionevolmente previsto per completare la valutazione della conformità entro i termini stabiliti o, se del caso, vi sono prove sufficienti che il fabbricante non ha potuto completare o iniziare la valutazione della conformità a causa di circostanze eccezionali e imprevedibili.
2. Il dispositivo o i dispositivi medici in questione sono di vitale importanza per la salute pubblica o la sicurezza o la salute dei pazienti.
3. Mancano i sostituti adeguati.
4. Se del caso, nel fascicolo tecnico, o in seguito ad attività di sorveglianza o di vigilanza del mercato, non vi sono, riguardo ai dispositivi delle generazioni precedenti o con caratteristiche simili, indicazioni secondo cui il dispositivo possa nuocere alla salute o alla sicurezza dei pazienti o alla salute pubblica.
5. Ciascuna deroga nazionale notificata ha carattere temporaneo e il suo periodo di validità è limitato a quanto può essere ragionevolmente ritenuto necessario per completare la procedura di valutazione della conformità applicabile o, in alternativa, per garantire la sicurezza o la salute dei pazienti o la protezione della salute pubblica.
6. È chiaramente rilevante per l’Unione estendere la validità di una o più deroghe nazionali notificate al territorio dell’Unione.
Le informazioni di cui ai punti da 1 a 5 della sottosezione B sono richieste per consentire alla Commissione di valutare se l’adozione di una deroga a livello dell’Unione sia debitamente motivata. Tale ulteriore documentazione completerà le informazioni inizialmente notificate alla Commissione nel quadro delle deroghe nazionali in questione. Dovrebbero essere contenute, in particolare, le seguenti informazioni:
a) una spiegazione dei motivi per cui la valutazione della conformità non è stata avviata o completata prima dell’immissione sul mercato; una spiegazione dell’importanza vitale dell’uso del dispositivo medico; un piano dettagliato sulle modalità per garantire la conformità o il ritiro del dispositivo dal mercato dopo la scadenza della deroga temporanea;
b) una spiegazione dell’importanza vitale dell’uso del dispositivo medico nel rispettivo Stato membro dovrebbe essere corredata da una o più dichiarazioni delle istituzioni sanitarie, compresi i motivi per cui il dispositivo non può essere sostituito.
Ai fini del punto 6 della sottosezione B, la Commissione intende consultare gli Stati membri mediante il gruppo MDCG. La Commissione stabilirà se l’estensione della deroga nazionale sia nell’interesse dell’Unione, tenendo conto dei riscontri ricevuti dal gruppo MDCG.
4. Procedura di adozione
La Commissione deciderà in merito alla necessità di adottare una deroga a livello dell’Unione sulla base delle informazioni di cui alle sottosezioni A e B della sezione 3. Ciò è necessario per garantire la sicurezza o la salute dei pazienti o la protezione della salute pubblica, salvaguardando nel contempo il corretto funzionamento del mercato interno.
A norma dell’articolo 59, paragrafo 3, primo comma, del regolamento (UE) 2017/745, la Commissione adotta deroghe a livello dell’Unione mediante atti di esecuzione. Tali atti di esecuzione sono adottati secondo la procedura di esame stabilita dal regolamento (UE) n. 182/2011 del Parlamento europeo e del Consiglio (8).
Per motivi imperativi di urgenza debitamente giustificati connessi alla salute e alla sicurezza delle persone, l’articolo 59, paragrafo 3, secondo comma, del regolamento (UE) 2017/745 stabilisce che la Commissione adotti atti di esecuzione immediatamente applicabili, senza previa presentazione al pertinente comitato di comitatologia secondo quanto disposto all’articolo 8, in combinato disposto con l’articolo 5 del regolamento (UE) n. 182/2011. In tali casi, al massimo quattordici giorni dopo la sua adozione, la Commissione sottoporrà l’atto di esecuzione al comitato competente al fine di ottenerne il parere, tenendo conto delle informazioni di cui alla sezione 3. Nel caso in cui il comitato presenti un parere negativo, la Commissione abrogherà immediatamente l’atto di esecuzione.
5. Condizioni generali
L’articolo 59, paragrafo 3, del regolamento (UE) 2017/745 prevede che la Commissione stabilisca le condizioni di una deroga a livello dell’Unione adottata mediante un atto di esecuzione. Nel definire tali condizioni, la Commissione baserà la propria decisione, in particolare sulle informazioni presentate conformemente alla sottosezione A della sezione 3. La Commissione può inoltre prendere in considerazione altre osservazioni presentate, ad esempio, dagli Stati membri nell’ambito del gruppo MDCG.
Le deroghe a livello dell’Unione possono stabilire condizioni più rigorose per l’immissione temporanea sul mercato di un dispositivo medico rispetto a quelle stabilite mediante le deroghe nazionali già in vigore per il dispositivo. Gli Stati membri dovrebbero invece poter introdurre, mediante misure nazionali, condizioni più rigorose di quelle previste dalle deroghe a livello dell’Unione. In tali casi dovrebbero prevalere le condizioni più rigorose.
Salvo diversa decisione, le deroghe a livello dell’Unione dovrebbero rimanere in vigore per un periodo non superiore a sei mesi. Eventuali modifiche sostanziali delle circostanze o delle informazioni di cui alla sezione 3 o di altre informazioni a disposizione della Commissione o degli Stati membri, in particolare attraverso la vigilanza del mercato, dovrebbero giustificare una nuova valutazione della deroga a livello dell’Unione e delle relative condizioni. In tali casi la Commissione può proporre di modificare o, se del caso, abrogare l’atto di esecuzione mediante il quale ha stabilito la deroga a livello dell’Unione. Tale procedura sarà oggetto di una consultazione degli Stati membri nell’ambito del gruppo MDCG.
Collegati:

ID 3545 | Rev. 3.0 del 12.04.2025 / Vademecum completo in allegato
Tutta la disciplina Tecnico/Normativa Direttiva TPED | ADR | UNI
I...
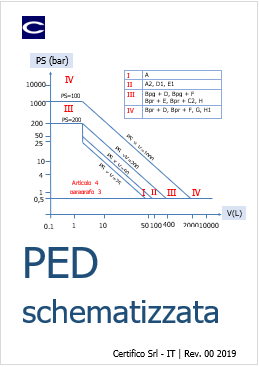
ID 7116 del 28.10.2018
Il Documento allegato illustra la Direttiva 2014/68/UE "PED", in particolare con l’aiuto di diagrammi e tabelle, si individuano le parti princ...
ID 18307 | 07.12.2022
Illegittima
La Circolare è illegittima per la parte in cui è interpretabile che la messa in servizio (denuncia/verifica) possa esser...
Testata editoriale iscritta al n. 22/2024 del registro periodici della cancelleria del Tribunale di Perugia in data 19.11.2024