RAPEX Report 16 del 21/04/2023 N. 32 A12/00840/23 Italia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 16 del 21/04/2023 N. 32 A12/00840/23 Italia
Approfondimento tecnico: Cementite
Il prodotto, di marca Tassani, mod. 5000998 X209C, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una concentrazione eccessiva di butanonossima, che è tossica e può provocare il cancro.
Regolamento (CE) n.1907/2006 REACH
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
[…] 28. Sostanze classificate come cancerogene di categoria 1 A o 1B nella parte 3 dell'allegato VI del regolamento (CE) n. 1272/2008 ed elencate rispettivamente nell'appendice 1 o nell'appendice 2.
Fatte salve le disposizioni di cui alle altre parti del presente allegato, alle voci da 28 a 30 si applicano le norme seguenti.
1. Non sono ammessi l’immissione sul mercato o l’uso:
- come sostanze,
- come componenti di altre sostanze, o
- nelle miscele,
per la vendita al pubblico quando la concentrazione singola nella sostanza o nella miscela è pari o superiore:
- al pertinente limite di concentrazione specifico indicato nell’allegato VI, parte 3, del regolamento (CE) n. 1272/2008, o
- al limite di concentrazione generico pertinente indicato nell'allegato I, parte 3, del regolamento (CE) n. 1272/2008.
Fatta salva l’applicazione di altre disposizioni comunitarie relative alla classificazione, all’imballaggio e all’etichettatura di sostanze e miscele, i fornitori devono garantire prima dell’immissione sul mercato che l’imballaggio di tali sostanze e miscele rechi in maniera visibile, leggibile ed indelebile la seguente dicitura:
«Uso ristretto agli utilizzatori professionali».
2. A titolo di deroga, il paragrafo 1 non si applica:
a) ai medicinali per uso umano o veterinario quali definiti nella direttiva 2001/82/CE e nella direttiva 2001/83/CE;
b) ai prodotti cosmetici quali definiti nella direttiva 76/768/CEE;
c) ai seguenti combustibili e prodotti derivati da olii minerali:
- ai combustibili per motori che sono soggetti alla direttiva 98/70/CE,
- agli articoli derivati dagli olii minerali, impiegati come combustibili o carburanti negli impianti di combustione mobili o fissi,
- ai combustibili venduti in sistemi chiusi (ad esempio: bombole di gas liquido);
d) ai colori per artisti di cui al regolamento (CE) n. 1272/2008;
e) alle sostanze elencate nell'appendice 11, colonna 1, per le applicazioni o gli usi elencati nell'appendice 11, colonna 2. Qualora nella colonna 2 dell'appendice 11 è specificata una data, la deroga si applica fino a tale data;
f) ai dispositivi di cui al regolamento (UE) 2017/745. […]
Regolamento (CE) n.1907/2006 REACH
Appendice 2
Voce 28 – Sostanze cancerogene: categoria 1B
Butanonossima; etilmetilchetossima; etilmetilchetone ossima
Numero indice 616-014-00-0
Numero CE 202-496-6
Numero CAS 96-29-7
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 16 del 21_04_2023 N. 32 A12_00840_23 Italia.pdf Cementite |
141 kB | 1 |
Notifica degli Stati membri sanzioni art. 41 Regolamento (UE) 2019/1020
Notifica degli Stati membri sanzioni art. 41 Regolamento (UE) 2019/1020 / Status al 31.08.2023
ID 19532 | 04.09.2023 / Status al 31.08.2023
Notifica degli Stati membri disposizioni sanzionatorie ex art Articolo 41 del regolamento (UE) 2019/1020
Regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio, del 20 giugno 2019, sulla vigilanza del mercato e sulla conformità dei prodotti e che modifica la direttiva 2004/42/CE e i regolamenti (CE) n. 765/2008 e (UE) n. 305/2011. (GU L 169/1 del 25.6.2019)
Status: 31.08.2023
_________
Articolo 41 Sanzioni
1. Gli Stati membri stabiliscono le norme relative alle sanzioni applicabili in caso di violazione del presente regolamento e della normativa di armonizzazione dell'Unione elencata nell'allegato II che impongono obblighi agli operatori economici e adottano tutte le misure necessarie per assicurare l'applicazione delle sanzioni conformemente al diritto nazionale.
2. Le sanzioni previste devono essere effettive, proporzionate e dissuasive.
3. Qualora non siano state notificate in precedenza, gli Stati membri notificano tali disposizioni alla Commissione, entro il 16 ottobre 2021 e provvedono a dare immediata notifica delle eventuali modifiche successive.
ALLEGATO II Elenco della normativa di armonizzazione dell'Unione senza disposizioni sulle sanzioni
1. Direttiva 69/493/CEE del Consiglio, del 15 dicembre 1969, sul ravvicinamento delle legislazioni degli Stati membri relative al vetro cristallo (GU L 326 del 29.12.1969, pag. 36);
2. direttiva 70/157/CEE del Consiglio, del 6 febbraio 1970, concernente il ravvicinamento delle legislazioni degli Stati membri relative al livello sonoro ammissibile e al dispositivo di scappamento dei veicoli a motore (GU L 42 del 23.2.1970, pag. 16);
3. direttiva 75/107/CEE del Consiglio, del 19 dicembre 1974, per il ravvicinamento delle legislazioni degli Stati Membri relative alle bottiglie impiegate come recipienti-misura (GU L 42 del 15.2.1975, pag. 14);
4. direttiva 75/324/CEE del Consiglio, del 20 maggio 1975, per il ravvicinamento delle legislazioni degli Stati membri relative agli aerosol (GU L 147 del 9.6.1975, pag. 40);
5. direttiva 76/211/CEE del Consiglio, del 20 gennaio 1976, per il ravvicinamento delle legislazioni degli Stati Membri relative al precondizionamento in massa o in volume di alcuni prodotti in imballaggi preconfezionati (GU L 46 del 21.2.1976, pag. 1);
6. direttiva 92/42/CEE del Consiglio, del 21 maggio 1992, concernente i requisiti di rendimento per le nuove caldaie ad acqua calda alimentate con combustibili liquidi o gassosi (GU L 167 del 22.6.1992, pag. 17);
7. direttiva 94/11/CE del Parlamento europeo e del Consiglio, del 23 marzo 1994, sul ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri concernenti l'etichettatura dei materiali usati nelle principali componenti delle calzature destinate alla vendita al consumatore (GU L 100 del 19.4.1994, pag. 37);
8. direttiva 94/62/CE del Parlamento europeo e del Consiglio, del 20 dicembre 1994, sugli imballaggi e i rifiuti di imballaggio (GU L 365 del 31.12.1994, pag. 10);
9. direttiva 2000/14/CE del Parlamento europeo e del Consiglio, dell'8 maggio 2000, sul ravvicinamento delle legislazioni degli Stati membri concernenti l'emissione acustica ambientale delle macchine e attrezzature destinate a funzionare all'aperto (GU L 162 del 3.7.2000, pag. 1);
10. direttiva 2000/53/CE del Parlamento europeo e del Consiglio, del 18 settembre 2000, relativa ai veicoli fuori uso (GU L 269 del 21.10.2000, pag. 34);
11. direttiva 2005/64/CE del Parlamento europeo e del Consiglio, del 26 ottobre 2005, sull'omologazione dei veicoli a motore per quanto riguarda la loro riutilizzabilità, riciclabilità e recuperabilità e che modifica la direttiva 70/156/CEE del Consiglio (GU L 310 del 25.11.2005, pag. 10);
12. direttiva 2006/40/CE del Parlamento europeo e del Consiglio, del 17 maggio 2006, relativa alle emissioni degli impianti di condizionamento d'aria dei veicoli a motore, che modifica la direttiva 70/156/CEE del Consiglio (GU L 161 del 14.6.2006, pag. 12);
13. direttiva 2007/45/CE del Parlamento europeo e del Consiglio, del 5 settembre 2007, che reca disposizioni sulle quantità nominali dei prodotti preconfezionati, abroga le direttive del Consiglio 75/106/CEE e 80/232/CEE e modifica la direttiva 76/211/CEE del Consiglio (GU L 247 del 21.9.2007, pag. 17);
14. regolamento (CE) n. 1222/2009 del Parlamento europeo e del Consiglio, del 25 novembre 2009, sull'etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri fondamentali (GU L 342 del 22.12.2009, pag. 46);
15. direttiva 2010/35/UE del Parlamento europeo e del Consiglio, del 16 giugno 2010, in materia di attrezzature a pressione trasportabili e che abroga le direttive del Consiglio 76/767/CEE, 84/525/CEE, 84/526/CEE, 84/527/CEE e 1999/36/CE (GU L 165 del 30.6.2010, pag. 1);
16. regolamento (UE) n. 305/2011 del Parlamento europeo e del Consiglio, del 9 marzo 2011, che fissa condizioni armonizzate per la commercializzazione dei prodotti da costruzione e che abroga la direttiva 89/106/CEE del Consiglio (GU L 88 del 4.4.2011, pag. 5);
17. regolamento (UE) n. 1007/2011 del Parlamento europeo e del Consiglio, del 27 settembre 2011, relativo alle denominazioni delle fibre tessili e all'etichettatura e al contrassegno della composizione fibrosa dei prodotti tessili e che abroga la direttiva 73/44/CEE del Consiglio e le direttive del Parlamento europeo e del Consiglio 96/73/CE e 2008/121/CE (GU L 272 del 18.10.2011, pag. 1);
18. direttiva 2014/90/UE del Parlamento europeo e del Consiglio, del 23 luglio 2014, sull'equipaggiamento marittimo e che abroga la direttiva 96/98/CE del Consiglio (GU L 257 del 28.8.2014, pag. 146);
19. regolamento (UE) n. 540/2014 del Parlamento europeo e del Consiglio, del 16 aprile 2014, relativo al livello sonoro dei veicoli a motore e i dispositivi silenziatori di sostituzione, che modifica la direttiva 2007/46/CE e abroga la direttiva 70/157/CEE (GU L 158 del 27.5.2014, pag. 131).
...
Fonte: CE
Collegati
[box-note]Regolamento (UE) 2019/1020[/box-note]
RAPEX Report 14 del 07/04/2023 N. 22 A12/00674/23 Slovenia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 14 del 07/04/2023 N. 22 A12/00674/23 Slovenia
Approfondimento tecnico: Piccola motosega a batteria
Il prodotto, di marca sconosciuta, barcode 23SI00603640042561, è stato respinto durante l’importazione perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE ed alle seguenti norme tecniche:
- EN 62841-1:2015 Sicurezza degli utensili e apparecchi per giardinaggio elettrici a motore portatili e trasportabili - Parte 1: Prescrizioni generali;
- EN 62841-4-1:2020 Utensili elettrici a motore portatili, utensili elettrici a motore trasportabili ed apparecchi elettrici per il giardinaggio - Sicurezza - Parte 4-1: Prescrizioni particolari per seghe a catena (IEC 62841-4-1:2017, modificata).
La motosega non ha un sistema protezione da contraccolpo, non ha nessun freno, non ha nessuna protezione della catena ed è priva di avvertenze per la sicurezza.
Direttiva 2006/42/CE
Allegato I
Requisiti essenziali di sicurezza e di tutela della salute relativi alla progettazione e alla costruzione delle macchine
Principi generali
1. Il fabbricante di una macchina, o il suo mandatario, deve garantire che sia effettuata una valutazione dei rischi per stabilire i requisiti di sicurezza e di tutela della salute che concernono la macchina. La macchina deve inoltre essere progettata e costruita tenendo conto dei risultati della valutazione dei rischi.
Con il processo iterativo della valutazione dei rischi e della riduzione dei rischi di cui sopra, il fabbricante o il suo mandatario:
- stabilisce i limiti della macchina, il che comprende l'uso previsto e l'uso scorretto ragionevolmente prevedibile,
- individua i pericoli cui può dare origine la macchina e le situazioni pericolose che ne derivano,
- stima i rischi, tenendo conto della gravità dell'eventuale lesione o danno alla salute e della probabilità che si verifichi,
- valuta i rischi al fine di stabilire se sia richiesta una riduzione del rischio conformemente all'obiettivo della presente direttiva,
- elimina i pericoli o riduce i rischi che ne derivano, applicando le misure di protezione nell'ordine indicato nel punto 1.1.2, lettera b).
2. Gli obblighi previsti dai requisiti essenziali di sicurezza e di tutela della salute si applicano soltanto se esiste il pericolo corrispondente per la macchina in questione, allorché viene utilizzata nelle condizioni previste dal fabbricante, o dal suo mandatario, o nelle condizioni anormali prevedibili. Il principio di integrazione della sicurezza di cui al punto 1.1.2 e gli obblighi relativi alla marcatura e alle istruzioni di cui ai punti 1.7.3 e 1.7.4 si applicano comunque.
3. I requisiti essenziali di sicurezza e di tutela della salute elencati nel presente allegato sono inderogabili. Tuttavia, tenuto conto dello stato della tecnica, gli obiettivi da essi prefissi possono non essere raggiunti. In tal caso la macchina deve, per quanto possibile, essere progettata e costruita per tendere verso questi obiettivi.
4. Il presente allegato si articola in varie parti. La prima ha una portata generale ed è applicabile a tutti i tipi di macchine. Le altre parti si riferiscono a taluni tipi di pericoli più specifici. Tuttavia è indispensabile esaminare il presente allegato in tutte le sue parti, al fine di essere certi di soddisfare tutti i requisiti essenziali pertinenti. Nel progettare la macchina, conformemente al punto 1 dei presenti principi generali, si tiene conto dei requisiti esposti nella parte generale e di quelli elencati in una o più delle altre parti in funzione dei risultati della valutazione dei rischi.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 14 del 07_04_2023 N. 22 A12_00674_23 Slovenia.pdf Piccola motosega a batteria |
113 kB | 0 |
Tabella A.6 assegnazione SIL / PL CEI EN IEC 62061 (2005-2022)
Tabella A.6 assegnazione SIL / PL CEI EN IEC 62061 (2005-2022)
ID 19472 | 23.04.2023 / Documento di approfondimento in allegato
Confronto tra la matrice di assegnazione SIL / PL della norma CEI EN IEC 62061:2022 e la matrice per l’assegnazione del SIL della CEI EN IEC 62061:2005.
Una delle più importanti novità introdotte dalla nuova norma CEI EN IEC 62061:2022 rispetto l’edizione precedente riguarda la sua applicazione anche ai sistemi pneumatici o idraulici oltre che a quelli elettrici.
La CEI EN IEC 62061:2022 tratta il grado di affidabilità richiesto per un sistema di controllo rilevante per la sicurezza: in questo caso, la stima si basa su un metodo ibrido, una combinazione tra una matrice e un approccio quantitativo.
Il metodo ibrido descritto nell’Allegato A della CEI EN IEC 62061:2022 è equivalente al metodo ibrido descritto al cap. 6.5 della ISO/TR 14121-2.
La matrice della tabella A.6 della CEI EN IEC 62061:2022 indica anche come determinare il PLr e ne illustra la relazione con il SIL necessario.
[panel]EN IEC 62061:2021 “Safety of machinery - Functional safety of safety-related control systems”
Data di pubblicazione: 2021-03
Recepita in Italia con la CEI EN IEC 62061:2022 “Sicurezza del macchinario - Sicurezza funzionale dei sistemi di comando e controllo relativi alla sicurezza”.
Data di pubblicazione IT: 2022-01
Con la Decisione di esecuzione (UE) 2022/621 la norma EN IEC 62061:2021- Sicurezza del macchinario - Sicurezza funzionale dei sistemi di comando e controllo relativi alla sicurezza IEC 62061:2021 è entrata in regime di armonizzazione per la Direttiva 2006/42/CE Macchine.
Con Decisione di esecuzione (UE) 2022/621 la norma EN 62061:2005 è ritirata dall’11.10.2023.
La Norma prescrive requisiti e fornisce raccomandazioni per la progettazione, l'integrazione e la convalida dei sistemi di controllo relativi alla sicurezza (SCS) per le macchine. È applicabile ai sistemi di controllo utilizzati, singolarmente o in combinazione, per svolgere funzioni di sicurezza su macchine non trasportabili manualmente durante il lavoro, compreso un gruppo di macchine che lavorano insieme in modo coordinato. La presente è una Norma specifica per il settore dei macchinari nell'ambito della serie di Norme CEI EN 61508 (tutte le parti). La progettazione di sottosistemi elettronici programmabili complessi o elementi di sottosistemi non rientra nell'ambito di questa Norma Questa Norma specifica i requisiti generali per la progettazione e la verifica di un sistema di controllo relativo alla sicurezza destinato ad essere utilizzato in modalità a domanda alta/continua La presente Norma affronta esclusivamente i requisiti di sicurezza funzionale volti a ridurre il rischio di situazioni pericolose e si applica ai rischi derivanti direttamente dai pericoli della macchina stessa o da un gruppo di macchine che lavorano insieme in modo coordinato.
La norma sostituisce completamente la Norma CEI EN 62061:2005-09, che rimane applicabile fino al 26-04-2024.[/panel]
________
[...] segue in allegato
Certifico Srl - IT | Rev. 0.0 2023
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 0.0 | 23.04.2023 | --- | Certifico Srl |
Collegati
[box-note]EN ISO 12100 e ISO/TR 14121-2: Esempio Valutazione del rischio
ISO TR 14121-2: Metodi per l'analisi del rischio
ISO/TR 14121-2 Risk assessment Hybrid Tool - File CEM
Stima del Rischio ISO/TR 14121-2 p. 6.3 Metodo grafico - Esempio e scheda
PL ok: Esempi di calcolo del Performance Level (PL) EN ISO 13849-1
CEI EN IEC 62061:2022
Direttiva macchine 2006/42/CE
ebook Guida Tecnica Direttiva macchine Ed. 6.0 2020
ebook Direttiva macchine e Norme Tecniche Armonizzate[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Tabella A.6 assegnazione SIL PL CEI EN IEC 62061 (2005-2022) Rev. 0.0 2023.pdf Certifico Srl - Rev. 0.0 2023 |
187 kB | 198 |
Il Parlamento Europeo adotta il Regolamento Macchine
Il Parlamento Europeo adotta il Regolamento Macchine
ID 19462 | 21.04.2023 / In allegato Testo approvato EN/IT
Il Parlamento Europeo, con 595 voti a favore, 7 contrari e 30 astenuti, ha adottato, nella seduta del 18 aprile 2023, il nuovo Regolamento Macchine.
Il nuovo Regolamento Macchine dovrebbe essere pubblicato sulla Gazzetta Ufficiale dell’Unione Europea nella prima parte del prossimo mese di luglio: entrata in vigore, quindi, 20 giorni dopo la pubblicazione.
Il nuovo Regolamento Macchine, poi, diverrà applicabile 42 mesi dopo l’entrata in vigore.
...
In allegato: Testo approvato - Macchine - P9_TA(2023)0097 - Risoluzione legislativa del Parlamento europeo del 18 aprile 2023 sulla proposta di regolamento del Parlamento europeo e del Consiglio sui prodotti macchina
______
Fonte: Parlamento Europeo
Collegati
[box-note]Manuale Istruzioni Direttiva/Regolamento macchine 2023: Tavola raffronto
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Proposal for a Regulation on machinery products
Proposta regolamento macchine - Lettera al presidente Commissione IMCO 25.01.2023
Status fasi Regolamento macchine
Report CE Regulation on Machinery Products - 18.11.2021
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| P9_TA_2023_0097 - Approvato PE 18.04.2023 - IT.pdf |
594 kB | 162 | ||
| P9_TA_2023_0097 - Approvato PE 18.04.2023 - EN.pdf |
570 kB | 18 |
Regolamento Macchine 2023 / Documenti elaborati
Regolamento Macchine 2023 / Documenti elaborati - Status 13.05.2025
ID 19432 | 13.05.2025 / Download scheda allegata
Documenti elaborati sul Regolamento macchine 2023, Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027.
I Documenti presentano contenuti sostanzialmente definitivi e possono essere utili per un breve screening sulle novità del Regolamento rispetto alla Direttiva macchine 2006/42/CE.
Regolamento Macchine | Obblighi operatori economici
ID 20008
Il presente documento analizza, con il supporto di schemi, gli obblighi degli operatori economici ovvero gli obblighi propri delle figure del fabbricante, del mandatario, dell'importatore e del distributore, come individuate dal nuovo Regolamento macchine, Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato nella GU n. 163 del 29 giugno 2023 ed in vigore dal 19 luglio 2023.
Modello di Dichiarazione di Conformità (UE) Regolamento macchine - Modello .doc / Modello .pdf CEM4
ID 19771
In allegato Modello di Dichiarazione di Conformità (UE) di macchine e prodotti correlati in accordo con il Regolamento (UE) 2023/1230 "macchine 2023".
- in formato .doc Rev. 1.0
- in formato .pdf template CEM4 Rev. 3.0
Modello di Dichiarazione di Incorporazione (UE) | .doc / .pdf CEM4
ID 19793
In allegato Modello di Dichiarazione di Incorporazione (UE) di quasi-macchine in accordo con il Regolamento (UE) 2023/1230 "macchine 2023".
- modello .doc Certifico Rev. 1.0
- modello .pdf template CEM4 Rev. 2.0
Tavola di concordanza estesa Direttiva/Regolamento Macchine 2023
ID 13382 / Rev. 5.0 2025
La tavola mette a confronto e raccorda l’articolato e gli allegati della Direttiva 2006/42/CE (IT) con i novelli propri del Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine/ IT
ID 13531
La tavola mette a confronto e raccorda i RESS (Requisiti essenziali di sicurezza e di tutela della salute) di cui all’Allegato I della Direttiva 2006/42/CE con i novelli propri di cui all’Allegato III del del Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
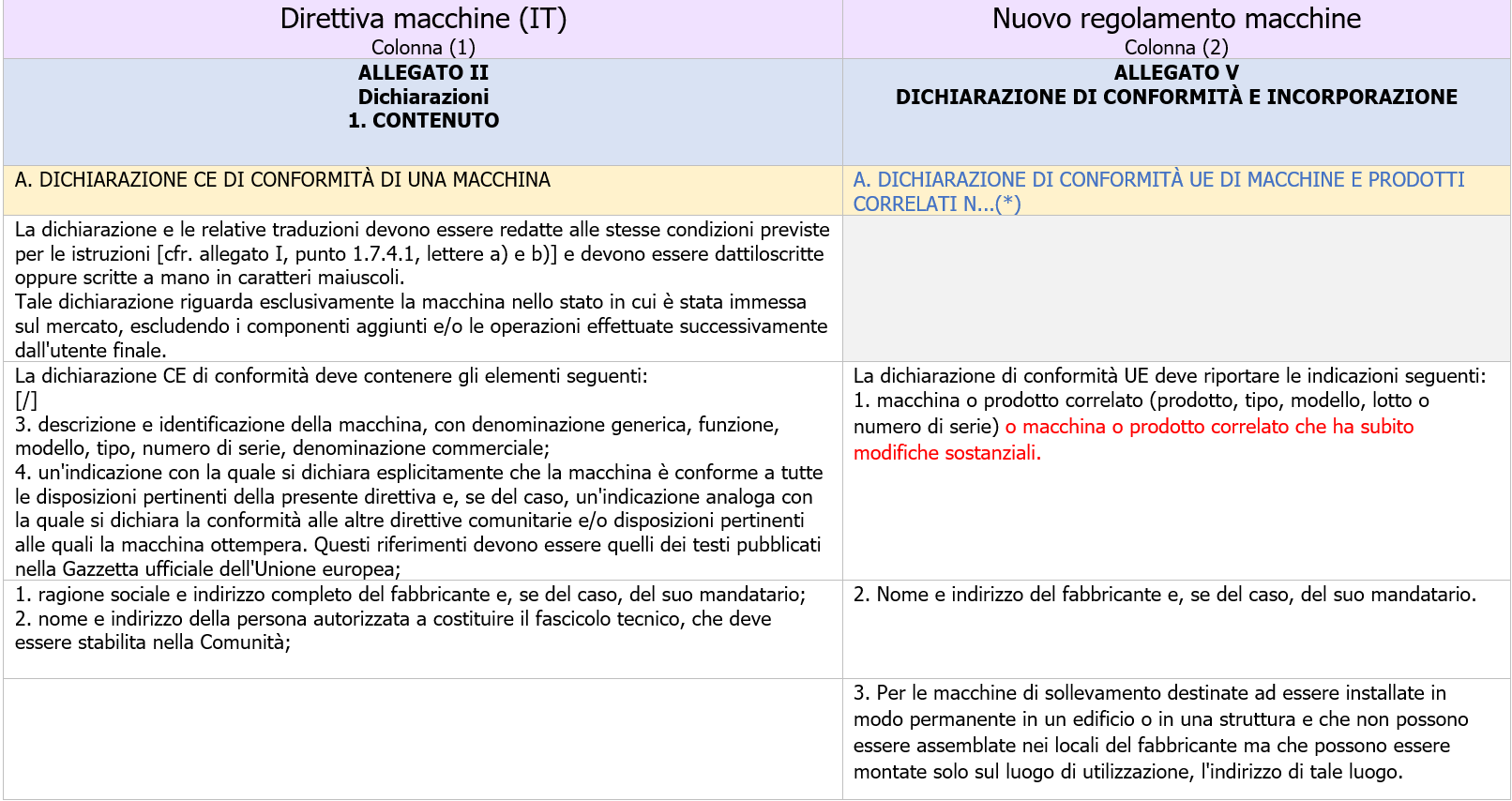
Dichiarazione di conformità UE di macchine e prodotti correlati
ID 19423
ANNEX V EU DECLARATION OF CONFORMITY AND INCORPORATION
Manuale Istruzioni Uso Direttiva macchine 2006/Regolamento macchine 2023: Tavola raffronto
ID 19419
ANNEX III ESSENTIAL HEALTH AND SAFETY REQUIREMENTS RELATING TO THE DESIGN AND CONSTRUCTION OF MACHINERY OR RELATED PRODUCTS (p. 1.7.4)
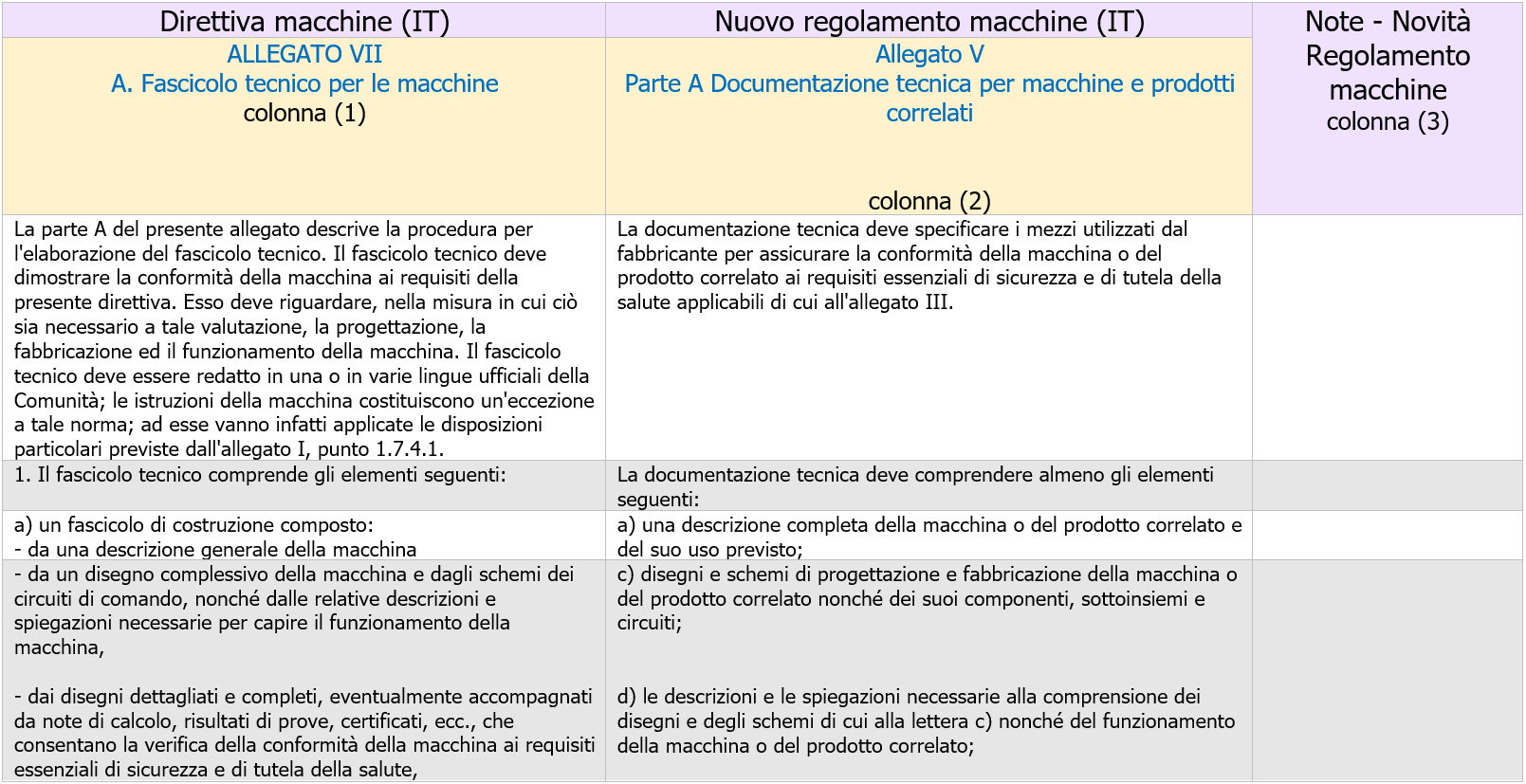
Fascicolo Tecnico Direttiva macchine 2006 / Regolamento macchine 2023: Tavola raffronto
ID 19416
ANNEX IV A. TECHNICAL DOCUMENTATION
Procedure di Valutazione della Conformità Regolamento macchine 2023
ID 19785
Il documento illustra le novelle disposizioni in merito alle procedure di valutazione della conformità contenute nel Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
Status fasi Regolamento macchine
ID 15553
Documento relativo alle fasi di sviluppo del Regolamento macchine dal 2021 al 2023
...
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 6.0 | 13.05.2025 | Tavola di concordanza estesa Direttiva/Regolamento Macchine 2023 | Certifico Srl |
| 5.0 | 19.07.2023 | Obblighi operatori economici Modello Dichiarazione di Conformità (UE) EN Modello Dichiarazione di Incorporazione (UE) EN |
Certifico Srl |
| 4.0 | 13.07.2023 | Modello Dichiarazione di Conformità (UE) Modello Dichiarazione di Incorporazione (UE) |
Certifico Srl |
| 3.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 - 04.07.2023 | Certifico Srl |
| 2.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 1.0 | 23.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 0.0 | 17.04.2023 | --- | Certifico Srl |
Collegati
[box-note]Regolamento Macchine | Obblighi operatori economici
Modello di Dichiarazione di Incorporazione (UE) Regolamento macchine
Dichiarazione di conformità UE macchine e prodotti correlati / Regolamento macchine 2023
Manuale Istruzioni Direttiva/Regolamento macchine 2023: Tavola raffronto
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Accordo provvisorio negoziati interistituzionali nuovo regolamento macchine 07.02.2023
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine
Status fasi Regolamento macchine[/box-note]
Manuale Istruzioni Direttiva/Regolamento macchine 2023: Tavola raffronto
Manuale Istruzioni per l'Uso Direttiva macchine 2006 /Regolamento macchine 2023: Tavola raffronto / Rev. 3.0 2023
ID 19419 | Rev. 3.0 del 04.07.2023 / Documento completo in allegato
La tavola di seguito proposta mette a confronto gli elementi che deve contenere il Manuale di Istruzioni per l'uso come previsto dal punto 1.7.4 dell'Allegato I (*) dei Requisiti Essenziali di Salute e Sicurezza della Direttiva 2006/42/CE (IT) colonna (1), con i novelli elementi che deve contenere il Manuale di Istruzioni per l'uso come previsto dal punto 1.7.4 dell'Allegato III dei Requisiti Essenziali di Salute e Sicurezza di cui al Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, in colonna (2). Inoltre, vengono inseriti nella colonna (3), note relative alle novità dispositive proprie del Regolamento macchine.
Inoltre sono presi in considerazione i contenuti Istruzioni per macchine specifiche RESS p. 2, 3, 4, 5, 6:
2. Requisiti essenziali supplementari di sicurezza e di tutela della salute per talune categorie di macchine e di prodotti correlati
2.1. Macchine e prodotti correlati alimentari e macchine e prodotti correlati per prodotti cosmetici o farmaceutici
2.2. Macchine o prodotti correlati portatili tenuti o condotti a mano
2.4. Macchine o prodotti correlati per l'applicazione di prodotti fitosanitari
3. Requisiti essenziali supplementari di sicurezza e di tutela della salute per ovviare ai rischi dovuti alla mobilità delle macchine o dei prodotti correlati
4. Requisiti essenziali supplementari di sicurezza e di tutela della salute per prevenire i rischi dovuti ad operazioni di sollevamento
5. Requisiti essenziali supplementari di sicurezza e di tutela della salute per le macchine o i prodotti correlati destinati ad essere utilizzati nei lavori sotterranei
6. Requisiti essenziali supplementari di sicurezza e di tutela della salute per le macchine o i prodotti correlati che presentano rischi particolari dovuti al sollevamento di persone
[box-note]Rev. 4.0 del 04 Luglio 2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-note]
[box-note]Rev. 3.0 del 03 Luglio 2023
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU n. 165/1 del 29.06.2023). Entrata in vigore: 19.07.2023
- Inseriti nella Tabella di raffronto anche i:
-- punti 2.1.2, 2.2.1.1., 2.2.2.2., 2.4.10., 3.6.3., 4.4., 5. e 6. dell'Allegato I Parte A della Direttiva 2006/42/CE, e i
-- punti 2.1.2, 2.2.1.1., 2.2.2.2., 2.4.10., 3.6.3., 4.4., 5. e 6. dell'Allegato III del Regolamento (UE) 2023/1230[/box-note]
[panel]Regolamento (UE) 2023/1230
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 19 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 53 Valutazione e riesame
1. Entro il 20 luglio 2028 e, successivamente, ogni quattro anni, la Commissione presenta una relazione sulla valutazione e sul riesame del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
2. Tenendo conto del progresso tecnico e dell'esperienza pratica acquisita negli Stati membri come specificato all'articolo 6, la Commissione include nella relazione una valutazione dei aspetti seguenti del presente regolamento:
a) i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) la procedura di valutazione della conformità applicabile alle macchine o ai prodotti correlati elencati nell’allegato I.
Se del caso, la relazione è corredata di una proposta legislativa di modifica delle pertinenti disposizioni del presente regolamento.
3. Entro il 20 luglio 2026 e, successivamente, ogni cinque anni, la Commissione presenta una relazione specifica sulla valutazione dell'articolo 6, paragrafi 4 e 5, del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
La Commissione include nelle sue relazioni gli elementi seguenti:
a) una sintesi dei dati e delle informazioni forniti dagli Stati membri a norma dell'articolo 6, paragrafo 5, durante il periodo di riferimento;
b) una valutazione dell'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I alla luce dei criteri di cui all'articolo 6, paragrafo 4.
Nelle relazioni la Commissione valuta l'adeguatezza e la disponibilità dei dati e delle informazioni forniti dagli Stati membri, comprese la loro adeguatezza e idoneità al fine di effettuare confronti, individuando eventuali carenze onde garantire il funzionamento efficace e l'applicazione dell'articolo 6.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 204 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2026;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.[/panel]
Tavola raffronto: Manuale di istruzioni Direttiva macchine 2006 / Regolamento macchine 2023
- colonna (1) p. 1.7.4, 1.7.4.1, 1.7.4.2, 1.7.4.3, 2.1.2, 2.2.1.1., 2.2.2.2., 2.4.10., 3.6.3., 4.4., 5. e 6. dell'Allegato I Parte A della Direttiva 2006/42/CE (IT)
- colonna (2) p. 1.7.4, 1.7.4.1, 1.7.4.2, 1.7.5, 2.1.2, 2.2.1.1., 2.2.2.2., 2.4.10., 3.6.3., 4.4., 5. e 6. dell'Allegato III del Regolamento (UE) 2023/1230
- colonna (3) Note di commento novità Regolamento (UE) 2023/1230
...Segue in allegato
Vedi Documento
Certifico Srl - IT | Rev. 3.0 2023
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 3.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 | Certifico Srl |
| 2.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 1.0 | 23.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 0.0 | 15.04.2023 | --- | Certifico Srl |
Collegati
[box-note]Regolamento (UE) 2023/1230
Regolamento macchine | Regolamento (UE) 2023/1230
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Dichiarazione di conformità UE macchine e prodotti correlati / Nuovo Regolamento macchine
Proposal for a Regulation on machinery products
Proposta regolamento macchine - Lettera al presidente Commissione IMCO 25.01.2023
Status fasi Regolamento macchine
Report CE Regulation on Machinery Products - 18.11.2021
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Manuale_Istruzioni Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto - Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
333 kB | 270 | ||
| Manuale_Istruzioni Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto - Rev. 2.0 2023.pdf Certifico Srl - Rev. 2.0 2023 |
330 kB | 56 | ||
| Manuale_Istruzioni Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
275 kB | 140 | ||
| Manuale_Istruzioni Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 0.0 2023.pdf Certifico Srl - Rev. 0.0 2023 |
278 kB | 108 |
RAPEX Report 12 del 24/03/2023 N. 04 A12/00608/23 Belgio

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 12 del 24/03/2023 N. 04 A12/00608/23 Belgio
Approfondimento tecnico: Pantaloncini per bambini
Il prodotto, di marca Petrol, mod. B-2020-SWSW953, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 14682:2014 - Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini – Specifiche.
I pantaloncini hanno lunghi cordoncini con estremità libere nella zona della vita e questo potrebbe portare ad un impigliamento durante le varie attività dei bambini.
Al capitolo 3.4, la norma EN 14682:2014, prevede quanto segue:
[…] i capi di abbigliamento indossati dal girovita in giù privi di spalline, bretelle, o maniche, come pantaloni, pantaloncini, gonne, mutande, parti inferiori di bikini, non devono avere:
a) estremità libere dei lacci passanti di lunghezza maggiore di 20 cm a ciascuna estremità quando il capo è in uno stato naturale allentato;
b) passanti sporgenti sui lacci passanti privi di estremità libere, quando il capo è steso in piano alla massima estensione. Quando sono utilizzati fermacorda per la regolazione dei lacci passanti privi di estremità libere, il fermacorda deve essere fissato al capo di abbigliamento;
c) cordoncini funzionali di lunghezza maggiore di 20 cm;
d) cordoncini decorativi di lunghezza maggiore di 14 cm comprese tutte le guarnizioni. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 12 del 24_03_2023 N. 04 A12_00608_23 Belgio.pdf Pantaloncini per bambini |
117 kB | 0 |
Decreto 26 gennaio 2023 / Segnalazione reclami dispositivi medici
Decreto 26 gennaio 2023 / Segnalazione reclami dispositivi medici - Termini e modalità
ID 19360 | 03.04.2023
Decreto 26 gennaio 2023 Termini e modalità di segnalazione dei reclami che coinvolgono dispositivi medici da parte degli operatori sanitari, degli utilizzatori profani e dei pazienti.
(GU n.77 del 31.03.2023)
Entrata in vigore: 15.04.2023
....
Art. 1. Oggetto
1. Il presente decreto definisce i termini e le modalità di segnalazione dei reclami, come definiti dall’art. 2, comma 2, lettera a), del decreto legislativo 5 agosto 2022, n. 137, da parte degli operatori sanitari pubblici o privati, degli utilizzatori profani e dei pazienti.
2. Ai fini del presente decreto:
a) per «dispositivi» si intendono i dispositivi medici e i dispositivi ricompresi nell’Allegato XVI del regolamento (UE) 2017/745;
b) per «utilizzatore profano», si intende, ai sensi dell’art. 2, paragrafo 1, punto 38) del regolamento (UE) 2017/745, una persona che non possiede qualifiche formali in un ambito pertinente dell’assistenza sanitaria o in una disciplina medica.
Art. 2. Termini di segnalazione
1. Gli operatori sanitari pubblici o privati, nonché le strutture sanitarie, le farmacie, i medici di medicina generale o i pediatri di libera scelta che ricevono le segnalazioni del reclamo da parte degli utilizzatori profani e dei pazienti, trasmettono, entro trenta giorni, tali segnalazioni al Ministero della salute.
Art. 3. Modalità di segnalazione
1. Fermo restando che la segnalazione del reclamo deve essere inviata al fabbricante secondo le modalità indicate dallo stesso, gli operatori sanitari pubblici o privati, nel rispetto di eventuali disposizioni delle regioni e province autonome, direttamente o tramite la struttura sanitaria coinvolta, le farmacie, i medici di medicina generale o i pediatri di libera scelta segnalano il reclamo al Ministero della salute secondo le modalità pubblicate sul sito internet del medesimo, che possono essere aggiornate sulla base delle nuove evidenze tecniche.
2. Gli utilizzatori profani e i pazienti segnalano il reclamo per il tramite della struttura sanitaria competente, della farmacia, del medico di medicina generale o del pediatra di libera scelta.
Art. 4. Entrata in vigore
1. Il presente decreto entra in vigore quindici giorni dopo la pubblicazione nella Gazzetta Ufficiale della Repubblica italiana.
...
Collegati
[box-note]Decreto 26 gennaio 2023
Decreto Min. Salute 26 gennaio 2023
Decreto Min. Salute del 26 gennaio 2023
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
Sentenza Corte di Giustizia Europea n. 52 del 23 marzo 2023
Sentenza Corte di Giustizia Europea n. 52 del 23 marzo 2023 / No altri requisiti Marcatura CE PED per Prevenzione Incendi
ID 19328 | 28.03.2023 / Sentenza in allegato (testo provvisorio)
Sicurezza antincendio negli esercizi aperti al pubblico: gli Stati membri non possono imporre ulteriori requisiti alle attrezzature a pressione quali apparecchiature che utilizzano refrigeranti infiammabili, come frigoriferi, congelatori o condizionatori d'aria, recanti la marcatura CE ai fini della messa a disposizione di tale apparecchiatura sul mercato nazionale.
La Corte ritiene che gli Stati membri non possano, anche solo per l'uso di tali attrezzature in locali aperti al pubblico e tenuto conto dei rischi specifici per la sicurezza antincendio, imporre ulteriori requisiti previsti dalla direttiva 2014/68/UE (nel caso, che tali apparecchiature siano ermeticamente sigillate se contenenti gas infiammabili) per la messa a disposizione sul mercato nazionale di tale apparecchiatura:
tali requisiti nazionali equivarrebbero a privare le misure di armonizzazione stabilite dalla direttiva PED, del loro valore di efficacia.
________
L’articolo 3, paragrafo 2, in combinato disposto con l’articolo 2, punto 31, nonché con l’articolo 5, paragrafo 1, primo comma, della direttiva 2014/68/UE del Parlamento europeo e del Consiglio, del 15 maggio 2014, concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di attrezzature a pressione esso osta a una normativa nazionale che, al fine di proteggere la salute e la sicurezza delle persone nei confronti dei rischi di incendio nelle strutture aperte al pubblico, impone alle attrezzature a pressione e agli insiemi che utilizzano refrigeranti infiammabili requisiti che non figurano tra i requisiti essenziali di sicurezza previsti da tale direttiva, al fine della messa a disposizione sul mercato o della messa in servizio di tali attrezzature e insiemi, sebbene rechino la marcatura CE.
________
Con un'ordinanza adottata nel 2019, il ministro dell'Interno francese ha modificato un'ordinanza del 1980 sulla sicurezza contro i rischi di incendio negli esercizi aperti al pubblico, per consentire, nel rispetto di determinati requisiti di sicurezza, l'utilizzo, in questi esercizi, di apparecchiature che utilizzano refrigeranti infiammabili, come frigoriferi, congelatori o condizionatori d'aria.
L'ordinanza in questione subordina l'utilizzo di apparecchiature utilizzanti refrigeranti infiammabili, in tali esercizi, al rispetto di un certo numero di requisiti.
Prevede, tra l'altro, che le apparecchiature con la marcatura CE non siano soggette a tali requisiti, a condizione che, se contenenti gas infiammabili, siano ermeticamente sigillate.
Syndicat Uniclima (associazione rappresentativa delle industrie termica, aeraulica e del freddo, che, tra l'altro, assiste e rappresenta le imprese dinanzi alle autorità francesi, europee e internazionali in materia di regolamentazione e questioni normative) ha proposto ricorso dinanzi al Conseil d'État (Consiglio di Stato, Francia).
Essa sostiene che la condizione posta dall'ordinanza impugnata, che richiede che l'apparecchiatura sia ermeticamente sigillata, se contiene un gas infiammabile, costituisce un requisito aggiuntivo rispetto a quelli previsti da tre direttive (PED, BT, Macchine), se le apparecchiature con la marcatura CE sono conformi ai requisiti di tali direttive.
Essa sostiene che l'ordinanza impugnata crea distorsioni della concorrenza in quanto impone agli operatori economici di modificare i loro prodotti esclusivamente ai fini di rendendoli disponibili sul mercato francese.
Il Conseil d'État (Consiglio di Stato, Francia) ha adito la Corte di giustizia al riguardo.
Nella sua sentenza, la Corte risponde che il diritto dell'Unione osta ad una normativa nazionale che, al fine di tutelare il salute e sicurezza delle persone contro i rischi di incendio nei locali aperti al pubblico, impone alle attrezzature a pressione l'utilizzo di refrigeranti non infiammabili, requisito che non figura tra i requisiti essenziali di sicurezza previste dalle direttive in questione, ai fini della messa a disposizione sul mercato o della messa in servizio di tali apparecchiature, se tali apparecchiature recano la marcatura CE.
Rileva che la "marcatura CE" consente al fabbricante di indicare che l'attrezzatura a pressione o l'insieme in questione è conforme ai requisiti armonizzati a livello dell'UE.
Tale marcatura indica la conformità con tali requisiti ed è la conseguenza visibile di un intero processo che comprende la valutazione della conformità in senso lato.
Pertanto, la Corte ritiene che gli Stati membri non possano, anche solo per l'uso di tali apparecchiature in locali aperti al pubblico e tenuto conto dei rischi specifici per la sicurezza antincendio, imporre ulteriori requisiti previsti dalla direttiva 2014/68/UE per la messa a disposizione sul mercato nazionale di tali apparecchiature:
tali requisiti nazionali equivarrebbero a privare le misure di armonizzazione stabilite dalla direttiva PED, del loro valore di efficacia.
[box-note]Direttiva 2014/68/UE
Articolo 2 Definizioni
...
«marcatura CE» : una marcatura mediante la quale il fabbricante indica che l’attrezzatura a pressione o l’insieme è conforme ai requisiti applicabili stabiliti nella normativa di armonizzazione dell’Unione che ne prevede l’apposizione;
...
Articolo 3 Messa a disposizione sul mercato e messa in servizio
...
2. La presente direttiva non pregiudica la facoltà degli Stati membri di prescrivere i requisiti che essi ritengono necessari per garantire la protezione delle persone e in particolare dei lavoratori in occasione dell’uso delle attrezzature a pressione o degli insiemi in questione, sempre che ciò non implichi loro modifiche non contemplate dalla presente direttiva.
...
Articolo 5 Libera circolazione
1. Gli Stati membri non vietano, limitano od ostacolano, per rischi dovuti alla pressione, la messa a disposizione sul mercato o la messa in servizio, alle condizioni fissate dal fabbricante, di attrezzature a pressione o di insiemi conformi alle disposizioni della presente direttiva.
...[/box-note]
Fonte: CGUE / CURIA
Collegati
[box-note]Nuova Direttiva PED 2014/68/UE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Sentenza Corte di Giustizia Europea n. 52 del del 23 marzo 2023.pdf |
1376 kB | 110 |
RAPEX Report 10 del 10/03/2023 N. 35 A12/00466/23 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 10 del 10/03/2023 N. 35 A12/00466/23 Francia
Approfondimento tecnico: Pittura a dita
Il prodotto, di marca HEMA, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-7:2014+A3:2020 “Sicurezza dei giocattoli - Parte 7: Pitture a dito - Requisiti e metodi di prova”.
Il prodotto contiene formaldeide (valore misurato: fino a 7255 mg/kg). La formaldeide è un sensibilizzante della cute, può scatenare reazioni allergiche e provocare il cancro.
Direttiva 2009/48/CE
Appendice C
Valori limite specifici per i prodotti chimici utilizzati nei giocattoli destinati ai bambini di età inferiore a 36 mesi o in altri giocattoli destinati ad essere messi in bocca, adottati a norma dell'articolo 46, paragrafo 2
Formaldeide (numero CAS: 50-00-0)
Valori limite:
- 1,5 mg/l (limite di migrazione) nei materiali polimerici per giocattoli;
- 0,1 ml/m3 (limite di emissione) nel legno agglomerato con resine utilizzato nei giocattoli;
- 30 mg/kg (tenore limite) nei materiali tessili per giocattoli;
- 30 mg/kg (tenore limite) nei cuoi e nelle pelli per giocattoli;
- 30 mg/kg (tenore limite) nei materiali cartacei per giocattoli;
- 10 mg/kg (tenore limite) nei materiali a base acquosa per giocattoli.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 10 del 10_03_2023 N. 35 A12_00466_23 Francia.pdf Pittura a dita |
109 kB | 0 |
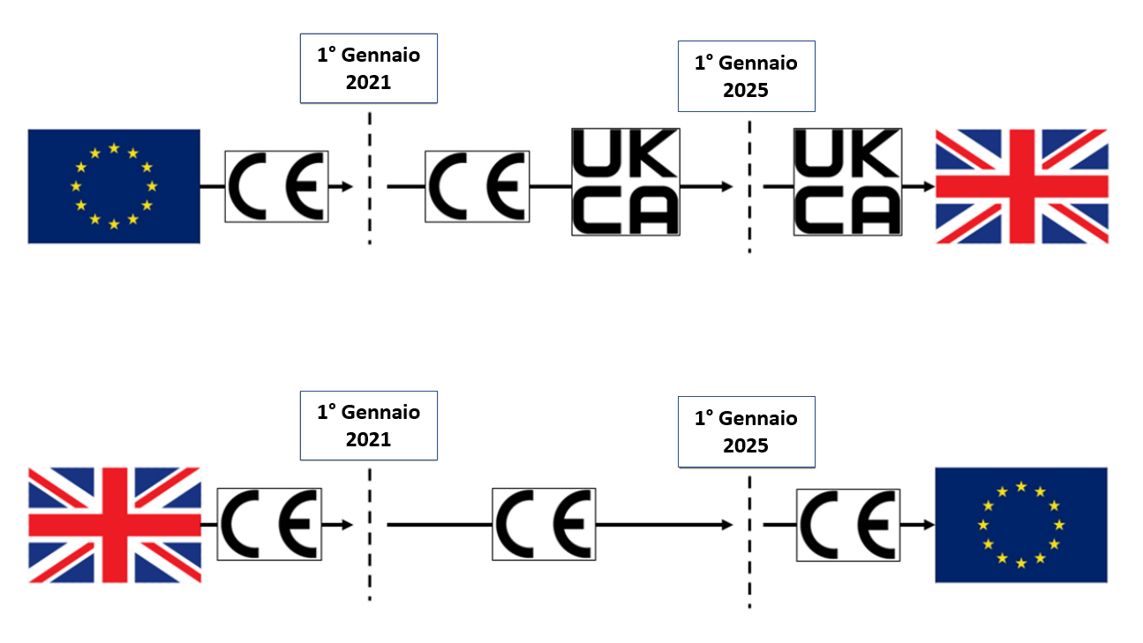
Regole per l'utilizzo del marchio (logo) UKCA
Regole per l'utilizzo (apposizione) del marchio (logo) UKCA
ID 19297 | 23.03.2023 / In allegato logo fonte GOV.UK
Regole per l'utilizzo ed aposizione del logo marchio UKCA (GB) per l'importazione di prodotti in GB(in coesistenza con la marcatura CE fino al 31.12.2024 per il mercato GB)
Download file logo:
- UKCA mark fill
- UKCA mark outline
Note
Il marchio UKCA può assumere diverse forme (ad esempio, il colore non deve essere uniforme), purché rimanga visibile, leggibile e mantenga le proporzioni richieste.
- riducendo o ingrandendo dimensione del marchio, le lettere che compongono il marchio UKCA devono essere proporzionate alla versione indicata di seguito
- la marcatura UKCA è alta almeno 5 mm a meno che non sia specificata una dimensione minima diversa nella legislazione pertinente
- il marchio UKCA deve essere facilmente visibile, leggibile e indelebile:
...
Collegati
[box-note]Marchio UKCA: estensione del periodo di transizione al 31.12.2024
Marchio UKCA: estensione del periodo di transizione al 31.12.2024
Guidance UKCA marking: conformity assessment and documentation
Il marchio UKCA - Vademecum Dicembre 2021
Marchio UKCA: Posticipata la data di entrata in vigore al 1° gennaio 2023
Guida marcatura UKCA
Regno Unito: La Marcatura CE sarà sostituita dalla marcatura UKCA[/box-note]
Decreto 6 ottobre 2020
Decreto 6 ottobre 2020
Esclusione della pubblicita' dei profilattici dall'autorizzazione del Ministero della salute.
(GU n.284 del 14.11.2020)
[box-warning]Abrogato da:
Decreto 26 gennaio 2023 Individuazione delle fattispecie di pubblicita' di dispositivi medici che non necessitano di autorizzazione ministeriale. (GU n.66 del 18.03.2023)[/box-warning]
Collegati
[box-note]Decreto 26 gennaio 2023[/box-note]
Decreto 26 gennaio 2023
Decreto 26 gennaio 2023 / Dispositivi medici che possono essere pubblicizzati senza autorizzazione ministeriale
Individuazione delle fattispecie di pubblicita' di dispositivi medici che non necessitano di autorizzazione ministeriale.
(GU n.66 del 18.03.2023)
________
Art. 1. Fattispecie che non necessitano di autorizzazione ministeriale
1. Ai sensi dell’art. 26, comma 6, del decreto legislativo 5 agosto 2022, n. 137, non sono oggetto di autorizzazione del Ministero della salute le pubblicità delle seguenti fattispecie di dispositivi:
a) profilattici;
b) accessori di dispositivi medici, come le montature per occhiali, a condizione che il messaggio pubblicitario si riferisca esclusivamente a proprietà non sanitarie.
2. Non sono sottoposte, inoltre, ad autorizzazione del Ministero della salute, ai sensi dell’art. 26, comma 6, del decreto legislativo 5 agosto 2022, n. 137:
a) la pubblicità, effettuata da un’azienda fabbricante o distributrice di dispositivi medici, che richiama la denominazione o il campo di attività delle medesime a condizione che non siano vantate specifiche proprietà di tali dispositivi, richiamati singolarmente, anche mediante l’immagine della loro confezione, o nel loro complesso;
b) le forme di promozione, anche mediante l’utilizzo dell’immagine della confezione, di dispositivi medici realizzate attraverso la messa in vendita di confezioni multiple al prezzo della confezione unitaria o mediante modalità diverse di operazioni a premio o concorsi, fermo restando, anche in tali casi, il divieto di diffondere senza autorizzazione messaggi che, oltre a far riferimento alle modalità di promozione, si riferiscano a proprietà e caratteristiche del dispositivo medico;
c) la pubblicazione dell’immagine o della rappresentazione grafica del dispositivo o del suo confezionamento sui listini dei prezzi di vendita e sugli annunci degli eventuali sconti praticati al pubblico;
d) limitatamente alla vendita a distanza, di cui all’art. 6 del regolamento (UE) 2017/745, la pubblicazione dell’immagine o della rappresentazione grafica del dispositivo o della sua confezione nonché la descrizione e la destinazione d’uso così come riportate nelle istruzioni per l’uso, purché sia presente e consultabile la versione integrale delle predette istruzioni per l’uso.
3. Il Ministero della salute, qualora una pubblicità effettuata ai sensi dei commi 1 e 2 presenti informazioni dalle quali può derivare un rischio per la salute dei consumatori:
a) ordina l’immediata cessazione della pubblicità;
b) ordina la diffusione, a spese del trasgressore, di un comunicato di rettifica e di precisazione, secondo modalità stabilite dallo stesso Ministero.
2. Abrogazioni
1. Sono abrogati, dalla data di entrata in vigore del presente decreto, il decreto del Ministro della salute 23 febbraio 2006, recante «Pubblicità dei dispositivi medici» e il decreto del Vice Ministro per la salute 6 ottobre 2020, recante «Esclusione della pubblicità dei profilattici dall’autorizzazione del Ministero della salute» citati in premessa.
...
segue in allegato
[box-note]Collegati
Decreto Legislativo 5 agosto 2022 n. 137
Regolamento (UE) 2017/745[/box-note]
Regolamento (UE) 2023/607
Regolamento (UE) 2023/607 / Modifica Reg. Dispositivi medici e DMD vitro
ID 19258 | 20.03.2023
Regolamento (UE) 2023/607 del Parlamento europeo e del Consiglio del 15 marzo 2023 che modifica i regolamenti (UE) 2017/745 e (UE) 2017/746 per quanto riguarda le disposizioni transitorie per determinati dispositivi medici e dispositivi medico-diagnostici in vitro
GU L 80/24 del 20.3.2023
Entrata in vigore: 20.03.2023
_______
Articolo 1 Modifiche del regolamento (UE) 2017/745
Il regolamento (UE) 2017/745 è così modificato:
1) l’articolo 120 è così modificato:
a) al paragrafo 2, il secondo comma è sostituito dal seguente:
«I certificati rilasciati da organismi notificati conformemente alle direttive 90/385/CEE e 93/42/CEE a decorrere dal 25 maggio 2017 che erano ancora validi al 26 maggio 2021 e che non sono stati revocati successivamente restano validi dopo la scadenza del termine indicato sul certificato fino alla data di cui al paragrafo 3 bis del presente articolo applicabile per la pertinente classe di rischio dei dispositivi. I certificati rilasciati da organismi notificati conformemente a tali direttive a decorrere dal 25 maggio 2017 che erano ancora validi al 26 maggio 2021 e che sono scaduti prima del 20 marzo 2023 sono considerati validi fino alle date di cui al paragrafo 3 bis del presente articolo solo se è soddisfatta una delle condizioni seguenti:
a) prima della data di scadenza del certificato, il fabbricante e un organismo notificato hanno firmato un accordo scritto conformemente all’allegato VII, punto 4.3, secondo comma, del presente regolamento, per la valutazione della conformità del dispositivo oggetto del certificato scaduto o di un dispositivo destinato a sostituire tale dispositivo;
b) un’autorità competente di uno Stato membro ha concesso una deroga alla procedura di valutazione della conformità applicabile a norma dell’articolo 59, paragrafo 1, del presente regolamento o ha imposto al fabbricante, conformemente all’articolo 97, paragrafo 1, del presente regolamento, di eseguire la procedura di valutazione della conformità applicabile.»;
b) il paragrafo 3 è sostituito dal seguente:
«3. In deroga all’articolo 5 e purché siano soddisfatte le condizioni stabilite al paragrafo 3 quater del presente articolo, i dispositivi di cui ai paragrafi 3 bis e 3 ter del presente articolo possono essere immessi sul mercato o messi in servizio fino alle date stabilite in tali paragrafi.
3 bis. I dispositivi con un certificato rilasciato ai sensi della direttiva 90/385/CEE o della direttiva 93/42/CEE e valido in virtù del paragrafo 2 del presente articolo possono essere immessi sul mercato o messi in servizio fino alle date seguenti:
a) 31 dicembre 2027, per tutti i dispositivi della classe III e per i dispositivi impiantabili della classe IIb, ad eccezione di materiali per sutura, graffette, materiali per otturazioni dentarie, apparecchi ortodontici, corone dentali, viti, cunei, placche e protesi, fili, chiodi, clip e connettori;
b) 31 dicembre 2028, per i dispositivi della classe IIb diversi da quelli di cui alla lettera a) del presente paragrafo, per i dispositivi della classe IIa e per i dispositivi della classe I immessi sul mercato in condizioni di sterilità o con funzione di misura.
3 ter. I dispositivi per i quali la procedura di valutazione della conformità a norma della direttiva 93/42/CEE non richiedeva l’intervento di un organismo notificato, per i quali è stata redatta una dichiarazione di conformità anteriormente al 26 maggio 2021 e per i quali la procedura di valutazione della conformità a norma del presente regolamento richiede l’intervento di un organismo notificato, possono essere immessi sul mercato o messi in servizio fino al 31 dicembre 2028.
3 quater. I dispositivi di cui ai paragrafi 3 bis e 3 ter del presente articolo possono essere immessi sul mercato o messi in servizio fino alle date di cui a tali paragrafi solo se sono soddisfatte le condizioni seguenti:
a) tali dispositivi continuano a essere conformi alla direttiva 90/385/CEE o alla direttiva 93/42/CEE, a seconda dei casi;
b) non ci sono cambiamenti significativi nella progettazione e nella destinazione d’uso;
c) i dispositivi non presentano un rischio inaccettabile per la salute o la sicurezza di pazienti, utilizzatori o altre persone o per altri aspetti della protezione della salute pubblica;
d) entro il 26 maggio 2024 il fabbricante ha istituito un sistema di gestione della qualità conformemente all’articolo 10, paragrafo 9;
e) entro il 26 maggio 2024 il fabbricante o il mandatario ha presentato una domanda formale a un organismo notificato conformemente all’allegato VII, punto 4.3, primo comma, per la valutazione della conformità di un dispositivo di cui al paragrafo 3 bis o 3 ter del presente articolo, o di un dispositivo destinato a sostituire tale dispositivo, ed entro il 26 settembre 2024 l’organismo notificato e il fabbricante hanno firmato un accordo scritto conformemente all’allegato VII, punto 4.3, secondo comma.
3 quinquies. In deroga al paragrafo 3 del presente articolo, le prescrizioni del presente regolamento in materia di sorveglianza post-commercializzazione, sorveglianza del mercato, vigilanza, registrazione di operatori economici e dispositivi si applicano ai dispositivi di cui ai paragrafi 3 bis e 3 ter del presente articolo e sostituiscono i corrispondenti requisiti di cui alle direttive 90/385/CEE e 93/42/CEE.
3 sexies. Fatti salvi il capo IV e il paragrafo 1 del presente articolo, l’organismo notificato che ha rilasciato il certificato di cui al paragrafo 3 bis del presente articolo continua a essere responsabile dell’appropriata sorveglianza dei requisiti applicabili relativi ai dispositivi che ha certificato, a meno che il fabbricante non abbia concordato con un organismo notificato designato a norma dell’articolo 42 che sia quest’ultimo a effettuare tale sorveglianza.
Entro il 26 settembre 2024 l’organismo notificato che ha firmato l’accordo scritto di cui al paragrafo 3 quater, lettera e), del presente articolo diventa responsabile della sorveglianza dei dispositivi oggetto dell’accordo scritto. Se l’accordo scritto riguarda un dispositivo destinato a sostituire un dispositivo oggetto di un certificato rilasciato a norma della direttiva 90/385/CEE o della direttiva 93/42/CEE, la sorveglianza è effettuata sul dispositivo che viene sostituito.
Le modalità per il trasferimento della responsabilità di sorveglianza dall’organismo notificato che ha rilasciato il certificato all’organismo notificato designato a norma dell’articolo 42 sono chiaramente definite in un accordo tra il fabbricante e l’organismo notificato designato a norma dell’articolo 42 e, se possibile, l’organismo notificato che ha rilasciato il certificato. L’organismo notificato designato a norma dell’articolo 42 non è responsabile delle attività di valutazione della conformità svolte dall’organismo notificato che ha rilasciato il certificato.
3 septies. In deroga all’articolo 5, i dispositivi su misura impiantabili della classe III possono essere immessi sul mercato o messi in servizio fino al 26 maggio 2026 senza un certificato rilasciato da un organismo notificato secondo la procedura di valutazione della conformità di cui all’articolo 52, paragrafo 8, secondo comma, a condizione che entro il 26 maggio 2024 il fabbricante o il mandatario abbia presentato una domanda formale a un organismo notificato conformemente all’allegato VII, punto 4.3, primo comma, per la valutazione della conformità e, entro il 26 settembre 2024, l’organismo notificato e il fabbricante abbiano firmato un accordo scritto conformemente all’allegato VII, punto 4.3, secondo comma.»;
c) il paragrafo 4 è sostituito dal seguente:
«4. I dispositivi immessi legittimamente sul mercato a norma delle direttive 90/385/CEE e 93/42/CEE anteriormente al 26 maggio 2021 e i dispositivi immessi legittimamente sul mercato a decorrere dal 26 maggio 2021 a norma dei paragrafi 3, 3 bis, 3 ter e 3 septies del presente articolo, possono continuare a essere messi a disposizione sul mercato o a essere messi in servizio.»;
2) l’articolo 122 è così modificato:
a) al primo comma, la frase introduttiva è sostituita dalla seguente:
«Fatto salvo l’articolo 120, paragrafi da 3 a 3 sexies e paragrafo 4, del presente regolamento e fatti salvi gli obblighi degli Stati membri e dei fabbricanti per quanto riguarda la vigilanza e gli obblighi dei fabbricanti relativamente alla messa a disposizione della documentazione, conformemente alle direttive 90/385/CEE e 93/42/CEE, tali direttive sono abrogate con effetto a decorrere dal 26 maggio 2021, fatti salvi:»;
b) il secondo comma è sostituito dal seguente:
«Per quanto riguarda i dispositivi di cui all’articolo 120, paragrafi da 3 a 3 quinquies e paragrafo 4, del presente regolamento, le direttive di cui al primo comma del presente articolo continuano ad applicarsi nella misura necessaria all’applicazione di tali paragrafi.»;
3) all’articolo 123, paragrafo 3, lettera d), il ventiquattresimo trattino è sostituito dal seguente:
«– articolo 120, paragrafo 3 quinquies.».
Articolo 2 Modifiche del regolamento (UE) 2017/746
Il regolamento (UE) 2017/746 è così modificato:
1) all’articolo 110, il paragrafo 4 è sostituito dal seguente:
«4. I dispositivi immessi legittimamente sul mercato ai sensi della direttiva 98/79/CE anteriormente al 26 maggio 2022 e i dispositivi immessi legittimamente sul mercato a decorrere dal 26 maggio 2022 a norma del paragrafo 3 del presente articolo possono continuare a essere messi a disposizione sul mercato o a essere messi in servizio.»;
2) all’articolo 112, il secondo comma è sostituito dal seguente:
«Per quanto riguarda i dispositivi di cui all’articolo 110, paragrafi 3 e 4, del presente regolamento, la direttiva 98/79/CE continua ad applicarsi nella misura necessaria all’applicazione di tali paragrafi.».
Articolo 3 Entrata in vigore
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
[...]
Collegati
[box-note]MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
Dichiarazione CE di conformità Regolamento (UE) 2017/745
Regolamento (UE) 2017/745
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
Decreto Min. Salute 26 gennaio 2023
Decreto Ministero della Salute 26 gennaio 2023
ID | 18.03.2023
Decreto 26 gennaio 2023 Individuazione delle fattispecie di pubblicita' di dispositivi medico-diagnostici in vitro che non necessitano di autorizzazione ministeriale.
(GU n.66 del 18.03.2023)
Entrata in vigore: 18.03.2023
______
Collegati
[box-note]Regolamento (UE) 2017/746[/box-note]
Norme armonizzate Click: i testi consolidati delle norme pubblicate Settembre 2022 / Marzo 2023
Norme armonizzate Click | Settembre 2022 / Marzo 2023
ID 19227 | 17.03.2023 / Download Documento allegato
I testi consolidati dell'elenco delle norme armonizzate per Direttiva / Regolamento UE pubblicate Settembre 2022 / Marzo 2023
Download Norme armonizzate Click Settembre 2022 - Marzo 2023
Come consultare i riferimenti delle norme armonizzate 2019/2023.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi delle Direttive nuovo approccio UE devono essere letti in relazione alle pubblicazioni precedenti.
Per facilitare la consultazione sono stati realizzati dei "testi consolidati" che saranno aggiornati nel tempo, dove sono riporti l'elenco dei titoli delle norme armonizzate pubblicate per Direttiva/Regolamento UE.
I testi consolidati Settembre 2022 / Marzo 2023:
Norme armonizzate Direttiva ATEX
Norme armonizzate Direttiva BT

10 Gennaio 2023
Norme armonizzate Direttiva Macchine
Norme armonizzate Regolamento CPR
Norme armonizzate Regolamento DPI
Norme armonizzate Direttiva RED
Norme armonizzate Direttiva Imbarcazioni da diporto

03 Ottobre 2022
Norme armonizzate Direttiva PED
_______
Tutti i testi consolidati Norme armonizzate Direttive di Prodotto:
Certifico Srl - IT | Rev. 5.0 2023
©Copia autorizzata Abbonati
Collegati
[box-note]Norme armonizzate Click
Direttiva click
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2021 / Dicembre 2021
Norme armonizzate Click: i testi consolidati delle norme pubblicate Gennaio 2020 / Luglio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Novembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Ottobre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Settembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Agosto 2019[/box-note]
Regolamento delegato (UE) 2023/502
Regolamento delegato (UE) 2023/502 / Modifica Regolamento Dispositivi medici
ID 19170 | 08.03.2023
Regolamento delegato (UE) 2023/502 della Commissione del 1° dicembre 2022 che modifica il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda la frequenza delle nuove e complete valutazioni degli organismi notificati
GU L 70/1 del 8.3.2023
Entrata in vigore: 11.03.2023
________
Articolo 1
All’articolo 44 del regolamento (UE) 2017/745, il paragrafo 10 è sostituito dal seguente:
«10. Cinque anni dopo la notifica di un organismo notificato, e successivamente ogni cinque anni, una nuova e completa valutazione per determinare se l’organismo notificato è ancora conforme alle prescrizioni di cui all’allegato VII viene effettuata dall’autorità responsabile degli organismi notificati dello Stato membro in cui l’organismo è stabilito e da un gruppo di valutazione congiunta secondo la procedura di cui all’articolo 39.
L’autorità responsabile degli organismi notificati dello Stato membro in cui è stabilito l’organismo notificato può effettuare una nuova e completa valutazione prima delle date di cui al primo comma su richiesta dell’organismo notificato oppure qualora essa, sulla base dei risultati delle valutazioni annuali effettuate a norma del paragrafo 4 del presente articolo, nutra dubbi circa il persistere della conformità di un organismo notificato alle prescrizioni di cui all’allegato VII.
Le nuove e complete valutazioni già avviate prima dell'11 marzo 2023 continuano a essere effettuate, a meno che l’autorità responsabile degli organismi notificati dello Stato membro in cui è stabilito l’organismo notificato non decida di sospendere o cessare la nuova e completa valutazione in corso tenendo conto delle proprie risorse e delle risorse dell’organismo notificato già impiegate per la nuova valutazione, nonché dei risultati delle valutazioni annuali effettuate a norma del paragrafo 4 del presente articolo. Prima di sospendere o di cessare a una nuova e completa valutazione in corso, l’autorità responsabile degli organismi notificati sente l’organismo notificato interessato.».
Articolo 2
Il presente regolamento entra in vigore il terzo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
...
Vedi il Testo consolidato
Vedi il Testo Consolidato del Regolamento MDR
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
RAPEX Report 15 del 14/04/2023 N. 60 A12/00735/23 Italia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 15 del 14/04/2023 N. 60 A12/00735/23 Italia
Approfondimento tecnico: Bagnoschiuma
Il prodotto, di marca Borotalco, barcode 8002410042283, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio del 30 novembre 2009, sui prodotti cosmetici.
Secondo l'elenco dei componenti, il prodotto contiene 2-(4-terz-butilbenzil)propionaldeide (BMHCA), che è vietato nei prodotti cosmetici. Il BMHCA può danneggiare il sistema riproduttivo, la salute del nascituro e può causare sensibilizzazione cutanea.
Regolamento (CE) 1223/2009
Articolo 14
Restrizioni applicabili alle sostanze elencate negli allegati
1. Fatto salvo l'articolo 3, i prodotti cosmetici non possono contenere:
a) sostanze vietate:
- sostanze vietate di cui all'allegato II;
b) sostanze soggette a restrizioni:
- sostanze soggette a restrizioni non impiegate conformemente alle restrizioni indicate nell'allegato III; […]
Regolamento (CE) 1223/2009
Allegato II
Elenco delle sostanze vietate nei prodotti cosmetici
n. 1666
Denominazione chimica/INN 2-(4-terz-butilbenzil)propionaldeide
Numero CAS 80-54-6
Numero CE 201-289-8
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 15 del 14_04_2023 N. 60 A12_00735_23 Italia.pdf Bagnoschiuma |
99 kB | 1 |
Il Consiglio adotta il nuovo regolamento sicurezza generale dei prodotti
Il Consiglio Europeo adotta il nuovo regolamento sicurezza generale dei prodotti
ID 19501 | 25.04.2023
[box-info]Pubblicato il 23.05.2023 il Regolamento (UE) 2023/988
Regolamento (UE) 2023/988 del Parlamento europeo e del Consiglio del 10 maggio 2023 relativo alla sicurezza generale dei prodotti, che modifica il regolamento (UE) n. 1025/2012 del Parlamento europeo e del Consiglio e la direttiva (UE) 2020/1828 del Parlamento europeo e del Consiglio, e che abroga la direttiva 2001/95/CE del Parlamento europeo e del Consiglio e la direttiva direttiva 87/357/CEE del Consiglio (GU L 135/1 del 23.5.2023)
Entrata in vigore: 12.05.2023
Applicazione dal 13.12.2024[/box-info]
Il Consiglio ha adottato il 25 aprile 2023, il regolamento generale sulla sicurezza dei prodotti (GPSR), che rafforza le norme di sicurezza per i prodotti venduti anche online. Il regolamento rafforzerà la sorveglianza del mercato per i prodotti non sicuri e i diritti dei consumatori.
Nel dettaglio:
- i mercati online dovranno cooperare con le autorità di vigilanza del mercato se rilevano un prodotto pericoloso sulla loro piattaforma e devono istituire un punto di contatto unico responsabile della sicurezza dei prodotti;
- le autorità di vigilanza del mercato potranno ordinare ai mercati online di rimuovere i prodotti pericolosi dalle loro piattaforme o di disabilitarne l'accesso;
- a tutti i prodotti si applicherà un regime unico di vigilanza del mercato;
- se un prodotto si è rivelato non sicuro, gli operatori economici devono adottare immediatamente misure correttive e informare le autorità di vigilanza del mercato e i consumatori;
- se un prodotto deve essere richiamato, i consumatori avranno diritto alla riparazione o sostituzione o al rimborso (e potranno scegliere tra almeno due di queste opzioni);
- gli operatori economici dovrebbero avere una persona responsabile per i prodotti venduti online e offline (indipendentemente dall'origine del prodotto), che assicurerà la disponibilità di documentazione tecnica, istruzioni e informazioni sulla sicurezza.
Dopo l'approvazione del 25.04.2023 da parte del Consiglio, l'atto legislativo è stato adottato.
Dopo essere stato firmato dal Presidente del Parlamento europeo e dal Presidente del Consiglio, il regolamento sarà pubblicato nella Gazzetta ufficiale dell'Unione europea ed entrerà in vigore il ventesimo giorno successivo alla sua pubblicazione.
A seguito dell'adozione formale del regolamento e della sua entrata in vigore, gli Stati membri avranno 18 mesi di tempo per applicare le nuove norme sulla sicurezza generale dei prodotti.
...
Fonte: Consiglio Europeo
Collegati
[box-note]Regolamento (UE) 2023/988
Proposal for the General Product Safety Regulation (GPSR)
Regolamento (UE) 2019/1020
Regolamento (UE) n. 1025/2012[/box-note]
RAPEX Report 13 del 31/03/2023 N. 13 A12/00635/23 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 13 del 31/03/2023 N. 13 A12/00635/23 Svezia
Approfondimento tecnico: Macchina fotografica giocattolo
Il prodotto, di marca sconosciuta, mod. 181/226014, è stato sottoposto alla procedura di ritiro dai siti internet sui quali era venduto perché non conforme al Regolamento (UE) 2019/1021 (POPS) del Parlamento Europeo e del Consiglio del 20 giugno 2019 relativo agli inquinanti organici persistenti.
Il prodotto contiene paraffine clorurate a catena corta (SCCP) (valore misurato fino allo 0,2 % in peso).
Gli SCCP persistono nell'ambiente, sono tossiche per gli organismi acquatici a basse concentrazioni e si accumulano nella fauna selvatica e nell'uomo, rappresentando un rischio per la salute umana e l'ambiente.
Regolamento (UE) 2019/1021 (POPS)
Allegato I
Alcani, C10-C13, cloro (paraffine clorurate a catena corta) (SCCP)
1. In deroga a quanto sopra, si consente la produzione, la commercializzazione e l'uso di sostanze o miscele contenenti SCCP in concentrazioni inferiori all'1 % in peso o di articoli contenenti SCCP in concentrazioni inferiori allo 0,15 % in peso.
2. L'uso è consentito per quanto concerne:
a) i nastri trasportatori per il settore minerario e i sigillanti per dighe contenenti SCCP già in uso al 4 dicembre 2015 o anteriormente; e
b) gli articoli contenenti SCCP diversi da quelli di cui alla lettera a) già in uso al 10 luglio 2012 o anteriormente.
3. Agli articoli di cui al punto 2 si applica l'articolo 4, paragrafo 2, terzo e quarto comma.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 13 del 31_03_2023 N. 13 A12_00635_23 Svezia.pdf Macchina fotografica giocattolo |
110 kB | 0 |
Regolamento (UE) 2023/1230


Regolamento (UE) 2023/1230 / Regolamento macchine / in vigore dal 19.07.2023
ID 19463 | 29.06.2023 / Download Testo Regolamento macchine IT / Download Regolamento macchine EN
Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio.
(GU n. 165/1 del 29.06.2023)
Entrata in vigore: 19.07.2023
Applicazione dal 20.01.2027 [42 mesi dopo la data di entrata in vigore]. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024 [6 mesi dopo la data di entrata in vigore];
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026 [39 mesi dopo la data di entrata in vigore];
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023 [data di entrata in vigore];
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024 [12 mesi dopo la data di entrata in vigore].
[box-warning]La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027.
La direttiva 73/361/CEE è abrogata.[/box-warning]
[box-info]Modifiche:
Regolamento (UE) 2024/2748 del Parlamento europeo e del Consiglio, del 9 ottobre 2024, che modifica i regolamenti (UE) n. 305/2011, (UE) 2016/424, (UE) 2016/425, (UE) 2016/426, (UE) 2023/988 e (EU) 2023/1230 per quanto riguarda le procedure di emergenza per la valutazione della conformità, la presunzione di conformità, l’adozione di specifiche comuni e la vigilanza del mercato nel contesto di un’emergenza nel mercato interno. GU L 2024/2748 dell'8.11.2024. Entrata in vigore: 28.11.2024. Applicazione a decorrere dal 29 maggio 2026
Rettifiche:
- Rettifica del regolamento (UE) 2023/1230 - 04.07.2023 (GU L 169/35 del 4.7.2023)[/box-info]
[box-download]In fondo all'articolo, scorrendo la pagina, in allegato testo:
- Regolamento (UE) 2023/1230 (IT)
- Regolamento (UE) 2023/1230 (EN)
- Regolamento (UE) 2023/1230 (Testo consolidato 29.06.2023 IT)
- Regolamento (UE) 2023/1230 (Consolidate text 29.06.2023 EN)[/box-download]
[...]
Premessa
Capo I Disposizioni generali
Articolo 1. Oggetto
Articolo 2. Ambito di applicazione
Articolo 3. Definizioni
Articolo 4. Libera circolazione
Articolo 5. Protezione delle persone durante l'installazione e l'uso di macchine o prodotti correlati
Articolo 6. Categorie di macchine e prodotti correlati elencati nell'allegato I soggetti a procedure specifiche di valutazione della conformità
Articolo 7. Componenti di sicurezza
Articolo 8. Requisiti essenziali di sicurezza e di tutela della salute dei prodotti rientranti nell'ambito di applicazione del presente regolamento
Articolo 9. Normativa specifica di armonizzazione dell'Unione
Capo II. Obblighi degli operatori economici
Articolo 10 Obblighi dei fabbricanti di macchine e di prodotti correlati
Articolo 11. Obblighi dei fabbricanti di quasi-macchine
Articolo 12. Mandatari
Articolo 13. Obblighi degli importatori di macchine e di prodotti correlati
Articolo 14. Obblighi degli importatori di quasi-macchine
Articolo 15. Obblighi dei distributori di macchine e di prodotti correlati
Articolo 16. Obblighi dei distributori di quasi-macchine
Articolo 17. Casi in cui gli obblighi dei fabbricanti si applicano agli importatori e ai distributori
Articolo 18. Altri casi in cui si applicano gli obblighi dei fabbricanti
Articolo 19. Identificazione degli operatori economici
Capo III. Conformità dei prodotti rientranti nell'ambito di applicazione del presente regolamento
Articolo 20. Presunzione di conformità dei prodotti rientranti nell'ambito di applicazione del presente regolamento
Articolo 21. Dichiarazione di conformità UE per le macchine e i prodotti correlati
Articolo 22. Dichiarazione di incorporazione UE di quasi-macchine
Articolo 23. Principi generali della marcatura CE
Articolo 24. Norme per l'apposizione della marcatura CE alle macchine e ai prodotti correlati
Capo IV. Valutazione della conformità
Articolo 25. Procedure di valutazione della conformità per le macchine e i prodotti correlati
Capo V. Notifica degli organismi di valutazione della conformità
Articolo 26. Notifica
Articolo 27. Autorità di notifica
Articolo 28. Prescrizioni relative alle autorità di notifica
Articolo 29. Obbligo di informazione delle autorità di notifica
Articolo 30. Prescrizioni relative agli organismi notificati
Articolo 31. Presunzione di conformità degli organismi notificati
Articolo 32. Ricorso a subappaltatori e affiliati da parte degli organismi notificati
Articolo 33. Domanda di notifica
Articolo 34. Procedura di notifica
Articolo 35. Numeri di identificazione ed elenchi degli organismi notificati
Articolo 36. Modifiche delle notifiche
Articolo 37. Contestazione della competenza degli organismi notificati
Articolo 38. Obblighi operativi degli organismi notificati
Articolo 39. Ricorsi contro le decisioni degli organismi notificati
Articolo 40. Obbligo di informazione a carico degli organismi notificati
Articolo 41. Scambio di esperienze
Articolo 42. Coordinamento degli organismi notificati
Capo VI. Vigilanza del mercato dell'Unione e procedure di salvaguardia dell'Unione
Articolo 43 Procedura a livello nazionale per i prodotti rientranti nell'ambito di applicazione del presente regolamento che presentano rischi
Articolo 44. Procedura di salvaguardia dell'Unione
Articolo 45. Prodotti conformi rientranti nell'ambito di applicazione del presente regolamento che presentano un rischio
Articolo 46. Non conformità formale
Capo VII. Delega di poteri e procedura di comitato
Articolo 47 Esercizio della delega
Articolo 48. Procedura di comitato
Capo VIII. Riservatezza e sanzioni
Articolo 49 Riservatezza
Articolo 50. Sanzioni
Capo IX. Disposizioni transitorie e finali
Articolo 51. Abrogazioni
Articolo 52. Disposizioni transitorie
Articolo 53. Valutazione e riesame
Articolo 54. Entrata in vigore e applicazione
Allegati
Allegato I Categorie di macchine o prodotti correlati per le quali va applicata una delle procedure di cui all'articolo 25, paragrafi 2 e 3
Allegato II Elenco indicativo di componenti di sicurezza
Allegato III Requisiti essenziali di sicurezza e di tutela della salute relativi alla progettazione e alla costruzione di macchine o prodotti correlati
Allegato IV Documentazione tecnica
Allegato V Dichiarazione di conformità UE e dichiarazione di incorporazione UE
Allegato VI Controllo interno della produzione
Allegato VII Esame UE del tipo
Allegato VIII Conformità al tipo basata sul controllo interno della produzione
Allegato IX Conformità basata sulla garanzia qualità totale
Allegato X Conformità basata sulla verifica dell'unità
Allegato XI Istruzioni per l'assemblaggio delle quasi-macchine
Allegato XII Tavola di concordanza
...
Abrogazioni, disposizioni transitorie e entrata in vigore
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 19 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 20 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2026;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Tutto il testo
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023
- Rettifica del regolamento (UE) 2023/1230 - 04.07.2023
...
IL PARLAMENTO EUROPEO E IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea, in particolare l'articolo 114,
vista la proposta della Commissione europea,
previa trasmissione del progetto di atto legislativo ai parlamenti nazionali,
visto il parere del Comitato economico e sociale europeo,
deliberando secondo la procedura legislativa ordinaria,
considerando quanto segue:
Considerando
(1) La direttiva 2006/42/CE del Parlamento europeo e del Consiglio4 è stata adottata nel contesto dell'istituzione del mercato interno, al fine di armonizzare i requisiti di sicurezza e tutela della salute per le macchine in tutti gli Stati membri ed eliminare gli ostacoli al commercio di macchine tra gli Stati membri.
(2) Il settore delle macchine costituisce una parte importante del settore della meccanica ed è uno dei pilastri industriali dell'economia dell'Unione. Il costo sociale dovuto all'alto numero di infortuni provocati direttamente dall'utilizzazione delle macchine può essere ridotto integrando la sicurezza nella progettazione e nella costruzione stesse delle macchine nonché effettuando una corretta installazione e manutenzione.
(3) L'esperienza acquisita nell'applicazione della direttiva 2006/42/CE ha evidenziato carenze e incongruenze nella copertura dei prodotti e nelle procedure di valutazione della conformità. È pertanto necessario migliorare, semplificare e adattare le disposizioni stabilite in tale direttiva alle esigenze del mercato e fornire norme chiare in relazione al quadro entro il quale i prodotti rientranti nell'ambito di applicazione del presente regolamento possono essere messi a disposizione sul mercato.
(4) Dato che le norme che fissano i requisiti per i prodotti rientranti nell'ambito di applicazione del presente regolamento, in particolare i requisiti essenziali di sicurezza e di tutela della salute e le procedure di valutazione della conformità, devono essere applicate in modo uniforme da tutti gli operatori in tutta l'Unione e non devono lasciare spazio a divergenze nell’attuazione da parte degli Stati membri, la direttiva 2006/42/CE dovrebbe essere sostituita da un regolamento.
(5) Gli Stati membri sono tenuti a tutelare nel loro territorio la sicurezza e la salute delle persone, in particolare dei lavoratori e dei consumatori e, ove opportuno, degli animali domestici nonché la tutela dei beni, e, se del caso, dell'ambiente, specie nei confronti dei rischi che derivano dall'uso previsto o da qualsiasi uso scorretto ragionevolmente prevedibile delle macchine o dei prodotti correlati. Per evitare dubbi, si dovrebbe considerare che gli animali domestici includano anche gli animali da allevamento.
(6) Il regolamento (CE) n. 765/2008 del Parlamento europeo e del Consiglio stabilisce norme riguardanti l'accreditamento degli organismi di valutazione della conformità e i principi generali della marcatura CE. Tale regolamento dovrebbe essere applicabile ai prodotti rientranti nell'ambito di applicazione del presente regolamento al fine di garantire che tali prodotti, che stanno beneficiando della libera circolazione delle merci all'interno dell'Unione, soddisfino requisiti volti ad offrire un livello elevato di tutela di interessi pubblici quali la tutela della salute e la sicurezza delle persone nonché, ove opportuno, degli animali domestici, nonché la tutela dei beni e, se del caso, dell'ambiente.
(7) Il regolamento (UE) 2019/1020 del Parlamento europeo e del Consiglio stabilisce norme in materia di vigilanza del mercato e di controllo dei prodotti che entrano nel mercato dell'Unione. Poiché la direttiva 2006/42/CE figura nell'allegato I del regolamento (UE) 2019/1020, tale regolamento si applica già ai prodotti rientranti nell'ambito di applicazione del presente regolamento. Tuttavia, il regolamento (UE) 2019/1020 si applica ai prodotti rientranti nell'ambito di applicazione del presente regolamento nella misura in cui non esistono disposizioni specifiche aventi lo stesso obiettivo che disciplinino in modo più specifico determinati aspetti relativi alla vigilanza del mercato e all'applicazione delle norme.
(8) Il regolamento (UE) 2019/1020 stabilisce i compiti degli operatori economici a riguardo di prodotti oggetto di talune normative di armonizzazione dell'Unione. Esso prevede inoltre che tali prodotti siano immessi sul mercato solo se esiste un operatore economico stabilito nell'Unione che è responsabile di tali compiti. Tra le suddette normative di armonizzazione dell'Unione figura la direttiva 2006/42/CE. Di conseguenza, i prodotti rientranti nell'ambito di applicazione del presente regolamento sono immessi sul mercato solo se vi è un operatore economico stabilito nell'Unione che è responsabile dei compiti di cui al regolamento (UE) 2019/1020 relativamente a tali prodotti.
(9) La decisione n. 768/2008/CE del Parlamento europeo e del Consiglio stabilisce principi comuni e disposizioni di riferimento da applicare in tutta la normativa settoriale. Allo scopo di garantire la coerenza con altre normative settoriali, è opportuno uniformare alcune disposizioni del presente regolamento a tale decisione, nella misura in cui le caratteristiche specifiche del settore non richiedano soluzioni differenti. Di conseguenza, talune definizioni, gli obblighi generali degli operatori economici, le norme sulla presunzione di conformità, le norme sulla dichiarazione di conformità UE, le norme sulla marcatura CE, i requisiti per gli organismi di valutazione della conformità, le norme sulle procedure di notifica e le procedure di valutazione della conformità e le norme sulle procedure per la gestione delle macchine o dei prodotti correlati e, se del caso, delle quasi-macchine, che presentano un rischio dovrebbero essere adattate alle disposizioni di riferimento stabilite in tale decisione.
(10) Il presente regolamento dovrebbe disciplinare i prodotti che sono nuovi sul mercato dell'Unione europea al momento della loro immissione sul mercato, e siano prodotti completamente nuovi realizzati da un fabbricante stabilito nell'Unione o prodotti, nuovi o usati, importati da un paese terzo.
(11) Laddove vi sia la possibilità che le macchine o i prodotti correlati siano utilizzati da consumatori, ossia da utilizzatori non professionali, nella progettazione e nella costruzione il fabbricante dovrebbe tenere conto del fatto che i consumatori non dispongono delle medesime conoscenze ed esperienze relative alla gestione delle macchine o dei prodotti correlati. Parimenti ne dovrebbe tenere conto qualora la macchina o il prodotto correlato siano abitualmente utilizzati per prestare servizi ai consumatori.
(12) Di recente sono state immesse sul mercato macchine più avanzate, meno dipendenti dagli operatori umani. Tali macchine lavorano a compiti definiti e in ambienti strutturati, tuttavia possono imparare a svolgere azioni nuove in tale contesto e diventare più autonome. Tra gli ulteriori perfezionamenti alle macchine, già realizzati o attesi, figurano l'elaborazione in tempo reale di informazioni, la risoluzione di problemi, la mobilità, i sistemi di sensori, l'apprendimento, l'adattabilità e la capacità di funzionare in ambienti non strutturati (ad esempio cantieri). La relazione della Commissione sulle implicazioni dell'intelligenza artificiale, dell'Internet delle cose e della robotica del 19 febbraio 2020 in materia di sicurezza e di responsabilità afferma che l'emergere di nuove tecnologie digitali, quali l'intelligenza artificiale, l'Internet delle cose e la robotica, pone nuove sfide in termini di sicurezza dei prodotti. La relazione conclude che la vigente normativa in materia di sicurezza dei prodotti, compresa la direttiva 2006/42/CE, presenta una serie di lacune in merito che devono essere colmate. Di conseguenza il presente regolamento dovrebbe disciplinare i rischi di sicurezza derivanti da nuove tecnologie digitali.
(13) Al fine di assicurare la tutela della salute e la sicurezza delle persone nonché, ove opportuno, degli animali domestici, nonché la tutela dei beni e, se del caso, dell'ambiente, il presente regolamento dovrebbe applicarsi a tutte le forme di fornitura di prodotti rientranti nell'ambito di applicazione del presente regolamento, comprese le vendite a distanza di cui al regolamento (UE) 2019/1020.
(14) A fini di certezza del diritto è necessario definire chiaramente l'ambito di applicazione del presente regolamento e i concetti relativi all'applicazione del medesimo con la maggiore precisione possibile.
(15) Al fine di garantire che l'ambito di applicazione del presente regolamento sia sufficientemente chiaro, è opportuno operare una distinzione tra macchine, prodotti correlati e quasi-macchine. Inoltre, i prodotti correlati dovrebbero essere intesi come comprendenti attrezzature intercambiabili, componenti di sicurezza, accessori di sollevamento, catene, funi e cinghie, nonché dispositivi amovibili di trasmissione meccanica, che sono tutti prodotti rientranti nell'ambito di applicazione del presente regolamento.
(16) Al fine di evitare di duplicare la disciplina riguardante un medesimo prodotto, è opportuno escludere dall'ambito di applicazione del presente regolamento le armi, comprese le armi da fuoco che sono soggette alla direttiva (UE) 2021/555 del Parlamento europeo e del Consiglio.
(17) Il presente regolamento mira ad affrontare i rischi derivanti dal funzionamento delle macchine e non dal trasporto di merci, persone o animali. Di conseguenza, il presente regolamento non dovrebbe applicarsi ai mezzi di trasporto per via aerea, per via navigabile e su rete ferroviaria, nonostante esso dovrebbe continuare ad applicarsi alle macchine installate su tali mezzi di trasporto. I mezzi di trasporto su strada che non sono ancora contemplati da un atto giuridico specifico dell'Unione dovrebbero essere disciplinati dal presente regolamento, relativamente ai rischi che potrebbero derivare dalla loro circolazione su strade pubbliche. Ciò significa che i veicoli, comprese le biciclette elettriche, i monopattini elettrici e altri dispositivi per la mobilità personale che non sono soggetti all'omologazione UE a norma del regolamento (UE) n. 167/2013 del Parlamento europeo e del Consiglio o del regolamento (UE) n. 168/2013 del Parlamento europeo e del Consiglio o all'omologazione a norma del regolamento (UE) 2018/858 del Parlamento europeo e del Consiglio, sono disciplinati dal presente regolamento.
(18) Gli elettrodomestici destinati all'uso domestico che non sono mobili azionati elettricamente, apparecchiature audio e video, apparecchiature per la tecnologia dell'informazione, macchine da ufficio, apparecchiature di collegamento e di controllo a bassa tensione e motori elettrici rientrano nell'ambito di applicazione della direttiva 2014/35/UE del Parlamento europeo e del Consiglio e dovrebbero pertanto essere esclusi dall'ambito di applicazione del presente regolamento. Alcuni di tali prodotti, ad esempio le lavatrici, stanno progressivamente integrando funzioni Wi-Fi e sono quindi disciplinate dalla direttiva 2014/53/UE del Parlamento europeo e del Consiglio in quanto apparecchiature radio. Anche tali prodotti dovrebbero essere esclusi dall'ambito di applicazione del presente regolamento.
(19) L'evoluzione del settore delle macchine ha determinato il ricorso crescente a mezzi digitali e i software svolgono un ruolo sempre più importante nella progettazione delle macchine. Di conseguenza la definizione di macchina dovrebbe essere adattata. A tale riguardo, le macchine alle quali manca solamente il caricamento di software destinati all'applicazione specifica prevista dal fabbricante e che sono oggetto della procedura di valutazione della conformità di tali macchine, dovrebbero rientrare nella definizione di macchina e non nelle definizioni di prodotti correlati o di quasi-macchine. Inoltre, la definizione di componenti di sicurezza dovrebbe riguardare non soltanto i dispositivi fisici ma anche quelli digitali. Al fine di tenere conto del crescente ricorso ad esso come componente di sicurezza, il software che svolge una funzione di sicurezza ed è immesso in maniera indipendente sul mercato dovrebbe essere considerato un componente di sicurezza.
(20) Tenuto conto della loro funzione essenziale di protezione, anche alcuni componenti inclusi nell'elenco indicativo dei componenti di sicurezza di cui all'allegato II dovrebbero essere soggetti a specifiche procedure di valutazione della conformità ed essere inclusi nell'allegato I.
(21) Le quasi-macchine sono prodotti che rientrano nell'ambito di applicazione del presente regolamento e che devono essere sottoposti a ulteriore costruzione per essere in grado di svolgere la loro applicazione specifica, ossia le operazioni ben definite per le quali sono stati progettati. Non è necessario che tutte le prescrizioni del presente regolamento si applichino alle quasi-macchine ma, al fine di assicurare la sicurezza dei prodotti nel loro complesso, è comunque importante che la libera circolazione di tali quasi-macchine sia garantita mediante una procedura specifica.
(22) Laddove i prodotti rientranti nell'ambito di applicazione del presente regolamento presentino rischi che sono affrontati dai requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento, ma che sono anche interamente o parzialmente disciplinati da una normativa di armonizzazione dell'Unione più specifica del presente regolamento, il presente regolamento non dovrebbe applicarsi nella misura in cui tali rischi siano disciplinati da tale altra normativa dell'Unione. In altri casi i prodotti rientranti nell'ambito di applicazione del presente regolamento potrebbero presentare rischi non affrontati dai requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento. Ad esempio i prodotti che integrano una funzione Wi-Fi potrebbero presentare rischi non affrontati dai requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento, dato che quest'ultimo non si occupa dei rischi specifici per tale funzione Wi-Fi.
(23) In occasione di fiere, esposizioni e dimostrazioni o eventi analoghi, dovrebbe essere possibile esporre prodotti rientranti nell'ambito di applicazione del presente regolamento che non soddisfano le prescrizioni del presente regolamento, dato che ciò non presenterebbe alcun rischio di sicurezza. Tuttavia, per motivi di trasparenza, le parti interessate dovrebbero essere adeguatamente informate del fatto che i prodotti rientranti nell'ambito di applicazione del presente regolamento non sono conformi e non possono essere acquistati.
(24) L'evoluzione dello stato dell'arte nel settore delle macchine incide sulla classificazione delle categorie di macchine o prodotti correlati elencati nell'allegato I. Al fine di rispecchiare correttamente le categorie di macchine o prodotti correlati che presentano un fattore di rischio più elevato, dovrebbero essere definiti criteri che consentano di valutare le categorie di prodotti che dovrebbero essere inclusi nell'elenco delle categorie di macchine o prodotti correlati che sono soggetti a una procedura più rigorosa di valutazione della conformità.
(25) Altri rischi relativi a nuove tecnologie digitali sono quelli provocati da terzi malintenzionati che incidono sulla sicurezza dei prodotti rientranti nell'ambito di applicazione del presente regolamento. A tale proposito i fabbricanti dovrebbero essere tenuti ad adottare misure proporzionate che si limitano alla protezione della sicurezza dei prodotti rientranti nell'ambito di applicazione del presente regolamento. Ciò non preclude l'applicazione ai prodotti rientranti nell'ambito di applicazione del presente regolamento di altri atti giuridici dell'Unione che affrontano specificamente aspetti di cibersicurezza.
(26) Al fine di garantire che le macchine o i prodotti correlati, quando sono immessi sul mercato o messi in servizio, non comportino rischi per la salute e la sicurezza delle persone o degli animali domestici e non causino danni a beni e, se del caso, all'ambiente, occorre definire i requisiti essenziali di sicurezza e di tutela della salute che devono essere soddisfatti affinché le macchine o i prodotti correlati siano autorizzati sul mercato. Le macchine o i prodotti correlati devono essere conformi ai requisiti essenziali di sicurezza e di tutela della salute quando vengono immessi sul mercato o messi in servizio. Qualora tali prodotti siano successivamente modificati, mediante mezzi fisici o digitali, in un modo non previsto o pianificato dal fabbricante e che incide sulla sicurezza di tali prodotti creando un nuovo pericolo o aumentando un rischio esistente, la modifica dovrebbe essere considerata sostanziale quando sono richieste nuove e significative misure di protezione. Tuttavia, le operazioni di riparazione e manutenzione che non incidono sulla conformità delle macchine o dei prodotti correlati rispetto ai pertinenti requisiti essenziali di sicurezza e di tutela della salute non dovrebbero essere considerate modifiche sostanziali. Al fine di garantire il rispetto da parte di tali prodotti dei requisiti essenziali di sicurezza e di tutela della salute pertinenti, la persona che effettua la modifica sostanziale dovrebbe essere tenuta a svolgere una nuova valutazione della conformità prima che il prodotto modificato possa essere immesso sul mercato o messo in servizio.
Al fine di evitare un onere inutile e sproporzionato, la persona che effettua la modifica sostanziale non dovrebbe essere tenuta a ripetere le prove e a produrre nuova documentazione in relazione alle macchine o ai prodotti correlati che sono parte di un insieme di macchine e sui quali la modifica non incide.
(27) Nel settore delle macchine, circa il 98 % delle imprese è costituito da piccole o medie imprese (PMI). Al fine di ridurre l'onere normativo per le PMI, è importante che gli organismi notificati valutino la possibilità di adeguare le tariffe per la valutazione della conformità e di ridurle proporzionalmente agli interessi e alle esigenze specifici delle PMI.
(28) Gli operatori economici dovrebbero essere responsabili della conformità dei prodotti rientranti nell'ambito di applicazione del presente regolamento rispetto ai requisiti di cui al presente regolamento in funzione dei rispettivi ruoli che rivestono nella catena di approvvigionamento, in modo da garantire un livello elevato di tutela di interessi pubblici, quali la tutela della salute e la sicurezza delle persone, in particolare dei consumatori e degli utilizzatori professionali nonché, ove opportuno, degli animali domestici, nonché la tutela dei beni e, se del caso, dell'ambiente, così come una concorrenza leale sul mercato dell'Unione.
(29) Tutti gli operatori economici che intervengono nella catena di approvvigionamento e distribuzione dovrebbero adottare misure atte a garantire che sul mercato siano messi a disposizione soltanto prodotti rientranti nell'ambito di applicazione del presente regolamento che siano conformi al presente regolamento. Il presente regolamento dovrebbe stabilire una ripartizione chiara e proporzionata degli obblighi corrispondenti al ruolo di ciascun operatore economico nella catena di approvvigionamento e distribuzione.
(30) Per facilitare la comunicazione tra gli operatori economici, le autorità di vigilanza del mercato e gli utilizzatori, i fabbricanti e gli importatori dovrebbero indicare il sito internet, l’indirizzo di posta elettronica o altri contatti digitali in aggiunta all’indirizzo postale.
(31) Il fabbricante, possedendo conoscenze dettagliate relative al processo di progettazione e produzione, si trova nella posizione migliore per eseguire la procedura di valutazione della conformità. La valutazione della conformità dovrebbe quindi rimanere obbligo esclusivo del fabbricante.
(32) Il fabbricante dovrebbe inoltre provvedere affinché sia effettuata una valutazione del rischio per il prodotto che rientra nell'ambito di applicazione del presente regolamento che il fabbricante intende immettere sul mercato o mettere in servizio. In tale contesto, il fabbricante dovrebbe stabilire quali requisiti essenziali di sicurezza e di tutela della salute siano applicabili al prodotto che rientra nell'ambito di applicazione del presente regolamento e quali misure debbano essere adottate per affrontare i rischi che il prodotto può presentare. La valutazione del rischio dovrebbe affrontare inoltre gli aggiornamenti o gli sviluppi futuri di un software installato nella macchina o nel prodotto correlato, che sono previsti quando la macchina o il prodotto correlato sono immessi sul mercato o messi in servizio. I rischi individuati durante la valutazione del rischio dovrebbero comprendere i rischi che potrebbero manifestarsi durante il ciclo di vita del prodotto in ragione di un'evoluzione prevista del suo comportamento affinché operi con livelli diversi di autonomia.
(33) La sicurezza dell'intera macchina o dell'intero prodotto correlato si basa sulle dipendenze e sulle interazioni tra i suoi componenti, comprese le quasi-macchine e, ove pertinente, con altre macchine o altri prodotti correlati che partecipano alla costituzione di un insieme coordinato di un sistema di macchine, che può anche avere come risultato un insieme di macchine. Di conseguenza i fabbricanti dovrebbero essere tenuti a considerare tutte tali interazioni nella valutazione del rischio.
(34) È essenziale che, prima della redazione della dichiarazione di conformità UE o della dichiarazione di incorporazione UE, il fabbricante prepari una documentazione tecnica. Il fabbricante dovrebbe essere tenuto a rendere tale documentazione tecnica disponibile alle autorità nazionali su richiesta o agli organismi notificati nel contesto della pertinente procedura di valutazione della conformità. I disegni dettagliati dei sottoinsiemi utilizzati per la fabbricazione del prodotto che rientra nell'ambito di applicazione del presente regolamento dovrebbero essere richiesti come parte della documentazione tecnica soltanto quando la conoscenza di tali disegni è essenziale per valutare la conformità rispetto ai requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento.
(35) Una persona che fabbrica macchine o prodotti correlati per uso proprio è considerata un fabbricante e dovrebbe essere tenuta ad adempiere tutti i relativi obblighi. In tal caso, la macchina o il prodotto correlato non sono immessi sul mercato, poiché il fabbricante non li mette a disposizione di un'altra persona, ma sono utilizzati dal fabbricante stesso. Tuttavia, tali macchine devono essere conformi al presente regolamento prima della loro messa in servizio.
(36) Occorre garantire che i prodotti rientranti nell'ambito di applicazione del presente regolamento provenienti da paesi terzi che entrano nel mercato dell'Unione siano conformi ai requisiti del presente regolamento e non presentino un rischio per la salute e la sicurezza delle persone, in particolare dei consumatori e degli utilizzatori professionali, nonché, all’occorrenza, degli animali domestici e dei beni e, se del caso, per l'ambiente, così come, in particolare, che le opportune procedure di valutazione della conformità siano state effettuate dai fabbricanti per quanto riguarda tali prodotti. È pertanto opportuno prevedere che gli importatori debbano garantire che i prodotti rientranti nell'ambito di applicazione del presente regolamento da essi immessi sul mercato siano conformi ai requisiti del presente regolamento e non presentino un rischio per la salute e la sicurezza delle persone nonché, all’occorrenza, degli animali domestici e per la tutela dei beni e, se del caso, per l'ambiente. Per lo stesso motivo è altresì opportuno prevedere che gli importatori si assicurino che siano state eseguite procedure di valutazione della conformità e che la marcatura CE, nel caso di macchine e prodotti correlati, sia apposta, e che la documentazione tecnica predisposta dai fabbricanti sia disponibile per ispezioni da parte delle autorità nazionali competenti.
(37) All'atto dell'immissione sul mercato dei prodotti rientranti nell'ambito di applicazione del presente regolamento, gli importatori dovrebbero indicare su tali prodotti il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, gli indirizzi postali, i siti internet, gli indirizzi di posta elettronica o altri contatti digitali e ai quali possono essere contattati. È opportuno prevedere eccezioni se le dimensioni o la natura del prodotto non consentono quanto sopra. Tra le eccezioni è compreso il caso in cui gli importatori sarebbero costretti ad aprire l'imballaggio per apporre il proprio nome e indirizzo sul prodotto.
(38) Il distributore che mette a disposizione sul mercato prodotti rientranti nell'ambito di applicazione del presente regolamento dopo l'immissione sul mercato degli stessi a opera del fabbricante o dell'importatore, dovrebbe agire con la dovuta attenzione per assicurarsi che, manipolando il prodotto rientrante nell'ambito di applicazione del presente regolamento, non ne comprometta la conformità ai requisiti stabiliti nel presente regolamento.
(39) Al fine di assicurare la salute e la sicurezza degli utilizzatori dei prodotti rientranti nell'ambito di applicazione del presente regolamento, gli operatori economici dovrebbero provvedere affinché tutta la documentazione pertinente, quali le istruzioni per l'uso, contenga informazioni precise e comprensibili e sia al contempo disponibile in una lingua facilmente comprensibile dagli utilizzatori, come stabilito dallo Stato membro interessato, tenga conto degli sviluppi tecnologici e delle variazioni del comportamento dell'utilizzatore, e sia il più possibile aggiornata. Nel caso in cui i prodotti rientranti nell'ambito di applicazione del presente regolamento siano messi a disposizione sul mercato in confezioni contenenti varie unità, le istruzioni e le informazioni dovrebbero accompagnare l'unità minima disponibile in commercio.
(40) Le istruzioni e altra documentazione pertinente possono essere forniti in formato digitale stampabile. Tuttavia, il fabbricante dovrebbe provvedere affinché i distributori possano fornire gratuitamente, su richiesta dell'utilizzatore al momento dell'acquisto, le istruzioni per l'uso in formato cartaceo. Il fabbricante dovrebbe inoltre prendere in considerazione la possibilità di fornire i dati di contatto a cui l'utilizzatore possa richiedere che le istruzioni gli siano inviate per posta.
(41) I distributori e gli importatori, vista la loro prossimità al mercato, dovrebbero essere coinvolti nei compiti di vigilanza del mercato svolti dalle autorità nazionali competenti e dovrebbero essere pronti a parteciparvi attivamente, fornendo a tali autorità tutte le informazioni necessarie sui prodotti in questione rientranti nell'ambito di applicazione del presente regolamento.
(42) L'operatore economico che immette sul mercato prodotti rientranti nell'ambito di applicazione del presente regolamento con il proprio nome o marchio commerciale oppure che modifica prodotti rientranti nell'ambito di applicazione del presente regolamento in modo tale che la loro conformità ai requisiti del presente regolamento possa risultare compromessa dovrebbe essere considerato il fabbricante di tali prodotti e assumersi i relativi obblighi.
(43) Garantire la tracciabilità dei prodotti rientranti nell'ambito di applicazione del presente regolamento lungo l'intera catena di approvvigionamento consente una vigilanza del mercato più semplice ed efficiente. Gli operatori economici dovrebbero pertanto essere tenuti a conservare per un certo periodo le informazioni sulle operazioni da loro effettuate aventi per oggetto prodotti rientranti nell'ambito di applicazione del presente regolamento. Tale obbligo dovrebbe tuttavia essere proporzionato al ruolo di ciascun operatore economico nella catena di approvvigionamento e gli operatori economici non dovrebbero essere tenuti ad aggiornare informazioni che non hanno originato
(44) Il presente regolamento dovrebbe limitarsi a definire i requisiti essenziali di sicurezza e di tutela della salute, integrati da una serie di requisiti più specifici per talune categorie di prodotti rientranti nell'ambito di applicazione del presente regolamento. Al fine di agevolare la valutazione della conformità rispetto a tali requisiti di sicurezza e tutela della salute, è necessario prevedere una presunzione di conformità per i prodotti rientranti nell'ambito di applicazione del presente regolamento che sono conformi alle norme armonizzate che vengono elaborate e i cui riferimenti sono pubblicati nella Gazzetta ufficiale dell'Unione europea conformemente al regolamento (UE) n. 1025/2012 del Parlamento europeo e del Consiglio, al fine della formulazione di specifiche tecniche dettagliate in relazione a tali requisiti.
(45) L'attuale quadro di normazione dell'UE, che si basa sui principi della nuova strategia stabiliti nella risoluzione del Consiglio, del 7 maggio 1985, relativa ad una nuova strategia in materia di armonizzazione tecnica e normalizzazione e sul regolamento (UE) n. 1025/2012, rappresenta il quadro predefinito per l'elaborazione di norme che prevedano una presunzione di conformità per i pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui al presente regolamento. Le norme europee dovrebbero essere orientate al mercato, tenere conto dell'interesse pubblico nonché degli obiettivi politici chiaramente affermati nella richiesta rivolta dalla Commissione a una o più organizzazioni europee di normazione di elaborare norme armonizzate entro un termine stabilito, e dovrebbero basarsi sul consenso. Tuttavia, in assenza di riferimenti pertinenti a norme armonizzate, la Commissione dovrebbe essere in grado di adottare atti di esecuzione che stabiliscono specifiche comuni per i requisiti essenziali di sicurezza e di tutela della salute del presente regolamento, a condizione che nel farlo rispetti debitamente il ruolo e le funzioni delle organizzazioni di normazione, quale soluzione eccezionale di ripiego per facilitare l'obbligo del fabbricante di rispettare tali requisiti di sicurezza e di tutela della salute, quando il processo di normazione è bloccato o quando vi sono ritardi nella definizione di norme armonizzate appropriate. Se tale ritardo è dovuto alla complessità tecnica della norma in questione, la Commissione dovrebbe tenerne conto prima di prendere in considerazione la definizione di specifiche comuni.
(46) Al fine di stabilire, nel modo più efficiente possibile, specifiche comuni che contemplino i requisiti essenziali di sicurezza e di tutela della salute di cui al presente regolamento, la Commissione dovrebbe coinvolgere nel procedimento le parti interessate.
(47) Per periodo ragionevole si dovrebbe intendere, in relazione alla pubblicazione del riferimento alle norme armonizzate nella Gazzetta ufficiale dell'Unione europea a norma del regolamento (UE) n. 1025/2012, un periodo durante il quale è prevista la pubblicazione nella Gazzetta ufficiale dell'Unione europea del riferimento alla norma, alla sua rettifica o alla sua modifica e che non dovrebbe superare un anno dal termine per l'elaborazione di un insieme di norme europee fissato in conformità del regolamento (UE) n. 1025/2012.
(48) Il rispetto delle norme armonizzate e delle specifiche comuni stabilite dalla Commissione dovrebbe essere volontario. Soluzioni tecniche alternative dovrebbero pertanto essere accettabili laddove la conformità dei prodotti rientranti nell'ambito di applicazione del presente regolamento rispetto ai requisiti essenziali di sicurezza e di tutela della salute sia dimostrata nel fascicolo tecnico.
(49) I requisiti essenziali di sicurezza e di tutela della salute dovrebbero essere soddisfatti al fine di garantire che il prodotto rientrante nell'ambito di applicazione del presente regolamento sia sicuro. Tali requisiti dovrebbero essere applicati con discernimento, tenendo conto dello stato dell'arte al momento della costruzione e delle esigenze tecniche ed economiche.
(50) Il regolamento (UE) n. 1025/2012 prevede una procedura riguardante le obiezioni alle norme armonizzate qualora queste ultime non soddisfino o non soddisfino completamente i requisiti di cui al presente regolamento.
(51) Al fine di affrontare i rischi derivanti dalle azioni dolose di terzi che incidono sulla sicurezza dei prodotti rientranti nell'ambito di applicazione del presente regolamento, il presente regolamento dovrebbe comprendere requisiti essenziali di sicurezza e di tutela della salute in relazione ai quali può, nella misura adeguata, sussistere una presunzione di conformità a seguito dell’emissione di un certificato o di una dichiarazione di conformità nell’ambito di un pertinente sistema di certificazione della cibersicurezza adottato conformemente al regolamento (UE) 2019/881 del Parlamento europeo e del Consiglio.
(52) I fabbricanti dovrebbero redigere una dichiarazione di conformità UE per fornire informazioni sulla conformità al presente regolamento delle macchine o dei prodotti correlati. I fabbricanti possono altresì essere tenuti, ai sensi di altri atti giuridici dell'Unione, a redigere una dichiarazione di conformità UE. Al fine di garantire un accesso efficace alle informazioni per fini di vigilanza del mercato, dovrebbe essere redatta un'unica dichiarazione di conformità UE in relazione a tutti gli atti giuridici dell'Unione. Per ridurre l'onere amministrativo a carico degli operatori economici, tale dichiarazione di conformità UE unica dovrebbe poter consistere in un fascicolo comprendente le dichiarazioni di conformità individuali pertinenti.
(53) Le norme armonizzate attinenti al presente regolamento dovrebbero tenere conto dei requisiti della direttiva (UE) 2019/882 del Parlamento europeo e del Consiglio e della Convenzione delle Nazioni Unite sui diritti delle persone con disabilità.
(54) L'elenco di prodotti di cui all'allegato IV della direttiva 2006/42/CE si è fondato sinora sul rischio derivante dall'uso previsto o da qualsiasi uso scorretto ragionevolmente prevedibile di tali prodotti o dalla loro funzione protettiva essenziale. Ciò nonostante il settore delle macchine accoglie modi nuovi di progettare e costruire macchine o prodotti correlati che potrebbero presentare fattori di rischio più elevati, indipendentemente da tale uso previsto o da qualsiasi uso scorretto ragionevolmente prevedibile. Ad esempio, i sistemi con comportamento evolutivo che garantiscono funzioni di sicurezza dovrebbero essere inclusi nell'allegato I a causa delle loro caratteristiche quali la dipendenza dai dati, l'opacità, l'autonomia e la connettività, che potrebbero aumentare considerevolmente la probabilità e la gravità del danno e compromettere gravemente la sicurezza della macchina o del prodotto correlato. Pertanto, la valutazione della conformità di un componente di sicurezza o di un sistema con comportamento evolutivo che garantisce funzioni di sicurezza dovrebbe essere effettuata da terzi, indipendentemente dal fatto che il componente di sicurezza sia stato immesso sul mercato in modo indipendente o sia parte di un sistema incorporato in una macchina immessa sul mercato. Tuttavia, se una macchina incorpora un sistema il cui componente di sicurezza è già stato sottoposto a una valutazione della conformità da parte di terzi al momento della sua immissione sul mercato in modo indipendente, tale macchina non dovrebbe essere nuovamente certificata da terzi unicamente sulla base dell'incorporazione di tale sistema.
(55) Le disposizioni relative alla valutazione della conformità da parte di terzi del software che garantisce le funzioni di sicurezza stabilite nel presente regolamento dovrebbero applicarsi solo ai sistemi con un comportamento evolutivo integrale o parziale utilizzando approcci di apprendimento automatico che garantiscono funzioni di sicurezza. Al contrario, tali disposizioni non dovrebbero essere applicate ai software incapaci di apprendere o evolvere e che sono programmati esclusivamente per l'esecuzione di alcune funzioni automatizzate delle macchine o dei prodotti correlati.
(56) La marcatura CE, che indica la conformità di un prodotto, è la conseguenza visibile di un intero processo che comprende la valutazione della conformità in senso lato. I principi generali che disciplinano la marcatura CE sono stabiliti nel regolamento (CE) n. 765/2008. È opportuno che nel presente regolamento siano stabilite le norme relative all'apposizione della marcatura CE sulle macchine o sui prodotti correlati.
(57) La marcatura CE dovrebbe essere l'unica marcatura che garantisce la conformità delle macchine o dei prodotti correlati ai requisiti del presente regolamento. Gli Stati membri dovrebbero pertanto intraprendere azioni adeguate per quanto concerne altre marcature che potrebbero indurre in errore terzi in merito al significato o alla forma della marcatura CE.
(58) Per consentire agli operatori economici di dimostrare, e alle autorità competenti di garantire, che le macchine o i prodotti correlati messi a disposizione sul mercato sono conformi ai requisiti essenziali di sicurezza e di tutela della salute, è necessario prevedere procedure di valutazione della conformità. La decisione n. 768/2008/CE contiene una serie di moduli per le procedure di valutazione della conformità, che vanno dalla procedura meno severa a quella più severa con un rigore proporzionale al livello di rischio effettivo e di sicurezza richiesto. Per garantire la coerenza intersettoriale ed evitare varianti ad hoc, è opportuno che le procedure di valutazione della conformità siano scelte tra tali moduli.
(59) È opportuno che la responsabilità di garantire l'effettuazione di una valutazione della conformità delle macchine o dei prodotti correlati a norma del presente regolamento spetti ai rispettivi fabbricanti. Tuttavia, per determinate categorie di macchine o prodotti correlati che presentano un fattore di rischio più elevato, è necessario richiedere una procedura di valutazione della conformità più rigorosa che comporta la partecipazione di un organismo notificato.
(60) È indispensabile che tutti gli organismi notificati svolgano le proprie funzioni allo stesso livello e in condizioni di concorrenza leale. A tal fine è necessario stabilire requisiti obbligatori da applicare agli organismi di valutazione della conformità che desiderano essere notificati per fornire servizi di valutazione della conformità.
(61) Quando un organismo di valutazione della conformità dimostra la conformità ai criteri fissati nelle norme armonizzate, si dovrebbe presumere che sia conforme ai corrispondenti requisiti stabiliti nel presente regolamento.
(62) Per garantire un livello uniforme di qualità nello svolgimento della valutazione della conformità delle macchine o dei prodotti correlati, è altresì necessario stabilire requisiti da applicare alle autorità di notifica e agli altri organismi che intervengono nella valutazione, nella notifica e nel controllo degli organismi notificati.
(63) Il sistema stabilito nel presente regolamento dovrebbe essere integrato dal sistema di accreditamento previsto dal regolamento (CE) n. 765/2008. Poiché l'accreditamento è un mezzo essenziale per la verifica della competenza degli organismi di valutazione della conformità, è opportuno impiegarlo anche ai fini della notifica.
(64) L'accreditamento trasparente, quale previsto dal regolamento (CE) n. 765/2008, che garantisce il necessario livello di fiducia nei certificati di conformità, dovrebbe essere considerato lo strumento preferito per dimostrare la competenza tecnica di tali organismi da parte delle autorità pubbliche nazionali in tutta l'Unione. Tuttavia, le autorità nazionali possono ritenere di possedere i mezzi adeguati per effettuare esse stesse tale valutazione. In tali casi, al fine di garantire l’adeguato livello di credibilità delle valutazioni effettuate da altre autorità nazionali, esse dovrebbero fornire alla Commissione e agli altri Stati membri le necessarie prove documentali che dimostrino che gli organismi di valutazione della conformità oggetto della valutazione soddisfano i pertinenti requisiti normativi.
(65) Spesso gli organismi di valutazione della conformità subappaltano parti delle loro attività connesse alla valutazione della conformità o fanno ricorso ad un'affiliata. Al fine di salvaguardare il livello di tutela richiesto per le macchine o prodotti correlati da immettere sul mercato, è indispensabile che i subappaltatori e le affiliate che eseguono la valutazione della conformità soddisfino gli stessi requisiti applicati agli organismi notificati in relazione allo svolgimento di compiti di valutazione della conformità. È pertanto importante che la valutazione della competenza e delle prestazioni degli organismi da notificare e la sorveglianza degli organismi già notificati siano estese anche alle attività eseguite dai subappaltatori e dalle affiliate.
(66) Poiché gli organismi notificati possono offrire i propri servizi in tutta l'Unione, è opportuno conferire agli altri Stati membri e alla Commissione la possibilità di sollevare obiezioni relative a un organismo notificato. È pertanto importante prevedere un periodo durante il quale sia possibile chiarire eventuali dubbi o preoccupazioni circa la competenza degli organismi di valutazione della conformità prima che essi inizino ad operare in qualità di organismi notificati.
(67) Nell'interesse della competitività, è fondamentale che gli organismi notificati applichino le procedure di valutazione della conformità senza creare oneri superflui per gli operatori economici. Analogamente, e per garantire parità di trattamento agli operatori economici, dovrebbe essere garantita un'applicazione tecnica coerente delle procedure di valutazione della conformità. Ciò può essere più agevolmente conseguito mediante un coordinamento e una cooperazione adeguati tra organismi notificati.
(68) La vigilanza del mercato è un'attività essenziale per garantire l'applicazione corretta ed uniforme del diritto dell'Unione. È pertanto opportuno istituire un quadro giuridico entro il quale la vigilanza del mercato possa essere svolta in maniera adeguata per quanto riguarda i prodotti rientranti nell'ambito di applicazione del presente regolamento.
(69) Gli Stati membri dovrebbero adottare tutti i provvedimenti opportuni per assicurare che le macchine e i prodotti correlati rientranti nell'ambito di applicazione del presente regolamento possano essere immessi sul mercato o messi in servizio soltanto se, adeguatamente installati, sottoposti a manutenzione e utilizzati conformemente ai fini cui sono destinati, o in condizioni d'impiego ragionevolmente prevedibili, non pregiudicano la salute o la sicurezza delle persone, in particolare dei consumatori e degli utilizzatori professionali, nonché, ove opportuno, degli animali domestici nonché la tutela dei beni e, se del caso, dell'ambiente. In particolare, la corretta installazione di macchine per il sollevamento è fondamentale per garantire la conformità ai requisiti essenziali di sicurezza e di tutela della salute. Le macchine e i prodotti correlati rientranti nell'ambito di applicazione del presente regolamento dovrebbero essere considerati non conformi ai requisiti essenziali di sicurezza e di tutela della salute stabiliti dal presente regolamento soltanto in condizioni di impiego che potrebbero derivare da un comportamento umano legittimo e facilmente prevedibile.
(70) Nel quadro di tale vigilanza del mercato dovrebbe essere stabilita una netta distinzione tra la contestazione di una norma armonizzata o di specifiche comuni che conferiscono una presunzione di conformità a prodotti rientranti nell'ambito di applicazione del presente regolamento e la clausola di salvaguardia relativa a prodotti rientranti nell'ambito di applicazione del presente regolamento.
(71) La direttiva 2006/42/CE prevede già una procedura di salvaguardia, che è necessaria per consentire la possibilità di contestare la conformità di prodotti rientranti nell'ambito di applicazione del presente regolamento. Per aumentare la trasparenza e ridurre i tempi procedurali, è necessario migliorare la procedura di salvaguardia esistente al fine di aumentarne l'efficienza e avvalersi delle conoscenze disponibili negli Stati membri.
(72) È opportuno integrare la procedura di salvaguardia esistente con una procedura in base alla quale le parti interessate sono informate delle misure di cui è prevista l'adozione in relazione ai prodotti rientranti nell'ambito di applicazione del presente regolamento che presentano un rischio per la salute o la sicurezza delle persone nonché, ove opportuno, degli animali domestici e dei beni e, se del caso, per l'ambiente. Tale procedura dovrebbe consentire alle autorità di vigilanza del mercato, in cooperazione con gli operatori economici interessati, di intervenire in una fase più precoce per quanto riguarda tali prodotti.
(73) Nei casi in cui gli Stati membri e la Commissione concordino sul fatto che una misura adottata da uno Stato membro sia giustificata, non dovrebbero essere previsti ulteriori interventi da parte della Commissione, tranne qualora la non conformità possa essere attribuita a lacune in una norma armonizzata o in specifiche comuni.
(74) Al fine di tener conto dei progressi e delle conoscenze in ambito tecnico o dei nuovi dati scientifici e di assicurare un livello sufficiente di disponibilità dei dati, è opportuno delegare alla Commissione il potere di adottare atti conformemente all'articolo 290 del trattato sul funzionamento dell'Unione europea riguardo alla modifica dell'elenco delle categorie di macchine o prodotti correlati nell’allegato I e dell'elenco indicativo dei componenti di sicurezza nell'allegato II e, se necessario, all'integrazione degli obblighi incombenti agli Stati membri di fornire i dati e le informazioni sulle categorie di macchine o prodotti correlati soggetti a una specifica procedura di valutazione della conformità attraverso l'elaborazione di una metodologia comune. Qualora una nuova categoria di macchine o prodotti correlati sia aggiunta all'elenco nell'allegato I, la Commissione dovrebbe garantire che agli operatori economici sia concesso il tempo sufficiente per adempiere i propri obblighi ai sensi del presente regolamento. È di particolare importanza che durante i lavori preparatori la Commissione svolga adeguate consultazioni, anche con le pertinenti parti interessate, nel rispetto dei principi stabiliti nell'accordo interistituzionale "Legiferare meglio" del 13 aprile 2016. In particolare, al fine di garantire la parità di partecipazione alla preparazione degli atti delegati, il Parlamento europeo e il Consiglio ricevono tutti i documenti contemporaneamente agli esperti degli Stati membri, e i loro esperti hanno sistematicamente accesso alle riunioni dei gruppi di esperti della Commissione incaricati della preparazione di tali atti delegati.
(75) Al fine di garantire condizioni uniformi di esecuzione del presente regolamento, è opportuno attribuire alla Commissione competenze di esecuzione per la definizione di un modello uniforme per la raccolta di dati e di informazioni ai fini dell'aggiunta di una categoria di macchine o di prodotti correlati all'allegato I o dell’eliminazione di una categoria di macchine o di prodotti correlati dall'allegato I, per la definizione di specifiche comuni per i requisiti essenziali di sicurezza e di tutela della salute di cui all’allegato III, per richiedere allo Stato membro notificante di adottare le misure correttive necessarie in relazione a un organismo notificato che non soddisfa i requisiti per la sua notifica, e per stabilire se una misura nazionale concernente prodotti rientranti nell’ambito di applicazione del presente regolamento conformi che uno Stato membro ritiene presentino un rischio per la salute e la sicurezza delle persone, in particolare dei consumatori e degli utilizzatori professionali o, all’occorrenza degli animali domestici nonché per la tutela dei beni o, se del caso, dell’ambiente, sia giustificata. È altresì opportuno che tali competenze siano esercitate conformemente al regolamento (UE) n. 182/2011 del Parlamento europeo e del Consiglio.
(76) Al fine di facilitare la corretta attuazione del presente regolamento, nell'adottare gli atti di esecuzione che definiscono o aggiornano un modello riguardante la raccolta, da parte degli Stati membri, di dati e di informazioni sugli infortuni o sui danni alla salute causati da macchine o prodotti correlati, la Commissione dovrebbe pubblicare orientamenti relativi alla raccolta e alla trasmissione di dati e di informazioni comparabili e di elevata qualità.
(77) Ove sussistano, in casi debitamente giustificati connessi alla protezione della salute o alla sicurezza delle persone, imperativi motivi di urgenza, è opportuno che la Commissione adotti atti di esecuzione immediatamente applicabili che determinino se una misura nazionale adottata nei confronti di prodotti conformi rientranti nell'ambito di applicazione del presente regolamento che presentano un rischio sia giustificata o meno.
(78) In linea con la prassi consolidata, il comitato istituito a norma del presente regolamento può svolgere un ruolo utile esaminando le questioni concernenti l'applicazione del regolamento stesso che possono essere sollevate dal suo presidente o dal rappresentante di uno Stato membro in conformità del suo regolamento interno.
(79) Ogniqualvolta questioni relative al presente regolamento, ad eccezione della sua attuazione o di sue violazioni sono esaminate in un gruppo di esperti della Commissione, il Parlamento europeo dovrebbe ricevere, in linea con la prassi corrente, tutte le informazioni e la documentazione, nonché, ove opportuno, l'invito a partecipare a tali riunioni.
(80) La Commissione dovrebbe determinare mediante atti di esecuzione e, in virtù della loro natura speciale, senza applicare il regolamento (UE) n. 182/2011, se le misure adottate dagli Stati membri nei confronti di prodotti non conformi rientranti nell'ambito di applicazione del presente regolamento siano giustificate o meno.
(81) La tracciabilità dei dati sulle macchine richiesta per il fascicolo tecnico e per fini di vigilanza del mercato dovrebbe essere conforme alle norme in materia di riservatezza per tutelare i fabbricanti.
(82) Gli Stati membri dovrebbero stabilire norme relative alle sanzioni applicabili in caso di violazione del presente regolamento ed assicurarne l'attuazione. Le sanzioni previste dovrebbero essere efficaci, proporzionate e dissuasive.
(83) Poiché l'obiettivo del presente regolamento, ossia garantire che i prodotti rientranti nell'ambito di applicazione del presente regolamento immessi sul mercato soddisfino i requisiti offrendo un livello elevato di tutela della salute e di sicurezza delle persone nonché, ove opportuno, degli animali domestici nonché la tutela dei beni e, se del caso, dell'ambiente, assicurando nel contempo il funzionamento del mercato interno, non può essere conseguito in misura sufficiente dagli Stati membri ma, a motivo della necessità di armonizzazione, può essere conseguito meglio a livello di Unione, quest'ultima può intervenire in base al principio di sussidiarietà sancito dall'articolo 5 del trattato sull'Unione europea. Il presente regolamento si limita a quanto è necessario per conseguire tale obiettivo in ottemperanza al principio di proporzionalità enunciato nello stesso articolo.
(84) Includendo nel proprio ambito di applicazione le macchine e gli accessori di sollevamento e le catene e le funi, la direttiva 2006/42/CE ha completamente sostituito la direttiva 73/361/CEE del Consiglio. È pertanto opportuno abrogare la direttiva 73/361/CEE del Consiglio.
(85) La direttiva 2006/42/CE è stata modificata più volte. Essendo necessarie ulteriori modifiche sostanziali e al fine di garantire un'attuazione uniforme delle norme sui prodotti rientranti nell'ambito di applicazione del presente regolamento in tutta l'Unione, è opportuno abrogare la direttiva 2006/42/CE.
(86) È necessario prevedere un periodo sufficiente affinché gli operatori economici adempiano i loro obblighi ai sensi del presente regolamento e affinché gli Stati membri istituiscano le infrastrutture amministrative necessarie all'applicazione del medesimo. L'applicazione del presente regolamento dovrebbe pertanto essere differita,
HANNO ADOTTATO IL PRESENTE REGOLAMENTO:
CAPO I DISPOSIZIONI GENERALI
Articolo 1 Oggetto
Il presente regolamento stabilisce i requisiti di sicurezza e di tutela della salute per la progettazione e la costruzione di macchine, prodotti correlati e quasi-macchine al fine di consentire la loro messa a disposizione sul mercato o la loro messa in servizio, garantendo al contempo un livello elevato di tutela della salute e di sicurezza delle persone, in particolare dei consumatori e degli utilizzatori professionali, e, ove opportuno, degli animali domestici nonché di tutela dei beni e, se del caso, dell'ambiente. Esso stabilisce inoltre norme concernenti la libera circolazione dei prodotti rientranti nell'ambito di applicazione del presente regolamento nell'Unione.
Articolo 2 Ambito di applicazione
1. Il presente regolamento si applica alle macchine e ai prodotti correlati seguenti:
a) attrezzature intercambiabili;
b) componenti di sicurezza;
c) accessori di sollevamento;
d) catene, funi e cinghie;
e) dispositivi amovibili di trasmissione meccanica.
Il presente regolamento si applica altresì alle quasi-macchine.
Ai fini del presente regolamento, le macchine, i prodotti correlati elencati nel primo comma e le quasi-macchine sono indicati come "prodotti rientranti nell'ambito di applicazione del presente regolamento".
2. Il presente regolamento non si applica a quanto segue:
a) i componenti di sicurezza destinati ad essere utilizzati come pezzi di ricambio in sostituzione di componenti identici e forniti dal fabbricante della macchina originaria, del prodotto correlato o della quasi-macchina;
b) le attrezzature specifiche per parchi giochi o di divertimento;
c) le macchine e i prodotti correlati specificamente progettati per essere utilizzati o che sono utilizzati all'interno di un impianto nucleare e la cui conformità al presente regolamento può compromettere la sicurezza nucleare dell'impianto in questione;
d) le armi, incluse le armi da fuoco;
e) i mezzi di trasporto per via aerea, per via navigabile o su rete ferroviaria, fatta eccezione per le macchine installate su tali mezzi di trasporto;
f) i prodotti aeronautici, le parti e gli equipaggiamenti che rientrano nell'ambito di applicazione del regolamento (UE) 2018/1139 del Parlamento europeo e del Consiglio e nella definizione di macchine ai sensi del presente regolamento, nella misura in cui il regolamento (UE) 2018/1139 disciplina i pertinenti requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento;
g) i veicoli a motore e i relativi rimorchi, nonché i sistemi, i componenti, le unità tecniche separate, le parti e le attrezzature progettate e costruite per tali veicoli, che rientrano nell'ambito di applicazione del regolamento (UE) 2018/858, fatta eccezione per le macchine installate su tali veicoli;
h) i veicoli a due o tre ruote e i quadricicli, nonché i sistemi, i componenti, le entità tecniche indipendenti, le parti e gli equipaggiamenti progettati e costruiti per tali veicoli, che rientrano nell'ambito di applicazione del regolamento (UE) n. 168/2013, fatta eccezione per le macchine installate su tali veicoli;
i) i trattori agricoli e forestali, nonché i sistemi, i componenti, le entità tecniche indipendenti, le parti e gli equipaggiamenti progettati e costruiti per tali trattori, che rientrano nell'ambito di applicazione del regolamento (UE) n. 167/2013, fatta eccezione per le macchine installate su tali trattori;
j) i veicoli a motore esclusivamente da competizione;
k) le navi marittime e le unità mobili off-shore, nonché le macchine installate a bordo di tali navi o unità;
l) le macchine o i prodotti correlati appositamente progettati e costruiti a fini militari o di mantenimento dell'ordine pubblico;
m) le macchine o i prodotti correlati appositamente progettati e costruiti a fini di ricerca per essere temporaneamente utilizzati nei laboratori;
n) gli ascensori utilizzati nei pozzi delle miniere;
o) le macchine o i prodotti correlati adibiti allo spostamento di artisti durante le rappresentazioni;
p) i seguenti prodotti elettrici ed elettronici, nella misura in cui rientrano nell'ambito della direttiva 2014/35/UE o della direttiva 2014/53/UE:
i) elettrodomestici destinati a uso domestico che non sono mobili azionati elettricamente;
ii) apparecchiature audio e video;
iii) apparecchiature nel settore delle tecnologie dell'informazione;
iv) macchine ordinarie da ufficio, fatta eccezione per le macchine per la stampa additiva per realizzare prodotti tridimensionali;
v) apparecchiature di collegamento e di controllo a bassa tensione;
vi) motori elettrici;
q) i prodotti elettrici ad alta tensione seguenti:
i) apparecchiature di collegamento e di controllo;
ii) trasformatori.
Articolo 3 Definizioni
Ai fini del presente regolamento si applicano le definizioni seguenti:
1) "macchina":
a) insieme equipaggiato o destinato a essere equipaggiato di un sistema di azionamento diverso dalla forza umana o animale diretta, composto di parti o di componenti, di cui almeno uno mobile, collegati tra loro solidamente per un'applicazione ben determinata;
b) insieme di cui alla lettera a), al quale mancano solamente elementi di collegamento al sito di impiego o di allacciamento alle fonti di energia e di movimento;
c) insieme di cui alle lettere a) e b), pronto per essere installato e che può funzionare solo dopo essere stato montato su un mezzo di trasporto o installato in un edificio o in una costruzione;
d) insiemi di macchine di cui alle lettere a), b) e c) o di quasi-macchine, che per raggiungere uno stesso risultato sono disposti e comandati in modo da avere un funzionamento solidale;
e) insieme di parti o di componenti, di cui almeno uno mobile, collegati tra loro solidalmente e destinati al sollevamento di pesi e la cui unica fonte di energia è la forza umana diretta;
f) insieme di cui alle lettere da a) ad e) al quale manca soltanto il caricamento del software destinato all'applicazione specifica prevista dal fabbricante;
2) "attrezzatura intercambiabile": dispositivo che, dopo la messa in servizio di una macchina o di un trattore agricolo o forestale, è assemblato a tale macchina o a tale trattore agricolo o forestale dall'operatore al fine di modificarne la funzione o apportarne una nuova funzione, a condizione che tale attrezzatura non sia un utensile;
3) "componente di sicurezza": un componente fisico o digitale, compreso un software, di un prodotto rientrante nell'ambito di applicazione del presente regolamento, che è progettato o destinato ad espletare una funzione di sicurezza e che è immesso sul mercato separatamente, il cui guasto o malfunzionamento mette a repentaglio la sicurezza delle persone, ma che non è indispensabile per il funzionamento di tale prodotto, o per il quale componenti normali possono essere sostituiti per il funzionamento di tale prodotto;
4) "funzione di sicurezza": una funzione che serve a soddisfare una misura di protezione destinata a eliminare o, se ciò non è possibile, a ridurre un rischio, e che, se ha un guasto potrebbe comportare un aumento di tale rischio;
5) "accessori di sollevamento": componenti o attrezzature, non collegati alle macchine per il sollevamento, che consentono la presa del carico, disposti tra la macchina e il carico oppure sul carico stesso, oppure destinati a divenire parte integrante del carico e ad essere immessi sul mercato separatamente, comprese imbracature e loro componenti;
6) "catene": catene progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
7) "funi": funi progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
8) "cinghie": cinghie progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
9) "dispositivo amovibile di trasmissione meccanica": componente amovibile destinato alla trasmissione di potenza tra macchine semoventi o un trattore e altre macchine o prodotti correlati, mediante collegamento al primo supporto fisso; quando è immesso sul mercato munito di riparo, il dispositivo e il riparo vanno considerati come un unico articolo;
10) "quasi-macchine": un insieme che non costituisce ancora una macchina in quanto, da solo, non è in grado di eseguire un'applicazione specifica e che è soltanto destinato a essere incorporato o assemblato ad altre macchine o ad altre quasi-macchine o apparecchi per costituire una macchina;
11) "messa a disposizione sul mercato": la fornitura di un prodotto rientrante nell'ambito di applicazione del presente regolamento affinché sia distribuito o usato sul mercato dell'Unione nel corso di un'attività commerciale, a titolo oneroso o gratuito;
12) "immissione sul mercato": la prima messa a disposizione di un prodotto rientrante nell'ambito di applicazione del presente regolamento sul mercato dell'Unione;
13) "messa in servizio": il primo utilizzo, conforme alla sua destinazione, di macchine o di prodotti correlati nell'Unione;
14) "requisiti essenziali di sicurezza e di tutela della salute": le disposizioni obbligatorie, di cui all'allegato III, relative alla progettazione e alla costruzione di prodotti rientranti nell'ambito di applicazione del presente regolamento, intese ad assicurare un livello elevato di tutela della salute e di sicurezza delle persone e, ove opportuno, degli animali domestici nonché di tutela dei beni e, se del caso, dell'ambiente.
15) "normativa di armonizzazione dell'Unione": la normativa dell'Unione che armonizza le condizioni di commercializzazione dei prodotti;
16) "modifica sostanziale": una modifica di una macchina o di un prodotto correlato, mediante mezzi fisici o digitali dopo che tale macchina o prodotto correlato è stato immesso sul mercato o messo in servizio, che non è prevista né pianificata dal fabbricante, e che incide sulla sicurezza della macchina o del prodotto correlato creando un nuovo pericolo o aumentando un rischio esistente, che richiede:
a) l'aggiunta di ripari o di dispositivi di protezione alla macchina o al prodotto correlato, operazione che necessita la modifica del sistema di controllo della sicurezza esistente, o
b) l'adozione di misure di protezione supplementari per garantire la stabilità o la resistenza meccanica di tale macchina o prodotto correlato;
17) "istruzioni per l'uso": le informazioni fornite dal fabbricante quando la macchina o il prodotto correlato è immesso sul mercato o messo in servizio, al fine di informare l'utilizzatore della macchina o del prodotto correlato in merito all'uso previsto e corretto di tale macchina o prodotto correlato, nonché le informazioni in merito a eventuali precauzioni da adottare quando si utilizza o si installa la macchina o il prodotto correlato, comprese le informazioni sul mantenimento della sicurezza e dell'idoneità della macchina o del prodotto correlato per il suo intero ciclo di vita;
18) "fabbricante": qualsiasi persona fisica o giuridica che:
a) fabbrichi prodotti rientranti nell'ambito di applicazione del presente regolamento o che faccia progettare o fabbricare tali prodotti e li commercializzi con il proprio nome o con il proprio marchio; oppure
b) fabbrichi prodotti rientranti nell'ambito di applicazione del presente regolamento e li metta in servizio per uso proprio;
19) "mandatario": qualsiasi persona fisica o giuridica stabilita all'interno dell'Unione che abbia ricevuto mandato scritto da un fabbricante per agire per suo conto in relazione a compiti specifici;
20) "importatore": qualsiasi persona fisica o giuridica stabilita nell'Unione che immette sul mercato dell'Unione un prodotto rientrante nell'ambito di applicazione del presente regolamento originario da un paese terzo;
21) "distributore": qualsiasi persona fisica o giuridica nella catena di approvvigionamento, diversa dal fabbricante o dall'importatore, che mette a disposizione un prodotto rientrante nell'ambito di applicazione del presente regolamento sul mercato;
22) "operatore economico": il fabbricante, il mandatario, l'importatore o il distributore;
23) "specifiche tecniche": un documento che prescrive i requisiti tecnici che devono essere soddisfatti dai prodotti rientranti nell'ambito di applicazione del presente regolamento;
24) "norma armonizzata": una norma armonizzata quale definita all'articolo 2, punto 1), lettera c), del regolamento (UE) n. 1025/2012;
25) “marcatura CE”: una marcatura mediante la quale il fabbricante indica che una macchina o un prodotto correlato è conforme ai requisiti applicabili stabiliti nella normativa di armonizzazione dell’Unione che ne prevede l’apposizione;
26) “accreditamento”: l’accreditamento quale definito all’articolo 2, punto 10, del regolamento (CE) n. 765/2008;
27) “organismo nazionale di accreditamento”: l’organismo nazionale di accreditamento quale definito all’articolo 2, punto 11, del regolamento (CE) n. 765/2008;
28) “valutazione della conformità”: la procedura atta a dimostrare se i requisiti essenziali di sicurezza e di tutela della salute del presente regolamento applicabili in relazione alle macchine o ai prodotti correlati siano stati rispettati;
29) “organismo di valutazione della conformità”: un organismo che svolge attività di valutazione della conformità, fra cui tarature, prove, certificazioni e ispezioni;
30) “organismo notificato”: un organismo di valutazione della conformità notificato conformemente al presente regolamento;
31) “autorità di vigilanza del mercato”: un’autorità di vigilanza del mercato quale definita all’articolo 3, punto 4, del regolamento (UE) 2019/1020;
32) “richiamo”: qualsiasi provvedimento volto a ottenere la restituzione di un prodotto rientrante nell’ambito di applicazione del presente regolamento che è già stato messo a disposizione di un utilizzatore;
33) “ritiro”: in relazione a un prodotto, qualsiasi provvedimento volto a impedire la messa a disposizione sul mercato di un prodotto rientrante nell'ambito di applicazione del presente regolamento presente nella catena di approvvigionamento;
34) "ciclo di vita": il periodo che va dal momento in cui una macchina o un prodotto correlato è immesso sul mercato o messo in servizio fino al momento in cui è scartato, compresi il tempo effettivo in cui la macchina o il prodotto correlato può essere utilizzato e le fasi di trasporto, montaggio, smontaggio, smantellamento (messa fuori servizio), rottamazione o altre modifiche fisiche o digitali previste dal fabbricante;
35) "codice sorgente": la versione attualmente installata del software di un prodotto rientrante nell'ambito di applicazione del presente regolamento, formulata in un linguaggio di programmazione non ambiguo e comprensibile per le persone;
36) "utilizzatore professionale": una persona fisica che utilizza o gestisce una macchina o un prodotto correlato nell'esercizio della sua attività professionale o del suo lavoro.
37) “beni rilevanti per la crisi”: i beni rilevanti per la crisi quali definiti all’articolo 3, punto 6), del regolamento (UE) 2024/2747 del Parlamento europeo e del Consiglio;
38) “modalità di emergenza nel mercato interno”: la modalità di emergenza nel mercato interno quale definita all’articolo 3, punto 3), del regolamento (UE) 2024/2747.
Articolo 4 Libera circolazione
1. Gli Stati membri non ostacolano, per ragioni relative agli aspetti trattati dal presente regolamento, la messa a disposizione sul mercato di prodotti rientranti nell'ambito di applicazione del presente regolamento o la messa in servizio di macchine o di prodotti correlati conformi al presente regolamento.
2. In occasione di fiere, esposizioni e dimostrazioni o eventi analoghi, gli Stati membri non impediscono l'esposizione di un prodotto rientrante nell'ambito di applicazione del presente regolamento non conforme al presente regolamento, a condizione che un'indicazione visibile specifichi chiaramente che tale prodotto non è conforme al presente regolamento e non sarà messo a disposizione sul mercato fino a quando non sarà stato reso conforme.
Durante le dimostrazioni sono adottate precauzioni adeguate per garantire la protezione delle persone.
Articolo 5 Protezione delle persone durante l'installazione e l'uso di macchine o prodotti correlati
Gli Stati membri possono stabilire requisiti per garantire che le persone, compresi i lavoratori, siano protette durante l'installazione e l'utilizzo di macchine o prodotti correlati, a condizione che tali norme non consentano la modifica di una macchina o di un prodotto correlato in un modo non compatibile con il presente regolamento.
Articolo 6 Categorie di macchine e prodotti correlati elencati nell'allegato I soggetti a procedure specifiche di valutazione della conformità
1. Le macchine e i prodotti correlati che rientrano nelle categorie elencate nell'allegato I, parte A, sono soggetti alle procedure specifiche di valutazione della conformità di cui all'articolo 25, paragrafo 2, e le macchine e i prodotti correlati che rientrano nelle categorie elencate nell'allegato I, parte B, sono soggetti alle procedure specifiche di valutazione della conformità di cui all'articolo 25, paragrafo 3.
2. Alla Commissione è conferito il potere di adottare atti delegati conformemente all'articolo 47 al fine di modificare l'allegato I, previa consultazione delle pertinenti parti interessate, in considerazione dei progressi e dell'evoluzione delle conoscenze in ambito tecnico o di nuovi dati scientifici, aggiungendo all'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I una nuova categoria di macchine o prodotti correlati o eliminando una categoria esistente di macchine o prodotti correlati da tale elenco o spostando una categoria di macchine o prodotti correlati da una parte ad un’altra di tale allegato, conformemente ai criteri di cui ai paragrafi 4, 5 e 7 del presente articolo.
3. Prima dell'adozione dell'atto delegato la Commissione chiede il parere degli esperti del pertinente gruppo di esperti in conformità dell'articolo 47, paragrafo 4.
4. La Commissione valuta la gravità del potenziale rischio intrinseco che presenta una categoria di macchine o prodotti correlati al fine di stabilire se aggiungere tale categoria di macchine o prodotti correlati all'allegato I o se eliminarla da tale allegato. Tale valutazione è stabilita sulla base della combinazione della probabilità del verificarsi del danno e della gravità di quest'ultimo.
Nel determinare la probabilità e la gravità del danno, sono presi in considerazione, se del caso, i criteri seguenti:
a) la natura del pericolo intrinseco alla funzione della categoria di macchine o prodotti correlati, tenendo conto dell'uso previsto e di qualsiasi uso scorretto ragionevolmente prevedibile;
b) la gravità del danno che una persona subirebbe, incluso il grado di reversibilità del danno;
c) il numero di persone potenzialmente interessate dal danno;
d) la frequenza e la durata dell'esposizione al pericolo al quale una persona sarebbe esposta nel corso dell'uso previsto o di qualsiasi uso scorretto ragionevolmente prevedibile della categoria di macchine o prodotti correlati;
e) le possibilità di evitare o di limitare il danno;
f) per quanto riguarda i componenti di sicurezza, la probabilità di conseguenze gravi per la sicurezza delle persone esposte al danno in caso di guasto di tali componenti.
5. Nello svolgimento della valutazione di cui al paragrafo 4, la Commissione prende in considerazione gli elementi seguenti:
a) le indicazioni del danno causato in passato da macchine o prodotti correlati che sono stati utilizzati per il loro uso previsto o a seguito di un qualsiasi uso scorretto ragionevolmente prevedibile;
b) le informazioni sui difetti di sicurezza rilevati nel corso della vigilanza del mercato e gli elementi che si possono trovare nei sistemi di informazione amministrati dalla Commissione;
c) le informazioni sugli infortuni noti e sui quasi infortuni gravi, incluse le caratteristiche di tali infortuni e quasi infortuni;
d) i dati sugli infortuni o i danni alla salute causati dalla macchina o dal prodotto correlato per almeno i quattro anni precedenti. In particolare le informazioni ottenute, tra l'altro, dal sistema di informazione e comunicazione per la vigilanza del mercato (ICSMS), le clausole di salvaguardia, i sistemi d'informazione rapida, la banca dati dell'Unione europea sugli infortuni (EU-IDB), le statistiche europee degli infortuni sul lavoro (ESAW) di Eurostat e le segnalazioni del gruppo di cooperazione amministrativa per le macchine (AdCO).
Oltre alle lettere da a) a d) del presente paragrafo, la Commissione tiene conto di qualsiasi altra informazione disponibile pertinente per la valutazione di cui al paragrafo 4.
6. I dati e le informazioni di cui al paragrafo 5, lettere da a) a d), sono forniti dagli Stati membri in conformità del paragrafo 9.
7. Una categoria di macchine o prodotti correlati è inclusa nell'allegato I, parte A, se, in base alla valutazione di cui al paragrafo 4 e tenendo conto delle informazioni disponibili, compresi i dati di cui al paragrafo 5, essa presenta un potenziale rischio intrinseco grave e se è soddisfatta almeno una delle condizioni seguenti:
a) non esistono norme armonizzate o specifiche comuni relative ai pertinenti requisiti essenziali di sicurezza e di tutela della salute;
b) esistono rischi residui, compresi quelli che, secondo il fabbricante, potrebbero essere ridotti attraverso una formazione particolare o un dispositivo di protezione individuale specifico, e i dati e le informazioni di cui al paragrafo 5 dimostrano il ripetersi di simili infortuni gravi o mortali o di danni alla salute connessi a tali rischi residui;
c) esistono dati e informazioni che, secondo la Commissione, dimostrano l'applicazione erronea ricorrente delle pertinenti norme armonizzate o delle specifiche comuni, in relazione alla quale le attività di vigilanza del mercato svolte non hanno determinato miglioramenti significativi della situazione del mercato in un periodo ragionevole;
d) esiste un grado di incertezza nei metodi di valutazione del rischio esistenti in relazione a nuove categorie di macchine o tecnologie.
Qualsiasi altra categoria di macchine o prodotti correlati che, in base a tale valutazione, presenti un grave rischio potenziale intrinseco ma non soddisfi una o più delle condizioni di cui alle lettere da a) a d) è inclusa nell'allegato I, parte B.
8. Uno Stato membro che nutra preoccupazioni in merito a una categoria di macchine o prodotti correlati, inclusa o meno nell'elenco di cui all'allegato I, informa immediatamente la Commissione di tali preoccupazioni e fornisce motivazioni a sostegno delle stesse.
La Commissione effettua la valutazione di cui al paragrafo 4 immediatamente dopo essere stata informata dallo Stato membro.
Dopo aver effettuato tale valutazione, la Commissione può avviare la procedura di cui al paragrafo 2.
9. Entro il 20 luglio 2025 e successivamente ogni cinque anni, gli Stati membri forniscono i dati e le informazioni di cui al paragrafo 5, comprese le informazioni indicanti che non si è verificato nessuno degli eventi di cui al paragrafo 5, per ciascuna categoria di macchine o prodotti correlati, inclusa o meno nell'elenco di cui all'allegato I, qualora la non inclusione sia motivo di preoccupazione per lo Stato membro.
10. La Commissione adotta atti di esecuzione che definiscono e, ove necessario alla luce degli sviluppi tecnologici e del mercato, aggiornano un modello riguardante la raccolta, da parte degli Stati membri, dei dati e delle informazioni di cui al paragrafo 5, lettere da a) a d).
Nell'adottare tali atti di esecuzione, la Commissione emana orientamenti relativi alla raccolta e alla trasmissione di dati e di informazioni comparabili e di elevata qualità.
Tali atti di esecuzione sono adottati secondo la procedura d'esame di cui all'articolo 48, paragrafo 3.
Il primo di tali atti di esecuzione è adottato al più tardi il 20 luglio 2024.
11. Se necessario dopo aver presentato la relazione di cui all'articolo 53, paragrafo 3, la Commissione adotta atti delegati conformemente all'articolo 47 al fine di integrare il paragrafo 5 del presente articolo specificando gli obblighi incombenti agli Stati membri di fornire i dati e le informazioni richiesti a norma del presente articolo attraverso la creazione di una metodologia comune relativa ai dati e alle informazioni da raccogliere, compresi i metodi per la loro raccolta e compilazione e le procedure per la loro trasmissione, nonché le pertinenti definizioni, in modo da garantire che la Commissione disponga di dati sufficienti e comparabili per effettuare la valutazione di cui al paragrafo 4.
Articolo 7 Componenti di sicurezza
1. Un elenco indicativo dei componenti di sicurezza è riportato nell'allegato II.
2. Alla Commissione è conferito il potere di adottare atti delegati conformemente all'articolo 47 al fine di modificare l'allegato II in considerazione dei progressi e delle conoscenze in ambito tecnico o di nuovi dati scientifici, includendo nell'elenco indicativo dei componenti di sicurezza un componente di sicurezza nuovo oppure eliminando da tale elenco un componente di sicurezza presente.
3. Uno Stato membro che nutre preoccupazioni in merito a un componente di sicurezza incluso o meno nell'elenco di cui all'allegato II informa immediatamente la Commissione delle proprie preoccupazioni e fornisce motivazioni a sostegno delle stesse.
Articolo 8 Requisiti essenziali di sicurezza e di tutela della salute dei prodotti rientranti nell'ambito di applicazione del presente regolamento
Le macchine o i prodotti correlati sono messi a disposizione sul mercato o messi in servizio soltanto se, quando debitamente installati, sottoposti a manutenzione e utilizzati conformemente al loro uso previsto o in condizioni ragionevolmente prevedibili, soddisfano i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
Le quasi-macchine sono messe a disposizione sul mercato solo se rispettano i pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
Articolo 9 Normativa specifica di armonizzazione dell'Unione
Laddove, per un determinato prodotto rientrante nell'ambito di applicazione del presente regolamento, i rischi affrontati dai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III sono interamente o parzialmente trattati da una normativa di armonizzazione dell'Unione più specifica del presente regolamento, il presente regolamento non si applica a tale prodotto nella misura in cui tale normativa specifica dell'Unione affronta detti rischi.
CAPO II
OBBLIGHI DEGLI OPERATORI ECONOMICI
Articolo 10 Obblighi dei fabbricanti di macchine e di prodotti correlati
1. All'atto dell'immissione sul mercato o della messa in servizio di una macchina o di un prodotto correlato, i fabbricanti garantiscono che siano stati progettati e fabbricati conformemente ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
2. Prima dell'immissione sul mercato o della messa in servizio di una macchina o di un prodotto correlato, i fabbricanti redigono la documentazione tecnica di cui all'allegato IV, parte A, ed eseguono o fanno eseguire la pertinente procedura di valutazione della conformità di cui all'articolo 25.
Se la conformità della macchina o di un prodotto correlato rispetto ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III è stata dimostrata da tale procedura di valutazione della conformità, i fabbricanti redigono la dichiarazione di conformità UE conformemente all'articolo 21 e appongono la marcatura CE conformemente all'articolo 24
3. I fabbricanti mantengono la documentazione tecnica e la dichiarazione di conformità UE a disposizione delle autorità di vigilanza del mercato per un periodo di almeno 10 anni dalla data di immissione sul mercato o dalla messa in servizio della macchina o del prodotto correlato. Se pertinente, il codice sorgente o la logica di programmazione integrati nella documentazione tecnica, su richiesta motivata da parte delle autorità nazionali competenti, sono messi a disposizione di tali autorità a condizione che tale codice sorgente o logica di programmazione siano necessari affinché esse siano in grado di verificare il rispetto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
4. I fabbricanti garantiscono che siano predisposte le procedure necessarie affinché le macchine o i prodotti correlati fabbricati nell'ambito di una produzione in serie rimangano conformi al presente regolamento. Le modifiche del processo produttivo o della progettazione o delle caratteristiche delle macchine o dei prodotti correlati, nonché le modifiche delle norme armonizzate, di altre specifiche tecniche o delle specifiche comuni di cui all'articolo 20 con riferimento alle quali è dichiarata la conformità delle macchine o dei prodotti correlati devono essere tenute debitamente in considerazione.
Laddove ritenuto necessario in considerazione dei rischi presentati dalle macchine o dai prodotti correlati, al fine di proteggere la salute e la sicurezza degli utilizzatori, i fabbricanti effettuano una prova a campione delle macchine o dei prodotti correlati messi a disposizione sul mercato e ne esaminano i risultati. Se del caso, i fabbricanti mantengono un registro dei reclami, delle macchine o dei prodotti correlati non conformi e dei richiami di macchine e di prodotti correlati, e informano i distributori di tale monitoraggio.
5. I fabbricanti garantiscono che sulle macchine o sui prodotti correlati da loro immessi sul mercato o messi in servizio siano apposti almeno una designazione del modello della macchina o del prodotto correlato, della serie o del tipo, l'anno di costruzione, vale a dire l'anno in cui il processo di fabbricazione si è concluso, nonché, eventualmente, un numero di lotto o di serie oppure qualsiasi altro elemento che ne consenta l'identificazione, oppure, qualora le dimensioni o la natura della macchina o del prodotto correlato non lo consentano, garantiscono che le informazioni prescritte siano fornite sull'imballaggio o in un documento di accompagnamento della macchina o del prodotto correlato.
6. I fabbricanti indicano il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, nonché l'indirizzo postale e il sito internet, l'indirizzo di posta elettronica o altri contatti digitali ai quali possono essere contattati sulla macchina o sul prodotto correlato oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento della macchina o del prodotto correlato. L’indirizzo indica un unico recapito presso il quale il fabbricante può essere contattato. Le informazioni relative al contatto sono in una lingua facilmente comprensibile dagli utilizzatori e le autorità di vigilanza del mercato.
7. I fabbricanti garantiscono che le macchine o i prodotti correlati siano accompagnati dalle istruzioni per l’uso e dalle informazioni di cui all’allegato III. Le istruzioni possono essere fornite in formato digitale. Tali istruzioni e informazioni descrivono chiaramente il modello di prodotto al quale corrispondono.
Quando le istruzioni per l’uso sono fornite in formato digitale, il fabbricante deve:
a) indicare sulla macchina o sul prodotto correlato, oppure, ove ciò non sia possibile, sull’imballaggio o in un documento di accompagnamento, le modalità di accesso alle istruzioni in formato digitale;
b) presentare le istruzioni per l’uso in un formato che consenta all’utilizzatore di stamparle e scaricarle, nonché di salvarle su un dispositivo elettronico in maniera da potervi accedere in qualsiasi momento, in particolare in caso di avaria della macchina o del prodotto correlato; tale requisito si applica anche quando le istruzioni per l’uso sono integrate nel software della macchina o del prodotto correlato;
c) renderle accessibili online durante il ciclo di vita previsto della macchina o del prodotto correlato e per un periodo di almeno 10 anni dopo l’immissione sul mercato della macchina o del prodotto correlato.
Tuttavia, su richiesta dell’utilizzatore al momento dell’acquisto, il fabbricante fornisce gratuitamente le istruzioni per l’uso in formato cartaceo entro un mese.
Nel caso di una macchina o di un prodotto correlato destinati a utilizzatori non professionali o che possono, in condizioni ragionevolmente prevedibili, essere utilizzati da utilizzatori non professionali, anche se non ad essi destinati, il fabbricante fornisce, in formato cartaceo, le informazioni sulla sicurezza essenziali per mettere in servizio la macchina o il prodotto correlato e per utilizzarli in modo sicuro.
Le istruzioni per l’uso, le informazioni sulla sicurezza e le informazioni di cui all’allegato III sono redatte in una lingua facilmente comprensibile dagli utilizzatori, secondo quanto stabilito dallo Stato membro interessato, e sono chiare, comprensibili e leggibili.
8. I fabbricanti garantiscono che la macchina o il prodotto correlato siano accompagnati dalla dichiarazione di conformità UE di cui all'allegato V, parte A, o, in alternativa, i fabbricanti forniscono l'indirizzo internet o codici a lettura ottica dove è possibile accedere a tale dichiarazione di conformità UE nelle istruzioni per l'uso e nelle informazioni di cui all'allegato III.
Le dichiarazioni di conformità UE digitali sono rese accessibili online per il ciclo di vita previsto della macchina o del prodotto correlato e, in ogni caso, per un periodo di almeno 10 anni dopo l'immissione sul mercato o la messa in servizio della macchina o del prodotto correlato.
9. I fabbricanti che ritengono o hanno motivo di ritenere che una macchina o un prodotto correlato da essi immesso sul mercato o messo in servizio non sia conforme al presente regolamento adottano immediatamente le azioni correttive necessarie per rendere conforme tale macchina o prodotto correlato, ritirarli o richiamarli, a seconda dei casi. Inoltre, se la macchina o il prodotto correlato presentano un rischio per la salute e la sicurezza delle persone nonché, all’occorrenza, degli animali domestici e per la tutela dei beni e, se del caso, dell'ambiente, i fabbricanti ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la macchina o il prodotto correlato sul mercato o li hanno messi in servizio, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive adottate.
10. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, i fabbricanti forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità delle macchine o dei prodotti correlati rispetto al presente regolamento, in una lingua facilmente comprensibile da tale autorità. Essi cooperano con tale autorità, su sua richiesta, a qualsiasi azione intrapresa per eliminare i rischi presentati dalle macchine o dai prodotti correlati che hanno immesso sul mercato o messo in servizio.
Articolo 11 Obblighi dei fabbricanti di quasi-macchine
1. All'atto dell'immissione sul mercato di una quasi-macchina, i fabbricanti garantiscono che sia stata progettata e fabbricata conformemente ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
2. Prima dell'immissione sul mercato di una quasi-macchina, i fabbricanti redigono la documentazione tecnica di cui all'allegato IV, parte B.
Se la conformità della quasi-macchina rispetto ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III è stata dimostrata nella documentazione tecnica di cui all'allegato IV, parte B, i fabbricanti redigono la dichiarazione di incorporazione UE conformemente all'articolo 22.
3. I fabbricanti mantengono la documentazione tecnica e la dichiarazione di incorporazione UE a disposizione delle autorità di vigilanza del mercato per un periodo di almeno 10 anni dalla data di immissione sul mercato della quasi-macchina. Se pertinente, il codice sorgente o la logica di programmazione integrati nella documentazione tecnica, su richiesta motivata da parte delle autorità nazionali competenti, sono messi a disposizione di tali autorità a condizione che tale codice sorgente o logica di programmazione siano necessari affinché esse siano in grado di verificare il rispetto dei pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
4. I fabbricanti si assicurano che siano predisposte le procedure necessarie affinché la quasi-macchina fabbricata nell'ambito di una produzione in serie continui a essere conforme al presente regolamento. Si tiene debitamente conto delle modifiche del processo produttivo o della progettazione o delle caratteristiche delle quasi-macchine, nonché delle modifiche delle norme armonizzate o di altre specifiche tecniche, o delle specifiche comuni di cui all'articolo 20, con riferimento alle quali è dichiarata o è verificata la conformità delle quasi-macchine.
5. I fabbricanti garantiscono che sulle quasi-macchine da loro immesse sul mercato siano apposti almeno una designazione della quasi-macchina, l'anno di costruzione, vale a dire l'anno in cui il processo di fabbricazione si è concluso, il modello e la serie o il tipo nonché, eventualmente, un numero di lotto o di serie oppure qualsiasi altro elemento che ne consenta l'identificazione, oppure, qualora le dimensioni o la natura della quasi- macchina non lo consentano, garantiscono che le informazioni prescritte siano fornite sull'imballaggio o in un documento di accompagnamento della quasi-macchina.
6. I fabbricanti indicano il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, nonché l'indirizzo postale e il sito internet, l'indirizzo di posta elettronica o altri contatti digitali ai quali possono essere contattati sulla quasi- macchina oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento della quasi-macchina. L'indirizzo indica un unico recapito presso il quale il fabbricante può essere contattato. Le informazioni relative al contatto sono scritte in una lingua facilmente comprensibile dalla persona incaricata dell'incorporazione della quasi-macchina e per le autorità di vigilanza del mercato.
7. I fabbricanti garantiscono che le quasi-macchine siano accompagnate dalle istruzioni per l'assemblaggio di cui all'allegato XI.
Le istruzioni per l'assemblaggio possono essere fornite dal fabbricante in formato digitale.
Quando le istruzioni per l'assemblaggio vengono fornite in formato digitale, il fabbricante deve:
a) indicare sulla quasi-macchina, oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento le modalità di accesso alle istruzioni per l'assemblaggio in formato digitale;
b) presentare le istruzioni per l'assemblaggio in un formato che consenta alla persona incaricata dell'incorporazione della quasi-macchina di stamparle e scaricarle, nonché di salvarle su un dispositivo elettronico in maniera da potervi accedere in qualsiasi momento, in particolare in caso di avaria della quasi- macchina; tale requisito si applica anche quando le istruzioni per l'assemblaggio sono integrate nel software della quasi-macchina;
c) renderle accessibili online per un periodo di almeno 10 anni dopo l'immissione sul mercato della quasi-macchina.
Tuttavia, su richiesta della persona incaricata dell'incorporazione della quasi-macchina al momento dell'acquisto, il fabbricante fornisce gratuitamente le istruzioni per l'assemblaggio in formato cartaceo entro un mese.
Le istruzioni per l'assemblaggio sono redatte in una lingua facilmente comprensibile dalla persona incaricata dell'incorporazione della quasi-macchina, secondo quanto stabilito dallo Stato membro interessato, e sono chiare, comprensibili e leggibili.
8. I fabbricanti garantiscono che la quasi-macchina sia accompagnata dalla dichiarazione di incorporazione UE di cui all'allegato V, parte B, o, in alternativa, i fabbricanti forniscono l'indirizzo internet o il codice ottico dove è possibile accedere a tale dichiarazione di incorporazione UE nelle istruzioni per l'assemblaggio di cui all'allegato XI.
Le dichiarazioni di incorporazione UE digitali sono rese accessibili online per un periodo di almeno 10 anni dopo l'immissione sul mercato della quasi-macchina.
9. I fabbricanti che ritengono o hanno motivo di ritenere che la quasi-macchina che hanno immesso sul mercato non sia conforme al presente regolamento adottano immediatamente le azioni correttive necessarie a renderla conforme, ritirarla o richiamarla, a seconda dei casi. Inoltre, se la quasi-macchina presenta un rischio per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute, i fabbricanti ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la quasi-macchina sul mercato, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive intraprese.
10. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, i fabbricanti forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità della quasi- macchina rispetto al presente regolamento, in una lingua facilmente comprensibile da tale autorità. Essi cooperano con tale autorità, su sua richiesta, a qualsiasi azione intrapresa per eliminare i rischi relativi ai pertinenti requisiti essenziali di sicurezza e di tutela della salute presentati dalla quasi-macchina che hanno immesso sul mercato.
Articolo 12 Mandatari
1. Il fabbricante di un prodotto rientrante nell'ambito di applicazione del presente regolamento può nominare, mediante mandato scritto, un mandatario.
Gli obblighi di cui all'articolo 10, paragrafo 1, e all'articolo 11, paragrafo 1, e l'obbligo di stesura della documentazione tecnica di cui all'allegato IV non rientrano nel mandato del mandatario.
2. Il mandatario esegue i compiti specificati nel mandato ricevuto dal fabbricante. Il mandato consente al mandatario di svolgere almeno i compiti seguenti:
a) mantenere a disposizione delle autorità nazionali di vigilanza del mercato la documentazione tecnica e la dichiarazione di conformità UE per le macchine e i prodotti correlati o la dichiarazione di incorporazione UE per le quasi-macchine per un periodo di almeno 10 anni dalla data in cui il prodotto è stato immesso sul mercato;
b) a seguito di una richiesta motivata da parte di un'autorità nazionale competente, fornire a tale autorità tutte le informazioni e la documentazione necessarie per dimostrare la conformità del prodotto rientrante nell'ambito di applicazione del presente regolamento, in formato cartaceo o digitale;
c) collaborare con le autorità nazionali competenti, se queste lo richiedono, riguardo a qualsiasi azione intrapresa per eliminare i rischi presentati da un prodotto rientrante nell'ambito di applicazione del presente regolamento che rientra nell'incarico del mandatario.
Articolo 13 Obblighi degli importatori di macchine e di prodotti correlati
1. Gli importatori immettono sul mercato soltanto macchine o prodotti correlati conformi.
2. Prima dell'immissione sul mercato di una macchina o di un prodotto correlato, gli importatori si assicurano che il fabbricante abbia svolto le procedure di valutazione della conformità adeguate di cui all'articolo 25. Essi assicurano che il fabbricante abbia redatto la documentazione tecnica di cui all'allegato V, parte A, che la marcatura CE di cui all'articolo 23 sia apposta sulla macchina o sul prodotto correlato, che la macchina o il prodotto correlato siano accompagnati dai documenti prescritti e che il fabbricante abbia rispettato le prescrizioni di cui all'articolo 10, paragrafi 5, 6 e 8.
L'importatore che ritenga o abbia motivo di ritenere che una macchina o un prodotto correlato non sia conforme al presente regolamento, non lo immette sul mercato fino a quando non sia stato reso conforme. Inoltre, laddove la macchina o il prodotto correlato presentino un rischio per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché la tutela dei beni e, se del caso, dell'ambiente, l'importatore ne informa il fabbricante e le autorità di vigilanza del mercato.
3. Gli importatori indicano il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, nonché l'indirizzo postale e il sito internet, l'indirizzo di posta elettronica o altri contatti digitali ai quali possono essere contattati sulla macchina o sul prodotto correlato oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento della macchina o del prodotto correlato. Le informazioni relative al contatto sono in una lingua facilmente comprensibile dagli utilizzatori e le autorità di vigilanza del mercato.
4. Gli importatori garantiscono che la macchina o il prodotto correlato siano accompagnati dalle istruzioni per l'uso e dalle informazioni di cui all'articolo 10, paragrafo 7.
5. Gli importatori garantiscono che, per il periodo in cui la macchina o il prodotto correlato sono sotto la loro responsabilità, le condizioni di deposito o di trasporto non compromettano la conformità ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
6. Laddove ritenuto necessario in considerazione dei rischi presentati da una macchina o da un prodotto correlato, al fine di tutelare la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché di tutelare i beni e, se del caso, l'ambiente, gli importatori svolgono una prova a campione delle macchine o dei prodotti correlati messi a disposizione sul mercato, esaminano i reclami, le macchine o i prodotti correlati non conformi e i richiami di macchine o di prodotti correlati e, se del caso, mantengono un registro degli stessi e informano i distributori di tale monitoraggio.
7. Gli importatori che ritengono o hanno motivo di ritenere che una macchina o un prodotto correlato da essi immesso sul mercato non sia conforme al presente regolamento adottano immediatamente le azioni correttive necessarie per rendere conforme tale macchina o prodotto correlato, ritirarli o richiamarli, a seconda dei casi. Inoltre, se la macchina o il prodotto correlato presenta un rischio per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente, gli importatori ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la macchina o il prodotto correlato sul mercato, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive adottate.
8. Gli importatori mantengono una copia della dichiarazione di conformità UE a disposizione delle autorità di vigilanza del mercato per un periodo di almeno 10 anni dalla data di immissione sul mercato della macchina o del prodotto correlato e si accertano che la documentazione tecnica di cui all'allegato IV, parte A, possa essere resa disponibile a tali autorità su loro richiesta. Se pertinente, il codice sorgente o la logica programmata integrati nella documentazione tecnica, su richiesta motivata da parte delle autorità nazionali competenti, sono messi a disposizione di tali autorità a condizione che tale codice sorgente o logica di programmazione siano necessari affinché esse siano in grado di verificare il rispetto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
9. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, gli importatori forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità della macchina o del prodotto correlato rispetto al presente regolamento, in una lingua facilmente comprensibile da tale autorità. Essi cooperano con tale autorità, su richiesta di quest'ultima, in merito a qualsiasi azione adottata per eliminare i rischi per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente presentati da una macchina o da un prodotto correlato che hanno immesso sul mercato.
Articolo 14 Obblighi degli importatori di quasi-macchine
1. Gli importatori immettono sul mercato soltanto quasi-macchine conformi.
2. Prima di immettere sul mercato una quasi-macchina, gli importatori assicurano che il fabbricante abbia redatto la documentazione tecnica di cui all'allegato IV, parte B, che la quasi-macchina sia accompagnata dai documenti prescritti e che il fabbricante abbia rispettato le prescrizioni di cui all'articolo 11, paragrafi 5, 6 e 8.
L'importatore che ritenga o abbia motivo di ritenere che una quasi-macchina non sia conforme al presente regolamento non la immette sul mercato fino a quando non sia stata resa conforme. Inoltre, se la quasi-macchina presenta un rischio per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute, l'importatore ne informa il fabbricante e le autorità di vigilanza del mercato.
3. Gli importatori indicano il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, nonché l'indirizzo postale e il sito internet, l'indirizzo di posta elettronica o altri contatti digitali ai quali possono essere contattati sulla quasi-macchina oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento della quasi-macchina. Le informazioni relative al contatto sono scritte in una lingua facilmente comprensibile dalla persona incaricata dell'incorporazione della quasi-macchina e per le autorità di vigilanza del mercato.
4. Gli importatori garantiscono che le quasi-macchine siano accompagnate dalle istruzioni per l'assemblaggio di cui all'articolo 11, paragrafo 7.
5. Gli importatori garantiscono che, per il periodo in cui la quasi-macchina è sotto la loro responsabilità, le condizioni di deposito o di trasporto non compromettano la conformità ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
6. Gli importatori che ritengono o hanno motivo di ritenere che la quasi-macchina che hanno immesso sul mercato non sia conforme al presente regolamento adottano immediatamente le azioni correttive necessarie a renderla conforme, ritirarla o richiamarla, a seconda dei casi. Inoltre, se la quasi-macchina presenta un rischio per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute, gli importatori ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la quasi-macchina sul mercato, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive intraprese.
7. Gli importatori mantengono una copia della dichiarazione di incorporazione UE a disposizione delle autorità di vigilanza del mercato per un periodo di almeno 10 anni dalla data di immissione sul mercato della quasi-macchina e si accertano che la documentazione tecnica di cui all'allegato IV, parte B, possa essere resa disponibile a tali autorità su loro richiesta.
8. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, gli importatori forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità della quasi- macchina rispetto al presente regolamento, in una lingua facilmente comprensibile da tale autorità. Essi cooperano con tale autorità, su richiesta di quest'ultima, in merito a qualsiasi azione adottata per eliminare i rischi per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute presentati da una quasi-macchina che hanno immesso in commercio.
Articolo 15 Obblighi dei distributori di macchine e di prodotti correlati
1. Quando mettono una macchina o un prodotto correlato a disposizione sul mercato, i distributori esercitano la dovuta diligenza per rispettare le prescrizioni del presente regolamento.
2. Prima di mettere una macchina o un prodotto correlato a disposizione sul mercato, i distributori verificano che:
a) la macchina o il prodotto correlato rechi la marcatura CE;
b) la macchina o il prodotto correlato siano accompagnati dalla dichiarazione di conformità UE di cui all'articolo 10, paragrafo 8;
c) la macchina o il prodotto correlato siano accompagnati dalle istruzioni per l'uso e dalle informazioni di cui all'articolo 10, paragrafo 7, scritte in una lingua facilmente comprensibile dagli utilizzatori, secondo quanto stabilito dallo Stato membro in cui la macchina o il prodotto correlato devono essere messi a disposizione sul mercato;
d) il fabbricante e l'importatore abbiano rispettato rispettivamente le prescrizioni di cui all'articolo 10, paragrafi 5 e 6, e all'articolo 13, paragrafo 3.
3. Il distributore che ritenga o abbia motivo di ritenere che la macchina o il prodotto correlato non siano conformi al presente regolamento, non mette la macchina o il prodotto correlato a disposizione sul mercato fino a quando non siano stati resi conformi. Inoltre, laddove la macchina o il prodotto correlato presentino un rischio per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente, il distributore ne informa il fabbricante o l'importatore e le autorità di vigilanza del mercato.
4. I distributori garantiscono che, per il periodo in cui la macchina o il prodotto correlato sono sotto la loro responsabilità, le condizioni di deposito o di trasporto non compromettano la conformità ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
5. I distributori che ritengono o hanno motivo di ritenere che la macchina o il prodotto correlato che hanno messo a disposizione sul mercato non sia conforme al presente regolamento, si assicurano che siano intraprese le azioni correttive necessarie a rendere la macchina o il prodotto correlato conformi, ritirarli o richiamarli, a seconda dei casi. Inoltre, se la macchina o il prodotto correlato presenta un rischio per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente, i distributori ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la macchina o il prodotto correlato sul mercato, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive adottate.
6. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, i distributori forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità della macchina o del prodotto correlato rispetto al presente regolamento, in una lingua facilmente comprensibile da tale autorità. Essi cooperano con tale autorità, su richiesta di quest'ultima, in merito a qualsiasi azione adottata per eliminare i rischi per la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente presentati da una macchina o da un prodotto correlato che hanno messo a disposizione sul mercato.
Articolo 16 Obblighi dei distributori di quasi-macchine
1. Quando mettono una quasi-macchina a disposizione sul mercato, i distributori esercitano la dovuta diligenza per rispettare le prescrizioni del presente regolamento.
2. Prima di mettere una quasi-macchina a disposizione sul mercato, i distributori verificano che:
a) la quasi-macchina sia accompagnata dalla dichiarazione di incorporazione UE di cui all'articolo 11, paragrafo 8;
b) la quasi-macchina sia accompagnata dalle istruzioni per l'assemblaggio di cui all'articolo 11, paragrafo 7, redatte in una lingua facilmente comprensibile dalla persona incaricata dell'incorporazione della quasi-macchina, secondo quanto stabilito dallo Stato membro in cui la quasi-macchina deve essere messa a disposizione sul mercato;
c) il fabbricante e l'importatore abbiano rispettato rispettivamente le prescrizioni di cui all'articolo 11, paragrafi 5 e 6, e all'articolo 14, paragrafo 3.
3. Il distributore che ritenga o abbia motivo di ritenere che una quasi-macchina non sia conforme al presente regolamento, non mette la quasi-macchina a disposizione sul mercato fino a quando non sia stata resa conforme. Inoltre, se la quasi-macchina presenta un rischio per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute, il distributore ne informa il fabbricante o l’importatore e le autorità di vigilanza del mercato.
4. I distributori garantiscono che, per il periodo in cui la quasi-macchina è sotto la loro responsabilità, le condizioni di deposito o di trasporto non compromettano la conformità ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
5. I distributori che ritengono o hanno motivo di ritenere che la quasi-macchina che hanno messo a disposizione sul mercato non sia conforme al presente regolamento, si assicurano che siano intraprese le azioni correttive necessarie a renderla conforme, ritirarla o richiamarla, a seconda dei casi. Inoltre, se la quasi-macchina presenta un rischio per quanto riguarda i pertinenti requisiti essenziali di sicurezza e di tutela della salute applicabili, i distributori ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione la quasi-macchina sul mercato, dando in particolare informazioni dettagliate sulla non conformità e su eventuali azioni correttive intraprese.
6. A seguito di una richiesta motivata da parte di un'autorità nazionale competente, i distributori forniscono a tale autorità, in formato cartaceo o digitale, tutte le informazioni e la documentazione necessarie a dimostrare la conformità della quasi- macchina al presente regolamento. Essi cooperano con tale autorità, su sua richiesta, a qualsiasi azione intrapresa per eliminare i rischi relativi ai requisiti essenziali di sicurezza e di tutela della salute presentati dalla quasi-macchina che hanno messo a disposizione sul mercato.
Articolo 17 Casi in cui gli obblighi dei fabbricanti si applicano agli importatori e ai distributori
Un importatore o distributore è considerato un fabbricante ai fini del presente regolamento, ed è soggetto agli obblighi del fabbricante di cui agli articoli 10 e 11, quando immette sul mercato un prodotto rientrante nell'ambito di applicazione del presente regolamento con il proprio nome o marchio commerciale o modifica un prodotto già immesso sul mercato in un modo suscettibile di incidere sulla conformità ai requisiti applicabili.
Articolo 18 Altri casi in cui si applicano gli obblighi dei fabbricanti
Una persona fisica o giuridica che apporta una modifica sostanziale alla macchina o a un prodotto correlato è considerata un fabbricante ai fini del presente regolamento ed è soggetta agli obblighi del fabbricante di cui all'articolo 10 per tale macchina o prodotto correlato oppure, se la modifica sostanziale incide sulla sicurezza solo della macchina o del prodotto correlato che è parte di un insieme di macchine, per la macchina o il prodotto correlato interessati, come dimostrato nella valutazione del rischio.
La persona che effettua la modifica sostanziale, in particolare, ma fatti salvi gli altri obblighi di cui all'articolo 10, garantisce e dichiara, sotto la sua esclusiva responsabilità, che la macchina o il prodotto correlato interessato sia conforme ai requisiti applicabili del presente regolamento e applica la pertinente procedura di valutazione della conformità di cui all'articolo 25, paragrafi 2, 3 e 4, del presente regolamento.
Un utilizzatore non professionale che effettua una modifica sostanziale alla propria macchina o prodotto correlato, per uso proprio, non è considerato un fabbricante ai fini del presente regolamento e non è soggetto agli obblighi del fabbricante di cui all’articolo 10.
Articolo 19 Identificazione degli operatori economici
1. Gli operatori economici indicano alle autorità di vigilanza del mercato che ne facciano richiesta:
a) qualsiasi operatore economico che abbia fornito loro un prodotto rientrante nell'ambito di applicazione del presente regolamento;
b) qualsiasi operatore economico cui essi abbiano fornito un prodotto rientrante nell'ambito di applicazione del presente regolamento.
2. Per ottemperare all'obbligo di cui al paragrafo 1, gli operatori economici conservano le informazioni di cui in tale paragrafo per un periodo di almeno 10 anni dal momento in cui abbiano fornito o siano stati loro forniti i prodotti rientranti nell'ambito di applicazione del presente regolamento.
CAPO III
CONFORMITÀ DEI PRODOTTI RIENTRANTI NELL'AMBITO DI APPLICAZIONE DEL PRESENTE REGOLAMENTO
Articolo 20 Presunzione di conformità dei prodotti rientranti nell'ambito di applicazione del presente regolamento
1. Un prodotto rientrante nell'ambito di applicazione del presente regolamento conforme alle norme armonizzate o alle parti di esse i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell'Unione europea è considerato conforme ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III contemplati da tali norme o da parti di esse.
2. Come previsto dall'articolo 10, paragrafo 1, del regolamento (UE) n. 1025/2012, la Commissione richiede a una o più organizzazioni europee di normazione di redigere norme armonizzate per i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
3. Alla Commissione è conferito il potere di adottare atti di esecuzione che stabiliscono specifiche comuni relative ai requisiti tecnici che forniscono i mezzi per soddisfare i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III per i prodotti rientranti nell'ambito di applicazione del presente regolamento.
Tali atti di esecuzione sono adottati solo laddove siano state soddisfatte le condizioni seguenti:
a) la Commissione ha richiesto, a norma dell'articolo 10, paragrafo 1, del regolamento (UE) n. 1025/2012, a una o più organizzazioni europee di normazione di elaborare una norma armonizzata per i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III e:
i) la richiesta non è stata accettata; o
ii) le norme armonizzate in riscontro a tale richiesta non sono prodotte entro la scadenza stabilita conformemente all'articolo 10, paragrafo 1, del regolamento (UE) n. 1025/2012; o
iii) le norme armonizzate non sono conformi alla richiesta; e
b) nessun riferimento a norme armonizzate che contemplano i requisiti essenziali di sicurezza e di tutela della salute pertinenti è stato pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente al regolamento (UE) n. 1025/2012 e non si prevede la pubblicazione di tale riferimento entro un termine ragionevole.
Tali atti di esecuzione sono adottati secondo la procedura d'esame di cui all'articolo 48, paragrafo 3.
4. Prima di predisporre il progetto di atto di esecuzione di cui al paragrafo 3, la Commissione informa il comitato di cui all'articolo 22 del regolamento (UE) n. 1025/2012 di ritenere soddisfatte le condizioni di cui al paragrafo 3.
5. Nel predisporre il progetto di atto di esecuzione di cui al paragrafo 3, la Commissione tiene conto del parere degli organismi competenti o del gruppo di esperti e consulta debitamente tutti i pertinenti portatori di interessi.
6. Un prodotto rientrante nell'ambito di applicazione del presente regolamento conforme alle specifiche comuni stabilite dagli atti di esecuzione di cui al paragrafo 3 o a parti di esse è considerato conforme ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III disciplinati da tali specifiche comuni o da parti di esse.
7. Qualora una norma armonizzata sia adottata da un'organizzazione europea di normazione e proposta alla Commissione al fine di pubblicarne il riferimento nella Gazzetta ufficiale dell'Unione europea, la Commissione valuta la norma armonizzata conformemente al regolamento (UE) n. 1025/2012. Quando il riferimento a una norma armonizzata è pubblicato nella Gazzetta ufficiale dell'Unione europea, la Commissione abroga gli atti di esecuzione di cui al paragrafo 3, o parti di essi riguardanti gli stessi requisiti essenziali di sicurezza e di tutela della salute quali disciplinati da tale norma armonizzata.
8. Se uno Stato membro ritiene che una specifica comune non soddisfi interamente i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III, ne informa la Commissione presentando una spiegazione dettagliata. La Commissione valuta tale spiegazione dettagliata e può, se del caso, modificare l'atto di esecuzione che stabilisce la specifica comune in questione.
9. Le macchine e i prodotti correlati che sono stati certificati o per i quali è stata emessa una dichiarazione di conformità nell’ambito di un sistema di certificazione della cibersicurezza adottato conformemente al regolamento (UE) 2019/881 e i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell'Unione europea, sono considerati conformi ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III, punti 1.1.9 e 1.2.1, per quanto concerne la protezione contro la corruzione e la sicurezza e l'affidabilità dei sistemi di controllo nella misura in cui tali requisiti siano contemplati dal certificato di cibersicurezza o dalla dichiarazione di conformità o da loro parti.
Articolo 21 Dichiarazione di conformità UE per le macchine e i prodotti correlati
1. La dichiarazione di conformità UE attesta che la conformità ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III è stata dimostrata.
2. La dichiarazione di conformità UE ha la struttura tipo di cui all'allegato V, parte A, e contiene gli elementi specificati nei moduli pertinenti di cui agli allegati VI, VIII, IX e X. È continuamente aggiornata ed è tradotta nella lingua o nelle lingue richieste dallo Stato membro sul cui mercato la macchina o il prodotto correlato sono immessi, messi a disposizione o messi in servizio.
3. Se alla macchina o al prodotto correlato si applicano più atti giuridici dell'Unione che prescrivono una dichiarazione di conformità UE, è compilata un'unica dichiarazione di conformità UE in relazione a tali atti. Tale dichiarazione contiene gli estremi degli atti giuridici dell'Unione in questione, compresi i riferimenti della loro pubblicazione.
4. Con la dichiarazione di conformità UE, il fabbricante si assume la responsabilità della conformità della macchina o del prodotto correlato ai requisiti stabiliti dal presente regolamento.
Articolo 22 Dichiarazione di incorporazione UE di quasi-macchine
1. La dichiarazione di incorporazione UE attesta che la conformità ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III è stata dimostrata.
2. La dichiarazione di incorporazione UE ha la struttura tipo di cui all'allegato V, parte B. È costantemente aggiornata e tradotta nella lingua o nelle lingue richieste dallo Stato membro sul cui mercato la quasi-macchina è immessa o messa a disposizione.
3. Se alla quasi-macchina si applicano più atti giuridici dell'Unione che prescrivono una dichiarazione di conformità UE, la dichiarazione di incorporazione UE contiene un'indicazione con la quale si dichiara la conformità a tali atti. Tale dichiarazione contiene gli estremi degli atti giuridici dell'Unione in questione, compresi i riferimenti della loro pubblicazione.
4. Con la dichiarazione di incorporazione UE, il fabbricante si assume la responsabilità della conformità della quasi-macchina ai requisiti stabiliti dal presente regolamento.
Articolo 23 Principi generali della marcatura CE
La marcatura CE è soggetta ai principi generali esposti all'articolo 30 del regolamento (CE) n. 765/2008.
Articolo 24 Norme per l'apposizione della marcatura CE alle macchine e ai prodotti correlati
1. La marcatura CE è apposta sulla macchina o sul prodotto correlato in modo visibile, leggibile e indelebile. Qualora non sia possibile o la natura della macchina o del prodotto correlato non lo consenta, essa è apposta sul suo imballaggio e sui documenti di accompagnamento della macchina o del prodotto correlato.
2. La marcatura CE è apposta sulla macchina o sul prodotto correlato prima dell'immissione sul mercato o della messa in servizio.
3. Qualora la conformità di una macchina o di un prodotto correlato sia valutata conformemente alla procedura di valutazione della conformità di cui all'articolo 25, paragrafo 2, lettere a), b) e c), e all'articolo 25, paragrafo 3, lettere b), c) e d), la marcatura CE è seguita dal numero di identificazione dell'organismo notificato coinvolto nella procedura.
Il numero di identificazione di tale organismo notificato è apposto dall'organismo stesso o, in base alle istruzioni di quest'ultimo, dal fabbricante o dal mandatario del fabbricante.
4. La marcatura CE e, se del caso, il numero di identificazione dell'organismo notificato possono essere seguiti da un pittogramma o qualsiasi altro marchio che indichi un rischio o un impiego particolare.
5. Gli Stati membri si avvalgono dei meccanismi esistenti per garantire un'applicazione corretta del regime che disciplina la marcatura CE e promuovono le azioni opportune contro l'uso improprio di tale marcatura.
CAPO IV VALUTAZIONE DELLA CONFORMITÀ
Articolo 25 Procedure di valutazione della conformità per le macchine e i prodotti correlati
1. Il fabbricante o la persona fisica o giuridica di cui all'articolo 18 applica una delle procedure per la valutazione della conformità di cui ai paragrafi 2, 3 e 4.
2. Se la categoria di macchine o prodotti correlati è elencata nell'allegato I, parte A, il fabbricante o la persona fisica o giuridica di cui all'articolo 18 applica una delle procedure seguenti:
a) l’esame UE del tipo (modulo B) di cui all'allegato VII, seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) di cui all'allegato VIII;
b) la conformità basata sulla garanzia qualità totale (modulo H) di cui all'allegato IX;
c) la conformità basata sulla verifica di un unico prodotto (modulo G) di cui all'allegato X.
3. Se la categoria di macchine o prodotti correlati è elencata nell'allegato I, parte B, il fabbricante o la persona fisica o giuridica di cui all'articolo 18 applica una delle procedure seguenti:
a) il controllo interno della produzione (modulo A) di cui all'allegato VI;
b) l’esame UE del tipo (modulo B) di cui all'allegato VII, seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) di cui all'allegato VIII;
c) la conformità basata sulla garanzia qualità totale (modulo H) di cui all'allegato IX;
d) la conformità basata sulla verifica di un unico prodotto (modulo G) di cui all'allegato X.
Se applica la procedura di controllo interno della produzione di cui alla lettera a), il fabbricante progetta e costruisce la macchina o il prodotto correlato conformemente alle norme armonizzate o alle specifiche comuni proprie a tale categoria di macchine o prodotti correlati riguardanti tutti i pertinenti requisiti essenziali di sicurezza e di tutela della salute.
Se la categoria di macchine o prodotti correlati è elencata nell'allegato I, parte B, e la macchina o il prodotto correlato non sono stati fabbricati conformemente alle norme armonizzate o alle specifiche comuni riguardanti tutti i pertinenti requisiti essenziali di sicurezza di tutela della salute per tale categoria di macchine o prodotti correlati, il fabbricante, compresa una persona fisica o giuridica di cui all’articolo 18, applica una delle procedure di cui alle lettere b), c) o d) del presente paragrafo.
4. Se la categoria di macchine o prodotti correlati non è elencata nell'allegato I, il fabbricante, compresa la persona fisica o giuridica di cui all'articolo 18 applica la procedura di controllo interno della produzione (modulo A) di cui all'allegato VI.
5. Gli organismi notificati tengono conto degli interessi e delle esigenze specifici delle piccole e medie imprese quando definiscono tariffe per la valutazione della conformità.
Capo IV bis Procedure di emergenza
Articolo 25 bis Applicazione di procedure di emergenza
1. Gli articoli da 25 ter a 25 sexies del presente regolamento si applicano esclusivamente se la Commissione ha adottato un atto di esecuzione a norma dell’articolo 28 del regolamento (UE) 2024/2747 con riferimento alle macchine e ai prodotti correlati contemplati dal presente regolamento.
2. Gli articoli da 25 ter a 25 sexies del presente regolamento si applicano esclusivamente alle macchine e ai prodotti correlati che sono stati designati come beni rilevanti per la crisi a norma dell’articolo 18, paragrafo 4, del regolamento (UE) 2024/2747.
3. Gli articoli da 25 ter a 25 sexies del presente regolamento si applicano esclusivamente durante la modalità di emergenza nel mercato interno che è stata attivata a norma dell’articolo 18 del regolamento (UE) 2024/2747.
L’articolo 25 quater, paragrafo 7, del presente regolamento si applica tuttavia durante la modalità di emergenza nel mercato interno e dopo la sua scadenza o disattivazione.
4. La Commissione può adottare atti di esecuzione riguardanti le misure correttive o restrittive da adottare, le procedure da seguire e i requisiti specifici in materia di etichettatura e tracciabilità in relazione alle macchine e ai prodotti correlati immessi sul mercato o messi in servizio a norma degli articoli da 43 quater a 43 quinquies. Tali atti di esecuzione sono adottati secondo la procedura d’esame di cui all’articolo 48, paragrafo 3.
Articolo 25 ter Assegnazione della priorità alla valutazione della conformità della macchina e dei prodotti correlati designati come beni rilevanti per la crisi
1. Il presente articolo si applica a tutti i tipi di macchine e ai prodotti correlati figuranti nell’atto di esecuzione di cui all’articolo 25 bis, paragrafo 1, oggetto di procedura di valutazione della conformità di cui all’articolo 25 che richiedono il coinvolgimento obbligatorio di un organismo notificato.
2. Gli organismi notificati si adoperano al massimo per trattare in via prioritaria tutte le domande di valutazione della conformità delle macchine e dei prodotti correlati di cui al paragrafo 1 del presente articolo, a prescindere dal fatto che tali domande siano state depositate prima o dopo l’attivazione delle procedure di emergenza a norma dell’articolo 25 bis.
3. L’assegnazione della priorità alle domande di valutazione della conformità delle macchine e dei prodotti correlati a norma del paragrafo 2 non comporta costi aggiuntivi sproporzionati per i fabbricanti che hanno depositato tali domande.
4. Gli organismi notificati compiono sforzi ragionevoli per aumentare le proprie capacità di prova in relazione alle macchine e ai prodotti correlati di cui al paragrafo 1 per i quali sono stati notificati.
Articolo 25 quater Deroga alle procedure di valutazione della conformità che richiedono il coinvolgimento obbligatorio di un organismo notificato
1. In deroga all’articolo 25, uno Stato membro può, su richiesta debitamente motivata di un operatore economico, autorizzare l’immissione sul mercato o la messa in servizio, nel territorio dello Stato membro interessato, di specifiche macchine o di prodotti correlati figuranti nell’atto di esecuzione di cui all’articolo 43 bis, paragrafo 1, e per i quali non sono state eseguite le procedure di valutazione della conformità di cui all’articolo 25 che richiedono il coinvolgimento obbligatorio di un organismo notificato, ma la cui conformità a tutti i requisiti essenziali di salute e di sicurezza applicabili stabiliti all’allegato III è stata dimostrata secondo le procedure di cui a tale autorizzazione.
2. Lo Stato membro notifica immediatamente alla Commissione e agli altri Stati membri l’eventuale autorizzazione rilasciata in conformità del paragrafo 1 del presente articolo. A condizione che i requisiti stabiliti nell’autorizzazione garantiscano la conformità ai requisiti essenziali di salute e di sicurezza applicabili di cui all’allegato III, la Commissione adotta senza ritardo un atto di esecuzione che estende, per un periodo limitato di tempo, la validità dell’autorizzazione rilasciata da uno Stato membro in conformità del paragrafo 1 del presente articolo al territorio dell’intera Unione e stabilisce le condizioni alle quali le specifiche macchine o i prodotti correlati possono essere immessi sul mercato o messi in servizio. In sede di preparazione del progetto di atto di esecuzione, la Commissione può chiedere alle autorità nazionali di vigilanza del mercato di fornire le informazioni od osservazioni pertinenti in merito alla valutazione tecnica alla base dell’autorizzazione di cui al paragrafo 1 del presente articolo. L’atto di esecuzione è adottato secondo la procedura d’esame di cui all’articolo 48, paragrafo 3.
Le macchine o i prodotti correlati oggetto dell’estensione della validità di cui al primo comma recano l’informazione che essi sono immessi sul mercato o messi in servizio come “beni rilevanti per la crisi”. L’atto di esecuzione di cui al primo comma precisa il contenuto e la presentazione delle informazioni in oggetto. Tali informazioni, al pari di qualunque etichettatura, sono chiare, comprensibili e intelligibili e, se del caso, in una lingua che può essere facilmente compresa dai consumatori e da altri utilizzatori finali, secondo quanto determinato dallo Stato membro interessato.
3. Per motivi imperativi di urgenza debitamente giustificati connessi alla necessità di salvaguardare la salute e la sicurezza delle persone, la Commissione adotta atti di esecuzione immediatamente applicabili secondo la procedura di cui all’articolo 48, paragrafo 4.
4. In attesa che sia adottato un atto di esecuzione di cui al paragrafo 2 o 3, l’autorizzazione rilasciata da un’autorità nazionale competente di uno Stato membro è valida soltanto sul suo territorio e sui territori di qualsiasi altro Stato membro le cui autorità nazionali competenti abbiano riconosciuto la validità di tale autorizzazione prima dell’adozione di tale atto di esecuzione. Gli Stati membri informano la Commissione e gli altri Stati membri in merito all’eventuale decisione di riconoscere la validità di tale autorizzazione.
5. Il fabbricante di macchine o di prodotti correlati oggetto della procedura di autorizzazione di cui al paragrafo 1 dichiara, sotto la sua esclusiva responsabilità, che le macchine o i prodotti correlati interessati sono conformi a tutti i requisiti essenziali di salute e di sicurezza applicabili di cui all’allegato III ed è responsabile dell’esecuzione di tutte le procedure di valutazione della conformità indicate dall’autorità nazionale competente.
6. Le autorizzazioni rilasciate a norma del paragrafo 1 stabiliscono le condizioni e i requisiti nel rispetto dei quali le macchine o i prodotti correlati possono essere immessi sul mercato o messi in servizio. Tali autorizzazioni stabiliscono almeno quanto segue:
a) una descrizione delle procedure seguite per dimostrare efficacemente la conformità ai requisiti essenziali di salute e di sicurezza applicabili stabiliti all’allegato III del presente regolamento;
b) eventuali requisiti specifici concernenti la tracciabilità delle macchine o dei prodotti correlati interessati;
c) una data di scadenza della validità dell’autorizzazione, che non può superare l’ultimo giorno del periodo di attivazione della modalità di emergenza nel mercato interno in conformità dell’articolo 18 del regolamento (UE) 2024/2747;
d) eventuali requisiti specifici concernenti la necessità di garantire una costante valutazione della conformità per quanto riguarda le macchine o i prodotti correlati interessati;
e) le misure da adottare alla scadenza o alla disattivazione della modalità di emergenza nel mercato interno riguardo alle macchine o ai prodotti correlati interessati immessi sul mercato o messi in servizio.
7. In deroga agli articoli 4, 23 e 24, le macchine o i prodotti correlati per i quali è stata concessa un’autorizzazione in conformità del paragrafo 1 del presente articolo non recano la marcatura CE e l’articolo 4 non si applica.
8. Le autorità di vigilanza del mercato di uno Stato membro in cui è valida un’autorizzazione a norma dei paragrafi 1, 2 e 4 del presente articolo sono autorizzate, in relazione a tali macchine e prodotti correlati, ad adottare tutte le azioni correttive e restrittive a livello nazionale previste dal regolamento (UE) 2019/1020 e dal presente regolamento. Esse ne informano immediatamente la Commissione e le autorità di vigilanza del mercato di tutti gli altri Stati membri.
9. L’applicazione della procedura di autorizzazione di cui ai paragrafi da 1 a 4 del presente articolo non incide sull’applicazione delle pertinenti procedure di valutazione della conformità stabilite dall’articolo 25 nel territorio dello Stato membro interessato.
Articolo 25 quinquies Presunzione di conformità sulla base di norme e specifiche comuni
1. Laddove le macchine o i prodotti correlati siano stati designati come beni rilevanti per la crisi, alla Commissione è conferito il potere di adottare atti di esecuzione che elenchino le norme appropriate o che stabiliscano specifiche comuni per tali macchine o prodotti correlati riguardanti i requisiti essenziali di salute e di sicurezza applicabili di cui all’allegato III del presente regolamento in uno dei casi seguenti:
a) se non sono stati pubblicati riferimenti a norme armonizzate che contemplano i requisiti essenziali applicabili di salute e di sicurezza di cui all’allegato III del presente regolamento nella Gazzetta ufficiale dell’Unione europea in conformità del regolamento (UE) n. 1025/2012 e non si prevede la pubblicazione di tali riferimenti entro un termine ragionevole; oppure
b) se le gravi perturbazioni del funzionamento del mercato interno che hanno determinato l’attivazione della modalità di emergenza nel mercato interno in conformità dell’articolo 18 del regolamento (EU) 2024/2747 limitano in misura significativa le possibilità dei fabbricanti di avvalersi delle norme armonizzate riguardanti i requisiti essenziali di salute e di sicurezza applicabili di cui all’allegato III del presente regolamento e i cui riferimenti sono stati già pubblicati nella Gazzetta ufficiale dell’Unione europea in conformità del regolamento (UE) n. 1025/2012.
2. Gli atti di esecuzione di cui al paragrafo 1 definiscono la soluzione tecnica alternativa più idonea a garantire la presunzione di conformità a norma del paragrafo 5. A tal fine, i riferimenti alle norme europee o alle pertinenti norme nazionali o internazionali applicabili possono essere pubblicati in tali atti di esecuzione o, in mancanza di norme europee o di pertinenti norme nazionali o internazionali applicabili, tali atti di esecuzione possono stabilire specifiche comuni.
3. Gli atti di esecuzione di cui al paragrafo 1 del presente articolo sono adottati in secondo la procedura d’esame di cui all’articolo 48, paragrafo 3 e si applicano fino all’ultimo giorno del periodo di attivazione della modalità di emergenza nel mercato interno, a meno che tali atti di esecuzione non siano modificati o abrogati in conformità del paragrafo 7 del presente articolo.
4. Prima di preparare il progetto di atto di esecuzione di cui al paragrafo 1 del presente articolo, la Commissione comunica al comitato di cui all’articolo 22 del regolamento (UE) n. 1025/2012 che ritiene soddisfatte le condizioni di cui al paragrafo 1 del presente articolo. In sede di preparazione di tale progetto di atto di esecuzione, la Commissione tiene conto dei pareri di pertinenti organismi o gruppi di esperti istituiti a norma del presente regolamento e consulta debitamente tutti i pertinenti portatori di interessi.
5. Fatto salvo l’articolo 20, le macchine e i prodotti correlati che sono conformi alle norme o alle specifiche comuni di cui al paragrafo 1 del presente articolo, o a parti di esse, sono considerati conformi ai requisiti essenziali di salute e di sicurezza applicabili di cui all’allegato III, contemplati da tali norme, specifiche comuni o parti di esse. A decorrere dal giorno successivo alla scadenza o alla disattivazione della modalità di emergenza nel mercato interno, i fabbricanti non possono più basarsi sulla presunzione di conformità prevista dalle norme o dalle specifiche comuni stabilite dagli atti di esecuzione di cui al paragrafo 1 del presente articolo.
6. In deroga all’articolo 25 bis, paragrafo 3, primo comma, a meno che vi siano motivi sufficienti per ritenere che le macchine e i prodotti correlati contemplati dalle norme o dalle specifiche comuni di cui al paragrafo 1 del presente articolo presentino un rischio per la salute o la sicurezza delle persone, le macchine e i prodotti correlati conformi a tali norme o specifiche comuni e che sono immessi sul mercato o messi in servizio si intendono conformi ai requisiti essenziali di salute e sicurezza applicabili di cui all’allegato III dopo la scadenza o l’abrogazione di un atto di esecuzione adottato a norma del paragrafo 3 del presente articolo e dopo la scadenza o disattivazione della modalità di emergenza nel mercato interno.
7. Qualora uno Stato membro ritenga che una norma o una specifica comune di cui al paragrafo 1 non soddisfi interamente i requisiti essenziali di salute e sicurezza applicabili stabiliti all’allegato III, esso ne informa la Commissione presentando una spiegazione dettagliata. La Commissione valuta tale spiegazione dettagliata e può, se del caso, modificare o abrogare l’atto di esecuzione che elenca la norma o stabilisce la specifica comune in questione.
Articolo 25 sexies Assegnazione della priorità alle attività di vigilanza del mercato e mutua assistenza tra le autorità
1.Gli Stati membri assegnano conferiscono la priorità alle attività di vigilanza del mercato per le macchine e i prodotti correlati figuranti nell’atto di esecuzione di cui all’articolo 25 bis, paragrafo 1 del presente regolamento. La Commissione facilita il coordinamento di tali sforzi di assegnazione delle priorità attraverso la rete dell’Unione per la conformità dei prodotti istituita a norma dell’articolo 29 del regolamento (UE) 2019/1020.
2.Le autorità di vigilanza del mercato degli Stati membri garantiscono che si compiano i massimi sforzi per fornire assistenza ad altre autorità di vigilanza del mercato durante una modalità di emergenza nel mercato interno, anche mobilitando e inviando gruppi di esperti per rafforzare temporaneamente il personale delle autorità di vigilanza del mercato che chiedono assistenza o fornendo sostegno logistico, ad esempio con il potenziamento della capacità di prova per le macchine e i prodotti correlati figuranti nell’atto di esecuzione di cui all’articolo 25 bis, paragrafo 1.
CAPO V NOTIFICA DEGLI ORGANISMI DI VALUTAZIONE DELLA CONFORMITÀ
Articolo 26 Notifica
Gli Stati membri notificano alla Commissione e agli altri Stati membri gli organismi autorizzati a svolgere compiti di valutazione della conformità per conto di terzi a norma del presente regolamento.
Articolo 27 Autorità di notifica
1. Gli Stati membri designano un'autorità di notifica che è responsabile dell'istituzione e dell'esecuzione delle procedure necessarie per la valutazione e la notifica degli organismi di valutazione della conformità e il controllo degli organismi notificati, anche per quanto riguarda l'ottemperanza all'articolo 32.
2. Gli Stati membri possono decidere che la valutazione e il controllo di cui al paragrafo 1 siano eseguiti da un organismo nazionale di accreditamento quale definito dal regolamento (CE) n. 765/2008 in conformità di tale regolamento.
3. Se l'autorità di notifica delega o altrimenti affida la valutazione, la notifica o il controllo di cui al paragrafo 1 a un organismo che non è un ente pubblico, detto organismo è una persona giuridica e rispetta mutatis mutandis le prescrizioni stabilite all'articolo 28. Inoltre, tale organismo adotta disposizioni per disciplinare la responsabilità civile connessa alle proprie attività.
4. L'autorità di notifica si assume la piena responsabilità per i compiti svolti dall'organismo di cui al paragrafo 3.
Articolo 28 Prescrizioni relative alle autorità di notifica
1. L'autorità di notifica è istituita in modo che non sorgano conflitti d'interesse con gli organismi di valutazione della conformità.
2. L'autorità di notifica è organizzata e gestita in modo che siano salvaguardate l'obiettività e l'imparzialità delle sue attività.
3. L'autorità di notifica è organizzata in modo che ogni decisione relativa alla notifica di un organismo di valutazione della conformità sia adottata da persone competenti diverse da quelle che hanno effettuato la valutazione.
4. L'autorità di notifica non offre né fornisce attività svolte dagli organismi di valutazione della conformità e non offre né fornisce servizi di consulenza su base commerciale o concorrenziale.
5. L'autorità di notifica salvaguarda la riservatezza delle informazioni ottenute.
6. L'autorità di notifica ha a sua disposizione un numero di dipendenti competenti sufficiente per l'adeguata esecuzione dei suoi compiti.
Articolo 29 Obbligo di informazione delle autorità di notifica
Gli Stati membri informano la Commissione delle loro procedure per la valutazione e la notifica degli organismi di valutazione della conformità e per il controllo degli organismi notificati, nonché di qualsiasi modifica delle stesse.
La Commissione rende pubbliche dette informazioni.
Articolo 30 Prescrizioni relative agli organismi notificati
1. Ai fini della notifica, l'organismo di valutazione della conformità rispetta le prescrizioni di cui ai paragrafi da 2 a 11.
2. L'organismo di valutazione della conformità è istituito a norma del diritto nazionale di uno Stato membro e ha personalità giuridica.
3. L'organismo di valutazione della conformità è un organismo terzo indipendente dall'organizzazione o dalla macchina o prodotto correlato che valuta.
Un organismo appartenente a un'associazione d'imprese o a una federazione professionale che rappresenta imprese coinvolte nella progettazione, nella fabbricazione, nella fornitura, nell'assemblaggio, nell'utilizzo o nella manutenzione delle macchine o dei prodotti correlati oggetto della valutazione può essere ritenuto un organismo di valutazione della conformità a condizione che ne siano dimostrate l'indipendenza e l'assenza di qualsiasi conflitto di interesse.
4. Un organismo di valutazione della conformità, i suoi alti dirigenti e il personale incaricato di svolgere le funzioni di valutazione della conformità non sono né il progettista, né il fabbricante, né il fornitore, né l'importatore, né il distributore, né l'installatore, né l'acquirente, né il proprietario, né l'utilizzatore né il responsabile della manutenzione delle macchine o dei prodotti correlati che essi valutano, né svolgono detti ruoli in relazione a una quasi-macchina che sia stata incorporata nel prodotto valutato, né sono il rappresentante di uno di tali soggetti. Ciò non preclude l'uso delle macchine o dei prodotti correlati valutati che sia necessario per il funzionamento dell'organismo di valutazione della conformità o l'uso delle macchine o dei prodotti correlati per scopi privati.
L'organismo di valutazione della conformità, i suoi alti dirigenti e il personale incaricato di svolgere le funzioni di valutazione della conformità non intervengono direttamente nella progettazione, nell'importazione, nella distribuzione, nella fabbricazione, nella commercializzazione, nell'installazione, nell'utilizzo o nella manutenzione delle macchine o dei prodotti correlati, né rappresentano i soggetti impegnati in tali attività. Non svolgono alcuna attività che possa essere in conflitto con la loro indipendenza di giudizio o con la loro integrità per quanto riguarda le attività di valutazione della conformità per cui essi sono notificati. Ciò vale in particolare per i servizi di consulenza.
L'organismo di valutazione della conformità garantisce che le attività delle sue affiliate o dei suoi subappaltatori non si ripercuotano sulla riservatezza, sull'obiettività o sull'imparzialità delle sue attività di valutazione della conformità.
5. L'organismo di valutazione della conformità e il suo personale eseguono le operazioni di valutazione della conformità con il massimo dell'integrità professionale e della competenza tecnica richiesta nel settore specifico e sono liberi da qualsivoglia pressione o incentivo, soprattutto di ordine finanziario, che possa influenzare il loro giudizio o i risultati delle loro attività di valutazione, in particolare da persone o gruppi di persone interessati ai risultati di tali attività.
6. L'organismo di valutazione della conformità è in grado di eseguire tutti i compiti di valutazione della conformità assegnatigli in base agli allegati VII, IX e X e per i quali è stato notificato, indipendentemente dal fatto che tali compiti siano eseguiti dall'organismo stesso o per suo conto e sotto la sua responsabilità.
In ogni momento, per ogni procedura di valutazione della conformità e per ogni tipo di macchina o prodotto correlato per i quali è stato notificato, l'organismo di valutazione della conformità ha a sua disposizione:
a) personale con conoscenze tecniche ed esperienza sufficiente e appropriata per eseguire i compiti di valutazione della conformità;
b) le descrizioni delle procedure in base alle quali è svolta la valutazione della conformità, garantendo la trasparenza e la capacità di riproduzione di tali procedure;
c) le politiche e procedure del caso necessarie per distinguere i compiti svolti in qualità di organismo notificato dalle altre attività;
d) le procedure per svolgere i compiti di valutazione della conformità che tengono debitamente conto delle dimensioni di un'impresa, del settore in cui opera, della sua struttura, del grado di complessità della tecnologia della macchina o del prodotto correlato in questione e della natura di massa o seriale del processo produttivo.
L'organismo di valutazione della conformità deve disporre dei mezzi necessari per eseguire in modo appropriato i compiti tecnici e amministrativi connessi ai compiti di valutazione della conformità e deve avere accesso a tutti gli strumenti o impianti occorrenti.
7. Il personale responsabile dell'esecuzione dei compiti di valutazione della conformità deve disporre di quanto segue:
a) una formazione tecnica e professionale solida che include tutti i compiti di valutazione della conformità per cui l'organismo di valutazione della conformità è stato notificato;
b) soddisfacenti conoscenze delle prescrizioni relative alle valutazioni che esegue e un'adeguata autorità per eseguire tali valutazioni;
c) una conoscenza e una comprensione adeguate dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III, delle norme armonizzate applicabili e delle specifiche comuni di cui all'articolo 20 e delle disposizioni pertinenti della normativa di armonizzazione dell'Unione, nonché della normativa nazionale;
d) la capacità di redigere certificati, registri e relazioni a dimostrazione del fatto che le valutazioni sono state effettuate.
8. Deve essere garantita l'imparzialità degli organismi di valutazione della conformità, dei loro alti dirigenti e del personale addetto ai compiti di valutazione della conformità.
La remunerazione degli alti dirigenti e del personale addetto ai compiti di valutazione della conformità non dipende dal numero di valutazioni della conformità eseguite o dai risultati di tali valutazioni.
9. Un organismo di valutazione della conformità sottoscrive un contratto di assicurazione per la responsabilità civile, a meno che detta responsabilità non sia direttamente coperta dallo Stato membro a norma del diritto nazionale o che lo Stato membro stesso non sia direttamente responsabile della valutazione della conformità.
10. Il personale dell'organismo di valutazione della conformità è tenuto al segreto professionale per tutto ciò di cui viene a conoscenza nell'esercizio dei suoi compiti di valutazione della conformità a norma degli allegati VII, IX e X, tranne nei confronti delle autorità competenti dello Stato membro in cui esercita i suoi compiti. I diritti di proprietà, i diritti di proprietà intellettuale e i segreti commerciali sono protetti.
11. Un organismo di valutazione della conformità partecipa alle attività di normazione pertinenti e alle attività del gruppo di coordinamento degli organismi notificati, istituito a norma dell'articolo 42, o fa sì che il personale addetto ai compiti di valutazione della conformità ne sia informato, e applica come guida generale le decisioni e i documenti amministrativi prodotti da tale gruppo.
Articolo 31 Presunzione di conformità degli organismi notificati
Qualora dimostri la propria conformità ai criteri stabiliti nelle pertinenti norme armonizzate o in parti di esse i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell'Unione europea, un organismo di valutazione della conformità è considerato conforme alle prescrizioni stabilite dall'articolo 30 nella misura in cui le norme armonizzate applicabili contemplano tali requisiti.
Articolo 32 Ricorso a subappaltatori e affiliati da parte degli organismi notificati
1. L'organismo notificato, qualora subappalti compiti specifici connessi alla valutazione della conformità oppure ricorra a un'affiliata, garantisce che il subappaltatore o l'affiliata rispettino le prescrizioni stabilite all'articolo 30 e ne informa di conseguenza l'autorità di notifica.
2. L'organismo notificato si assume l'intera responsabilità dei compiti eseguiti da subappaltatori o affiliate, ovunque questi siano stabiliti.
3. Le attività possono essere subappaltate o eseguite da un'affiliata soltanto previo consenso del cliente.
4. Un organismo notificato tiene a disposizione dell'autorità di notifica i documenti relativi all'esame delle qualifiche del subappaltatore o dell'affiliata e al lavoro svolto da questi ultimi ai sensi degli allegati VII, IX e X.
Articolo 33 Domanda di notifica
1. L'organismo di valutazione della conformità presenta domanda di notifica all'autorità di notifica dello Stato membro in cui è stabilito.
2. La domanda di notifica è accompagnata da una descrizione delle attività di valutazione della conformità, delle procedure di valutazione della conformità di cui agli allegati VII, IX e X e dei tipi o delle categorie di macchine o prodotti correlati per i quali l'organismo di valutazione della conformità dichiara di essere competente, nonché da un certificato di accreditamento, laddove esista, rilasciato da un organismo nazionale di accreditamento che attesti che tale organismo soddisfa le prescrizioni stabilite all'articolo 30.
3. Qualora l'organismo di valutazione della conformità non possa fornire un certificato di accreditamento di cui al paragrafo 2, esso fornisce all'autorità di notifica tutte le prove documentali necessarie per la verifica, il riconoscimento e il controllo periodico della sua conformità alle prescrizioni di cui all'articolo 30.
Articolo 34 Procedura di notifica
1. L'autorità di notifica effettua la notifica soltanto degli organismi di valutazione della conformità che soddisfano le prescrizioni di cui all'articolo 30.
2. L'autorità di notifica effettua la notifica alla Commissione e agli altri Stati membri utilizzando lo strumento elettronico di notifica sviluppato e gestito dalla Commissione.
3. La notifica di cui al paragrafo 2 comprende gli elementi seguenti:
a) dettagli completi delle attività di valutazione della conformità da svolgere;
b) un'indicazione del modulo o dei moduli di valutazione della conformità e dei tipi o categorie di macchine o prodotti correlati interessati;
c) l'attestazione pertinente della competenza.
4. Qualora una notifica non sia basata su un certificato di accreditamento di cui all'articolo 33, paragrafo 2, l'autorità di notifica fornisce alla Commissione e agli altri Stati membri le prove documentali che attestino la competenza dell'organismo di valutazione della conformità nonché le disposizioni predisposte per fare in modo che tale organismo sia monitorato periodicamente e continui a soddisfare le prescrizioni stabilite all'articolo 30.
5. L'organismo di valutazione della conformità interessato può eseguire le attività di un organismo notificato solo se non sono sollevate obiezioni da parte della Commissione o degli altri Stati membri entro due settimane dalla convalida della notifica, qualora essa includa un certificato di accreditamento di cui all'articolo 33, paragrafo 2, o entro due mesi dalla notifica qualora essa includa le prove documentali di cui al paragrafo 4 del presente articolo.
Solo tale organismo è considerato un organismo notificato ai fini del presente regolamento.
6. L'autorità di notifica effettua una notifica alla Commissione e agli altri Stati membri in merito a eventuali modifiche pertinenti successive riguardanti la notifica di cui al paragrafo 2.
Articolo 35 Numeri di identificazione ed elenchi degli organismi notificati
1. La Commissione assegna un numero di identificazione a ciascun organismo notificato.
La Commissione assegna un numero unico anche se l'organismo è notificato ai sensi di diversi atti dell'Unione.
2. La Commissione mette a disposizione del pubblico l'elenco degli organismi notificati a norma del presente regolamento, inclusi i numeri di identificazione loro assegnati e le attività di valutazione della conformità per le quali sono stati notificati.
La Commissione provvede a far sì che l'elenco sia tenuto aggiornato.
Articolo 36 Modifiche delle notifiche
1. Qualora accerti o sia informata che un organismo notificato non è più conforme alle prescrizioni di cui all'articolo 30 o non adempie i suoi obblighi di cui all'articolo 38, l'autorità di notifica limita, sospende o ritira la notifica, a seconda dei casi, in funzione della gravità del mancato rispetto di tali prescrizioni o dell'inadempimento di tali obblighi. Essa ne informa immediatamente la Commissione e gli altri Stati membri.
2. Nei casi di limitazione, sospensione o ritiro della notifica, oppure di cessazione dell'attività dell'organismo notificato, l'autorità di notifica adotta le misure appropriate per garantire che le pratiche di tale organismo siano evase da un altro organismo notificato o siano messe a disposizione delle autorità di notifica e di vigilanza del mercato responsabili, su loro richiesta.
Articolo 37 Contestazione della competenza degli organismi notificati
1. La Commissione indaga su tutti i casi in cui abbia dubbi o siano portati alla sua attenzione dubbi sulla competenza di un organismo notificato o sulla continua ottemperanza di un organismo notificato alle prescrizioni e alle responsabilità cui è sottoposto.
2. Lo Stato membro di notifica fornisce alla Commissione, su richiesta, tutte le informazioni relative alla base della notifica o del mantenimento della competenza dell'organismo notificato interessato.
3. La Commissione garantisce la riservatezza di tutte le informazioni sensibili raccolte nel corso delle sue indagini.
4. La Commissione, qualora accerti che un organismo notificato non soddisfa o non soddisfa più i requisiti per la sua notifica, adotta un atto di esecuzione con cui chiede allo Stato membro di notifica di prendere le misure correttive necessarie incluso, all'occorrenza, il ritiro della notifica.
Tale atto di esecuzione è adottato secondo la procedura consultiva di cui all'articolo 48, paragrafo 2.
Articolo 38 Obblighi operativi degli organismi notificati
1. Un organismo notificato esegue le valutazioni della conformità secondo le procedure di valutazione della conformità di cui agli allegati VII, IX e X.
2. L'organismo notificato svolge le proprie attività in modo proporzionato, evitando oneri inutili per gli operatori economici e tenendo debitamente conto delle dimensioni di un'impresa, del settore in cui opera, della struttura dell'impresa, del grado di complessità della tecnologia in questione e della natura seriale o di massa del processo di produzione.
Nel fare ciò l'organismo notificato rispetta tuttavia il grado di rigore e il livello di tutela necessari per la conformità della macchina o del prodotto correlato rispetto alle prescrizioni del presente regolamento.
3. Se un organismo notificato rileva che un fabbricante non ha rispettato i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III o le corrispondenti norme armonizzate o specifiche comuni di cui all'articolo 20, chiede a tale fabbricante di intraprendere le azioni correttive appropriate e non rilascia un certificato di esame UE del tipo, non adotta una decisione di approvazione dei sistemi di qualità né rilascia un certificato di verifica dell’unità.
4. L'organismo notificato che, nel corso del monitoraggio della conformità successivo all'adozione di una decisione di approvazione, conformemente all'allegato IX, rilevi che una macchina o un prodotto correlato non sono più conformi, chiede al fabbricante di intraprendere le azioni correttive opportune e all'occorrenza sospende o ritira la decisione di approvazione, se necessario.
Qualora non siano intraprese azioni correttive o non producano il risultato richiesto, l'organismo notificato limita, sospende o ritira le decisioni di approvazione, a seconda dei casi.
Articolo 39 Ricorsi contro le decisioni degli organismi notificati
Un organismo notificato provvede affinché sia disponibile una procedura di ricorso trasparente e accessibile contro le proprie decisioni.
Articolo 40 Obbligo di informazione a carico degli organismi notificati
1. L'organismo notificato informa l'autorità di notifica:
a) di qualunque rifiuto, limitazione, sospensione o ritiro di un certificato di esame UE del tipo, non adotta una decisione di approvazione dei sistemi di qualità né rilascia un certificato di verifica dell’unità;
b) di qualunque circostanza che possa influire sull'ambito o sulle condizioni della sua notifica;
c) di qualunque richiesta di informazioni che abbia ricevuto dalle autorità di vigilanza del mercato in relazione alle sue attività di valutazione della conformità;
d) su richiesta, di qualunque attività di valutazione della conformità eseguita nell'ambito della sua notifica e di qualsiasi altra attività eseguita, incluse quelle transfrontaliere e di subappalto.
2. L'organismo notificato fornisce agli altri organismi notificati a norma del presente regolamento, le cui attività di valutazione della conformità sono simili e hanno come oggetto gli stessi tipi di macchina o prodotti correlati, informazioni pertinenti su questioni relative ai risultati negativi e, su richiesta, positivi della valutazione della conformità.
Articolo 41 Scambio di esperienze
La Commissione provvede all'organizzazione di uno scambio di esperienze tra le autorità nazionali degli Stati membri responsabili della politica di notifica.
Articolo 42 Coordinamento degli organismi notificati
La Commissione garantisce l'istituzione e il corretto funzionamento di un coordinamento e una cooperazione appropriati tra organismi notificati a norma del presente regolamento sotto forma di un gruppo settoriale di organismi notificati.
Gli organismi notificati partecipano al lavoro di tale gruppo, direttamente o mediante rappresentanti designati.
CAPO VI
VIGILANZA DEL MERCATO DELL'UNIONE E PROCEDURE DI SALVAGUARDIA DELL'UNIONE
Articolo 43 Procedura a livello nazionale per i prodotti rientranti nell'ambito di applicazione del presente regolamento che presentano rischi
1. Le autorità di vigilanza del mercato di uno degli Stati membri, qualora abbiano sufficienti ragioni per ritenere che un prodotto rientrante nell'ambito di applicazione del presente regolamento rappresenti un rischio per la salute o la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente, effettuano una valutazione del prodotto interessato che investa tutte le prescrizioni pertinenti del presente regolamento. A tal fine, gli operatori economici interessati cooperano ove necessario con le autorità di vigilanza del mercato.
Se, attraverso la valutazione di cui al primo comma, le autorità di vigilanza del mercato concludono che il prodotto rientrante nell'ambito di applicazione del presente regolamento non rispetta le prescrizioni del presente regolamento, richiedono tempestivamente all'operatore economico interessato di adottare le misure correttive proporzionate del caso, come previsto dall'articolo 16, paragrafo 3, del regolamento (UE) 2019/1020, al fine di porre termine allo stato di non conformità oppure di eliminare i rischi o, ove ciò non fosse possibile, di ridurre al minimo il rischio identificato dalle autorità di vigilanza del mercato entro un termine ragionevole e proporzionato alla natura del rischio di cui al primo comma.
Le autorità di vigilanza del mercato ne informano l'organismo notificato competente.
2. Qualora ritengano che l'inadempienza non sia limitata al territorio nazionale, le autorità di vigilanza del mercato informano la Commissione e gli altri Stati membri dei risultati della valutazione e delle misure che hanno richiesto all'operatore economico di adottare.
3. L'operatore economico provvede affinché siano adottate tutte le opportune misure correttive in tutta l'Unione nei confronti dei prodotti rientranti nell'ambito di applicazione del presente regolamento che lo stesso ha messo a disposizione sul mercato.
4. Qualora l'operatore economico interessato non adotti le misure correttive di cui al paragrafo 1, secondo comma, entro il termine specificato, o qualora la non conformità di cui al paragrafo 1, secondo comma, o il rischio di cui al paragrafo 1, primo comma, permangano, le autorità di vigilanza del mercato provvedono affinché il prodotto interessato sia ritirato o richiamato, o che la sua messa a disposizione sul mercato sia vietata o limitata. In tali casi, le autorità di vigilanza del mercato provvedono affinché il pubblico, la Commissione e gli altri Stati membri ne siano informati immediatamente.
5. Le informazioni di cui al paragrafo 4 comprendono tutti i dettagli disponibili, in particolare i dati necessari all'identificazione del prodotto non conforme rientrante nell'ambito di applicazione del presente regolamento, la sua origine, la natura della presunta non conformità e dei rischi connessi, la natura e la durata delle misure nazionali adottate, nonché le argomentazioni espresse dall'operatore economico interessato. In particolare, le autorità di vigilanza del mercato indicano se la non conformità sia dovuta a una delle circostanze seguenti:
a) mancato rispetto da parte del prodotto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) lacune delle norme armonizzate di cui all'articolo 20, paragrafo 1;
c) lacune delle specifiche comuni di cui all'articolo 20, paragrafo 6.
6. Gli Stati membri diversi da quello che ha avviato la procedura a norma del presente articolo comunicano senza ritardo alla Commissione e agli altri Stati membri le eventuali misure adottate, qualsiasi informazione supplementare a loro disposizione riguardante la non conformità del prodotto interessato rientrante nell'ambito di applicazione del presente regolamento e, in caso di disaccordo con la misura nazionale adottata, le loro obiezioni.
7. Qualora, entro tre mesi dal ricevimento delle informazioni di cui al paragrafo 4, uno Stato membro o la Commissione non sollevino obiezioni contro la misura provvisoria presa da uno Stato membro, tale misura è ritenuta giustificata.
8. Gli Stati membri provvedono affinché siano adottate senza ritardo le opportune misure restrittive in relazione al prodotto interessato rientrante nell'ambito di applicazione del presente regolamento, quali il suo ritiro dal mercato.
Articolo 44 Procedura di salvaguardia dell'Unione
1. Se, in esito alla procedura di cui all'articolo 43, paragrafi 4, 6 e 7, sono sollevate obiezioni contro una misura assunta da uno Stato membro o se la Commissione ritiene la misura nazionale contraria agli atti giuridici dell'Unione, la Commissione si consulta senza ritardo con gli Stati membri e con l'operatore o gli operatori economici interessati e valuta la misura nazionale.
In base ai risultati di tale valutazione, la Commissione determina, mediante un atto di esecuzione che assume la forma di una decisione, se la misura nazionale sia giustificata o meno.
La Commissione indirizza la propria decisione a tutti gli Stati membri e la comunica senza ritardo ad essi e all'operatore o agli operatori economici interessati.
2. Se la misura nazionale è ritenuta giustificata, tutti gli Stati membri provvedono affinché siano adottate le opportune misure restrittive, come il ritiro, nei confronti del prodotto non conforme rientrante nell'ambito di applicazione del presente regolamento e ne informano la Commissione.
Se la misura nazionale è ritenuta ingiustificata, lo Stato membro interessato la revoca.
3. Se la misura nazionale è ritenuta giustificata e la non conformità del prodotto rientrante nell'ambito di applicazione del presente regolamento è attribuita a lacune nelle norme armonizzate di cui all'articolo 43, paragrafo 5, lettera b), del presente regolamento o nelle o nelle specifiche comuni di cui all'articolo 43, paragrafo 5, lettera c), del presente regolamento, la Commissione applica, rispettivamente, la procedura di cui all'articolo 11 del regolamento (UE) n. 1025/2012 o all'articolo 20, paragrafo 8, del presente regolamento.
Articolo 45 Prodotti conformi rientranti nell'ambito di applicazione del presente regolamento che presentano un rischio
1. Se uno Stato membro, dopo aver effettuato una valutazione ai sensi dell'articolo 43, paragrafo 1, ritiene che un prodotto rientrante nell'ambito di applicazione del presente regolamento, pur conforme ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III, presenti un rischio per la salute o la sicurezza delle persone e, ove opportuno, degli animali domestici nonché per la tutela dei beni e, se del caso, dell'ambiente, richiede all'operatore economico interessato di adottare ogni misura opportuna per garantire che tale prodotto, all'atto della sua immissione sul mercato, non presenti più tale rischio o che sia ritirato o richiamato entro un termine ragionevole, proporzionato alla natura del rischio.
2. L'operatore economico assicura che siano adottate tutte le misure correttive appropriate in tutta l’Unione nei confronti di tutti i prodotti rientranti nell'ambito di applicazione del presente regolamento interessati che ha messo a disposizione sul mercato.
3. Lo Stato membro informa immediatamente la Commissione e gli altri Stati membri in merito al prodotto che presenta un rischio, ai sensi del paragrafo 1. Tali informazioni includono tutti i dettagli disponibili, in particolare i dati necessari all'identificazione del prodotto interessato, l'origine e la catena di approvvigionamento del prodotto, la natura del rischio connesso nonché la natura e la durata delle misure nazionali adottate.
4. La Commissione avvia immediatamente consultazioni con gli Stati membri e l'operatore o gli operatori economici interessati e valuta le misure nazionali adottate.
In base ai risultati della valutazione la Commissione adotta un atto di esecuzione che assume la forma di una decisione che definisce se la misura nazionale sia giustificata o meno e impone, all'occorrenza, le opportune misure.
Tale atto di esecuzione è adottato secondo la procedura d'esame di cui all'articolo 48, paragrafo 3.
Per imperativi motivi d'urgenza debitamente giustificati connessi alla tutela della salute e alla sicurezza delle persone, la Commissione adotta un atto di esecuzione immediatamente applicabile secondo la procedura di cui all'articolo 48, paragrafo 4.
5. La Commissione indirizza la propria decisione a tutti gli Stati membri e la comunica immediatamente ad essi e all'operatore o agli operatori economici interessati.
Articolo 46 Non conformità formale
1. Fatto salvo l'articolo 43, se uno Stato membro giunge a una delle conclusioni seguenti in merito a una macchina o a un prodotto correlato richiede all'operatore economico interessato di porre fine allo stato di non conformità in questione:
a) la marcatura CE è stata apposta in violazione dell'articolo 30 del regolamento (CE) n. 765/2008 o dell'articolo 24 del presente regolamento;
b) la marcatura CE non è stata apposta;
c) il numero di identificazione dell'organismo notificato che interviene nella fase di controllo della produzione è stato apposto in violazione dell'articolo 24, paragrafo 3, o non è stato apposto;
d) la dichiarazione di conformità UE non è stata compilata o non è stata compilata correttamente;
e) la documentazione tecnica non è disponibile o è incompleta;
f) le informazioni di cui all'articolo 10, paragrafo 6, o all'articolo 13, paragrafo 3, sono assenti, false o incomplete;
g) non sono rispettate altre prescrizioni amministrative di cui all'articolo 10 o all'articolo 13.
2. Fatto salvo l'articolo 43, se uno Stato membro giunge a una delle conclusioni seguenti in merito a una quasi-macchina, chiede all'operatore economico interessato di porre fine allo stato di non conformità in questione:
a) la dichiarazione di incorporazione UE non è stata compilata o non è stata compilata correttamente;
b) la documentazione tecnica non è disponibile o è incompleta;
c) le informazioni di cui all'articolo 11, paragrafo 5, o all'articolo 14, paragrafo 3, sono assenti, false o incomplete;
d) non sono rispettate altre prescrizioni amministrative di cui all'articolo 11 o all'articolo 14.
3. Se la non conformità di cui ai paragrafi 1 e 2 permane, lo Stato membro interessato provvede a limitare o proibire la messa a disposizione sul mercato del prodotto interessato rientrante nell'ambito di applicazione del presente regolamento o provvede affinché sia richiamato o ritirato dal mercato.
CAPO VII
DELEGA DI POTERI E PROCEDURA DI COMITATO
Articolo 47 Esercizio della delega
1. Il potere di adottare atti delegati è conferito alla Commissione alle condizioni stabilite nel presente articolo.
2. Il potere di adottare atti delegati di cui all'articolo 6, paragrafi 2 e 11, e all'articolo 7, paragrafo 2, è conferito alla Commissione per un periodo di cinque anni a decorrere dal 19 luglio 2023. La Commissione predispone una relazione sulla delega di potere al più tardi nove mesi prima della scadenza del periodo di cinque anni. La delega di potere è tacitamente prorogata per periodi di identica durata, a meno che il Parlamento europeo o il Consiglio non si oppongano a tale proroga al più tardi tre mesi prima della scadenza di ciascun periodo.
3. La delega di potere di cui all’articolo 6, paragrafi 2 e 11, e all’articolo 7, paragrafo 2, può essere revocata in qualsiasi momento dal Parlamento europeo o dal Consiglio. La decisione di revoca pone fine alla delega di potere ivi specificata. Gli effetti della decisione decorrono dal giorno successivo alla pubblicazione della decisione nella Gazzetta ufficiale dell’Unione europea o da una data successiva ivi specificata. Essa non pregiudica la validità degli atti delegati già in vigore.
4. Prima dell’adozione dell’atto delegato la Commissione consulta gli esperti designati da ciascuno Stato membro nel rispetto dei principi stabiliti nell’accordo interistituzionale “Legiferare meglio” del 13 aprile 2016.
5. Non appena adotta un atto delegato, la Commissione ne dà contestualmente notifica al Parlamento europeo e al Consiglio.
6. Un atto delegato adottato ai sensi dell’articolo 6, paragrafi 2 e 11, e dell’articolo 7, paragrafo 2, entra in vigore solo se né il Parlamento europeo né il Consiglio hanno sollevato obiezioni entro il termine di due mesi dalla data in cui esso è stato loro notificato o se, prima della scadenza di tale termine, sia il Parlamento europeo che il Consiglio hanno informato la Commissione che non intendono sollevare obiezioni. Tale termine è prorogato di due mesi su iniziativa del Parlamento europeo o del Consiglio.
Articolo 48 Procedura di comitato
1. La Commissione è assistita da un comitato. Esso è un comitato ai sensi del regolamento (UE) n. 182/2011.
2. Nei casi in cui è fatto riferimento al presente paragrafo, si applica l’articolo 4 del regolamento (UE) n. 182/2011.
3. Nei casi in cui è fatto riferimento al presente paragrafo, si applica l’articolo 5 del regolamento (UE) n. 182/2011.
Qualora il comitato non esprima alcun parere in merito al progetto di atto di esecuzione di cui all’articolo 20, paragrafo 3, si applica l’articolo 5, paragrafo 4, terzo comma, del regolamento (UE) n. 182/2011.
4. Nei casi in cui è fatto riferimento al presente paragrafo, si applica l’articolo 8 del regolamento (UE) n. 182/2011 in combinato disposto con l’articolo 5 dello stesso.
5. La Commissione consulta il comitato nelle questioni per le quali la consultazione di esperti del settore è richiesta a norma del regolamento (UE) n. 1025/2012 o di qualsiasi altro atto giuridico dell’Unione.
Il comitato può inoltre esaminare qualsiasi altra questione riguardante l’applicazione del presente regolamento sollevata dal suo presidente o da un rappresentante di uno Stato membro in conformità del suo regolamento interno.
CAPO VIII RISERVATEZZA E SANZIONI
Articolo 49 Riservatezza
1. Tutte le parti rispettano la riservatezza delle informazioni e dei dati seguenti ottenuti nello svolgimento dei loro compiti conformemente al presente regolamento:
a) i dati personali;
b) informazioni commercialmente riservate e segreti commerciali di una persona fisica o giuridica, compresi i diritti di proprietà intellettuale, salvo che la divulgazione sia nell'interesse pubblico.
2. Fatto salvo il paragrafo 1, le informazioni scambiate in via riservata tra le autorità nazionali competenti e tra queste ultime e la Commissione non sono divulgate senza il preventivo accordo dell'autorità nazionale competente dalla quale tali informazioni provengono.
3. I paragrafi 1 e 2 non pregiudicano i diritti e gli obblighi della Commissione, degli Stati membri e degli organismi notificati in materia di scambio delle informazioni e di diffusione degli avvisi di sicurezza né gli obblighi delle persone interessate di fornire informazioni ai sensi del diritto penale.
4. La Commissione e gli Stati membri possono scambiare informazioni riservate con le autorità di regolamentazione di paesi terzi con i quali abbiano concluso accordi e intese di riservatezza, bilaterali o multilaterali qualora tali accordi e intese garantiscano che qualsiasi scambio di informazioni sia conforme al diritto dell'Unione applicabile.
Articolo 50 Sanzioni
1. Gli Stati membri stabiliscono le norme sulle sanzioni applicabili in caso di violazione del presente regolamento da parte degli operatori economici e adottano tutte le misure necessarie per assicurarne l'attuazione. Le sanzioni previste sono efficaci, proporzionate e dissuasive e possono comprendere sanzioni penali per violazioni gravi.
2. Entro il 20 ottobre 2026 gli Stati membri notificano tali norme e tali provvedimenti alla Commissione e notificano immediatamente qualsiasi successiva modifica ad essi apportata.
CAPO IX
DISPOSIZIONI TRANSITORIE E FINALI
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 19 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 53 Valutazione e riesame
1. Entro il 20 luglio 2028 e, successivamente, ogni quattro anni, la Commissione presenta una relazione sulla valutazione e sul riesame del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
2. Tenendo conto del progresso tecnico e dell'esperienza pratica acquisita negli Stati membri come specificato all'articolo 6, la Commissione include nella relazione una valutazione dei aspetti seguenti del presente regolamento:
a) i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) la procedura di valutazione della conformità applicabile alle macchine o ai prodotti correlati elencati nell’allegato I.
Se del caso, la relazione è corredata di una proposta legislativa di modifica delle pertinenti disposizioni del presente regolamento.
3. Entro il 20 luglio 2026 e, successivamente, ogni cinque anni, la Commissione presenta una relazione specifica sulla valutazione dell'articolo 6, paragrafi 4 e 5, del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
La Commissione include nelle sue relazioni gli elementi seguenti:
a) una sintesi dei dati e delle informazioni forniti dagli Stati membri a norma dell'articolo 6, paragrafo 5, durante il periodo di riferimento;
b) una valutazione dell'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I alla luce dei criteri di cui all'articolo 6, paragrafo 4.
Nelle relazioni la Commissione valuta l'adeguatezza e la disponibilità dei dati e delle informazioni forniti dagli Stati membri, comprese la loro adeguatezza e idoneità al fine di effettuare confronti, individuando eventuali carenze onde garantire il funzionamento efficace e l'applicazione dell'articolo 6.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 20 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2026;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
____________
ALLEGATO I
CATEGORIE DI MACCHINE O PRODOTTI CORRELATI PER LE QUALI VA APPLICATA UNA DELLE PROCEDURE DI CUI ALL'ARTICOLO 25, PARAGRAFI 2 E 3
Parte A
Categorie di macchine o prodotti correlati per le quali va applicata una delle procedure di cui all'articolo 25, paragrafo 2:
1. Dispositivi amovibili di trasmissione meccanica, compresi i loro ripari.
2. Ripari dei dispositivi amovibili di trasmissione meccanica.
3. Ponti elevatori per veicoli.
4. Apparecchi portatili a carica esplosiva per il fissaggio o altre macchine ad impatto.
5. Componenti di sicurezza dotati di un comportamento integralmente o parzialmente autoevolutivo che utilizzano approcci di apprendimento automatico che garantiscono funzioni di sicurezza.
6. Macchine che integrano sistemi con un comportamento integralmente o parzialmente autoevolutivo che utilizzano approcci di apprendimento automatico che garantiscono funzioni di sicurezza che non sono state immesse in modo indipendente sul mercato, solo per quanto riguarda tali sistemi.
Parte B
Categorie di macchine o prodotti correlati per le quali va applicata una delle procedure di cui all'articolo 25, paragrafo 3:
1. Seghe circolari (monolama e multilame) per la lavorazione del legno e di materie con caratteristiche fisiche simili o per la lavorazione della carne e di materie con caratteristiche fisiche simili, dei tipi seguenti:
1.1. seghe a lama/e in posizione fissa nel corso del taglio, con tavola o supporto del pezzo fissi, con avanzamento manuale del pezzo o con dispositivo di trascinamento amovibile;
1.2. seghe a lama/e in posizione fissa nel corso del taglio, a tavola cavalletto o carrello a movimento alternato, a spostamento manuale;
1.3. seghe a lama/e in posizione fissa nel corso del taglio, dotate di un dispositivo di avanzamento integrato dei pezzi da segare a carico e/o scarico manuale;
1.4. seghe a lama/e mobile/i durante il taglio, a dispositivo di avanzamento integrato, a carico e/o scarico manuale.
2. Spianatrici ad avanzamento manuale per la lavorazione del legno.
3. Piallatrici su una faccia, ad avanzamento integrato, a carico e/o scarico manuale per la lavorazione del legno.
4. Seghe a nastro a carico e/o scarico manuale per la lavorazione del legno e di materie con caratteristiche fisiche simili o per la lavorazione della carne e di materie con caratteristiche fisiche simili, dei tipi seguenti:
4.1. seghe a lama/e in posizione fissa durante il taglio, con tavola o supporto del pezzo fissi o a movimento alternato;
4.2. seghe a lama/e montata/e su un carrello a movimento alternato.
5. Macchine combinate dei tipi di cui ai punti da 1 a 4 e al punto 7 per la lavorazione del legno e di materie con caratteristiche fisiche simili.
6. Tenonatrici a mandrini multipli ad avanzamento manuale per la lavorazione del legno.
7. Fresatrici ad asse verticale, "toupies" ad avanzamento manuale per la lavorazione del legno e di materie con caratteristiche fisiche simili.
8. Seghe a catena portatili da legno.
9. Presse, comprese le piegatrici, per la lavorazione a freddo dei metalli, a carico e/o scarico manuale, i cui elementi mobili di lavoro possono avere una corsa superiore a 6 mm e una velocità superiore a 30 mm/s.
10. Formatrici delle materie plastiche per iniezione o compressione a carico o scarico manuale.
11. Formatrici della gomma a iniezione o compressione, a carico o scarico manuale.
12. Macchine per lavori sotterranei dei tipi seguenti:
12.1. locomotive e benne di frenatura;
12.2. armatura semovente idraulica.
13. Veicoli per la raccolta di rifiuti domestici a carico manuale dotate di un meccanismo di compressione.
14. Apparecchi per il sollevamento di persone o di persone e cose, con pericolo di caduta verticale superiore a 3 metri.
15. Dispositivi di protezione per rilevare la presenza di persone.
16. Ripari mobili automatici interbloccati progettati per essere utilizzati come mezzi di protezione nelle macchine di cui ai punti 9, 10 e 11 della presente parte.
17. Blocchi logici per assicurare funzioni di sicurezza.
18. Strutture di protezione in caso di ribaltamento (ROPS).
19. Strutture di protezione contro la caduta di oggetti (FOPS).
ALLEGATO II
ELENCO INDICATIVO DI COMPONENTI DI SICUREZZA
1. Ripari dei dispositivi amovibili di trasmissione meccanica.
2. Dispositivi di protezione per rilevare la presenza di persone.
3. Ripari mobili automatici interbloccati progettati per essere utilizzati come mezzi di protezione nelle macchine di cui ai punti 9, 10 e 11 dell'allegato I, Parte B.
4. Blocchi logici per assicurare funzioni di sicurezza.
5. Valvole dotate di mezzi ausiliari per il rilevamento di guasti destinate ad essere utilizzate per il comando dei movimenti pericolosi delle macchine.
6. Sistemi di estrazione per le emissioni delle macchine.
7. Ripari e dispositivi di protezione destinati a proteggere le persone esposte contro gli elementi mobili coinvolti nel processo di lavorazione delle macchine.
8. Dispositivi di controllo del carico e dei movimenti delle macchine per il sollevamento.
9. Sistemi di ritenzione per mantenere le persone sul sedile.
10. Dispositivi di arresto di emergenza.
11. Sistemi di scarico per evitare la formazione di cariche elettrostatiche potenzialmente pericolose.
12. Limitatori di energia e dispositivi di sicurezza citati ai punti 1.5.7, 3.4.7 e 4.1.2.6 dell'allegato III.
13. Sistemi e dispositivi destinati a ridurre l'emissione di rumore e di vibrazioni.
14. Strutture di protezione in caso di ribaltamento (ROPS).
15. Strutture di protezione contro la caduta di oggetti (FOPS).
16. Dispositivi di comando a due mani.
17. I componenti seguenti per macchine progettate per la salita e/o la discesa di persone da un piano all'altro:
a) dispositivi di bloccaggio delle porte di piano;
b) dispositivi che impediscono la caduta dell'unità di carico o movimenti ascendenti incontrollati;
c) dispositivi di limitazione di velocità eccessiva;
d) ammortizzatori ad accumulazione di energia, a caratteristica non lineare o con smorzamento del movimento di ritorno;
e) ammortizzatori a dissipazione di energia;
f) dispositivi di sicurezza su martinetti dei circuiti idraulici e utilizzati come dispositivi paracadute;
g) interruttori di sicurezza con componenti elettronici.
18. Software che garantisce funzioni di sicurezza.
19. Componenti di sicurezza dotati di un comportamento integralmente o parzialmente autoevolutivo che utilizzano approcci di apprendimento automatico che garantiscono funzioni di sicurezza.
20. Sistemi di filtrazione destinati ad essere integrati in cabine di macchine al fine di proteggere gli operatori o altre persone contro materiali e sostanze pericolosi, compresi i prodotti fitosanitari e filtri per tali sistemi di filtrazione.
ALLEGATO III
REQUISITI ESSENZIALI DI SICUREZZA E DI TUTELA DELLA SALUTE RELATIVI ALLA PROGETTAZIONE E ALLA COSTRUZIONE DI MACCHINE O PRODOTTI CORRELATI
Parte A DEFINIZIONI
Ai fini del presente allegato si intende per:
a) "pericolo": una potenziale fonte di lesione o danno alla salute;
b) "zona pericolosa": qualsiasi zona all'interno e/o in prossimità di una macchina o di un prodotto correlato in cui la presenza di una persona costituisca un rischio per la sicurezza o la salute di detta persona;
c) "persona esposta": qualsiasi persona che si trovi interamente o in parte in una zona pericolosa;
d) "operatore": la persona o le persone incaricate di installare, di far funzionare, di regolare, di pulire, di riparare e di spostare una macchina o un prodotto correlato o di eseguirne la manutenzione;
e) "rischio", combinazione della probabilità e della gravità di una lesione o di un danno per la salute che possano insorgere in una situazione pericolosa;
f) "riparo": elemento di una macchina o di un prodotto correlato utilizzato specificamente per garantire la protezione tramite una barriera materiale;
g) "dispositivo di protezione": dispositivo (diverso da un riparo) che riduce il rischio, da solo o associato ad un riparo;
h) "uso previsto": l'uso di una macchina o di un prodotto correlato conformemente alle informazioni fornite nelle istruzioni per l'uso;
i) "uso scorretto ragionevolmente prevedibile": l'uso di una macchina o di un prodotto correlato in un modo diverso da quello indicato nelle istruzioni per l'uso, ma che può derivare dal comportamento umano facilmente prevedibile.
Parte B PRINCIPI GENERALI
1. Il fabbricante di una macchina o di un prodotto correlato deve provvedere affinché sia effettuata una valutazione del rischio per stabilire i requisiti essenziali di sicurezza e di tutela della salute che concernono la macchina o il prodotto correlato. La macchina o il prodotto correlato devono inoltre essere progettati e costruiti per eliminare i rischi o, ove non sia possibile, ridurre al minimo tutti i rischi pertinenti, tenendo conto dei risultati della valutazione del rischio.
Con il processo iterativo della valutazione del rischio e della riduzione del rischio di cui al primo comma, il fabbricante:
a) stabilisce i limiti della macchina o del prodotto correlato, il che comprende l'uso previsto e l'uso scorretto ragionevolmente prevedibile;
b) individua i pericoli cui può dare origine la macchina o il prodotto correlato e le situazioni pericolose che ne derivano;
c) stima i rischi, tenendo conto della gravità dell'eventuale lesione o danno alla salute e della probabilità che si verifichi;
d) valuta i rischi al fine di stabilire se sia richiesta una riduzione del rischio conformemente all'obiettivo del presente regolamento;
e) elimina i pericoli o riduce i rischi che ne derivano, applicando le misure di protezione nell'ordine indicato nel punto 1.1.2, lettera b).
La valutazione del rischio e la riduzione del rischio includono i pericoli che possono manifestarsi durante il ciclo di vita della macchina o del prodotto correlato prevedibili al momento dell'immissione della macchina o del prodotto correlato sul mercato come un'evoluzione prevista del suo comportamento o della sua logica integralmente o parzialmente autoevolutivi in ragione del fatto che tale macchina o prodotto correlato è progettato per funzionare con livelli variabili di autonomia.
La valutazione del rischio e la riduzione del rischio comprendono i rischi derivanti dalle interazioni tra macchine che per raggiungere uno stesso risultato sono disposte e comandate in modo da avere un funzionamento solidale, formando così una macchina come definita all'articolo 3, punto 1, lettera d).
2. Gli obblighi previsti dai requisiti essenziali di sicurezza e di tutela della salute si applicano soltanto se esiste il pericolo corrispondente per la macchina o il prodotto correlato in questione, allorché viene utilizzato nelle condizioni previste dal fabbricante o in condizioni anormali prevedibili. Tuttavia, il principio di integrazione della sicurezza di cui al punto 1.1.2 e gli obblighi relativi alla marcatura delle macchine o dei prodotti correlati di cui al punto 1.7.3 e alle istruzioni per l’uso di cui al punto 1.7.4 si applicano in ogni caso.
3. I requisiti essenziali di sicurezza e di tutela della salute elencati nel presente allegato sono inderogabili; tuttavia, tenuto conto dello stato dell’arte, gli obiettivi da essi prefissi possono non essere raggiunti. In tal caso, la macchina o il prodotto correlato, per quanto possibile, deve essere progettato e costruito per tendere verso tali obiettivi.
4. Il presente allegato si articola in sei capi. Il primo capo ha una portata generale e si applica a tutte le macchine o prodotti correlati. Gli altri capi si riferiscono a taluni tipi di pericoli più specifici. Tuttavia, è indispensabile esaminare il presente allegato in tutte le sue parti, al fine di essere certi di soddisfare tutti i pertinenti requisiti essenziali di sicurezza e di tutela della salute. Nel progettare la macchina o un prodotto correlato si tiene conto dei requisiti contenuti nel primo capo e di quelli elencati in uno o più degli altri capi, in funzione dei risultati della valutazione del rischio condotta in conformità del punto 1 dei presenti principi generali. I requisiti essenziali di sicurezza e di tutela della salute per la tutela dell'ambiente sono applicabili unicamente alle macchine o ai prodotti correlati a di cui al punto 2.4.
5. I presenti principi generali si applicano alla valutazione del rischio effettuata dal fabbricante di quasi-macchine.
1. REQUISITI ESSENZIALI DI SICUREZZA E DI TUTELA DELLA SALUTE
1.1. CONSIDERAZIONI GENERALI
1.1.1. Applicabilità
Gli obblighi previsti dai requisiti essenziali di sicurezza e di tutela della salute si applicano alle quasi-macchine nella misura in cui tali requisiti sono pertinenti.
I requisiti pertinenti relativi alle quasi-macchine non riguardano i requisiti che possono essere soddisfatti solo al momento dell'incorporazione della quasi- macchina. Tuttavia, i principi di integrazione della sicurezza di cui al punto 1.1.2 sono applicabili in tutti i casi.
1.1.2. Principi d'integrazione della sicurezza
a) Per progettazione e costruzione, le macchine o i prodotti correlati devono essere atti a funzionare, ad essere azionati, ad essere regolati e a subire la manutenzione senza che tali operazioni espongano a rischi le persone, se effettuate nelle condizioni previste tenendo anche conto dell'uso scorretto ragionevolmente prevedibile. Le misure di protezione devono avere lo scopo di eliminare ogni rischio durante l'esistenza prevedibile della macchina o del prodotto correlato, comprese le fasi di trasporto, montaggio, smontaggio, smantellamento (messa fuori servizio) e rottamazione.
b) Per la scelta delle soluzioni più opportune il fabbricante deve applicare i principi seguenti, nell'ordine indicato:
i) eliminare i pericoli o, qualora non sia possibile, ridurre al minimo i rischi (integrazione della sicurezza nella progettazione e nella costruzione della macchina o dei prodotti correlati);
ii) adottare i necessari provvedimenti protettivi contro i rischi che non possono essere eliminati;
iii) informare gli utilizzatori dei rischi residui dovuti all'incompleta efficacia delle misure di protezione adottate, indicare se è richiesta una formazione particolare e segnalare se è necessario prevedere un dispositivo di protezione individuale.
c) In sede di progettazione e di costruzione di una macchina o di un prodotto correlato, nonché all'atto della redazione delle istruzioni per l'uso, il fabbricante deve prendere in considerazione non solo l'uso previsto della macchina o del prodotto correlato, ma anche l'uso scorretto ragionevolmente prevedibile. La macchina o il prodotto correlato devono essere progettati e costruiti in modo da evitare che siano utilizzati in modo anormale, se ciò può comportare un rischio. Negli altri casi le istruzioni per l'uso devono richiamare l'attenzione dell'utilizzatore sulle controindicazioni nell'uso della macchina o del prodotto correlato che potrebbero presentarsi, in base all'esperienza.
d) La macchina o il prodotto correlato devono essere progettati e costruiti tenendo conto delle limitazioni imposte all'operatore dall'uso necessario o prevedibile delle attrezzature di protezione individuale.
e) La macchina o il prodotto correlato, devono essere progettati e costruiti in modo tale da consentire all'utilizzatore, se del caso, di verificare le funzioni di sicurezza. La macchina o il prodotto correlato devono essere forniti completi di tutte le attrezzature e gli accessori speciali e, se del caso, della descrizione delle procedure di prova funzionale specifiche, essenziali per poterli verificare, regolare, eseguirne la manutenzione e utilizzarli in condizioni di sicurezza.
1.1.3. Materiali e prodotti
I materiali utilizzati per la costruzione di macchine o dei prodotti correlati o i prodotti utilizzati od originati durante la loro utilizzazione non devono presentare rischi per la salute e la sicurezza delle persone. In particolare, se sono usati dei fluidi, le macchine o i prodotti correlati devono essere progettati e costruiti in modo da prevenire rischi dovuti al riempimento, all'utilizzazione, al recupero e all'evacuazione.
1.1.4. Illuminazione
Le macchine o i prodotti correlati devono essere forniti di un'illuminazione incorporata adeguata alle operazioni laddove, malgrado un'illuminazione ambiente avente un valore normale, la mancanza di tale dispositivo potrebbe determinare rischi.
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo che non vi siano zone d'ombra che possano causare disturbo, né fastidiosi abbagliamenti, né effetti stroboscopici pericolosi sugli elementi mobili dovuti all'illuminazione.
Le parti interne che devono essere ispezionate e regolate frequentemente devono essere munite di opportuni dispositivi di illuminazione; lo stesso dicasi per le zone di manutenzione.
1.1.5. Progettazione di una macchina o di un prodotto correlato ai fini della movimentazione
La macchina o il prodotto correlato o ciascuno dei suoi diversi elementi, devono:
a) poter essere movimentati e trasportati in modo sicuro,
b) essere imballati o progettati per essere immagazzinati in modo sicuro e senza deterioramenti.
Durante il trasporto della macchina o del prodotto correlato o dei suoi elementi non devono potersi verificare spostamenti intempestivi né pericoli dovuti all'instabilità se la macchina o il prodotto correlato o i suoi elementi sono sottoposti a movimentazione secondo le istruzioni.
Se la massa, le dimensioni o la forma di una macchina o di un prodotto correlato o dei suoi vari elementi non ne consentono lo spostamento a mano, la macchina o il prodotto correlato o ciascuno dei suoi vari elementi devono essere:
a) muniti di accessori che consentano di afferrarli con un mezzo di sollevamento; oppure
b) progettati in modo da consentire il fissaggio di detti accessori; oppure
c) di forma tale che i normali mezzi di sollevamento possano adattarvisi facilmente.
Se la macchina il un prodotto correlato o uno dei suoi elementi devono essere spostati a mano, devono essere:
a) facilmente spostabili; oppure
b) muniti di dispositivi di presa che ne consentano la movimentazione in modo sicuro.
Sono necessarie disposizioni speciali per il trasporto di utensili e/o di parti di macchine o di prodotti correlati, anche leggeri, potenzialmente pericolosi.
1.1.6. Ergonomia
Nelle condizioni d'uso previste devono essere eliminati o ridotti al minimo possibile il disagio, la fatica e le tensioni psichiche e fisiche (stress) dell'operatore, tenuto conto almeno dei principi seguenti dell'ergonomia:
a) tener conto della variabilità delle dimensioni fisiche, della forza e della resistenza dell'operatore;
b) evitare la necessità di movimenti o posture lavorativi impegnativi e sforzi manuali superiori alla capacità dell'operatore;
c) offrire lo spazio necessario per i movimenti delle parti del corpo dell'operatore,
d) evitare un ritmo di lavoro condizionato dalla macchina;
e) evitare un controllo che richiede una concentrazione prolungata;
f) adeguare l'interfaccia tra uomo e macchina alle caratteristiche prevedibili degli operatori, anche rispetto a una macchina o a un prodotto correlato dotati di un comportamento o una logica integralmente o parzialmente auto-evolutivi e che sono progettati per funzionare con livelli variabili di autonomia;
g) se del caso, adeguare una macchina o un prodotto correlato dotati di un comportamento o una logica integralmente o parzialmente auto-evolutivi e che sono progettati per funzionare con livelli variabili di autonomia affinché rispondano alle persone adeguatamente e appropriatamente (ad esempio verbalmente attraverso parole e non verbalmente attraverso gesti, espressioni facciali o movimento del corpo) e comunichino le loro azioni pianificate (ad esempio cosa faranno e perché) agli operatori in maniera comprensibile.
1.1.7. Postazioni di lavoro
La postazione di lavoro deve essere progettata e costruita in modo da evitare ogni rischio derivante dai gas di scarico o dalla mancanza di ossigeno.
Se la macchina o il prodotto correlato sono destinati ad essere utilizzati in un ambiente pericoloso che presenta rischi per la salute e la sicurezza dell'operatore o se la macchina stessa o il prodotto correlato stesso generano un ambiente pericoloso, devono essere previsti i mezzi adeguati ad assicurare che l'operatore lavori in buone condizioni e sia protetto da ogni pericolo prevedibile.
Se del caso, la postazione di lavoro deve essere dotata di una cabina adeguata, progettata, costruita o attrezzata in modo da soddisfare i suddetti requisiti. L'uscita deve consentire un rapido abbandono della macchina. Si deve inoltre, se del caso, prevedere un'uscita di sicurezza in una direzione diversa dall'uscita normale.
1.1.8. Sedili
Ove appropriato e se le condizioni di lavoro lo consentono, nella postazione di lavoro integrata alla macchina o al prodotto correlato deve essere prevista l'installazione di sedili.
Se l'operatore è destinato a lavorare seduto e la postazione di lavoro è parte integrante della macchina o del prodotto correlato, il sedile deve essere fornito unitamente alla macchina o al prodotto correlato.
Il sedile dell'operatore deve renderlo capace di mantenere una posizione stabile. Inoltre il sedile e la sua distanza dai dispositivi di comando devono potersi adattare all'operatore.
Se la macchina o il prodotto correlato sono sottoposti a vibrazioni, il sedile deve essere progettato e costruito in modo da ridurre al livello più basso ragionevolmente possibile le vibrazioni trasmesse all'operatore. Il sedile deve essere ancorato in modo da resistere a tutte le sollecitazioni che può subire. Se sotto i piedi dell'operatore non esiste alcun piano di appoggio, egli deve disporre di un poggiapiedi antisdrucciolo.
1.1.9. Protezione dall'alterazione
La macchina o il prodotto correlato devono essere progettati e costruiti in modo tale da fare sì che il collegamento ad essi di un altro dispositivo, tramite qualsiasi caratteristica del dispositivo connesso stesso o tramite qualsiasi dispositivo remoto che comunica con la macchina o il prodotto correlato, non determini una situazione pericolosa.
I componenti hardware che trasmettono segnali o dati, importanti per il collegamento o l'accesso a software che sono fondamentali affinché la macchina o il prodotto correlato rispettino i pertinenti requisiti essenziali di sicurezza e di tutela della salute, devono essere progettati in modo tale da essere adeguatamente protetti da un'alterazione accidentale o intenzionale. La macchina o il prodotto correlato devono raccogliere prove in merito a un intervento legittimo o illegittimo su tali componenti hardware, se importante per il collegamento o l'accesso al software critico per la conformità della macchina o del prodotto correlato.
Software e dati critici per il rispetto da parte della macchina o del prodotto correlato dei pertinenti requisiti essenziali di sicurezza e di tutela della devono essere individuati come tali e devono essere adeguatamente protetti da un'alterazione accidentale o intenzionale.
La macchina o il prodotto correlato devono individuare il software installato sullo stesso, necessario per il suo funzionamento in condizioni di sicurezza, e devono essere in grado di fornire tali informazioni in qualsiasi momento in un formato facilmente accessibile.
La macchina o il prodotto correlato devono raccogliere prove di un intervento legittimo o illegittimo sul software o di una modifica del software installato sulla macchina o sul prodotto correlato o della sua configurazione.
1.2. SISTEMI DI COMANDO
1.2.1. Sicurezza ed affidabilità dei sistemi di comando
I sistemi di comando devono essere progettati e costruiti in modo da evitare l'insorgere di situazioni pericolose.
I sistemi di comando devono essere progettati e costruiti in modo tale che:
a) riescano a resistere, se del caso, a circostanze e rischi, a previste sollecitazioni di servizio e ad influssi esterni intenzionali o meno, compresi tentativi deliberati ragionevolmente prevedibili da parte di terzi che conducono a una situazione pericolosa;
b) un'avaria nell'hardware o nella logica del sistema di comando non crei situazioni pericolose;
c) errori della logica del sistema di comando non creino situazioni pericolose;
d) i limiti delle funzioni di sicurezza siano stabiliti come parte della valutazione del rischio effettuata dal fabbricante e non siano consentite modifiche alle impostazioni o alle norme generate dalla macchina o dal prodotto correlato o dagli operatori, neanche durante la fase di apprendimento della macchina o del prodotto correlato, qualora tali modifiche possano determinare situazioni pericolose;
e) errori umani ragionevolmente prevedibili nelle manovre non creino situazioni pericolose;
f) la registrazione di tracciamento dei dati generati in relazione a un intervento e delle versioni del software di sicurezza caricato dopo l'immissione sul mercato o la messa in servizio della macchina o del prodotto correlato sia consentita per cinque anni dopo tale caricamento, esclusivamente al fine di dimostrare la conformità della macchina o del prodotto correlato rispetto al presente allegato a fronte di una richiesta motivata da parte di un'autorità nazionale competente.
I sistemi di controllo delle macchine o dei prodotti correlati dotati di un comportamento o una logica integralmente o parzialmente auto-evolutivi e che sono progettati per funzionare con livelli variabili di autonomia devono essere progettati e costruiti in maniera tale da:
a) non essere la causa di azioni, da parte della macchina o del prodotto correlato, che vanno oltre il suo compito e il suo spazio di movimento definiti;
b) consentire che siano registrati i dati relativi al processo decisionale in materia di sicurezza per i sistemi di sicurezza basati su software che garantiscono la funzione di sicurezza, compresi i componenti di sicurezza, dopo che la macchina o il prodotto correlato sono stati immessi sul mercato o messi in servizio, e che tali dati siano conservati per un anno dopo la loro raccolta, esclusivamente per dimostrare la conformità della macchina o del prodotto correlato al presente allegato a seguito di una richiesta motivata da parte di un'autorità nazionale competente;
c) consentire in qualsiasi momento la correzione della macchina o del prodotto correlato al fine di preservarne la sicurezza intrinseca.
Particolare attenzione deve essere prestata a quanto segue:
a) la macchina o il prodotto correlato non devono avviarsi in modo inatteso;
b) i parametri della macchina o del prodotto correlato non devono cambiare in modo incontrollato, laddove tale cambiamento possa portare a situazioni pericolose;
c) devono essere evitate le modifiche delle impostazioni o delle norme, generate dalla macchina o dal prodotto correlato o dagli operatori, anche durante la fase di apprendimento della macchina o del prodotto correlato, qualora tali modifiche possano determinare situazioni pericolose;
d) non deve essere impedito l'arresto della macchina o del prodotto correlato, se l'ordine di arresto è già stato dato;
e) nessun elemento mobile della macchina o del prodotto o pezzo correlato trattenuto dalla macchina o dal prodotto correlato deve cadere o essere espulso;
f) non deve essere impedito l'arresto manuale o automatico degli elementi mobili di qualsiasi tipo;
g) i dispositivi di protezione devono rimanere pienamente efficaci o dare un comando di arresto;
h) le parti del sistema di controllo legate alla sicurezza si devono applicare in modo coerente all'interezza di un insieme di macchine o di prodotti correlati o di semi-macchine o di una loro combinazione.
In caso di comando wireless, un guasto della comunicazione o della connessione o una connessione difettosa non deve comportare una situazione pericolosa.
1.2.2. Dispositivi di comando
I dispositivi di comando devono essere:
a) chiaramente visibili e individuabili utilizzando, se del caso, pittogrammi;
b) disposti in modo da garantire una manovra sicura, univoca e rapida;
c) progettati in modo tale che il movimento del dispositivo di comando sia coerente con l'azione del comando;
d) situati fuori delle zone pericolose tranne il caso, all'occorrenza, di taluni dispositivi di comando, come un arresto di emergenza o una pulsantiera pensile;
e) sistemati in modo che la loro manovra non causi rischi supplementari;
f) progettati o protetti in modo che l'azione comandata, se comporta un pericolo, possa avvenire soltanto in seguito ad un'azione deliberata;
g) fabbricati in modo da resistere alle sollecitazioni prevedibili, prestando particolare attenzione ai dispositivi di arresto di emergenza che possono essere soggetti a notevoli sollecitazioni.
Se un dispositivo di comando è progettato e costruito per consentire varie azioni differenti, vale a dire se la sua azione non è univoca, l'azione comandata deve essere chiaramente indicata e, all'occorrenza, confermata.
La posizione e la corsa dei dispositivi di comando, nonché lo sforzo richiesto devono essere compatibili con l'azione comandata, tenendo conto dei principi ergonomici.
Le macchine o i prodotti correlati devono essere muniti di indicatori necessari per un funzionamento sicuro. Dalle postazioni di comando l'operatore deve poter leggere i suddetti indicatori.
Da ogni postazione di comando l'operatore deve poter essere in grado di assicurarsi dell'assenza di persone nelle zone pericolose oppure il sistema di comando deve essere progettato e costruito in modo che l'avviamento sia impedito fintanto che qualsiasi persona si trova nella zona pericolosa.
Qualora nessuna di tali possibilità sia applicabile, prima dell'avviamento della macchina o del prodotto correlato deve essere emesso un segnale di avvertimento sonoro e/o visivo. Le persone esposte devono avere il tempo di abbandonare la zona pericolosa o impedire l'avviamento della macchina.
Se necessario, vanno previsti mezzi per assicurarsi che la macchina o il prodotto correlato possano essere comandati solo dalle postazioni di comando situate in una o più zone o posti prestabiliti.
Quando vi sono più postazioni di comando, il sistema di comando deve essere progettato in modo che l'impiego di una di esse renda impossibile l'uso delle altre, ad eccezione dei comandi di arresto e degli arresti di emergenza.
Quando la macchina o il prodotto correlato sono muniti di più postazioni di manovra, ognuna di esse deve disporre di tutti i dispositivi di comando necessari, senza ostacolare né mettere in situazione pericolosa mutuamente gli operatori.
1.2.3. Avviamento
L'avviamento di una macchina o di un prodotto correlato deve essere possibile soltanto tramite un'azione volontaria su un dispositivo di comando previsto a tal fine.
Il medesimo requisito si applica:
a) alla rimessa in marcia dopo un arresto, indipendentemente dall'origine;
b) all'effettuazione di una modifica rilevante delle condizioni di funzionamento.
Tuttavia, purché ciò non generi situazioni pericolose, la rimessa in marcia o la modifica delle condizioni di funzionamento può essere effettuata tramite un'azione volontaria su un dispositivo diverso dal dispositivo di comando previsto a tal fine.
Per le macchine o i prodotti correlati a funzionamento automatico, l'avviamento degli stessi, la rimessa in marcia dopo un arresto o la modifica delle condizioni di funzionamento possono essere effettuati senza intervento esterno, se ciò non produce situazioni pericolose.
Quando la macchina o il prodotto correlato sono muniti di vari dispositivi di comando dell'avviamento e gli operatori possono pertanto mettersi mutuamente in pericolo, devono essere installati dispositivi supplementari per eliminare tali rischi. Se per ragioni di sicurezza l'avviamento e/o l'arresto devono essere effettuati in una sequenza specifica, opportuni dispositivi devono garantire che tali operazioni siano eseguite nell'ordine corretto.
1.2.4. Arresto
1.2.4.1. Arresto normale
La macchina o il prodotto correlato devono essere muniti di un dispositivo di comando che consenta l'arresto generale in condizioni di sicurezza.
Ogni postazione di lavoro deve essere munita di un dispositivo di comando che consenta di arrestare, in funzione dei pericoli esistenti, tutte le funzioni della macchina o del prodotto correlato o unicamente una di esse, in modo che la macchina o il prodotto correlato siano portati in condizioni di sicurezza.
Il comando di arresto della macchina o del prodotto correlato deve avere priorità rispetto ai comandi di avviamento.
Ottenuto l'arresto della macchina o del prodotto correlato o delle loro funzioni pericolose, si deve interrompere l'alimentazione dei relativi azionatori.
1.2.4.2. Arresto operativo
Se, per motivi operativi, è necessario un comando di arresto che non interrompe l'alimentazione degli azionatori, la condizione di arresto deve essere monitorata e mantenuta.
1.2.4.3. Arresto di emergenza
La macchina o il prodotto correlato devono essere muniti di uno o più dispositivi di arresto di emergenza, che consentano di evitare situazioni di pericolo attuali o imminenti.
Si applicano le eccezioni seguenti:
a) le macchine o i prodotti correlati per i quali il dispositivo di arresto di emergenza non può ridurre il rischio, perché non riduce il tempo per ottenere l'arresto normale oppure perché non permette di prendere le misure specifiche che il rischio richiede;
b) le macchine o i prodotti correlati portatili tenuti o condotti a mano.
Il dispositivo deve:
a) comprendere dispositivi di comando chiaramente individuabili, ben visibili e rapidamente accessibili;
b) provocare l'arresto del processo pericoloso nel tempo più breve possibile, senza creare rischi supplementari;
c) quando necessario avviare, o permettere di avviare, alcuni movimenti di salvaguardia.
Quando si smette di azionare il dispositivo di arresto di emergenza dopo un ordine di arresto, tale ordine deve essere mantenuto da un blocco del dispositivo di arresto di emergenza, sino al suo sblocco; non deve essere possibile ottenere il blocco del dispositivo senza che quest'ultimo generi un ordine di arresto; lo sblocco del dispositivo deve essere possibile soltanto con una apposita manovra e non deve riavviare la macchina o il prodotto correlato, ma soltanto consentirne la rimessa in funzione.
La funzione di arresto di emergenza deve essere sempre disponibile e operativa a prescindere dalla modalità di funzionamento.
I dispositivi di arresto di emergenza devono offrire soluzioni di riserva ad altre misure di protezione e non sostituirsi ad esse.
1.2.4.4. Insiemi di macchine o di prodotti correlati
Nel caso di una macchina o di un prodotto correlato o di elementi di una macchina o di un prodotto correlato progettati per lavorare assemblati, la macchina o il prodotto correlato devono essere progettati e costruiti in modo tale che i comandi di arresto, compresi i dispositivi di arresto di emergenza, possano bloccare non soltanto la macchina stessa o il prodotto correlato stesso ma anche tutte le attrezzature collegate, qualora il loro mantenimento in funzione possa costituire un pericolo.
1.2.5. Selezione del modo di comando o di funzionamento
Il modo di comando o di funzionamento selezionato deve avere la priorità su tutti gli altri modi di comando o di funzionamento, salvo l'arresto di emergenza.
Se è stato progettato e costruito per consentire diversi modi di comando o di funzionamento che necessitano di misure di protezione e/o di procedure di lavoro diverse, la macchina o il prodotto correlato devono essere muniti di un selettore di modo di comando o di funzionamento che possa essere bloccato in ogni posizione. A ciascuna posizione del selettore, che deve essere chiaramente individuabile, deve corrispondere un solo modo di comando o di funzionamento.
Il selettore può essere sostituito da altri mezzi di selezione che limitino l'utilizzo di talune funzioni della macchina o del prodotto correlato a talune categorie di operatori.
Se per alcune operazioni la macchina o il prodotto correlato devono poter funzionare con un riparo spostato o rimosso e/o con il dispositivo di protezione neutralizzato, il selettore del modo di comando o di funzionamento deve simultaneamente:
a) escludere tutti gli altri modi di comando o di funzionamento;
b) consentire l'attivazione delle funzioni pericolose soltanto mediante dispositivi di comando che necessitano di un'azione continuata;
c) consentire l'attivazione delle funzioni pericolose soltanto in condizioni di minor rischio, evitando i pericoli derivanti dal succedersi delle sequenze;
d) impedire qualsiasi attivazione delle funzioni pericolose mediante un'azione volontaria o involontaria sui sensori della macchina o del prodotto correlato.
Se queste quattro condizioni non possono essere soddisfatte simultaneamente, il selettore del modo di comando o di funzionamento deve attivare altre misure di protezione progettate e costruite per garantire una zona di intervento sicura.
Inoltre, alla postazione di manovra l'operatore deve avere la padronanza del funzionamento degli elementi sui quali agisce.
1.2.6. Guasto del circuito di alimentazione di energia o della connessione alla rete di comunicazione
L'interruzione, il ripristino dopo un'interruzione o la variazione, di qualsiasi tipo, dell'alimentazione di energia o della connessione alla rete di comunicazione della macchina o del prodotto correlato non deve creare situazioni pericolose.
Particolare attenzione deve essere prestata a quanto segue:
a) la macchina o il prodotto correlato non devono avviarsi in modo inatteso;
b) i parametri della macchina non devono cambiare in modo incontrollato, quando tale cambiamento può portare a situazioni pericolose;
c) non deve essere impedito l'arresto della macchina o del prodotto correlato, se l'ordine di arresto è già stato dato;
d) nessun elemento mobile della macchina o del prodotto o pezzo correlato trattenuto dalla macchina o dal prodotto correlato deve cadere o essere espulso;
e) non deve essere impedito l'arresto manuale o automatico degli elementi mobili di qualsiasi tipo;
f) i dispositivi di protezione devono rimanere pienamente efficaci o dare un comando di arresto.
1.3. MISURE DI PROTEZIONE CONTRO I RISCHI MECCANICI
1.3.1. Rischio di perdita di stabilità
La macchina o il prodotto correlato, elementi e attrezzature compresi, devono avere una stabilità tale da evitare il rovesciamento, la caduta o gli spostamenti non comandati durante il trasporto, il montaggio, lo smontaggio e tutte le altre azioni che interessano la macchina e il prodotto correlato.
Se la forma stessa della macchina o del prodotto correlato o la sua installazione prevista non garantiscono sufficiente stabilità, devono essere previsti ed indicati nelle istruzioni per l'uso appositi mezzi di fissaggio.
1.3.2. Rischio di rottura durante il funzionamento
Gli elementi delle macchine o dei prodotti correlati, nonché i loro organi di collegamento, devono resistere agli sforzi cui devono essere sottoposti durante l'utilizzazione.
I materiali utilizzati devono presentare caratteristiche di resistenza sufficienti e adeguate all'ambiente di utilizzazione, previsto dal fabbricante, in particolare per quanto riguarda i fenomeni di fatica, invecchiamento, corrosione e abrasione.
Nelle istruzioni per l'uso devono essere indicati i tipi e le frequenze delle ispezioni e manutenzioni necessarie per motivi di sicurezza. Devono essere indicati dove appropriato gli elementi soggetti ad usura, nonché i criteri di sostituzione.
Se nonostante le precauzioni prese sussistono rischi di disintegrazione o di rottura, gli elementi in questione devono essere montati, disposti o protetti in modo che i loro eventuali frammenti vengano trattenuti evitando situazioni pericolose.
Le tubazioni rigide o elastiche contenenti fluidi, in particolare ad alta pressione, devono poter sopportare le sollecitazioni interne ed esterne previste e devono essere solidamente fissate o protette affinché, in caso di rottura, esse non presentino rischi.
In caso di alimentazione automatica del materiale da lavorare verso l'utensile, devono essere soddisfatte le condizioni seguenti per evitare rischi per le persone:
a) al momento del contatto tra l’utensile e il pezzo, l'utensile deve aver raggiunto le sue normali condizioni di lavoro;
b) al momento dell'avviamento e/o dell'arresto dell'utensile (volontario o accidentale), il movimento di alimentazione e il movimento dell'utensile devono essere coordinati.
1.3.3. Rischi dovuti alla caduta o alla proiezione di oggetti
Devono essere prese precauzioni per evitare i rischi derivanti dalla caduta o dalla proiezione di oggetti.
1.3.4. Rischi dovuti a superfici, spigoli o angoli
Gli elementi accessibili della macchina o di un prodotto correlato devono essere privi, entro i limiti consentiti dalle loro funzioni, di angoli acuti e di spigoli vivi, nonché di superfici rugose che possono causare lesioni.
1.3.5. Rischi dovuti a una macchina o a un prodotto correlato combinati
Quando è previsto che la macchina o il prodotto correlato possano eseguire diversi tipi di operazioni con ripresa manuale del pezzo fra ogni operazione (macchina o prodotto correlato combinati), essi devono essere progettati e costruiti in modo che ciascun elemento possa essere utilizzato separatamente senza che gli altri elementi costituiscano un rischio per le persone esposte.
A tal fine, gli elementi che non siano protetti devono poter essere messi in moto o arrestati individualmente.
1.3.6. Rischi connessi alle variazioni delle condizioni di funzionamento
Quando possono effettuare operazioni in condizioni di impiego diverse, la macchina o il prodotto correlato devono essere progettati e costruiti in modo che la scelta e la regolazione di tali condizioni possano essere effettuate in modo sicuro e affidabile.
1.3.7. Rischi dovuti a elementi mobili
Gli elementi mobili della macchina o del prodotto correlato devono essere progettati e costruiti per evitare i rischi di contatto che possono provocare infortuni oppure, se i rischi persistono, essere muniti di ripari o dispositivi di protezione.
Devono essere adottate tutte le misure necessarie per impedire un bloccaggio improvviso degli elementi mobili. Nei casi in cui, malgrado le precauzioni prese, possa verificarsi un bloccaggio, dovranno essere previsti, ove opportuno, i dispositivi di protezione specifici e gli utensili specifici necessari per permettere lo sbloccaggio in modo sicuro.
Le istruzioni per l'uso e, ove possibile, un'indicazione sulla macchina o sul prodotto correlato devono individuare tali dispositivi di protezione specifici e la modalità di impiego.
La prevenzione di rischi derivanti da contatto che determinano situazioni di pericolo e le tensioni psichiche che possono essere causate dall'interazione con la macchina deve essere adeguata in relazione a:
a) coesistenza uomo-macchina in uno spazio condiviso in assenza di collaborazione diretta;
b) interazione uomo-macchina.
1.3.8. Scelta di una protezione contro i rischi dovuti a elementi mobili
I ripari o i dispositivi di protezione progettati contro i rischi dovuti a elementi mobili devono essere scelti in funzione del tipo di rischio. Per la scelta si deve ricorrere alle linee guida seguenti.
1.3.8.1. Elementi mobili di trasmissione
I ripari progettati per proteggere le persone dai pericoli creati dagli elementi mobili di trasmissione devono essere:
a) ripari fissi di cui al punto 1.4.2.1; oppure
b) ripari mobili interbloccati, di cui al punto 1.4.2.2.
Se si prevedono interventi frequenti, si deve ricorrere a ripari mobili interbloccati.
1.3.8.2. Elementi mobili che partecipano alla lavorazione
I ripari o i dispositivi di protezione progettati per proteggere le persone dai pericoli creati dagli elementi mobili che partecipano alla lavorazione devono essere:
a) ripari fissi di cui al punto 1.4.2.1; oppure
b) ripari mobili interbloccati, di cui al punto 1.4.2.2. oppure
c) dispositivi di protezione di cui al punto 1.4.3; oppure
d) una combinazione di quanto sopra.
Tuttavia, se taluni elementi mobili che partecipano direttamente alla lavorazione non possono essere resi interamente inaccessibili durante il loro funzionamento a causa di operazioni che richiedono l'intervento dell'operatore, tali elementi devono essere muniti di:
a) ripari fissi o di ripari mobili interbloccati, che impediscano l'accesso alle parti degli elementi non utilizzate per la lavorazione; e
b) ripari regolabili di cui al punto 1.4.2.3, che limitino l'accesso alle parti degli elementi mobili cui è necessario accedere.
1.3.9. Rischi di movimenti incontrollati
Quando un elemento della macchina o del prodotto correlato è stato arrestato, la sua deriva dalla posizione di arresto, per qualsiasi causa che non sia l'azionamento di dispositivi di comando, deve essere impedita o essere tale da non presentare un rischio.
1.4. CARATTERISTICHE RICHIESTE PER I RIPARI ED I DISPOSITIVI DI PROTEZIONE
1.4.1. Requisiti generali
I ripari e i dispositivi di protezione:
a) devono essere di costruzione robusta;
b) devono essere fissati solidamente;
c) non devono provocare pericoli supplementari;
d) non devono essere facilmente elusi o resi inefficaci;
e) devono essere situati ad una distanza sufficiente dalla zona pericolosa;
f) non devono limitare più del necessario l'osservazione del ciclo di lavoro; e
g) devono permettere gli interventi indispensabili per l'installazione e/o la sostituzione degli utensili e per i lavori di manutenzione, limitando però l'accesso soltanto al settore in cui deve essere effettuato il lavoro e, se possibile, senza smontare il riparo o senza disattivare il dispositivo di protezione.
Inoltre, se possibile, i ripari devono proteggere dalla caduta e dalla proiezione di materiali o oggetti e dalle emissioni provocate dalla macchina o dal prodotto correlato.
1.4.2. Requisiti particolari per i ripari
a) Ripari fissi
Il fissaggio dei ripari fissi deve essere ottenuto con sistemi che richiedono l'uso di utensili per la loro apertura o smontaggio.
I sistemi di fissaggio devono rimanere attaccati ai ripari o alla macchina o al prodotto correlato quando i ripari sono rimossi.
Se possibile, i ripari non devono poter rimanere al loro posto in mancanza dei loro mezzi di fissaggio.
b) Ripari mobili interbloccati
I ripari mobili interbloccati devono:
a) per quanto possibile restare uniti alla macchina o al prodotto correlato quando siano aperti;
b) essere progettati e costruiti in modo che la loro regolazione richieda un intervento volontario.
I ripari mobili interbloccati devono essere associati ad un dispositivo di interblocco che:
a) impedisca l'avviamento di funzioni pericolose della macchina o del prodotto correlato fin quando i ripari sono chiusi; e
b) dia un comando di arresto non appena i ripari non sono più chiusi.
Se un operatore può raggiungere la zona pericolosa prima che sia cessato il rischio dovuto alle funzioni pericolose della macchina o del prodotto correlato, i ripari mobili devono essere associati ad un dispositivo di bloccaggio del riparo, oltre che ad un dispositivo di interblocco che:
a) impedisca l'avviamento delle funzioni pericolose della macchina o del prodotto correlato fin quando il riparo non è chiuso e bloccato; e
b) tenga il riparo chiuso e bloccato fin quando non è cessato il rischio di lesioni dovuto alle funzioni pericolose della macchina o del prodotto correlato.
I ripari mobili interbloccati devono essere progettati in modo che la mancanza o il guasto di uno dei loro elementi impedisca l'avviamento o provochi l'arresto delle funzioni pericolose della macchina o del prodotto correlato.
c) Ripari regolabili che limitano l'accesso
I ripari regolabili che limitano l'accesso alle parti degli elementi mobili indispensabili alla lavorazione devono:
a) potersi regolare manualmente o automaticamente a seconda del tipo di lavorazione da eseguire; e
b) potersi regolare facilmente senza l'uso di un attrezzo.
1.4.3. Requisiti particolari per i dispositivi di protezione
I dispositivi di protezione devono essere progettati e incorporati nel sistema di comando in modo tale che:
a) la messa in moto degli elementi mobili non sia possibile fintantoché l'operatore può raggiungerli;
b) le persone non possano accedere agli elementi mobili in movimento; e
c) la mancanza o il guasto di uno dei loro elementi impedisca l'avviamento o provochi l'arresto degli elementi mobili.
La loro regolazione deve richiedere un intervento volontario.
1.5. RISCHI DOVUTI AD ALTRE CAUSE
1.5.1. Energia elettrica
Se sono alimentati con energia elettrica, le macchine o i prodotti correlati devono essere progettati, costruiti ed equipaggiati in modo da prevenire o da consentire di prevenire tutti i pericoli dovuti all'energia elettrica.
Gli obiettivi di sicurezza fissati dalla direttiva 2014/35/UE si applicano alle macchine o ai prodotti correlati. Tuttavia, gli obblighi concernenti la valutazione della conformità e l'immissione sul mercato o la messa in servizio di macchine o di prodotti correlati in relazione ai pericoli dovuti all'energia elettrica sono disciplinati esclusivamente dal presente regolamento.
1.5.2. Elettricità statica
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da evitare o da ridurre la formazione di cariche elettrostatiche potenzialmente pericolose e/o devono essere muniti di mezzi che consentano di scaricarle.
1.5.3. Alimentazione diversa dall'energia elettrica
Se sono alimentati da fonti di energia diverse da quella elettrica, le macchine o i prodotti correlati devono essere progettati, costruiti ed equipaggiati in modo da prevenire tutti i rischi che possono derivare da tali fonti di energia.
1.5.4. Errori di montaggio
Gli errori commessi al montaggio o al rimontaggio di taluni pezzi, che potrebbero essere all'origine di rischi, devono essere resi impossibili dalla progettazione e dalla costruzione degli stessi oppure mediante indicazioni figuranti sui pezzi o sui loro carter. Le stesse indicazioni devono figurare sugli elementi mobili o sui loro carter, qualora occorra conoscere il senso del moto per evitare rischi.
Se del caso, nelle istruzioni per l'uso devono figurare informazioni supplementari su tali rischi.
Se l'origine dei rischi può essere dovuta ad un collegamento difettoso, la progettazione o le indicazioni figuranti sugli elementi da collegare e, se del caso, sui mezzi di collegamento devono rendere impossibili i raccordi errati.
1.5.5. Temperature estreme
Devono essere adottate opportune misure per evitare qualsiasi rischio di lesioni causate dal contatto o dalla vicinanza con parti della macchina o del prodotto correlato o materiali a temperatura elevata o molto bassa.
Devono inoltre essere adottate le misure necessarie per evitare i rischi di proiezione di materiali molto caldi o molto freddi o per proteggere da tali rischi.
1.5.6. Incendio
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da evitare qualsiasi rischio d'incendio o di surriscaldamento presentato dalla macchina stessa o dal prodotto correlato stesso o da gas, liquidi, polveri, vapori od altre sostanze, prodotti o utilizzati dalla macchina o dal prodotto correlato.
1.5.7. Esplosione
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da evitare qualsiasi rischio di esplosione presentato dalla macchina stessa o dal prodotto correlato stesso o da gas, liquidi, polveri, vapori od altre sostanze prodotti o utilizzati dalla macchina o dal prodotto correlato.
Le macchine o i prodotti correlati devono essere conformi, per quanto riguarda i rischi di esplosione dovuti all'utilizzo in atmosfera potenzialmente esplosiva, alla specifica normativa di armonizzazione dell'Unione.
1.5.8. Rumore
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale che i rischi dovuti all'emissione di rumore aereo siano ridotti al livello minimo, tenuto conto del progresso tecnico e della possibilità di disporre di mezzi atti a limitare il rumore, in particolare alla fonte.
Il livello dell'emissione di rumore può essere valutato in riferimento ai dati comparativi di emissione di macchine o prodotti correlati simili.
1.5.9. Vibrazioni
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale che i rischi dovuti alle vibrazioni trasmesse dalle stesse o dagli stessi siano ridotti al livello minimo, tenuto conto del progresso tecnico e della disponibilità di mezzi atti a ridurre le vibrazioni, in particolare alla fonte.
Il livello dell'emissione di vibrazioni può essere valutato in riferimento ai dati comparativi di emissione di macchine o prodotti correlati simili.
1.5.10. Radiazione
Le emissioni indesiderabili di radiazioni da parte delle macchine o dei prodotti correlati devono essere eliminate o ridotte a livelli che non producono effetti negativi sulle persone.
Ogni emissione di radiazioni ionizzanti funzionali deve essere ridotta al livello minimo sufficiente per il corretto funzionamento della macchina o del prodotto correlato durante la regolazione, il funzionamento e la pulizia. Qualora sussistano rischi si devono prendere le necessarie misure di protezione.
Ogni emissione di radiazioni non ionizzanti funzionali durante la regolazione, il funzionamento e la pulizia deve essere ridotta a livelli che non producono effetti negativi sulle persone.
1.5.11. Radiazioni esterne
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale che il loro funzionamento non sia perturbato dalle radiazioni esterne.
1.5.12. Radiazioni laser
In caso di impiego di dispositivi laser, deve essere preso in considerazione quanto segue:
a) i dispositivi laser montati su macchine o su prodotti correlati devono essere progettati e costruiti in modo da evitare qualsiasi radiazione involontaria;
b) i dispositivi laser montati su macchine o su prodotti correlati devono essere protetti in modo tale che né le radiazioni utili, né le radiazioni prodotte da riflessione o da diffusione e le radiazioni secondarie possano nuocere alla salute;
c) i dispositivi ottici per l'osservazione o la regolazione di dispositivi laser montati su macchine o su prodotti correlati devono essere tali che le radiazioni laser non creino alcun rischio per la salute.
1.5.13. Emissioni di materie e sostanze pericolose
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale da evitare i rischi di inalazione, ingestione, contatto con la pelle, gli occhi e le mucose e di penetrazione attraverso la pelle delle materie e sostanze pericolose prodotte.
Se il pericolo non può essere eliminato, la macchina o il prodotto correlato devono essere equipaggiati in modo che le materie e sostanze pericolose possano essere contenute, captate, aspirate, precipitate mediante vaporizzazione di acqua, filtrate o trattate con un altro metodo altrettanto efficace.
Qualora il processo non sia totalmente chiuso durante il normale funzionamento della macchina o del prodotto correlato, i dispositivi di contenimento, captazione, filtrazione, separazione o aspirazione devono essere situati in modo da produrre il massimo effetto.
1.5.14. Rischio di restare imprigionati in una macchina
Le macchine o i prodotti correlati devono essere progettati, costruiti o dotati di mezzi che consentano di evitare che una persona resti chiusa all'interno o, se ciò non fosse possibile, devono essere dotati di mezzi per chiedere aiuto.
1.5.15. Rischio di scivolamento, inciampo o caduta
Le parti della macchina o del prodotto correlato sulle quali è previsto lo spostamento o lo stazionamento delle persone devono essere progettate e costruite in modo da evitare che esse scivolino, inciampino o cadano su tali parti o fuori di esse.
Se opportuno, dette parti devono essere dotate di mezzi di presa fissi rispetto all'utilizzatore che gli consentano di mantenere la stabilità.
1.5.16. Fulmini
Le macchine o i prodotti correlati che necessitano di protezione dagli effetti di fulmini durante l'uso devono essere equipaggiati in modo da scaricare al suolo le eventuali scariche elettriche.
1.6. MANUTENZIONE
1.6.1. Manutenzione delle macchine o dei prodotti correlati
I punti di regolazione e di manutenzione devono essere situati fuori dalle zone pericolose. Gli interventi di regolazione, di manutenzione, di riparazione e di pulizia devono poter essere eseguiti quando la macchina o il prodotto correlato sono fermi.
Se per motivi tecnici non è possibile soddisfare una delle precedenti condizioni, devono essere adottate misure per garantire che dette operazioni possano essere eseguite in condizioni di sicurezza (cfr. punto 1.2.5).
Per le macchine automatizzate e, se del caso, per altre macchine o altri prodotti correlati, deve essere previsto un dispositivo di connessione che consenta di montare un dispositivo di diagnosi di ricerca delle avarie.
Gli elementi delle macchine automatizzate o dei prodotti correlati che devono essere sostituiti frequentemente devono essere facilmente smontabili e rimontabili in condizioni di sicurezza. L'accesso a tali elementi deve consentire di svolgere questi compiti con i mezzi tecnici necessari secondo il metodo operativo previsto.
1.6.2. Accesso alle postazioni di lavoro e ai punti d'intervento utilizzati per la manutenzione
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da permettere l'accesso in condizioni di sicurezza a tutte le zone in cui è necessario intervenire durante il funzionamento, la regolazione e la manutenzione della macchina o del prodotto correlato.
Nel caso di macchine o di prodotti correlati nei quali le persone devono entrare per azionarli, effettuarne la regolazione, la manutenzione o la pulizia, gli accessi a tali macchine o prodotti correlati devono essere dimensionati e adattati per l'uso di attrezzature di soccorso in modo tale da rendere possibile un soccorso di emergenza alle persone.
1.6.3. Isolamento dalle fonti di energia
Le macchine o i prodotti correlati devono essere muniti di dispositivi che consentono di isolarli da ciascuna delle loro fonti di energia. Tali dispositivi devono essere identificati chiaramente. Essi devono poter essere bloccati, qualora la riconnessione possa rappresentare un pericolo per le persone. I dispositivi devono inoltre poter essere bloccati nel caso in cui l'operatore non possa verificare l'effettivo costante isolamento da tutte le posizioni cui ha accesso.
Nel caso di macchine o di prodotti correlati che possono essere alimentati ad energia elettrica mediante una spina ad innesto, è sufficiente la rimozione della spina, qualora l'operatore possa verificare da tutte le posizioni cui ha accesso, che la spina resti disinserita.
L'eventuale energia residua o immagazzinata dopo l'isolamento della macchina o del prodotto correlato deve poter essere dissipata senza rischio per le persone.
In deroga al requisito dei commi precedenti, taluni circuiti possono non essere separati dalla loro fonte di energia onde consentire, ad esempio, il supporto di pezzi, la tutela di informazioni, l'illuminazione delle parti interne, ecc. In questo caso devono essere adottate misure particolari per garantire la sicurezza degli operatori.
1.6.4. Intervento dell'operatore
La macchina o il prodotto correlato devono essere progettati, costruiti ed equipaggiati in modo tale da limitare la necessità d'intervento dell’operatore. L'intervento di un operatore, ogniqualvolta non possa essere evitato, deve poter essere effettuato facilmente e in condizioni di sicurezza.
1.6.5. Pulizia delle parti interne
La macchina o il prodotto correlato devono essere progettati e costruiti in modo che la pulizia delle parti interne che hanno contenuto sostanze o miscele pericolose sia possibile senza penetrare in tali parti interne; anche un eventuale svuotamento completo deve poter essere compiuto dall'esterno. Se è impossibile evitare di penetrarvi, la macchina o il prodotto correlato devono essere progettati e costruiti in modo da consentire di effettuare la pulizia in condizioni di sicurezza.
1.7. INFORMAZIONI
1.7.1. Informazioni e avvertenze sulla macchina o sul prodotto correlato
Le informazioni e le avvertenze sulla macchina o sul prodotto correlato dovrebbero essere fornite preferibilmente in forma di simboli o pittogrammi facilmente comprensibili.
Le informazioni e le avvertenze scritte o verbali devono essere espresse in una lingua stabilita dallo Stato membro interessato, facilmente comprensibile dagli utilizzatori finali.
1.7.1.1. Informazioni e dispositivi di informazione
Le informazioni necessarie alla guida di una macchina o di un prodotto correlato devono essere fornite in forma chiara e facilmente comprensibile. Non devono essere in quantità tale da sovraccaricare l'operatore.
Le unità di visualizzazione o qualsiasi altro mezzo di comunicazione interattiva tra l'operatore e la macchina o il prodotto correlato devono essere di facile comprensione e impiego.
1.7.1.2. Dispositivi di allarme
Quando la sicurezza e la salute delle persone possono essere messe in pericolo da un'avaria nel funzionamento di una macchina o di un prodotto correlato non sorvegliati, tale macchina o prodotto correlato devono essere attrezzati in modo da emettere un segnale di avvertenza sonoro o luminoso adeguato.
Se la macchina o il prodotto correlato sono muniti di dispositivi di avvertenza, questi ultimi devono poter essere compresi senza ambiguità e facilmente percepiti. Devono essere adottate misure opportune per consentire all'operatore di verificare la costante efficienza di tali dispositivi di avvertenza.
Devono essere applicate le disposizioni degli atti giuridici specifici dell'Unione concernenti i colori e i segnali di sicurezza.
1.7.2. Avvertenze in merito ai rischi residui
Nel caso in cui permangano dei rischi, malgrado siano state adottate le misure di protezione integrate nella progettazione, le protezioni e le misure di protezione complementari, devono essere previste le necessarie avvertenze, compresi i dispositivi di avvertenza.
1.7.3. Marcatura delle macchine o dei prodotti correlati
Oltre ai requisiti di marcatura di cui agli articoli 10 e 24, le macchine o i prodotti correlati devono recare una marcatura visibile, leggibile e indelebile.
Le macchine o i prodotti correlati di cui ai capi da 2 a 6 del presente allegato devono recare una marcatura conforme ai requisiti supplementari indicati in tali capi.
Inoltre la macchina o un prodotto correlato progettati e costruiti per l'utilizzo in atmosfera esplosiva devono recare l'apposita marcatura.
Le macchine o i prodotti correlati devono altresì recare indicazioni complete riguardanti il proprio tipo, nonché le indicazioni indispensabili alla sicurezza di utilizzo. Tali informazioni sono soggette ai requisiti di cui al punto 1.7.1.
Se un elemento della macchina o di un prodotto correlato deve essere movimentato durante l'utilizzazione con mezzi di sollevamento, la sua massa deve essere indicata in modo leggibile, indelebile e non ambiguo.
1.7.4. Istruzioni per l'uso
In aggiunta agli obblighi di cui all'articolo 10, paragrafo 7, le istruzioni per l'uso sono redatte come segue.
In deroga all'articolo 10, paragrafo 7, le istruzioni per la manutenzione destinate ad essere usate da personale specializzato incaricato dal fabbricante o dal suo mandatario possono essere fornite in una sola lingua ufficiale dell'Unione compresa da detto personale.
1.7.4.1. Principi generali di redazione delle istruzioni per l'uso
a) Il contenuto delle istruzioni per l'uso non deve riguardare soltanto l'uso previsto della macchina o del prodotto correlato, ma deve tener conto anche dell'uso scorretto ragionevolmente prevedibile.
b) In caso di macchine o di prodotti correlati destinati all'utilizzazione da parte di operatori non professionali, la redazione e la presentazione delle istruzioni per l'uso devono tenere conto del livello di formazione generale e della perspicacia che ci si può ragionevolmente aspettare da tali operatori.
1.7.4.2. Contenuto delle istruzioni per l'uso
1. Le istruzioni per l'uso devono contenere, se del caso, almeno le informazioni seguenti:
a) la ragione sociale e l’indirizzo completo del fabbricante e, se del caso, del suo mandatario;
b) la designazione della macchina o del prodotto correlato, come indicato sulla macchina stessa o sul prodotto correlato stesso, eccetto il numero di serie (cfr. punto 1.7.3);
c) la dichiarazione di conformità UE o l'indirizzo internet o il codice ottico dove è possibile accedere alla dichiarazione di conformità UE, conformemente all'articolo 10, paragrafo 8;
d) una descrizione generale della macchina o del prodotto correlato;
e) i disegni, i diagrammi, le descrizioni e le spiegazioni necessari per l'uso, la manutenzione e la riparazione della macchina o del prodotto correlato e per verificarne il corretto funzionamento;
f) una descrizione della o delle postazioni di lavoro che possono essere occupate dagli operatori;
g) una descrizione dell'uso previsto della macchina o del prodotto correlato;
h) le avvertenze concernenti i modi nei quali la macchina o il prodotto correlato non devono essere usati e che potrebbero, in base all'esperienza, presentarsi;
i) le istruzioni per il montaggio, l'installazione e il collegamento, inclusi i disegni e i diagrammi e i sistemi di fissaggio e la designazione del telaio o dell'installazione su cui la macchina o il prodotto correlato devono essere montati;
j) le istruzioni per l'installazione e il montaggio volte a ridurre il rumore e le vibrazioni prodotti;
k) le istruzioni per la messa in servizio e l'uso della macchina o del prodotto correlato e, se necessario, le istruzioni per la formazione degli operatori;
l) le informazioni in merito ai rischi residui che permangono, malgrado siano state adottate le misure di protezione integrate nella progettazione e malgrado le protezioni e le misure di protezione complementari adottate;
m) le istruzioni sulle misure di protezione che devono essere adottate dall'utilizzatore, incluse, se del caso, le attrezzature di protezione individuale che devono essere fornite;
n) le caratteristiche essenziali degli utensili che possono essere montati sulla macchina o sul prodotto correlato;
o) le condizioni in cui la macchina o il prodotto correlato soddisfano i requisiti di stabilità durante l'utilizzo, il trasporto, il montaggio, lo smontaggio, in condizioni di fuori servizio, durante le prove o le avarie prevedibili;
p) le istruzioni per effettuare in condizioni di sicurezza le operazioni di trasporto, movimentazione e stoccaggio, indicanti la massa della macchina o del prodotto correlato nonché dei suoi vari elementi allorché devono essere regolarmente trasportati separatamente;
q) il protocollo operativo da rispettare in caso di infortunio o avaria; se si può verificare un blocco, il metodo operativo da rispettare per permettere di sbloccare la macchina in condizioni di sicurezza;
r) la descrizione delle operazioni di regolazione e manutenzione che devono essere effettuate dall'utilizzatore nonché le misure di manutenzione preventiva da rispettare tenendo conto della progettazione e dell'utilizzo della macchina o del prodotto correlato;
s) le istruzioni per effettuare in condizioni di sicurezza la regolazione e la manutenzione, incluse le misure di protezione che dovrebbero essere adottate durante tali operazioni;
t) le specifiche dei pezzi di ricambio da utilizzare, se incidono sulla salute e la sicurezza degli operatori;
u) le informazioni seguenti relative all'emissione di rumore aereo:
i) il livello di pressione acustica dell'emissione ponderato A nelle postazioni di lavoro, se supera 70 dB(A); se tale livello non supera 70 dB (A), deve essere indicato;
ii) il valore massimo della pressione acustica istantanea ponderata C nelle postazioni di lavoro, se supera 63 Pa (130 dB rispetto a 20 μPa),
iii) il livello di potenza acustica ponderato A emesso dalla macchina o dal prodotto correlato, se il livello di pressione acustica dell'emissione ponderato A nelle postazioni di lavoro supera 80 dB (A).
I suddetti valori devono essere quelli misurati effettivamente sulla macchina o sul prodotto correlato in questione, oppure quelli stabiliti sulla base di misurazioni effettuate su una macchina o un prodotto correlato tecnicamente comparabili rappresentativi della macchina o del prodotto correlato da produrre.
Quando si tratta di una macchina o di un prodotto correlato di grandissime dimensioni, invece del livello di potenza acustica ponderato A possono essere indicati livelli di pressione acustica dell'emissione ponderati A in appositi punti intorno alla macchina o al prodotto correlato.
Qualora non possano essere applicate le norme armonizzate o le specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, i dati acustici devono essere misurati usando il codice di misurazione più appropriato adeguato alla macchina o al prodotto correlato.
Ogniqualvolta sono indicati i valori dell'emissione acustica, devono essere specificate le incertezze relative a tali valori. Devono essere descritte le condizioni di funzionamento della macchina o del prodotto correlato durante la misurazione e i metodi utilizzati per effettuarla.
Se la postazione o le postazioni di lavoro non sono o non possono essere definite, i livelli di pressione acustica ponderati A devono essere misurati a 1 m dalla superficie della macchina o del prodotto correlato e a 1,60 m di altezza dal suolo o dalla piattaforma di accesso. Devono essere indicati la posizione e il valore della pressione acustica massima.
Per quanto concerne le macchine o i prodotti correlati atti a ridurre il rumore, le istruzioni per l’uso devono specificare, se del caso, le modalità per montare e installare correttamente tali dispositivi (cfr. anche il punto 1.7.4.2, punto 1, lettera j)).
Qualora atti giuridici specifici dell'Unione stabiliscano altre indicazioni per la misurazione del livello di pressione acustica o del livello di potenza acustica, tali atti giuridici si applicano e non si applicano le prescrizioni corrispondenti del presente punto;
v) le informazioni sulle precauzioni, sui dispositivi e sui mezzi necessari per soccorrere immediatamente e con cautela le persone;
w) se le macchine o i prodotti correlati possono emettere radiazioni non ionizzanti che potrebbero nuocere alle persone, in particolare se portatrici di dispositivi medici impiantabili attivi o non attivi, le informazioni riguardanti le radiazioni emesse per l'operatore e le persone esposte;
x) se la progettazione delle macchine o dei prodotti correlati consente emissioni di sostanze pericolose dalla macchina o dal prodotto correlato, le caratteristiche del dispositivo di captazione, filtrazione o scarico, qualora tale dispositivo non sia fornito con la macchina o il prodotto correlato, nonché una qualsiasi delle informazioni seguenti:
i) la portata per l'emissione di sostanze e materiali pericolosi dalla macchina o dal prodotto correlato;
ii) la concentrazione di sostanze e materiali pericolosi attorno alla macchina o al prodotto correlato provenienti da questi ultimi o da materiali o sostanze utilizzati con la macchina o il prodotto correlato;
iii) l'efficacia del dispositivo di captazione o filtrazione e le condizioni da rispettare per preservarne l'efficacia nel tempo.
I valori di cui al primo comma devono essere misurati effettivamente per la macchina o il prodotto correlato in questione oppure stabiliti in base a misure relative a una unità di macchina o prodotto correlato tecnicamente comparabile, rappresentativa dello stato dell'arte.
1.7.5. Pubblicazioni illustrative o promozionali
Le pubblicazioni illustrative o promozionali che descrivono la macchina o il prodotto correlato non possono essere in contraddizione con le istruzioni per l'uso per quanto concerne gli aspetti relativi alla salute e alla sicurezza. Le pubblicazioni illustrative o promozionali che descrivono le caratteristiche delle prestazioni della macchina o del prodotto correlato devono contenere le stesse informazioni delle istruzioni per l'uso per quanto concerne le emissioni.
2. REQUISITI ESSENZIALI SUPPLEMENTARI DI SICUREZZA E DI TUTELA DELLA SALUTE PER TALUNE CATEGORIE DI MACCHINE E DI PRODOTTI CORRELATI
Le macchine e i prodotti correlati alimentari, le macchine e i prodotti correlati per prodotti cosmetici o farmaceutici, le macchine e i prodotti correlati tenuti o condotti a mano, le macchine e i prodotti correlati portatili per il fissaggio e altre macchine ad impatto, le macchine e i prodotti correlati per la lavorazione del legno e di materie con caratteristiche fisiche simili e le macchine e i prodotti correlati per l'applicazione di prodotti fitosanitari, devono soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente capo (cfr. Principi generali, punto 4).
2.1. MACCHINE E PRODOTTI CORRELATI ALIMENTARI E MACCHINE E PRODOTTI CORRELATI PER PRODOTTI COSMETICI O FARMACEUTICI
2.1.1. Considerazioni generali
Le macchine o i prodotti correlati destinati ad essere utilizzati per prodotti alimentari o per prodotti cosmetici o farmaceutici devono essere progettati e costruiti in modo da evitare qualsiasi rischio di infezione, di malattia e di contagio.
Devono essere rispettati i requisiti seguenti:
a) i materiali a contatto o che possono venire a contatto con prodotti alimentari, acque destinate al consumo umano o prodotti cosmetici o farmaceutici devono soddisfare le condizioni stabilite nei pertinenti agli atti giuridici dell'Unione; la macchina o il prodotto correlato devono essere progettati e costruiti in modo tale che detti materiali possano essere puliti prima di ogni utilizzazione e, se ciò non è possibile, devono essere utilizzati elementi monouso;
b) tutte le superfici a contatto con i prodotti alimentari, le acque destinate al consumo umano o i prodotti cosmetici o farmaceutici ad eccezione di quelle degli elementi monouso devono:
i) essere lisce e prive di rugosità o spazi in cui possono fermarsi materie organiche; lo stesso requisito va rispettato per i collegamenti fra le superfici;
ii) essere progettate e costruite in modo da ridurre al minimo le sporgenze, i bordi e gli angoli;
iii) poter essere pulite e disinfettate facilmente, se del caso, dopo aver asportato le parti facilmente smontabili; gli angoli interni devono essere raccordati con raggi tali da consentire una pulizia completa;
c) i liquidi e i gas aerosol provenienti da prodotti alimentari, cosmetici o farmaceutici e dai prodotti di pulizia, di disinfezione e di risciacquatura devono poter defluire completamente verso l'esterno della macchina o del prodotto correlato (se possibile in una posizione "pulizia");
d) le macchine o i prodotti correlati devono essere progettati e costruiti al fine di evitare l'ingresso di sostanze o di esseri viventi, in particolare insetti, o accumuli di materie organiche, in zone impossibili da pulire;
e) le macchine o i prodotti correlati devono essere progettati e costruiti in modo che i prodotti ausiliari pericolosi per la salute, inclusi i lubrificanti, non possano entrare in contatto con i prodotti alimentari o l’acqua destinata al consumo umano, cosmetici o farmaceutici. All'occorrenza, la macchina o i prodotti correlati devono essere progettati e costruiti per permettere di verificare regolarmente il rispetto di tale requisito.
2.1.2. Istruzioni per l'uso
Le istruzioni per l'uso delle macchine o dei prodotti correlati alimentari e delle macchine o dei prodotti correlati per prodotti cosmetici o farmaceutici devono indicare i prodotti e i metodi raccomandati per la pulizia, la disinfezione e la risciacquatura non solo delle parti facilmente accessibili ma anche delle parti alle quali è impossibile o sconsigliato accedere.
2.2. MACCHINE O PRODOTTI CORRELATI PORTATILI TENUTI O CONDOTTI A MANO
2.2.1. Considerazioni generali
Le macchine o i prodotti correlati portatili tenuti o condotti a mano devono:
a) a seconda del tipo, avere una superficie di appoggio sufficiente e disporre in numero sufficiente di mezzi di presa e di mantenimento correttamente dimensionati, sistemati in modo da garantire la stabilità della macchina o del prodotto correlato nelle condizioni di funzionamento previste;
b) tranne quando sia tecnicamente impossibile o quando esista un dispositivo di comando indipendente, se le impugnature non possono essere abbandonate in tutta sicurezza, essere muniti di dispositivi di comando manuali per l'avviamento e l'arresto disposti in modo tale che l'operatore non debba abbandonare i mezzi di presa per azionarli;
c) essere esenti dai rischi dovuti all'avviamento intempestivo o al mantenimento in funzione dopo che l'operatore ha abbandonato i mezzi di presa; se tale requisito non è tecnicamente realizzabile, occorre adottare misure compensative;
d) consentire, all'occorrenza, l'osservazione visiva delle zone pericolose e dell'azione dell'utensile sul materiale lavorato;
e) disporre di un dispositivo o un sistema di scarico correlato, con una presa di collegamento di estrazione o un sistema equivalente per captare o ridurre le emissioni di sostanze pericolose. Il presente requisito non si applica quando comporta un nuovo pericolo o quando la funzione principale della macchina o del prodotto correlato consiste nell'applicazione di sostanze pericolose e non si applica nemmeno alle emissioni dei motori a combustione interna;
f) essere progettati e costruiti in modo che le impugnature delle macchine o dei prodotti correlati portatili consentano un avviamento e un arresto facili e agevoli.
2.2.1.1. Istruzioni per l'uso
Le istruzioni per l'uso devono fornire le indicazioni seguenti relative alle vibrazioni, espresse come accelerazione (m/s2) e trasmesse da macchine o prodotti correlati portatili tenuti o condotti a mano:
a) il valore totale delle vibrazioni continue a cui è sottoposto il sistema mano- braccio;
b) il valore medio dell'ampiezza di picco dell'accelerazione ottenuto da vibrazioni da urti ripetuti, cui è sottoposto il sistema mano-braccio;
c) l'incertezza di entrambe le misurazioni.
I valori di cui al primo comma devono essere quelli misurati effettivamente per la macchina o il prodotto correlato in questione oppure quelli stabiliti in base a misure relative a una macchina o un prodotto correlato tecnicamente comparabili, rappresentativi dello stato dell'arte.
Qualora non possano essere applicate le norme armonizzate o le specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, i dati sulle vibrazioni devono essere misurati usando il codice di misurazione più appropriato per la macchina o al prodotto correlato.
Devono essere specificati le condizioni di funzionamento della macchina durante la misurazione e i metodi utilizzati per effettuarla oppure il riferimento alla norma armonizzata applicata.
2.2.2. Macchine o prodotti correlati portatili per il fissaggio o altre macchine o altri prodotti correlati ad impatto
2.2.2.1. Considerazioni generali
Le macchine o prodotti correlati portatili per il fissaggio e altre macchine o altri prodotti correlati ad impatto devono essere progettati e costruiti in modo da:
a) effettuare la trasmissione dell'energia al pezzo propulso tramite un componente intermedio che non si separa dal dispositivo;
b) impedire l'impatto, tramite un dispositivo di consenso, se la macchina o il prodotto correlato non sono posizionati correttamente con una pressione adeguata sul materiale di base,
c) impedire l'azionamento involontario; se del caso, per azionare l'impatto deve essere necessaria una sequenza appropriata di azioni sul dispositivo di consenso e sul dispositivo di comando;
d) impedire l'azionamento intempestivo durante la movimentazione o in caso di urto;
e) poter effettuare le operazioni di carico e scarico facilmente e in condizioni di sicurezza.
Se necessario, deve essere possibile dotare il dispositivo di uno o più ripari paraschegge e i ripari appropriati devono essere forniti dal fabbricante della macchina o del prodotto correlato.
2.2.2.2. Istruzioni per l'uso
Le istruzioni per l'uso devono fornire le indicazioni necessarie riguardanti:
a) gli accessori e le attrezzature intercambiabili che possono essere impiegati con la macchina o con il prodotto correlato;
b) gli elementi appropriati per il fissaggio o altro impatto da utilizzare con la macchina o con il prodotto correlato;
c) se del caso, le cartucce appropriate da utilizzare.
2.3. MACCHINE O PRODOTTI CORRELATI PER LA LAVORAZIONE DEL LEGNO E DI MATERIE CON CARATTERISTICHE FISICHE SIMILI
Le macchine o i prodotti correlati per la lavorazione del legno e di materie con caratteristiche fisiche simili devono rispettare i requisiti seguenti:
a) la macchina o il prodotto correlato devono essere progettati, costruiti o attrezzati in modo che il pezzo da lavorare possa essere posizionato e guidato in condizioni di sicurezza; quando il pezzo è tenuto manualmente su un banco di lavoro, quest'ultimo deve garantire una stabilità sufficiente durante la lavorazione e non deve ostacolare lo spostamento del pezzo;
b) se la macchina o il prodotto correlato possono essere utilizzati in condizioni che comportano un rischio di proiezione di pezzi o loro parti, essi devono essere progettati, costruiti o attrezzati in modo da impedire tale proiezione o, qualora ciò non sia possibile, in modo che la proiezione non produca danni per l'operatore e/o le persone esposte;
c) la macchina o il prodotto correlato devono essere equipaggiati di freno automatico che arresti l'utensile in tempo sufficientemente breve in caso di rischio di contatto con l'utensile in fase di rallentamento;
d) quando l'utensile è integrato in una macchina non completamente automatizzata o in un prodotto correlato non completamente automatizzato, tale macchina o prodotto correlato devono essere progettati e costruiti in modo tale da eliminare o ridurre i rischi di infortuni alle persone.
2.4. MACCHINE O PRODOTTI CORRELATI PER L'APPLICAZIONE DI PRODOTTI FITOSANITARI
2.4.1. Ai fini del punto 2.4, si applica la definizione seguente:
“Macchine o prodotti correlati per l'applicazione di prodotti fitosanitari": le macchine o i prodotti correlati specificamente utilizzati per l'applicazione di prodotti fitosanitari ai sensi dell'articolo 2, paragrafo 1, del regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio.
2.4.2. Considerazioni generali
Il fabbricante di una macchina o di prodotti correlati per l'applicazione di prodotti fitosanitari deve garantire che sia effettuata una valutazione del rischio di esposizione non intenzionale dell'ambiente ai prodotti fitosanitari, in conformità della procedura di valutazione del rischio e di riduzione del rischio di cui ai Principi generali, punto 1.
Le macchine o i prodotti correlati per l'applicazione di prodotti fitosanitari devono essere progettati e costruiti tenendo in considerazione i risultati della valutazione del rischio di cui al primo comma in modo da poter essere utilizzati, regolati e sottoposti a manutenzione senza causare un'esposizione non intenzionale dell'ambiente ai prodotti fitosanitari.
Devono sempre essere evitate fuoriuscite.
2.4.3. Comando e controllo
Devono essere possibili, con facilità e accuratezza, il comando, il controllo e l'arresto immediato dell'applicazione di prodotti fitosanitari dalle postazioni operative.
2.4.4. Riempimento e svuotamento
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale da facilitare il riempimento preciso con la quantità necessaria di prodotti fitosanitari e assicurare lo svuotamento agevole e completo, prevenendo ogni dispersione accidentale di prodotti fitosanitari ed evitando ogni contaminazione di fonti idriche nel corso di tali operazioni.
2.4.5. Applicazione di prodotti fitosanitari
2.4.5.1. Tasso di applicazione
Le macchine o i prodotti correlati devono essere muniti di dispositivi che permettano di regolare in modo facile, preciso e affidabile il tasso di applicazione.
2.4.5.2. Distribuzione, deposizione e dispersione di prodotti fitosanitari
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da assicurare che il prodotto fitosanitario sia depositato nelle zone bersaglio, da ridurre al minimo le perdite nelle altre zone e da evitare la dispersione di prodotti fitosanitari nell'ambiente. Se del caso, deve essere garantita una distribuzione uniforme e una deposizione omogenea.
2.4.5.3. Prove
Per accertare se le componenti corrispondenti della macchina o del prodotto correlato sono conformi ai requisiti stabiliti nei punti 2.4.5.1 e 2.4.5.2, il fabbricante deve effettuare, o far effettuare, prove adeguate per ogni tipo di macchina o di prodotto correlato.
2.4.5.4. Dispersione durante la disattivazione
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale da prevenire la dispersione in fase di disattivazione della funzione di applicazione dei prodotti fitosanitari.
2.4.6. Manutenzione
2.4.6.1. Pulizia
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da consentire una pulizia agevole e completa senza contaminazione dell'ambiente.
2.4.6.2. Riparazione
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo da facilitare la sostituzione delle parti usurate senza contaminazione dell'ambiente.
2.4.7. Ispezioni
Deve essere possibile collegare con facilità alle macchine o ai prodotti correlati gli strumenti di misura necessari per verificare il buon funzionamento degli stessi.
2.4.8. Marcatura di ugelli, filtri a cestello e altri filtri
Ugelli, filtri a cestello e altri filtri devono essere contrassegnati in modo che il loro tipo e la loro dimensione possano essere identificati chiaramente.
2.4.9. Indicazione del prodotto fitosanitario in uso
Se del caso, le macchine o i prodotti correlati devono essere muniti di uno specifico supporto su cui l'operatore possa apporre il nome del prodotto fitosanitario in uso.
2.4.10. Istruzioni per l'uso
Nelle istruzioni per l'uso devono figurare le indicazioni seguenti:
a) le precauzioni da adottare durante le operazioni di miscelazione, carico, applicazione, svuotamento, lavaggio, riparazione e trasporto per evitare la contaminazione dell'ambiente;
b) le condizioni dettagliate d'uso per i diversi ambienti operativi previsti, comprese le corrispondenti predisposizioni e regolazioni richieste per assicurare la deposizione del prodotto fitosanitario nelle zone bersaglio, riducendo al minimo le perdite nelle altre zone e, se del caso, per assicurare la distribuzione uniforme e la deposizione omogenea del prodotto fitosanitario;
c) la gamma dei tipi e delle dimensioni degli ugelli, dei filtri a cestello e degli altri filtri che possono essere utilizzati con la macchina o il prodotto correlato;
d) la frequenza dei controlli e i criteri e i metodi per la sostituzione delle parti soggette a usura che influiscono sul corretto funzionamento della macchina o del prodotto correlato, come gli ugelli, i filtri a cestello e gli altri filtri;
e) le specifiche della taratura, della manutenzione giornaliera, della preparazione per l'inverno e degli altri controlli necessari per assicurare il corretto funzionamento della macchina o del prodotto correlato;
f) i tipi di prodotto fitosanitario che possono provocare anomalie nel funzionamento della macchina o del prodotto correlato;
g) l'indicazione che l'operatore dovrebbe tenere aggiornato il nome del prodotto fitosanitario in uso nel supporto specifico di cui al punto 2.4.9;
h) il collegamento e l'uso di attrezzature e di accessori speciali e le necessarie precauzioni da prendere;
i) l'indicazione che la macchina o il prodotto correlato possono essere soggetti ai requisiti nazionali in materia di ispezioni regolari da parte degli organi designati, come previsto nella direttiva 2009/128/CE del Parlamento europeo e del Consiglio;
j) le caratteristiche delle macchine o dei prodotti correlati che devono essere sottoposte a controllo per assicurarne il corretto funzionamento;
k) le istruzioni per il collegamento dei necessari strumenti di misurazione.
3. REQUISITI ESSENZIALI SUPPLEMENTARI DI SICUREZZA E DI TUTELA DELLA SALUTE PER OVVIARE AI RISCHI DOVUTI ALLA MOBILITÀ DELLE MACCHINE O DEI PRODOTTI CORRELATI
Le macchine o i prodotti correlati che presentano rischi dovuti alla mobilità devono soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute di cui al presente capo (cfr. Principi generali, punto 4)
3.1. CONSIDERAZIONI GENERALI
3.1.1. Ai fini del presente punto, si applicano le definizioni seguenti:
a) "macchina o prodotti correlati che presentano rischi dovuti alla mobilità":
i) macchine o prodotti correlati il cui lavoro richiede la mobilità durante il lavoro oppure uno spostamento continuo o semicontinuo secondo una successione di stazioni di lavoro fisse; o
ii) macchine o prodotti correlati il cui lavoro si effettua senza spostamenti, ma che possono essere muniti di mezzi che consentano di spostarli più facilmente da un luogo all'altro;
b) "conducente": operatore competente incaricato dello spostamento della macchina o del prodotto correlato, che può essere trasportato dalla macchina oppure accompagnarla a piedi, o azionarla mediante telecomando;
c) "macchina mobile autonoma": macchina mobile che dispone di una modalità autonoma, nel contesto della quale tutte le funzioni essenziali di sicurezza della macchina mobile sono assicurate nella sua zona per le operazioni di spostamento e lavorazione senza l'interazione permanente di un operatore;
d) "supervisore": un operatore competente incaricato della supervisione della macchina mobile autonoma;
e) "funzione di supervisione": sorveglianza non permanente da remoto della macchina mobile autonoma mediante un dispositivo che consenta di ricevere informazioni o avvisi e di trasmettere ordini limitati alla macchina.
3.2. POSTAZIONI DI LAVORO
3.2.1. Postazione di guida
La visibilità dalla postazione di guida deve essere tale da consentire al conducente di far muovere la macchina o il prodotto correlato e i suoi utensili nelle condizioni di impiego ragionevolmente prevedibili, in tutta sicurezza per sé stesso e per le persone esposte. In caso di necessità, adeguati dispositivi devono rimediare ai rischi dovuti a insufficiente visibilità diretta.
La macchina o il prodotto correlato su cui è trasportato il conducente devono essere progettati e costruiti in modo che alle postazioni di guida non si presentino per il conducente rischi dovuti al contatto involontario con le ruote o con i cingoli.
Se le dimensioni lo consentono e se i rischi non ne sono aumentati, la postazione di guida del conducente trasportato deve essere progettata e costruita in modo da poter essere dotata di cabina. La cabina deve comportare un luogo destinato alla sistemazione delle istruzioni per l'uso necessarie al conducente.
3.2.2. Sedili
Laddove vi sia il rischio che gli operatori o altre persone trasportati dalla macchina possano essere schiacciati tra elementi della macchina e l'ambiente circostante in caso di ribaltamento o rovesciamento laterale, in particolare per le macchine munite di una struttura di protezione di cui ai punti 3.4.3 o 3.4.4:
a) la macchina deve essere progettata o munita di un sistema di ritenuta in modo da mantenere le persone sui loro sedili o all'interno della struttura di protezione, senza opporsi ai movimenti necessari alle operazioni né ai movimenti dovuti alla sospensione dei sedili rispetto alla struttura; non deve essere possibile lo spostamento della macchina laddove vi sia un rischio significativo di ribaltamento o rovesciamento laterale e non sia utilizzato un sistema di ritenuta;
detti sistemi di ritenuta o soluzioni devono tenere conto dei principi dell'ergonomia e non devono essere montati se aumentano i rischi;
b) deve essere emesso un segnale visivo e sonoro presso la postazione di guida per avvisare il conducente quando si trova in posizione di guida e il sistema di ritenuta non è in uso.
3.2.3. Postazioni per altre persone
Se le condizioni di utilizzazione prevedono che, oltre al conducente, siano saltuariamente o regolarmente trasportate sulla macchina o vi lavorino altre persone, devono essere previste postazioni adeguate affinché il loro trasporto o lavoro avvenga senza rischi.
Il punto 3.2.1, secondo e terzo comma, si applica anche alle postazioni delle persone diverse dal conducente.
3.2.4. Funzione di supervisione
Se del caso, le macchine o i prodotti correlati mobili autonomi devono disporre di una funzione di supervisione specifica per la modalità autonoma. Tale funzione deve consentire al supervisore di ricevere da remoto informazioni dalla macchina.
La funzione di supervisione deve consentire soltanto azioni per arrestare e avviare la macchina o il prodotto correlato da remoto o spostarli in una posizione sicura e in uno stato sicuro per evitare di provocare altri rischi. Deve inoltre essere progettata e costruita in maniera tale da consentire tali azioni soltanto quando il supervisore può vedere direttamente o indirettamente la zona di movimento e di lavoro della macchina e i dispositivi di protezione sono operativi.
Le informazioni che il supervisore riceve dalla macchina quando la funzione di supervisione è attiva devono consentire al supervisore di disporre di una visuale completa e precisa del funzionamento, del movimento e del posizionamento sicuro della macchina nella sua zona di spostamento e lavoro.
Tali informazioni devono avvisare il supervisore del verificarsi di situazioni impreviste o pericolose presenti o imminenti, che richiedono il suo intervento.
Se la funzione di supervisione non è attiva, la macchina non deve essere in grado di funzionare.
3.3. SISTEMI DI COMANDO
Se necessario, devono essere previsti sistemi atti ad impedire l’uso non autorizzato dei comandi.
Nelle macchine o nei prodotti correlati dotati di telecomando, ogni unità di comando deve indicare chiaramente quali siano le macchine o i prodotti correlati che essa è destinata a comandare.
Il sistema di telecomando deve essere progettato e costruito in modo da influenzare soltanto:
a) la macchina o il prodotto correlato in questione;
b) le funzioni in questione.
Le macchine o i prodotti correlati dotati di telecomando devono essere progettati e costruiti in modo da rispondere unicamente ai segnali delle unità di comando previste.
Per le macchine o i prodotti correlati mobili autonomi, il sistema di comando deve essere progettato in maniera tale da svolgere le funzioni di sicurezza autonomamente, come stabilito al presente punto, anche quando le azioni sono ordinate utilizzando una funzione di supervisione da remoto.
3.3.1. Dispositivi di controllo
Dalla postazione di manovra il conducente deve poter azionare tutti i dispositivi di comando necessari al funzionamento della macchina o del prodotto correlato, tranne per quanto riguarda le funzioni che possono essere esercitate in condizioni di sicurezza solo mediante dispositivi di comando collocati altrove. Dette funzioni includono, in particolare, quelle di cui sono responsabili operatori diversi dal conducente o per le quali è necessario che il conducente lasci la postazione di manovra per comandarle in condizioni di sicurezza.
I pedali eventuali devono essere progettati, costruiti e disposti in modo che possano essere azionati da un conducente in modo sicuro con il minimo rischio di azionamento errato. Devono avere una superficie antisdrucciolo ed essere facili da pulire.
Quando il loro azionamento può comportare pericoli, in particolare movimenti pericolosi, i dispositivi di comando, ad esclusione di quelli a posizioni predeterminate, devono ritornare in posizione neutra non appena l'operatore li lascia liberi.
Nel caso di una macchina a ruote, il meccanismo di sterzo deve essere progettato e costruito in modo da ridurre la forza dei movimenti bruschi del volante o della leva di sterzo, dovuti ai colpi subiti dalle ruote sterzanti.
Il comando di blocco del differenziale deve essere progettato e disposto in modo da permettere di sbloccare il differenziale quando la macchina è in movimento.
Il sesto comma del punto 1.2.2, concernente i segnali di avviamento sonori e/o visivi, si applica unicamente in caso di retromarcia.
3.3.2. Avviamento/spostamento
Qualsiasi spostamento comandato di una macchina semovente con conducente trasportato deve essere possibile soltanto se il conducente si trova al posto di comando.
Quando, per il suo lavoro, una macchina è attrezzata con dispositivi che superano la sua sagoma normale (ad esempio stabilizzatore, freccia, ecc.), è necessario che il conducente disponga di mezzi che gli consentano di verificare facilmente, prima di spostare la macchina, che detti dispositivi siano in una posizione che consente uno spostamento sicuro.
Ciò vale anche per la posizione di tutti gli altri elementi che, per consentire uno spostamento sicuro, devono occupare una posizione definita, se necessario bloccata.
Quando ciò non genera altri rischi, lo spostamento della macchina deve essere subordinato alla posizione sicura degli elementi sopra indicati.
Uno spostamento involontario della macchina non deve essere possibile all'atto dell'avviamento del motore.
Lo spostamento di una macchina mobile autonoma deve tenere conto dei rischi relativi alla zona nella quale è destinata a muoversi e lavorare.
3.3.3. Funzione di spostamento
Fatte salve le disposizioni relative alla circolazione stradale, le macchine semoventi e i loro rimorchi devono rispettare i requisiti in materia di rallentamento, di arresto, di frenatura e di immobilizzazione che garantiscano la sicurezza in tutte le condizioni di funzionamento, di carico, di velocità, di caratteristiche del suolo e di pendenza previste.
Il rallentamento e l'arresto della macchina semovente devono poter essere ottenuti dal conducente attraverso un dispositivo principale. Se la sicurezza lo esige, in caso di guasto del dispositivo principale o in mancanza di energia per azionare tale dispositivo, un dispositivo d'emergenza con un dispositivo di comando interamente indipendente e facilmente accessibile deve consentire il rallentamento e l'arresto.
Se la sicurezza lo esige, l'immobilizzazione della macchina deve essere mantenuta con un dispositivo di sosta. Questo dispositivo può essere combinato con uno dei dispositivi di cui al secondo comma, se ha un'azione puramente meccanica.
Le macchine dotate di telecomando devono disporre di sistemi atti ad azionare automaticamente e immediatamente l'arresto e a prevenire il funzionamento potenzialmente pericoloso nelle situazioni seguenti:
a) quando il conducente ne ha perso il controllo;
b) quando è ricevuto un segnale di arresto;
c) quando è individuata un'avaria in un elemento del sistema di controllo legato alla sicurezza;
d) quando un segnale di convalida non è stato rilevato entro un termine specificato.
Il punto 1.2.4 non si applica alla funzione spostamento.
Le macchine o i prodotti correlati mobili autonomi devono essere conformi a una delle condizioni seguenti o a entrambe, ove necessario in base alla valutazione del rischio:
i) devono spostarsi e funzionare in una zona chiusa dotata di un sistema di protezione periferica comprendente ripari o dispositivi di protezione;
ii) devono essere dotati di dispositivi destinati a rilevare qualsiasi essere umano, animale domestico o qualsiasi altro ostacolo nelle loro vicinanze, laddove tali ostacoli potrebbero costituire un rischio per la salute e la sicurezza delle persone o di animali domestici o per il funzionamento sicuro della macchina o del prodotto correlato.
Gli spostamenti di macchine o prodotti correlati mobili correlati con uno o più rimorchi o apparecchiature rimorchiate, tra cui macchine o prodotti correlati mobili autonomi correlati a uno o più rimorchi o apparecchiature trainate, non devono generare rischi per persone, animali domestici o qualsiasi altro ostacolo presente nella zona pericolosa di tali macchine o prodotti correlati nonché di rimorchi o apparecchiature trainate.
3.3.4. Spostamento delle macchine con conducente a piedi
Ogni spostamento di una macchina semovente con conducente a piedi deve essere possibile solo se quest'ultimo esercita un'azione continua sul dispositivo di comando corrispondente. In particolare, nessuno spostamento deve essere possibile all'atto d'avviamento del motore. Il sistema di comando delle macchine con conducente a piedi deve essere progettato in modo da ridurre al minimo i rischi connessi allo spostamento inopinato della macchina verso il conducente, in particolare i rischi:
a) di schiacciamento;
b) di lesioni provocate da utensili rotanti.
La velocità di spostamento della macchina deve essere compatibile con l'andatura del conducente.
Sulle macchine che possono essere munite di un utensile rotante, quest'ultimo non deve potere essere azionato quando il comando di retromarcia è inserito, salvo che lo spostamento della macchina risulti dal movimento dell'utensile. In quest'ultimo caso la velocità in retromarcia deve essere sufficientemente ridotta, in modo da non presentare rischi per il conducente.
3.3.5. Guasto del circuito di comando
In caso di guasto dell'alimentazione del servosterzo, la macchina deve poter essere guidata per il tempo necessario ad arrestarla.
Nel caso di una macchina mobile autonoma, un guasto del meccanismo di sterzo non deve incidere sulla sicurezza della macchina.
3.4. MISURE DI PROTEZIONE CONTRO I RISCHI MECCANICI
3.4.1. Movimenti incontrollati
Le macchine o i prodotti correlati devono essere progettati, costruiti ed eventualmente montati su un supporto mobile in modo che al momento dello spostamento le oscillazioni incontrollate del baricentro non ne pregiudichino la stabilità né comportino sforzi eccessivi per la struttura.
3.4.2. Elementi mobili di trasmissione
In deroga al punto 1.3.8.1, nel caso dei motori, i ripari mobili che impediscono l'accesso agli elementi mobili del compartimento motore non devono essere provvisti di dispositivi di interblocco, a condizione che la loro apertura sia possibile soltanto con l'impiego di un utensile o di una chiave, oppure dopo aver azionato un comando situato sulla postazione di guida, se quest'ultima si trova in una cabina completamente chiusa con una serratura per impedire l'accesso non autorizzato.
3.4.3. Ribaltamento o rovesciamento laterale
Quando per una macchina semovente con conducente, operatore/i o altra/e persona/e trasportati esiste il rischio di ribaltamento o rovesciamento laterale, tale macchina deve essere munita di una struttura di protezione appropriata, a meno che ciò non accresca i rischi.
Detta struttura deve essere tale da garantire alle persone trasportate, in caso di ribaltamento o rovesciamento laterale, un adeguato volume limite di deformazione.
Al fine di verificare che la struttura soddisfi il requisito di cui al secondo comma, il fabbricante deve effettuare, o far effettuare, prove appropriate per ciascun tipo di struttura.
3.4.4. Caduta di oggetti
Quando per una macchina semovente con conducente, operatore/i altra/e o persona/e trasportati esistono rischi dovuti alla caduta di oggetti o di materiali, essa deve essere progettata e costruita in modo da tenere conto di tali rischi; essa deve inoltre essere munita, se le sue dimensioni lo consentono, di una struttura di protezione appropriata.
Detta struttura deve esser tale che in caso di caduta di oggetti o di materiali sia garantito alla persona o alle persone trasportate un adeguato volume limite di deformazione.
Al fine di verificare che la struttura soddisfi il requisito di cui al secondo comma, il fabbricante deve effettuare, o far effettuare, prove appropriate per ciascun tipo di struttura.
3.4.5. Mezzi di accesso
Mezzi di appoggio o di sostegno devono essere progettati, costruiti e disposti in modo che gli operatori li utilizzino istintivamente e non ricorrano ai dispositivi di comando per facilitare l'accesso.
3.4.6. Dispositivi di traino
Ogni macchina utilizzata per trainare o destinata ad essere trainata deve essere munita di dispositivi di rimorchio o di traino progettati, costruiti e disposti in modo da garantire che il collegamento e lo sganciamento possano essere effettuati facilmente e in modo sicuro e da impedire uno sganciamento accidentale durante l'utilizzazione.
Qualora il carico sul timone lo richieda, tali macchine devono essere munite di un supporto con una superficie d'appoggio adattata al carico e al terreno.
3.4.7. Trasmissione di potenza tra la macchina semovente (o il trattore) e la macchina azionata
I dispositivi amovibili di trasmissione meccanica che collegano una macchina semovente (o un trattore) al primo supporto fisso di una macchina azionata devono essere progettati e costruiti in modo che tutte le parti in movimento durante il funzionamento siano protette per tutta la lunghezza.
Sul lato della macchina semovente o del trattore, la presa di forza alla quale è correlato il dispositivo amovibile di trasmissione meccanica deve essere protetta da un riparo fisso correlato alla macchina semovente (o al trattore) oppure da qualsiasi altro dispositivo che garantisca una protezione equivalente.
Deve essere possibile aprire tale riparo per accedere al dispositivo amovibile di trasmissione. Una volta collocata, deve esservi abbastanza spazio per impedire all'albero motore di danneggiare il riparo quando la macchina (o il trattore) è in movimento.
Sul lato della macchina azionata, l'albero comandato deve essere chiuso in un carter di protezione fissato sulla macchina.
La presenza di un limitatore di coppia o di una ruota libera è autorizzata per la trasmissione cardanica soltanto sul lato in cui avviene il collegamento con la macchina azionata. In tal caso occorre indicare sul dispositivo amovibile di trasmissione meccanica il senso del montaggio.
Ogni macchina azionata il cui funzionamento implica la presenza di un dispositivo amovibile di trasmissione meccanica che la colleghi ad una macchina semovente (o a un trattore) deve possedere un sistema di aggancio del dispositivo amovibile di trasmissione meccanica tale che, quando la macchina è staccata, il dispositivo amovibile di trasmissione meccanica e il suo riparo non vengano danneggiati dal contatto con il suolo o con un elemento della macchina.
Gli elementi esterni del riparo devono essere progettati, costruiti e disposti in modo da non poter ruotare con il dispositivo amovibile di trasmissione meccanica. Il riparo deve coprire l'albero di trasmissione fino alle estremità delle ganasce interne nel caso di giunti cardanici semplici e almeno fino al centro del giunto o dei giunti esterni nel caso di cardani detti a grandangolo.
Se sono previsti accessi alle postazioni di lavoro in prossimità del dispositivo amovibile di trasmissione meccanica, essi devono essere progettati e costruiti in modo da evitare che i ripari di tali alberi possano servire da predellini, a meno che non siano progettati e costruiti a tal fine.
3.5. MISURE DI PROTEZIONE CONTRO ALTRI RISCHI
3.5.1. Batteria d'accumulatori
L'alloggiamento della batteria deve essere progettato e costruito in modo da impedire la proiezione dell'elettrolita sull'operatore in caso di ribaltamento o rovesciamento laterale e da evitare l'accumulo di vapori vicino ai posti occupati dagli operatori.
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo che la batteria possa essere disinserita con un dispositivo facilmente accessibile previsto a tal fine.
Le batterie con ricarica automatica per macchine mobili o prodotti correlati, tra cui macchine o prodotti correlati mobili autonomi, sono progettate per prevenire i pericoli di cui ai punti 1.3.8.2 e 1.5.1, compresi i rischi di contatto o di urto della macchina o del prodotto correlato con una persona o un'altra macchina o un altro prodotto correlato quando la macchina o i prodotti correlati si muovono autonomamente verso la stazione di ricarica.
3.5.2. Incendio
A seconda dei pericoli previsti dal fabbricante la macchina deve, qualora le dimensioni lo consentano:
a) permettere l'installazione di estintori facilmente accessibili; oppure
b) essere munita di sistemi di estinzione che siano parte integrante della macchina.
3.5.3. Emissioni di sostanze pericolose
Il punto 1.5.13, secondo e terzo comma, non si applica quando la funzione principale della macchina è l'applicazione di sostanze pericolose. Tuttavia l'operatore deve essere protetto dal rischio di esposizione a tali emissioni pericolose.
Le macchine mobili che trasportano il conducente aventi come loro funzione principale l'applicazione di sostanze pericolose devono essere dotate di cabine di filtrazione o misure di sicurezza equivalenti.
3.5.4. Rischio di contatto con linee elettriche aeree sotto tensione
A seconda della loro altezza, in relazione all’uso previsto, una macchina o un prodotto correlato mobile devono essere progettati, costruiti ed equipaggiati in maniera tale da prevenire il rischio di contatto con una linea elettrica aerea sotto tensione o il rischio di creare un arco elettrico tra qualsiasi parte della macchina o un operatore che conduce la macchina e una linea elettrica aerea sotto tensione.
Quando il rischio di contatto con una linea elettrica aerea sotto tensione non può essere evitato completamente per le persone che operano la macchina, le macchine o i prodotti correlati mobili devono essere progettati, costruiti ed equipaggiati in maniera tale da prevenire qualsiasi pericolo elettrico.
3.6. INFORMAZIONI E INDICAZIONI
3.6.1. Iscrizioni, segnalazioni e avvertimenti
Le macchine o i prodotti correlati devono essere tutti provvisti di iscrizioni e/o di targhe con le istruzioni per l'uso, la regolazione e la manutenzione, ovunque necessario, per garantire la tutela della salute e la sicurezza delle persone. Tali mezzi devono essere scelti, progettati e realizzati in modo da essere chiaramente visibili e indelebili.
Fatte salve le disposizioni relative alla circolazione stradale, le macchine o i prodotti correlati con conducente trasportato devono essere dotati dell’attrezzatura seguente:
a) un avvisatore acustico che consenta di avvertire le persone;
b) un sistema di segnalazione luminosa che tenga conto delle condizioni di impiego previste; ciò non si applica alle macchine o ai prodotti correlati destinati esclusivamente ai lavori sotterranei e sprovvisti di alimentazione elettrica;
c) all'occorrenza, vi deve essere un appropriato sistema di collegamento tra il rimorchio e la macchina o un prodotto correlato per l'azionamento dei segnali.
Le macchine o i prodotti correlati dotati di telecomando, le cui condizioni di impiego normali espongono le persone a rischi di urto o di schiacciamento, devono essere muniti di mezzi adeguati per segnalare i loro spostamenti o di mezzi per proteggere le persone contro tali rischi. Lo stesso vale per le macchine o i prodotti correlati la cui utilizzazione implica la ripetizione sistematica di avanzamento e arretramento lungo uno stesso asse e il cui conducente non ha visibilità posteriore diretta.
Le macchine o i prodotti correlati devono essere costruiti in modo tale che i dispositivi di avvertimento e di segnalazione non possano essere disinseriti involontariamente. Laddove indispensabile ai fini della sicurezza, tali dispositivi devono essere muniti di mezzi di controllo del buon funzionamento e un loro guasto deve essere reso apparente all'operatore.
Qualora il movimento delle macchine o dei loro utensili sia particolarmente pericoloso, devono essere previste indicazioni sulle macchine stesse che avvertano di non avvicinarsi alle macchine durante il lavoro; tali indicazioni devono essere leggibili a distanza sufficiente per garantire la sicurezza delle persone che operano nei pressi delle macchine.
3.6.2. Marcatura
1) Le macchine o i prodotti correlati devono tutti recare, in modo leggibile e indelebile, le indicazioni seguenti:
a) la potenza nominale espressa in chilowatt (kW);
b) la massa, nella configurazione più usuale, in chilogrammi (kg);
2) Inoltre, se del caso, le macchine o i prodotti correlati devono tutti recare, in modo leggibile e indelebile, le indicazioni seguenti:
a) lo sforzo massimo di trazione previsto dal fabbricante al gancio di traino in newton (N);
b) lo sforzo verticale massimo previsto sul gancio di traino in newton (N).
3.6.3. Istruzioni per l'uso
3.6.3.1. Vibrazioni
Le istruzioni per l'uso devono fornire le indicazioni seguenti relative alle vibrazioni, espresse come accelerazione (m/s2), trasmesse dalla macchina o dai prodotti correlati al sistema mano-braccio o a tutto il corpo:
a) il valore totale delle vibrazioni continue a cui è sottoposto il sistema mano- braccio;
b) il valore medio dell'ampiezza di picco dell'accelerazione ottenuto da vibrazioni da urti ripetuti, cui è sottoposto il sistema mano-braccio;
c) il valore quadratico medio massimo dell'accelerazione ponderata cui è esposto tutto il corpo, quando superi 0,5 m/s2. Se tale livello è inferiore o pari a 0,5 m/s2, deve essere indicato;
d) l'incertezza delle misurazioni.
I suddetti valori devono essere quelli misurati effettivamente sulla macchina o sul prodotto correlato in questione, oppure quelli stabiliti sulla base di misurazioni effettuate su una macchina o su prodotti correlati tecnicamente comparabili rappresentativi della macchina o dei prodotti correlati da produrre.
Qualora non possano essere applicate le norme armonizzate o le specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, le vibrazioni devono essere misurate usando il codice di misurazione più appropriato adeguato alla macchina o ai prodotti correlati interessati.
Devono essere descritte le condizioni di funzionamento durante la misurazione e il codice di misurazione utilizzato per effettuarla.
3.6.3.2. Usi molteplici
Le istruzioni per l'uso di una macchina o di un prodotto correlato che consente vari usi a seconda dell'attrezzatura impiegata e le istruzioni per l'uso delle attrezzature intercambiabili devono contenere le informazioni necessarie a consentire il montaggio e l'impiego in sicurezza della macchina o del prodotto correlato di base nonché delle attrezzature intercambiabili che possono esservi montate.
3.6.3.3. Macchine o prodotti correlati mobili autonomi
Le istruzioni per l'uso di macchine o prodotti correlati mobili autonomi devono specificare le caratteristiche delle loro zone di spostamento e di lavoro nonché delle zone pericolose.
4. REQUISITI ESSENZIALI SUPPLEMENTARI DI SICUREZZA E DI TUTELA DELLA SALUTE PER PREVENIRE I RISCHI DOVUTI AD OPERAZIONI DI SOLLEVAMENTO
Le macchine o i prodotti correlati che presentano rischi dovuti ad operazioni di sollevamento devono soddisfare tutti i pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui al presente capo (cfr. Principi generali, punto 4).
4.1. CONSIDERAZIONI GENERALI
4.1.1. Ai fini del punto 4.1, si applicano le definizioni seguenti:
a) "operazione di sollevamento": operazione di spostamento di unità di carico costituite da cose e/o persone che necessitano, in un determinato momento, di un cambiamento di livello;
b) "carico guidato": carico di cui l'intero spostamento avviene lungo guide rigide o flessibili, la cui posizione nello spazio è determinata da punti fissi;
c) "coefficiente di utilizzazione": rapporto aritmetico tra il carico garantito dal fabbricante, fino al quale un componente è in grado di trattenere tale carico, ed il carico massimo di esercizio marcato sul componente;
d) "coefficiente di prova": rapporto aritmetico tra il carico utilizzato per effettuare le prove statiche o dinamiche della macchina o del prodotto correlato o di un accessorio di sollevamento ed il carico massimo di esercizio marcato sulla macchina o sul prodotto correlato o sull'accessorio di sollevamento;
e) "prova statica": verifica che consiste nel controllare la macchina o il prodotto correlato o un accessorio di sollevamento e nell'applicargli successivamente una forza corrispondente al carico massimo di esercizio moltiplicato per un coefficiente di prova statica appropriato; quindi, dopo aver soppresso il carico, nell'eseguire di nuovo un'ispezione della macchina o dell'accessorio di sollevamento per controllare che non si sia verificato alcun danno;
f) "prova dinamica": verifica che consiste nel far funzionare la macchina o il prodotto correlato in tutte le possibili configurazioni al carico massimo di esercizio moltiplicato per il coefficiente di prova dinamica appropriato, tenendo conto del comportamento dinamico della macchina di sollevamento onde verificarne il buon funzionamento;
g) "supporto del carico": parte della macchina o del prodotto correlato sulla quale o nella quale le persone e/o le cose sono sorrette per essere sollevate.
4.1.2. Misure di protezione contro i rischi meccanici
4.1.2.1. Rischi dovuti alla mancanza di stabilità
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo che la stabilità prescritta al punto 1.3.1 sia mantenuta sia in servizio che fuori servizio, incluse tutte le fasi di trasporto, montaggio e smontaggio, in caso di guasti prevedibili di componenti e durante le prove effettuate in conformità delle istruzioni per l'uso. A tal fine il fabbricante deve utilizzare i metodi di verifica appropriati.
4.1.2.2. Macchine o prodotti correlati che si spostano lungo guide o su vie di scorrimento
Le macchine o i prodotti correlati devono essere muniti di dispositivi che agiscono sulle guide o vie di scorrimento in modo da evitare i deragliamenti.
Se, nonostante la presenza di simili dispositivi, permane un rischio di deragliamento o di guasto di un organo di guida o di scorrimento, si devono prevedere dispositivi che impediscano la caduta di attrezzature, di componenti o del carico, nonché il ribaltamento della macchina.
4.1.2.3. Resistenza meccanica
Le macchine o i prodotti correlati, inclusi gli accessori di sollevamento e i relativi componenti, devono poter resistere alle sollecitazioni cui sono soggetti nel corso della loro intera vita, durante il funzionamento e, se del caso, anche quando sono fuori servizio, nelle condizioni di installazione e di esercizio previste e in tutte le relative configurazioni, tenendo conto eventualmente degli effetti degli agenti atmosferici e degli sforzi esercitati dalle persone. Questo requisito deve essere soddisfatto anche durante il trasporto, il montaggio e lo smontaggio.
Le macchine o i prodotti correlati, inclusi gli accessori di sollevamento, devono essere progettati e costruiti in modo tale da evitare guasti dovuti alla fatica e all'usura tenuto conto dell'uso previsto e di qualsiasi uso scorretto ragionevolmente prevedibile.
I materiali utilizzati devono essere scelti tenendo conto degli ambienti di esercizio previsti, soprattutto per quanto riguarda la corrosione, l'abrasione, gli urti, le temperature estreme, la fatica, la fragilità, le radiazioni e l'invecchiamento.
La macchina o i prodotti correlati, inclusi gli accessori di sollevamento, devono essere progettati e costruiti in modo tale da sopportare i sovraccarichi applicati nelle prove statiche senza presentare deformazioni permanenti né disfunzioni manifeste. Il calcolo della resistenza deve tenere conto del valore del coefficiente di prova statica che è scelto in modo tale da garantire un livello adeguato di sicurezza. In generale, tale coefficiente ha i valori seguenti:
a) macchine o prodotti correlati mossi dalla forza umana, inclusi accessori di sollevamento: 1,5;
b) altre macchine o altri prodotti correlati: 1,25.
Le macchine o i prodotti correlati devono essere progettati e costruiti in modo tale da sopportare perfettamente le prove dinamiche effettuate con il carico massimo di utilizzazione moltiplicato per il coefficiente di prova dinamica. Il coefficiente di prova dinamica è scelto in modo da garantire un livello di sicurezza adeguato; tale coefficiente è, in generale, pari a 1,1. Le prove sono generalmente eseguite alle velocità nominali previste. Qualora il circuito di comando della macchina o del prodotto correlato autorizzi più movimenti simultanei le prove devono essere effettuate nelle condizioni più sfavorevoli, in generale combinando i relativi movimenti.
4.1.2.4. Pulegge, tamburi, rulli, funi e catene
I diametri delle pulegge, dei tamburi e dei rulli devono essere compatibili con le dimensioni delle funi o delle catene di cui possono essere muniti.
I tamburi e i rulli devono essere progettati, costruiti ed installati in modo che le funi o le catene di cui sono muniti possano avvolgersi senza lasciare lateralmente l'alloggiamento previsto.
Le funi utilizzate direttamente per il sollevamento o il supporto del carico non devono comportare alcuna impiombatura a parte quelle alle loro estremità. Le impiombature sono tuttavia tollerate negli impianti destinati per progettazione ad essere modificati regolarmente in funzione delle esigenze di utilizzazione.
Il coefficiente di utilizzazione dell'insieme fune e terminale deve essere scelto in modo tale da garantire un livello adeguato di sicurezza. Questo coefficiente è, in generale, pari a 5.
Il coefficiente di utilizzazione delle catene di sollevamento deve essere scelto in modo tale da garantire un livello adeguato di sicurezza. Questo coefficiente è, in generale, pari a 4.
Al fine di verificare che sia stato raggiunto il coefficiente di utilizzazione adeguato, il fabbricante deve effettuare, o far effettuare, prove appropriate per ciascun tipo di catena e di fune utilizzato direttamente per il sollevamento del carico e per ciascun tipo di terminale di fune.
4.1.2.5. Accessori di sollevamento e relativi componenti
Gli accessori di sollevamento e i relativi componenti devono essere dimensionati tenendo conto dei fenomeni di fatica e di invecchiamento per un numero di cicli di funzionamento conforme alla durata di vita prevista alle condizioni di funzionamento specificate per l'applicazione prevista.
Inoltre:
a) il coefficiente di utilizzazione degli insiemi fune metallico e terminale deve essere scelto in modo tale da garantire un livello adeguato di sicurezza; questo coefficiente è, in generale, pari a 5. Le funi non devono comportare nessun intreccio o anello diverso da quelli delle estremità;
b) allorché sono utilizzate catene a maglie saldate, queste devono essere del tipo a maglie corte. Il coefficiente di utilizzazione delle catene deve essere scelto in modo tale da garantire un livello adeguato di sicurezza; questo coefficiente è, in generale, pari a 4;
c) il coefficiente di utilizzazione delle funi, delle imbracature o delle cinghie di fibre tessili dipende dal materiale, dal processo di fabbricazione, dalle dimensioni e dall'utilizzazione. Questo coefficiente deve essere scelto in modo da garantire un livello di sicurezza adeguato; esso è, in generale, pari a 7, a condizione che i materiali utilizzati siano di ottima qualità controllata e che il processo di fabbricazione sia adeguato all'uso previsto. In caso contrario, il coefficiente è in generale più elevato per garantire un livello di sicurezza equivalente. Le funi, le imbracature o le cinghie di fibre tessili non devono presentare alcun nodo, impiombatura o collegamento, a parte quelli dell'estremità dell'imbracatura o della chiusura di un'imbracatura senza estremità;
d) il coefficiente d'utilizzazione di tutti i componenti metallici di un'imbracatura o utilizzati con un'imbracatura deve essere scelto in modo da garantire un livello adeguato di sicurezza; questo coefficiente è, in generale, pari a 4;
e) il carico massimo di utilizzazione di una braca a trefoli è stabilito tenendo conto del coefficiente di utilizzazione del trefolo più debole, del numero di trefoli e di un fattore di riduzione che dipende dal tipo di imbracatura;
f) al fine di verificare che sia stato raggiunto il coefficiente di utilizzazione adeguato, il fabbricante deve effettuare, o far effettuare, prove appropriate per ciascun tipo di componente di cui alle lettere da a) a d).
4.1.2.6. Comando dei movimenti
I dispositivi di controllo dei movimenti devono agire in modo da mantenere in condizioni di sicurezza la macchina o il prodotto correlato su cui sono installati.
a) Le macchine o i prodotti correlati devono essere progettati, costruiti o attrezzati con dispositivi che mantengono l'ampiezza dei movimenti dei loro componenti entro i limiti previsti. L'attività di questi dispositivi deve essere preceduta eventualmente da un segnale;
b) Se più macchine o prodotti correlati fissi o traslanti su rotaie possono compiere evoluzioni simultanee con rischio di urti, tali macchine devono essere progettate e costruite per poter essere equipaggiate di sistemi che consentano di evitare tali rischi.
c) Le macchine o i prodotti correlati devono essere progettati e costruiti in modo che i carichi non possano derivare pericolosamente o cadere improvvisamente in caduta libera anche in caso di interruzione parziale o totale di energia o quando cessa l'azione dell'operatore.
d) Tranne che per le macchine o i prodotti correlati il cui lavoro richieda una siffatta applicazione, nelle normali condizioni di esercizio non deve essere possibile abbassare il carico soltanto sotto il controllo di un freno a frizione.
e) Gli organi di presa devono essere progettati e costruiti in modo da evitare la caduta improvvisa dei carichi.
4.1.2.7. Movimenti di carichi durante la movimentazione
La postazione di manovra della macchina deve essere posizionata in modo tale da assicurare la più ampia visuale possibile delle traiettorie degli elementi mobili, per evitare la possibilità di urtare persone, materiali o altre macchine che possono funzionare simultaneamente e quindi presentare un pericolo.
Le macchine a carico guidato devono essere progettate e costruite in modo tale da prevenire lesioni alle persone dovute ai movimenti del carico, del supporto del carico o degli eventuali contrappesi.
4.1.2.8. Macchine che collegano piani definiti
4.1.2.8.1. Movimenti del supporto del carico
Il movimento del supporto del carico delle macchine che collegano piani definiti deve essere a guida rigida verso e ai piani. Anche i sistemi a forbice sono considerati a guida rigida.
4.1.2.8.2. Accesso al supporto del carico
Se al supporto del carico hanno accesso persone, la macchina deve essere progettata e costruita in modo da garantire che il supporto del carico resti immobile durante l'accesso, in particolare al momento del carico o dello scarico.
La macchina deve essere progettata e costruita in modo da garantire che il dislivello tra il supporto del carico e il piano servito non crei rischi di inciampo.
4.1.2.8.3. Rischi dovuti al contatto con il supporto del carico in movimento
Se necessario, per soddisfare i requisiti di cui al punto 4.1.2.7, secondo comma, il percorso del supporto del carico deve essere reso inaccessibile durante il funzionamento normale.
Laddove, durante l'ispezione o la manutenzione, vi sia il rischio che le persone situate al di sotto o al di sopra del supporto del carico siano schiacciate tra il supporto del carico e le parti fisse, deve essere lasciato spazio libero sufficiente tramite volumi di rifugio o dispositivi meccanici di blocco del movimento del supporto del carico.
4.1.2.8.4. Rischio di caduta del carico dal supporto del carico
In caso di rischio di caduta del carico dal supporto del carico, la macchina deve essere progettata e costruita in modo da prevenire tale rischio.
4.1.2.8.5. Piani
Devono essere prevenuti i rischi dovuti al contatto delle persone ai piani con il supporto del carico in movimento o altri elementi mobili.
In caso di rischio di caduta di persone nel percorso del supporto del carico quando quest'ultimo non è presente ai piani, devono essere installati ripari per prevenire tale rischio. Detti ripari non devono aprirsi in direzione del percorso del supporto del carico. Devono essere montati con un dispositivo di interblocco controllato dalla posizione del supporto del carico che impedisce:
a) movimenti pericolosi del supporto del carico finché i ripari non sono chiusi e bloccati;
b) l'apertura pericolosa di un riparo finché il supporto del carico non si sia arrestato al piano corrispondente.
4.1.3. Idoneità all'impiego
Il fabbricante si accerta, all'atto dell'immissione sul mercato o della prima messa in servizio delle macchine di sollevamento o dei prodotti correlati, inclusi gli accessori di sollevamento, con adeguate misure che egli adotta o fa adottare, che le macchine di sollevamento o i prodotti correlati, inclusi gli accessori di sollevamento, pronti ad essere utilizzati, a operazione manuale o a operazione motorizzata, possano svolgere le funzioni previste in condizioni di sicurezza.
Le prove statiche e dinamiche di cui al punto 4.1.2.3 devono essere eseguite su tutte le macchine di sollevamento o prodotti correlati pronti per essere messi in servizio.
Se le macchine o i prodotti correlati non possono essere montati nei locali del fabbricante le misure appropriate devono essere adottate sul luogo dell'utilizzazione dal fabbricante. In caso contrario, esse possono essere adottate tanto nei locali del fabbricante quanto sul luogo dell'utilizzazione.
4.2. REQUISITI PER LE MACCHINE O I PRODOTTI CORRELATI MOSSI DA ENERGIA DIVERSA DA QUELLA UMANA
4.2.1. Comando dei movimenti
Devono essere utilizzati dispositivi di comando ad azione mantenuta per il comando della macchina o dei prodotti correlati o delle loro attrezzature. Tuttavia, per i movimenti, parziali o totali, per i quali non si corre il rischio di urto da parte del carico o della macchina o del prodotto correlato, si possono sostituire detti comandi con dispositivi di comando che consentono movimenti con arresti automatici a posizioni preselezionate senza dover mantenere l'azionamento da parte dell'operatore.
4.2.2. Controllo delle sollecitazioni
Le macchine o i prodotti correlati con un carico massimo di utilizzazione pari almeno a 1000 kg o il cui momento di rovesciamento è pari almeno a 40 000 Nm devono essere dotati di dispositivi che avvertano il conducente e impediscano i movimenti pericolosi in caso:
a) di sovraccarico sia per eccesso di carico massimo di utilizzazione, sia per superamento del momento massimo di utilizzazione dovuto a tale carico; o
b) di superamento del momento di rovesciamento.
4.2.3. Impianti guidati da funi
Le funi portanti, traenti o portanti e traenti devono essere tese da contrappesi o da un dispositivo che consente di controllare in permanenza la tensione.
4.3. INFORMAZIONI E MARCATURA
4.3.1. Catene, funi e cinghie
Ogni lunghezza di catena, fune o cinghia di sollevamento che non faccia parte di un insieme deve recare una marcatura o, se ciò non è possibile, una targa o un anello inamovibile con i riferimenti del fabbricante e l'identificazione della relativa attestazione.
L'attestazione sopra menzionata deve contenere almeno le indicazioni seguenti:
a) il nome e indirizzo del fabbricante;
b) la descrizione della catena o della fune comprendente:
i) le dimensioni nominali;
ii) la costruzione;
iii) il materiale di fabbricazione; e
iv) qualsiasi trattamento metallurgico speciale subito dal materiale;
c) il metodo di prova impiegato;
d) il carico massimo che deve essere sopportato, durante il funzionamento, dalla catena o dalla fune. Una forcella di valori può essere indicata in funzione delle applicazioni previste.
4.3.2. Accessori di sollevamento
Gli accessori di sollevamento devono recare le indicazioni seguenti:
a) l’identificazione del materiale, qualora tale informazione sia necessaria per la sicurezza di utilizzo;
b) il carico di utilizzazione massimo.
Per gli accessori di sollevamento sui quali la marcatura è materialmente impossibile, le indicazioni di cui al primo comma devono essere riportate su una targa o un altro mezzo equivalente fissato saldamente all'accessorio.
Le indicazioni devono essere leggibili e situate in un punto in cui non rischino di scomparire per effetto dell'usura né di compromettere la resistenza dell'accessorio.
4.3.3. Macchine di sollevamento o prodotti correlati
Il carico massimo di utilizzazione deve essere marcato in modo ben visibile sulla macchina di sollevamento o sul prodotto correlato. Questa marcatura deve essere leggibile, indelebile e chiara.
Se il carico massimo di utilizzazione dipende dalla configurazione della macchina di sollevamento o del prodotto correlato, ogni postazione di lavoro deve essere munita di una targa dei carichi che indichi sotto forma di tabelle o di diagrammi i carichi di utilizzazione consentiti per ogni singola configurazione.
Le macchine o i prodotti correlati destinati al sollevamento di sole cose, munite di un supporto del carico accessibile alle persone, devono recare un'avvertenza chiara ed indelebile che vieti il sollevamento di persone. Tale avvertenza deve essere visibile da ciascun posto da cui è possibile l'accesso.
4.4. ISTRUZIONI PER L'USO
4.4.1. Accessori di sollevamento
Ogni accessorio di sollevamento, o ciascuna partita di accessori di sollevamento commercialmente indivisibile, deve essere accompagnato da istruzioni che forniscano almeno le indicazioni seguenti:
a) l’uso previsto;
b) i limiti di utilizzazione (in particolare per gli accessori di sollevamento quali ventose magnetiche o a vuoto che non soddisfano pienamente le disposizioni di cui al punto 4.1.2.6, lettera e));
c) le istruzioni per il montaggio, l'uso e la manutenzione;
d) il coefficiente di prova statica utilizzato.
4.4.2. Macchine di sollevamento o prodotti correlati
Le macchine di sollevamento o i prodotti correlati devono essere accompagnati da istruzioni per l'uso che forniscano le informazioni seguenti:
a) le caratteristiche tecniche della macchina di sollevamento o del prodotto correlato, in particolare:
i) il carico massimo di utilizzazione ed eventualmente un richiamo alla targa dei carichi o alla tabella dei carichi di cui al punto 4.3.3, secondo comma;
ii) le reazioni sugli appoggi o sugli incastri e, se del caso, le caratteristiche delle guide;
iii) se del caso, la definizione ed i mezzi di installazione delle zavorre;
b) il contenuto del registro di controllo della macchina di sollevamento, se non è fornito insieme a quest'ultima;
c) le raccomandazioni per l'uso, in particolare per ovviare alle insufficienze della visione diretta del carico da parte dell'operatore;
d) se del caso, una relazione di prova che descriva dettagliatamente le prove statiche e dinamiche effettuate dal fabbricante, o per suo conto;
e) per le macchine di sollevamento o i prodotti correlati che non sono montati presso il fabbricante nella loro configurazione di utilizzazione, le istruzioni necessarie per attuare le disposizioni di cui al punto 4.1.3 prima della loro prima messa in servizio.
5. REQUISITI ESSENZIALI SUPPLEMENTARI DI SICUREZZA E DI TUTELA DELLA SALUTE PER LE MACCHINE O I PRODOTTI CORRELATI DESTINATI AD ESSERE UTILIZZATI NEI LAVORI SOTTERRANEI
Le macchine o i prodotti correlati destinati ad essere utilizzati nei lavori sotterranei devono soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute di cui al presente capo (cfr. Principi generali, punto 4).
5.1. RISCHI DOVUTI ALLA MANCANZA DI STABILITÀ
Le armature semoventi devono essere progettate e costruite in modo da permettere un adeguato orientamento, quando vengono spostate, e non devono ribaltarsi prima e durante la messa sotto pressione e dopo la decompressione. Devono disporre di ancoraggi per la piastra di testa dei raccordi idraulici individuali.
5.2. CIRCOLAZIONE
Le armature semoventi devono permettere alle persone di circolare senza intralci.
5.3. DISPOSITIVI DI COMANDO
I dispositivi di comando dell'acceleratore e dei freni che consentono di spostare le macchine che scorrono su rotaia devono essere azionati a mano. Tuttavia i dispositivi di consenso possono essere a pedale.
I dispositivi di comando delle armature semoventi devono essere progettati, costruiti e disposti in modo da permettere che, durante l'operazione di avanzamento, gli operatori siano protetti da un'armatura fissa. I dispositivi di comando devono essere protetti da qualsiasi azionamento involontario.
5.4. ARRESTO DELLO SPOSTAMENTO
Le locomotive destinate ad essere impiegate nei lavori sotterranei devono essere munite di un dispositivo di consenso che agisca sul circuito di comando dello spostamento della macchina di modo che si arresti, se il conducente non è più in grado di comandarlo.
5.5. INCENDIO
La lettera b) del punto 3.5.2 è obbligatoria per le macchine o i prodotti correlati comprendenti parti ad alto rischio di infiammabilità.
Il sistema di frenatura delle macchine o dei prodotti correlati destinati ad essere impiegati nei lavori sotterranei deve essere progettato e costruito in modo da non produrre scintille o essere causa di incendio.
Le macchine o i prodotti correlati a motore a combustione interna destinati ad essere impiegati in lavori sotterranei devono essere dotati esclusivamente di motore che utilizzi un combustibile a bassa tensione di vapore che escluda qualsiasi scintilla di origine elettrica.
5.6. EMISSIONI DI GAS DI SCARICO
I gas di scarico emessi da motori a combustione interna non devono essere evacuati verso l'alto.
6. REQUISITI ESSENZIALI SUPPLEMENTARI DI SICUREZZA E DI TUTELA DELLA SALUTE PER LE MACCHINE O I PRODOTTI CORRELATI CHE PRESENTANO RISCHI PARTICOLARI DOVUTI AL SOLLEVAMENTO DI PERSONE
Le macchine o i prodotti correlati che presentano rischi particolari dovuti al sollevamento di persone devono soddisfare tutti i pertinenti requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente capo (cfr. Principi generali, punto 4).
6.1. CONSIDERAZIONI GENERALI
6.1.1. Resistenza meccanica
Il supporto del carico, incluse eventuali botole, deve essere progettato e costruito in modo da offrire lo spazio e la resistenza corrispondenti al numero massimo di persone consentito nel supporto del carico e al carico massimo di utilizzazione.
I coefficienti di utilizzazione dei componenti di cui ai punti 4.1.2.4 e 4.1.2.5 non sono sufficienti per le macchine o i prodotti correlati destinati al sollevamento di persone e devono, come regola generale, essere raddoppiati. Le macchine o i prodotti correlati destinati al sollevamento di persone o di persone e cose devono essere muniti di un sistema di sospensione o di sostegno del supporto del carico, progettato e costruito in modo tale da garantire un adeguato livello globale di sicurezza e di evitare il rischio di caduta del supporto del carico.
Se per sospendere il supporto del carico sono utilizzate funi o catene, come regola generale sono richieste almeno due funi o catene indipendenti, ciascuna con il proprio ancoraggio.
6.1.2. Controllo delle sollecitazioni per le macchine o i prodotti correlati mossi da una forza diversa dalla forza umana
I requisiti di cui al punto 4.2.2 si applicano a prescindere dal carico massimo di utilizzazione e dal momento di rovesciamento, a meno che il fabbricante possa dimostrare che non vi sono rischi di sovraccarico o di rovesciamento.
6.2. DISPOSITIVI DI COMANDO
Se i requisiti di sicurezza non impongono altre soluzioni, come regola generale il supporto del carico deve essere progettato e costruito in modo che le persone che vi si trovano dispongano di dispositivi di comando dei movimenti di salita e discesa e, se del caso, di altri movimenti del supporto del carico.
Tali dispositivi di comando devono avere la precedenza sugli altri dispositivi di comando dello stesso movimento salvo sui dispositivi di arresto di emergenza.
I dispositivi di comando per i movimenti di cui al primo comma devono essere del tipo ad azione mantenuta, tranne quando il supporto del carico è completamente chiuso. Se non vi è alcun rischio per le persone o le cose che si trovano sul supporto del carico in caso di urto o caduta e se non vi è alcun rischio dovuto a movimenti verso l'alto e verso il basso del supporto del carico, si possono utilizzare dispositivi di comando che consentono movimenti con arresti automatici a posizioni preselezionate, anziché dispositivi di comando di tipo ad azione mantenuta.
6.3. RISCHI PER LE PERSONE CHE SI TROVANO NEL SUPPORTO DEL CARICO O SOPRA DI ESSO
6.3.1. Rischi dovuti ai movimenti del supporto del carico
Le macchine o i prodotti correlati per il sollevamento di persone devono essere progettati, costruiti e attrezzati in modo tale che le accelerazioni o le decelerazioni del supporto del carico non generino rischi per le persone.
6.3.2. Rischio di caduta delle persone dal supporto del carico
Il supporto del carico non deve inclinarsi tanto da comportare un rischio di caduta per i suoi occupanti, anche durante i movimenti della macchina o del prodotto correlato e del supporto del carico.
Se il supporto del carico è progettato per fungere da postazione di lavoro, devono essere adottate disposizioni per garantirne la stabilità e impedire movimenti pericolosi.
Se le misure di cui al punto 1.5.15 non sono sufficienti, i supporti del carico devono essere muniti di ancoraggi appropriati in numero adeguato al numero di persone consentito nel supporto del carico. I punti di ancoraggio devono essere sufficientemente resistenti per l'uso di attrezzature per la protezione individuale contro le cadute dall'alto.
Eventuali botole nel pavimento o nel soffitto o portelli laterali devono essere progettati e costruiti in modo da impedire l'apertura involontaria e devono aprirsi in senso contrario al rischio di caduta in caso di apertura inopinata.
6.3.3. Rischio dovuto alla caduta di oggetti sul supporto del carico
In caso di rischio di caduta di oggetti sul supporto del carico con conseguente pericolo per le persone, il supporto del carico deve essere munito di una copertura di protezione.
6.4. MACCHINE O PRODOTTI CORRELATI CHE COLLEGANO PIANI DEFINITI
6.4.1. Rischi per le persone che si trovano nel supporto del carico o sopra di esso
Il supporto del carico deve essere progettato e costruito in modo da prevenire i rischi dovuti al contatto tra le persone e/o le cose, che si trovano nel supporto del carico o sopra di esso, con elementi fissi o mobili. Se necessario, per soddisfare questo requisito, il supporto del carico stesso deve essere completamente chiuso e con porte munite di un dispositivo di interblocco che impedisca movimenti pericolosi del supporto del carico, se le porte non sono chiuse. Le porte devono restare chiuse se il supporto del carico si arresta tra i piani, qualora vi sia il rischio di caduta dal supporto del carico.
La macchina o i prodotti correlati devono essere progettati, costruiti e, se necessario, muniti di dispositivi in modo da impedire movimenti incontrollati in salita o in discesa del supporto del carico. Tali dispositivi devono essere in grado di arrestare il supporto del carico in condizioni di carico di utilizzazione massimo e di velocità massima prevedibile.
L'azione di arresto non deve causare decelerazioni dannose per gli occupanti, in qualsiasi condizione di carico.
6.4.2. Comandi ai piani
I comandi ai piani, ad eccezione di quelli di emergenza, non devono avviare movimenti del supporto del carico quando:
a) i dispositivi di comando nel supporto del carico sono azionati;
b) il supporto del carico non si trova a un piano.
6.4.3. Accesso al supporto del carico
I ripari ai piani e sul supporto del carico devono essere progettati e costruiti in modo da garantire il trasferimento in condizioni di sicurezza verso il supporto del carico e viceversa, tenuto conto della gamma prevedibile di cose e persone da sollevare.
6.5. MARCATURE
Nel supporto del carico devono figurare le informazioni necessarie per garantire la sicurezza, inclusi:
a) il numero di persone consentito nel supporto del carico;
b) il carico di utilizzazione massimo.
ALLEGATO IV DOCUMENTAZIONE TECNICA
Parte A
DOCUMENTAZIONE TECNICA PER MACCHINE E PRODOTTI CORRELATI
La documentazione tecnica deve specificare i mezzi utilizzati dal fabbricante per assicurare la conformità della macchina o del prodotto correlato ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III.
La documentazione tecnica deve comprendere almeno gli elementi seguenti:
a) una descrizione completa della macchina o del prodotto correlato e del suo uso previsto;
b) la documentazione relativa alla valutazione del rischio che deve dimostrare la procedura seguita, inclusi:
i) un elenco dei requisiti essenziali di sicurezza e di tutela della salute applicabili alla macchina o al prodotto correlato;
ii) la descrizione delle misure di protezione attuate per soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute applicabili e, se del caso, l'indicazione dei rischi residui connessi con la macchina o il prodotto correlato;
c) disegni e schemi di progettazione e fabbricazione della macchina o del prodotto correlato nonché dei suoi componenti, sottoinsiemi e circuiti;
d) le descrizioni e le spiegazioni necessarie alla comprensione dei disegni e degli schemi di cui alla lettera c) nonché del funzionamento della macchina o del prodotto correlato;
e) i riferimenti delle norme armonizzate di cui all'articolo 20, paragrafo 1, o delle specifiche comuni adottate dalla Commissione a norma dell'articolo 20, paragrafo 3, che sono state applicate per la progettazione e la fabbricazione della macchina o del prodotto correlato. In caso di applicazione parziale delle norme armonizzate o delle specifiche comuni la documentazione tecnica deve specificare le parti che sono state applicate;
f) se le norme armonizzate o le specifiche comuni non sono state applicate o lo sono state solo parzialmente, la descrizione delle altre specifiche tecniche che sono state applicate al fine di soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute e applicabili;
g) le relazioni e/o i risultati dei calcoli di progettazione, delle prove, delle ispezioni e degli esami effettuati per verificare la conformità della macchina o del prodotto correlato rispetto ai requisiti essenziali di sicurezza e di tutela della salute applicabili;
h) una descrizione dei mezzi usati dal fabbricante durante la produzione della macchina o del prodotto correlato per assicurare la conformità della macchina o del prodotto correlato fabbricato rispetto alle specifiche di progettazione;
i) una copia delle istruzioni per l'uso e delle informazioni che figurano nell'allegato III, punto 1.7.4;
j) se del caso, la dichiarazione UE di incorporazione per le quasi-macchine di cui all'allegato V, parte B, e le istruzioni di assemblaggio di cui all’allegato XI;
k) se del caso, copie delle dichiarazioni UE di conformità delle macchine o dei prodotti correlati, nonché di qualsiasi prodotto disciplinato da altre normative di armonizzazione dell'Unione incorporate nella macchina o nel prodotto correlato;
l) per le macchine o i prodotti correlati fabbricati in serie, le misure interne che saranno attuate per garantire che tali macchine o prodotti correlati restino conformi al presente regolamento;
m) il codice sorgente o la logica di programmazione del software relativo alla sicurezza al fine di dimostrare la conformità della macchina o del prodotto correlato rispetto al presente regolamento a seguito di una richiesta motivata da parte di un'autorità nazionale competente, a condizione che sia necessario/a affinché tali autorità siano in grado di verificare il rispetto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
n) per le macchine alimentate da sensori, azionate da remoto o autonome o i prodotti correlati, se le operazioni relative alla sicurezza sono controllate da dati provenienti da sensori, una descrizione, se del caso, delle caratteristiche generali, delle capacità e delle limitazioni del sistema, dei dati, dello sviluppo, delle prove e della convalida dei processi utilizzati;
o) i risultati di ricerche e prove su componenti, accessori o sulla macchina o il prodotto correlato svolte dal fabbricante per stabilire se la macchina o il prodotto correlato, in conseguenza della sua progettazione o costruzione, possano essere montati e messi in servizio in condizioni di sicurezza.
Parte B
DOCUMENTAZIONE TECNICA PER LE QUASI-MACCHINE
La documentazione tecnica deve specificare i mezzi utilizzati dal fabbricante per assicurare la conformità della quasi-macchina ai pertinenti requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III.
La documentazione tecnica deve comprendere almeno gli elementi seguenti:
a) una descrizione completa della quasi-macchina e della sua funzione prevista ove incorporata o assemblata ad altre macchine o ad altre quasi-macchine o apparecchi;
b) la documentazione relativa alla valutazione del rischio che dimostra la procedura seguita, inclusi:
i) un elenco dei requisiti essenziali di sicurezza e di tutela della salute applicabili alla quasi-macchina,
ii) una descrizione delle misure di protezione attuate per eliminare i pericoli identificati o per ridurre i rischi e, se del caso, l'indicazione dei rischi residui;
c) disegni e schemi di progettazione e fabbricazione della quasi-macchina nonché dei suoi componenti, sottoinsiemi e circuiti;
d) le descrizioni e le spiegazioni necessarie alla comprensione dei disegni e degli schemi di cui alla lettera c) nonché del funzionamento della quasi-macchina;
e) i riferimenti delle norme armonizzate a norma dell'articolo 20, paragrafo 1, o delle specifiche comuni adottate dalla Commissione a norma dell'articolo 20, paragrafo 3, che sono state applicate per la progettazione e la fabbricazione della quasi- macchina. In caso di applicazione parziale delle norme armonizzate o delle specifiche comuni la documentazione tecnica deve specificare le parti che sono state applicate;
f) se le norme armonizzate o le specifiche comuni non sono state applicate o lo sono state solo parzialmente, le descrizioni delle altre specifiche tecniche che sono state applicate al fine di soddisfare tutti i requisiti essenziali di sicurezza e di tutela della salute e di applicabili;
g) le relazioni e/o i risultati dei calcoli di progettazione, delle prove, delle ispezioni e degli esami effettuati per verificare la conformità della quasi-macchina rispetto ai requisiti essenziali di sicurezza e di tutela della salute applicabili;
h) una descrizione dei mezzi usati dal fabbricante durante la produzione della quasi- macchina per assicurare la conformità della quasi-macchina fabbricata rispetto alle specifiche di progettazione;
i) una copia delle istruzioni di assemblaggio per la quasi-macchina di cui all'allegato XI;
j) nel caso di quasi-macchine fabbricate in serie, le misure interne che saranno attuate per garantire che tali quasi-macchine restino conformi ai requisiti essenziali di sicurezza e di tutela della salute applicati;
k) il codice sorgente o la logica di programmazione del software relativo alla sicurezza, su richiesta motivata da parte di un'autorità nazionale competente, a condizione che tale codice sorgente o logica di programmazione siano necessari affinché tali autorità siano in grado di verificare il rispetto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
l) per una quasi-macchina alimentata da sensori, azionata da remoto o autonoma, se le operazioni relative alla sicurezza sono controllate da dati provenienti da sensori, una descrizione, se del caso, delle caratteristiche generali, delle capacità e delle limitazioni del sistema, dei dati, dello sviluppo, delle prove e della convalida dei processi utilizzati;
m) i risultati di ricerche e prove su componenti, accessori o sulla quasi-macchina svolte dal fabbricante per stabilire se la macchina, in conseguenza della sua progettazione o costruzione, possa essere montata e incorporata in condizioni di sicurezza.
ALLEGATO V DICHIARAZIONE DI CONFORMITÀ UE E DICHIARAZIONE DI INCORPORAZIONE UE
Parte A
Dichiarazione di conformità UE di macchine e prodotti correlati n. … (1)
La dichiarazione di conformità UE deve riportare le indicazioni seguenti:
1. Macchina o prodotto correlato (prodotto, tipo, modello, lotto o numero di serie) o macchina o prodotto correlato che ha subito modifiche sostanziali.
2. Nome e indirizzo del fabbricante e, se del caso, del suo mandatario.
3. Per le macchine di sollevamento destinate ad essere installate in modo permanente in un edificio o in una struttura e che non possono essere assemblate nei locali del fabbricante ma che possono essere montate solo sul luogo di utilizzazione, l'indirizzo di tale luogo.
4. La presente dichiarazione di conformità è rilasciata sotto l'esclusiva responsabilità del fabbricante.
5. Oggetto della dichiarazione (identificazione della macchina o del prodotto correlato che ne consenta la rintracciabilità; se necessario per l'identificazione della macchina o del prodotto correlato, si può includere un'immagine a colori sufficientemente chiara).
6. L'oggetto della dichiarazione di cui al punto 5 è conforme alla normativa di armonizzazione dell'Unione seguente.
7. Riferimenti alle norme armonizzate di cui all'articolo 20, paragrafo 1, o alle specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, che sono state applicate, compresa la data della pubblicazione del riferimento alle norme armonizzate nella Gazzetta ufficiale dell’Unione europea o della specifica comune, oppure riferimenti ad altre specifiche tecniche, compresa la data, in relazione alla quale si dichiara la conformità. In caso di applicazione parziale delle norme armonizzate o delle specifiche comuni la dichiarazione UE di conformità deve specificare le parti che sono state applicate.
8. Laddove applicabile, l'organismo notificato... (nome, numero)... ha effettuato l'esame UE del tipo (modulo B) e ha emesso il certificato di esame UE del tipo... (riferimento a tale certificato), seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) o la conformità basata sulla verifica di un unico prodotto (modulo G) o sulla garanzia qualità totale (modulo H).
9. Laddove applicabile, la macchina o il prodotto correlato sono soggetti alla procedura di valutazione della conformità basata sul controllo interno della produzione (modulo A).
10. Informazioni supplementari: Firmato a nome e per conto di: … (luogo e data del rilascio):
(nome e cognome, funzione) (firma):
Parte B
Dichiarazione di incorporazione UE di quasi-macchine n. … (2)
La dichiarazione di incorporazione deve contenere gli elementi seguenti:
1. Quasi-macchina (numero di prodotto, di tipo, di modello, di lotto o di serie).
2. Nome e indirizzo del fabbricante e, se del caso, del suo mandatario.
3. La presente dichiarazione di incorporazione è rilasciata sotto l'esclusiva responsabilità del fabbricante.
4. Oggetto della dichiarazione (identificazione della quasi-macchina che ne consenta la rintracciabilità; se necessario per l'identificazione della quasi-macchina, si può includere un'immagine a colori sufficientemente chiara).
5. Un'indicazione con la quale si dichiara esplicitamente quali requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio (3) sono applicati e rispettati e che la documentazione tecnica pertinente è stata compilata in conformità dell'allegato IV, parte B e, se del caso, un'indicazione con la quale si dichiara che la quasi-macchina è conforme rispetto ad altra normativa di armonizzazione dell'Unione pertinente.
6. Riferimenti alle norme armonizzate di cui all'articolo 20, paragrafo 1, o alle specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, che sono state applicate, compresa la data della norma o della specifica comune, oppure riferimenti ad altre specifiche tecniche, compresa la data, in relazione alla quale si dichiara la conformità. In caso di applicazione parziale delle norme armonizzate o delle specifiche comuni la dichiarazione UE di incorporazione deve specificare le parti che sono state applicate.
7. Un impegno a trasmettere, in risposta a una richiesta adeguatamente motivata da parte delle autorità nazionali, informazioni pertinenti sulle quasi-macchine. L'impegno deve comprendere le modalità di trasmissione e lasciare impregiudicati i diritti di proprietà intellettuale del fabbricante della quasi-macchina.
8. Una dichiarazione secondo cui la quasi-macchina non deve essere messa in servizio finché la macchina finale in cui deve essere incorporata non è stata dichiarata conforme al presente regolamento.
9. Informazioni supplementari: Firmato a nome e per conto di: … (luogo e data del rilascio):
(nome e cognome, funzione) (firma):
__________
(1) L'assegnazione di un numero, da parte del fabbricante, alla dichiarazione di conformità è opzionale.
(2) L'assegnazione di un numero alla dichiarazione di conformità è opzionale.
(3) Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio (GU L 165 del 29.6.2023, pag. 1).
ALLEGATO VI
CONTROLLO INTERNO DELLA PRODUZIONE
(Modulo A)
1. Il controllo interno della produzione è la procedura di valutazione della conformità con cui il fabbricante ottempera agli obblighi stabiliti ai punti 2, 3 e 4 e garantisce e dichiara, sotto la sua esclusiva responsabilità, che la macchina o il prodotto correlato interessati soddisfano i requisiti del presente regolamento.
2. Documentazione tecnica
Il fabbricante deve predisporre la documentazione tecnica di cui all'allegato IV, parte A.
3. Fabbricazione
Il fabbricante deve adottare tutte le misure necessarie affinché il processo di fabbricazione e il suo controllo garantiscano la conformità della macchina o dei prodotti correlati fabbricati rispetto alla documentazione tecnica di cui al punto 2 e ai requisiti applicabili del presente regolamento.
4. Marcatura CE e dichiarazione di conformità UE
4.1. Il fabbricante deve apporre la marcatura CE su tutte le macchine o i prodotti correlati che soddisfano i requisiti applicabili del presente regolamento.
4.2. Il fabbricante deve compilare una dichiarazione di conformità UE per ciascun modello di macchina o prodotto correlato conformemente all'articolo 21 che, insieme alla documentazione tecnica, lascia a disposizione delle autorità nazionali per 10 anni dalla data in cui la macchina o il prodotto correlato sono stati immessi sul mercato o messi in servizio. La dichiarazione di conformità UE deve identificare il modello della macchina o del prodotto correlato per il quale è stata compilata.
Una copia della dichiarazione di conformità UE deve essere messa a disposizione delle autorità competenti su richiesta.
5. Mandatario
Gli obblighi del fabbricante di cui al punto 4 possono essere adempiuti, per conto del fabbricante e sotto la sua responsabilità, dal suo mandatario, purché siano specificati nel mandato.
ALLEGATO VII ESAME UE DEL TIPO
(Modulo B)
1. L'esame UE del tipo è la parte di una procedura di valutazione della conformità con cui un organismo notificato esamina il progetto tecnico della macchina o del prodotto correlato e verifica e attesta che il progetto tecnico di tale macchina o prodotto correlato rispetta i requisiti applicabili del presente regolamento.
2. L'esame UE del tipo deve prevedere la valutazione dell'adeguatezza del progetto tecnico della macchina o del prodotto correlato tramite esame della documentazione tecnica, nonché esame di un campione della macchina o del prodotto correlato, rappresentativo della produzione prevista (tipo di produzione).
3. Domanda di esame UE del tipo
Il fabbricante deve presentare una domanda di esame UE del tipo a un unico organismo notificato di sua scelta.
Tale domanda deve contenere:
a) il nome e l'indirizzo del fabbricante e, qualora la domanda sia presentata da un mandatario, anche il nome e l'indirizzo di quest'ultimo;
b) una dichiarazione scritta in cui si precisi che la medesima domanda non è stata presentata ad alcun altro organismo notificato;
c) la documentazione tecnica descritta nell'allegato IV, parte A;
d) l’accesso ai campioni della macchina o del prodotto correlato rappresentativi della produzione prevista. L’organismo notificato può chiedere altri campioni qualora siano necessari per eseguire il programma di prove. Per le macchine o i prodotti correlati fabbricati in serie in cui ciascun articolo è fabbricato per adattarsi a un singolo utilizzatore, i campioni forniti devono essere rappresentativi della gamma dei diversi utilizzatori, mentre per le macchine o i prodotti correlati fabbricati come unità singole, per soddisfare le esigenze specifiche di un singolo utilizzatore, deve essere fornito un modello di base.
4. Esame UE del tipo L’organismo notificato deve:
a) esaminare la documentazione tecnica per valutare l’adeguatezza del progetto tecnico della macchina o del prodotto correlato. Nel condurre tale esame, non è necessario prendere in considerazione l’allegato IV, parte A, secondo comma, lettere h) ed l);
b) per le macchine o i prodotti correlati fabbricati in serie in cui ciascun articolo è fabbricato per adattarsi a un singolo utilizzatore, esaminare la descrizione delle misure al fine di valutarne l'adeguatezza;
c) verificare che i campioni siano stati fabbricati in conformità della documentazione tecnica, nonché individuare gli elementi progettati conformemente alle disposizioni applicabili delle norme armonizzate pertinenti o alle specifiche comuni adottate dalla Commissione ai sensi dell'articolo 20, paragrafo 3, nonché gli elementi progettati conformemente ad altre specifiche tecniche;
d) effettuare o far effettuare esami e prove appropriati per controllare se, qualora il fabbricante abbia scelto di applicare le soluzioni di cui alle norme armonizzate pertinenti o alle specifiche comuni adottate dalla Commissione a norma dell'articolo 20, paragrafo 3, tali soluzioni siano state applicate correttamente;
e) effettuare o far effettuare esami e prove appropriate, per verificare se, laddove non siano state applicate le soluzioni di cui alle norme armonizzate pertinenti o alle specifiche tecniche adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, le soluzioni adottate dal fabbricante, comprese quelle applicate in linea con altre specifiche comuni, soddisfino i requisiti essenziali di sicurezza e di tutela della salute corrispondenti e siano state applicate correttamente.
5. Relazione di valutazione
L'organismo notificato deve redigere una relazione di valutazione che elenca le iniziative intraprese in conformità del punto 4 e i relativi risultati. Senza pregiudicare i propri obblighi di fronte alle autorità di notifica, l'organismo notificato deve rendere pubblico l'intero contenuto della relazione, o parte di esso, solo con l'accordo del fabbricante.
6. Certificato di esame UE del tipo
6.1. Se il tipo soddisfa i requisiti essenziali di sicurezza e di tutela della salute applicabili, l'organismo notificato deve rilasciare al fabbricante un certificato di esame UE del tipo.
Il periodo di validità di un certificato di nuova emissione e, se del caso, di un certificato rinnovato non deve essere superiore a cinque anni.
6.2. Il certificato di esame UE del tipo deve contenere almeno le informazioni seguenti:
a) il nome e il numero di identificazione dell'organismo notificato;
b) il nome e l'indirizzo del fabbricante e, qualora la domanda sia presentata da un mandatario, anche il nome e l'indirizzo di quest'ultimo;
c) un'identificazione della macchina o del prodotto correlato oggetto del certificato (numero di tipo);
d) una dichiarazione in cui si attesta che il tipo di macchina o prodotto correlato soddisfa i requisiti essenziali di sicurezza e di tutela della salute applicabili;
e) laddove le norme armonizzate o le specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, siano state applicate integralmente o parzialmente, i riferimenti di tali norme o specifiche comuni o di loro parti;
f) laddove siano state applicate altre specifiche tecniche, i riferimenti di tali specifiche tecniche;
g) la data di rilascio, la data di scadenza e, se del caso, la data o le date di rinnovo;
h) le eventuali condizioni connesse al rilascio del certificato.
6.3. Il certificato di esame UE del tipo può avere uno o più allegati.
6.4. Se il tipo non soddisfa i requisiti essenziali di sicurezza e di tutela della salute applicabili, l'organismo notificato deve rifiutare di rilasciare un certificato di esame UE del tipo e ne deve informare il richiedente, motivando dettagliatamente il suo rifiuto.
7. Riesame del certificato di esame UE del tipo
7.1. L'organismo notificato deve seguire l'evoluzione dello stato dell’arte generalmente riconosciuto e valutare se il tipo omologato non è più conforme ai requisiti essenziali di sicurezza e di tutela della salute applicabili, oltre a stabilire se tali modifiche richiedono ulteriore indagine. In caso affermativo l'organismo notificato ne deve informare il fabbricante.
7.2. Il fabbricante deve informare l'organismo notificato che detiene la documentazione tecnica relativa al certificato di esame UE del tipo di tutte le modifiche apportate al tipo omologato e di tutte le modifiche apportate alla documentazione tecnica che potrebbero incidere sulla conformità della macchina o del prodotto correlato rispetto ai requisiti essenziali di sicurezza e di tutela della salute applicabili o sulle condizioni di validità di tale certificato. Tali modifiche devono comportare un'ulteriore omologazione sotto forma di supplemento al certificato originario di esame UE del tipo.
7.3. Il fabbricante deve garantire che la macchina o il prodotto correlato continuino a soddisfare i requisiti essenziali di sicurezza e di tutela della salute applicabili alla luce dello stato dell’arte.
7.4. Il fabbricante deve chiedere all'organismo notificato di rivedere il certificato di esame UE del tipo:
a) in caso di una modifica del tipo omologato di cui al punto 7.2;
b) in caso di un'evoluzione dello stato dell’arte di cui al punto 7.3;
c) al più tardi, prima della data di scadenza del certificato.
Nel caso di cui alla lettera c), il riesame può comportare il rinnovo del certificato di esame UE del tipo solamente se la domanda è presentata dal fabbricante non più di 12 mesi e non meno di sei mesi prima della data di scadenza del certificato di esame UE del tipo. Se il fabbricante non rispetta tali scadenze, il riesame può comportare soltanto un'omologazione sotto forma di supplemento al certificato originario di esame UE del tipo e la data di scadenza del certificato sarà quella del certificato originario.
7.5. L'organismo notificato deve esaminare la macchina o il prodotto correlato e, se necessario alla luce delle modifiche apportate, eseguire le prove pertinenti per assicurare che il tipo omologato continui a soddisfare i requisiti essenziali di sicurezza e di tutela della salute applicabili. Se l'organismo notificato constata che il tipo omologato continua a soddisfare i requisiti essenziali di sicurezza e di tutela della salute applicabili, deve rinnovare il certificato di esame UE del tipo o rilasciare un supplemento al certificato originario di esame UE del tipo. L'organismo notificato deve garantire che la procedura di riesame sia conclusa prima della data di scadenza del certificato di esame UE del tipo.
7.6. Nel caso in cui non siano soddisfatte le condizioni di cui al punto 7.4, lettere a) e b), si deve applicare una procedura di riesame semplificata. Il fabbricante deve fornire all'organismo notificato quanto segue:
a) il proprio nome e indirizzo, nonché i dati identificativi dell'esame UE del tipo in questione;
b) la conferma del fatto che non sono state apportate modifiche al tipo omologato di cui al punto 7.2, compresi materiali, sottocomponenti o sottoinsiemi, né alle pertinenti norme armonizzate o specifiche comuni adottate dalla Commissione a norma dell'articolo 20, paragrafo 3 o ad altre specifiche tecniche applicate;
c) la conferma che non sia avvenuta alcuna evoluzione dello stato dell’arte di cui al punto 7.3; e
d) laddove non già fornite, copie dei disegni e delle fotografie del prodotto attuale, della marcatura del prodotto e delle informazioni sul prodotto.
Se l'organismo notificato ha confermato che non sono state apportate modifiche al tipo omologato di cui al punto 7.2 e che non è avvenuta alcuna evoluzione dello stato dell’arte di cui al punto 7.3, si deve applicare la procedura di riesame semplificata, e non devono essere effettuati gli esami e le prove di cui al punto 7.5. In tali casi l'organismo notificato deve rinnovare il certificato di esame UE del tipo.
I costi connessi a tale rinnovo devono essere proporzionati agli oneri amministrativi della procedura semplificata.
Se l'organismo notificato constata che è avvenuta un'evoluzione dello stato dell’arte di cui al punto 7.3, si deve applicare la procedura di cui al punto 7.5.
7.7. Se, in seguito al riesame, l'organismo notificato conclude che il certificato di esame UE del tipo non è più valido, lo deve revocare e il fabbricante deve cessare di immettere sul mercato la macchina o il prodotto correlato in questione.
8. Ogni organismo notificato deve informare le proprie autorità di notifica in merito ai certificati di esame UE del tipo e/o dei supplementi da esso rilasciati o ritirati e periodicamente, o su richiesta, deve rendere disponibile alle autorità notificanti l'elenco di tali certificati e/o supplementi respinti, sospesi o altrimenti sottoposti a restrizioni.
Ogni organismo notificato deve informare gli altri organismi notificati in merito ai certificati di esame UE del tipo e/o ai supplementi da esso respinti, ritirati, sospesi o altrimenti sottoposti a restrizioni e, su richiesta, informarli in merito ai certificati di esame UE del tipo e/o dei supplementi da esso rilasciati.
La Commissione, gli Stati membri e gli altri organismi notificati possono ottenere, su richiesta, una copia di certificati di esame UE del tipo e/o dei supplementi in relazione agli stessi. La Commissione e gli Stati membri possono ottenere, su richiesta, copia della documentazione tecnica e dei risultati degli esami effettuati dall'organismo notificato.
L'organismo notificato deve conservare una copia del certificato di esame UE del tipo, dei relativi allegati e supplementi, nonché il fascicolo tecnico contenente la documentazione presentata dal fabbricante, per un periodo di cinque anni dalla scadenza della validità di tale certificato.
9. Il fabbricante deve tenere a disposizione delle autorità nazionali una copia del certificato di esame UE del tipo, degli allegati e dei supplementi insieme alla documentazione tecnica per almeno 10 anni dalla data in cui la macchina o il prodotto correlato sono stati immessi sul mercato o messi in servizio.
10. Il mandatario del fabbricante può presentare la domanda di cui al punto 3 ed adempiere gli obblighi di cui ai punti 7.2, 7.4 e 9 purché siano specificati nel mandato.
ALLEGATO VIII
CONFORMITÀ AL TIPO BASATA SUL CONTROLLO INTERNO DELLA PRODUZIONE
(Modulo C)
1. La conformità al tipo basata sul controllo interno della produzione è la parte della procedura di valutazione della conformità con cui il fabbricante ottempera agli obblighi di cui ai punti 2 e 3 e garantisce e dichiara, sotto la sua esclusiva responsabilità, che la macchina o il prodotto correlato in questione è conforme al tipo descritto nel certificato di esame UE del tipo e soddisfa i requisiti applicabili del presente regolamento.
2. Fabbricazione
Il fabbricante deve adottare tutte le misure necessarie affinché il processo di fabbricazione e il suo controllo garantiscano la conformità della macchina o del prodotto correlato fabbricati rispetto al tipo descritto nel certificato di esame UE del tipo e ai requisiti applicabili del presente regolamento.
3. Marcatura CE e dichiarazione di conformità UE
3.1. Il fabbricante deve apporre la marcatura CE su tutte le macchine o i prodotti correlati conformi al tipo descritto nel certificato di esame UE del tipo e che soddisfano i requisiti applicabili del presente regolamento.
3.2. Il fabbricante deve compilare una dichiarazione di conformità UE per un modello di macchina o prodotto correlato e la deve tenere a disposizione delle autorità nazionali per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato o messo in servizio. La dichiarazione di conformità UE deve identificare la macchina o il prodotto correlato per il quale è stata compilata.
Una copia della dichiarazione di conformità UE deve essere messa a disposizione delle autorità competenti su richiesta.
4. Mandatario
Gli obblighi del fabbricante di cui al punto 3 possono essere adempiuti, per conto del fabbricante e sotto la sua responsabilità, dal suo mandatario, purché siano specificati nel mandato.
ALLEGATO IX
CONFORMITÀ BASATA SULLA GARANZIA QUALITÀ TOTALE
(Modulo H)
1. La conformità basata sulla garanzia qualità totale è la procedura di valutazione della conformità mediante la quale il fabbricante adempie gli obblighi di cui ai punti 2 e 5, e garantisce e dichiara, sotto la sua esclusiva responsabilità, che la macchina o il prodotto correlato in questione soddisfa i requisiti del presente regolamento ad esso applicabili.
2. Fabbricazione
Il fabbricante deve applicare un sistema qualità approvato per la progettazione, la fabbricazione, l'ispezione finale e il collaudo della macchina o del prodotto correlato in questione secondo quanto specificato al punto 3 e deve essere soggetto alla sorveglianza di cui al punto 4.
3. Sistema qualità
3.1. Il fabbricante deve presentare una domanda di valutazione del proprio sistema di qualità all'organismo notificato di sua scelta per la macchina o il prodotto correlato in questione.
Tale domanda deve contenere:
a) il nome e l'indirizzo del fabbricante e, qualora la domanda sia presentata da un mandatario, anche il nome e l'indirizzo di quest'ultimo;
b) la documentazione tecnica descritta nell’allegato IV, parte A, lettere da a) a g), da i) a k) e da m) a o), per un modello di ciascuna categoria di macchine o prodotti correlati che intende fabbricare.
c) la documentazione relativa al sistema qualità; e
d) una dichiarazione scritta che specifichi che la stessa domanda non è stata presentata a un altro organismo notificato.
3.2. Il sistema qualità deve garantire la conformità delle macchine e dei prodotti correlati ai requisiti del presente regolamento ad essi applicabili.
Tutti i criteri, i requisiti e le disposizioni adottati dal fabbricante devono essere documentati in modo sistematico e ordinato, sotto forma di disposizioni, procedure e istruzioni scritte. Tale documentazione relativa al sistema qualità deve consentire un'interpretazione coerente di programmi, schemi, manuali e rapporti riguardanti la qualità.
Tale documentazione deve contenere in particolare un'adeguata descrizione:
a) degli obiettivi di qualità, della struttura organizzativa e delle responsabilità e dei poteri di gestione relativi alla qualità della progettazione e alla qualità dei prodotti;
b) delle specificazioni tecniche di progettazione, norme incluse, che si intende applicare e, qualora non siano applicate integralmente le norme armonizzate o le specifiche comuni pertinenti adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, degli strumenti, incluse altre specifiche tecniche, che si intende utilizzare per garantire il rispetto dei requisiti essenziali di sicurezza e di tutela della salute del presente regolamento che si applicano alla macchina o al prodotto correlato;
c) delle tecniche, dei processi e degli interventi sistematici in materia di controllo e verifica della progettazione che si intende applicare nella progettazione della macchina o del prodotto correlato;
d) delle tecniche, dei processi e degli interventi sistematici che si intende applicare nella fabbricazione, nel controllo di qualità e nella garanzia della qualità;
e) dei controlli e delle prove che saranno effettuati prima, durante e dopo la fabbricazione, con l'indicazione della frequenza con cui si intende effettuarli;
f) della documentazione in materia di qualità, quali i rapporti ispettivi e i dati sulle prove, le tarature, le relazioni sulle qualifiche del personale interessato, ecc.;
g) dei mezzi di controllo delle modalità per ottenere la qualità di progettazione e la qualità del prodotto richieste e dell'efficace funzionamento del sistema qualità.
3.3. L'organismo notificato deve valutare il sistema qualità per determinare se soddisfa i requisiti di cui al punto 3.2.
L'organismo deve presumere la conformità a tali requisiti degli elementi del sistema qualità conformi alle specifiche corrispondenti della norma armonizzata pertinente.
Oltre ad avere esperienza nei sistemi di gestione della qualità, almeno un membro del gruppo incaricato della verifica deve avere esperienza nella valutazione del settore e della tecnologia della macchina o del prodotto correlato in questione e conoscere i requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato
III. La verifica deve comprendere una visita valutativa presso i locali del fabbricante. Il gruppo incaricato della verifica deve esaminare la documentazione tecnica di cui al punto 3.1, lettera b), per verificare la capacità del fabbricante di individuare i requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III e di effettuare gli esami necessari per garantire la conformità della macchina o del prodotto correlato rispetto a tali requisiti.
La decisione deve essere notificata al fabbricante o al suo mandatario.
La notifica deve contenere le conclusioni della verifica e la decisione con motivazione circostanziata.
3.4. Il fabbricante si deve impegnare a soddisfare gli obblighi derivanti dal sistema qualità approvato e a fare in modo che esso rimanga adeguato ed efficace.
3.5. Il fabbricante deve tenere informato l'organismo notificato che ha approvato il sistema qualità di qualsiasi modifica prevista di tale sistema.
L'organismo notificato deve valutare le modifiche proposte e decidere se il sistema qualità modificato continua a soddisfare i requisiti di cui al punto 3.2 o se è necessaria una nuova valutazione.
L'organismo notificato deve notificare la propria decisione al fabbricante. Tale notifica deve contenere le conclusioni dell'esame e la decisione con motivazione circostanziata.
4. Sorveglianza sotto la responsabilità dell'organismo notificato
4.1. La sorveglianza deve garantire che il fabbricante adempia tutti gli obblighi derivanti dal sistema qualità approvato.
4.2. Il fabbricante deve consentire all'organismo notificato di accedere, a fini ispettivi, ai locali di progettazione, fabbricazione, ispezione, prova e deposito e gli deve fornire tutte le informazioni necessarie, in particolare:
a) la documentazione relativa al sistema qualità;
b) la documentazione prevista nella parte del sistema qualità riservata alla progettazione, quali risultati di analisi, calcoli, prove, ecc.;
c) la documentazione prevista al punto "Fabbricazione" del sistema qualità, quali i rapporti ispettivi e i dati sulle prove, le tarature, le relazioni sulle qualifiche del personale coinvolto, ecc.
4.3. L'organismo notificato deve svolgere periodicamente verifiche ispettive per assicurarsi che il fabbricante mantenga e utilizzi il sistema qualità; esso deve fornire al fabbricante una relazione sulle verifiche effettuate.
4.4. L'organismo notificato può inoltre effettuare visite senza preavviso presso il fabbricante. Nel corso di tali visite, l'organismo notificato può, se necessario, svolgere o far svolgere prove sul prodotto, per verificare il corretto funzionamento del sistema qualità. Detto organismo deve trasmettere al fabbricante una relazione sulla visita e, se sono state effettuate prove, una relazione sulle medesime.
5. Marcatura CE e dichiarazione di conformità UE
5.1. Il fabbricante deve apporre a ciascun prodotto che risulti conforme ai requisiti applicabili del presente regolamento la necessaria marcatura CE quale stabilita nel presente regolamento e, sotto la responsabilità dell'organismo notificato di cui al punto 3.1, il numero di identificazione di quest'ultimo.
5.2. Il fabbricante deve compilare una dichiarazione scritta di conformità UE per ciascuna unità del modello di macchina o prodotto correlato e la deve tenere a disposizione delle autorità nazionali per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato o messo in servizio. La dichiarazione di conformità UE deve identificare il modello di macchina o prodotto correlato per cui è stata compilata.
Una copia della dichiarazione di conformità UE deve essere messa a disposizione delle autorità pertinenti su richiesta.
6. Per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato o messo in servizio, il fabbricante deve tenere a disposizione delle autorità nazionali:
a) la documentazione tecnica di cui al punto 3.1, lettera b);
b) la documentazione relativa al sistema qualità di cui al punto 3.1, lettera c);
c) le informazioni riguardanti le modifiche di cui al punto 3.5 e la relativa approvazione;
d) le decisioni e le relazioni dell'organismo notificato di cui ai punti 3.5, 4.3 e 4.4.
7. Ciascun organismo notificato deve informare la propria autorità di notifica circa le decisioni di approvazione dei sistemi qualità rilasciate o ritirate e, periodicamente o su richiesta, deve mettere a disposizione di tale autorità l'elenco delle decisioni di approvazione del sistema qualità da esso rifiutate, sospese o altrimenti limitate.
Ciascun organismo notificato deve informare gli altri organismi notificati delle decisioni di approvazione del sistema qualità da esso rifiutate, sospese o ritirate e, su richiesta, delle decisioni di approvazione del sistema qualità da esso rilasciate.
8. Mandatario
Gli obblighi del fabbricante di cui ai punti 3.1, 3.5, 5 e 6 possono essere adempiuti, per conto del fabbricante e sotto la sua responsabilità, dal suo mandatario, purché siano specificati nel mandato.
ALLEGATO X
CONFORMITÀ BASATA SULLA VERIFICA DELL'UNITÀ
(Modulo G)
1. La conformità basata sulla verifica dell'unità è la procedura di valutazione della conformità mediante la quale il fabbricante adempie gli obblighi definiti ai punti 2, 3 e 5, e garantisce e dichiara, sotto la sua esclusiva responsabilità, che la macchina o il prodotto correlato, oggetto del punto 4, è conforme ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
2. Documentazione tecnica
Il fabbricante deve compilare la documentazione tecnica e metterla a disposizione dell'organismo notificato di cui al punto 4. La documentazione deve consentire di valutare la conformità della macchina o del prodotto correlato ai pertinenti requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III e deve comprendere un'analisi e una valutazione adeguate dei rischi. La documentazione tecnica deve precisare i requisiti essenziali di sicurezza e di tutela della salute applicabili e comprendere, nella misura necessaria ai fini della valutazione, la progettazione, la fabbricazione e il funzionamento della macchina o del prodotto correlato.
La documentazione tecnica deve contenere, laddove applicabile, almeno gli elementi seguenti:
a) il nome e l'indirizzo del fabbricante e, qualora la domanda sia presentata da un mandatario, anche il nome e l'indirizzo di quest'ultimo;
b) la documentazione tecnica per l'unità di macchina o prodotto correlato che si intende fabbricare.
Inoltre, la documentazione tecnica deve contenere, laddove applicabile, almeno:
i) gli elementi di cui all'allegato IV, parte A, lettere da a) a g);
ii) la documentazione relativa al sistema qualità; e
iii) una dichiarazione scritta che specifichi che la stessa domanda non è stata presentata a un altro organismo notificato.
2.1. Il fabbricante deve tenere la documentazione tecnica a disposizione delle autorità nazionali competenti per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato.
3. Fabbricazione
Il fabbricante deve adottare tutte le misure necessarie affinché il processo di fabbricazione e il suo controllo garantiscano la conformità della macchina o del prodotto correlato fabbricati rispetto ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III.
4. Verifica
L'organismo notificato scelto dal fabbricante deve effettuare o far effettuare gli esami e le prove del caso, stabiliti dalle pertinenti norme armonizzate e/o specifiche comuni, o prove equivalenti, per verificare la conformità della macchina o del prodotto correlato ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III. In assenza di tali norme armonizzate e/o specifiche comuni, l'organismo notificato deve decidere quali prove sia opportuno effettuare.
L'organismo notificato deve rilasciare un certificato relativo agli esami e alle prove effettuati e apporre, o far apporre sotto la propria responsabilità, il proprio numero di identificazione sulla macchina o sul prodotto correlato approvati.
Il fabbricante deve tenere i certificati a disposizione delle autorità nazionali per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato.
5. Marcatura CE e dichiarazione di conformità UE
5.1. Il fabbricante deve apporre la necessaria marcatura CE di cui all'articolo 10, paragrafo 2, e, sotto la responsabilità dell'organismo notificato di cui al punto 4, il numero di identificazione di tale organismo, a ciascuna macchina o ciascun prodotto correlato che risulti conforme ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III.
5.2. Il fabbricante deve compilare una dichiarazione scritta di conformità UE e la deve tenere a disposizione delle autorità nazionali per almeno 10 anni dalla data in cui la macchina o il prodotto correlato è stato immesso sul mercato o messo in servizio. La dichiarazione di conformità UE deve identificare la macchina o il prodotto correlato per il quale è stata compilata.
Una copia di tale dichiarazione UE deve essere messa a disposizione delle autorità pertinenti su richiesta.
6. Mandatario
Gli obblighi del fabbricante di cui ai punti 2.1 e 5 possono essere adempiuti da un mandatario, che agisce per conto del fabbricante e sotto la sua responsabilità, purché tali obblighi siano specificati nel mandato.
ALLEGATO XI
ISTRUZIONI PER L'ASSEMBLAGGIO DELLE QUASI-MACCHINE
1. Le istruzioni per l'assemblaggio delle quasi-macchine devono contenere una descrizione delle condizioni da soddisfare per assicurare che le quasi-macchine vengano incorporate correttamente nelle macchine o in altre quasi-macchine o apparecchi e che le macchine o le altre quasi-macchine o apparecchi con le quasi- macchine incorporate non compromettano la salute e la sicurezza delle persone e, ove opportuno, degli animali domestici nonché la tutela dei beni e se del caso, dell'ambiente.
2. Le istruzioni per l'assemblaggio devono contenere le informazioni pertinenti da utilizzare nelle istruzioni della macchina o di altre quasi-macchine o apparecchi in cui tale quasi-macchina sarà incorporata. Ciascuna istruzione per l'assemblaggio deve contenere, se del caso, almeno le informazioni seguenti:
a) una descrizione generale della quasi-macchina;
b) i disegni, i diagrammi, le descrizioni e le spiegazioni necessari per l'incorporazione nella macchina finale, la manutenzione e la riparazione della quasi-macchina e per verificarne il corretto funzionamento;
c) le avvertenze concernenti i modi in cui la quasi-macchina non deve essere usata e che potrebbero, in base all'esperienza, presentarsi;
d) le istruzioni per il montaggio, l'installazione e il collegamento, inclusi i disegni e i diagrammi e i sistemi di fissaggio e la designazione del telaio o dell'installazione su cui la quasi-macchina deve essere montata;
e) informazioni relative al rumore o alle vibrazioni che possono essere ridotti dall'incorporazione;
f) informazioni sui requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III applicabili alla quasi-macchina;
g) le caratteristiche essenziali degli utensili che possono essere montati sulla quasi-macchina;
h) le condizioni in cui la quasi-macchina soddisfa i requisiti di stabilità, trasporto, montaggio e smontaggio, in condizioni di fuori servizio, durante le prove o le avarie prevedibili;
i) le istruzioni per effettuare in condizioni di sicurezza le operazioni di trasporto, movimentazione e stoccaggio, indicanti la massa della quasi- macchina e dei suoi vari elementi allorché devono essere regolarmente trasportati separatamente;
j) il metodo operativo da rispettare in caso di infortunio o avaria; se si può verificare un blocco, il metodo operativo da rispettare per permettere di sbloccare la macchina in condizioni di sicurezza;
k) la descrizione delle operazioni di regolazione e manutenzione che devono essere effettuate dall'utilizzatore nonché le misure di manutenzione preventiva da rispettare tenendo conto della progettazione;
l) le istruzioni per effettuare in condizioni di sicurezza la regolazione e la manutenzione, incluse le misure di protezione che dovrebbero essere adottate durante tali operazioni;
m) le specifiche dei pezzi di ricambio da utilizzare, se incidono sulla salute e la sicurezza degli operatori;
n) una descrizione chiara della versione delle istruzioni per l'assemblaggio corrispondente al modello di quasi-macchina.
Se la quasi-macchina è destinata ad essere utilizzata in una macchina di cui ai capi da 2 a 6 dell'allegato III, le istruzioni per l'assemblaggio devono contenere anche le informazioni pertinenti da includere nelle istruzioni per l'uso di tale macchina.
3. Le istruzioni per l'assemblaggio delle quasi-macchine devono contenere la dichiarazione di incorporazione UE, oppure l'indirizzo internet o il codice ottico dove è possibile accedere alla dichiarazione di incorporazione UE.
ALLEGATO XII
TAVOLA DI CONCORDANZA
|
Presente regolamento |
|
|
Articolo 1 |
Articolo 2 |
|
Articolo 2 |
Articolo 3 |
|
Articolo 3 |
Articolo 9 |
|
Articolo 4, paragrafi 1 e 2 |
Articolo 8 |
|
Articolo 4, paragrafi 3 e 4 |
- |
|
Articolo 5 |
Articoli 10 e 11 |
|
Articolo 6 |
Articolo 4 |
|
Articolo 7 |
Articolo 20, paragrafo 1 |
|
Articolo 8, paragrafo 1 |
Articoli 6 paragrafo 1, e 7, paragrafo 1 |
|
Articolo 8, paragrafo 2 |
- |
|
Articolo 9 |
- |
|
Articolo 10 |
Articolo 44, paragrafo 3 |
| Articolo 11 | Articoli 43, 44 e 45 |
| Articolo 12 | Articolo 25 |
| Articolo 13 | Articolo 11 |
| Articolo 14 (e allegato XI) | Dall'articolo 26 all'articolo 42 |
| Articolo 15 | Articolo 5 |
| Articolo 16 | Articoli 23 e 24 |
| Articolo 17 | Articolo 46 |
| Articolo 18 | Articolo 49 |
| Articolo 19 | -- |
| Articolo 20 | -- |
| Articolo 21 | Articolo 53 |
| Articolo 21 bis | Articolo 47 |
| Articolo 22 | Articolo 48 |
| Articolo 23 | Articolo 50 |
| Articolo 24 | - |
| Articolo 25 | Articolo 51 |
| Articolo 26 | -- |
| Articolo 27 | -- |
| Articolo 28 | Articolo 54 (primo comma) |
| Articolo 29 | Articolo 54 (secondo e terzo comma) |
| Allegato I - Principi generali e punto 1.1.1 (Definizioni) | Allegato III - parte A (Definizioni) e parte B (Principi generali) |
| Allegato I, punti 1.1.2 - 1.1.8 | Allegato III, capo 1 |
| Allegato I, punto 2 | Allegato III, capo 2 |
| Allegato I, punto 3 | Allegato III, capo 3 |
| Allegato I, punto 4 | Allegato III, capo 4 |
| Allegato I, punto 5 | Allegato III, capo 5 |
| Allegato I, punto 6 | Allegato III, capo 6 |
| Allegato II, parti A e B | Allegato V, parti A e B |
| Allegato III | -- |
| Allegato IV | Allegato I |
| Allegato V | Allegato II |
| Allegato VI | Allegato XI |
| Allegato VII, parti A e B | Allegato IV, parti A e B |
| Allegato VIII, letto in combinato disposto con l'articolo 12, paragrafo 3, lettera a) | Allegato VI |
| Allegato VIII (punto 3), letto in combinato disposto con l'articolo 12, paragrafo 3, lettera b) | Allegato VIII |
| Allegato IX | Allegato VII |
| Allegato X | Allegato IX |
| Allegato XI | Articolo 30 |
Collegati
[box-note]Regolamento macchine: i Requisiti Essenziali di sicurezza e salute RESS
Procedure di Valutazione della Conformità Regolamento macchine
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Proposal for a Regulation on machinery products
Proposta regolamento macchine - Lettera al presidente Commissione IMCO 25.01.2023
Status fasi Regolamento macchine
Report CE Regulation on Machinery Products - 18.11.2021
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020
https://www.cem4.eu/[/box-note]
Regolamento (UE) 2023/826
Regolamento (UE) 2023/826 / Specifiche di progettazione ecocompatibile consumo di energia stand-by
ID 19436 | 18.04.2023
Regolamento (UE) 2023/826 della Commissione del 17 aprile 2023 che stabilisce le specifiche di progettazione ecocompatibile per il consumo di energia nei modi spento, stand-by e stand-by in rete delle apparecchiature elettriche ed elettroniche domestiche e da ufficio in applicazione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio e abroga i regolamenti della Commissione (CE) n. 1275/2008 e (CE) n. 107/2009
GU L 103/29 del 18.4.2023
Entrata in vigore: 08.05.2023
Applicazione: A decorrere dal 9 maggio 2025. Tuttavia, l’articolo 6, primo comma, si applica a partire dall'8 maggio 2023.
[box-warning]Il regolamento (CE) n. 1275/2008 è abrogato con effetto dal 9 maggio 2025.
Il regolamento (CE) n. 107/2009 è abrogato con effetto dal 9 maggio 2025.[/box-warning]
Modifiche:
- Regolamento (UE) 2023/2533 della Commissione, del 17 novembre 2023, recante modalità di esecuzione della direttiva 2009/125/CE del Parlamento europeo e del Consiglio in merito alle specifiche per la progettazione ecocompatibile delle asciugabiancheria per uso domestico, e che modifica il regolamento (UE) 2023/826 della Commissione e abroga il regolamento (UE) n. 932/2012 della Commissione. (GU L 2023/2533 del 22.11.2023)
_______
Articolo 1 Oggetto
Il presente regolamento stabilisce le specifiche di progettazione ecocompatibile in relazione al consumo di energia nei modi spento, stand-by e stand-by in rete ai fini dell’immissione sul mercato o della messa in servizio delle apparecchiature elettriche ed elettroniche domestiche e da ufficio.
[...]
Aticolo 3 Specifiche di progettazione ecocompatibile
Le specifiche di progettazione ecocompatibile sono fissate nell’allegato III.
Articolo 4 Valutazione di conformità
1. La procedura di valutazione della conformità di cui all’articolo 8 della direttiva 2009/125/CE costituisce il sistema per il controllo interno della progettazione di cui all’allegato IV della medesima direttiva o il sistema di gestione di cui all’allegato V della medesima direttiva.
2. Ai fini della valutazione della conformità di cui all’articolo 8 della direttiva 2009/125/CE, la documentazione tecnica contiene le informazioni di cui all’allegato III, punto 3, lettera b), del presente regolamento, nonché i dettagli e i risultati dei calcoli effettuati conformemente all’allegato IV del presente regolamento.
3. Se le informazioni incluse nella documentazione tecnica per un particolare modello sono state ottenute:
a) da un modello che ha le medesime caratteristiche tecniche rilevanti per quanto riguarda le informazioni tecniche da fornire a norma dell’allegato III del presente regolamento, ma è prodotto da un altro fabbricante, oppure
b) dai calcoli effettuati in base al progetto, per estrapolazione da un altro modello dello stesso o di un altro fabbricante, o con entrambi i metodi,
la documentazione tecnica del modello contiene i dettagli e i risultati di tali calcoli o estrapolazioni, la valutazione effettuata dal fabbricante per verificare l’accuratezza dei calcoli e, se del caso, la dichiarazione dell’identità tra i modelli di fabbricanti diversi.
La documentazione tecnica comprende un elenco dei modelli equivalenti di cui al primo e secondo comma, compresi gli identificativi del modello.
4. La documentazione tecnica comprende le informazioni di cui al punto 3, lettera a), dell’allegato III del presente regolamento.
Articolo 5 Procedura di verifica a fini di sorveglianza del mercato
Quando effettuano le verifiche a fini di sorveglianza del mercato di cui all’articolo 3, paragrafo 2, della direttiva 2009/125/CE, le autorità degli Stati membri applicano la procedura di verifica di cui all’allegato V del presente regolamento.
Articolo 6 Elusione e aggiornamenti del software
Il fabbricante, l’importatore o il mandatario non immette sul mercato apparecchiature progettate per essere in grado di rilevare il fatto di essere sottoposte a prova, ad esempio riconoscendo le condizioni o il ciclo di prova, e reagire specificamente alterando automaticamente le loro prestazioni durante la prova per raggiungere un livello più favorevole per qualsiasi parametro riportato nella documentazione tecnica o in qualsiasi altra documentazione fornita.
Il consumo energetico dell’apparecchiatura e ciascuno degli altri parametri dichiarati non peggiorano in seguito a un aggiornamento del software o del firmware se misurati secondo lo stesso metodo di prova originariamente utilizzato per la dichiarazione di conformità, salvo con il consenso esplicito dell’utilizzatore finale prima dell’aggiornamento. Se l’aggiornamento non è accettato le prestazioni non risultano in alcun modo modificate.
L’aggiornamento del software non determina una modifica delle prestazioni dell’apparecchiatura che lo renda non conforme alle specifiche di progettazione ecocompatibile applicabili a fini della dichiarazione di conformità.
Articolo 7 Parametri di riferimento indicativi
I parametri di riferimento indicativi per le apparecchiature e le tecnologie più efficienti disponibili sul mercato al momento dell’adozione del presente regolamento figurano nell’allegato VI.
Articolo 8 Riesame
La Commissione riesamina il presente regolamento alla luce del progresso tecnologico e presenta i relativi risultati al forum consultivo entro il 9 maggio 2027.
Il riesame valuta in particolare l’opportunità:
a) delle specifiche per i modi stand-by, spento e stand-by in rete;
b) delle specifiche per lo stand-by in rete per gli apparecchi HiNA (High Network Availability) e gli apparecchi con funzionalità HiNA e la loro distinzione rispetto agli apparecchi non HiNA;
c) di includere nell’ambito di applicazione del presente regolamento altri gruppi di prodotti pertinenti, compresi i prodotti utilizzati nel settore dei servizi;
d) di stabilire specifiche per il modo di manutenzione della batteria dei caricabatterie.
Articolo 9 Abrogazione
Il regolamento (CE) n. 1275/2008 è abrogato con effetto dal 9 maggio 2025.
Il regolamento (CE) n. 107/2009 è abrogato con effetto dal 9 maggio 2025.
Articolo 10 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 9 maggio 2025. Tuttavia, l’articolo 6, primo comma, si applica a partire dall’entrata in vigore del regolamento.
...
Collegati
[box-note]Direttiva 2009/125/CE - ERP[/box-note]
Dichiarazione di conformità UE macchine e prodotti correlati / Regolamento macchine 2023
Dichiarazione di conformità UE di macchine e prodotti correlati / Nuovo Regolamento macchine / Rev. 3.0 Luglio 2023
ID 19423 | Rev. 3.0 del 04.07.2023 / In allegato documento completo
Il presente documento illustra i novelli contenuti della dichiarazione di conformità UE relativa a macchine prodotti correlati di cui al Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
Inoltre, a titolo illustrativo, viene proposta una tavola raffronto inerente la dichiarazione di conformità UE, così strutturata:
- in colonna (1) contenuti dell’Allegato II Parte A della Direttiva 2006/42/CE
- in colonna (2) contenuti dell’Allegato V Parte A Regolamento (UE) 2023/1230
Il regolamento diventerà applicabile dal 20 gennaio 2027
[box-note]Update Rev. 3.0 del 04.07.2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-note]
[box-note]Update Rev. 2.0 del 03.07.2023
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU n. 165/1 del 29.06.2023). Entrata in vigore: 19.07.2023[/box-note]
Vedi Modello Dichiarazione di conformità (UE)
[panel]Regolamento (UE) 2023/1230
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CEabrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 19 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 53 Valutazione e riesame
1. Entro il 20 luglio 2028 e, successivamente, ogni quattro anni, la Commissione presenta una relazione sulla valutazione e sul riesame del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
2. Tenendo conto del progresso tecnico e dell'esperienza pratica acquisita negli Stati membri come specificato all'articolo 6, la Commissione include nella relazione una valutazione dei aspetti seguenti del presente regolamento:
a) i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) la procedura di valutazione della conformità applicabile alle macchine o ai prodotti correlati elencati nell’allegato I.
Se del caso, la relazione è corredata di una proposta legislativa di modifica delle pertinenti disposizioni del presente regolamento.
3. Entro il 20 luglio 2026 e, successivamente, ogni cinque anni, la Commissione presenta una relazione specifica sulla valutazione dell'articolo 6, paragrafi 4 e 5, del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
La Commissione include nelle sue relazioni gli elementi seguenti:
a) una sintesi dei dati e delle informazioni forniti dagli Stati membri a norma dell'articolo 6, paragrafo 5, durante il periodo di riferimento;
b) una valutazione dell'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I alla luce dei criteri di cui all'articolo 6, paragrafo 4.
Nelle relazioni la Commissione valuta l'adeguatezza e la disponibilità dei dati e delle informazioni forniti dagli Stati membri, comprese la loro adeguatezza e idoneità al fine di effettuare confronti, individuando eventuali carenze onde garantire il funzionamento efficace e l'applicazione dell'articolo 6.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 20 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2023;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.[/panel]
…
La dichiarazione di conformità UE attesta che la conformità ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III del Nuovo Regolamento Macchine è stata dimostrata.
La dichiarazione di conformità UE ha la struttura tipo di cui alla Parte A dell'allegato V, contiene gli elementi specificati nei moduli pertinenti di cui agli allegati VI, VIII, IX e X (nuovo modulo G - verifica delle unità) ed è continuamente aggiornata. È tradotta nella lingua o nelle lingue richieste dallo Stato membro sul cui mercato il prodotto macchina è immesso o messo a disposizione o messo in servizio.
Se alla macchina e i prodotti correlati si applicano più atti dell'Unione che prescrivono una dichiarazione di conformità UE, viene compilata un'unica dichiarazione di conformità UE in relazione a tali atti dell'Unione. Tale dichiarazione contiene gli estremi degli atti dell'Unione in questione, compresi i riferimenti della loro pubblicazione.
Con la dichiarazione di conformità UE, il fabbricante si assume la responsabilità della conformità della macchina o dei prodotti correlati ai requisiti stabiliti dal presente regolamento.
[box-note]Regolamento (UE) 2023/1230
Articolo 21 Dichiarazione di conformità UE per le macchine e i prodotti correlati
1. La dichiarazione di conformità UE attesta che la conformità ai requisiti essenziali di sicurezza e di tutela della salute applicabili di cui all'allegato III è stata dimostrata.
2. La dichiarazione di conformità UE ha la struttura tipo di cui all'allegato V, parte A, e contiene gli elementi specificati nei moduli pertinenti di cui agli allegati VI, VIII, IX e X. È continuamente aggiornata ed è tradotta nella lingua o nelle lingue richieste dallo Stato membro sul cui mercato la macchina o il prodotto correlato sono immessi, messi a disposizione o messi in servizi.[/box-note]
[box-warning]Distinzione tra:
- macchine e
- prodotti correlati (attrezzature intercambiabili, componenti di sicurezza, accessori di sollevamento, catene, funi e cinghie, dispositivi amovibili di trasmissione meccanica).[/box-warning]
Articolo 2 Ambito di applicazione
1. Il presente regolamento si applica alle macchine e ai prodotti correlati seguenti:
a) attrezzature intercambiabili;
b) componenti di sicurezza;
c) accessori di sollevamento;
d) catene, funi e cinghie;
e) dispositivi amovibili di trasmissione meccanica.
Il presente regolamento si applica altresì alle quasi-macchine.
Ai fini del presente regolamento, le macchine, i prodotti correlati elencati nel primo comma e le quasi-macchine sono indicati come "prodotti rientranti nell'ambito di applicazione del presente regolamento".
2. Il presente regolamento non si applica a quanto segue:
a) i componenti di sicurezza destinati ad essere utilizzati come pezzi di ricambio in sostituzione di componenti identici e forniti dal fabbricante della macchina originaria, del prodotto correlato o della quasi-macchina;
b) le attrezzature specifiche per parchi giochi o di divertimento;
c) le macchine e i prodotti correlati specificamente progettati per essere utilizzati o che sono utilizzati all'interno di un impianto nucleare e la cui conformità al presente regolamento può compromettere la sicurezza nucleare dell'impianto in questione;
d) le armi, incluse le armi da fuoco;
e) i mezzi di trasporto per via aerea, per via navigabile o su rete ferroviaria, fatta eccezione per le macchine installate su tali mezzi di trasporto;
f) i prodotti aeronautici, le parti e gli equipaggiamenti che rientrano nell'ambito di applicazione del regolamento (UE) 2018/1139 del Parlamento europeo e del Consiglio e nella definizione di macchine ai sensi del presente regolamento, nella misura in cui il regolamento (UE) 2018/1139 disciplina i pertinenti requisiti essenziali di sicurezza e di tutela della salute stabiliti nel presente regolamento;
g) i veicoli a motore e i relativi rimorchi, nonché i sistemi, i componenti, le unità tecniche separate, le parti e le attrezzature progettate e costruite per tali veicoli, che rientrano nell'ambito di applicazione del regolamento (UE) 2018/858, fatta eccezione per le macchine installate su tali veicoli;
h) i veicoli a due o tre ruote e i quadricicli, nonché i sistemi, i componenti, le entità tecniche indipendenti, le parti e gli equipaggiamenti progettati e costruiti per tali veicoli, che rientrano nell'ambito di applicazione del regolamento (UE) n. 168/2013, fatta eccezione per le macchine installate su tali veicoli;
i) i trattori agricoli e forestali, nonché i sistemi, i componenti, le entità tecniche indipendenti, le parti e gli equipaggiamenti progettati e costruiti per tali trattori, che rientrano nell'ambito di applicazione del regolamento (UE) n. 167/2013, fatta eccezione per le macchine installate su tali trattori;
j) i veicoli a motore esclusivamente da competizione;
k) le navi marittime e le unità mobili off-shore, nonché le macchine installate a bordo di tali navi o unità;
l) le macchine o i prodotti correlati appositamente progettati e costruiti a fini militari o di mantenimento dell'ordine pubblico;
m) le macchine o i prodotti correlati appositamente progettati e costruiti a fini di ricerca per essere temporaneamente utilizzati nei laboratori;
n) gli ascensori utilizzati nei pozzi delle miniere;
o) le macchine o i prodotti correlati adibiti allo spostamento di artisti durante le rappresentazioni;
p) i seguenti prodotti elettrici ed elettronici, nella misura in cui rientrano nell'ambito della direttiva 2014/35/UE o della direttiva 2014/53/UE:
i) elettrodomestici destinati a uso domestico che non sono mobili azionati elettricamente;
ii) apparecchiature audio e video;
iii) apparecchiature nel settore delle tecnologie dell'informazione;
iv) macchine ordinarie da ufficio, fatta eccezione per le macchine per la stampa additiva per realizzare prodotti tridimensionali;
v) apparecchiature di collegamento e di controllo a bassa tensione;
vi) motori elettrici;
q) i prodotti elettrici ad alta tensione seguenti:
i) apparecchiature di collegamento e di controllo;
ii) trasformatori.
Articolo 3 Definizioni
Ai fini del presente regolamento si applicano le definizioni seguenti:
1) "macchina":
a) insieme equipaggiato o destinato a essere equipaggiato di un sistema di azionamento diverso dalla forza umana o animale diretta, composto di parti o di componenti, di cui almeno uno mobile, collegati tra loro solidamente per un'applicazione ben determinata;
b) insieme di cui alla lettera a), al quale mancano solamente elementi di collegamento al sito di impiego o di allacciamento alle fonti di energia e di movimento;
c) insieme di cui alle lettere a) e b), pronto per essere installato e che può funzionare solo dopo essere stato montato su un mezzo di trasporto o installato in un edificio o in una costruzione;
d) insiemi di macchine di cui alle lettere a), b) e c) o di quasi-macchine, che per raggiungere uno stesso risultato sono disposti e comandati in modo da avere un funzionamento solidale;
e) insieme di parti o di componenti, di cui almeno uno mobile, collegati tra loro solidalmente e destinati al sollevamento di pesi e la cui unica fonte di energia è la forza umana diretta;
f) insieme di cui alle lettere da a) ad e) al quale manca soltanto il caricamento del software destinato all'applicazione specifica prevista dal fabbricante;
2) "attrezzatura intercambiabile": dispositivo che, dopo la messa in servizio di una macchina o di un trattore agricolo o forestale, è assemblato a tale macchina o a tale trattore agricolo o forestale dall'operatore al fine di modificarne la funzione o apportarne una nuova funzione, a condizione che tale attrezzatura non sia un utensile;
3) "componente di sicurezza": un componente fisico o digitale, compreso un software, di un prodotto rientrante nell'ambito di applicazione del presente regolamento, che è progettato o destinato ad espletare una funzione di sicurezza e che è immesso sul mercato separatamente, il cui guasto o malfunzionamento mette a repentaglio la sicurezza delle persone, ma che non è indispensabile per il funzionamento di tale prodotto, o per il quale componenti normali possono essere sostituiti per il funzionamento di tale prodotto;
4) "funzione di sicurezza": una funzione che serve a soddisfare una misura di protezione destinata a eliminare o, se ciò non è possibile, a ridurre un rischio, e che, se ha un guasto potrebbe comportare un aumento di tale rischio;
5) "accessori di sollevamento": componenti o attrezzature, non collegati alle macchine per il sollevamento, che consentono la presa del carico, disposti tra la macchina e il carico oppure sul carico stesso, oppure destinati a divenire parte integrante del carico e ad essere immessi sul mercato separatamente, comprese imbracature e loro componenti;
6) "catene": catene progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
7) "funi": funi progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
8) "cinghie": cinghie progettate e costruite a fini di sollevamento come parte integrante di macchine per il sollevamento o di accessori di sollevamento;
9) "dispositivo amovibile di trasmissione meccanica": componente amovibile destinato alla trasmissione di potenza tra macchine semoventi o un trattore e altre macchine o prodotti correlati, mediante collegamento al primo supporto fisso; quando è immesso sul mercato munito di riparo, il dispositivo e il riparo vanno considerati come un unico articolo;
10) "quasi-macchine": un insieme che non costituisce ancora una macchina in quanto, da solo, non è in grado di eseguire un'applicazione specifica e che è soltanto destinato a essere incorporato o assemblato ad altre macchine o ad altre quasi-macchine o apparecchi per costituire una macchina;
11) "messa a disposizione sul mercato": la fornitura di un prodotto rientrante nell'ambito di applicazione del presente regolamento affinché sia distribuito o usato sul mercato dell'Unione nel corso di un'attività commerciale, a titolo oneroso o gratuito;
12) "immissione sul mercato": la prima messa a disposizione di un prodotto rientrante nell'ambito di applicazione del presente regolamento sul mercato dell'Unione;
13) "messa in servizio": il primo utilizzo, conforme alla sua destinazione, di macchine o di prodotti correlati nell'Unione;
14) "requisiti essenziali di sicurezza e di tutela della salute": le disposizioni obbligatorie, di cui all'allegato III, relative alla progettazione e alla costruzione di prodotti rientranti nell'ambito di applicazione del presente regolamento, intese ad assicurare un livello elevato di tutela della salute e di sicurezza delle persone e, ove opportuno, degli animali domestici nonché di tutela dei beni e, se del caso, dell'ambiente.
15) "normativa di armonizzazione dell'Unione": la normativa dell'Unione che armonizza le condizioni di commercializzazione dei prodotti;
16) "modifica sostanziale": una modifica di una macchina o di un prodotto correlato, mediante mezzi fisici o digitali dopo che tale macchina o prodotto correlato è stato immesso sul mercato o messo in servizio, che non è prevista né pianificata dal fabbricante, e che incide sulla sicurezza della macchina o del prodotto correlato creando un nuovo pericolo o aumentando un rischio esistente, che richiede:
a) l'aggiunta di ripari o di dispositivi di protezione alla macchina o al prodotto correlato, operazione che necessita la modifica del sistema di controllo della sicurezza esistente, o
b) l'adozione di misure di protezione supplementari per garantire la stabilità o la resistenza meccanica di tale macchina o prodotto correlato;
[…]
Obblighi fabbricanti di macchine e prodotti correlati
I fabbricanti garantiscono che la macchina o i prodotti correlati siano accompagnati dalla dichiarazione di conformità UE di cui all'allegato V, parte A, o forniscono l'indirizzo Internet al quale è possibile accedervi nelle istruzioni per l'uso e nelle informazioni di cui alla sezione 1.7 dell'allegato III.
Le dichiarazioni digitali di conformità UE sono rese accessibili online per la durata prevista della macchina o del prodotto correlato e non meno di 10 anni dopo l'immissione sul mercato o la messa in servizio della macchina o del prodotto correlato.
Articolo 10 Obblighi dei fabbricanti di macchine e di prodotti correlati
1. All'atto dell'immissione sul mercato o della messa in servizio di una macchina o di un prodotto correlato, i fabbricanti garantiscono che siano stati progettati e fabbricati conformemente ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
2. Prima dell'immissione sul mercato o della messa in servizio di una macchina o di un prodotto correlato, i fabbricanti redigono la documentazione tecnica di cui all'allegato IV, parte A, ed eseguono o fanno eseguire la pertinente procedura di valutazione della conformità di cui all'articolo 25.
Se la conformità della macchina o di un prodotto correlato rispetto ai requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III è stata dimostrata da tale procedura di valutazione della conformità, i fabbricanti redigono la dichiarazione di conformità UE conformemente all'articolo 21 e appongono la marcatura CE conformemente all'articolo 24
3. I fabbricanti mantengono la documentazione tecnica e la dichiarazione di conformità UE a disposizione delle autorità di vigilanza del mercato per un periodo di almeno 10 anni dalla data di immissione sul mercato o dalla messa in servizio della macchina o del prodotto correlato. Se pertinente, il codice sorgente o la logica di programmazione integrati nella documentazione tecnica, su richiesta motivata da parte delle autorità nazionali competenti, sono messi a disposizione di tali autorità a condizione che tale codice sorgente o logica di programmazione siano necessari affinché esse siano in grado di verificare il rispetto dei requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III.
4. I fabbricanti garantiscono che siano predisposte le procedure necessarie affinché le macchine o i prodotti correlati fabbricati nell'ambito di una produzione in serie rimangano conformi al presente regolamento. Le modifiche del processo produttivo o della progettazione o delle caratteristiche delle macchine o dei prodotti correlati, nonché le modifiche delle norme armonizzate, di altre specifiche tecniche o delle specifiche comuni di cui all'articolo 20 con riferimento alle quali è dichiarata la conformità delle macchine o dei prodotti correlati devono essere tenute debitamente in considerazione.
Laddove ritenuto necessario in considerazione dei rischi presentati dalle macchine o dai prodotti correlati, al fine di proteggere la salute e la sicurezza degli utilizzatori, i fabbricanti effettuano una prova a campione delle macchine o dei prodotti correlati messi a disposizione sul mercato e ne esaminano i risultati. Se del caso, i fabbricanti mantengono un registro dei reclami, delle macchine o dei prodotti correlati non conformi e dei richiami di macchine e di prodotti correlati, e informano i distributori di tale monitoraggio.
5. I fabbricanti garantiscono che sulle macchine o sui prodotti correlati da loro immessi sul mercato o messi in servizio siano apposti almeno una designazione del modello della macchina o del prodotto correlato, della serie o del tipo, l'anno di costruzione, vale a dire l'anno in cui il processo di fabbricazione si è concluso, nonché, eventualmente, un numero di lotto o di serie oppure qualsiasi altro elemento che ne consenta l'identificazione, oppure, qualora le dimensioni o la natura della macchina o del prodotto correlato non lo consentano, garantiscono che le informazioni prescritte siano fornite sull'imballaggio o in un documento di accompagnamento della macchina o del prodotto correlato.
6. I fabbricanti indicano il proprio nome, la propria denominazione commerciale registrata o il proprio marchio registrato, nonché l'indirizzo postale e il sito internet, l'indirizzo di posta elettronica o altri contatti digitali ai quali possono essere contattati sulla macchina o sul prodotto correlato oppure, ove ciò non sia possibile, sull'imballaggio o in un documento di accompagnamento della macchina o del prodotto correlato. L’indirizzo indica un unico recapito presso il quale il fabbricante può essere contattato. Le informazioni relative al contatto sono in una lingua facilmente comprensibile dagli utilizzatori e le autorità di vigilanza del mercato.
[…]
8. I fabbricanti garantiscono che la macchina o il prodotto correlato siano accompagnati dalla dichiarazione di conformità UE di cui all'allegato V, parte A, o, in alternativa, i fabbricanti forniscono l'indirizzo internet o codici a lettura ottica dove è possibile accedere a tale dichiarazione di conformità UE nelle istruzioni per l'uso e nelle informazioni di cui all'allegato III.
Le dichiarazioni di conformità UE digitali sono rese accessibili online per il ciclo di vita previsto della macchina o del prodotto correlato e, in ogni caso, per un periodo di almeno 10 anni dopo l'immissione sul mercato o la messa in servizio della macchina o del prodotto correlato.
[box-note]Regolamento (UE) 2023/1230
ALLEGATO V DICHIARAZIONE DI CONFORMITÀ E INCORPORAZIONE
A. DICHIARAZIONE DI CONFORMITÀ UE DI MACCHINE E PRODOTTI CORRELATI… N...(1)
La dichiarazione di conformità UE deve riportare le indicazioni seguenti:
1. Macchina o prodotto correlato (prodotto, tipo, modello, lotto o numero di serie) o macchina o prodotto correlato che ha subito modifiche sostanziali.
2. Nome e indirizzo del fabbricante e, se del caso, del suo mandatario.
3. Per le macchine di sollevamento destinate ad essere installate in modo permanente in un edificio o in una struttura e che non possono essere assemblate nei locali del fabbricante ma che possono essere montate solo sul luogo di utilizzazione, l'indirizzo di tale luogo.
4. La presente dichiarazione di conformità è rilasciata sotto l'esclusiva responsabilità del fabbricante.
5. Oggetto della dichiarazione (identificazione della macchina o del prodotto correlato che ne consenta la rintracciabilità; se necessario per l'identificazione della macchina o del prodotto correlato, si può includere un'immagine a colori sufficientemente chiara).
6. L'oggetto della dichiarazione di cui al punto 5 è conforme alla normativa di armonizzazione dell'Unione seguente.
7. Riferimenti alle norme armonizzate di cui all'articolo 20, paragrafo 1, o alle specifiche comuni adottate dalla Commissione conformemente all'articolo 20, paragrafo 3, che sono state applicate, compresa la data della pubblicazione del riferimento alle norme armonizzate nella Gazzetta ufficiale dell’Unione europea o della specifica comune, oppure riferimenti ad altre specifiche tecniche, compresa la data, in relazione alla quale si dichiara la conformità. In caso di applicazione parziale delle norme armonizzate o delle specifiche comuni la dichiarazione UE di conformità deve specificare le parti che sono state applicate.
8. Laddove applicabile, l'organismo notificato... (nome, numero)... ha effettuato l'esame UE del tipo (modulo B) e ha emesso il certificato di esame UE del tipo... (riferimento a tale certificato), seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) o la conformità basata sulla verifica di un unico prodotto (modulo G) o sulla garanzia qualità totale (modulo H).
9. Laddove applicabile, la macchina o il prodotto correlato sono soggetti alla procedura di valutazione della conformità basata sul controllo interno della produzione (modulo A).
10. Informazioni supplementari:
Firmato a nome e per conto di: …
(luogo e data del rilascio):
(nome e cognome, funzione) (firma):
1 L'assegnazione di un numero, da parte del fabbricante, alla dichiarazione di conformità è opzionale. [/box-note]
Tavola raffronto: Dichiarazione di conformità Direttiva macchine 2006 / Regolamento macchine 2023 (IT)
- in colonna (1) contenuti dell’Allegato II Parte A della Direttiva 2006/42/CE (IT)
- in colonna (2) contenuti dell’Allegato V Parte A Regolamento (UE) 2023/1230
...Segue in allegato
Vedi Documenti
Certifico Srl - IT | Rev. 3.0 2023
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 3.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 | Certifico Srl |
| 2.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 1.0 | 23.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 0.0 | 16.04.2023 | --- | Certifico Srl |
Collegati
[box-note]Regolamento (UE) 2023/1230
Manuale Istruzioni Direttiva/Regolamento macchine 2023: Tavola raffronto
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Proposal for a Regulation on machinery products
Proposta regolamento macchine - Lettera al presidente Commissione IMCO 25.01.2023
Status fasi Regolamento macchine
Report CE Regulation on Machinery Products - 18.11.2021
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dichiarazione di conformità UE Macchine e prodotti correlati - Reg. macchine Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
368 kB | 196 | ||
| Dichiarazione di conformità UE Macchine e prodotti correlati - Reg. macchine Rev. 2.0 2023.pdf Certifico Srl - Rev. 2.0 2023 |
364 kB | 24 | ||
| Dichiarazione di conformità UE Macchine e prodotti correlati - Reg. macchine Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
361 kB | 154 | ||
| Dichiarazione di conformità UE Macchine e prodotti correlati - Reg. macchine Rev. 0.0 2023.pdf Certifico Srl - Rev. 0.0 2023 |
356 kB | 117 |
Fascicolo Tecnico Direttiva/Regolamento macchine 2023: Tavola raffronto
Fascicolo Tecnico Direttiva macchine 2006 / Regolamento macchine 2023: Tavola raffronto / Rev. 3.0 2023
ID 19416 | Rev. 3.0 del 04.07.2023 / In allegato documento completo
La tavola di seguito proposta mette a confronto gli elementi contenuti nel fascicolo tecnico così come normati dall’Allegato VII Parte A della Direttiva 2006/42/CE (IT) colonna (1), con i novelli elementi contenuti dell'Allegato IV Parte A in colonna (2) del Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023. Inoltre, vengono inseriti nella colonna (3), note relative alle novità dispositive proprie del Regolamento macchine.
[box-info]Rev. 3.0 del 04 Luglio 2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-info]
[box-note]Update Rev. 2.0 del 03 Luglio 2023
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU n. 165/1 del 29.06.2023). Entrata in vigore: 19.07.2023[/box-note]
[panel]Regolamento (UE) 2023/1230
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 16 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 53 Valutazione e riesame
1. Entro il 20 luglio 2028 e, successivamente, ogni quattro anni, la Commissione presenta una relazione sulla valutazione e sul riesame del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
2. Tenendo conto del progresso tecnico e dell'esperienza pratica acquisita negli Stati membri come specificato all'articolo 6, la Commissione include nella relazione una valutazione dei aspetti seguenti del presente regolamento:
a) i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) la procedura di valutazione della conformità applicabile alle macchine o ai prodotti correlati elencati nell’allegato I.
Se del caso, la relazione è corredata di una proposta legislativa di modifica delle pertinenti disposizioni del presente regolamento.
3. Entro il 20 luglio 2026 e, successivamente, ogni cinque anni, la Commissione presenta una relazione specifica sulla valutazione dell'articolo 6, paragrafi 4 e 5, del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
La Commissione include nelle sue relazioni gli elementi seguenti:
a) una sintesi dei dati e delle informazioni forniti dagli Stati membri a norma dell'articolo 6, paragrafo 5, durante il periodo di riferimento;
b) una valutazione dell'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I alla luce dei criteri di cui all'articolo 6, paragrafo 4.
Nelle relazioni la Commissione valuta l'adeguatezza e la disponibilità dei dati e delle informazioni forniti dagli Stati membri, comprese la loro adeguatezza e idoneità al fine di effettuare confronti, individuando eventuali carenze onde garantire il funzionamento efficace e l'applicazione dell'articolo 6.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 20 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2026;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.[/panel]
Tavola raffronto: Fascicolo Tecnico Direttiva macchine 2006 / Regolamento macchine 2023
- colonna (1) Allegato VII Parte A della Direttiva 2006/42/CE
- colonna (2) Allegato IV Parte A Regolamento (UE) 2023/1230
- colonna (3) Note di commento novità Regolamento (UE) 2023/1230
...Segue in allegato
Vedi Documenti
Certifico Srl - IT | Rev. 3.0 2023
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 3.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 | Certifico Srl |
| 2.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 1.0 | 23.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 0.0 | 14.04.2023 | --- | Certifico Srl |
Collegati
[box-note]Manuale Istruzioni Direttiva/Regolamento macchine 2023: Tavola raffronto
Dichiarazione di conformità UE macchine e prodotti correlati / Nuovo Regolamento macchine
Proposal for a Regulation on machinery products
Proposta regolamento macchine - Lettera al presidente Commissione IMCO 25.01.2023
Status fasi Regolamento macchine
Report CE Regulation on Machinery Products - 18.11.2021
Direttiva macchine 2006/42/CE
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Fascicolo Tecnico Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
259 kB | 242 | ||
| Fascicolo Tecnico Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 2.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
256 kB | 125 | ||
| Fascicolo Tecnico Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
253 kB | 198 | ||
| Fascicolo Tecnico Direttiva macchine 2006 Regolamento macchine 2023 - Tavola raffronto Rev. 0.0 2023.pdf Certifico Srl - Rev. 0.0 2023 |
250 kB | 129 |
RAPEX Report 11 del 17/03/2023 N. 39 A12/00518/23 Italia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 11 del 17/03/2023 N. 39 A12/00518/23 Italia
Approfondimento tecnico: Maglietta per bambini
Il prodotto, di marca Everlast, mod. 6046 226, è stato sottoposto al divieto di commercializzazione perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
L'iscrizione plastificata sul prodotto ha un'eccessiva concentrazione di ftalato di bis(2-etilesil) ftalato (DEHP) e Benzil-butil-ftalato (BBP) (valori misurati: fino al 51 % e 0,9 % in peso, rispettivamente). Questi ftalati possono causare danni al sistema riproduttivo dei bambini.
Regolamento (CE) n .1907/2006
Allegato XVII | Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. Bis(2-etilesil) ftalato (DEHP) | Dibutilftalato (DBP) | Benzilbutilftalato (BBP) | Diisobutilftalato (DIBP)
1. Non possono essere utilizzati nei giocattoli e negli articoli di puericultura, come sostanze o in miscele, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
2. Non possono essere immessi sul mercato nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
Inoltre, il DIBP non può essere immesso sul mercato dopo il 7 luglio 2020 nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
3. Non possono essere immessi sul mercato dopo il 7 luglio 2020 in articoli, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato contenuto nell'articolo.
4. Il punto 3 non si applica:
a) agli articoli esclusivamente destinati all'uso industriale e agricolo o all'uso in ambiente esterno, a condizione che nessun materiale plastificato venga a contatto con le mucose o a contatto prolungato con la pelle;
b) agli aeromobili immessi sul mercato prima del 7 gennaio 2024 o agli articoli, indipendentemente dalla loro data di immissione sul mercato, impiegati esclusivamente per la manutenzione o riparazione di tali aeromobili, qualora tali articoli siano essenziali alla sicurezza e all'aeronavigabilità degli aeromobili;
c) ai veicoli a motore che rientrano nell'ambito di applicazione della direttiva 2007/46/CE immessi sul mercato prima del 7 gennaio 2024 o agli articoli, indipendentemente dalla loro data di immissione sul mercato, impiegati esclusivamente per la manutenzione e riparazione di tali veicoli, qualora questi ultimi non possano funzionare nel modo previsto in assenza di tali articoli;
d) agli articoli immessi sul mercato prima del 7 luglio 2020;
e) agli strumenti di misurazione destinati all'uso in laboratorio e ai componenti di detti strumenti;
f) ai materiali e agli articoli destinati a venire a contatto con i prodotti alimentari che rientrano nell'ambito di applicazione del regolamento (CE) n. 1935/2004 o del regolamento (CE) n. 10/2011 della Commissione;
g) ai dispositivi medici che rientrano nell'ambito di applicazione delle direttive 90/385/CEE, 93/42/CEE o 98/79/CE e ai componenti di detti dispositivi medici;
h) alle apparecchiature elettriche ed elettroniche che rientrano nell'ambito di applicazione della direttiva 2011/65/UE;
i) al confezionamento primario dei medicinali che rientrano nell'ambito di applicazione del regolamento (CE) n. 726/2004, della direttiva 2001/82/CE o della direttiva 2001/83/CE;
j) ai giocattoli e agli articoli di puericultura di cui ai punti 1 e 2.
5. Ai fini dei punti 1, 2, 3 e 4, lettera a), valgono le seguenti definizioni:
a) «materiali plastificati», uno dei seguenti materiali omogenei:
- il cloruro di polivinile (PVC), il cloruro di polivinilidene (PVDC), l'acetato polivinilico (PVA), i poliuretani;
- qualsiasi altro polimero (tra cui le schiume polimeriche e la gomma) con l'eccezione dei rivestimenti in gomma di silicone e in lattice naturale;
- i rivestimenti per superfici, i rivestimenti antiscivolo, i prodotti di finitura, le decalcomanie, le stampe;
- gli adesivi, i sigillanti, gli inchiostri e le vernici.
b) «contatto prolungato con la pelle», contatto continuo di durata superiore a 10 minuti o contatto intermittente su un periodo di 30 minuti, misurati nell'arco di una giornata.
c) «articoli di puericultura», qualsiasi prodotto destinato a conciliare il sonno o il rilassamento dei bambini, alla loro igiene e al loro nutrimento o al succhiamento.
6. Ai fini del punto 4, lettera b), per «aeromobile» si intende uno dei seguenti:
a) un aeromobile civile prodotto conformemente a un certificato di omologazione rilasciato a norma del regolamento (UE) n. 216/2008 o a un'approvazione di progetto rilasciata in conformità alla normativa nazionale di uno Stato contraente dell'Organizzazione internazionale dell'aviazione civile (ICAO) o per cui è stato rilasciato un certificato di aeronavigabilità da uno Stato contraente dell'ICAO in conformità all'allegato 8 della Convenzione sull'aviazione civile internazionale firmata a Chicago il 7 dicembre 1944;
b) un aeromobile militare.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 11 del 17_03_2023 N. 39 A12_00518_23 Italia.pdf Maglietta per bambini |
115 kB | 1 |
UNI EN 14384 Idranti soprasuolo | Caratteristiche e Marcatura CE
UNI EN 14384 Idranti soprasuolo | Caratteristiche e Marcatura CE
ID 19344 | 25.05.2023 / Documento di approfondimento in allegato
Documento di approfondimento sulle caratteristiche e la marcatura CE degli idranti soprasuolo in accordo alla norma tecnica UNI EN 14384:2006 “Idranti antincendio a colonna soprasuolo”.
La norma UNI EN 14384:2006 specifica i requisiti minimi, i metodi di prova, la marcatura e la valutazione di conformità degli idranti antincendio a colonna soprasuolo:
- da installare in un sistema di distribuzione dell’acqua;
- di dimensioni DN 80, DN 100 e DN 150;
- adatti a una pressione d’esercizio ammissibile, PFA, di PN 16 con o senza sistema di scarico;
- con attacco di alimentazione verticale o orizzontale, flangiato o con estremità a incastro o imboccata;
- con uno o due attacchi di uscita secondo i requisiti nazionali;
- con valvola a globo (tipo a vite) o a saracinesca.
La norma specifica, inoltre, la valutazione di conformità degli idranti antincendio a colonna soprasuolo e si applica agli idranti antincendio che convogliano acqua potabile e non potabile e con acqua filtrata. Per altri liquidi, possono essere applicati requisiti aggiuntivi.
I raccordi da collegare alle uscite non rientrano nello scopo e campo di applicazione della UNI EN 14384:2006 e dovrebbero soddisfare i requisiti nazionali.
[box-info]UNI EN 14384:2006 “Idranti antincendio a colonna soprasuolo”
Data entrata in vigore: 09 marzo 2006
Norma armonizzata Regolamento (UE) 305/2011 CPR[/box-info]
[panel]UNI 10779:2021
[...] 6.4.1 Idranti a colonna soprasuolo
Gli idranti a colonna soprasuolo devono essere conformi alla UNI EN 14384.
Per ciascun idrante deve essere prevista, secondo le necessità di utilizzo, una o più tubazioni flessibili di DN 70 conformi alla UNI 9487 complete di raccordi UNI 804, lancia erogatrice conforme alla UNI 11423 e con le chiavi di manovra, indispensabili all’uso dell’idrante stesso, conformi a quanto indicato nella UNI EN 14384.
Tali dotazioni devono essere ubicate in prossimità degli idranti, in apposite cassette di contenimento dotate di sella di sostegno, o conservate in una o più postazioni accessibili in sicurezza, anche in caso di incendio, ed adeguatamente individuate da apposita segnaletica.
Ove ritenuto necessario, l’idrante può essere dotato di carenatura di sicurezza anti-vandalismo, conforme alla UNI EN 14384. [...][/panel]
Vedi documento di approfondimento
Gli idranti soprasuolo sono di due tipologie principali (a secco ed a umido).
Figura A - Tipologie di idranti soprasuolo
Nell’idrante a secco la colonna si svuota automaticamente quando si chiude l’otturatore principale, mentre in quello a umido la colonna rimane piena d’acqua.
Entrambe le tipologie possono poi essere con sistema a rottura prestabilita o senza sistema a rottura prestabilita e questo ne determina le classificazioni A, B, C, D riportate nel prospetto 6 della UNI EN 14384:2006.
Figura B - Sistema di rottura
Il meccanismo permette alla parte soprasuolo dell’idrante di separarsi dalla parte sottosuolo quando soggetta a impatto, mantenendo la tenuta dell’otturatore principale.
[...]
4.9 Giri di apertura
Il numero effettivo di giri (N, con tolleranza ±1) per aprire completamente l’idrante unitamente ai segni che indichino almeno la direzione di apertura devono essere riportati in modo chiaro sulla parte superiore dell’idrante antincendio come indicato nella figura 2.
Nel caso di un idrante a colonna soprasuolo a umido, i segni devono trovarsi vicino ad ogni singolo dispositivo di manovra.
Il fabbricante deve dichiarare il numero di giri del dispositivo di manovra dall’inizio del flusso alla completa apertura (giri effettivi), il numero di giri del dispositivo di manovra prima dell’inizio del flusso (giri a vuoto) nonché la loro somma (giri totali).
Figura 2 - Esempio di segni di apertura
[...]
6 Designazione, marcatura e dati aggiuntivi
6.1 Designazione
L’idrante deve essere designato dalla lettera corrispondente (A, B, C o D), come indicato nel prospetto 6.
Prospetto 6 - Designazione
6.2 Marcatura degli idranti
Tutti gli idranti devono essere provvisti di marcatura permanente nella parte superiore, con le seguenti indicazioni:
- direzione di apertura;
- numero di giri per l’apertura.
Inoltre, tutti gli idranti devono essere marcati in modo sicuro e permanente riportando le seguenti informazioni:
- riferimento alla presente norma europea, cioè EN 14384;
- DN;
- PN;
- marchio del fabbricante;
- data di fabbricazione;
- lettera di designazione;
- adeguatezza per il fluido trasportato; se l’acqua è potabile, riferimento alla EN 1074-6.
Nota Laddove il punto ZA.3 riporti le stesse informazioni del presente punto, i requisiti del presente punto sono soddisfatti.
[...]
ZA.2 Procedimento per l'attestazione di conformità degli idranti antincendio a colonna soprasuolo
Il sistema di attestazione di conformità degli idranti antincendio a colonna soprasuolo indicati nel prospetto ZA.1, come indicato nell’Allegato III del mandato, è illustrato nel prospetto ZA.2 per l’impiego previsto indicato.
Prospetto ZA.2 - Sistema di attestazione di conformità
L'organismo di certificazione del prodotto certificherà le prove iniziali di tipo di tutte le caratteristiche indicate nel prospetto ZA.1 in conformità alle disposizioni del punto 7.2, e per l'ispezione iniziale della fabbrica e del controllo di produzione in fabbrica e per la sorveglianza continua, la valutazione e l'approvazione del controllo di produzione in fabbrica, tutte le caratteristiche devono interessare l'organismo approvato.
Il fabbricante deve attuare un sistema di controllo della produzione in fabbrica in conformità alle disposizioni del punto 7.3 e, per l’ulteriore verifica dei campioni prelevati presso la fabbrica, deve eseguire le prove di produzione secondo il punto 7.4.
ZA.3 Marcatura CE
Il fabbricante o il suo rappresentante autorizzato designato nella EEA sono responsabili dell’applicazione della marcatura CE. Il simbolo di marcatura CE da applicare deve essere conforme alla Direttiva 93/68/CE e deve apparire sull’idrante unitamente alle informazioni specificate nel punto 6.2. Inoltre, il simbolo della marcatura CE deve apparire sull'imballaggio e/o sui documenti commerciali di accompagnamento, unitamente alle informazioni seguenti:
- numero di identificazione dell'organismo di certificazione; e
- nome o marchio di identificazione del produttore/fornitore; e
- le ultime due cifre dell'anno in cui la marcatura è stata applicata;
- numero del certificato CE di conformità; e
- numero della presente norma (EN 14384); e
- tipo di prodotto (cioè idrante antincendio a colonna soprasuolo); e
- le informazioni richieste dal punto 6.3, eccetto le dimensioni richieste dal punto 4.1 e il contatto con l’acqua potabile richiesto dal punto 4.5.
La figura ZA.1 fornisce un esempio di informazioni da riportare sull’imballaggio e/o sui documenti commerciali d'accompagnamento.
Figura ZA.1 - Esempio di informazioni sulla marcatura CE
[...]
Appendice Nazionale NA
Requisiti per l’Italia
NA.1 Scopo e campo di applicazione
La presente appendice specifica i requisiti e le caratteristiche degli idranti soprasuolo, non trattati e/o non specificati dalla UNI EN 14384.
[...]
Prospetto NA.1 - Configurazioni ammissibili degli attacchi di uscita
[...] segue in allegato
Fonti
UNI EN 14384:2006
Certifico Srl - IT | Rev. 0.0 2023
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 0.0 | 25.05.2023 | --- | Certifico Srl |
Collegati
[box-note]Regolamento (UE) 305/2011 CPR
Progettazione reti di idranti: quadro normativo e UNI 10779:2021
Antincendio norme tecniche UNI Status
UNI 10779:2021 | Progettazione di rete di idranti
EN 671-3 Manutenzione dei naspi ed idranti a muro
MIUMIA: Il Prodotto sulla Manutenzione Antincendio
Codice Prevenzione Incendi DM 3 agosto 2015 | RTO II
Registro antincendio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| UNI EN 14384 Idranti soprasuolo Caratteristiche e Marcatura CE Rev. 00 2023.pdf Certifico Srl - Rev. 0.0 2023 |
761 kB | 139 |
Decisione di esecuzione Commissione del 14.4.2021 COM(2021) 2406 final
Decisione di esecuzione Commissione del 14.4.2021 / COM(2021) 2406 final
Commission implementing Decision of 14.4.2021 on a standardisation request to the European Committee for Standardization and the European Committee for Electrotechnical Standardization as regards medical devices in support of Regulation (EU) 2017/745 of the European Parliament and of the Council and in vitro diagnostic medical devices in support of Regulation (EU) 2017/746 of the European Parliament and of the Council
________
Article 1 Requested standardisation activities
1. The European Committee for Standardization (CEN) and the European Committee for Electrotechnical Standardization (Cenelec) are requested to revise the existing harmonised standards listed in Table 1 of Annex I to this Decision and to draft the new harmonised standards listed in Table 2 of that Annex in support of Regulation (EU) 2017/745 for medical devices by the deadlines set in that Annex.
2. CEN and Cenelec are requested to revise the existing standards listed in Table 1 of Annex II to this Decision and to draft the new harmonised standards listed in Table 2 of that Annex in support of Regulation (EU) 2017/746 for in vitro diagnostic medical devices by the deadlines set in that Annex.
3. The standards referred to in paragraphs 1 and 2 shall meet the requirements set out in Annex III.
ANNEX I
List of existing standards to be revised and list of new standards to be drafted as referred to in Article 1(1)
ANNEX II
List of existing standards to be revised and list of new standards to be drafted as referred to in Article 1(2)
ANNEX III
Requirements for the standards referred to in Article 1
...
add more in attachment
Collegati
[box-note]Regolamento (UE) 2017/745
Regolamento (UE) 2017/746
Norme armonizzate Regolamento dispositivi medici (MD) 2017/745/UE
Norme armonizzate Regolamento dispositivi medici-diagnostici in vitro 2017/746/UE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Commission implementing Decision of 14.4.2021 COM(2021) 2406 final.pdf |
718 kB | 0 |
RAPEX Report 09 del 03/03/2023 N. 03 A12/00453/23 Irlanda

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 09 del 03/03/2023 N. 03 A12/00453/23 Irlanda
Approfondimento tecnico: Tazza
Il prodotto, di marca Costa Coffee, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti.
Il piccolo cuore di vetro all'interno della tazza di vetro può staccarsi. Un bambino potrebbe metterlo in bocca e soffocare.
Direttiva 2001/95/CE
CAPO II
Obbligo generale di sicurezza, valutazione di conformità, criteri e norme europee
Articolo 3
1. I produttori sono tenuti ad immettere sul mercato soltanto prodotti sicuri.
2. Un prodotto è considerato sicuro, per quanto concerne gli aspetti disciplinati dalla pertinente normativa nazionale, quando in mancanza di disposizioni comunitarie specifiche che ne disciplinano la sicurezza, è conforme alle normative nazionali specifiche dello Stato membro nel cui territorio è commercializzato, che sono stabilite nel rispetto del trattato, in particolare degli articoli 28 e 30, e che fissano i requisiti cui deve rispondere il prodotto sul piano sanitario e della sicurezza per poter essere commercializzato.
Si presume che un prodotto sia sicuro, per quanto concerne i rischi e le categorie di rischi disciplinati dalla pertinente normativa nazionale, quando è conforme alle norme nazionali non cogenti che recepiscono le norme europee, i cui riferimenti sono stati pubblicati dalla Commissione nella Gazzetta ufficiale delle Comunità europee a norma dell'articolo 4. Gli Stati membri pubblicano i riferimenti di tali norme nazionali.
3. In circostanze diverse da quelle di cui al paragrafo 2, si valuta la conformità di un prodotto all'obbligo generale di sicurezza tenendo conto in particolare, se esistono, dei seguenti elementi:
a) norme nazionali non cogenti che recepiscono norme europee pertinenti diverse da quelle di cui al paragrafo 2;
b) norme in vigore nello Stato membro in cui il prodotto è commercializzato;
c) raccomandazioni della Commissione relative ad orientamenti sulla valutazione della sicurezza dei prodotti;
d) codici di buona condotta in materia di sicurezza dei prodotti vigenti nel settore interessato;
e) ultimi ritrovati della tecnica;
f) sicurezza che i consumatori possono ragionevolmente attendere.
4. La conformità di un prodotto ai criteri volti a garantire l'obbligo generale di sicurezza, in particolare alle disposizioni di cui ai paragrafi 2 o 3 non vieta alle autorità competenti degli Stati membri di adottare le opportune misure per limitarne l'immissione sul mercato o chiederne il ritiro dal mercato o il richiamo qualora, nonostante tale conformità, il prodotto si riveli pericoloso.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 09 del 03_03_2023 N. 03 A12_00453_23 Irlanda.pdf Tazza |
93 kB | 0 |
Guida marchio UKCA
Guida marchio UKCA edita dalla I.T.A. (Italian Trade Agency) / ICE - Update Marzo 2023
ID 19296 | 23 Marzo 2023 / In allegato
In allegato le Guide prodotte sul marchio UKCA (GB) in relazione alla marcatura CE (EU)
________
Il marchio UKCA è stato introdotto dal Governo Britannico dopo la Brexit, al posto della della marcatura CE (Inghilterra, Scozia e Galles / No Irlanda del Nrod).
Il marchio UCKA (UK Conformity Assessed) è in vigore dal 1° gennaio 2021, ed il corrispondente UK alla marcatura CE In EU.
Fino al 31 dicembre 2024 (periodo di transizione) la Gran Bretagna riconoscierà la marcatura CE e la marcatura epsilon invertita per la maggior parte dei prodotti, i fabbricanti potranno utlizzare sia la marcatura CE / epsilon invertita che il marchio UKCA.
Dal 1° gennaio 2025 per l'importazione di prodotti in Gran Bretagna il marchio UKCA diventerà obbligatorio.
In questo periodo di transizione se saranno presenti eventuali divergenze tra i requisiti per la marcatura CE e quelli per la marchio UKCA per un determinato prodotto, non sarà possibile importare tale prodotto in Gran Bretagna se unicamente marcato CE.
[box-warning]Marchio UKCA in UE
Il marchio UKCA non è riconosciuto dall’UE, quindi prodotti provenienti dalla Gran Bretagna devono essere marcati CE.[/box-warning]
Fig. 1 - Timeline Marchio UKCA / CE (UE - GB e GB - UE)
Aree di prodotto coperte dal marchio UKCA:
- giocattoli
- pirotecnica
- imbarcazioni da diporto e moto d'acqua
- recipienti a pressione semplici
- compatibilità elettromagnetica
- strumenti per pesare a funzionamento non automatico
- strumenti di misura
- bottiglie contenitore di misurazione
- ascensori
- apparecchiature per atmosfere potenzialmente esplosive (UKEX)
- apparecchiature radiofoniche
- attrezzature a pressione
- dispositivi di protezione individuale (DPI)
- apparecchi a gas
- macchinari
- attrezzature per l'uso all'aperto
- ecodesign
- aerosol
- apparecchiature elettriche a bassa tensione
_______
IN SINTESI
1. la marcatura CE verrà accettata fino al 31-12-2024;
2. la marcatura CE può convivere con la UKCA sul prodotto;
3. la marcatura UKCA diventa obbligatoria e deve essere eseguita da un “Approved Body UCKA” in tutti i casi in cui la norma britannica lo preveda in modo specifico;
4. nel Regno Unito, successivamente al 31-12-2024, per le nuove Norme BS che differiranno da quelle equivalenti EN verranno definiti dei periodi di convivenza tra Norme BS e Norme EN;
5. a prescindere che si continui ad usare la marcatura CE, che si utilizzi solo il marchio UKCA o si utilizzino entrambi è obbligatorio dal 01/01/2023 che esista un soggetto di riferimento per le autorità britanniche in UK che risieda nel Regno Unito in qualità di Rappresentante Autorizzato in UK o di Importatore;
6. i dettagli del soggetto di riferimento per le autorità di controllo britanniche che risieda nel Regno Unito devono essere riportati sul prodotto (o sul suo imballaggio o su un documento di accompagnamento qualora l’indicazione sul prodotto non fosse fattibile);
7. l’etichetta di prodotto può essere costituita da una “sticky label” purché riporti i dati precedentemente indicati;
8. il fabbricante di consuetudine definisce con i soggetti di riferimento per le autorità di controllo britanniche che risiedano nel Regno Unito, degli accordi specifici sui quali vengono precisati obblighi e responsabilità di entrambe le parti.
Per i prodotti importati da uno stato dello Spazio Economico Europeo o dalla Svizzera prima delle 23:00 del 31 dicembre 2027, i dettagli dell’importatore possono essere indicati altrove (ad esempio su un documento di accompagnamento o sull’imballaggio) invece di essere apposti sul prodotto stesso.
________
QUADRO ATTUALE
DISPOSITIVI MEDICI
PRODOTTI DA COSTRUZIONE
LE DISPOSIZIONI EMANATE LUGLIO 2022
INFORMAZIONI DI DETTAGLIO
CONTROLLI SULLA CONFORMITÀ DEI PRODOTTI
FASCICOLO TECNICO
PERSONA RESPONSIBLE LIBRETTO USO & MANUTENZIONE E DOCUMENTI PUBBLICI DESTINATI AL CONSUMATORE/UTILIZZATORE (ES. ISTRUZIONI DI MONTAGGIO O INSTALLAZIONE)
IL SOGGETTO DI RIFERIMENTO PER LE AUTORITÀ DI CONTROLLO BRITANNICHE
SOGGETTO DI RIFERIMENTO PER LE AUTORITÀ DI CONTROLLO
IMPORTATORE RAPPRESENTANTE AUTORIZZATO IN UK
FILIALE O AZIENDA CONSOCIATA IN UK
INDICAZIONE SUL PRODOTTO DI UN SOGGETTO DI RIFERIMENTO PER LE AUTORITÀ DI CONTROLLO
MARCATURA UKCA
IMPIANTO COMPOSTO DA PARTI MARCATE CE E INSTALLATO IN UK
IN SINTESI
_______
Il 14 novembre 2022 le autorità britanniche competenti hanno pubblicato il provvedimento col quale hanno annunciato che la marcatura CE sarà riconosciuta in Gran Bretagna per ulteriori 2 anni, consentendo alle aziende la scelta tra l’utilizzo del marchio UKCA piuttosto che di quello CE. Le aziende, quindi, godranno di una rilevante flessibilità in merito al contrassegno da applicare.
Dal 31 dicembre 2022 la data ultima è pertanto spostata al 31 dicembre 2024. Regole diverse sussistono per i dispositivi medici, i prodotti da costruzione, le attrezzature a pressione trasportabili, i prodotti ferroviari e le attrezzature marittime.
DISPOSITIVI MEDICI
La Medical Device Regulations 2002 (UK MDR 2002) stabiliva che l'accettazione dei dispositivi marcati CE sul mercato britannico terminasse il 30 giugno 2023. Il governo è intervenuto con le disposizioni transitorie, poche settimane orsono, stabilendo un'estensione del riconoscimento dei dispositivi medici recanti la marcatura CE immessi sul mercato britannico. I produttori i cui dispositivi medici recano una marcatura "CE" potranno, pertanto, continuare a immettere i loro dispositivi sul mercato della Gran Bretagna fino al 30 giugno 2024.
PRODOTTI DA COSTRUZIONE
Il governo britannico ha esteso il riconoscimento dei prodotti da costruzione con marchio CE in Gran Bretagna per ulteriori due anni e mezzo, fino al 30 giugno 2025. Le imprese potranno utilizzare il nuovo marchio UKCA o il marchio CE durante questo periodo.
...
segue in allegato
Vedi Regole per l'utilizzo (apposizione) del marchio (logo) UKCA
Fonte : GOV UK
I.T.A. Italian Trade Agency
ICE - Agenzia per la promozione all'estero e l'internazionalizzazione della impree italiane
Collegati
[box-note]Regole per l'utilizzo del marchio (logo) UKCA
Marchio UKCA: estensione del periodo di transizione al 31.12.2024
Guidance UKCA marking: conformity assessment and documentation
Il marchio UKCA - Vademecum Dicembre 2021
Marchio UKCA: Posticipata la data di entrata in vigore al 1° gennaio 2023
Guida marcatura UKCA
Regno Unito: La Marcatura CE sarà sostituita dalla marcatura UKCA[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| UKCA - ITA Ed. 5.0 Marzo 2023.pdf |
196 kB | 116 | ||
| UKCA - ITA Ed. 4.0 Febraio 2022.pdf |
969 kB | 8 | ||
| UKCA - ITA Ed. 2.0 Gennaio 2021.pdf |
927 kB | 3 | ||
| UKCA - ITA Ed. 1.0 Ottobre 2020.pdf |
643 kB | 3 |
Decreto 23 febbraio 2006
Decreto 23 febbraio 2006
Pubblicita' dei dispositivi medici.
(GU n.93 del 21.04.2006)
[box-warning]Abrogato da:
Decreto 26 gennaio 2023 Individuazione delle fattispecie di pubblicita' di dispositivi medici che non necessitano di autorizzazione ministeriale. (GU n.66 del 18.03.2023)[/box-warning]
Collegati
[box-note]Decreto 26 gennaio 2023[/box-note]
Study to support the Impact Assessment digital labelling for EU fertilising products
Study to support the Impact Assessment on the use of digital labelling for EU fertilising products
ID 19260 | 20.03.2023
This study provides input for the Impact Assessment accompanying an initiative to introduce voluntary digital labelling for EU Fertilising Products under the Fertilising Products Regulation (EU) No 2019/1009, with a view to improving the communication of essential information and achieving cost-efficiency for industry.
Key issues assessed were the increased costs for industry arising from having to provide more information on the label, linked with frequent changes in such information, unnecessary duplication of labels and different stakeholder needs.
The study found that digital labelling tools were already widely used and that an appetite for increased digitalisation exists. Policy options were developed and assessed, and a relatively cautious approach was proposed, which although not maximising efficiency costs and benefits, bore in mind concerns of stakeholders with regards to the need to see information regarding safety, use, storage and agronomic efficiency on the physical label. The study methodology employed extensive data collection tools. However, often data were missing or not very robust.
...
Fonte: EC
Collegati
[box-note]Linea guida etichettatura prodotti fertilizzanti regolamento (UE) 2019/1009 (FPR)
Regolamento (UE) 2019/1009
FAQs related to Regulation (EU) 2019/1009
Dichiarazione UE di conformità Fertilizzanti - Modello
Regolamento (CE) n. 1069/2009
Regolamento (CE) n.1107/2009
Regolamento (CE) n. 2003/2003
Concimi: in arrivo il regolamento che prevede la marcatura CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Study digital labelling for EU fertilising products.pdf EC 15.03.2023 |
5229 kB | 0 |
RAPEX Report 08 del 24/02/2023 N. 58 A12/00337/23 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 08 del 24/02/2023 N. 58 A12/00337/23 Germania
Approfondimento tecnico: Macchina per incisione laser
Il prodotto, di marca Sculpfun, mod. S6 Pro, è stato sottoposto alla procedura di rimozione dal mercato online perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE ed alle norme tecniche EN 60825-1:2014 “Sicurezza dei prodotti laser - Parte 1: Classificazione degli apparecchi e requisiti” ed EN 60825-4:2006 “Sicurezza degli apparecchi laser Parte 4: Barriere per laser”.
Il raggio laser è troppo potente e il prodotto non è dotato di un involucro protettivo, lo schermo di protezione laser disponibile non può sopportare la piena potenza del laser. Inoltre, il prodotto non ha meccanismi di sicurezza e continua a funzionare in caso di reset o impatto. Gli utenti possono essere esposti direttamente alla luce laser, con conseguenti danni alla vista.
Allegato I
1.5.12. Radiazioni laser
In caso di impiego di dispositivi laser va tenuto conto delle seguenti disposizioni:
- i dispositivi laser montati su macchine devono essere progettati e costruiti in modo da evitare qualsiasi radiazione involontaria,
- i dispositivi laser montati sulle macchine debbono essere protetti in modo tale che né le radiazioni utili, né le radiazioni prodotte da riflessione o da diffusione e le radiazioni secondarie possano nuocere alla salute,
- i dispositivi ottici per l'osservazione o la regolazione di dispositivi laser montati sulle macchine devono essere tali che le radiazioni laser non creino alcun rischio per la salute.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 08 del 24_02_2023 N. 58 A12_00337_23 Germania.pdf Macchina per incisione laser |
105 kB | 1 |
Decreto Min. Salute del 26 gennaio 2023
Decreto Min. della Salute del 26 gennaio 2023
ID 19239 | 18.03.2023
Decreto Min. della Salute del 26 gennaio 2023 - Individuazione delle fattispecie di pubblicita' di dispositivi medici che non necessitano di autorizzazione ministeriale.
(GU n.66 del 18.03.2023)
Entrata in vigore: 19.03.2023
Collegati
[box-note]Decreto Legislativo 5 agosto 2022 n. 137
Regolamento (UE) 2017/745[/box-note]
Regolamento delegato (UE) 2023/503
Regolamento delegato (UE) 2023/503 / Modifica Regolamento DMD Vitro
ID 19171 | 08.03.2023
Regolamento delegato (UE) 2023/503 della Commissione del 1° dicembre 2022 che modifica il regolamento (UE) 2017/746 del Parlamento europeo e del Consiglio per quanto riguarda la frequenza delle nuove e complete valutazioni degli organismi notificati
GU L 70/3 del 8.3.2023
Entrata in vigore: 11.03.2023
________
Articolo 1
All’articolo 40 del regolamento (UE) 2017/746, il paragrafo 10 è sostituito dal seguente:
«10. Cinque anni dopo la notifica di un organismo notificato, e successivamente ogni cinque anni, una nuova e completa valutazione per determinare se l’organismo notificato è ancora conforme alle prescrizioni di cui all’allegato VII viene effettuata dall’autorità responsabile degli organismi notificati dello Stato membro in cui l’organismo è stabilito e da un gruppo di valutazione congiunta secondo la procedura di cui all’articolo 35.
L’autorità responsabile degli organismi notificati dello Stato membro in cui è stabilito l’organismo notificato può effettuare una nuova e completa valutazione prima delle date di cui al primo comma su richiesta dell’organismo notificato oppure qualora essa, sulla base dei risultati delle valutazioni annuali effettuate a norma del paragrafo 4 del presente articolo, nutra dubbi circa il persistere della conformità di un organismo notificato alle prescrizioni di cui all’allegato VII.
Le nuove e complete valutazioni già avviate prima dell’11 marzo 2023 continuano a essere effettuate, a meno che l’autorità responsabile degli organismi notificati dello Stato membro in cui è stabilito l’organismo notificato non decida di sospendere o cessare la nuova e completa valutazione in corso tenendo conto delle proprie risorse e delle risorse dell’organismo notificato già impiegate per la nuova valutazione, nonché dei risultati delle valutazioni annuali effettuate a norma del paragrafo 4 del presente articolo. Prima di sospendere o di cessare a una nuova e completa valutazione in corso, l’autorità responsabile degli organismi notificati sente l’organismo notificato interessato.».
Articolo 2
Il presente regolamento entra in vigore il terzo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
...
Collegati
[box-note]Regolamento (UE) 2017/746[/box-note]
Lists electrical equipment and phenomena not covered by the LVD
Lists electrical equipment and phenomena not covered by the LVD
ID 19168 | 07.03.2023 / Documento completo in allegato
Documento sulle esclusioni dei materiali elettrici e fenomeni dal campo di applicazione della Direttiva 2014/35/UE (Bassa Tensione) / LVD, riportati nell'Allega II, in accordo con:
- Direttiva 2014/35/UE
- Guidelines on the application of the directive LVD 2014/35/EU - August 2018
La guida detta precisazioni in merito, presenti immagini esempio.
________
[box-note]Direttiva 2014/35/UE
Articolo 1 Oggetto e ambito di applicazione
L’obiettivo della presente direttiva è garantire che il materiale elettrico sul mercato soddisfi requisiti che offrano un livello elevato di protezione della salute e della sicurezza delle persone, degli animali domestici e dei beni, assicurando nel contempo il funzionamento del mercato interno. La presente direttiva si applica al materiale elettrico destinato ad essere adoperato ad una tensione nominale compresa fra 50 e 1 000 V in corrente alternata e fra 75 e 1 500 V in corrente continua, fatta eccezione per i materiali e per i fenomeni di cui all’allegato II.
ALLEGATO II MATERIALI E FENOMENI ESCLUSI DALL’AMBITO DI APPLICAZIONE DELLA PRESENTE DIRETTIVA
- Materiali elettrici destinati ad essere usati in ambienti esposti a pericoli di esplosione.
- Materiali elettrici per radiologia e uso clinico. Parti elettriche di ascensori e montacarichi.
- Contatori elettrici.
- Prese di corrente (basi e spine) a uso domestico.
- Dispositivi di alimentazione di recinti elettrici.
- Disturbi radioelettrici.
- Materiali elettrici speciali, destinati ad essere usati sulle navi o sugli aeromobili e per le ferrovie, conformi alle disposizioni di sicurezza stabilite da organismi internazionali cui partecipano gli Stati membri.
- Kit di valutazione su misura per professionisti, destinati ad essere utilizzati unicamente in strutture di ricerca e sviluppo a tali fini.[/box-note]
[box-note]Guidelines on the application of the directive LVD 2014/35/EU - August 2018
...
Lists electrical equipment and phenomena not covered by the LVD
Annex II lists electrical equipment and phenomena not covered by the LVD
- Electrical equipment for use in an explosive atmosphere
- Electrical equipment for radiology and medical purposes
- Electrical parts for goods and passenger lifts
- Electricity meters
- Plugs and socket outlets for domestic use
- Electric fence controllers
- Radio-electrical interference
- Specialized electrical equipment, for use on ships, aircraft or railways, which complies with the safety provisions drawn up by international bodies in which the Member States participate.
- Custom built evaluation kits destined for professionals to be used solely at research and development facilities for such purposes.
§ 58 Which electrical equipment are excluded from the Directive?
The list in Annex II is intended to be exhaustive concerning electrical equipment explicitly excluded from the scope of the LVD. The reasons for the exemptions, for some electrical equipment, are that they are covered by other more specific Union acts. Other electrical equipment is excluded because of different reasons. These exclusions are the following:
- Electrical equipment for use in an explosive atmosphere
It is covered by the ATEX-Directive 2014/34/EU
- Electrical equipment for radiology and medical purposes
It is covered by Directive 93/42/EEC on Medical Devices which will be replaced, as of 26 May 2020, by Regulation (EU) 2017/745; Articles 120, 122and 123 of Regulation (EU) 2017/745 provide transitional arrangements and different dates of applicability with respect to certain provisions.
- Electrical parts for goods and passenger lifts
It is covered by the Lifts Directive 2014/33/EU. See also §73.
- Electricity meters
- Plugs and socket outlets for domestic use (20)
There is no harmonised household plug system throughout Europe and therefore these products have no relevance for the internal market.
However: special plugs and socket outlets e.g. for appliance couplers or industrial purposes are not excluded.
- Electric fence controllers
Very specialised electrical equipment with a limited number of items, which have no relevance for the internal market. They are subject to type certification in some Member States required by their national law.
- Specialised electrical equipment, for use on ships, aircraft or railways, which complies with the safety provisions drawn up by international bodies in which the Member States participate.
This electrical equipment is excluded from the LVD as far as it is covered by regulations of international institutions e.g. UNECE, International Maritime Organisation (IMO), International Civil Aviation Organisation (ICAO) or covered by related EU acts such as Directive 2014/90/EU (21) or Regulation (EC) No 216/2008.(22)
- Custom built evaluation kits destined for professionals to be used solely at research and development facilities for such purposes.
(20) “Domestic” plugs and sockets may also be used in commercial or industrial premises for uses, which do not require specialised industrial features.
(21) Directive 2014/90/EU of the European Parliament and of the Council of 23 July 2014 on marine equipment and repealing Council Directive 96/98/EC
(22) Regulation (EC) No 216/2008 of the European Parliament and of the Council of 20 February 2008 on common rules in the field of civil aviation and establishing a European Aviation Safety Agency, and repealing Council Directive 91/670/EEC, Regulation (EC) No 1592/2002 and Directive 2004/36/EC; there is a proposal for a new regulation to replace Regulation (EC) 2016/2008 (Procedure 2015/0277/COD).
...[/box-note]
Examples of products within or outside the scope of LVD
...

...
segue in allegato
Collegati
[box-note]Nuova Direttiva Bassa Tensione 2014/35/UE
Guidelines LVD 2014/35/EU - August 2018
Norme armonizzate Direttiva bassa tensione 2014/35/UE (BT)
CEI 23-50 Prescrizioni spine e prese usi domestici/similari e fogli di normalizzazione
CEI 23-57 Spine e prese per usi domestici e similari - Adattatori 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Lists electrical equipment and phenomena not covered by the LVD Rev. 00 2023.pdf Certifico Srl - Rev. 0.0 2023 |
1584 kB | 53 |
Altri articoli...
- RAPEX Report 07 del 17/02/2023 N. 18 A12/00290/23 Svezia
- RAPEX Report 06 del 10/02/2023 N. 01 A11/00021/23 Polonia
- Accordo provvisorio negoziati interistituzionali nuovo regolamento macchine 07.02.2023
- Proposta di Regolamento etichettatura digitale dei prodotti fertilizzanti
- Decreto 29 settembre 2003