RAPEX Report 45 del 06/11/2020 N. 02 A12/01457/20 Cipro

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 45 del 06/11/2020 N. 02 A12/01457/20 Cipro
Approfondimento tecnico: Accendino fantasia
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla norma europea EN 13869 “Accendini - Requisiti di sicurezza relativi ai bambini per gli accendini - Requisiti di sicurezza e metodi di prova”.
L'accendino attrae i bambini e può essere facilmente scambiato per un giocattolo. I bambini possono giocarci e ustionarsi o provocare un incendio.
La norma tecnica EN 13869:2016 stabilisce che nessun accendino deve essere attraente per i bambini.
Inoltre, il meccanismo o il sistema di un accendino che rende il prodotto resistente all’azionamento corretto da parte dei bambini deve:
a) azzerarsi automaticamente dopo ogni azionamento del meccanismo di accensione dell’accendino;
b) evitare di pregiudicare l’azionamento sicuro dell’accendino quando utilizzato in modo abituale e convenzionale;
c) essere efficace per la vita utile ragionevolmente prevista dell’accendino; e
d) essere difficile da inibire o disattivare.
Per accendino attraente per i bambini si intende:
“accendino, compreso qualsiasi supporto che possa essere incorporato successivamente o qualsiasi accessori che possa essere montato successivamente, che assomiglia mediante qualunque mezzo a un altro oggetto comunemente riconosciuto come attraente per i bambini più giovani di 51 mesi o destinato al loro utilizzo, oppure che ha effetti audio di intrattenimento o effetti animati”.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 45 del 06_11_2020 N. 02 A12_01457_20 Cipro.pdf Accendino fantasia |
499 kB | 0 |
Dichiarazione UE di conformità | Direttiva MED
Dichiarazione UE di conformità | Direttiva MED
ID 12019 | 11.11.2020 Dichiarazione di conformità pdf/doc in allegato
Modello di Dichiarazione UE di Conformità Equipaggiamento marittimo MED in accordo con l'articolo 16 della Direttiva 2014/90/UE.
Rev. 0.0 2020
______
Articolo 1 Obiettivo
L’obiettivo della presente direttiva è migliorare la sicurezza in mare e prevenire l’inquinamento marino mediante l’applicazione uniforme dei pertinenti strumenti internazionali relativi all’equipaggiamento marittimo da installare a bordo
delle navi UE e di garantire la libera circolazione di tale equipaggiamento all’interno dell’Unione.
Articolo 3 Ambito di applicazione
1. La presente direttiva si applica all’equipaggiamento presente o da installare a bordo delle navi UE, per il quale gli strumenti internazionali richiedono l’approvazione da parte dell’amministrazione dello Stato di bandiera, a prescindere dal fatto che la nave si trovi o meno sul territorio dell’Unione nel momento in cui l’equipaggiamento è installato a bordo.
2. Benché l’equipaggiamento di cui al paragrafo 1 possa rientrare anche nell’ambito di applicazione di strumenti del diritto dell’Unione diversi dalla presente direttiva, ai fini dell’articolo 1 tale equipaggiamento è soggetto esclusivamente alla presente direttiva.
Articolo 9 Marchio di conformità
1. L’equipaggiamento marittimo, la cui conformità ai requisiti della presente direttiva sia stata dimostrata in conformità delle pertinenti procedure di valutazione della conformità, reca il marchio di conformità.
2. Il marchio di conformità non è apposto su nessun altro prodotto.
3. La forma del marchio di conformità da utilizzare è illustrata nell’allegato I.
4. L’uso del marchio di conformità è soggetto ai principi generali di cui all’articolo 30, paragrafi 1 e da 3 a 6, del regolamento (CE) n. 765/2008, dove qualsiasi riferimento alla marcatura CE è inteso come riferimento al marchio di conformità.
Articolo 12 Obblighi dei fabbricanti
1. Con l’apposizione del marchio di conformità i fabbricanti si assumono la responsabilità di garantire che l’equipaggiamento marittimo sul quale è apposto il marchio sia stato progettato e fabbricato in conformità delle specifiche tecniche e delle norme applicate conformemente all’articolo 35, paragrafo 2, e si assumono gli obblighi di cui ai paragrafi da 2 a 9 del presente articolo.
2. I fabbricanti predispongono la documentazione tecnica prescritta e fanno eseguire le procedure di valutazione della conformità applicabili.
3. Se la procedura di verifica della conformità ha dimostrato che l’equipaggiamento marittimo è conforme ai requisiti applicabili, i fabbricanti redigono la dichiarazione UE di conformità a norma dell’articolo 16 e appongono il marchio di conformità a norma degli articoli 9 e 10.
4. I fabbricanti mantengono la documentazione tecnica e la dichiarazione UE di conformità, di cui all’articolo 16, per un periodo di tempo pari ad almeno dieci anni dopo l’apposizione del marchio di conformità e, in ogni caso, non
inferiore al periodo di vita atteso dell’equipaggiamento marittimo interessato.
5. I fabbricanti garantiscono l’attuazione delle procedure necessarie affinché la produzione in serie continui a essere conforme. Sono tenute in considerazione le modifiche alla progettazione o alle caratteristiche dell’equipaggiamento marittimo e le modifiche ai requisiti degli strumenti internazionali di cui all’articolo 4, sulla base dei quali è dichiarata la conformità dell’equipaggiamento marittimo. Se necessario, in conformità dell’allegato II, i fabbricanti fanno eseguire una nuova valutazione di conformità.
6. I fabbricanti si assicurano che sui loro prodotti sia apposto un numero di tipo, di lotto, di serie o altri elementi che ne consentano l’identificazione, o, se le dimensioni o la natura del prodotto non lo permettono, che le informazioni prescritte siano riportate sull’imballaggio o su un documento di accompagnamento del prodotto o, se del caso, su entrambi.
7. Gli importatori indicano sul prodotto il loro nome, la loro denominazione commerciale registrata o il loro marchio registrato e l’indirizzo al quale possono essere contattati oppure, ove ciò non sia possibile, riportano le informazioni sull’imballaggio o in un documento che accompagna il prodotto o, se del caso, su entrambi. L’indirizzo deve indicare un unico punto di contatto del fabbricante.
8. I fabbricanti si accertano che il prodotto sia corredato di istruzioni e di tutte le informazioni necessarie per l’installazione a bordo e l’uso sicuri, comprese le eventuali limitazioni d’uso, che possano essere agevolmente comprese dagli utilizzatori, oltre all’eventuale altra documentazione richiesta dagli strumenti internazionali o dalle norme di prova.
9. I fabbricanti che ritengono o hanno motivo di ritenere che un prodotto su cui hanno apposto il marchio di conformità non sia conforme ai requisiti di progettazione, costruzione ed efficienza applicabili e alle norme di prova applicati conformemente all’articolo 35, paragrafi 2 e 3, prendono immediatamente le misure correttive necessarie per rendere conforme tale prodotto, per ritirarlo o richiamarlo, a seconda dei casi. Inoltre, qualora il prodotto presenti un rischio, i fabbricanti ne informano immediatamente le competenti autorità nazionali degli Stati membri, indicando in particolare gli aspetti di non conformità e qualsiasi misura correttiva adottata
10. A seguito di una richiesta motivata di un’autorità competente, i fabbricanti forniscono senza indugio a quest’ultima tutte le informazioni e la documentazione necessarie per dimostrare la conformità del prodotto in una lingua che può essere facilmente compresa o accettabile da tale autorità, ne autorizzano l’accesso ai propri impianti a fini di vigilanza del mercato, conformemente all’articolo 19 del regolamento (CE) n. 765/2008, e forniscono campioni o li rendono accessibili in conformità dell’articolo 25, paragrafo 4 della presente direttiva. Essi cooperano con tale autorità, su richiesta di quest’ultima, a qualsiasi azione intrapresa per eliminare i rischi presentati dai prodotti che hanno immesso sul mercato.
Articolo 16 Dichiarazione UE di conformità
1. La dichiarazione UE di conformità attesta che è stata dimostrata la conformità ai requisiti stabiliti in conformità dell’articolo 4.
2. La dichiarazione UE di conformità segue la struttura del modello riportato nell’allegato III della decisione n. 768/ 2008/CE. Essa contiene gli elementi specificati nei moduli pertinenti di cui all’allegato II della presente direttiva ed è tenuta aggiornata.
3. Nel redigere la dichiarazione UE di conformità il fabbricante si assume la responsabilità e gli obblighi di cui all’articolo 12, paragrafo 1.
4. Quando l’equipaggiamento marittimo è installato a bordo di una nave UE, è fornita alla nave una copia della dichiarazione UE di conformità relativa a tale equipaggiamento; la dichiarazione è mantenuta a bordo della nave fino a quando l’equipaggiamento di cui trattasi non sia stato rimosso. La dichiarazione è tradotta dal fabbricante nella o nelle lingue richieste dallo Stato membro di bandiera ed anche in almeno una lingua di uso comune nel settore del trasporto marittimo.
5. Una copia della dichiarazione UE di conformità è trasmessa all’organismo o agli organismi notificati che hanno condotto le pertinenti procedure di valutazione della conformità.
...
Allegato I MARCHIO DI CONFORMITÀ
Il marchio di conformità ha la forma seguente:
In caso di riduzione o di ingrandimento del marchio di conformità, devono essere rispettate le proporzioni indicate nel simbolo graduato.
I diversi elementi del marchio di conformità devono avere sostanzialmente la stessa dimensione verticale che non può essere inferiore a 5 mm.
Tale dimensione minima può essere ignorata per oggetti in scala ridotta.
© Certifico S.r.l.
Rev. 0.0 2020
Collegati:
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
Le nuove Dichiarazioni di Conformità UE 2014/2016: i Modelli per tipologie di Prodotto
ADCO MED EU Declaration of conformity template [/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dichiarazione UE di conformità MED Rev. 0.0 2020.docx Certifico Srl - Rev. 0.0 2020 |
43 kB | 17 | ||
| Dichiarazione UE di conformità MED Rev. 0.0 2020.pdf Certifico Srl - Rev. 0.0 2020 |
382 kB | 20 |
RAPEX Report 44 del 30/10/2020 N. 25 A11/00086/20 Regno Unito

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 44 del 30/10/2020 N. 25 A11/00086/20 Regno Unito
Approfondimento tecnico: Trapano elettrico
Il prodotto, di marca Vontox, mod. X00136P4QX, è stato sottoposto alla procedura di distruzione del prodotto perché non conforme al alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60335-2-45: 2003 “Sicurezza degli apparecchi elettrici d'uso domestico e similare Parte 2: Norme particolari per utensili elettrici mobili riscaldanti e apparecchi similari”.
L'isolamento elettrico è inadeguato e le distanze tra il circuito primario e secondario non sono sufficienti. Di conseguenza, il prodotto può surriscaldarsi, provocando delle ustioni all’utilizzatore.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 44 del 30_10_2020 N. 25 A11_00086_20 Regno Unito.pdf Trapano elettrico |
401 kB | 1 |
Certificazione acustica e vibratoria delle macchine
Certificazione acustica e vibratoria delle macchine - Manuale operativo
INAIL, 2020
Viene presentato il manuale operativo per la certificazione acustica e vibratoria delle macchine, realizzato dall'Università di Ferrara in collaborazione con il Laboratorio rischi agenti fisici del Dimeila, nell'ambito del progetto BRIC ID26 del PAR 2016-2018 dell'Inail.
Il Manuale si pone come obiettivo fornire indicazioni operative ai progettisti e ai costruttori di macchine e attrezzature per la corretta certificazione acustica e vibratoria e consentire quindi ai datori di lavoro di scegliere le macchine in grado di ridurre i rischi di esposizione dei lavoratori addetti.
Nella prima parte del manuale (capitolo 2) vengono illustrati i principali riferimenti legislativi e normativi derivanti dalle strategie comunitarie, in particolare dalla direttiva 2006/42/CE (direttiva macchine), indirizzate a regolamentare le emissioni acustiche delle macchine e attrezzature rilevanti ai fini della preservazione della salute dei lavoratori. Vengono inoltre fornite le definizioni e le procedure finalizzate alla certificazione acustica e vibratoria, incluse le procedure di valutazione della conformità e la relativa marcatura CE di prodotti.
Nella seconda parte del manuale (capitoli 3 e 4) vengono descritti gli obblighi legislativi e le procedure relative alla certificazione acustica e vibratoria delle macchine, facendo riferimento soprattutto alle indicazioni delle principali direttive europee del settore rumore (2006/42/CE, 2000/14/CE, 2003/10/CE) e vibrazioni (2006/42/CE, 2002/44/CE).
Vengono inoltre descritte sinteticamente le principali norme tecniche generali e fatti alcuni cenni sulla struttura delle norme tecniche di prodotto.
Nell’ultimo paragrafo di ciascuno di questi capitoli, viene fornita una breve descrizione delle informazioni relative al database normativo, sia come elenco che come schede tecniche per ciascuna norma. In questi paragrafi, in particolare, si descrivono i campi nei quali è strutturato il database che possono essere poi utilizzati per agevolare la ricerca delle informazioni necessarie, quando sarà implementato su supporto informatico.
Negli elenchi delle norme (riportati negli allegati B.1 e B.2), sono state elencate ed analizzate circa 400 norme per il rumore e circa 100 norme per le vibrazioni. Il database di schede tecniche di sintesi per ciascuna norma rappresenta uno strumento fondamentale per perseguire l’obiettivo di fornire indicazioni procedurali per la certificazione acustica e vibratoria delle macchine.
Le norme sono state censite e classificate, considerando sia quelle di carattere generale che quelle specifiche di prodotto, tenendo conto della loro applicabilità in laboratorio o in campo, mettendo in risalto sia le diverse condizioni operative che le diverse condizioni di misura.
Il database delle schede tecniche di ciascuna norma, una volta implementato su supporto informatico, potrà essere aggiornato ed ampliato seguendo le revisioni e gli aggiornamenti normativi, così da mantenere aggiornate le informazioni.
Nell’allegato A del manuale è riportata la descrizione del caso studio relativo ai trattori agricoli che, com’è noto, espongono gli operatori a rumore e vibrazioni. Si è scelta questa tipologia di macchine in quanto la sua diffusione è estremamente rilevante in Italia (quasi 2 milioni di unità) e le stesse risultano in larga misura obsolete in quanto il rinnovo di questi mezzi stenta a decollare. Pertanto, questa indagine risulta particolarmente importante anche a fini igienistici.
________
1 Introduzione
1.1 Contenuti del manuale
2 Quadro su legislazione e normativa tecnica
2.1 Introduzione
2.2 Il nuovo approccio’ e gli strumenti legislativi
2.3 Valutazione della conformità
2.3.1 Moduli per la valutazione della conformità
2.3.2 Dichiarazione UE di conformità
2.3.3 Marcatura CE
2.4 Organismi notificati e accreditamento
2.5 Rapporto tra leggi e norme - Norme armonizzate
2.6 Norme di tipo A, tipo B e tipo C
2.7 Norme tecniche ed enti di normazione
3 La certificazione acustica delle macchine
3.1 Obblighi legislativi per il rumore
3.1.1 Direttiva macchine (2006/42/CE)
3.1.2 Direttiva sull’emissione acustica ambientale delle macchine destinate a funzionare all’aperto (2000/14/CE)
3.1.3 Direttiva 2003/10/CE
3.2 Norme tecniche generali - Rumore
3.2.1 Norme generali per la caratterizzazione delle emissioni acustiche delle macchine
3.2.2 Norme generali per la Direttiva 2006/42/CE
3.2.3 Norme generali per la Direttiva 2000/14/CE
3.3 Norme tecniche di prodotto - Rumore
3.4 Descrizione database norme - Rumore
4 La certificazione vibratoria delle macchine
4.1 Obblighi legislativi per le vibrazioni
4.1.1 Direttiva macchine (2006/42/CE)
4.1.2 Direttiva 2002/44/CE
4.2 Norme tecniche generali - Vibrazioni
4.2.1 Norme generali per la Direttiva 2006/42/CE
4.3 Norme tecniche di prodotto - Vibrazioni
4.4 Descrizione database norme - Vibrazioni
5 Bibliografia e Sitografia
Allegati
A Caso studio: rumore e vibrazioni sui trattori agricoli
A.1 Materiali e metodi
A.1.1 Trattori e dotazioni
A.1.2 Superfici di prova
A.1.3 Attività esaminate
A.1.4 Strumenti, metodi di misura ed elaborazione dei dati
A.2 Risultati
A.2.1 Dati ed elaborazioni
A.3 Analisi dei risultati
A.3.1 Rilievi presso l’azienda agricola
A.3.2 Rilievi presso il costruttore
A.4 Osservazioni
A.4.1 Assi delle vibrazioni determinanti il rischio per l’operatore
A.4.2 Valori delle vibrazioni determinanti il rischio per l’operatore
A.4.3 Attenuazione delle vibrazioni da parte dei sedili
A.4.4 Graduatorie dei trattori in termini di rischio
A.4.5 Graduatorie dei trattori in termini di vibrazioni complessive sul basamento del sedile
A.4.6 Graduatorie dei sedili dei trattori
A.5 Considerazioni finali sul caso studio
A.5.1 Assi delle vibrazioni determinanti il rischio per l’operatore
A.5.2 Accelerazioni determinanti il rischio e graduatorie
A.5.3 Impulsività delle accelerazioni sul piano del sedile
A.5.4 Carro a rimorchio
A.5.5 Attenuazione dei sedili e graduatorie
A.5.6 Curva di trasmissibilità delle vibrazioni attraverso il sedile
A.5.7 Componenti in frequenza delle accelerazioni
A.5.8 Frequenza di risonanza degli pneumatici e del sistema trattore pneumatici
A.5.9 Frequenza di risonanza e di eccitazione del sedile
A.5.10 Sospensioni
A.5.11 Accelerazioni sulle piste a risalti
A.5.12 Rumore
A.6 Dati di omologazione dei trattori
A.6.1 Rumore al posto operatore
A.6.2 Vibrazioni
A.7 I valori di esposizione sui trattori nel database del PAF
A.7.1 Rumore al posto operatore
A.7.2 Vibrazioni
A.8 Conclusioni
B Norme tecniche
B.1 Elenco norme tecniche rumore
B.2 Elenco norme tecniche vibrazione
...
Fonte: INAIL
Collegati:
[box-note]Direttiva macchine 2006/42/CE
Direttiva 2002/44/CE
Direttiva 2000/14/CE emissione acustica ambientale macchine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Certificazione acustica e vibratoria delle macchine - Manuale operativo.pdf Manuale operativo 2020 |
5503 kB | 546 |
RAPEX Report 42 del 16/10/2020 N. 01 A12/01347/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 42 del 16/10/2020 N. 01 A12/01347/20 Polonia
Approfondimento tecnico: Scooter elettrico
Il prodotto, di marca Techlife, è stato sottoposto alla procedura di richiamo presso gli utenti finali perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE.
Si possono creare delle crepe nel manubrio che possono causarne la rottura.
Direttiva 2006/42/CE
Allegato I
1.3.2. Rischio di rottura durante il funzionamento
Gli elementi della macchina, nonché i loro organi di collegamento, devono resistere agli sforzi cui devono essere sottoposti durante l'utilizzazione.
I materiali utilizzati devono presentare caratteristiche di resistenza sufficienti ed adeguate all'ambiente di utilizzazione, previsto dal fabbricante o dal suo mandatario, in particolare per quanto riguarda i fenomeni di fatica, invecchiamento, corrosione e abrasione.
Nelle istruzioni devono essere indicati i tipi e le frequenze delle ispezioni e manutenzioni necessarie per motivi di sicurezza. Devono essere indicati dove appropriato gli elementi soggetti ad usura, nonché i criteri di
Se nonostante le precauzioni prese sussistono rischi di disintegrazione o di rottura, gli elementi in questione devono essere montati, disposti e/o protetti in modo che i loro eventuali frammenti vengano trattenuti evitando situazioni pericolose.
Le tubazioni rigide o elastiche contenenti fluidi, in particolare ad alta pressione, devono poter sopportare le sollecitazioni interne ed esterne previste e devono essere solidamente fissate e/o protette affinché, in caso di rottura, esse non presentino rischi.
In caso di alimentazione automatica del materiale da lavorare verso l'utensile, devono essere soddisfatte le seguenti condizioni per evitare rischi per le persone:
- al momento del contatto utensili/pezzo, l'utensile deve aver raggiunto le sue normali condizioni di lavoro,
- al momento dell'avviamento e/o dell'arresto dell'utensile (volontario o accidentale), il movimento di alimentazione e il movimento dell'utensile debbono essere coordinati.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 42 del 16_10_2020 N. 01 A12_01347_20 Polonia.pdf Scooter elettrico |
127 kB | 2 |
D.Lgs. 17 marzo 1995 n.115
D.Lgs. 17 marzo 1995 n.115
Attuazione della direttiva 92/59/CEE relativa alla sicurezza generale dei prodotti.
Abrogato da: D. Lgs. 6 settembre 2005 n. 206
(GU n.92 del 20-04-1995)
Collegati
[box-note]Direttiva 92/59/CEE
Decreto Legislativo 6 settembre 2005 n. 206
Codice del Consumo[/box-note]
Dichiarazione di Conformità Direttiva 2001/95/CE GPSD
Dichiarazione di Conformità Direttiva 2001/95/CE GPSD | Sicurezza generale prodotti
ID 11935 | 28.10.2020
Modello Dichiarazione di Conformità Direttiva 2001/95/CE sicurezza generale dei prodotti (Dichiarazione del Produttore "non espressamente prevista", ma "consigliata sempre" per i prodotti non soggetti a Direttive che prevedono la marcatura CE, per i quali è obbligo la consegna della Dichiarazione CE/UE di Conformità).
Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti (G.U. L 11/4 del 15.1.2002)
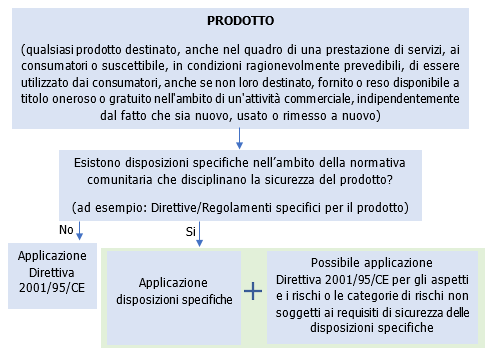
Fig. 1 – Schema applicazione Direttiva 2001/95/CE
Fig. 2 – Esempio tavolo da campeggio
Fig. 3 – Esempio monitor computer
[panel]Ambito di applicazione
Articolo 1
1. La presente direttiva è intesa a garantire che i prodotti immessi sul mercato siano sicuri.
2. La presente direttiva si applica a tutti i prodotti definiti all'articolo 2, lettera a). Ciascuna delle sue disposizioni si applica nella misura in cui non esistano, nell'ambito della normativa comunitaria, disposizioni specifiche aventi lo stesso obiettivo che disciplinano la sicurezza dei prodotti in questione.
Se dei prodotti sono soggetti a requisiti di sicurezza prescritti dalla normativa comunitaria, la presente direttiva si applica unicamente per gli aspetti e i rischi o le categorie di rischi non soggetti a tali requisiti. Di conseguenza:
a) l'articolo 2, lettere b) e c) e gli articoli 3 e 4 non si applicano a tali prodotti, per quanto riguarda i rischi o le categorie di rischio disciplinati dalla normativa specifica;
b) gli articoli da 5 a 18 si applicano se sugli aspetti disciplinati da tali articoli non esistono disposizioni specifiche riguardanti lo stesso obiettivo.
Definizioni
Articolo 2
Ai fini della presente direttiva, s'intende per:
a) «prodotto»: qualsiasi prodotto destinato, anche nel quadro di una prestazione di servizi, ai consumatori o suscettibile, in condizioni ragionevolmente prevedibili, di essere utilizzato dai consumatori, anche se non loro destinato, fornito o reso disponibile a titolo oneroso o gratuito nell'ambito di un'attività commerciale, indipendentemente dal fatto che sia nuovo, usato o rimesso a nuovo.
Tale definizione non si applica ai prodotti usati forniti come pezzi d'antiquariato o come prodotti da riparare o da rimettere a nuovo prima dell'utilizzazione, purché il fornitore ne informi chiaramente la persona cui fornisce il prodotto;
b) «prodotto sicuro»: qualsiasi prodotto che, in condizioni di uso normali o ragionevolmente prevedibili, compresa la durata e, se del caso, la messa in servizio, l'installazione e le esigenze di manutenzione, non presenti alcun rischio oppure presenti unicamente rischi minimi, compatibili con l'impiego del prodotto e considerati accettabili nell'osservanza di un livello elevato di tutela della salute e della sicurezza delle persone, in funzione, in particolare, degli elementi seguenti:
i) delle caratteristiche del prodotto, in particolare la sua composizione, il suo imballaggio, le modalità del suo assemblaggio e, se del caso, della sua installazione e della sua manutenzione;
ii) dell'effetto del prodotto su altri prodotti, qualora sia ragionevolmente prevedibile l'utilizzazione del primo con i secondi;
iii) della presentazione del prodotto, della sua etichettatura, delle eventuali avvertenze e istruzioni per il suo uso e la sua eliminazione nonché di qualsiasi altra indicazione o informazione relativa al prodotto;
iv) delle categorie di consumatori che si trovano in condizione di rischio nell'utilizzazione del prodotto, in particolare dei bambini e degli anziani.
La possibilità di raggiungere un livello di sicurezza superiore o di procurarsi altri prodotti che presentano un rischio minore non costituisce un motivo sufficiente per considerare un prodotto come «non sicuro» o «pericoloso»;
c) «prodotto pericoloso»: qualsiasi prodotto che non risponda alla definizione di «prodotto sicuro» di cui alla lettera b);
d) «rischio grave»: qualsiasi rischio grave, compresi quelli i cui effetti non sono immediati, che richieda un intervento rapido delle autorità pubbliche;
e) «produttore»:
i) il fabbricante del prodotto stabilito nella Comunità, e qualsiasi altra persona che si presenti come fabbricante apponendo sul prodotto il proprio nome, il proprio marchio o un altro segno distintivo, o colui che rimette a nuovo il prodotto;
ii) il rappresentante del fabbricante se quest'ultimo non è stabilito nella Comunità o, qualora non vi sia un rappresentante stabilito nella Comunità, l'importatore del prodotto;
iii) gli altri operatori professionali della catena di commercializzazione nella misura in cui la loro attività possa incidere sulle caratteristiche di sicurezza dei prodotti;
f) «distributore»: qualsiasi operatore professionale della catena di commercializzazione, l'attività del quale non incide sulle caratteristiche di sicurezza dei prodotti;
g) «richiamo»: le misure volte ad ottenere la restituzione di un prodotto pericoloso che il fabbricante o il distributore ha già fornito o reso disponibile ai consumatori;
h) «ritiro»: qualsiasi misura volta a impedire la distribuzione e l'esposizione di un prodotto pericoloso, nonché la sua offerta al consumatore.
Obbligo generale di sicurezza, valutazione di conformità, criteri e norme europee
Articolo 3
1. I produttori sono tenuti ad immettere sul mercato soltanto prodotti sicuri.
2. Un prodotto è considerato sicuro, per quanto concerne gli aspetti disciplinati dalla pertinente normativa nazionale, quando in mancanza di disposizioni comunitarie specifiche che ne disciplinano la sicurezza, è conforme alle normative nazionali specifiche dello Stato membro nel cui territorio è commercializzato, che sono stabilite nel rispetto del trattato, in particolare degli articoli 28 e 30, e che fissano i requisiti cui deve rispondere il prodotto sul piano sanitario e della sicurezza per poter essere commercializzato.
Si presume che un prodotto sia sicuro, per quanto concerne i rischi e le categorie di rischi disciplinati dalla pertinente normativa nazionale, quando è conforme alle norme nazionali non cogenti che recepiscono le norme europee, i cui riferimenti sono stati pubblicati dalla Commissione nella Gazzetta ufficiale delle Comunità europee a norma dell'articolo 4. Gli Stati membri pubblicano i riferimenti di tali norme nazionali.
3. In circostanze diverse da quelle di cui al paragrafo 2, si valuta la conformità di un prodotto all'obbligo generale di sicurezza tenendo conto in particolare, se esistono, dei seguenti elementi:
a) norme nazionali non cogenti che recepiscono norme europee pertinenti diverse da quelle di cui al paragrafo 2;
b) norme in vigore nello Stato membro in cui il prodotto è commercializzato;
c) raccomandazioni della Commissione relative ad orientamenti sulla valutazione della sicurezza dei prodotti;
d) codici di buona condotta in materia di sicurezza dei prodotti vigenti nel settore interessato;
e) ultimi ritrovati della tecnica;
f) sicurezza che i consumatori possono ragionevolmente attendere.
4. La conformità di un prodotto ai criteri volti a garantire l'obbligo generale di sicurezza, in particolare alle disposizioni di cui ai paragrafi 2 o 3 non vieta alle autorità competenti degli Stati membri di adottare le opportune misure per limitarne l'immissione sul mercato o chiederne il ritiro dal mercato o il richiamo qualora, nonostante tale conformità, il prodotto si riveli pericoloso.
Altri obblighi dei produttori ed obblighi dei distributori
Articolo 5
1. I produttori devono, nei limiti delle rispettive attività, fornire al consumatore le informazioni pertinenti che gli consentano di valutare i rischi inerenti ad un prodotto durante la durata di utilizzazione normale o ragionevolmente prevedibile del medesimo, allorché questi ultimi non siano immediatamente percettibili senza adeguate avvertenze, e di premunirsi contro detti rischi.
La presenza di tali avvertenze non esenta dal rispetto degli altri obblighi previsti nella presente direttiva.
Sempre nei limiti delle rispettive attività, i produttori devono adottare misure proporzionate, in funzione delle caratteristiche dei prodotti da essi forniti, onde
a) essere informati sui rischi che tali prodotti potrebbero presentare;
b) intraprendere le azioni opportune, compresi, se necessario per evitare tali rischi, il ritiro dal mercato, l'informazione appropriata ed efficace dei consumatori e il richiamo del prodotto.
Le misure di cui al terzo comma comprendono, ad esempio:
a) l'indicazione, in base al prodotto o al suo imballaggio, dell'identità e degli estremi del produttore nonché del riferimento del prodotto o, eventualmente, della partita di prodotti di cui fa parte, salvo nei casi l'omissione di tale indicazione sia giustificata; e
b) quando opportuno, i controlli a campione sui prodotti commercializzati, l'esame dei reclami e, se del caso, la tenuta di un registro degli stessi, nonché l'informazione del produttore ai distributori in merito a tale sorveglianza.
Le azioni, di cui al terzo comma, lettera b), hanno luogo su base volontaria o su richiesta delle competenti autorità a norma dell'articolo 8, paragrafo 1, lettera f). Il richiamo interviene come ultimo rimedio, quando altre azioni non siano sufficienti a prevenire i rischi del caso, ove i produttori la ritengano necessaria oppure vi siano tenuti in seguito a provvedimenti dell'autorità competente. Essa può aver luogo nell'ambito dei codici di buona condotta in materia nello Stato membro interessato, se previsti.
2. I distributori sono tenuti ad agire con diligenza per contribuire all'osservanza degli obblighi di sicurezza pertinenti, in particolare sono tenuti a non fornire prodotti che sappiano oppure che avrebbero dovuto sapere, in base alle informazioni in loro possesso ed in quanto operatori professionali, non conformi a tali obblighi. Inoltre, essi devono, nei limiti delle rispettive attività, partecipare ai controlli della sicurezza dei prodotti immessi sul mercato, in particolare trasmettendo le informazioni concernenti i rischi dei prodotti, conservando e fornendo la documentazione atta a rintracciare l'origine dei prodotti e collaborando alle azioni intraprese da produttori e autorità competenti per evitare tali rischi. Entro i limiti delle rispettive attività, devono adottare le misure che consentano loro un'efficace collaborazione.
3. Qualora i produttori e i distributori sappiano o debbano sapere sulla base delle informazioni in loro possesso e in quanto operatori professionali, che un prodotto da loro immesso sul mercato presenta per il consumatore rischi incompatibili con l'obbligo generale di sicurezza, essi informano immediatamente le autorità competenti degli Stati membri alle condizioni stabilite dall'allegato I, precisando in particolare le azioni intraprese per prevenire i rischi per i consumatori.
La Commissione adatta i requisiti specifici di tale obbligo di informazione che figurano nell’allegato I. Tali misure, intese a modificare elementi non essenziali della presente direttiva completandola, sono adottate secondo la procedura di regolamentazione con controllo di cui all’articolo 15, paragrafo 5.
4. Nei limiti delle rispettive attività, produttori e distributori collaborano con le autorità competenti, ove richiesto dalle medesime, in ordine alle azioni intraprese per evitare i rischi presentati dai prodotti che essi forniscono o hanno fornito. Le procedure di tale collaborazione, comprese le procedure di dialogo con i produttori e i distributori interessati in merito ad aspetti connessi alla sicurezza dei prodotti, sono stabilite dalle autorità competenti.[/panel]
Fig. 4– Obblighi principali produttore
[box-info]Codice del consumo
Il Decreto Legislativo 6 settembre 2005, n. 206 (Codice del Consumo) ha disposto (con l'art. 146, comma 1, lettera o) l'abrogazione del Decreto Legislativo 21 maggio 2004 n.172 attuazione della Direttiva 2001/95/CE.
G.U. n.235 08/10/2005, SO n.162
...
Art. 146. Abrogazioni
1. Dalla data di entrata in vigore del presente codice sono abrogati:
...
o) il decreto legislativo 21 maggio 2004, n. 172, recante attuazione della Direttiva 2001/95/CE, relativa alla sicurezza generale dei prodotti;
Articoli che recepiscono la Direttiva 2001/95/CE
Art. 102. Finalità e campo di applicazione
Art. 103. Definizioni
Art. 104. Obblighi del produttore e del distributore
Art. 105. Presunzione e valutazione di sicurezza
Art. 106. Procedure di consultazione e coordinamento
Art. 107. Controlli
Art. 108. Disposizioni procedurali
Art. 109. Sorveglianza del mercato
Art. 110. Notificazione e scambio di informazioni
Art. 111. Responsabilità del produttore
Art. 112. Sanzioni
Art. 113. Rinvio
Allegato II[/box-info]
© Certifico S.r.l.
Rev. 0.0 2020 (Direttiva 2001/95/CE)
Collegati
[box-note]Direttiva 2001/95/CE Sicurezza Generale Prodotti
Codice del Consumo[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dichiarazione conformità Direttiva 2001 95 CE.docx Certifico Srl - Rev. 00 2020 |
74 kB | 69 |
D.P.R. 24 maggio 1988 n. 224
D.P.R. 24 maggio 1988, n. 224
Attuazione della direttiva CEE n. 85/374 relativa al ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri in materia di responsabilità per danno da prodotti difettosi, ai sensi dell'art. 15 della legge 16 aprile 1987, n. 183.
(G.U. n. 146 del 23 giugno 1988, S.O. n. 56)
Decreto abrogato dal D.Lgs. 6 settembre 2005 n. 206 (Codice del Consumo)
Collegati
[box-note]Direttiva 85/374/CEE
Direttiva 1999/34/CE
Direttiva 2001/95/CE Sicurezza Generale Prodotti
Codice del Consumo[/box-note]
Responsabilità prodotti difettosi: Quadro normativo
Responsabilità prodotti difettosi: Quadro normativo / Update Rev. 1.0 2024
ID 11931 | 31.01.2024 / In allegato documento completo
Nell'UE, i consumatori possono richiedere il risarcimento dei danni causati da prodotti difettosi. Dal 1985, le norme sulla responsabilità del prodotto mirano a mantenere un giusto equilibrio tra gli interessi dei consumatori e dei produttori.
[box-note]Update Rev. 1.0 del 31.01.2024
- Regolamento (UE) 2023/988 del Parlamento europeo e del Consiglio del 10 maggio 2023 relativo alla sicurezza generale dei prodotti, che modifica il regolamento (UE) n. 1025/2012 del Parlamento europeo e del Consiglio e la direttiva (UE) 2020/1828 del Parlamento europeo e del Consiglio, e che abroga la direttiva 2001/95/CE del Parlamento europeo e del Consiglio e la direttiva 87/357/CEE del Consiglio. (GU L 135/1 del 23.5.2023)
- Proposta di nuova direttiva sulla responsabilità per danno da prodotti difettosi
- Aggiornamenti grafici[/box-note]
Legislazione UE sulla responsabilità per prodotti difettosi:
Se un prodotto difettoso causa danni fisici ai consumatori o alla loro proprietà, il produttore deve fornire un risarcimento indipendentemente dal fatto che vi sia negligenza o colpa da parte sua.
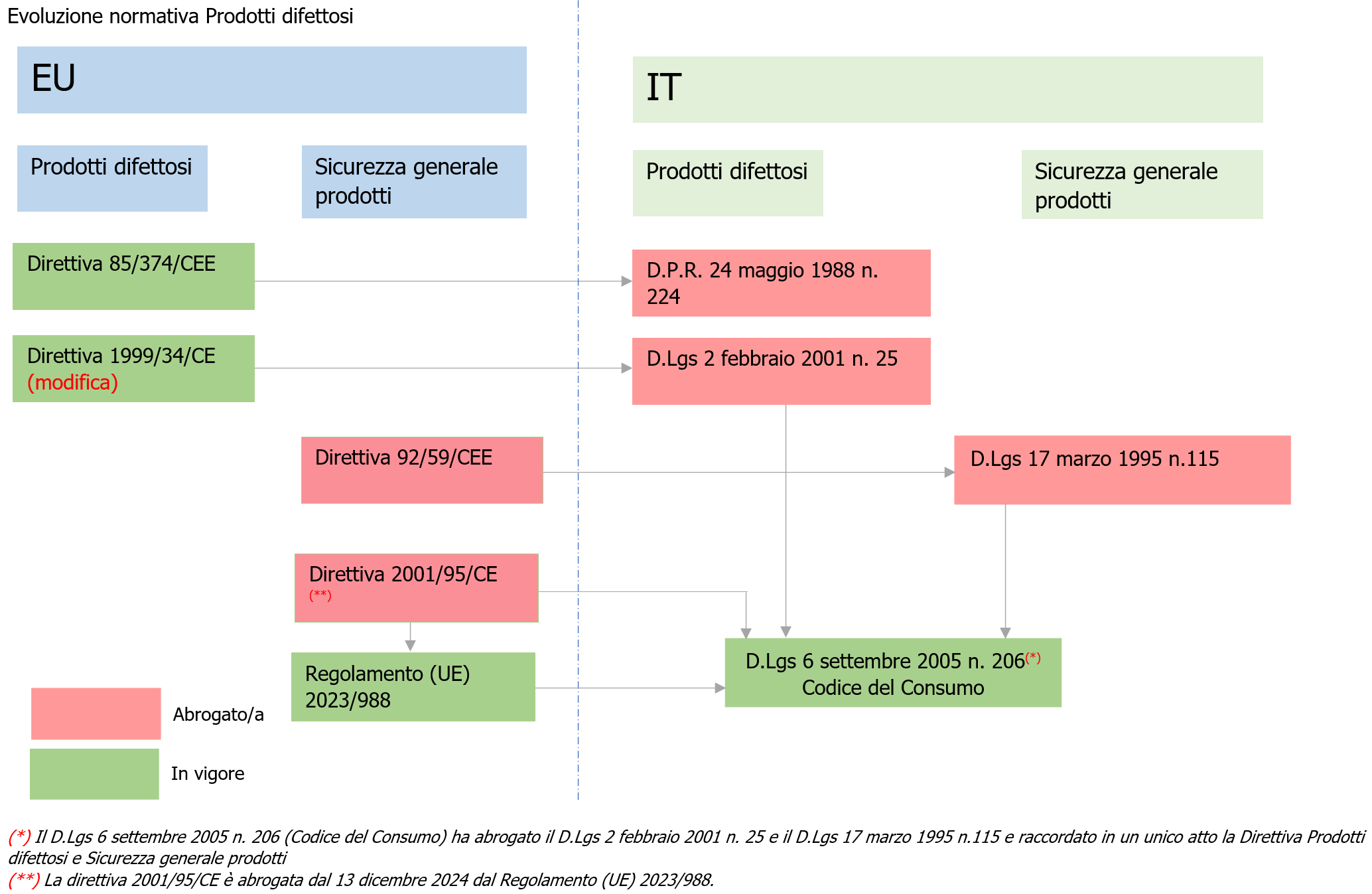
- La direttiva 85/374/CEE sulla responsabilità per danno da prodotti difettosi è stata adottata nel 1985.
- La direttiva 1999/34/CE ha esteso la portata della responsabilità ai prodotti dell'agricoltura e della pesca.
Questa legislazione si applica a qualsiasi prodotto commercializzato nello Spazio economico europeo. Il risarcimento del danno materiale è limitato ai beni per uso privato o consumo con una soglia inferiore di 500 euro. Stabilisce un termine di 3 anni per il risarcimento dei danni e vieta clausole che limitano o escludono la responsabilità del produttore. È responsabilità della parte lesa provare il danno, il difetto e la relazione causale tra difetto e danno ai fini del risarcimento.
Diritti dei produttori
I produttori possono essere esentati dalla responsabilità a determinate condizioni, in particolare se dimostrano che:
- non hanno messo in circolazione il prodotto
- il difetto era dovuto alla conformità del prodotto a norme cogenti emanate da pubbliche autorità
- lo stato delle conoscenze scientifiche o tecniche al momento della messa in circolazione del prodotto non ha potuto rilevare il difetto.
Azioni della Commissione
La Commissione europea segue l'evoluzione della giurisprudenza della Corte di giustizia dell'UE, analizza le informazioni e le denunce ricevute e riferisce ogni cinque anni sull'applicazione della direttiva al Consiglio dell'Unione europea e al Parlamento europeo. Sono già state presentate cinque relazioni di candidatura. La quinta relazione, relativa al periodo 2011-2015, è stata presentata nel 2018.
In questo contesto, la Commissione ha effettuato una valutazione formale della direttiva 85/374/CEE supportata da uno studio esterno. Questa valutazione è una valutazione basata su prove per stabilire se la direttiva continui a essere uno strumento adeguato e continui a raggiungere i suoi obiettivi oggi, anche alla luce dei nuovi sviluppi tecnologici.
Nell'ambito della valutazione, la Commissione ha avviato una consultazione pubblica sulla valutazione della direttiva 85/374/CEE. Lo scopo di questa consultazione era raccogliere il feedback delle parti interessate sull'applicazione e le prestazioni della direttiva, compreso il modo in cui questo si collega alle sfide sollevate dai nuovi sviluppi tecnologici.
La Commissione ha istituito un gruppo di esperti sulla responsabilità e le nuove tecnologie. Il gruppo ha due formazioni. La "formazione sulla responsabilità per danno da prodotti difettosi" aiuterà la Commissione a elaborare orientamenti sulla direttiva. La "formazione di nuove tecnologie" valuterà le implicazioni delle tecnologie digitali emergenti per i più ampi quadri di responsabilità a livello nazionale e dell'UE.
Nel 2020 la Commissione ha pubblicato una relazione sulle più ampie implicazioni, potenziali lacune e orientamenti per i quadri di responsabilità e sicurezza per l'intelligenza artificiale, l'Internet degli oggetti e la robotica.
[...]
Proposta di nuova direttiva sulla responsabilità per danno da prodotti difettosi
Il 28 settembre 2022 la Commissione europea ha presentato una proposta (2022/0302 (COD)) di nuova direttiva sulla responsabilità per danno da prodotti difettosi che abrogherà la direttiva 85/374/CEE.
Status procedimento: 24.01.2024 Discussione al Consiglio europeo in prima lettura (ST 5809 2024 INIT).
L'obiettivo della direttiva sulla responsabilità per danno da prodotti difettosi è fornire un sistema a livello di UE per il risarcimento delle persone che subiscono lesioni fisiche o danni patrimoniali a causa di prodotti difettosi. Dall'adozione della direttiva sulla responsabilità per danno da prodotti difettosi nel 1985 si sono verificati cambiamenti significativi nelle modalità di fabbricazione, distribuzione e funzionamento dei prodotti, compresa la modernizzazione delle norme in materia di sicurezza dei prodotti e di vigilanza del mercato. La duplice transizione verde e digitale è in atto e comporta enormi vantaggi per la società e l'economia europee, ad esempio prolungando la vita di materiali e prodotti, come avviene attraverso la rifabbricazione, o aumentando la produttività e la convenienza grazie ai prodotti intelligenti e all'intelligenza artificiale.
La valutazione della direttiva sulla responsabilità per danno da prodotti difettosi, effettuata nel 2018 nel quadro del programma di controllo dell'adeguatezza e dell'efficacia della regolamentazione (REFIT) della Commissione, ha permesso di concludere che, nel complesso, tale direttiva si è rivelata uno strumento efficace e pertinente. Tuttavia la direttiva presentava anche numerose carenze:
- non era chiaro sul piano giuridico in che modo applicare le definizioni e i concetti vecchi di decenni della direttiva sulla responsabilità per danno da prodotti difettosi a prodotti della moderna economia digitale e dell'economia circolare (ad es. software e prodotti che necessitano di software o servizi digitali per funzionare, quali dispositivi intelligenti e veicoli autonomi);
- l'onere della prova (ossia la necessità di provare, per ottenere il risarcimento, che il prodotto era difettoso e che questo ha provocato il danno subito) era gravoso per le persone danneggiate nei casi complessi (ad es. quelli concernenti prodotti farmaceutici o prodotti intelligenti o basati sull'IA);
- la normativa limitava eccessivamente la possibilità di presentare domande di risarcimento (ad es. i danni patrimoniali di valore inferiore a 500 EUR semplicemente non sono recuperabili a norma della direttiva sulla responsabilità per danno da prodotti difettosi).
Le carenze della direttiva nel campo delle tecnologie digitali emergenti sono state ulteriormente analizzate nel Libro bianco sull'intelligenza artificiale (IA), nella relazione di accompagnamento in materia di responsabilità da intelligenza artificiale, Internet delle cose e robotica e nella relazione del gruppo di esperti in materia di responsabilità e nuove tecnologie. Il Parlamento europeo ha messo in evidenza anche la necessità di norme in materia di responsabilità adeguate al mondo digitale, per garantire un livello elevato di protezione effettiva dei consumatori nonché la parità di condizioni e la certezza giuridica per tutte le imprese, evitando nel contempo costi e rischi elevati per le piccole e medie imprese (PMI) e le start-up.
La revisione della direttiva sulla responsabilità per danno da prodotti difettosi mira a garantire il funzionamento del mercato interno, la libera circolazione delle merci, una concorrenza non falsata tra operatori di mercato e un elevato livello di protezione della salute e dei beni dei consumatori.
Nello specifico la presente proposta ha le seguenti finalità:
- garantire che le norme sulla responsabilità riflettano la natura e i rischi dei prodotti nell'era digitale e nell'economia circolare;
- garantire che esista sempre un'impresa con sede nell'UE che possa essere ritenuta responsabile per i prodotti difettosi acquistati direttamente da fabbricanti al di fuori dell'UE, alla luce della crescente tendenza dei consumatori ad acquistare prodotti direttamente da paesi terzi senza che vi sia un fabbricante o un importatore con sede nell'UE;
- alleggerire l'onere della prova nei casi complessi e allentare le limitazioni alla presentazione di domande di risarcimento, garantendo nel contempo un giusto equilibrio tra i legittimi interessi di fabbricanti, danneggiati e consumatori in generale; e
- garantire la certezza del diritto migliorando l'allineamento della direttiva sulla responsabilità per danno da prodotti difettosi con il nuovo quadro legislativo istituito dalla decisione n. 768/2008/CE e con le norme in materia di sicurezza dei prodotti, nonché codificando la giurisprudenza attinente alla direttiva sulla responsabilità per danno da prodotti difettosi.
La nuova direttiva proposta sulla responsabilità estende la definizione di "prodotto" al software e ai file per la fabbricazione digitale. In ragione della crescente complessità tecnica di molti prodotti, gli Stati membri devono inoltre garantire che la persona danneggiata che chiede un risarcimento dinanzi a un organo giurisdizionale nazionale abbia accesso a elementi di prova pertinenti a disposizione del fabbricante sulle modalità di fabbricazione del prodotto.
Economia circolare
Nell'economia circolare, i prodotti sono concepiti per essere più durevoli, riutilizzabili, riparabili e facili da migliorare. Quando un prodotto subisce modifiche sostanziali e viene messo a disposizione sul mercato o rimesso in servizio, è considerato un prodotto nuovo. La nuova direttiva stabilisce che, se le modifiche non sono apportate dal fabbricante originario, la persona che ha apportato le modifiche sostanziali sia ritenuta responsabile in qualità di fabbricante del prodotto modificato.
Prodotti acquistati da fabbricanti di paesi terzi
Poiché i consumatori acquistano in misura crescente da fabbricanti con sede al di fuori dell'UE, la nuova direttiva sulla responsabilità prevede per i prodotti difettosi provenienti da fabbricanti di paesi terzi lo stesso livello di protezione accordato nel caso di prodotti difettosi di fabbricanti dell'UE. Essa dispone che l'importatore del prodotto difettoso, il rappresentante autorizzato del fabbricante o, in ultima istanza, il fornitore di servizi di logistica (un'impresa che si occupa generalmente dell'immagazzinamento, dell'imballaggio e della spedizione di un prodotto) possano essere ritenuti responsabili per i danni.
Termine di scadenza più lungo
Il diritto al risarcimento scade dopo 10 anni dall'immissione sul mercato del prodotto difettoso. Nei casi in cui i sintomi di lesioni personali tardino a manifestarsi, il termine di scadenza è di 20 anni - un termine più lungo rispetto alla proposta iniziale della Commissione di 15 anni.
Onere della prova
Uno degli obiettivi della direttiva è garantire ai consumatori un'equa possibilità di ottenere un risarcimento nei casi complessi. Il Consiglio ha pertanto razionalizzato le presunzioni che si applicano quando un attore incontra difficoltà eccessive, in particolare a causa della complessità tecnica o scientifica del caso.
In tali circostanze, l'attore è tenuto unicamente a dimostrare la probabilità che il prodotto fosse difettoso oppure che il carattere difettoso dello stesso è una causa probabile del danno.
[...]
Regolamento (UE) 2023/988 - Nuovo Regolamento Sicurezza Generale dei Prodotti (GSPR)
Regolamento (UE) 2023/988
del Parlamento europeo e del Consiglio del 10 maggio 2023 relativo alla sicurezza generale dei prodotti, che modifica il regolamento (UE) n. 1025/2012 del Parlamento europeo e del Consiglio e la direttiva (UE) 2020/1828 del Parlamento europeo e del Consiglio, e che abroga la direttiva 2001/95/CE del Parlamento europeo e del Consiglio e la direttiva 87/357/CEE del Consiglio. (GU L 135/1 del 23.5.2023)
Entrata in vigore: 12.05.2023
Applicazione dal 13.12.2024
La direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti è abrogata dal 13 dicembre 2024
Il Regolamento (UE) 2023/988 fornisce un elevato livello di tutela dei consumatori e condizioni di parità per le imprese, migliorando in tal modo il funzionamento del mercato interno dell’Unione europea (Unione).
A tal fine, sostituisce l’attuale direttiva generale sulla sicurezza dei prodotti e l’attuale direttiva sui prodotti che imitano i prodotti alimentari, che garantiscono la sicurezza dei beni di consumo venduti sia offline che online.
Qualsiasi decisione adottata a norma del Regolamento (UE) 2023/988, la quale limiti l’immissione o la messa a disposizione sul mercato di un prodotto o ne imponga il ritiro o il richiamo non incide sulla valutazione, sotto il profilo delle disposizioni del diritto nazionale applicabile nella fattispecie, della responsabilità della parte cui essa è destinata.
Il regolamento fa salva la direttiva 85/374/CEE del Consiglio.
Il regolamento:
- si applica ai prodotti nuovi, utilizzati, riparati o ricondizionati:
-- disponibili per la distribuzione, il consumo o l’utilizzo nell’Unione («immissione o messa a disposizione sul mercato»), gratuitamente o dietro corrispettivo, che non sono coperti da altre normative specifiche in materia di sicurezza dei prodotti dell’Unione;
-- soggetti agli specifici requisiti di sicurezza dell’Unione esistenti per quanto riguarda i rischi e gli aspetti che non sono già in esso contenuti;
-- si applica ai prodotti offerti ai consumatori nell’Unione attraverso tutti i canali di vendita;
- non si applica a quanto segue:
-- medicinali per uso umano o veterinario;
-- prodotti alimentari e mangimi;
-- piante e animali vivi, organismi geneticamente modificati e microrganismi soggetti a uso confinato;
sottoprodotti di origine animale;
-- prodotti fitosanitari;
-- attrezzature di trasporto gestite da un fornitore di servizi;
-- aeromobili la cui progettazione, produzione, manutenzione e funzionamento comportano un basso rischio per la sicurezza;
-- oggetti d’antiquariato;
-- prodotti chiaramente indicati come da riparare o da rimettere a nuovo prima di essere utilizzati.
Il regolamento stabilisce gli obblighi a carico degli operatori economici* interessati e dei fornitori di mercati online. Inoltre, chiarisce le regole di vigilanza del mercato e i poteri delle autorità nazionali. È strettamente connesso ad altre normative dell’Unione pertinenti, come il regolamento sulla vigilanza del mercato e il regolamento sui servizi digitali.
Il regolamento sarà implementato da tutti gli attori interessati, tenendo conto del principio di precauzione.
Requisiti di sicurezza
Gli operatori economici immetteranno o metteranno a disposizione sul mercato soltanto prodotti sicuri (requisito di sicurezza generale).
La sicurezza dei prodotti deve essere valutata tenendo conto, in particolare, dei seguenti criteri:
- le caratteristiche del prodotto, quali progettazione, caratteristiche tecniche, composizione, imballaggio e istruzioni;
- l’effetto su altri prodotti;
- la presentazione del prodotto, l’etichettatura, le avvertenze e le istruzioni e informazioni sulla sicurezza;
- le categorie di consumatori che utilizzano il prodotto;
- l’aspetto del prodotto, in particolare gli aspetti legati all’imitazione di prodotti alimentari o all’attrattività per i bambini;
- le caratteristiche di cibersicurezza e tutte le funzionalità evolutive, di apprendimento e predittive del prodotto.
Il regolamento prevede inoltre casi in cui si presume che un prodotto sia sicuro. Tali casi includono prodotti conformi alle norme europee pertinenti citate nella Gazzetta ufficiale dell’Unione europea.
Altri elementi che possono essere presi in considerazione per valutare la sicurezza di un prodotto sono le norme nazionali e internazionali, i sistemi di certificazione volontaria, i codici di buona condotta e le ragionevoli aspettative dei consumatori.
Informazioni sui prodotti non sicuri
Si presume che un prodotto considerato pericoloso in uno Stato membro dell’Unione sia pericoloso anche in tutti gli altri.
Quando viene richiamato un prodotto, le informazioni devono essere messe a disposizione del pubblico in una lingua chiara e dettagliata e i consumatori hanno diritto a un rimedio efficace, privo di costi e tempestivo.
In generale, le informazioni sui prodotti pericolosi devono essere messe a disposizione del pubblico tramite il portale Safety Gate.
Obbligo di avere un operatore economico responsabile nell’Unione
Per ciascun prodotto che rientra nell’ambito di applicazione del regolamento, deve esistere un operatore economico responsabile nell’Unione (un fabbricante, un importatore, un rappresentante autorizzato o un prestatore di servizi di logistica dell’Unione) incaricato di svolgere compiti relativi alla sicurezza del prodotto.
Principali obblighi dei fabbricanti:
- garantire che i prodotti siano sicuri sin dalla progettazione;
- effettuare analisi interne dei rischi e redigere la documentazione tecnica pertinente;
- agire immediatamente e informare i consumatori e le autorità nazionali tramite il portale Safety Business Gateway se ritengono che un prodotto sul mercato sia pericoloso;
- condividere informazioni sugli incidenti;
- fornire le informazioni essenziali sulla sicurezza e sulla tracciabilità dei prodotti o del loro imballaggio;
- fornire i dati di contatto per ricevere i reclami, studiarli e tenere un registro interno di tali reclami.
I fabbricanti possono nominare un rappresentante autorizzato per adempiere ai propri obblighi.
Principali obblighi degli importatori
- garantire che i prodotti siano conformi ai requisiti sulla sicurezza generale del regolamento, rifiutando l’immissione sul mercato di qualsiasi di questi che ritengano non soddisfi tali requisiti;
- fornire i loro dati di contatto sui prodotti e verificare che siano accompagnati da istruzioni e informazioni di sicurezza chiare;
- assumersi la responsabilità degli articoli di cui si stanno prendendo cura durante le fasi di trasporto e conservazione;
- informare i fabbricanti e le autorità nazionali di vigilanza del mercato tramite il Safety Business Gateway se ritengono che sia presente un prodotto pericoloso nel mercato e garantire che il pubblico ne venga informato.
Principali obblighi dei distributori:
- garantire che i produttori e, ove applicabile, gli importatori rispettino i requisiti del regolamento, rifiutando l’immissione sul mercato di qualsiasi prodotto che ritengano non soddisfi tali requisiti;
- informare i fabbricanti, gli importatori e le autorità di vigilanza nazionali tramite il Safety Business Gateway se ritengono che sia presente un prodotto pericoloso nel mercato e garantire che venga intrapresa una misura adeguata.
Obblighi orizzontali degli operatori economici:
- istituire processi interni di sicurezza dei prodotti per conformarsi al regolamento;
- cooperare con le autorità di vigilanza del mercato per eliminare o attenuare i rischi derivanti da qualsiasi prodotto immesso sul mercato;
- su richiesta delle autorità, fornire informazioni specifiche sul prodotto (rischi, reclami, misure correttive) per dieci anni e informazioni sulla tracciabilità della catena di fornitura per sei anni;
- informare le autorità in merito agli incidenti causati da un prodotto;
- fornire dati a un sistema di tracciabilità che la Commissione europea può istituire per conservare i dettagli dei prodotti che potrebbero presentare un grave rischio per la salute e la sicurezza pubblica;
- informare direttamente tutti i consumatori interessati in merito ai richiami per la sicurezza dei prodotti e alle avvertenze sulla sicurezza, nel caso in cui un prodotto venga richiamato utilizzando un modello di avviso di richiamo obbligatorio;
- offrire ai consumatori la scelta di almeno due dei seguenti rimedi quando un prodotto viene richiamato: riparazione o sostituzione del prodotto, oppure un rimborso adeguato;
- seguire norme specifiche per la vendita a distanza fornendo, nell’ambito dell’offerta di prodotti precontrattuali, dettagli del produttore o del suo rappresentante, una descrizione chiara del prodotto e qualsiasi avvertenza o informazione sulla sicurezza, come avverrebbe in un negozio fisico.
Obblighi specifici dei fornitori di mercati online relativi alla sicurezza dei prodotti
I seguenti obblighi specifici per prodotto si basano sui requisiti orizzontali del regolamento sui servizi digitali:
- attuare due punti di contatto unici per la comunicazione diretta in materia di sicurezza: uno per le autorità di sorveglianza del mercato, l’altro per il pubblico;
- registrarsi nel portale Safety Gate;
- predisporre processi interni di sicurezza dei prodotti;
- garantire che, senza una garanzia minima di sicurezza dei prodotti e le informazioni sulla tracciabilità, che devono essere fornite dal relativo operatore, non possa essere pubblicato un elenco (conformità mediante obbligo di progettazione);
- verificare in modo casuale se i prodotti offerti sono sicuri utilizzando banche dati pubbliche, compreso il portale Safety Gate;
- reagire entro un termine breve agli ordini governativi e agli avvisi di terzi e garantire che gli elenchi ritirati non ricompaiano;
- fornire informazioni adeguate e tempestive ai consumatori quando un prodotto viene richiamato contattando direttamente tutti coloro che hanno acquistato l’articolo sul proprio sito e pubblicando i relativi dettagli sulla loro pagina web;
- informare, in caso di richiamo o incidente, l’operatore economico interessato e informare e cooperare con le autorità di vigilanza del mercato.
Vigilanza del mercato e attuazione
L’applicazione delle norme di sicurezza dei prodotti dell’Unione rientra nella competenza delle autorità nazionali di vigilanza del mercato.
La vigilanza del mercato ai sensi del presente regolamento e del regolamento (UE) 2019/1020 (regolamento sulla vigilanza del mercato) è allineata nella misura del possibile.
Le autorità, quando viene identificato un prodotto pericoloso, possono chiedere al produttore i dettagli di altri articoli che utilizzano la stessa procedura o componenti, oppure facenti parte dello stesso lotto.
Gli Stati membri determineranno le sanzioni da irrogare in caso di violazione delle norme del presente regolamento, le quali devono essere efficaci, proporzionate e dissuasive.
La rete per la sicurezza dei consumatori delle autorità nazionali, coordinata dalla Commissione:
- facilita lo scambio regolare di informazioni, competenze e migliori pratiche e agevola l’applicazione delle norme in materia di sicurezza dei prodotti;
- organizza progetti comuni di sorveglianza e prova;
- migliora la cooperazione dell’Unione in materia di reperimento, ritiro e richiamo dei prodotti pericolosi.
Le autorità di vigilanza del mercato:
- possono cooperare con altri colleghi, operatori economici o organizzazioni di consumatori al fine di garantire la salute e la sicurezza pubblica in presenza di specifiche categorie di prodotti;
- condurranno azioni di controllo coordinate e simultanee («indagini a tappeto») relative ai prodotti per garantire il rispetto del regolamento.
La Commissione:
- sviluppa, modernizza e mantiene il sistema di allarme rapido dell’Unione utilizzato per lo scambio di informazioni sulle misure nazionali adottate contro i prodotti non alimentari pericolosi (Safety Gate);
- mantiene un portale web (il Safety Business Gateway) che consente agli operatori economici e ai venditori attivi in mercati online di fornire alle autorità di vigilanza del mercato e al pubblico informazioni sui prodotti potenzialmente pericolosi;
- gestisce il portale Safety Gate, che fornisce al pubblico informazioni a titolo gratuito sui rischi individuati;
- può cooperare con paesi terzi e organizzazioni internazionali per migliorare la sicurezza generale dei prodotti, anche attraverso scambi di informazioni sui prodotti pericolosi;
- elabora una serie di relazioni di valutazione sull’attuazione del regolamento;
- ha il potere e l’obbligo di adottare determinati atti di esecuzione e delegati.
[...]
Fig. 1 - Evoluzione Normativa Prodotti difettosi/ Sicurezza Generale Prodotti
[box-note]Direttiva 85/374/CEE
La Direttiva 85/374/CEE: responsabilità sul prodotto stabilisce il principio della responsabilità indipendentemente dalla colpa, applicabile ai produttori europei. Se un prodotto difettoso* provoca danni al consumatore, il produttore può essere responsabile anche senza negligenza o colpa da parte sua.
Danni coperti
La direttiva si applica a danni:
- causati dalla morte o da lesioni personali;
- causati alla proprietà privata.
I paesi dell’Unione europea (UE) possono fissare un limite per la responsabilità totale di un produttore in caso di morte o di lesione personale derivanti da articoli identici aventi lo stesso difetto.
Responsabilità
Il termine produttore designa:
- il produttore di una materia prima, il fabbricante di un prodotto finito o di una parte componente;
- l’importatore del prodotto;
- qualsiasi persona che appone il proprio nome, marchio o altro segno distintivo sul prodotto;
- qualsiasi persona che appone il proprio nome, marchio o altro segno distintivo sul prodotto;
- qualsiasi persona che fornisce un prodotto il cui produttore o importatore non può essere identificato.
Prova del danno
Un prodotto è difettoso quando non offre la sicurezza che ci si può legittimamente attendere tenuto conto di tutte le circostanze, tra cui:
- la presentazione del prodotto;
- l’uso al quale il prodotto può essere ragionevolmente destinato;
- il momento della messa in circolazione del prodotto.
L’onere della prova spetta alla persona danneggiata. Essa deve dimostrare:
- il danno effettivo;
- un difetto nel prodotto;
- un nesso di causalità tra il danno e il difetto.
Tuttavia, essa non deve dimostrare la negligenza o la colpa del produttore o dell’importatore.
Esclusione di responsabilità
Una serie di fattori può esonerare il produttore dalla responsabilità, nel caso in cui:
- non abbia messo in circolazione il prodotto;
- il difetto sia comparso dopo che il prodotto è stato messo in circolazione;
- il prodotto non sia stato fabbricato per essere venduto o distribuito a scopo di lucro;
- il prodotto non sia stato fabbricato o distribuito per qualsiasi scopo nel quadro delle normali operazioni e pratiche della sua attività;
- il difetto sia dovuto alla conformità del prodotto rispetto a norme vincolanti emanate da autorità pubbliche;
- il difetto di un componente sia stato causato durante la fabbricazione di un prodotto finale.
Quando il danneggiato ha colpa, la responsabilità del produttore può essere ridotta.
Scadenza della responsabilità
- Il danneggiato dispone di tre anni entro i quali chiedere un risarcimento. Il periodo decorre dalla data in cui il danneggiato ha avuto conoscenza del danno, del difetto e dell’identità del produttore.
- Il produttore non è più responsabile dopo dieci anni dalla data di immissione sul mercato del prodotto.
- Nessuna clausola contrattuale può permettere al produttore di limitare la sua responsabilità in relazione alla persona danneggiata.
Direttiva 85/374/CEE del Consiglio, del 25 luglio 1985, relativa al ravvicinamento delle disposizioni legislative, regolamentari ed amministrative degli Stati membri in materia di responsabilità per danno da prodotti difettosi (GU L 210/29 del 7.8.1985)[/box-note]
Segue in allegato
Certifico Srl - IT | Rev. 1.0 2024
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 1.0 | 31.01.2024 | - Regolamento (UE) 2023/988 - Proposta di nuova direttiva sulla responsabilità per danno da prodotti difettosi - Aggiornamenti grafici |
Certifico Srl |
| 0.0 | 29.10.2020 | Certifico Srl |
Collegati
[box-note]Direttiva 85/374/CEE
Direttiva 1999/34/CE
Valutazione della direttiva 85/374/CEE Prodotti difettosi
Dichiarazione di Conformità Direttiva 2001/95/CE GPSD
Codice del Consumo[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Responsabilita' Prodotti difettosi - Quadro normativo Rev. 1.0 2024.pdf Certifico Srl - Rev. 1.0 2024 |
626 kB | 57 | ||
| Responsabilita' Prodotti difettosi - Quadro normativo Rev. 00 2020.pdf Certifico Srl - Rev. 0.0 2020 |
513 kB | 110 | ||
| Communication Artificial Intelligence EC 2018.pdf |
419 kB | 33 | ||
| Working Document on liability for emerging digital technologies EC 2018.pdf |
396 kB | 32 | ||
| Quinta relazione Direttiva 1989 374 Prodotti difettosi 2018.pdf |
269 kB | 40 | ||
| Quarta relazione Direttiva 1989 374 Prodotti difettosi 2011.pdf |
53 kB | 19 | ||
| Terza relazione Direttiva 1989 374 Prodotti difettosi 2006.pdf |
154 kB | 23 | ||
| Seconda relazione Direttiva 1989 374 Prodotti difettosi 2001.pdf |
192 kB | 21 | ||
| Prima relazione Direttiva 1989 374 Prodotti difettosi 1995.pdf |
152 kB | 20 |
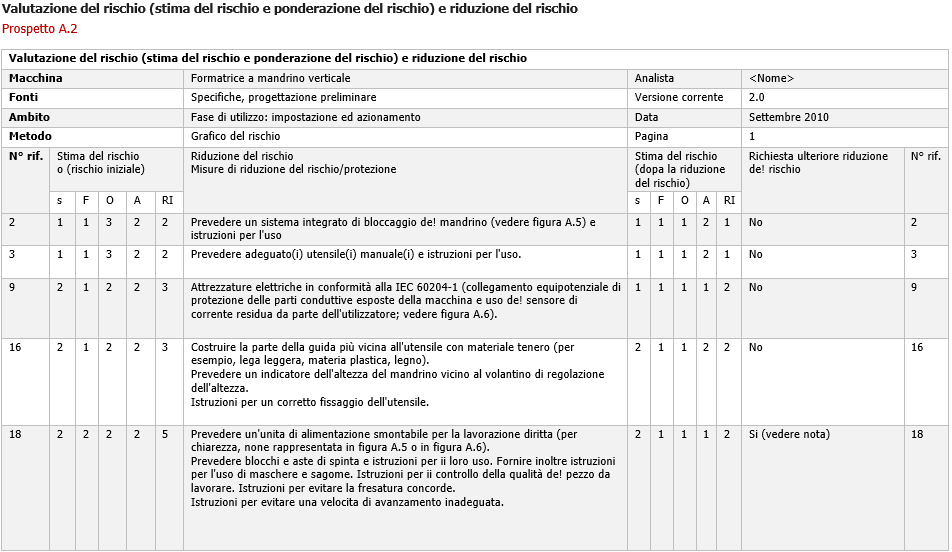
Stima del Rischio ISO/TR 14121-2 p. 6.3 Metodo grafico - Esempio e scheda
Stima del Rischio ISO/TR 14121-2 p. 6.3 Metodo grafico - Esempio e scheda
ID 11902 | 26.10.2020 / Documento completo allegato
La norma ISO/TR 14121-2 (Rapporto Tecnico) Sicurezza del macchinario Valutazione del rischio Parte 2: Guida pratica ed esempi di metodi, fornisce una guida pratica per l'esecuzione della valutazione del rischio per il macchinario in conformità alla UNI EN ISO 12100 e descrive diversi metodi e strumenti per ogni fase del processo. Fornisce esempi di differenti misure che possono essere utilizzate per ridurre il rischio ed è destinata ad essere utilizzata per la valutazione del rischio di una estesa varietà di macchinari in termini di complessità e di potenziale di danno.
I suoi utilizzatori previsti sono le persone coinvolte nella progettazione, installazione o modifica del macchinario.
Nel Documento è illustrato uno dei quattro metodi riportati nella ISO/TR 14121-2, il “Metodo grafico” o “Grafico del Rischio” (p. 6.3) con esempio / scheda di valutazione del rischio e processo di riduzione del rischio per una macchina formatrice a mandrino verticale, in cui 'identificazione dei pericoli è limitata alla fase di utilizzo e, in particolare, alla messa a punto e al funzionamento della macchina.
Il grafico del rischio utilizzato in questo esempio è equivalente alla matrice del rischio riportata in seguito.
[box-info]Metodi di Stima del Rischio ISO/TR 14121-2
Nella ISO/TR 14121-2 sono illustrati 4 metodi per la Stima del Rischio:
1. Matrice del rischio (6.2)
2. Grafico del rischio / Metodo grafico (6.3)
3. Punteggio numerico (6.4)
4. Metodo ibrido (6.5)
Si ricorda che la EN ISO 12100 demanda all'uso dei metodi illustrati nella ISO/TR 14121-2 (anche se non armonizzata) per la valutazione dei rischi relativi alle macchine:
"EN ISO 12100
...
Scopo e campo di applicazione ...L’uso pratico di diversi metodi per ogni fase della valutazione del rischio è descritto nell’ISO/TR 14121-2".[/box-info]
Fig. 0 - ISO/TR 14121-2 Metodi di Stima del rischio
_______
Excursus
Metodo grafico / Grafico del rischio
Generalità
Il metodo grafico / grafico del rischio è basato su un albero decisionale.
Ogni nodo del grafico rappresenta un parametro del rischio (gravita, esposizione, probabilità che si verifichi un evento pericoloso, evitabilità) e ogni ramo che si diparte da un nodo rappresenta una classe del parametro (per esempio bassa gravità o alta gravità).
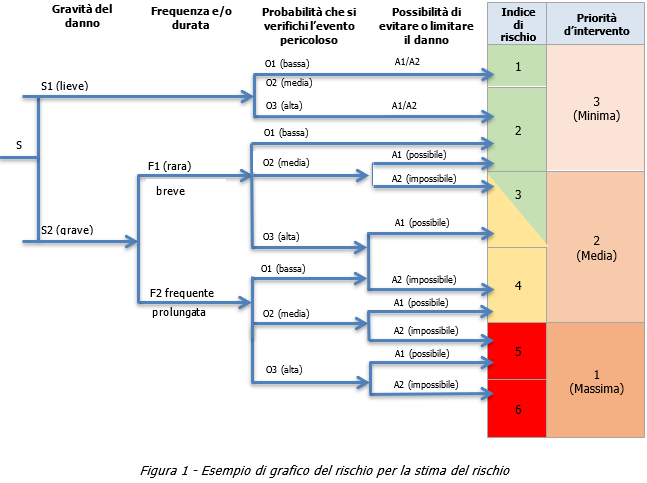
Per ogni situazione pericolosa, dovrebbe essere assegnata una classe ad ogni parametro. Si segue quindi il percorso sul grafico del rischio a partire dal punto iniziale. Ad ogni giunzione, ii percorso precede lungo un certo ramo in conformità alla classe selezionata. Il ramo finale porta al livello o all'indice di rischio associato alla combinazione delle classi (rami) scelte. Il risultato finale è una stima del rischio qualificata con termini quali "alto", "medio", "basso", un numero, per esempio, da 1 a 6, o una lettera, per esempio, da A a F.
I grafici del rischio sono utili per illustrare l'entità della riduzione del rischio associata alla misura di protezione/riduzione del rischio e al parametro di rischio che essa influenza.
I grafici del rischio diventano molto complessi e sovraffollati se ci sono più di due rami per più di un parametro del rischio. Per questa ragione, i metodi ibridi tendono a combinare un grafico del rischio con una matrice per uno dei parametri.
Esempio di uno strumento o di un metodo grafico del rischio
Prima che ii rischio sia stimato usando ii grafico del rischio, si dovrebbero descrivere ii pericolo associate, la situazione pericolosa, l'evento pericoloso e ii possibile danno in conformità al punto 5.4 della ISO 12100:2010 (vedere ii modulo vuoto fornito nel prospetto A.1). Quindi si calcola un indice del rischio usando ii grafico del rischio indicate in figura 1, sulla base dei quattro parametri seguenti, corrispondenti ai quattro elementi di rischio come definiti al punto 5.5.2.1 della ISO 12100:2010, ciascuno avente i suoi limiti particolari:
Gravita del danno: S
S1: lesione lieve (solitamente reversibile; esempi: graffi, lacerazioni, livido, leggera ferita che richiede ii pronto soccorso, ecc.) incapace di eseguire lo stesso compito per non più di due giorni;
S2: lesione grave (generalmente irreversibile, compreso ii decesso; esempi: rottura, amputazione o schiacciamento degli arti, fratture, lesioni gravi che richiedono l'applicazione di punti, gravi traumi muscoloscheletrici (MST), ecc. Incapace di eseguire lo stesso compito per più di due giorni.
Frequenza e/o durata dell'esposizione al pericolo: F
F1: da rara ad abbastanza frequente e/o breve durata di esposizione
Due volte o meno per turno di lavoro o meno di 15 min di esposizione cumulativa per turno di lavoro.
F2: da frequente a continua e/o lunga durata di esposizione
Più di due volte per turno di lavoro o più di 15 min di esposizione cumulativa per turno di lavoro.
Probabilità che si verifichi un evento pericoloso: O
O1: bassa (così improbabile da poter presumere che si possa non fare esperienza del suo verificarsi)
Tecnologia matura, collaudata e riconosciuta nell'applicazione di sicurezza, robustezza.
O2: media (probabile che si verifichi talvolta)
Guasto tecnico osservato negli ultimi due anni. Azione umana impropria da parte di una persona ben formata, consapevole del rischio e con più di sei mesi di esperienza nella stazione di lavoro.
O3: alta (probabile che si verifichi con frequenza)
Guasto tecnico osservato regolarmente (ogni sei mesi o meno). Azione umana impropria da parte di una persona non formata, con meno di sei mesi di esperienza nella stazione di lavoro.
Possibilità di evitare o limitare il danno: A
A1: possibile in alcune condizioni:
se parti si muovono a una velocità minore di 0,25 m/s e ii lavoratore esposto ha familiarità con ii rischio e con l'indicazione di una situazione pericolosa o di un evento imminente; il lavoratore ha inoltre la capacità di accorgersi della situazione pericolosa ed è in grado di reagire in presenza di particolari condizioni (temperatura, rumore, ergonomia, ecc.).
A2: impossibile.
I risultati di questa prima stima del rischio sono inseriti in un modulo; ad ogni situazione pericolosa è assegnato un indice di rischio. In questo esempio, la stima di ciascuna situazione pericolosa è eseguita considerando che:
a) un indice di rischio di 1 o 2 corrisponde al rischio minimo;
b) un indice di rischio di 3 o 4 corrisponde al rischio medio;
c) un indice di rischio di 5 o 6 corrisponde al rischio massimo.
Dopo la considerazione dei possibili mezzi per ridurre il rischio, si procede nuovamente a stimare il rischio per la progettazione finale utilizzando lo stesso grafico del rischio, così come impiegato per la progettazione iniziale.
Nota
Il modulo vuoto riportato nel prospetto A.1 può essere utilizzato per documentare i risultati della prima stima del rischio.
Conclusioni
Il metodo del grafico del rischio può essere utilizzato per stimare un indice di rischio, principalmente per le situazioni pericolose che possono causare danni acuti, (pericoli meccanici, elettrici o, in certa misura, termici). Il grafico del rischio proposto non è molto appropriato per stimare i rischi correlati ad alcuni pericoli per la salute quali il rumore o l'ergonomia. In questi casi i risultati ottenuti dovrebbero essere confrontati con i risultati ottenuti con strumenti specifici dedicati al rumore o ai fattori ergonomici.
È stato ritenuto pratico da parte di alcuni settori adattare leggermente i parametri e i limiti del grafico del rischio; questi cambiamenti potrebbero portare a risultati diversi.
Il grafico del rischio utilizzato in questo esempio è equivalente alla matrice del rischio rappresentata nella figura 2.
...
Esempio
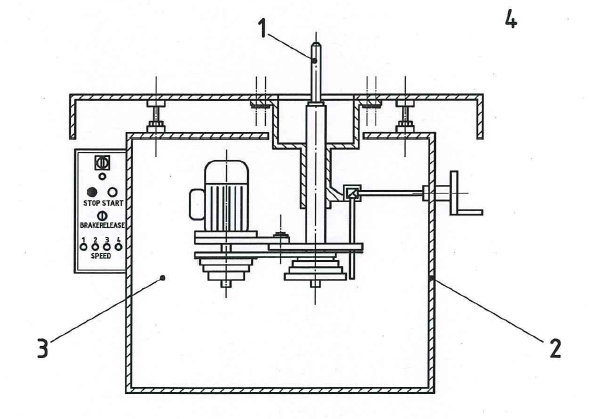
Macchina formatrice a mandrino verticale
A.1 Identificazione dei pericoli
A.1.1 Parte del sistema analizzato
L'identificazione dei pericoli è limitata, in questo esempio, alla fase di utilizzo e, in particolare, alla messa a punto e al funzionamento della macchina.
A.1.2 Attività da svolgere
Durante la messa a punto della macchina, sono da svolgere le seguenti attività:
- sostituzione dell'utensile sul mandrino fermo;
- montaggio e regolazione della guida adatta (per lavorazione diritta o per lavorazione curva);
variazione della velocità del mandrino;
- prove, alimentazione/lavorazione dei pezzi da lavorare per verificare se la profondità di taglio, la regolazione dell'altezza del mandrino, ecc. sono corrette, oppure, se necessario, per regolare nuovamente l'altezza dello strumento o la posizione della guida.
Durante il funzionamento della macchina si esegue il compito seguente: fresatura o formatura del pezzo da lavorare.
...
Nota
Tutte le attività di regolazione sono state considerate come parte della messa a punto della macchina e pertanto il funzionamento si riferisce soltanto al processo di fresatura (alimentazione manuale del pezzo da lavorare e suo mantenimento in posizione durante il processo di lavorazione).
A.1.3 Pericoli e scenari di infortunio pertinenti
Le zone pericolose sono definite come indicato in figura A.2.
A.2 Zone pericolose
Legenda
1 Zona lavoro (zona 1)
2 Telaio della macchina (zona 2)
3 Zona di trasmissione (zona 3)
4 Area circostante la macchina (zona 4)
...
Valutazione del rischio (Identificazione del pericolo)
Prospetto A.1
...
...
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]EN ISO 12100 e ISO/TR 14121-2: Esempio Valutazione del rischio
ISO TR 14121-2: Metodi per l'analisi del rischio
ISO/TR 14121-2 Risk assessment Hybrid Tool - File CEM
EN ISO 12100 Valutazione del Rischio | File CEM
EN ISO 12100: La sequenza per la Valutazione del Rischio e la documentazione prevista
Direttiva macchine 2006/42/CE
ebook Guida Tecnica Direttiva macchine Ed. 6.0 2020
ebook Direttiva macchine e Norme Tecniche Armonizzate[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Stima del Rischio ISO TR 14121-2 p. 6.3 Metodo grafico Rev. 00 2020.pdf Certifico Srl - Rev. 0.0 2020 |
404 kB | 1005 | ||
| Stima del Rischio ISO TR 14121-2 p. 6.3 Metodo grafico - Scheda Rev. 00 2020.docx Certifico Srl - Rev. 0.0 2020 |
24 kB | 604 |
RAPEX Report 41 del 09/10/2020 N. 27 A12/01346/20 Regno Unito

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 41 del 09/10/2020 N. 27 A12/01346/20 Regno Unito
Approfondimento tecnico: Anello luminoso
Il prodotto, di marca Baker Ross, mod. AR472, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 62115 “Giocattoli elettrici - Sicurezza“.
Il circuito elettrico e le batterie a bottone possono staccarsi facilmente dal giocattolo. Un bambino potrebbe metterne uno qualsiasi in bocca e rischiando di soffocare. Se ingerite, le pile a bottone possono innescare la generazione dell'idrossido di sodio altamente corrosivo nel corpo in quanto provoca gravi ustioni e danni ai tessuti.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
[…] 4. a) I giocattoli e le loro parti non devono comportare un rischio di strangolamento.
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori. […]
EN 62115 “Giocattoli elettrici - Sicurezza“.
13. Costruzione
[…] Per ridurre il rischio di ingestione delle batterie i componenti che le contengono non devo poter essere rimossi senza l’uso di uno strumento. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 41 del 09_10_2020 N. 27 A12_01346_20 Regno unito.pdf Anello luminoso |
358 kB | 0 |
RAPEX Report 40 del 02/10/2020 N. 19 A12/01312/20 Romania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 40 del 02/10/2020 N. 19 A12/01312/20 Romania
Approfondimento tecnico: Maglietta per bambini
Il prodotto, di marca Disney Baby, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla norma tecnica EN 14682:2015 - Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini – Specifiche.
Il prodotto contiene piccoli elementi decorativi che possono essere facilmente staccati. Un bambino può metterli in bocca e soffocare.
EN 14682:2015
Appendice E – Valutazione del rischio
Una valutazione del rischio in relazione alla presente norma europea deve essere effettuata tenendo in considerazione il rischio di strangolamento o intrappolamento presentato da cordoncini e stringhe nell’abbigliamento per bambini. Esempi di elementi che possono richiedere una valutazione del rischio sono:
- gli elementi di design decorativi, per esempio fiocchi, cinturini, linguette, strap ecc. devono essere tutti sottoposti ad una valutazione del rischio al fine di escludere la presenza di pericoli per colui che indossa il capo;
- i passanti funzionali applicati alla parte interna dei capi per facilitarne l’esposizione o per appenderli devono essere sottoposti ad una valutazione del rischio al fine di escludere la presenza di pericoli per colui che indossa il capo.
Nota – Altri pericoli derivanti dall’abbigliamento devono essere considerati separatamente.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 40 del 02_10_2020 N. 19 A12_01312_20 Romania.pdf Maglietta per bambini |
402 kB | 0 |
Legge 8 luglio 1950 n. 640

Legge 8 luglio 1950 n. 640
Disciplina delle bombole per metano.
(GU n.199 del 31.8.1950)
_________
Testo consolidato 2020
Modifiche/abrogazioni:
- Avviso di rettifica (in G.U. 26/11/1953, n.272)
- LEGGE 7 giugno 1990, n. 145 (in G.U. 14/06/1990, n.137)
- Decreto-Legge 16 luglio 2020 n. 76 (in SO n.24, relativo alla G.U. 16/07/2020, n.178) convertito con modificazioni dalla Legge 11 settembre 2020 n. 120 (in S.O. n. 33, relativo alla G.U. 14/09/2020, n. 228)
- Legge 11 settembre 2020 n. 120 (in SO n.33, relativo alla G.U. 14/09/2020, n.228)
Collegati:
[box-note]Materiale Corso di formazione rivenditori ed installatori di bombole GPL
Vademecum bombole GPL[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Legge 8 luglio 1950 n. 640 Testo consolidato 2020.pdf Elaborato Certifico S.r.l. Ottobre 2020 |
862 kB | 0 |
Revisione della Direttiva Macchine: Parere CESE 2020
Revisione della Direttiva Macchine: Parare CESE 2020
Riferimento: CCMI/172-EESC-2020
Il CESE accoglie con favore gli attuali sforzi della Commissione per analizzare e possibilmente migliorare le prestazioni della direttiva macchine 2006/42/CE come parte del suo programma di adeguatezza e rendimento regolamentare (REFIT).
Il CESE ritiene che la direttiva macchine sia uno strumento molto importante e di successo per l'industria europea e il suo approccio di base deve essere lasciato invariato. Sebbene il CESE concordi sulla necessità di apportare alcune modifiche, modifiche di massa alla direttiva macchine, in particolare ai requisiti essenziali di salute e sicurezza (EHSR) di cui all'allegato I, avrebbero un profondo impatto negativo sul lavoro di sviluppo delle norme armonizzate necessarie e devono essere evitate.
CESE: Comitato Economico e Sociale Europeo
Collegati
[box-note]Revisione della Direttiva macchine: primo trimestre 2021
Direttiva macchine 2006/42/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Revisione della direttiva macchine - Relazione informativa CESE 2020.pdf CESE 2020 |
158 kB | 45 |
Revisione della Direttiva macchine: primo trimestre 2021
Revisione della Direttiva macchine: Roadmap EC / Adozione primo trimestre 2021
ID 11648 | Update 30 Settembre 2020
La Roadmap per la revisione della Direttiva macchine 2016/42/CE è stata lanciata dalla Commissione Europea a Gennaio 2019 (primo step), e dovrebbe concludersi con l'adozione da parte della Commissione entro il primo trimestre 2021.
1
Primo step "Roadmap"
- Questo passaggio ha definito l'inizio della Roadmap dal 14/01/2019 al 11/02/2019.
2
Secondo step "consultazione delle pubblicazioni"
Questa fase è stata aperta dal 07.06.2019 al 30.08.2019
3
Terzo step "adozione"
Il terzo passo sarà l'adozione da parte della Commissione prevista per il primo trimestre del 2021
_______
Gli obiettivi di questa revisione della direttiva macchine
La direttiva macchine deve essere aggiornata per migliorare ulteriormente i livelli di sicurezza e tenere conto delle ultime innovazioni IT. La revisione proposta:
- allinea la direttiva con la legislazione armonizzata dell'UE sulla salute e la sicurezza dei prodotti e
- affronta le sfide che possono derivare dal progresso tecnico nella digitalizzazione
A. Contesto, definizione del problema e controllo della sussidiarietà
L'UE ha un vantaggio competitivo in settori leader a livello mondiale come la produzione e la robotica, producendo più di un quarto dei robot di servizio industriale e professionale del mondo. Con l'emergere di nuove tecnologie digitali come l'Intelligenza Artificiale (AI) e l'Internet of Things (IoT), l'UE deve rimanere competitiva in un mercato globale in trasformazione. Le tecnologie digitali emergenti stanno prendendo sempre più piede non solo nelle applicazioni di consumo ma anche a livello commerciale / industriale, dove possono portare nuovi livelli di efficienza e produttività.
La comunicazione della Commissione sull'intelligenza artificiale per l'Europa (adottata il 25 aprile 2018) mostra come l'UE stia preparando un ambiente in cui le imprese e la società possono fare il miglior uso dell'IA. Si riferisce alla Direttiva macchine 2016/42/CE quale atto legislativo chiave sui robot.
Questa iniziativa dovrebbe essere vista nel contesto del quarto settore politico prioritario nell'ambito dell '"agenda per l'occupazione, la crescita, l'equità e il cambiamento democratico" del presidente Juncker, vale a dire un mercato interno più profondo ed equo con una base industriale rafforzata.
La Direttiva Macchine ha due obiettivi generali:
- garantire un elevato livello di sicurezza e protezione per gli utenti dei macchinari e le altre persone ad esso esposte; e
- garantire la libera circolazione delle macchine nel mercato interno.
I prodotti che copre vanno dai tosaerba alle stampanti 3D, dagli utensili manuali elettrici ai macchinari da costruzione, dai robot alle linee di produzione industriale automatizzate complete. Un ulteriore obiettivo, la tutela dell'ambiente, è limitato ai macchinari utilizzati nelle applicazioni dei pesticidi.
Questa iniziativa affronta le questioni individuate in una valutazione della direttiva, che è stata effettuata nell'ambito del programma di adeguatezza e rendimento della regolamentazione della Commissione (REFIT). La valutazione ha concluso (cfr.SWD (2018) 160) che la direttiva è generalmente pertinente, efficace, efficiente e coerente e ha un valore aggiunto per l'UE, ma che erano necessari miglioramenti e semplificazioni specifici.
Sebbene la valutazione indichi che la direttiva consente sviluppi tecnologici nell'era digitale, dato che è sostenuta dai principi del "nuovo approccio'' che stabilisce requisiti di base obbligatori, lasciando i dettagli tecnici per soddisfare tali requisiti alle norme tecniche, sono necessarie ulteriori analisi per quanto riguarda la sua efficacia e idoneità allo scopo in futuro, rispetto agli sviluppi nella digitalizzazione, come IoT, AI e la nuova generazione di robot autonomi.
...
[box-note]REVISIONE DELLA DIRETTIVA MACCHINE: PARARE CESE 2020
Riferimento: CCMI/172-EESC-2020
Il CESE accoglie con favore gli attuali sforzi della Commissione per analizzare e possibilmente migliorare le prestazioni della direttiva macchine 2006/42/CE come parte del suo programma di adeguatezza e rendimento regolamentare (REFIT).
Il CESE ritiene che la direttiva macchine sia uno strumento molto importante e di successo per l'industria europea e il suo approccio di base deve essere lasciato invariato. Sebbene il CESE concordi sulla necessità di apportare alcune modifiche, modifiche di massa alla direttiva macchine, in particolare ai requisiti essenziali di salute e sicurezza (EHSR) di cui all'allegato I, avrebbero un profondo impatto negativo sul lavoro di sviluppo delle norme armonizzate necessarie e devono essere evitate.
CESE: Comitato Economico e Sociale Europeo
Vedi[/box-note]
add more in attachment
Collegati
[box-note]Evaluation of the Machinery Directive 2006/42/EC | EC 2018
Direttiva macchine 2016/42/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Revisione della Direttiva macchine - Roadmap EC Rev. 00.2020.pdf Certifico Srl - Rev. 0.0 2020 |
111 kB | 193 | ||
| Inception impact assessment - Ares(2019)132242.pdf EC 2020 |
449 kB | 58 |
RAPEX Report 38 del 18/09/2020 N. 23 INFO/00130/20 Regno Unito

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 38 del 18/09/2020 N. 23 INFO/00130/20 Regno Unito
Approfondimento tecnico: Macchina per incisione
Il prodotto, di marca CNC, mod. CNC3-3018PRO, è stato sottoposto alla procedura di distruzione perché non conforme alla Direttiva 2006/42/CE del Consiglio, del 17 maggio 2006, relativa alle macchine e che modifica la direttiva 95/16/CE ed alla Direttiva 2006/95/CE el Parlamento Europeo e del Consiglio del 12 dicembre 2006 concernente il ravvicinamento delle legislazioni degli Stati membri relative al materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione. La Direttiva 2006/95/CE è stata abrogata a decorrere dal 20 aprile 2016, data di entrata in vigore della Direttiva 2014/35/UE.
Il diametro dei conduttori di tensione è inadeguato. I contatti sulla spina sono troppo grandi e il contatto di terra è parzialmente rivestito, ciò può portare a surriscaldamento e rischio di ustioni e scosse elettriche da contatto.
Direttiva 2006/42/CE
Allegato I
Requisiti essenziali di sicurezza e di tutela della salute
1.5. Rischi dovuti ad altri pericoli
1.5.1. Energia elettrica
Se la macchina è alimentata con energia elettrica, essa deve essere progettata, costruita ed equipaggiata in modo da prevenire o da consentire di prevenire tutti i pericoli dovuti all'energia elettrica.
Gli obiettivi di sicurezza fissati dalla direttiva 73/23/CEE si applicano alle macchine. Tuttavia gli obblighi concernenti la valutazione della conformità e l'immissione sul mercato e/o la messa in servizio di macchine in relazione ai pericoli dovuti all'energia elettrica sono disciplinati esclusivamente dalla presente direttiva.
Direttiva 2006/95/CE
Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
[…]2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità al punto 1 sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di ferite o altri danni che posson derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e gli oggetti siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l'esperienza, possono derivare dal materiale elettrico;
d) l'isolamento sia proporzionato alle sollecitazioni previste.[…]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 38 18_0920_20 N. 23 INFO_00130_20 Regno Unito.pdf Macchina per incisione |
444 kB | 0 |
Decreto 5 agosto 2020
Decreto 5 agosto 2020
Attuazione delle direttive delegate della Commissione europea (UE) 2020/360, (UE) 2020/361, (UE) 2020/364, (UE) 2020/365 e (UE) 2020/366, di modifica del decreto legislativo 4 marzo 2014, n. 27, sulla restrizione di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
(GU Serie Generale n.228 del 14-09-2020)
...
Collegati:
[box-note]Direttiva delegata (UE) 2020/360
Direttiva delegata (UE) 2020/361
Direttiva delegata (UE) 2020/364
Direttiva delegata (UE) 2020/365
Direttiva delegata (UE) 2020/366
Direttiva RoHS III | Testo consolidato
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
RAPEX Report 36 del 04/09/2020 N. 15 A12/01199/20 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 36 del 04/09/2020 N. 15 A12/01199/20 Svezia
Approfondimento tecnico: Crema per la pelle
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di divieto di commercializzazione perché non conforme Regolamento (CE) 1223/2009.
Il prodotto contiene mercurio (valore misurato: 21,3 mg/kg).
Il mercurio si accumula nel corpo e può danneggiare i reni, il cervello e il sistema nervoso. Inoltre, può influire sulla riproduzione e sul nascituro.
Regolamento (CE) 1223/2009
Articolo 14
Restrizioni applicabili alle sostanze elencate negli allegati
1. Fatto salvo l'articolo 3, i prodotti cosmetici non possono contenere:
a) sostanze vietate:
- sostanze vietate di cui all'allegato II;
b) sostanze soggette a restrizioni:
- sostanze soggette a restrizioni non impiegate conformemente alle restrizioni indicate nell'allegato III; […]
Regolamento (CE) 1223/2009
Allegato I
Elenco delle sostanze vietate nei prodotti cosmetici
n. 221 Mercurio e suoi composti, ad eccezione di quelli inclusi nell'allegato V
Numero CAS 7439-97-6
Numero CE 231-106-7
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 36 del 04_09_2020 N. 15 A12_01199_20 Svezia.pdf Crema per la pelle |
399 kB | 1 |
Check list EN 60204-1:2018 Testing of the electrical equipment of machines - IFA
Check list EN 60204-1:2018 Testing of the electrical equipment of machines | IFA 2020
2020, IFA
Da IFA una check list sulla norma: EN 60204-1:2018 equipaggiamenti elettrici di macchine (2a - Vedi Ed 2007)
EN 60204-1 (2018), "Sicurezza del macchinario - Equipaggiamento elettrico delle macchine - Requisiti generali" è una norma europea armonizzata (Tipo B) ai sensi della Direttiva Macchine 2006/42/CE e della Direttiva Bassa tensione 2014/35/UE.
Sulla base di questo standard, l'IFA - Istituto per la sicurezza e la salute sul lavoro del DGUV ha elaborato una checklist con l'ausilio del quale l'apparecchiatura elettrica delle macchine può essere testata in una sequenza adeguata. Poiché ogni fase di test fa riferimento alla sezione pertinente dello standard, la checklist è utile anche per gli utenti che non utilizzano lo standard su base giornaliera.
[box-warning]EN 60204-1:2018 Armonizzazione BT / M
BT - Bassa Tensione
Con la Decisione di esecuzione (UE) 2019/1956 (GU L 306/26 del 27.11.2019), la EN 60204-1:2018 entra in regime di armonizzazione per la Direttiva 2014/35/UE "Bassa Tensione" a partire dalla data del 27 Novembre 2019. La norma sostituita, EN 60204-1:2006, è ritirata dal 27 maggio 2021 (cessazione Presunzione di Conformità).
M - Macchine
- Con la Decisione di esecuzione (UE) 2020/480 (GU L 102/6 del 02.04.2020) la EN 60204-1:2018 è entrata in regime di armonizzazione per la Direttiva 2006/42/CE "Macchine" a partire dalla data del 02 aprile 2020. La norma sostituita, EN 60204-1:2006, è ritirata dal 02 ottobre 2021 (cessazione Presunzione di Conformità). [/box-warning]
Da IFA un Documento PDF compilabile per l'analisi dell'applicazione della norma.
3. Details of the device under test and the testing procedure
4. Physical ambient and operating conditions
5. Result of testing – testing checklists
6. Information for use and technical documentation
IFA
Istituto per la Sicurezza e Salute sul lavoro - DE
Ed.: 2020
[box-note]Check list EN 60204-1:2006 Testing of the electrical equipment of machines - IFA
La nuova 6a edizione 2016 della norma IEC 60204-1
CEI EN 60204-1:2018 Equipaggiamento elettrico macchine | File CEM[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Safety testing of machines IFA 2020.pdf IFA 2020 |
6453 kB | 245 |
ADCO MED EU Declaration of conformity template
ADCO MED EU Declaration of conformity template
ID 12018 | 11.11.2020
ADCO MED EU DECLARATION OF CONFORMITY TEMPLATE
(to be used for marine equipment within the scope of DIRECTIVE 2014/90/EU)
1. N°… (unique identification of the product): [Give type, batch or serial number(s) as appropriate]
2. This declaration of conformity is issued under the sole responsibility of the manufacturer:
3. Name and address of the manufacturer (and his authorised representative, if applicable):
4. Object of the declaration (identification of product allowing traceability. It may include a photograph, where appropriate): [Give MED entry number and description (e.g. MED/1.11 Linethrowing appliances), current version of implementing act and model and brand names, etc., Product description as given for EC type examination certificate]
5. The object of the declaration described above is in conformity with Directive 2014/90/EU
6. References to the relevant performance requirements and test standards - specifying also year of issue, version, dates - in relation to which conformity is declared: [Typically references to IMO documents and IEC, ISO, EN standards given in the relevant item in the implementing act and the Notified Body’s EC type examination certificate]
7. The notified body/bodies [give name(s) and number(s)] performed a [as appropriate indicate the used modules: B+D, B+E, B+F, G] conformity assessment procedure and issued the certificate(s): …[Indicate the certificate numbers, validity of Modules D and E].
8. Additional Information - Application and / or limitations (if any), as specified in EC Type Examination Certificate (Module B or G): [ Any limitations on the acceptance or use of the product or specific requirements stipulated in the relevant section of SOLAS, MARPOL, LSA, etc. or any other condition of validity - such as life rafts height of stowage, …].
9. Signature:
Signed for and on behalf of: …………………………………
(place and date of issue):
(name, function) (signature):
__________
Fonte: EU
Collegati:
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
Le nuove Dichiarazioni di Conformità UE 2014/2016: i Modelli per tipologie di Prodotto
Dichiarazione UE di conformità | Direttiva MED[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ADCO MED EU Declaration of conformity template.pdf |
110 kB | 8 |
Guidance on Article 10 (10) of RED (Directive 2014/53/EU)
Guidance on Article 10 (10) of RED (Directive 2014/53/EU)
EC, 05.11.2020
The purpose of this document it to provide guidance only on the applicability of Article 10 (10) of the RED (Radio Equipment Directive 2014/53/EU). It incorporates clarifications given in the RED Guide on Article 10 (10) of the RED and includes also some additional clarifications on that provision.
This document is intended purely as a guidance document and it is distributed for information purposes only.
In the event of any inconsistency between the provisions of Union law (such as the RED) and this document, the provisions of the Union law prevail.
As this document was prepared by the Commission services, it does not commit the European Commission.
It is highlighted that only the Court of Justice of the European Union is competent to authoritatively interpret Union law.
_________
Fonte: EC
Collegati:
[box-note]Nuova Direttiva R&TTE 2014/53/UE (Direttiva RED)
Decreto Legislativo 22 giugno 2016 n. 128
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidance on Article 10.10 of RED.pdf EC, November 2020 |
418 kB | 45 |
RAPEX Report 43 del 23/10/2020 N. 09 A12/01397/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 43 del 23/10/2020 N. 09 A12/01397/20 Germania
Approfondimento tecnico: Guinzaglio per cani
Il prodotto, di marca KERBL, è stato sottoposto alla procedura di richiamo presso i consumatori e ritiro dal mercato perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto rilascia una quantità eccessiva di nichel (quantità misurata fino a 0,5 μg/cm²/settimana). A contatto con la pelle, il nichel ha un effetto sensibilizzante e può provocare reazioni allergiche.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
27. Nichel
1. Non è consentito l’uso:
a) in tutti gli oggetti metallici che vengono inseriti negli orecchi perforati o in altre parti perforate del corpo umano, a meno che il tasso di cessione di nickel da tali oggetti metallici sia inferiore a 0,2 μg/cm2 per settimana (limite di migrazione);
b) in articoli destinati ad entrare in contatto diretto e prolungato con la pelle, quali:
- orecchini,
- collane, bracciali e catenelle, cavigliere, anelli,
- casse di orologi da polso, cinturini per orologi e chiusure di orologi,
- bottoni automatici, fermagli, rivetti, cerniere lampo e marchi metallici, se sono applicati agli indumenti, se il tasso di cessione di nickel dalle parti di questi articoli che vengono a contatto diretto e prolungato con la pelle è superiore a 0,5 μ/cm2/settimana;
c) negli articoli di cui alla lettera b) se hanno un rivestimento senza nickel, a meno che tale rivestimento sia sufficiente a garantire che il tasso di cessione di nickel dalle parti di tali articoli che sono a contatto diretto e prolungato con la pelle non superi 0,5 μg/cm2/settimana per un periodo di almeno due anni di uso normale dell’articolo.
2. Gli articoli che sono oggetto del paragrafo 1 non possono essere immessi sul mercato se non sono conformi alle prescrizioni di tale paragrafo.
3. Le norme adottate dal Comitato europeo di normalizzazione (CEN) sono utilizzate come metodi di prova per dimostrare la conformità degli articoli ai paragrafi 1 e 2.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 43 del 23_10_2020 N. 09 A12_01397_20 Germania.pdf Guinzaglio per cani |
111 kB | 0 |
Draft standardisation medical devices and in vitro diagnostic medical devices
Draft standardisation request as regards medical devices and in vitro diagnostic medical devices
EU, October 2020
Article 1 Requested standardisation activities
1. The European Committee for Standardization (CEN) and the European Committee for Electrotechnical Standardization (Cenelec) are requested to revise the existing standards listed in Table 1 of Annex I to this Decision and to draft new standards listed in Table 2 of that Annex in support of Regulation (EU) 2017/745 for medical devices by the deadlines set in that Annex.
2. CEN and Cenelec are requested to revise the existing standards listed in Table 1 of Annex II to this Decision and to draft new standards listed in Table 2 of that Annex in support of Regulation (EU) 2017/746 for in vitro diagnostic medical devices by the deadlines set in that Annex.
3. The standards referred to in paragraphs 1 and 2 shall meet the requirements set out in Annex III.
4. CEN and Cenelec shall provide the Commission with the titles of the requested standards in all official languages of the Union.
Article 2 Work programme
CEN and Cenelec shall prepare a draft joint work programme indicating all the standards listed in Annexes I and II, the responsible technical bodies and a timetable for the execution of the requested standardisation activities in line with the deadlines set out in those Annexes. CEN and Cenelec shall submit the draft joint work programme to the Commission by [insert date – 6 weeks after notification of this Decision by the Commission]. CEN and Cenelec shall inform the Commission of any amendments to the joint work programme.
CEN and Cenelec shall provide the Commission with access to an overall project plan and inform the Commission of any amendments to the joint work programme.
Article 3 Reporting
1. CEN and Cenelec shall report annually to the Commission on the execution of the standardisation request referred to in Article 1 indicating the progress made in implementation of the work programme referred to in Article 2.
2. CEN and Cenelec shall submit the first annual joint report to the Commission by [insert date – 12 months after notification of this Decision by the Commission].
3. Subsequent annual reports shall be submitted to the Commission by 31 October each year.
4. CEN and Cenelec shall provide the Commission with the final report by 30 June 2024.
5. Without prejudice to the reporting obligations set out in paragraphs 1 to 4, CEN and Cenelec shall promptly report to the Commission any concerns relating to the scope of the standardisation request referred to in Article 1 and the deadlines set in Annexes I and II.
Article 4 Harmonised standards
CEN and Cenelec shall include in each harmonised standard a clear and precise description of the relationship between its content and the corresponding safety and performance requirements set out in Annex I to Regulation (EU) 2017/745 or in Annex I to Regulation (EU) 2017/746 that it aims to cover. Each harmonised standard developed on the basis of the standardisation request referred to in Article 1 of this Decision shall refer to this Decision.
CEN and Cenelec shall include in each revised standard information on significant changes that were introduced in that standard.
CEN and Cenelec shall provide the Commission with the titles of the requested harmonised standards in all the official languages of the Union.
Article 5 Validity of the standardisation request
If CEN or Cenelec do not accept the standardisation request referred to in Article 1 within a month of receiving it, the request may not constitute a basis for the standardisation activities referred to in that Article.
This Decision shall expire on 31 December 2024.
Article 6 Expiry of existing standardisation mandates
1. The following standardisation mandates shall expire on 26 May 2021:
(a) BC/CEN/CENELEC/09/89 of 19 December 1991;
(b) BC/CENELEC/02/89;
(c) BC/CEN/03/91;
(d) M/023 - BC/CEN/03/023/93-08 of 5 August 1993;
(e) BC/CEN/CENELEC/029/96;
(f) M/295 of 9 September 1999;
(g) M/320 of 13 June 2002;
(h) M/321 of 13 June 2002;
(i) M/332 of 7 July 2003;
(j) M/333 of 23 October 2003;
(k) M/342 of 10 February 2004;
(l) M/432 of 24 November 2008;
(m) M/433 of 24 November 2008;
(n) M/467 of 19 May 2010.
2. The following standardisation mandates shall expire on 26 May 2022:
(a) M/252 of 12 September 1997;
(b) M/384 of 6 April 2006.
3. The following standardisation mandate shall expire on the date of adoption of the standardisation request referred to in Article 1:
(a) M/565 of 15 May 2020.
Article 7 Addressees
This Decision is addressed to the European Committee for Standardization (CEN) and the European Committee for Electrotechnical Standardization (Cenelec).
....Segue in allegato
Collegati:
[box-note]Linee guida Regolamento Medical Devices (UE) 2017/745
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Draft standardisation request as regards MD and in vitro diagnostic MD.pdf EU, October 2020 |
273 kB | 3 |
Direttiva 92/59/CEE
Direttiva 92/59/CEE
Direttiva 92/59/CEE del Consiglio, del 29 giugno 1992, relativa alla sicurezza generale dei prodotti
(GU L 228 dell'11.8.1992)
[box-note]Recepimento
Attuazione della direttiva 92/59/CEE relativa alla sicurezza generale dei prodotti.
Abrogato da: D. Lgs. 6 settembre 2005 n. 206 (GU n.92 del 20-04-1995)[/box-note]
Abrogata da: Direttiva 2001/95/CE
Collegati
[box-note]Direttiva 2001/95/CE Sicurezza Generale Prodotti[/box-note]
D.Lgs. 2 febbraio 2001 n. 25
D.Lgs. 2 febbraio 2001 n. 25
Attuazione della direttiva 1999/34/CE, che modifica la direttiva 85/374/CEE, in materia di responsabilita' per danno da prodotti difettosi.
(GU n.49 del 28-02-2001)
_______
Art. 1.
1. Al decreto del Presidente della Repubblica 24 maggio 1988, n. 224, sono apportate le seguenti modifiche:
a) il comma 3 dell'articolo 2 e' abrogato;
b) il comma 1 dell'articolo 3 e' sostituito dal seguente: "1. Produttore e' il fabbricante del prodotto finito o di una sua componente, il produttore della materia prima, nonche', per i prodotti agricoli del suolo e per quelli dell'allevamento, della pesca e della caccia, rispettivamente l'agricoltore, l'allevatore, il pescatore ed il cacciatore.";
c) il comma 2 dell'articolo 3 e' abrogato.
Il presente decreto, munito del sigillo dello Stato, sara' inserito nella Raccolta ufficiale degli atti normativi della Repubblica italiana.
E' fatto obbligo a chiunque spetti di osservarlo e di farlo osservare.
Dato a Roma, addi' 2 febbraio 2001
_______
Collegati
[box-note]Direttiva 1999/34/CE[/box-note]
Valutazione della direttiva 85/374/CEE Prodotti difettosi
Valutazione della direttiva 85/374/CEE Prodotti difettosi
Valutazione della direttiva 85/374/CEE del Consiglio sul ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri in materia di responsabilità per prodotti difettosi
January 2018, Written by EY, with the support of Technopolis Group and VVA
- Fornire dati quantitativi e qualitativi sull'applicazione della direttiva sulla responsabilità per danno da prodotti difettosi negli Stati membri, con spiegazioni dettagliate sulle esperienze di successo o sui problemi incontrati dalle parti interessate;
- Stabilire come viene distribuita la responsabilità oggettiva per i danni tra i diversi partecipanti all'IoT, in particolare nel caso di oggetti o sensori collegati che si basano l'uno sull'altro e su dati esterni che non sono necessariamente sotto il controllo di un singolo "produttore". in particolare dai tribunali o dalla dottrina nazionali, in quanto "prodotti" ai fini della direttiva;
- Scoprire se il comportamento autonomo non intenzionale di un robot avanzato è considerato, in particolare dai tribunali o dalla dottrina nazionali, un "difetto" secondo i criteri della direttiva;
...
[box-note]Direttiva 85/374/CEE
D.P.R. 24 maggio 1988 n. 224
Codice del Consumo
Relazione CE Responsabilità per danno prodotti difettosi[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Evaluation of Council Directive 85 374 EEC Defective products.pdf ECC 2018 |
3116 kB | 19 |
Direttiva 1999/34/CE
Direttiva 1999/34/CE
Direttiva 1999/34/CE del Parlamento europeo e del Consiglio, del 10 maggio 1999, che modifica la direttiva 85/374/CEE del Consiglio relativa al ravvicinamento delle disposizioni legislative, regolamentari ed amministrative degli Stati membri in materia di responsabilità per danno da prodotti difettosi
[box-note]Recepimento
Attuazione della direttiva 1999/34/CE, che modifica la direttiva 85/374/CEE, in materia di responsabilita' per danno da prodotti difettosi.
(GU n.49 del 28-02-2001)[/box-note]
Collegati
[box-note]D.Lgs. 2 febbraio 2001 n. 25
Direttiva 85/374/CEE
Direttiva 2001/95/CE Sicurezza Generale Prodotti
Codice del Consumo[/box-note]
Determina Direttoriale ADM MISE 8 ottobre 2020
Determina Direttoriale ADM MISE 8 ottobre 2020
Semplificazione procedure di vigilanza giocattoli e DPI
La Determina Direttoriale dell'Agenzia Dogane Monopoli (ADM) e del Ministero dello Sviluppo economico semplifica le procedure di vigilanza sulle importazioni di giocattoli di e dispositivi di protezione individuale (DPI).
ARTICOLO 1 (Importazione di giocattoli che non evidenzino pericolosità palese per la sicurezza dei consumatori. Sdoganamento in attesa dell’esito degli accertamenti analitici)
1. In caso di importazioni di giocattoli selezionate per l’invio di campioni che - pur in presenza di una sospetta non conformità - non evidenzino ictu oculi una pericolosità palese per la sicurezza dei consumatori e che posseggono i requisiti formali e documentali previsti dalle normative UE di settore, su richiesta motivata degli importatori, o dei loro rappresentanti in Dogana, che non risultano segnalati nelle banche dati di ADM per profili di rischio, in attesa dell’esito degli accertamenti analitici effettuati dai laboratori di ADM, l’Ufficio delle Dogane adotta un provvedimento di sospensione dello svincolo ex. art. 27 del Regolamento (CE) 765/2008 e può procedere allo sdoganamento con contestuale emissione di una bolletta doganale A20 per l’invio della spedizione presso il luogo di destinazione indicato dall’importatore, con divieto di commercializzazione, sottoposta alla vigilanza di ADM in applicazione della normativa nazionale e unionale di riferimento.
2. Per le ipotesi di cui al comma 1, si intende acquisito sia il parere favorevole del MISE, sia il cd “provvedimento interlocutorio”, ai sensi dell’articolo 28 del Reg. (CE) n. 765 del 2008, con conseguente efficacia della sospensione dello svincolo fino all’adozione da parte dello stesso MISE della decisione definitiva nei soli casi di analisi difformi.
3. Nei casi di esito conforme delle analisi di laboratorio, l’Ufficio delle Dogane procede a svincolare direttamente le merci senza indugio e senza il coinvolgimento del MISE.
4. In caso di esito difforme delle analisi, il responsabile del laboratorio trasmette una relazione di servizio allegando i relativi certificati aventi fede pubblica all’Ufficio delle Dogane che, ove ne ricorrano i presupposti, segnala la notizia di reato all’Autorità giudiziaria competente per l’attivazione delle conseguenti operatività con le Forze di Polizia.
5. Nei casi di cui al comma 4, l’Ufficio delle Dogane acquisisce gli atti inerenti all’importazione, nonché gli esiti difformi delle analisi, trasmettendone la documentazione al MISE ai fini dell’adozione della decisione definitiva.
ARTICOLO 2 (Importazione di giocattoli che evidenziano fondati sospetti di pericolosità per la sicurezza dei consumatori. Provvedimento di sospensione dello svincolo delle merci)
1. In caso di importazioni di giocattoli che evidenzino un fondato sospetto di pericolosità per la sicurezza dei consumatori ai sensi della “Convenzione” e della nota della Direzione Antifrode e Controlli di ADM prot. n. 278647/RU del 12 agosto 2020, l’Ufficio delle Dogane adotta un provvedimento di sospensione dello svincolo ex. art. 27 del Regolamento CE 765/2008, acquisisce tutta la documentazione inerente all’importazione e procede al prelevamento di campioni per le successive analisi da parte dei laboratori di ADM.
2. Per le ipotesi di cui al comma 1, si intende acquisito il c.d. “provvedimento interlocutorio”, ai sensi dell’articolo 28 del reg. (CE) n. 765 del 2008, con conseguente efficacia della sospensione dello svincolo fino all’adozione, da parte del MISE, della decisione definitiva da assumersi nei soli casi di analisi e/o documentazione difformi.
3. Nei casi di esito conforme delle analisi di laboratorio l’Ufficio delle Dogane procede direttamente a svincolare le merci senza indugio e senza il coinvolgimento del MISE.
4. In presenza, invece, di esito difforme delle analisi di laboratorio, il responsabile del laboratorio trasmette una relazione di servizio allegando i relativi certificati aventi fede pubblica all’Ufficio delle Dogane che, ove ne ricorrano i presupposti, segnala la notizia di reato all’Autorità giudiziaria competente per l’attivazione delle conseguenti operatività con le Forze di Polizia.
5. Nei casi di cui al comma 4, nonché nei casi in cui residui il sospetto di mancato possesso dei requisiti formali e documentali previsti dalle normative UE di settore, l’Ufficio delle Dogane – dopo aver acquisito gli esiti difformi delle analisi di laboratorio - procede a darne comunicazione al MISE per l’adozione della decisione definitiva.
ARTICOLO 3 (dispositivi di protezione individuale)
1. Qualora dalla preliminare verifica effettuata dagli Uffici doganali il prodotto sia qualificabile come dispositivo di protezione individuale ai sensi del Regolamento (UE) n. 2016/425, per l’effettuazione dei relativi controlli, la preventiva istruttoria di competenza degli Uffici delle dogane tiene conto degli elementi informativi riportati nell’Allegato I alla presente determinazione, anche ai fini della redazione della segnalazione al MISE, ai sensi dell’art. 27 del Regolamento CE 765/2008.
2. In caso di importazioni di dispositivi di protezione individuale marcati CE, nel caso in cui la marcatura sia priva della prescritta documentazione ovvero sia accompagnata da documentazione invalida o falsa, l’Ufficio delle Dogane redige una relazione di servizio, adotta i provvedimenti di competenza e, ove ne ricorrano i presupposti, segnala la notizia di reato all’Autorità giudiziaria.
[...]
[panel]
Check list dei controlli che gli Uffici delle dogane sono tenuti ad effettuare prima di segnalare al MISE la spedizione:
1. denominazione del prodotto e direttiva di riferimento di prodotto;
2. chiara individuazione della posizione giuridica del soggetto (fabbricante e/o importatore) i cui estremi sono apposti sul prodotto;
3. numero di tipo, di lotto, di serie che consenta l’individuazione e che permetta l'univoca identificazione tra i vari certificati e/o dichiarazioni consegnate;
4. riferimenti alle norme e alle regole tecniche utilizzate per la progettazione e fabbricazione, al livello o alla classe di protezione del dispositivo ed al rischio da cui il dispositivo è destinato a proteggere;
5. nome, denominazione commerciale registrata o marchio registrato del fabbricante (o del mandatario in UE) e indirizzo postale dove può essere contattato (L’indirizzo deve indicare un unico recapito in cui il fabbricante può essere contattato);
6. nome, denominazione commerciale registrata o marchio registrato dell'importatore (nel caso in cui il fabbricante sia extra UE) e indirizzo postale dove può essere contattato;
7. informazioni di cui al punto 1.4 dell’allegato II del Regolamento (UE) 2016/425 ed istruzioni d’uso in lingua italiana o in una lingua facilmente comprensibile;
8. marcatura CE, che deve essere apposta sul DPI in modo visibile, leggibile e indelebile. Se ciò fosse impossibile o ingiustificato a causa della natura del DPI, la marcatura CE è apposta sull’imballaggio o sui documenti di accompagnamento del DPI. La marcatura CE è soggetta ai principi generali di cui all’art. 30 del Regolamento (CE) n. 765/2008.
9. certificato di esame UE del tipo (articolo 19 del Regolamento UE 2016/425) emesso da Organismo notificato e presente esclusivamente sul portale NANDO, con verifica espressa della famiglia di prodotto (protezione occhi, protezione faccia, protezione vie respiratorie, ecc.);
10. dichiarazione di conformità UE a firma del fabbricante (articolo 15 del Regolamento UE 2016/425), ovvero dell’importatore nel caso in cui quest’ultimo si dichiari fabbricante ai sensi dell’articolo 12 del Regolamento DPI.
Per quel che concerne le istruttorie relative alle segnalazioni al MISE riguardo i dispositivi di protezione individuale, il fabbricante, ovvero l’importatore nel caso in cui quest’ultimo si dichiari come fabbricante (art. 12 del Regolamento UE 425/2016), deve assumersi tutte le responsabilità previste dagli artt. 8 e 15 del Regolamento UE 425/2016. Analogamente si rimanda all’art 10 per quel che concerne gli obblighi dell’importatore. In particolare, gli Uffici delle dogane sono invitati a porre l’attenzione sull’osservanza da parte degli operatori economici coinvolti dei seguenti articoli del Regolamento UE 425/2016.[/panel]
Fonte: MISE
Collegati:
[box-note]Regolamento DPI | Regolamento (UE) 2016/425
Guida per lo sdoganamento delle mascherine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Determina Direttoriale ADM MISE 8 ottobre 2020.pdf |
583 kB | 0 |
Regulation (EU) 2016/426: Guidance point 3.7 of Annex I (GAR)
Regulation (EU) 2016/426: Guidance point 3.7 of Annex I (GAR)
EU, October 2020
Regulation (EU) 2016/426 on appliances burning gaseous fuels (GAR) - Guidance document in relation to point 3.7 of Annex I - Materials and parts of appliances/fittings in contact with food and water intended for human consumption
In relation to materials/parts of the appliance/fitting in contact with food
- Regulation (EC) N° 1935/2004 on materials and articles intended to come into contact with food1 and all implementing acts adopted pursuant to Article 5(1) thereof such as:
- Commission Regulation (EU) No 10/2011 of 14 January 2011 on plastic materials and articles intended to come into contact with food; and
- Commission Regulation (EC) No 2023/2006 on good manufacturing practice for materials and articles intended to come into contact with food
In relation to materials/parts of the appliance/fitting in contact with water intended for human consumption
- Directive 98/83/EC on the quality of water intended for human consumption (hereinafter “the Drinking water Directive”)
[box-note]N.B. State of play of the revision of the Drinking water Directive by 30 September 2020 On 1 February 2018, the Commission adopted a proposal for a revision of the Drinking water Directive.
The European Parliament proposed amendments to the Commission proposal at its plenary on 23 October 2018.
On 5 March 2019, the Council adopted its position on the proposal to revise the Drinking water Directive.
The Parliament and the Council reached a provisional agreement in the trilogues on 18 December 2019. Members States' ambassadors (Coreper) confirmed the agreement on 5 February and the ENVI Committee gave its endorsement on 18 February 2020.
The confirmation of the political agreement was submitted to the Environment Council meeting on 5 March 2020. After legal-linguistic revision, the Council is expected to formally adopt the text as its first reading position, after which the file will return to Parliament for final adoption in second reading.[/box-note]
Point 3.7. of Annex I to the GAR refers specifically to the definition of “water intended for human consumption” provided by Article 2 of the Drinking water Directive according to which “all water either in its original state or after treatment, intended for drinking, cooking, food preparation or other domestic purposes, regardless of its origin and whether it is supplied from a distribution network, from a tanker, or in bottles or containers”.
The GAR itself does not contain any additional elements of definition of the concept of “water intended for human consumption” and simply refers to the definition provided by the Drinking water Directive.
[...] Segue in allegato
Fonte: EU
Collegati:
[box-note]Regolamento (UE) 2016/426: Apparecchi a gas
Guide ufficiali UE Nuovo Approccio[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Regulation EU 2016 426 Guidance point 3.7 of Annex I (GAR).pdf EU October 2020 |
800 kB | 20 |
RAPEX Report 39 del 25/09/2020 N. 01 A12/01276/20 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 39 del 25/09/2020 N. 01 A12/01276/20 Ungheria
Approfondimento tecnico: Braccialetti
Il prodotto, di marca sconosciuta, mod. 19150-27, proveniente dalla Repubblica Popolare Cinese, è stato respinto alla frontiera e sottoposto alla procedura di distruzione perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il metallo dei braccialetti contiene cadmio (valore misurato: 1,63% in peso).
Il cadmio è dannoso per la salute umana, perché si accumula nell'organismo, può danneggiare gli organi e può provocare il cancro.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
23. Cadmium
[…] 10. Sono vietati l'uso o l'immissione sul mercato se il tenore è pari o superiore allo 0,01 % in peso del metallo in:
i) monili di metallo e altri componenti di metallo impiegati nella fabbricazione di oggetti di gioielleria;
ii) parti di metallo di articoli di gioielleria e di bigiotteria e accessori per capelli, compresi:
- braccialetti, collane e anelli
- gioielli per piercing,
- orologi da polso e cinturini,
- spille e gemelli per polsini. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 39 del 25_09_2020 N. 01 A12_01276_20 Ungheria.pdf Braccialetti |
458 kB | 0 |
Dichiarazione CE di Conformità | Direttiva 2009/48/CE Giocattoli
Dichiarazione CE di Conformità | Direttiva 2009/48/CE Giocattoli
ID 11652 | Rev. 0.0 2020
Modello di Dichiarazione CE di Conformità Direttiva 2009/48/CE Giocattoli.
Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli. (GU L 170/1 del 30.6.2009)
Articolo 1 Oggetto
La presente direttiva stabilisce norme sulla sicurezza dei giocattoli e sulla loro libera circolazione nella Comunità.
Articolo 2 Ambito di applicazione
1. La presente direttiva si applica ai prodotti progettati o destinati, in modo esclusivo o meno, a essere utilizzati per fini di gioco da bambini di età inferiore a 14 anni («giocattoli»). A norma della presente direttiva, i prodotti elencati nell’allegato I non sono considerati come giocattoli.
2. La presente direttiva non si applica:
a) alle attrezzature per aree da gioco per uso pubblico;
b) alle macchine da gioco automatiche, a moneta o no, per uso pubblico;
c) ai veicoli-giocattolo con motore a combustione;
d) alle macchine a vapore giocattolo; e
e) alle fionde e alle catapulte.
Articolo 4 Obblighi dei fabbricanti
...
2. I fabbricanti preparano la documentazione tecnica prescritta dall’articolo 21 ed eseguono o fanno eseguire la procedura di valutazione della conformità applicabile a norma dell’articolo 19.
Qualora la conformità di un giocattolo alle prescrizioni applicabili sia stata dimostrata da tale procedura, i fabbricanti redigono, a norma dell’articolo 15, una dichiarazione CE di conformità, e appongono la marcatura CE di cui all’articolo 17, paragrafo 1.
3. I fabbricanti conservano la documentazione tecnica e la dichiarazione CE di conformità per un periodo di dieci anni dopo che il giocattolo è stato immesso sul mercato.
...
Articolo 15 Dichiarazione CE di conformità
1. La dichiarazione CE di conformità attesta che è stata dimostrata la conformità ai requisiti definiti all’articolo 10 e all’allegato II.
2. La dichiarazione CE di conformità contiene almeno gli elementi specificati nell’allegato III della presente direttiva e dei pertinenti moduli della decisione 768/2008/CE ed è continuamente aggiornata. La dichiarazione CE di conformità ha la struttura tipo di cui all’allegato III della presente direttiva. È tradotta nella lingua o nelle lingue richieste dallo Stato membro nel quale il giocattolo viene immesso o messo a disposizione.
3. Con la dichiarazione CE di conformità il fabbricante si assume la responsabilità della conformità del giocattolo.
...
Articolo 16 Principi generali della marcatura CE
1. I giocattoli resi disponibili sul mercato recano la marcatura CE.
2. La marcatura CE è soggetta ai principi generali esposti all’articolo 30 del regolamento (CE) n. 765/2008.
3. Gli Stati membri presumono la conformità del giocattolo recante la marcatura CE con la presente direttiva.
4. I giocattoli che non recano la marcatura CE o che non sono altrimenti conformi alla presente direttiva possono essere presentati ed utilizzati in occasione di fiere ed esposizioni, purché un’indicazione chiara precisi che il giocattolo non è conforme alla presente direttiva e che non saranno messi a disposizione nella Comunità prima di essere resi conformi.
...
Articolo 17 Regole e condizioni per l’apposizione della marcatura CE
1. La marcatura CE è apposta in modo visibile, leggibile e indelebile sul giocattolo o su un’etichetta affissa o sull’imballaggio. Nel caso di giocattoli di piccole dimensioni o costituiti da piccole parti la marcatura CE può essere apposto su un’etichetta oppure su un foglio informativo. Qualora ciò risulti tecnicamente impossibile, nel caso di giocattoli venduti in espositori e a condizione che l’espositore sia stato inizialmente utilizzato come imballaggio per i giocattoli, la marcatura CE deve essere affissa sull’espositore stesso. Qualora l’eventuale marchio CE non sia visibile dall’esterno dell’imballaggio, questo va apposto almeno sull’imballaggio.
2. La marcatura CE è apposta sul giocattolo prima della sua immissione sul mercato. Può essere seguita da un pittogramma o da qualsiasi altro marchio che indichi un rischio o un impiego particolare.
...
ALLEGATO III DICHIARAZIONE CE DI CONFORMITÀ
1. N. … (identificazione unica del giocattolo/dei giocattoli)
2. Nome ed indirizzo del fabbricante o del suo rappresentante autorizzato:
3. La presente dichiarazione di conformità è rilasciata sotto l’esclusiva responsabilità del fabbricante:
4. Oggetto della dichiarazione (identificazione del giocattolo che ne consenta la rintracciabilità). È inclusa un’immagine a colori di chiarezza sufficiente a permettere l’identificazione del giocattolo).
5. L’oggetto della dichiarazione di cui al punto 4 è conforme alla pertinente normativa comunitaria di armonizzazione.
6. Riferimento alle pertinenti norme armonizzate utilizzate o riferimento alle specifiche in relazione alle quali viene dichiarata la conformità:
7. Se del caso, l’organismo notificato …: (denominazione, numero) … ha effettuato (descrizione dell’intervento) … e rilasciato il certificato:
8. Informazioni supplementari:
Firmato a nome e per conto di:
(luogo e data di emissione)
(nome e cognome, funzione) (firma)
© Certifico S.r.l.
Rev. 0.0 2020 (Direttiva 2009/48/CE Giocattoli)
Collegati
[box-note]Direttiva 2009/48/CE giocattoli
Raccolta Linee guida sicurezza giocattoli | 02.2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dichiarazione CE di conformità Direttiva 2009_48_CE Giocattoli Rev. 0.0 2020.docx Certifico Srl - Rev. 0.0 2020 |
29 kB | 37 |
Artificial Intelligence for Europe
Artificial Intelligence for Europe
COM(2018) 237 final | 25 April 2018
Artificial intelligence (AI) is already part of our lives – it is not science fiction. From using a virtual personal assistant to organise our working day, to travelling in a self-driving vehicle, to our phones suggesting songs or restaurants that we might like, AI is a reality. Beyond making our lives easier, AI is helping us to solve some of the world's biggest challenges: from treating chronic diseases or reducing fatality rates in traffic accidents1 to fighting climate change or anticipating cybersecurity threats.
In Denmark, AI is helping save lives by allowing emergency services to diagnose cardiac arrests or other conditions based on the sound of a caller's voice. In Austria, it is helping radiologists detect tumours more accurately by instantly comparing xrays with a large amount of other medical data. Many farms across Europe are already using AI to monitor the movement, temperature and feed consumption of their animals. The AI system can then automatically adapt the heating and feeding machinery to help farmers monitor their animals' welfare and to free them up for other tasks. And AI is also helping European manufacturers to become more efficient and to help factories return to Europe.
These are some of the many examples of what we know AI can do across all sectors, from energy to education, from financial services to construction. Countless more examples that cannot be imagined today will emerge over the next decade. Like the steam engine or electricity in the past, AI is transforming our world, our society and our industry. Growth in computing power, availability of data and progress in algorithms have turned AI into one of the most strategic technologies of the 21st century. The stakes could not be higher. The way we approach AI will define the world we live in. Amid fierce global competition, a solid European framework is needed.
...
[box-info]What is artificial intelligence?
Artificial intelligence (AI) refers to systems that display intelligent behaviour by analysing their environment and taking actions – with some degree of autonomy – to achieve specific goals. AI-based systems can be purely software-based, acting in the virtual world (e.g. voice assistants, image analysis software, search engines, speech and face recognition systems) or AI can be embedded in hardware devices (e.g. advanced robots, autonomous cars, drones or Internet of Things applications). We are using AI on a daily basis, e.g. to translate languages, generate subtitles in videos or to block email spam. Many AI technologies require data to improve their performance. Once they perform well, they can help improve and automate decision making in the same domain. For example, an AI system will be trained and then used to spot cyberattacks on the basis of data from the concerned network or system.[/box-info]
...
add more in attachment
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Artificial Intelligence for Europe COM(2018) 237.pdf EC 2019 |
419 kB | 12 |
Structure of Technical Documentation (Medical Devices)
Structure of Technical Documentation (Medical Devices)
ID 11637 | 28.09.2020
- Note Technical Documentation Regulation (EU) 2017/745 (MDR)
- Example Structure Model Rev. 1.0 sept. 2020
The following structure is based on Regulation (EU) 2017/745 (MDR) but is also suitable for technical documentation according to Directive 93/42/EEC.
1. Device description and specification
1.1. General description of the device, its variants and its intended purpose
1.1.1. Name and address of the manufacturer
1.1.2. Overview of devices/ device groups/device types e.g. table with designation and reference to the REF number, including UDI-DI (if applicable)
1.1.3. All trade names under which the device is placed on the market
1.1.4. Description and specifications of the device including its intended purpose, indication(s), contraindication(s) and warnings, the intended patient group and the medical conditions to be diagnosed/treated/monitored
1.1.5. UMDNS/GMDN classification (if applicable)
1.1.6. Technical specifications of the device, such as characteristics, dimensions and performance attributes of the device
1.1.7. Variants/components/configurations and accessories of the device
1.1.8. Exact software version (if applicable)
1.1.9. Explanations of new characteristics and new intended purposes/indications
1.2. UDI (as soon as implemented or obligatory)
Description of the basis-UDI-DI, taking into account all variants covered by the technical documentation
Until the complete implementation of the UDI requirements at least a clear representation of all variants covered by the TD (sizes, forms, coatings, etc.).
1.3. Designation / Classification
Justification for the designation as a medical device and description of the classification of the device including justification for on the applied classification rule(s), exact identification of the applied indent, statement for the classification
1.4. Declaration of Conformity (DoC)
DoC according to Annex IV MDR or according to MDD (considering EK-MED-Beschluss 3.9 A4). For initial certifications (e.g. MDR) the DoC has to be filed in draft status.
....
segue in allegato
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Regolamento (UE) 2017/745
Technical File Medical Device[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Technical file Medical device - Note.pdf Certifico S.r.l. Rev. 00 2020 |
400 kB | 46 | ||
| Structure Technical Documentation Medical Devices.docx Certifico Srl - Rev. 0.0 2020 |
38 kB | 29 | ||
| Structure Technical Documentation Medical Devices.pdf Certifico Srl - Rev. 0.0 2020 |
355 kB | 42 |
RAPEX Report 37 del 11/09/2020 N. 10 A12/01212/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 37 del 11/09/2020 N. 10 A12/01212/20 Polonia
Approfondimento tecnico: Cavalli giocattolo di plastica
Il prodotto, di marca HH Poland, mod. HM164232, No.CF1015, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il materiale plastico del giocattolo contiene una quantità eccessiva di bis (2-etilesil) ftalato (DEHP) (valore misurato fino allo 0,53% in peso). Questo ftalato può nuocere alla salute dei bambini, provocando possibili danni al sistema riproduttivo.
Regolamento (CE) n .1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. ftalato di bis(2-etilesile) (DEHP)
1. Non possono essere utilizzati come sostanze o in miscele in concentrazioni superiori allo 0,1 % in peso del materiale plastificato, nei giocattoli e negli articoli di puericultura.
2. I giocattoli e gli articoli di puericultura contenenti tali ftalati in concentrazione superiore allo 0,1 % in peso del materiale plastificato non possono essere immessi sul mercato.
4. Ai fini della presente voce, per «articoli di puericultura» si intende qualsiasi prodotto destinato a conciliare il sonno, il rilassamento, l’igiene, il nutrimento e il succhiare dei bambini.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 37 del 11_09_2020 N. 10 A12_01212_20 Polonia.pdf Cavalli giocattolo di plastica |
383 kB | 0 |
Decreto 19 Maggio 2020
Decreto 19 maggio 2020
Attuazione delle direttive delegate della Commissione europea (UE) 2019/1845 ed (UE) 2019/1846, di modifica del decreto legislativo 4 marzo 2014, n. 27, sulla restrizione di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
(GU Serie Generale n.228 del 14-09-2020)
...
Collegati:
[box-note]Direttiva RoHS III | Testo consolidato
Direttiva delegata (UE) 2019/1845
Direttiva delegata (UE) 2019/1846
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
RAPEX Report 35 del 28/08/2020 N. 15 A12/01184/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 35 del 28/08/2020 N. 15 A12/01184/20 Polonia
Approfondimento tecnico: Slime giocattolo
Il prodotto, di marca Midex, mod. N0.020A e N0: D30941, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica armonizzata EN 71-3 “Sicurezza dei giocattoli - parte 3: Migrazione di alcuni elementi”.
La migrazione del boro dal giocattolo è troppo elevata (valore misurato: 404,65 mg/kg). L'ingestione o il contatto con una quantità eccessiva di boro può nuocere alla salute dei bambini danneggiando il loro sistema riproduttivo.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
III. Proprietà Chimiche
13. Fatti salvi i punti 3, 4 e 5, non devono essere superati i seguenti limiti di migrazione degli elementi sotto indicati dai giocattoli o dai loro componenti:
Boro
- mg/kg di materiale per giocattoli secco, fragile, in polvere o flessibile = 1200
- mg/kg di materiale per giocattoli liquido o colloso = 300
- mg/kg di materiale rimovibile dal giocattolo mediante raschiatura = 15000
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 35 del 28_08_2020 N. 15 A12_01184_20 Polonia.pdf Slime giocattolo |
417 kB | 1 |
Altri articoli...
- Radiazioni gamma materiali da costruzione | D.lgs 101/2020 e Reg. CPR
- Circolare del 1° settembre 2020 (Prot. 42211)
- Impact assessment study on the revision of Directive 2006/42/EC
- Rapporto attività di vigilanza sui dispositivi medici Ed. 2020
- RAPEX Report 34 del 21/08/2020 N. 17 A12/01153/20 Danimarca