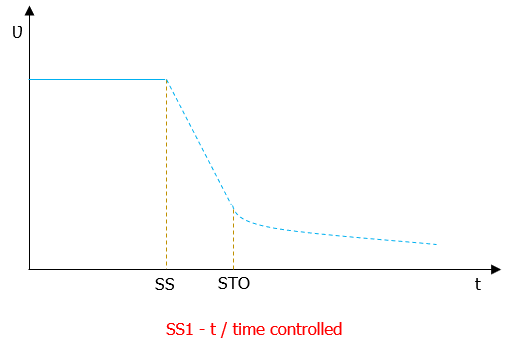
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
ID 13955 | 08.07.2021 / Documento allegato
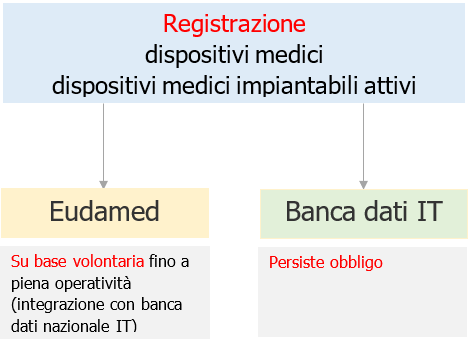
Attualmente, tutte le imprese che ricoprono ruoli individuati dai Regolamenti per i quali sussiste l'obbligo di registrazione in Eudamed, possono procedere alla registrazione su base volontaria al fine di ottenere il Single Registration Number (SRN).
Tuttavia, la registrazione in Eudamed e l'ottenimento dell'SRN non sostituiscono l'obbligo di adempiere alla registrazione nella banca dati nazionale.
Nei prossimi mesi di uso del sistema su base volontaria, è prevista la doppia registrazione in Eudamed e nella banca dati Italiana. A tal proposito, si ricorda quanto previsto dal Regolamento (UE) 2017/745 nell’art.123.3(d) "Fino a quando Eudamed non sarà pienamente operativa (previsione Maggio 2022), le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti”; per l’Italia tale circostanza è relativa agli obblighi di registrazione nella banca dati nazionale dei dispositivi medici del Ministero della Salute. Analoghe disposizioni sono previste per il settore IVD.
Nel corso di questa fase, il Ministero sta lavorando all’impostazione e gestione integrata dei sistemi di registrazione di livello nazionale ed europeo.
[box-warning]Registrazione in Eudamed e banca dati nazionale Art.123.3(d) Regolamento (UE) 2017/745
"Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione".[/box-warning]
Fig. 1 – Applicazione di Eudamed e Banca dati nazionale IT
3. In deroga al paragrafo 2:
a) gli articoli da 35 a 50 si applicano a decorrere dal 26 novembre 2017. Tuttavia, a decorrere da tale data fino al 26 maggio 2021, gli obblighi degli organismi notificati a norma degli articoli da 35 a 50 si applicano solo agli organismi che presentano una domanda di designazione a norma dell'articolo 38;
b) gli articoli 101 e 103 si applicano a decorrere dal 26 novembre 2017;
c) l'articolo 102 si applica a decorrere dal 26 maggio 2018;
d) fatti salvi gli obblighi della Commissione ai sensi dell'articolo 34, qualora, a causa di circostanze che non avrebbero potuto essere ragionevolmente previste alla stesura del piano di cui all'articolo 34, paragrafo 1, Eudamed non sia pienamente operativa il 26 maggio 2021, gli obblighi e le prescrizioni relativi a Eudamed si applicano a decorrere dalla data corrispondente a sei mesi dalla data di pubblicazione dell'avviso di cui all'articolo 34, paragrafo 3.
— articolo 29,
— articolo 31,
— articolo 32,
— articolo 33, paragrafo 4,
— articolo 40, paragrafo 2, seconda frase,
— articolo 42, paragrafo 10,
— articolo 43, paragrafo 2,
— articolo 44, paragrafo 12, secondo comma,
— articolo 46, paragrafo 7, lettere d) ed e),
— articolo 53, paragrafo 2,
— articolo 54, paragrafo 3,
— articolo 55, paragrafo 1,
— articoli da 70 a 77,
— articolo 78, paragrafi da 1 a 13,
— articoli da 79 a 82,
— articolo 86, paragrafo 2,
— articoli 87 e 88,
— articolo 89, paragrafi 5 e 7, e articolo 89, paragrafo 8, terzo comma,
— articolo 90,
— articolo 93, paragrafi 4, 7 e 8,
— articolo 95, paragrafi 2 e 4,
— articolo 97, paragrafo 2, ultima frase,
— articolo 99, paragrafo 4,
— articolo 120, paragrafo 3, primo comma, seconda frase.
Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione.[/box-info]
[box-note]Regolamento (UE) 2017/745
Articolo 34 Funzionalità di Eudamed
1. La Commissione, in collaborazione con l'MDCG, elabora le specifiche funzionali di Eudamed. La Commissione elabora un piano per l'attuazione di tali specifiche entro il 26 maggio 2018. Il piano cerca di garantire la piena operatività di Eudamed in una data che consenta alla Commissione di pubblicare l'avviso di cui al paragrafo 3 del presente articolo entro il 25 marzo 2021 nonché il rispetto di tutti gli altri termini pertinenti stabiliti nell'articolo 123 del presente regolamento e nell'articolo 113 del regolamento (UE) 2017/746.
2. La Commissione, sulla base di una relazione di valutazione contabile indipendente, informa l'MDCG di aver verificato la piena funzionalità di Eudamed e la conformità di Eudamed alle specifiche funzionali elaborate a norma del paragrafo 1.
3. La Commissione, dopo aver consultato l'MDCG e aver appurato che le condizioni di cui al paragrafo 2 sono state soddisfatte, pubblica un avviso a tal fine nella Gazzetta ufficiale dell'Unione europea.[/box-note][box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Eudamed - Banca Dati EUropea sui Dispositivi MEdici[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dispositivi medici - Registrazione in Eudamed e banca dati nazionale Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
156 kB | 76 |
Circolare Min Salute n. 42343 11 giugno 2021
Circolare Min Salute n. 42343 dell'11 giugno 2021: Purificatori e sanificatori d’aria non sono dispositivi medici
ID 13950 | 08.07.2021
La Circolare del Ministero della Salute dell’11 giugno 2021 ha chiarito che purificatori e sanificatori d’aria non possono presentare la marcatura CE come dispositivo medico e la relativa Dichiarazione di Conformità UE dispositivo medico. La posizione ha corpo dalla linea guida europea “Manual on Borderline and Classification in the Community Regulatory Framework for medical devices”.
_______
Il Ministero fa presente che questi prodotti, alla luce della loro destinazione d’uso e modalità d’azione (sanificazione, igienizzazione, purificazione dell’aria degli ambienti), non rientrano nella definizione di dispositivo medico.
Il Ministero ha richiesto di conseguenza alle aziende fabbricanti, che hanno marcato CE questi prodotti, di non qualificarli come dispositivi medici e di cancellarli dalla Banca Dati dei dispositivi medici.
I prodotti impiegati per la sanificazione, l’igienizzazione e la purificazione dell’aria degli ambienti potranno essere introdotti sul mercato sulla base delle disposizioni generali sulla sicurezza dei prodotti immessi in commercio, secondo il Codice del consumo (D.L.gs. 206/2005), presentando eventualmente la marcatura CE ai sensi di altri atti di armonizzazione dell'Unione che riguardano aspetti trasversali, ad esempio:
- Direttiva macchine 2006/42/CE
- Direttiva BT 2014/35/UE
- Direttiva EMC 2014/30/UE
Perché non sono dispositivi medici
Esistono sul mercato vari tipi di purificatori d'aria e prodotti per la decontaminazione della stessa. Alcuni di questi sistemi contengono filtri per rimuovere le particelle presenti nell'aria, mentre altri possono distruggere i microrganismi presenti nell’aria. In entrambi i casi l'aria purificata viene immessa negli ambienti ma non è collegata direttamente ai singoli pazienti.
Questi prodotti hanno quindi lo scopo di "controllare l'ambiente" rimuovendo gli allergeni o la contaminazione dall'aria, ma non agiscono direttamente su un singolo paziente e non c'è contatto diretto con esso.
Analogamente esistono lampade germicide a flusso UV che hanno lo scopo di diminuire il livello di carica microbica negli ambienti e sebbene il mantenimento di aria pulita possa contribuire a mantenere un paziente in un ambiente appropriato, questo non è considerato uno "scopo medico". Informazioni dettagliate, anche su sistemi con raggi UV-C, sono contenute nel documento: Rapporto ISS COVID-19 n. 25/2020 - Raccomandazioni ad interim sulla sanificazione di strutture non sanitarie nell’attuale emergenza COVID-19: superfici, ambienti interni e abbigliamento.
La posizione dell’Unione Europea
La linea guida europea “Manual on Borderline and Classification in the Community Regulatory Framework for medical devices” version 1.22 (05-2019), alla monografia “1.13 - Air purifiers/Air decontamination units/Mobile air decontamination units” e alla monografia “1.23. UV flow germicidal lamp” indica che i prodotti impiegati per la sanificazione, l’igienizzazione e la purificazione dell’aria degli ambienti non rientrano nella definizione di dispositivo medico.
Anche il Regolamento (UE) 2017/745 (MDR), in applicazione dal 26 maggio 2021, pur non affrontando direttamente la questione, ha esplicitamente incluso nell’ambito di applicazione soltanto quei prodotti destinati alla pulizia, alla disinfezione e alla sterilizzazione dei dispositivi medici. (cfr. art. 2, par. 1 MDR).
Sulla base di questi riferimenti normativi, il Ministero ha emanato la Circolare di chiarimento.
Collegati
[box-note]Medical devices | Manual on borderline and classification
Raccomandazioni sanificazione strutture non sanitarie
[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare Min Salute n. 42343 del 11 giugno 2021.pdf Min Salute 2021 |
333 kB | 33 |
Position Paper CEN-CENELEC draft Machinery Regulation July 2021
Position Paper CEN-CENELEC draft Machinery Regulation July 2021
ID 13933 | 07.07.2021 / In allegato Position paper
Position Paper CEN-CENELEC response to the European Commission’s Public Consultation on the draft Machinery Regulation July 2021
Il 21 aprile 2021, la Commissione Europea (CE) ha adottato la sua proposta di Regolamento Macchine che sostituirà la Direttiva Macchine 2006/42/CE.
Allo stesso tempo, la CE ha avviato una consultazione pubblica per ottenere un feedback sul progetto di regolamento macchine. Con questo documento, CEN e CENELEC forniscono la loro posizione su questa proposta.
Consultazione Revisione Direttiva macchine - Timeline data articolo
Questo documento è il risultato delle consultazioni che sono state effettuate nel Forum di settore CEN-CENELEC sulle macchine e nei Consigli tecnici CEN e CENELEC e tra i TC responsabili delle norme armonizzate ai sensi della Direttiva Macchine.
Nel dicembre 2020, CEN-CENELEC ha fornito la sua risposta alla prima consultazione CE sul regolamento macchine che era stata presentata alla riunione dell'EC Machinery Working Group, tenutasi il 9-10 novembre 2020.
Il CEN e il CENELEC si rammaricano che la maggior parte delle richieste non sia stata presa in considerazione e quindi non si rifletta nella proposta della CE del 21 aprile 2021 (COM(2021) 202 definitivo).
Impatto sugli standard
Gli elementi della proposta della CE che creeranno un impatto immediato per CEN-CENELEC sono i seguenti:
[alert]- competenze di esecuzione CE per l'elaborazione delle specifiche tecniche (articolo 17.3 della proposta di regolamento macchine), cfr. anche commento specifico 1.;
- la modifica della procedura di valutazione della conformità per le macchine ad alto rischio di cui all'attuale Allegato IV – ovvero la proposta di eliminare l'opzione di controllo interno in caso di applicazione di norme armonizzate (Articolo 21.2), cfr. anche specifico commento 3;
- il collegamento tra l'Allegato III della proposta di regolamento Macchine e il “sistema di IA ad alto rischio” nel regolamento di IA, si veda anche il commento specifico 4;
- la moltitudine di cambiamenti nei Requisiti Essenziali di Salute e Sicurezza (EHSR) (Allegato III) si veda anche il commento specifico 5. & 6.;[/alert]
Considerando quest'ultimo aspetto si prevede che le modifiche introdotte dalla proposta CE avranno un forte impatto sulla maggior parte delle norme armonizzate se non su tutte.
...
Fonte: EC
Collegati
[box-note]Proposal for a Regulation on machinery products
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Direttiva macchine 2006/42/CE
Direttiva macchine 2021: la proposta di revisione[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position Paper CEN-CENELEC draft Machinery Regulation July 2021.pdf |
349 kB | 37 |
Decreto Dirigenziale n. 172 del 18 Giugno 2021
Decreto Dirigenziale n. 172 del 18 Giugno 2021 | Specifiche tecniche impianti a fune
Disposizioni e specificazioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone.
GU n. 150 del 25.06.2021
Entrata in vigore: 10.07.2021
...
Articolo 1
1. Sono approvate le disposizioni e specificazioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone contenute nell’Allegato Tecnico, che del presente decreto costituisce parte integrante.
2. Le disposizioni e le specificazioni contenute nell’Allegato Tecnico al presente decreto costituiscono l’articolazione in forma organica delle norme europee, integrate con le norme nazionali vigenti in materia.
3. Gli impianti realizzati in conformità alle disposizioni ed alle specificazioni contenute nell’Allegato Tecnico al presente decreto si presumono conformi ai requisiti essenziali di cui all’Allegato II del Regolamento (UE) 2016/424.
4. Resta ferma la possibilità di utilizzare soluzioni tecniche diverse da quelle prospettate dalle stesse disposizioni e prescrizioni, a condizione che venga dimostrata la conformità ai requisiti essenziali di cui all’Allegato II del Regolamento (UE) 2016/424.
Articolo 2
I progetti degli impianti a fune adibiti al trasporto di persone, elaborati secondo il Regolamento (UE) 2016/424 e presentati alle competenti Amministrazioni successivamente alla data di entrata in vigore del presente decreto, sono redatti in conformità alle disposizioni e prescrizioni contenute nell’Allegato Tecnico del presente decreto, fatto salvo quanto disposto dall’art. 1, comma 4, del presente decreto.
Articolo 3
Entro tre anni dall’entrata in vigore del presente decreto, le disposizioni e le prescrizioni di cui all’art. 1, comma 1, del presente decreto sono sottoposte a verifica al fine di accertare l’eventuale necessità di aggiornamento o revisione.
Articolo 4
È abrogato il decreto dirigenziale 16 novembre 2012 concernente «Disposizioni e prescrizioni tecniche per le infrastrutture degli impianti a fune adibiti al trasporto di persone » a far data dalle disposizioni del successivo art.5 del presente decreto.
_________
DISPOSIZIONI E SPECIFICAZIONI TECNICHE PER LE INFRASTRUTTURE DEGLI IMPIANTI A FUNE ADIBITI AL TRASPORTO DI PERSONE.
1. CAMPO DI APPLICAZIONE E SCOPO DELLE NORME
1.1 Oggetto
1.2 Campo di applicazione
1.3 Commissione funicolari aeree e terrestri
1.4 Soluzioni tecniche alternative
1.5 Soluzioni tecniche innovative
2. DOCUMENTAZIONE TECNICA E PROCEDURE
2.1 Documentazione tecnica
2.1.1 Documenti funiviari contenuti nel progetto di cui all’articolo 23 comma 6 del d.lgs. 50/2016
2.1.2 Progetto definitivo funiviario finalizzato all’ottenimento del nullaosta di cui all’art. 3 del D.P.R. 753/80
2.1.3 Progetto strutturale esecutivo dell’opera
2.2 Figure professionali
2.3 Procedure per l’esame dei progetti
2.3.1 Procedure relative al progetto di cui al punto 2.1.1
2.3.2 Procedure relative all’esame del progetto di cui al punto 2.1.2
2.3.3 Procedure per le soluzioni diverse o innovative di cui ai punti 1.4 e 1.5.
3. DISPOSIZIONI GENERALI
3.1 Tracciato e profilo della linea
3.1.1 Scelta del tracciato
3.1.2 Tracciato delle funicolari
3.1.3 Tracciato delle funivie
3.1.4 Tracciato delle sciovie e delle slittinovie
3.2 Profilo limite
3.2.1 Profilo limite delle funicolari
3.2.2 Profilo limite delle funivie
3.2.3 Profilo limite delle sciovie
3.2.4 Profilo limite delle funi dei circuiti di linea o portanti i conduttori di tali circuiti, delle funi di ancoraggio, di segnalazione e simili
3.2.5 Profilo limite delle funi di soccorso
3.3 Sagoma limite e distanza di sicurezza
3.3.1 Generalità
3.3.2 Distanze di sicurezza nelle funicolari
3.3.3 Distanze di sicurezza da elementi appartenenti alla funivia
3.3.4 Intervia delle funivie
3.3.5 Distanze di sicurezza da oggetti non appartenenti all’impianto ed al terreno
3.3.6 Sagoma limite, distanze di sicurezza nelle sciovie
3.4 Distanza massima dal terreno
3.4.1 Generalità
3.4.2 Funivie con veicoli chiusi
3.4.3 Funivie con veicoli aperti
3.5 Velocità di marcia e intervallo in tempo tra i veicoli
3.5.1 Velocità di marcia delle funicolari e delle funivie, generalità
3.5.2 Velocità di marcia delle funicolari e delle funivie
3.5.3 Intervallo minimo e distanza minima tra i veicoli nelle funivie a moto unidirezionale
3.5.4 Velocità di marcia e intervallo delle sciovie e delle slittinovie
4. NORME COMUNI ALLE STAZIONI
4.1 Vie di transito e aree di lavoro
4.1.1 Generalità
4.1.2 Aree d’imbarco delle seggiovie
4.1.3 Aree di sbarco delle seggiovie
4.1.4 Aree d’imbarco e di sbarco nelle stazioni intermedie delle seggiovie
4.1.5 Aree d’imbarco e di sbarco delle sciovie
4.1.6 Stazioni intermedie delle sciovie
4.1.7 Aree d’imbarco e sbarco delle cabinovie
4.2 Immagazzinamento dei veicoli d’impianti a collegamento temporaneo
4.3 Requisiti ulteriori
4.3.1 Norme comuni alle stazioni
4.3.2 Requisiti per impianti gemelli
5. STAZIONE MOTRICE
5.1 Caratteristiche generali
5.2 Argano e freni
5.2.1 Argano di funicolari e funivie
5.2.2 Sistemi frenanti di funicolari e funivie
5.2.3 Argano e freni delle sciovie
6. TENSIONE E GUIDA DELLE FUNI
6.1 Tensione delle funi
6.1.1 Generalità
6.1.2 Corsa del carrello tenditore
6.1.3 Fine corsa
6.1.4 Indicatori di posizione
6.1.5 Contrappeso e carrello di tensione
6.1.6 Dispositivi per la ripresa della tensione
6.2 Attacchi di estremità
6.3 Area di spostamento dei contrappesi
6.4 Dispositivi di ammortizzazione
6.5 Requisiti dei sistemi idraulici per il tensionamento delle funi
6.5.1 Aspetti costruttivi
6.5.2 Mantenimento e sorveglianza dei valori limite della tensione nominale
6.6 Requisiti dei sistemi di tensionamento fissi
6.6.1 Controllo della tensione delle funi
6.6.2 Regolazione della tensione delle funi
6.7 Requisiti degli altri dispositivi di tensionamento
6.8 Requisiti dei dispositivi di tensionamento delle sciovie
6.8.1 Generalità
6.8.2 Requisiti specifici per le sciovie
6.9 Guida e supporto delle funi – Generalità
6.10 Guida e supporto delle funi traenti delle funicolari
6.11 Guida e supporto delle funi delle funivie bifune
6.12 Guida della fune portante-traente delle funivie monofune
6.13 Guida della fune portante-traente delle sciovie
7. RECUPERO ED EVACUAZIONE
7.1 Generalità
7.1.1 Modalità di evacuazione
7.2 Piano di evacuazione
7.3 Tempi di recupero e di evacuazione
7.4 Percorsi di evacuazione delle funicolari
7.5 Evacuazione verticale
7.6 Evacuazione dei viaggiatori mediante veicoli di soccorso
7.7 Soccorso integrato
8. PREVENZIONE INCENDI
8.1 Generalità
8.2 Documentazione
8.2.1 Valutazione del rischio d’incendio
9. SEGNALAZIONE AL VOLO
9.1 Segnalazione agli enti e alle autorità
9.2 Dimensionamento
10. VENTO MASSIMO DI ESERCIZIO
10.1 Definizione di vento massimo di esercizio
10.2 Rilevazione del vento
10.3 Segnalazione del vento
10.4 Esclusioni
11. SISTEMI DI COMUNICAZIONE E INFORMAZIONE
11.1 Rete telefonica pubblica
11.2 Collegamenti telefonici interni
11.3 Comunicazioni ai viaggiatori
12. POSIZIONE DELLA SEGNALETICA PER I VIAGGIATORI SUGLI IMPIANTI A FUNE
12.1 Generalità
12.2 Posizione dei pittogrammi
12.2.1 Segnali di informazione
12.2.2 Segnali di obbligo
12.2.3 Segnali di divieto
12.2.4 Segnali di pericolo
12.3 Ulteriori precisazioni
13. FUNICOLARI AD ESERCIZIO AUTOMATICO
13.1 Generalità
13.2 Sorveglianza dell’esercizio
13.3 Recinzione del tracciato
13.4 Accesso al tracciato
13.5 Evacuazione
13.6 Accesso ai veicoli
13.7 Sorveglianza del tracciato
14. FUNIVIE BIFUNE SENZA FRENO SULLA PORTANTE
14.1 Premessa
14.2 Provvedimenti per assicurare l'integrità dell'anello trattivo
14.3 Misure intese a prevenire incidenti con anello integro
14.3.1 Limitazione della libertà di oscillazione
14.3.2 Assenza di accavallamenti
15. CALCOLI FUNIVIARI E AZIONI CORRELATE
15.1 Indicazioni generali per i calcoli
15.1.1 Generalità
15.1.2 Metodi di calcolo
15.1.3 Presentazione dei calcoli
15.1.4 Giustificazioni mediante prove sperimentali
15.1.5 Azioni
15.2 Calcoli giustificativi delle funi
15.2.1 Generalità
15.2.2 Azioni per il calcolo di linea e la verifica delle funi
15.3 Grado di sicurezza – Generalità
15.4 Funi portanti
15.4.1 Tensioni e frecce delle funi
15.4.2 Grado di sicurezza
15.4.3 Sollecitazione di flessione
15.4.4 Forze di appoggio minime
15.5 Funi traenti e funi zavorra
15.5.1 Tensioni e frecce delle funi
15.5.2 Grado di sicurezza
15.5.3 Sollecitazione di flessione
15.5.4 Forze di appoggio minime
15.6 Funi portanti-traenti delle funivie
15.6.1 Tensioni e frecce delle funi
15.6.2 Grado di sicurezza
15.6.3 Sollecitazione a flessione
15.6.4 Forze di appoggio minime
15.7 Funi portanti-traenti delle sciovie
15.7.1 Tensioni e frecce delle funi
15.7.2 Grado di sicurezza
15.7.3 Sollecitazione a flessione
15.7.4 Forze di appoggio minime
15.8 Funi tenditrici .
15.8.1 Tensioni delle funi
15.8.2 Grado di sicurezza
15.8.3 Sollecitazione di flessione
15.9 Funi soccorso
15.9.1 Tensioni delle funi, frecce, forze di appoggio, sollecitazioni di flessione
15.9.2 Grado di sicurezza
15.10Funi dei circuiti di linea o portanti i conduttori di tali circuiti, funi di ancoraggio, di segnalazione e simili
15.10.1 Grado di sicurezza
15.10.2 Sollecitazione di flessione
15.11 Trasmissione della forza periferica alla puleggia motrice
15.11.1 Verifica dell’aderenza
15.11.2 Coefficiente d’attrito ammissibile sulla puleggia motrice
15.11.3 Condizioni di carico
15.12 Calcolo della potenza motrice
15.12.1 Generalità
15.12.2 Potenza continuativa in caso di velocità di marcia e/o forza periferica variabili
15.12.3 Potenza continuativa in caso di velocità di marcia e/o forza periferica costanti
15.12.4 Potenza in accelerazione
15.13 Documentazione tecnica da presentare per la giustificazione del calcolo di linea
15.13.1 Per le funicolari
15.13.2 Per le funivie
15.13.3 Per le sciovie
16. OPERE CIVILI D’INFRASTRUTTURE FUNIVIARIE
16.1 Campo di applicazione
16.2 Normativa di riferimento
16.3 Vita nominale e classe d’uso
16.4 Materiali .
16.4.1 Generalità
16.4.2 Materiali diversi dall'acciaio
16.5 Azioni
16.5.1 Pesi propri e azioni di carattere prettamente civile
16.5.2 Azioni variabili funiviarie agenti sulle opere civili
16.5.3 Azioni variabili ambientali
16.5.4 Azioni sismiche
16.5.5 Azioni derivanti dalla valanga
16.5.6 Azioni eccezionali funiviarie agenti sulle opere civili
16.6 Combinazione delle azioni
16.7 Verifiche
16.7.1 Verifiche geotecniche allo SLU in combinazione sismica
16.7.2 Verifiche allo SLE
16.7.3 Verifiche a fatica
16.7.4 Rotazione dei sostegni in caso di scarrucolamento
16.8 Prescrizioni particolari
16.8.1 Tiranti di ancoraggio
16.8.2 Collegamenti
17. ELETTROTECNICA DI IMPIANTO
17.1 Oggetto, requisiti generali e definizioni
17.1.1 Oggetto
17.1.2 Requisiti generali
17.1.3 Definizioni
17.2 Sorgenti di energia e sistemi di distribuzione: criteri realizzativi
17.2.1 Interruttori generali funiviari
17.2.2 Ulteriori caratteristiche degli interruttori generali
17.2.3 Caratteristiche dei sistemi di distribuzione
17.2.4 Condizioni per l’allacciamento di utenze diverse
17.2.5 Criteri per la disponibilità dell’azionamento di riserva
17.2.6 Criteri per la disponibilità degli azionamenti di recupero o di soccorso
17.2.7 Sorgenti di energia per la marcia di recupero e soccorso
17.2.8 Illuminazione
17.2.9 Illuminazione notturna
17.2.10 Telecomando della marcia da stazioni non motrici
17.3 Protezione contro i contatti diretti e indiretti ed equipotenzialità delle masse metalliche
17.3.1 Norme di riferimento per le protezioni contro i contatti diretti e indiretti
17.3.2 Impianto di terra locale
17.3.3 Equipotenzialità
17.3.4 Messa a terra delle funi
17.4 Protezione delle strutture contro i fulmini
17.4.1 Norme di riferimento per la protezione delle strutture contro i fulmini
17.4.2 Protezione dei sostegni
17.4.3 Scaricatori
17.5 Ulteriori requisiti
17.5.1 Norme sui locali che alloggiano quadri elettrici
17.5.2 Ubicazione quadri elettrici
17.5.3 Protezione dai contatti accidentali
17.5.4 Disposizione degli interruttori di manutenzione e arresto di emergenza
17.5.5 Ubicazione minima interruttori di manutenzione
17.5.6 Ubicazione minima pulsanti di arresto di emergenza
17.5.7 Arresto per rottura delle funi ausiliarie
17.6 Registratore dei dati di arresto e di rallentamento per vento
18. ATTRAVERSAMENTI E PARALLELISMI
18.1 Documentazione
18.2 Nulla osta o autorizzazione
18.3 Dichiarazione del direttore dei lavori di opere di attraversamento
18.4 Disposizioni tecniche
18.4.1 Attraversamenti con percorsi stradali
18.4.2 Attraversamenti con corsi d’acqua navigabili
18.4.3 Attraversamenti con altri sistemi di trasporto ad impianti fissi
18.4.4 Attraversamenti superiori da parte di teleferiche, impianti similari e funivie
destinate al trasporto privato
18.4.5 Parallelismi con altri impianti a fune
18.4.6 Attraversamenti e parallelismi con linee elettriche e telefoniche
18.4.7 Attraversamenti e parallelismi di canali e condotte
18.4.8 Attraversamenti e parallelismi di condotte d’acqua in pressione
19. RIPOSIZIONAMENTI
19.1 Generalità
19.2 Condizioni per il riposizionamento
19.2.1 Condizioni temporali
19.2.2 Esecutore del riposizionamento
19.3 Procedure per lo smontaggio e il contestuale riposizionamento
19.3.1 Domanda per il riposizionamento
19.3.2 Verifica delle scadenze
19.3.3 Individuazione dell’esecutore del riposizionamento
19.3.4 Sopralluogo
19.3.5 Termini temporali per lo smontaggio e l’immagazzinamento
19.3.6 Inventario dei componenti
19.4 Procedure per il solo smontaggio
19.4.1 Domanda di smontaggio
19.4.2 Verifica delle scadenze e sopralluogo
19.4.3 Individuazione ditta incaricata dello smontaggio
19.4.4 Smontaggio ed inventario dei componenti
19.5 Progetto di riposizionamento
19.5.1 Termini per la presentazione del progetto di riposizionamento
19.5.2 Documentazione di impianto
19.5.3 Norme di riferimento per la progettazione
19.5.4 Contenuti del progetto
19.5.5 Ammissibilità all’utilizzo di componenti diversi
19.5.6 Azioni
19.5.7 Funi
19.5.8 Ulteriori richieste per impianti certificati
19.5.9 Competenza sui progetti
19.6 Fine lavori
19.7 Scadenziario
19.8 Manuale d’uso e manutenzione
20. DISPOSIZIONI PROGETTUALI SPECIFICHE DA ADOTTARE NELL’INFRASTRUTTURA PER LA SICUREZZA DEL PERSONALE
20.1 Normativa di settore e specificità funiviarie
20.2 Requisiti generali per la protezione del personale
20.3 Requisiti di sicurezza per la protezione del personale
20.3.1 Accesso ai dispositivi di tensionamento della fune
20.3.2 Attrezzamenti specifici per l’evacuazione
20.3.3 Aree di lavoro e di passaggio e piattaforme di lavoro
20.3.4 Accesso alle piattaforme di lavoro
20.3.5 Parapetti nelle aree di lavoro e di passaggio e nelle piattaforme di lavoro
20.3.6 Rotaie per i veicoli nei magazzini e nei luoghi di manutenzione
20.3.7 Punti di attacco per i dispositivi per le operazioni sollevamento e abbassamento delle funi o altri componenti di impianto
20.3.8 Punti di ancoraggio per la messa fuori tensione delle funi
20.3.9 Dispositivi di movimentazione dei carichi pesanti
Collegati
[box-note]Decreto 11 maggio 2017
D.D. n. 288 del 17 settembre 2014
Decreto 18 febbraio 2011
Decreto Dirigenziale n. 189 del 29 maggio 2019
La sezione legislazione "Impianti a fune trasporto persone"
Regolamento (UE) 2016/424: Impianti a fune[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Decreto Dirigenziale n. 172 del 18 Giugno 2021.pdf |
2037 kB | 16 |
RAPEX Report 23 del 11/06/2021 N. 12 A12/00845/21 Danimarca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 23 del 11/06/2021 N. 12 A12/0845/21 Danimarca
Approfondimento tecnico: Lama per sega circolare
Il prodotto Drillpro 4-9 Inch Grinder Chain Disc 7-22 Tooth Wo, di marca sconosciuta, è stato sottoposto alla procedura richiamo presso i consumatori perché non conforme alla Direttiva 2006/42/CE del Parlamento Europeo e del Consiglio del 17 maggio 2006 relativa alle macchine e che modifica la Direttiva 95/16/CE.
La lama della sega circolare può essere montata su una smerigliatrice angolare che potrebbe quindi, contro l'uso previsto, essere utilizzata come sega circolare a mano.
L’uso scorretto potrebbe causare dei contraccolpi o la perdita di controllo dell’attrezzatura.
Direttiva 2006/42/CE
Allegato I
Requisiti essenziali di sicurezza e di tutela della salute relativi alla progettazione e alla costruzione delle macchine
Principi generali
1. Il fabbricante di una macchina, o il suo mandatario, deve garantire che sia effettuata una valutazione dei rischi per stabilire i requisiti di sicurezza e di tutela della salute che concernono la macchina. La macchina deve inoltre essere progettata e costruita tenendo conto dei risultati della valutazione dei rischi.
Con il processo iterativo della valutazione dei rischi e della riduzione dei rischi di cui sopra, il fabbricante o il suo mandatario:
- stabilisce i limiti della macchina, il che comprende l'uso previsto e l'uso scorretto ragionevolmente prevedibile,
- individua i pericoli cui può dare origine la macchina e le situazioni pericolose che ne derivano,
- stima i rischi, tenendo conto della gravità dell'eventuale lesione o danno alla salute e della probabilità che si verifichi,
- valuta i rischi al fine di stabilire se sia richiesta una riduzione del rischio conformemente all'obiettivo della presente direttiva,
- elimina i pericoli o riduce i rischi che ne derivano, applicando le misure di protezione nell'ordine indicato nel punto 1.1.2, lettera b).
2. Gli obblighi previsti dai requisiti essenziali di sicurezza e di tutela della salute si applicano soltanto se esiste il pericolo corrispondente per la macchina in questione, allorché viene utilizzata nelle condizioni previste dal fabbricante, o dal suo mandatario, o nelle condizioni anormali prevedibili. Il principio di integrazione della sicurezza di cui al punto 1.1.2 e gli obblighi relativi alla marcatura e alle istruzioni di cui ai punti 1.7.3 e 1.7.4 si applicano comunque.
3. I requisiti essenziali di sicurezza e di tutela della salute elencati nel presente allegato sono inderogabili. Tuttavia, tenuto conto dello stato della tecnica, gli obiettivi da essi prefissi possono non essere raggiunti. In tal caso la macchina deve, per quanto possibile, essere progettata e costruita per tendere verso questi obiettivi.
4. Il presente allegato si articola in varie parti. La prima ha una portata generale ed è applicabile a tutti i tipi di macchine. Le altre parti si riferiscono a taluni tipi di pericoli più specifici. Tuttavia è indispensabile esaminare il presente allegato in tutte le sue parti, al fine di essere certi di soddisfare tutti i requisiti essenziali pertinenti. Nel progettare la macchina, conformemente al punto 1 dei presenti principi generali, si tiene conto dei requisiti esposti nella parte generale e di quelli elencati in una o più delle altre parti in funzione dei risultati della valutazione dei rischi.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 23 del 11_06_2021 N. 12 A12_00845_21 Danimarca.pdf Lama per sega circolare |
342 kB | 0 |
Nuovo Regolamento macchine: definita la "modifica sostanziale" | Note
Nuovo Regolamento macchine: definita la "modifica sostanziale" | Note
ID 13797 | 16.06.2021 / Documento completo allegato
Nel nuovo Regolamento macchine 2021 (proposta) prevista la definizione di "modifica sostanziale" ad una macchina e gli obblighi per chi apporta tale modifica.
Indicazioni su “modifiche” alle macchine sono presenti nella Guida Ufficiale Direttiva macchine IT 2010 ed EN 2019 (vedi in fondo documento).
Si illustrano i periodi d’interesse del nuovo Regolamento macchine (proposta).
[box-note]Considerando (23)
Al fine di garantire che le macchine, quando immesse sul mercato o messe in servizio, non comportino rischi per la salute e la sicurezza delle persone o degli animali domestici e non arrechino danni alle cose e, se del caso, all'ambiente, devono essere soddisfatti i requisiti essenziali di salute e sicurezza.
Qualora le macchine siano successivamente modificate, fisicamente o digitalmente, in un modo non previsto dal fabbricante e tale modifica posso comportare che non siano più soddisfatti i pertinenti requisiti essenziali di salute e sicurezza, la modifica deve essere considerata sostanziale.
Ad esempio, gli utilizzatori possono caricare un software nella macchina che non è previsto dal fabbricante e che può generare nuovi rischi. Al fine di garantire la conformità di tale prodotto con i relativi requisiti essenziali di salute e sicurezza, la persona che effettua la modifica sostanziale dovrebbe eseguire una nuova valutazione di conformità prima di immettere sul mercato la macchina modificata o di metterla in servizio.
Tale requisito dovrebbe applicarsi solo alla parte modificata della macchina, a condizione che la modifica non influisca sulla macchina nel suo complesso. Al fine di evitare un onere inutile e sproporzionato, la persona che effettua la modifica sostanziale non dovrebbe essere tenuta a ripetere i test e produrre nuova documentazione in relazione ad aspetti della macchina che non sono interessati dalla modifica.
Dovrebbe spettare alla persona che esegue la modifica sostanziale dimostrare che la modifica non ha un impatto sulla macchina nel suo complesso.[/box-note]
[box-note]Art. 3 Definizioni
«modifica sostanziale»: modifica di una macchina, mediante mezzi fisici o digitali dopo che la macchina è stata immessa sul mercato o messa in servizio, non prevista dal fabbricante e per cui la conformità della macchina ai pertinenti requisiti essenziali di salute e sicurezza potrebbe essere alterata;[/box-note]
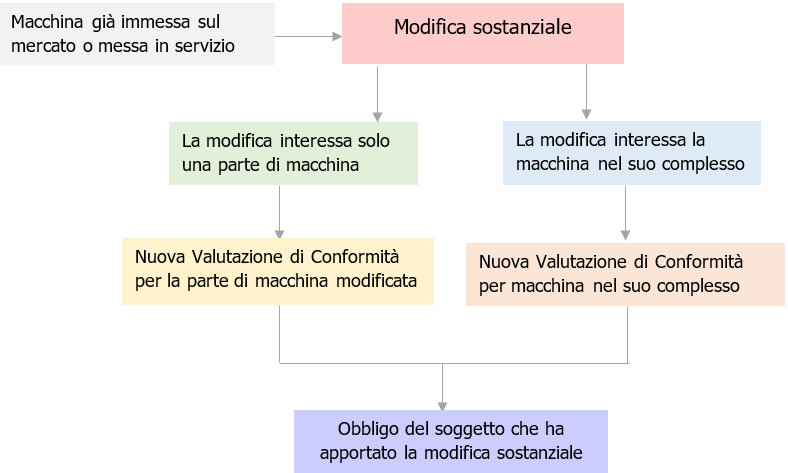
[box-note]Articolo 15 Altri casi in cui si applicano gli obblighi dei fabbricanti
Una persona fisica o giuridica, diversa dal fabbricante, dall'importatore o dal distributore, che apporta una modifica sostanziale alla macchina deve essere considerato un fabbricante ai fini del presente regolamento ed è soggetto agli obblighi del fabbricante di cui all'articolo 10 per la parte della macchina interessata dalla modifica o, se la modifica sostanziale ha un impatto sulla sicurezza della macchina nel suo complesso, per l'intera macchina.[/box-note]
In Figura 1 la Procedura per una “modifica sostanziale”.
Fig. 1 - Procedura Artt. 9, 15 per una modifica sostanziale ad una macchina
[box-info]Note:
- La modifica di una macchina da funzionamento manuale ad automatico è una modifica sostanziale (dettagliare)
- Una modifica sostanziale è ad esempio il revamping di una macchina nella quale il funzionamento è modificato da logica elettromeccanica a logica programmabile.[/box-info]
[box-warning]Miglioramenti di sicurezza / Modifiche
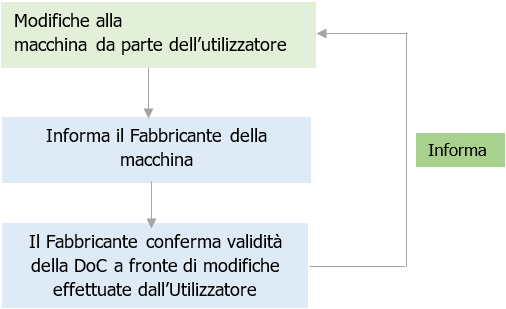
Modifiche su aspetti di sicurezza (1) non sono in generale modifiche sostanziali, ma è sempre da considerare che il Fabbricante originario, dovrebbe esserne informato, affinché possa aggiornare il Fascicolo Tecnico e/o la Valutazione dei Rischi e confermare la validità della Dichiarazione CE/UE di Conformità già emessa. (ns procedura a seguire)
La Procedura adottata serve ad allineare la Valutazione di conformità della macchina già immessa sul mercato o messa in servizio ed il FT esistente conservato da parte del fabbricante su modifiche effettuate dall’utilizzatore (che in generale non è a conoscenza della Valutazione dei rischi del fabbricante) e che potrebbero non essere autorizzate dal fabbricante ed evitare eventuali contestazioni su modifiche non previsti dal fabbricante (anche di miglioramenti di sicurezza), ed inficiare la DoC conservata dall’utilizzatore (vedi Fig. 2).[/box-warning]
Fig. 2 - Procedura Utilizzatore / Fabbricante per modifiche effettuate su una macchina (Certifico)
[box-note]D.Lgs. 81/2008
Art. 71 - Obblighi del datore di lavoro
1. Il datore di lavoro mette a disposizione dei lavoratori attrezzature conformi ai requisiti di cui all'articolo precedente, idonee ai fini della salute e sicurezza e adeguate al lavoro da svolgere o adattate a tali scopi che devono essere utilizzate conformemente alle disposizioni legislative di recepimento delle direttive comunitarie.
2. All'atto della scelta delle attrezzature di lavoro, il datore di lavoro prende in considerazione:
a) le condizioni e le caratteristiche specifiche del lavoro da svolgere;
b) i rischi presenti nell'ambiente di lavoro;
c) i rischi derivanti dall'impiego delle attrezzature stesse;
d) i rischi derivanti da interferenze con le altre attrezzature già in uso.
3. Il datore di lavoro, al fine di ridurre al minimo i rischi connessi all'uso delle attrezzature di lavoro e per impedire che dette attrezzature possano essere utilizzate per operazioni e secondo condizioni per le quali non sono adatte, adotta adeguate misure tecniche ed organizzative, tra le quali quelle dell'allegato VI.
4. Il datore di lavoro prende le misure necessarie affinché:
a) le attrezzature di lavoro siano:
1) installate ed utilizzate in conformità alle istruzioni d'uso;
2) oggetto di idonea manutenzione al fine di garantire nel tempo la permanenza dei requisiti di sicurezza di cui all'articolo 70 e siano corredate, ove necessario, da apposite istruzioni d'uso e libretto di manutenzione;
3) assoggettate alle misure di aggiornamento dei requisiti minimi di sicurezza stabilite con specifico provvedimento regolamentare adottato in relazione alle prescrizioni di cui all'articolo 18, comma 1, lettera z);
b) siano curati la tenuta e l'aggiornamento del registro di controllo delle attrezzature di lavoro per cui lo stesso è previsto.
5. Le modifiche apportate alle macchine quali definite all'articolo 1, comma 2, del decreto del Presidente della Repubblica 24 luglio 1996, n. 459 , per migliorarne le condizioni di sicurezza in rapporto alle previsioni del comma 1, ovvero del comma 4, lettera a), numero 3), non configurano immissione sul mercato ai sensi dell'articolo 1, comma 3, secondo periodo, sempre che non comportino modifiche delle modalità di utilizzo e delle prestazioni previste dal costruttore.[/box-note]
CAPO IV VALUTAZIONE DELLA CONFORMITÀ
Articolo 21 Procedure di valutazione della conformità per le macchine eccetto le quasi-macchine
1. Per certificare la conformità la macchina al presente regolamento, il fabbricante o il suo mandatario e la persona che ha apportato una modifica sostanziale al prodotto meccanico applicano una delle procedure di valutazione della conformità di cui all'art. paragrafi 2 e 3.
2. Se la macchina è una macchina ad alto rischio elencata nell'allegato I, il fabbricante o il suo mandatario e la persona che ha apportato una modifica sostanziale alla macchina applicano una delle seguenti procedure:
a) procedura di esame UE del tipo (modulo B) di cui all'allegato VII, seguita dalla conformità al tipo basata sul controllo interno della produzione (modulo C) di cui all'allegato VIII;
(b) conformità basata sulla garanzia di qualità totale (modulo H) di cui all'allegato IX.
3. Se la macchina non è una macchina ad alto rischio elencata nell'allegato I, il fabbricante o il rappresentante autorizzato del fabbricante e la persona che ha apportato una modifica sostanziale alla macchina applicano la procedura di controllo interno della produzione (modulo A) di cui all'allegato VI.
4. Gli organismi notificati tengono conto degli interessi e delle esigenze specifici delle piccole e medie imprese quando fissano le tariffe per la valutazione della conformità e riducono tali tariffe in proporzione ai loro interessi e bisogni specifici.
____
[box-note](23) Whereas:
In order toensure that machinery products, when placed on the market or put into service, do not entail health and safety risks for persons or domestic animals and do not cause harm to property and, where applicable, the environment, essential health and safety requirements should be set out which have to be met in order for the machinery products to be allowed on the market. Machinery products should comply with the essential health and safety requirements when placed on the market or put into service. Where such machinery products are subsequently modified, by physical or digital means, in a way that is not foreseen by the manufacturer and that may imply that it no longer meets the relevant essential health and safety requirements, the modification should be considered as substantial. For example, users may upload software in a machinery product that is not foreseen by the manufacturer and that may
generate new risks. In order to ensure the compliance of such a machinery product with the relevant essential health and safety requirements, the person that carries out
the substantial modification should be required to perform a new conformity assessment before placing the modified machinery product on the market or putting it into service. That requirement should only apply with respect to the modified part of the machinery product, provided that the modification does not affect the machinery product as a whole. In order to avoid an unnecessary and disproportionate burden, the person carrying out the substantial modification should not be required to repeat tests and produce new documentation in relation to aspects of the machinery product that are not impacted by the modification. It should be up to the person who carries out the substantial modification to demonstrate that the modification does not have an impact on the machinery product as a whole.
Art. 3 Definitions
16. ‘substantial modification’ means a modification of a machinery product, by physical or digital means after that machinery product has been placed on the market or put into service, which is not foreseen by the manufacturer and as a result of which the compliance of the machinery product with the relevant essential health and safety requirements may be affected;
Article 15 Other cases in which obligations of manufacturers apply
A natural or legal person, other than the manufacturer, the importer or the distributor, that carries out a substantial modification of the machinery product shall be considered a manufacturer for the purposes of this Regulation and shall be subject to the obligations of the manufacturer set out in Article 10 for the part of the machinery product that is affected by the modification or, if the substantial modification has an impact on the safety of the machinery product as a whole, for the entire machinery product.
CHAPTER IV CONFORMITY ASSESSMENT
Article 21 Conformity assessment procedures for machinery products except partly completed machinery
1. In order to certify the conformity of a machinery product with this Regulation, the manufacturer or its authorised representative and the person who has carried out a substantial modification to the machinery product, shall apply one of the procedures for assessment of conformity referred to in paragraphs 2 and 3.
2. Where the machinery product is a high-risk machinery product listed in Annex I, the manufacturer or the manufacturer’s authorised representative and the person who has carried out a substantial modification to the machinery product shall apply one of the following procedures:
(a) EU type-examination procedure (module B) provided for in Annex VII, followed by conformity to type based on internal production control (module C) set out in Annex VIII;
(b) Conformity based on full quality assurance (module H) set out in Annex IX.
3. Where the machinery product is not a high-risk machinery product listed in Annex I, the manufacturer or the manufacturer’s authorised representative and the person who has made a substantial modification to the machinery product shall apply the internal production control procedure (module A) set out in Annex VI.
4. Notified bodies shall take into account the specific interests and needs of small and medium sized enterprises when setting the fees for conformity assessment and reduce those fees proportionately to their specific interests and needs.
ANNEX I
HIGH-RISK MACHINERY PRODUCTS
1. Circular saws (single- or multi-blade) for working with wood and material with similar physical characteristics or for working with meat and material with similar physical characteristics, of the following types:
1.1. sawing machinery with fixed blade(s) during cutting, having a fixed bed or support with manual feed of the workpiece or with a demountable power feed;
1.2. sawing machinery with fixed blade(s) during cutting, having a manually operated reciprocating saw-bench or carriage;
1.3. sawing machinery with fixed blade(s) during cutting, having a built-in mechanical feed device for the workpieces, with manual loading and/or unloading;
1.4. sawing machinery with movable blade(s) during cutting, having mechanical movement of the blade, with manual loading and/or unloading.
2. Hand-fed surface planing machinery for woodworking.
3. Thicknessers for one-side dressing having a built-in mechanical feed device, with manual loading and/or unloading for woodworking.
4. Band-saws with manual loading and/or unloading for working with wood and material with similar physical characteristics or for working with meat and material with similar physical characteristics, of the following types:
4.1. sawing machinery with fixed blade(s) during cutting, having a fixed or reciprocatingmovement bed or support for the workpiece;
4.2. sawing machinery with blade(s) assembled on a carriage with reciprocating motion.
5. Combined machinery of the types referred to in points 1 to 4 and in point 7 for working with wood and material with similar physical characteristics.
6. Hand-fed tenoning machinery with several tool holders for woodworking.
7. Hand-fed vertical spindle moulding machinery for working with wood and material with similar physical characteristics.
8. Portable chainsaws for woodworking.
9. Presses, including press-brakes, for the cold working of metals, with manual loading and/or unloading, whose movable working parts may have a travel exceeding 6 mm and a speed exceeding 30 mm/s.
10. Injection or compression plastics-moulding machinery with manual loading or unloading.
11. Injection or compression rubber-moulding machinery with manual loading or unloading.
12. Machinery for underground working of the following types:
12.1. locomotives and brake-vans;
12.2. hydraulic-powered roof supports.
13. Manually loaded trucks for the collection of household refuse incorporating a compression mechanism.
14. Removable mechanical transmission devices including their guards.
15. Guards for removable mechanical transmission devices.
16. Vehicle servicing lifts.
17. Devices for the lifting of persons or of persons and goods involving a hazard of falling from a vertical height of more than three metres.
18. Portable cartridge-operated fixing and other impact machinery.
19. Protective devices designed to detect the presence of persons.
20. Power-operated interlocking movable guards designed to be used as safeguards in machinery referred to in points 9, 10 and 11.
21. Logic units to ensure safety functions.
22. Roll-over protective structures (ROPS).
23. Falling-object protective structures (FOPS).
24. Software ensuring safety functions, including AI systems.
25. Machinery embedding AI systems ensuring safety functions.[/box-note]
...
segue in allegato
Collegati
[box-note]
Proposal for a Regulation on machinery products
Direttiva macchine 2006/42/CE
Guida direttiva macchine 2006/42/CE - Ed. 2019 EN
Guida Direttiva macchine 2006/42/CE - Ed. 2010 ITA
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine
Tavola di concordanza estesa Direttiva/Regolamento Macchine
D.Lgs. 81/2008 Testo Unico Salute e Sicurezza Lavoro[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Nuovo regolamento macchine - Modifica sostanziale - Note Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
317 kB | 490 |
RAPEX Report 21 del 28/05/2021 N. 22 A12/00725/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 21 del 28/05/2021 N. 22 A12/00725/21 Repubblica Ceca
Approfondimento tecnico: Palloncini
Il prodotto di marca DONGFANG, mod. A3, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli e alla pertinente norma europea EN 71-12:2017 “Sicurezza dei giocattoli - Parte 12: N-nitrosammine e sostanze N-nitrosabili”.
La gomma del palloncino rilascia una quantità eccessiva di N-nitrosammine e N-nitrosabile (valori misurati: 0,072 mg/kg e 2,92 mg/kg rispettivamente). Queste sostanze possono causare il cancro attraverso l'ingestione o l'esposizione cutanea. Un bambino potrebbe toccare o mettere il prodotto in bocca.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
[…] III. Proprietà Chimiche
1. I giocattoli devono essere progettati e costruiti in modo che non ci siano rischi di effetti nocivi sulla salute dell’uomo dovuti all’esposizione alle sostanze o alle miscele chimiche di cui i giocattoli sono costituiti o che sono in essi contenuti, ove i giocattoli vengono utilizzati conformemente a quanto prevede l’articolo 10, paragrafo 2, primo comma.
I giocattoli devono essere conformi alla pertinente legislazione comunitaria concernente determinate categorie di prodotti o attenersi alle restrizioni applicabili ad alcune sostanze e miscele.
2. I giocattoli che siano essi stessi sostanze o miscele devono inoltre essere conformi alla direttiva 67/548/CEE del Consiglio, del 27 giugno 1967, concernente il ravvicinamento delle disposizioni legislative, regolamentari e amministrative relative alla classificazione, all’imballaggio e all’etichettatura delle sostanze pericolose (1), della direttiva 1999/45/CE del Parlamento europeo e del Consiglio, del 31 maggio 1999, concernente il ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri relative alla classificazione, all’imballaggio e all’etichettatura dei preparati pericolosi (2) e del regolamento (CE) n. 1272/2008, del Parlamento europeo e del Consiglio, ove applicabile, relativo alla classificazione, imballaggio ed etichettatura di certe sostanze e miscele (3).
3. Fatte salve le restrizioni di cui al paragrafo 2 del punto 1, prima frase, è vietato l’impiego nei giocattoli, in loro componenti o in parti degli stessi distinte a livello microstrutturale, di sostanze classificate come cancerogene, mutagene o tossiche per la riproduzione (CMR) delle categorie 1A, 1B o 2 di cui al regolamento (CE) n. 1272/2008.
4. In deroga al punto 3, le sostanze o miscele classificate come CMR delle categorie di cui all’appendice B, sezione 3, possono essere utilizzate nei giocattoli, in loro componenti o in parti degli stessi distinte a livello microstrutturale, purché sia rispettata almeno una delle seguenti condizioni:
a) tali sostanze e miscele sono contenute in una concentrazione singola pari o inferiore alle pertinenti concentrazioni stabilite negli atti giuridici della Comunità menzionati nell’appendice B, sezione 2, per la classificazione delle miscele contenenti tali sostanze;
b) tali sostanze e miscele non sono in alcun modo accessibili ai bambini, anche mediante inalazione, quando il giocattolo è utilizzato come indicato all’articolo 10, paragrafo 2, primo comma; o
c) è stata adottata una decisione ex articolo 46, paragrafo 3, per autorizzare la sostanza o miscela e il suo utilizzo, e la sostanza o miscela e il suo uso consentito sono stati elencati nell’appendice A.
Tale decisione può essere adottata se si rispettano le seguenti condizioni:
i) l’uso della sostanza o miscela è stato valutato dal comitato scientifico competente ed è risultato sicuro, in particolare riguardo all’esposizione;
ii) non sono disponibili sostanze o miscele alternative idonee, come attestato dall’analisi delle alternative; e
iii) la sostanza o miscela non è vietata per impieghi in articoli di consumo a norma del regolamento (CE) n. 1907/2006.
La Commissione incarica il comitato scientifico competente di eseguire una nuova valutazione di tali sostanze o miscele non appena emergano preoccupazioni in merito alla sicurezza e al più tardi ogni cinque anni dalla data dell’adozione di una decisione a norma dell’articolo 46, paragrafo 3. […]
[…] 8. Fatta salva l’applicazione dei punti 3 e 4, è vietato l’uso di nitrosammine e di sostanze nitrosabili nei giocattoli destinati ai bambini di età inferiore a 36 mesi o in altri giocattoli destinati ad essere portati alla bocca, qualora la migrazione di tali sostanze sia pari o superiore a 0,05 mg/kg per le nitrosammine e a 1 mg/kg per le sostanze nitrosabili. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 21 del 28_05_2021 N. 22 A12_00725_21 Repubblica Ceca.pdf Palloncini |
361 kB | 0 |
Direttiva (UE) 2021/903
Direttiva (UE) 2021/903
Direttiva (UE) 2021/903 della Commissione del 3 giugno 2021 che modifica la direttiva 2009/48/CE del Parlamento europeo e del Consiglio per quanto riguarda i valori limite specifici per l’anilina in determinati giocattoli
GU L 197/110 del 4.6.2021
Entrata in vigore: 24 Giugno 2021
Applicazione: 5 dicembre 2022
_______
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
vista la direttiva 2009/48/CE del Parlamento europeo e del Consiglio, del 18 giugno 2009, sulla sicurezza dei giocattoli, in particolare l’articolo 46, paragrafo 2,
considerando quanto segue:
visto il trattato sul funzionamento dell’Unione europea,
vista la direttiva 2009/48/CE del Parlamento europeo e del Consiglio, del 18 giugno 2009, sulla sicurezza dei giocattoli, in particolare l’articolo 46, paragrafo 2,
considerando quanto segue:
(1) La direttiva 2009/48/CE stabilisce determinate prescrizioni per le sostanze chimiche classificate come cancerogene, mutagene o tossiche per la riproduzione a norma del regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio. L’allegato II, appendice C, della direttiva 2009/48/CE stabilisce valori limite specifici per i prodotti chimici utilizzati nei giocattoli destinati ai bambini di età inferiore ai 36 mesi o in altri giocattoli destinati ad essere messi in bocca.
(2) L’anilina (numero CAS 62-53-3) è classificata come cancerogena di categoria 2 e mutagena di categoria 2 ai sensi del regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio. A norma dell’allegato II, parte III, punto 5, lettera a), della direttiva 2009/48/CE, le sostanze cancerogene di categoria 2 come l’anilina possono essere utilizzate nei giocattoli in una concentrazione singola pari o inferiore alle pertinenti concentrazioni stabilite nel regolamento (CE) n. 1272/2008 per la classificazione delle miscele contenenti tali sostanze, ovvero l’1 %, che corrisponde a 10 000 mg/kg («tenore limite»). Lo stesso tenore limite si applica alle sostanze mutagene di categoria 2.
(3) Nel suo parere del 29 maggio 2007 il Comitato scientifico dei rischi sanitari e ambientali (CSRSA) ha reputato che i composti cancerogeni, mutageni o tossici per la riproduzione (CMR) non dovrebbero essere presenti nei giocattoli. Secondo le conclusioni della relazione di valutazione dei rischi dell’Unione europea è necessario limitare i rischi per la salute dei consumatori associati all’uso di prodotti contenenti anilina. Tali conclusioni erano basate su «preoccupazioni relative alla mutagenicità e cancerogenicità derivanti dall’esposizione dovuta all’uso di prodotti contenenti anilina, in quanto sostanza identificata come cancerogena senza un livello soglia.» Nel suo parere relativo alla restrizione di sostanze contenute negli inchiostri per tatuaggi e nel trucco permanente , il comitato per la valutazione dei rischi (RAC) dell’Agenzia europea per le sostanze chimiche ha indicato che l’anilina è considerata una sostanza cancerogena senza un livello di soglia. L’anilina può quindi provocare il cancro anche a un livello di esposizione minimo.
(4) La Commissione ha istituito il gruppo di esperti sulla sicurezza dei giocattoli, incaricato di assisterla nella preparazione di proposte legislative e iniziative politiche nel settore della sicurezza dei giocattoli. Per questioni inerenti alle sostanze chimiche che possono essere utilizzate nei giocattoli, il gruppo di esperti sulla sicurezza dei giocattoli si avvale della consulenza del suo sottogruppo «prodotti chimici» (gruppo di lavoro sui prodotti chimici nei giocattoli).
(5) Nel corso della riunione del sottogruppo «prodotti chimici» del 18 febbraio 2015, diversi membri hanno indicato che l’anilina può trovarsi nei materiali colorati per giocattoli, come tessili o cuoio, se sottoposti alla prova di scissione riduttiva di cui all’appendice 10 del regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio. La presenza di anilina nei tessuti a seguito di prove di scissione riduttiva è stata confermata in uno studio effettuato in Svezia, che dava seguito alla riunione del gruppo di esperti sulla sicurezza dei giocattoli dell’8 giugno 2015. Su 23 campioni di materiale tessile l’anilina è stata identificata in un campione tessile rosso (ovvero sul 4 % del totale) a una concentrazione di 91 mg/kg. La presenza di anilina nei materiali tessili a seguito di prove di scissione riduttiva è stata confermata in uno studio condotto su 153 campioni, in cui l’anilina è stata individuata su 9 campioni (il 6 % del totale dei campioni) a una concentrazione massima di 588 mg/kg. I base a quanto riportato su una rivista di consumo tedesca, è stata riscontrata la presenza di anilina dopo scissione riduttiva anche in un colore a dita. Il sottogruppo «prodotti chimici» ha inoltre osservato, nella comunicazione scritta inviata alla Commissione nel maggio 2020, che l’anilina libera potrebbe essere presente nei colori a dita come impurità dei coloranti di tali colori.
(6) Nel corso della riunione del gruppo di esperti sulla sicurezza dei giocattoli dell’8 giugno 2015 la Germania ha presentato un documento di sintesi contenente la valutazione scientifica delle proprietà tossicologiche dell’anilina. Secondo tale valutazione l’attuale tenore limite per l’anilina presenta un rischio sia per gli effetti sistemici, sia per gli effetti cancerogeni di tale sostanza. Durante la riunione del 26 settembre 2017 il sottogruppo «prodotti chimici» ha concluso che una restrizione dell’anilina nei giocattoli dovrebbe interessare i giocattoli e i relativi componenti in materiale tessile e cuoio, nonché i colori a dita, poiché fino a quel momento erano disponibili poche informazioni sulla necessità di limitare l’anilina nei giocattoli o nei materiali per giocattoli diversi da tessili, cuoio e colori a dita. Il sottogruppo ha inoltre indicato che il valore limite dovrebbe essere pari a 30 mg/kg dopo scissione riduttiva, che corrisponde alla concentrazione minima rilevabile tramite questo tipo di prova. Per quanto riguarda i colori a dita, il sottogruppo ha indicato che dovrebbe essere fissato un limite per l’anilina libera pari a 10 mg/kg, corrispondente alla concentrazione minima rilevabile tramite le prove di routine dei colori a dita.
(7) Durante la riunione del 19 dicembre 2017 il gruppo di esperti sulla sicurezza dei giocattoli ha esaminato l’opportunità di fissare valori limite a 30 mg/kg per l’anilina dopo scissione riduttiva nei materiali per giocattoli in tessuto e cuoio, a 30 mg/kg per l’anilina dopo scissione riduttiva nei colori a dita e a 10 mg/kg per l’anilina libera nei colori a dita, come indicato in precedenza dal sottogruppo «prodotti chimici».
(8) A norma dell’articolo 46, paragrafo 2, della direttiva 2009/48/CE, nell’adottare i valori limite specifici per le sostanze chimiche di cui all’appendice C di detta direttiva è necessario tenere conto delle disposizioni in materia di imballaggio di prodotti alimentari di cui al regolamento (CE) n. 1935/2004 del Parlamento europeo e del Consiglio. Le ipotesi alla base dei metodi di prova della migrazione di cui all’articolo 11, paragrafo 4, del regolamento (UE) n. 10/2011 della Commissione, che costituisce una misura specifica ai sensi dell’articolo 5 del regolamento (CE) n. 1935/2004 e che stabilisce norme specifiche per la fabbricazione e la commercializzazione di materiali e oggetti di materia plastica destinati a venire a contatto con i prodotti alimentari, sono tuttavia diverse dalle ipotesi alla base dei tenori limite di anilina in determinati giocattoli di cui alla direttiva 2009/48/CE. È inoltre impossibile confrontare i limiti di migrazione e i tenori limite. Secondo queste conclusioni, nel fissare un limite per l’anilina in determinati giocattoli non è pertanto possibile tenere conto delle disposizioni in materia di imballaggio di prodotti alimentari.
(9) Alla luce della classificazione dell’anilina quale sostanza CMR, delle conclusioni della relazione di valutazione dei rischi dell’Unione europea, dei pareri del RAC e del CSRSA e dei pareri del gruppo di esperti sulla sicurezza dei giocattoli e del relativo sottogruppo «prodotti chimici», nonché degli studi sulla presenza di anilina nei tessili è necessario fissare un valore limite per l’anilina nei materiali tessili per giocattoli e nei materiali di cuoio per giocattoli pari a 30 mg/kg dopo scissione riduttiva e un limite per l’anilina nei colori a dita pari a 10 mg/kg come anilina libera e a 30 mg/kg dopo scissione riduttiva.
(10) È pertanto opportuno modificare di conseguenza la direttiva 2009/48/CE.
(11) Le misure di cui alla presente direttiva sono conformi al parere del comitato per la sicurezza dei giocattoli,
HA ADOTTATO LA PRESENTE DIRETTIVA:
Articolo 1
Nell’allegato II, appendice C, della direttiva 2009/48/CE è aggiunta la seguente voce:
| Sostanza | Numero CAS | Valore limite | |
Anilina |
62-53-3 |
30 mg/kg | dopo scissione riduttiva nei materiali tessili per giocattoli e nei materiali di cuoio per giocattoli |
| 10 mg/kg | come anilina libera nei colori a dita | ||
| 30 mg/kg | dopo scissione riduttiva nei colori a dita. |
Articolo 2
1. Gli Stati membri adottano e pubblicano, entro il 4 dicembre 2022, le disposizioni legislative, regolamentari e amministrative necessarie per conformarsi alla presente direttiva. Essi ne trasmettono immediatamente il testo alla Commissione.
Essi applicano tali disposizioni a decorrere dal 5 dicembre 2022.
Le disposizioni adottate dagli Stati membri contengono un riferimento alla presente direttiva o sono corredate di tale riferimento all’atto della pubblicazione ufficiale. Le modalità del riferimento sono stabilite dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni principali di diritto interno che adottano nel settore disciplinato dalla presente direttiva.
Articolo 3
La presente direttiva entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Articolo 4
Gli Stati membri sono destinatari della presente direttiva.
...
Collegati
[box-note]Direttiva 2009/48/CE giocattoli
Giocattoli | Direttiva 2009/48/CE e NTA
Norme armonizzate Direttiva 2009/48/CE Giocattoli[/box-note]
RAPEX Report 20 del 21/05/2021 N. 01 A11/00036/21 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 20 del 21/05/2021 N. 01 A11/00036/21 Polonia
Approfondimento tecnico: Giocattoli morbidi
Il prodotto, di marca Zestaw dla malucha, mod. TG379438-5012-BH208-1342, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE ed alla norma tecnica EN 71-1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
L’imbottitura del giocattolo è facilmente accessibile a causa della debolezza di alcune cuciture. Un bambino piccolo potrebbe mettere il materiale in bocca e soffocare.
La Direttiva 2009/48/CE, all’Allegato II, contenente i Requisiti Particolari di Sicurezza, stabilisce che:
4. […]
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili.
Al fine del rispetto del requisito della Direttiva 2009/48/CE, la norma tecnica EN 71-1, al punto 8.2, descrive come testare i prodotti ed i loro componenti per verificare che non possano causare soffocamento.
Ogni giocattolo o componente deve essere inserito, senza compressione dello stesso, all’interno di un cilindro di prova. La prova ha esito positivo se il giocattolo o componente non si adatta completamente all’interno del cilindro.
Inoltre, il punto 5.2, della norma tecnica EN 71-1, stabilisce che i giocattoli morbidi devono essere testati tramite una specifica prova di trazione e, in seguito alla prova, non deve essere possibile inserire uno stelo di 12 mm di diametro attraverso una qualsiasi cucitura. La prova serve a verificare che le cuciture del giocattolo non permettano l’inserimento di due dita del bambino all’interno del prodotto e la conseguente estrazione del materiale di riempimento.
Il test prevede l’utilizzo di apposite pinze munite di dischi di 19 mm di diametro. Le pinze devono essere posizionate, ad esempio, tra la gamba ed il corpo del peluche ed in modo che siano equidistanti dalle cuciture.
Gradualmente deve essere applicata una forza di 70 ± 2 N per un periodo di 5 s.
A seguito della prova di trazione, è necessario verificare l’inserimento, in una qualsiasi cucitura, di uno stelo di 12 mm di diametro, applicando una forza massima di 10 N. Lo stelo non deve entrare per più di 6 mm.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 20 del 21_05_2021 N. 01 A11_00036_21 Polonia.pdf Giocattoli morbidi |
396 kB | 0 |
Circolare Ministero della Salute del 25 Maggio 2021
Circolare Min. della Salute del 25 Maggio 2021 | Applicazione Reg. UE 2017/745 (MDR)
Applicazione del Regolamento UE 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, nel settore delle indagini cliniche relative ai dispositivi medici
La presente circolare fornisce prime indicazioni sull’applicazione del Regolamento UE 2017/745 (di seguito il “Regolamento”) nel settore delle indagini cliniche relative ai dispositivi medici a partire dal 26 maggio 2021, e sulle conseguenti modalità di applicazione delle disposizioni nazionali vigenti in materia.
Le presenti indicazioni sono valide fino all’entrata in vigore di provvedimenti che modifichino quelli menzionati.
La Circolare contiene indicazioni riguardanti nello specifico:
1. Disposizioni efficaci alla data del 26 maggio 2021
2. Disposizioni applicabili alle indagini cliniche su dispositivi non recanti la marcatura CE
3. Disposizioni applicabili alle indagini cliniche su dispositivi recanti la marcatura CE
4. Disposizioni applicabili alle modifiche sostanziali delle indagini cliniche
5. Disposizioni applicabili alle informazioni che lo Sponsor deve fornire dopo l’avvio di un’indagine clinica
6. Disposizioni per la digitalizzazione e la semplificazione applicabili a tutti gli scambi di informazioni
7. Disposizioni applicabili alla partecipazione dei Comitati etici
8. Disposizioni applicabili per l’accertamento dell’idoneità delle strutture presso cui dovrebbe svolgersi un’indagine clinica
9. Disposizioni applicabili per la corresponsione di tariffe
10. Disposizioni applicabili alle indagini cliniche per le quali è stata presentata notifica prima del 26 maggio 2021
______
1. Disposizioni efficaci alla data del 26 maggio 2021
1.1. Il Regolamento UE 2017/745 si applica a decorrere al 26 maggio 2021, ai sensi dell’art. 123, paragrafo 2, così come modificato dal Regolamento UE 2020/561.
1.2. Alla data del 26 maggio 2021 non trovano applicazione gli obblighi e le prescrizioni del Regolamento riguardanti la banca dati europea Eudamed, non essendo questa pienamente operativa, e in particolare, per quanto concerne le indagini cliniche, quelli di cui agli articoli da 70 a 82, in quanto l’art. 123, al paragrafo 4, punto d, prevede che si applichino a decorrere dalla data corrispondente a sei mesi dalla data di pubblicazione sulla Gazzetta Ufficiale dell’Unione Europea dell'avviso con il quale la Commissione europea dà notizia di aver verificato la piena funzionalità di Eudamed e la conformità di Eudamed alle specifiche funzionali, secondo le procedure di cui all’art. 34 del Regolamento.
1.3. Fino a quando Eudamed non sarà pienamente operativa, ai sensi dell’art. 124, paragrafo 4, punto d, le corrispondenti disposizioni delle Direttive 90/385/CEE e 93/42/CEE (di seguito le “Direttive”) continuano ad applicarsi al fine di ottemperare agli obblighi previsti dagli articoli da 70 a 82 per quanto riguarda lo scambio di informazioni.
1.4. La Direttiva 90/385/CE e la Direttiva 93/42/CE, ai sensi dell’art. 122, sono abrogate a partire dal 26 maggio 2021, ma fino alla piena operatività di Eudamed non sono abrogati alcuni articoli e allegati, tra i quali l‘articolo 10 e gli Allegati 6 e 7 della Direttiva 90/385/CE, nonchè l’articolo 15 e gli Allegati VIII e X della Direttiva 93/42/CE.
1.5. Il D. Lgs. 46/97 e il D. Lgs. 507/92, (di seguito i “Decreti Legislativi di recepimento delle Direttive” o anche i “Decreti Legislativi”), così come modificati dal D. Lgs. 37/2010, restano vigenti fino all’emanazione di provvedimenti di abrogazione, e continuano ad applicarsi per quanto risulta compatibile con il Regolamento.
1.6. Sono altresì vigenti, fino all’emanazione di provvedimenti di espressa abrogazione, i decreti ministeriali emanati in conseguenza del recepimento delle Direttive, e continuano ad applicarsi per quanto risulta compatibile con il Regolamento.
2. Disposizioni applicabili alle indagini cliniche su dispositivi non recanti la marcatura CE
2.1. A partire dalla data del 26 maggio 2021 non si applicano, alle indagini cliniche per le quali non sia già stata presentata notifica ai fini del loro avvio, i commi 1, 2, 3 e 4 dell’art. 14 del D.Lgs. 46/97 e i commi 1, 2 e 3 dell’art. 7 del D. Lgs. 507/92, nonché gli Allegati VIII al D.Lgs. 46/97 e 6 al D. Lgs. 507/92 in quanto non compatibili con le previsioni dell’art. 62 del Regolamento, sui soggetti legittimati (di cui al paragrafo 2) e sulla natura e sulla forma del procedimento (di cui al paragrafo 4), nonchè con quelle dell’Allegato XV al Regolamento sulla documentazione.
2.2. A partire dalla data del 26 maggio 2021, per gli stessi motivi di cui al punto precedente, non si applicano gli articoli 2, 3 e 4 del Decreto del Ministro della salute 2 agosto 2005 (Modalità di presentazione della documentazione della notifica di indagine clinica con dispositivi medici).
2.3. A partire dalla data del 26 maggio 2021 si applicano le previsioni dell’articolo 70 del Regolamento sulla domanda di indagine clinica, per quanto sia consentito dalla mancanza di una piena operatività della banca dati Eudamed.
2.4. Per la presentazione della domanda di autorizzazione al Ministero della salute sono applicabili le previsioni sulla documentazione necessaria di cui all’Allegato XV, Capo II del Regolamento.
2.5. Allo scopo di utilizzare lo stesso modello di raccolta delle informazioni che sarà implementato in Eudamed, di rendere omogenea la trattazione amministrativa con quella degli altri Stati membri e di ridurre gli oneri per gli sponsor che promuovono indagini cliniche multicentriche in più Stati, il modello di domanda è quello definito dal Gruppo di Lavoro “Clinical Investigation Evaluation Working Group” promosso dalla Commissione europea e adottato dal Gruppo di coordinamento per i dispositivi medici istituito dall’art. 103 del Regolamento.
Tale modello può essere utilizzato per la presentazione della domanda al Ministero della salute anche nella versione in lingua inglese, così come la documentazione di contenuto clinico e tecnico che lo accompagna. Le dichiarazioni devono essere prodotte almeno nella versione in lingua italiana, che fa fede ai fini amministrativi.
2.6. Le indicazioni per la predisposizione e l’invio della documentazione relativa alla domanda di indagine clinica sono disponibili sul sito web del Ministero della salute.
2.7. Fino alla piena operatività di Eudamed il processo di convalida della domanda si conclude con la notifica, mediante posta elettronica certificata, della decisione sulla convalida da parte del Ministero della salute. I termini temporali per la decadenza o il tacito respingimento della domanda, di cui al paragrafo 3 dell’art. 70, e quelli per la tacita convalida della domanda, di cui al comma 5 dell’art. 70, sono considerati ordinatori e non perentori.
2.8. La domanda di indagine clinica non sarà convalidata in mancanza di un parere formulato da un Comitato etico che esprima un parere che possa essere considerato valido in tutto il territorio nazionale, in quanto, ai fini del procedimento di autorizzazione, il pronunciamento sulla revisione etica è obbligatorio e potenzialmente interdittivo, ai sensi dell’art. 62 del Regolamento.
2.9. Per le indagini cliniche relative ai dispositivi di classe I e ai dispositivi non invasivi delle classi IIa e IIb, di cui all’art. 70, del paragrafo 7, punto a, il Ministero della salute notificherà, mediante posta elettronica certificata, l’esito delle attività di convalida della domanda, ai fini dell’eventuale avvio delle indagini stesse, e proseguirà le attività di valutazione scientifica, anche ai fini dell’eventuale adozione di misure correttive ai sensi dell’art. 76 comma 1.
2.10. Per le indagini cliniche relative ai dispositivi invasivi delle classi IIa e IIb e ai dispositivi di classe III di cui all’art. 70, del paragrafo 7, punto b, le indagini potranno essere avviate dopo la notifica allo sponsor, mediante posta elettronica certificata, dell'autorizzazione da parte del Ministero della salute.
[...] Segue in allegato
Fonte: Ministero della Salute
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE
Direttiva click
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Circolare Ministero della Salute del 25 Maggio 2021.pdf |
360 kB | 26 |
Decreto 23 aprile 2021
Decreto 23 aprile 2021 | Modello aggiornato DCI 2021
Approvazione del modello di Dichiarazione di costruzione o importazione (DCI).
(GU n.122 del 24.05.2021)
[box-warning]Modello aggiornato del Decreto 19 giugno 2019
Sulla base delle risultanze delle iniziali attività di esercizio del Sistema telematico centrale della nautica da diporto, si è reso necessario procedere all’aggiornamento del modello di Dichiarazione di costruzione o importazione di cui al Decreto 19 giugno 2019[/box-warning]
...
Art. 1.
1. La Dichiarazione di costruzione o importazione (DCI) è conforme al modello di cui all’allegato I del presente decreto.
Art. 2.
1. La DCI è rilasciata dai soggetti di cui all’elenco istituito dal decreto direttoriale 19 giugno 2019, pubblicato nella Gazzetta Ufficiale – Serie generale - n. 164 del 15 luglio 2019, previa richiesta da parte del costruttore oppure dell’armatore o dell’utilizzatore a titolo di locazione finanziaria o, in mancanza, del proprietario, inoltrata, anche da un’agenzia incaricata, tramite il portale informatico di cui all’art. 3 del presente decreto, nei casi previsti dall’art. 13, comma 5, del decreto del Presidente della Repubblica 14 dicembre 2018, n. 152.
2. Ai fini del rilascio della DCI il richiedente, assumendosi la responsabilità delle conseguenze civili e penali previste in caso di dichiarazioni mendaci, comunica nella domanda:
a) per le persone fisiche: i propri dati anagrafici, il codice fiscale, la cittadinanza, la residenza e l’eventuale domicilio, se diverso dalla residenza; i cittadini di Stati terzi allegano alla domanda copia del permesso o della carta di soggiorno;
b) per le persone giuridiche: i dati risultanti dal registro delle persone giuridiche oppure, se trattasi di imprese, dal registro delle imprese tenuto dalla Camera di commercio industria artigianato e agricoltura, nonché i dati di cui alla lettera a) del legale rappresentante che presenta la richiesta;
c) la tipologia di unità, specificandone le principali caratteristiche tecniche, tra cui la lunghezza, la larghezza e l’anno di costruzione;
d) per natanti e imbarcazioni da diporto marcate CE: il codice identificativo dello scafo (WIN) e la data di rilascio della dichiarazione di conformità del costruttore, la cui copia è allegata alla domanda;
e) per natanti e imbarcazioni da diporto non marcate CE: la data di rilascio del certificato di omologazione con dichiarazione di conformità al prototipo oppure il numero dell’attestazione di idoneità con l’indicazione dall’organismo tecnico che l’ha rilasciata. Le copie dei suddetti documenti sono allegate alla domanda;
f) per le navi da diporto: la denominazione del cantiere, il tipo e il modello della nave e, se unità nuova, il numero di costruzione, secondo i dati tecnici riportati nell’estratto del registro navi in costruzione oppure nell’ultimo certificato di stazza valido, la cui copia è allegata alla domanda;
g) la tipologia dell’apparato propulsivo, con l’indicazione del numero unico di identificazione e della potenza dei motori installati;
h) se persona fisica, i dati identificativi; se persona giuridica, la ragione o denominazione sociale del soggetto da cui è stata acquisita la proprietà, con la specifica della tipologia del titolo di proprietà;
i) in caso di aggiornamento della DCI per rinnovo o convalida del certificato di sicurezza o del certificato di idoneità al noleggio: la denominazione dell’organismo notificato o autorizzato rilasciante, la data di rilascio e quella di validità dell’attestazione o della dichiarazione di idoneità o della dichiarazione ai fini delle annotazioni di sicurezza, la cui copia è allegata alla domanda.
3. Per le unità già iscritte nei registri del diporto o presso registri comunitari, la documentazione di cui alle lettere d) , e) ed f) , del precedente comma è allegata alla domanda di rilascio della DCI solo se è nella disponibilità del richiedente.
4. Nei casi di accertata impossibilità, formalmente dichiarata da parte dei soggetti abilitati al rilascio della DCI, del reperimento di tutti i dati previsti dal precedente comma 2, le formalità per il rilascio della licenza di navigazione, della licenza di navigazione provvisoria, del certificato di sicurezza, del certificato di idoneità al noleggio e dell’autorizzazione alla navigazione temporanea, sono comunque espletate.
5. La domanda di rilascio della DCI finalizzata alla richiesta dell’autorizzazione alla navigazione temporanea è compilata con i soli dati del soggetto richiedente.
[...]
Collegati
[box-note]Decreto 19 giugno 2019 | Modello DCI
Decreto 19 giugno 2019 | Associazioni costruttori, importatori e distributori unita' da diporto
Decreto 19 giugno 2019 | Modelli licenza navigazione unità da diporto
D.P.R. 14 dicembre 2018 n. 152
Codice della Nautica da Diporto
Sistema telematico centrale della nautica da diporto (Siste)[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Decreto 23 aprile 2021.pdf |
249 kB | 7 |
Raccolta Linee guida sicurezza giocattoli | 05.2021
Raccolta Linee guida sicurezza giocattoli | 05.2021
ID 10191 | Aggiornamento 05.2021
I giocattoli devono rispettare i requisiti della Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli (GU L 170/1 del 30.6.2009) e devono riportare la marcatura CE.
La Commissione e il gruppo di esperti sulla sicurezza dei giocattoli elaborano documenti di orientamento per assistere i produttori, gli importatori, i distributori e le autorità pubbliche nell'interpretazione e nell'applicazione della direttiva sulla sicurezza dei giocattoli 2009/48/CE. I documenti di orientamento non sono giuridicamente vincolanti ma esprimono il punto di vista della maggioranza dei membri del gruppo di esperti.
L'UE conta circa 80 milioni di bambini di età inferiore a 14 anni e approssimativamente 2.000 aziende, con oltre 100.000 dipendenti, operanti direttamente nel settore dei giocattoli e dei giochi. Si tratta nella maggior parte dei casi di piccole e medie imprese (PMI).
[panel]Giochi e giocattoli sono strumenti fondamentali per lo sviluppo di un bambino. Mentre i fabbricanti sono responsabili della sicurezza dei propri prodotti, gli importatori, gli organismi notificati e le autorità nazionali svolgono un ruolo nel garantire che i giocattoli venduti nei negozi europei soddisfino tutti i requisiti di sicurezza.
Fondamentale è assicurare che le norme e i requisiti di sicurezza rimangano al passo con le ultime tendenze del settore dei giocattoli, specialmente considerato lo sviluppo costante di nuovi materiali e processi di produzione.
Il mercato interno dei giocattoli ha contribuito positivamente allo sviluppo del settore e alla tutela dei consumatori, grazie all'armonizzazione delle caratteristiche di sicurezza dei giocattoli in tutta l'UE.
La nuova Direttiva in materia di sicurezza dei giocattoli rafforza le disposizioni esecutive e sui nuovi requisiti di sicurezza, garantendo che i bambini continuino a godere dei massimi livelli di protezione.
La nuova direttiva migliora le norme vigenti in materia di commercializzazione dei giocattoli prodotti o importati nell'UE, al fine di ridurre gli incidenti ad essi associati e conseguire benefici sanitari a lungo termine.
Oggi, i partner commerciali più importanti per l'Europa rimangono gli Stati Uniti, per le esportazioni, e l'Estremo Oriente, per le importazioni.
Tra le principali opportunità per l'industria europea dei giocattoli figura il potenziale d'esportazione dei prodotti europei di alta qualità, sostenuto dalla Commissione migliorando le condizioni di accesso ai mercati dei paesi terzi.[/panel]
Indice raccolta
In rosso i Documenti aggiornati 05.2021
01. Guidance document on scooters - 05/10/2016
02. Community legislation applicable to "floating seats" - 26/04/2001
03. The guidance document on the relationship between the Safety of Toys Directive and the Cadmium Directive (Directive 91/338/EEC) has become obsolete after the Court of Justice has given its judgment in case C-9/04 - 03/02/2003
04. Guidance document on grey zone problem: Is a specific product covered by the Toy Safety Directive 2009/48/EC or not? - 15/10/2015
05. Guidelines on the treatment of "grey zone" products - criteria to classify products consisting of miniatures to be assembled and painted and their support products - 13/02/2003
06. Guidelines on the treatment of "grey zone" products - criteria for differentiating dolls for adult collectors from toys - 13/02/2003
07. Guidance document on toys used in and on the water - 15/01/2014
08. Guidance document on pools - 28/01/2019
09. Guidance document on the classification of books - 10/12/2013
10. Guidance document on the classification of music instruments - 26/02/2019
11. Guidance document on the classification of toys intended children under 3 years - 06/04/2009
12. Guidance document on packaging - 09/07/2012
13. Guidance document on crafts - 19/04/2011
14. Guidance document on sports equipments - 18/01/2012
15. Guidance document on writing instruments and stationary - 20/01/2012
16. Guidelines on electronic equipments - 09/07/2012
17. Guidance document on disguise costumes - 04/12/2012
18. Guidance document on puffer balls and similar toys- 16/09/2019
19. Guidance document on soother holders - 26/09/2019
20. Guidance document n° 20 on the application of Directive 2009/48/EC on the safety of toys
A. Guideline on the interpretation of the concept “which can be placed in the mouth” as laid down in the entry 52 of Annex XVII to REACH Regulation 1907/2006 - 08/01/2014
A1. TSD explanatory guidance document in ENGLISH (Rev 1.9) - 10/02/2016
A2. TSD explanatory guidance document in CHINESE (Rev 1.9) - 10/02/2016
A3. Technical documentation guidance document - 10/02/2016
A4. Technical documentation guidance document in ENGLISH (Version 1.5) 22/02/2016
A5. Technical documentation guidance document in CHINESE (Version 1.5) 22/02/2016
A6. Technical documentation guidance document - 22/02/2016
B. Template of the EC Declaration of Conformity - 13/07/2011
C1. Overview of the warnings required by the Toy Safety Directive 2009/48/EC in the different languages - 12/09/2014
C2. Overview of the national language requirements for warnings, information and documentation as foreseen by the Member States' transposition legislation of Directive 2009/48/EC on the safety of toys - 02/10/2014
D. Soft-filled toys with sequins - 06/03/2019
E1. Recommendation No 1 format EC type examination certificate (Rev 3) 10/06/2014
E2. Recommendation No 2 NoBo identification number affixed to the toy (Rev 1) 21/04/2010
E3. Recommendation No 3 failure of safety limit (Rev 1) 11/04/2011
E4. Recommendation No 4 transitional period (Rev 1) 12/04/2011
E5. Protocol No 1 Toys submitted to EC-Type Examination (Rev 8) 06/03/2019
E6. Protocol No 2 Microbiological safety of toys (Rev 3) 18/02/2016
E7. Protocol No 4 Washability of toys approval (Rev 2) 22/12/2017
E8. Protocol No 5 Microwavable toys (Rev 1) 24/09/2018
F. Use of a Notified Body's name and number for activities not required by EU legislation 27/05/2015
In rosso Documenti aggiornati 05.2021
Raccolta Adobe portfolio
Data: 17.05.2021
Dim: 40Mb
Collegati
[box-note]Raccolta Linee guida sicurezza giocattoli | 02.2020
Raccolta UE Linee Guida Giocattoli - AGG. 03.2015
Direttiva 2009/48/CE giocattoli
Giocattoli | Direttiva 2009/48/CE e NTA[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidance on Toy Safety Agg. 05.2021.pdf Agg. 05.2021 |
36539 kB | 17 |
RAPEX Report 18 del 07/05/2021 N. 10 A12/000614/21 Slovenia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 18 del 07/05/2021 N. 10 A12/000614/21 Slovenia
Approfondimento tecnico: Bambola con accessori
Il prodotto, di marca Mia fashion, mod. B435, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene Bis(2-etilesil) ftalato (DEHP) (valore misurato: 9,9% in peso), Dibutil ftalato (DBP) (valore misurato: 6,6% in peso) e Diisononilftalato (DINP) (valore misurato: 0,5% in peso).
Questi ftalati possono danneggiare la salute dei bambini, causando danni al sistema riproduttivo.
Regolamento (CE) n .1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. Ftalato di bis(2-etilesile) (DEHP), Dibutilftalato (DBP), Benzilbutilftalato (BBP), Diisobutilftalato (DIBP)
1. Non possono essere utilizzati nei giocattoli e negli articoli di puericultura, come sostanze o in miscele, singolarmente o in qualsiasi combinazione degli ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
2. Non possono essere immessi sul mercato nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato.
Inoltre, il DIBP non può essere immesso sul mercato dopo il 7 luglio 2020 nei giocattoli o negli articoli di puericultura, singolarmente o in qualsiasi combinazione dei primi tre ftalati elencati nella colonna 1 della presente voce, in una concentrazione pari o superiore allo 0,1 % in peso del materiale plastificato. […]
52. Diisononilftalato (DINP), Diisodecilftalato (DIDP), Ftalato di diottile (DNOP)
1. Non possono essere utilizzati come sostanze o in miscele in concentrazioni superiori allo 0,1 % in peso del materiale plastificato nei giocattoli e negli articoli di puericultura che possono essere messi in bocca dai bambini.
2. Tali giocattoli e articoli di puericultura contenenti tali ftalati in concentrazione superiore allo 0,1 % in peso del materiale plastificato non possono essere immessi sul mercato.
4. Ai fini della presente voce, per «articoli di puericultura» si intende qualsiasi prodotto destinato a conciliare il sonno, il rilassamento, l’igiene, il nutrimento e il succhiare dei bambini.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 18 del 07_05_2021 N. 10 A12_000614_21 Slovenia.pdf Bambola con accessori |
378 kB | 0 |
Funzioni di arresto / Categorie di arresto | Macchine e Azionamenti
Funzioni di arresto / Categorie di arresto Macchine / Azionamenti
ID 13532 | Rev. 2.0 del 04.08.2023 / Documento completo allegato con esempi circuitali
Documento sulle funzioni di arresto (e categorie di arresto) di macchine e azionamenti, in accordo con:
- Regolamento (UE) 2023/1230
- Direttiva 2006/42/CE
- Guida macchine Direttiva 2006/42/CE | 2010 IT
- EN 60204-1:2018
- EN ISO 13850:2016
- CEI EN 61800-5-2:2016
Estratto
In accordo con il RESS 1.2.4 dell’Allegato I della Direttiva 2006/42/CE e allegato III del Regolamento (UE) 2023/1230, in una macchina deve essere sempre presente un arresto (1.2.4.1. Arresto normale). E’ possibile, invece, derogare, in determinate condizioni dalla presenza dell’arresto di emergenza.
Fig. 1 - Tipi di arresto Direttiva macchine
Direttiva macchine / Regolamento macchine RESS 1.2.4
|
1.2.4. Arresto |
1.2.4. Arresto |
|
1.2.4.1. Arresto normale La macchina deve essere munita di un dispositivo di comando che consenta l'arresto generale in condizioni di sicurezza. Ogni posto di lavoro deve essere munito di un dispositivo di comando che consenta di arrestare, in funzione dei pericoli esistenti, tutte le funzioni della macchina o unicamente una di esse, in modo che la macchina sia portata in condizioni di sicurezza. Il comando di arresto della macchina deve essere prioritario rispetto ai comandi di avviamento. Ottenuto l'arresto della macchina o delle sue funzioni pericolose, si deve interrompere l'alimentazione dei relativi azionatori.
|
1.2.4.1. Arresto normale |
|
1.2.4.2. Arresto operativo Se, per motivi operativi, è necessario un comando di arresto che non interrompe l'alimentazione degli azionatori, la condizione di arresto deve essere monitorata e mantenuta. |
1.2.4.2. Arresto operativo |
|
1.2.4.3. Arresto di emergenza La macchina deve essere munita di uno o più dispositivi di arresto di emergenza, che consentano di evitare situazioni di pericolo che rischino di prodursi nell'imminenza o che si stiano producendo. Sono escluse da quest'obbligo: - le macchine per le quali il dispositivo di arresto di emergenza non può ridurre il rischio, perché non riduce il tempo per ottenere l'arresto normale oppure perché non permette di prendere le misure specifiche che il rischio richiede, Il dispositivo deve: - comprendere dispositivi di comando chiaramente individuabili, ben visibili e rapidamente accessibili,ù Quando si smette di azionare il dispositivo di arresto di emergenza dopo un ordine di arresto, detto ordine deve essere mantenuto da un blocco del dispositivo di arresto di emergenza, sino al suo sblocco; non deve essere possibile ottenere il blocco del dispositivo senza che quest'ultimo generi un ordine di arresto; lo sblocco del dispositivo deve essere possibile soltanto con una apposita manovra e non deve riavviare la macchina, ma soltanto autorizzarne la rimessa in funzione. La funzione di arresto di emergenza deve essere sempre disponibile e operativa a prescindere dalla modalità di funzionamento. I dispositivi di arresto di emergenza devono offrire soluzioni di riserva ad altre misure di protezione e non sostituirsi ad esse. |
1.2.4.3. Arresto di emergenza La macchina o il prodotto correlato devono essere muniti di uno o più dispositivi di arresto di emergenza, che consentano di evitare situazioni di pericolo attuali o imminenti. Si applicano le eccezioni seguenti: Il dispositivo deve: Quando si smette di azionare il dispositivo di arresto di emergenza dopo un ordine di arresto, tale ordine deve essere mantenuto da un blocco del dispositivo di arresto di emergenza, sino al suo sblocco; non deve essere possibile ottenere il blocco del dispositivo senza che quest'ultimo generi un ordine di arresto; lo sblocco del dispositivo deve essere possibile soltanto con una apposita manovra e non deve riavviare la macchina o il prodotto correlato, ma soltanto consentirne la rimessa in funzione. I dispositivi di arresto di emergenza devono offrire soluzioni di riserva ad altre misure di protezione e non sostituirsi ad esse. |
|
1.2.4.4. Assemblaggi di macchine Nel caso di macchine o di elementi di macchine progettati per lavorare assemblati, le macchine devono essere progettate e costruite in modo tale che i comandi di arresto, compresi i dispositivi di arresto di emergenza, possano bloccare non soltanto le macchine stesse ma anche tutte le attrezzature collegate, qualora il loro mantenimento in funzione possa costituire un pericolo.
|
1.2.4.4. Insiemi di macchine o di prodotti correlati Nel caso di una macchina o di un prodotto correlato o di elementi di una macchina o di un prodotto correlato progettati per lavorare assemblati, la macchina o il prodotto correlato devono essere progettati e costruiti in modo tale che i comandi di arresto, compresi i dispositivi di arresto di emergenza, possano bloccare non soltanto la macchina stessa o il prodotto correlato stesso ma anche tutte le attrezzature collegate, qualora il loro mantenimento in funzione possa costituire un pericolo. |
Commenti arresto di emergenza Guida Direttiva macchine 2006/42/CE (Versione 2010 IT)
[box-note]Guida macchine Direttiva 2006/42/CE | 2010 IT
§200 Dispositivi di arresto normale
I requisiti di cui al punto 1.2.4.1 mirano a garantire che l’operatore possa sempre arrestare la macchina in condizioni di sicurezza. A parte l’esigenza di arrestare la macchina in condizioni di sicurezza per ragioni operative, è anche essenziale che l’operatore possa arrestare la macchina in caso di malfunzionamento che potrebbe produrre situazioni pericolose.
Il secondo paragrafo si applica alle macchine dotate di uno o più posti di lavoro. In taluni casi, un singolo operatore può comandare tutta la macchina da diversi posti di lavoro, a seconda dei compiti da svolgere o della fase di attività della macchina. In altri casi, i vari componenti della macchina possono essere comandati da diversi operatori.
E’ possibile che il dispositivo di arresto di cui è dotato ogni posto di lavoro possa azionare l’arresto di tutta la macchina o solo di una parte di essa, laddove ciò sia possibile senza rischi – cfr. §203: commenti sul punto 1.2.4.4. Se del caso, il dispositivo di arresto deve poter arrestare le parti pertinenti di una macchina complessa secondo una sequenza determinata – cfr. §199: commenti sul punto 1.2.3.§
...[/box-note]
Categorie d’arresto EN 60204-1
In accordo con EN 60204-1 “Sicurezza del macchinario - Equipaggiamento elettrico delle macchine Parte 1: Regole generali”, sono definite 3 categorie di funzioni di arresto:
- Categoria di arresto 0: arresto mediante rimozione immediata dell'alimentazione di potenza agli attuatori di macchina (per es. arresto non controllato);
- Categoria di arresto 1: arresto controllato mantenendo l'alimentazione di potenza agli attuatori di macchina fino all'arresto, e rimuovendo poi la potenza ad arresto avvenuto;
- Categoria di arresto 2: arresto controllato mantenendo l’alimentazione di potenza agli attuatori di macchina.
Quindi:
EN ISO 13850:2015 (armonizzata DM)
[box-note]EN ISO 13850:2015
4.1.1 Funzione di arresto d'emergenza
4.1.1.1 Lo scopo della funzione di arresto di emergenza e evitare situazioni di emergenza effettive derivanti dal comportamento di persone o da un evento pericoloso inatteso.
La funzione di arresto di emergenza deve essere attivata mediante una singola azione umana.
4.1.1.2 La funzione di arresto di emergenza deve essere disponibile e operativa in ogni momento.
Deve avere la precedenza su tutte le altre funzioni e operazioni e in tutte le modalità operative della macchina senza compromettere altre funzioni di protezione (per esempio il rilascio di persone intrappolate, lo spegnimento degli incendi).
Quando la funzione di arresto di emergenza è attivata:
- deve essere mantenuta fino al riarmo manuale;
- non deve essere possibile per ogni comando di avviamento arrestato dall'attivazione della funzione di arresto di emergenza di avere effetto su tali operazioni.
La funzione di arresto di emergenza deve essere riarmata mediante un'azione umana intenzionale.
Il riarmo della funzione di arresto di emergenza deve essere eseguito mediante il disinnesto di un dispositivo di arresto di emergenza (vedere punto 4.1.4). Il riarmo non deve attivare l'avviamento della macchina.
Nota
La funzione di arresto di emergenza non può essere considerata una misura di prevenzione di avviamenti inattesi come descritto nella ISO 12100.
...
4.1.3 Categorie di arresto
L'arresto di emergenza deve funzionare in conformità a una delle categorie di arresto seguenti (vedere anche la IEC 60204-1). La categoria di arresto pertinente deve essere selezionata mediante la valutazione del rischio.
Categoria di arresto 0
Arresto mediante rimozione immediata dell'energia per gli attuatori della macchina.
Nota 1
Può essere necessaria una frenatura aggiuntiva.
Esempi di categoria di arresto 0 sono:
- interruzione dell'energia elettrica del(dei) motore(i) elettrico(i) della macchina mediante dispositivi di commutazione elettromeccanici;
- scollegamento meccanico (disinnesto) tra gli elementi pericolosi e il(i) loro attuatore(i) della macchina;
- blocco dell'alimentazione di fluido agli attuatori idraulici pneumatici della macchina;
- interruzione dell'energia necessaria a generare una coppia o una forza in un motore elettrico utilizzando la funzione "Safe torque off" (STO) di un sistema di azionamento in conformità alla IEC 61800-5-2.
Categoria di arresto 1
Arresto di movimenti e di operazioni con l'energia disponibile agli attuatori della macchina per ottenere l'arresto e quindi l'interruzione dell'alimentazione quando è ottenuto l'arresto. Esempi di categoria di arresto 1 sono: decelerazione di movimenti e successiva rimozione dell'energia elettrica per il(i) motore(i) quando il movimento e terminate mediante dispositivi di commutazione elettromeccanici; utilizzo della funzione "Safe stop 1" (SS1) di un sistema di azionamento in conformità alla IEC 61800-5-2.
Nota 2
Per la rimozione dell'energia, può essere sufficiente rimuovere l'energia necessaria a generare una coppia o una forza. Ciò può essere ottenuto mediante disinnesto, scollegamento, spegnimento o mezzi elettronici [per esempio un sistema di azionamento (Power Drive System - PDS) in conformità alla IEC 61800-5-2], senza effettuare necessariamente l'isolamento.[/box-note]
CEI EN 61800-5-2:2016 Sicurezza azionamenti
La norma CEI EN 61800-5-2 si occupa dei requisiti di sicurezza funzionale per "azionamenti elettrici a velocità variabile". La parte 5-2 della serie EN 61800-X è una norma di prodotto per gli azionamenti elettrici con funzioni di sicurezza integrate. La parte 5-2 definisce le prescrizioni per lo sviluppo di azionamenti sicuri con riferimento alla loro sicurezza funzionale.
Gli azionamenti devono essere conformi ai requisiti previsti dalle norme:
- EN/IEC 61508 (sicurezza funzionale di sistemi elettrici ed elettronici),
- EN/IEC 62061 (sicurezza funzionale di sistemi di controllo delle macchine)
- EN ISO 13849 (sicurezza delle macchine)
mediante applicazione e conformità a quanto prescritto a livello normativo.
La norma EN 61800-5-2 suddivide le funzioni di sicurezza in funzioni di arresto e altre funzioni di sicurezza, come ad esempio le funzioni di movimento in sicurezza o le funzioni di frenatura in sicurezza.
Funzioni di arresto sicuro secondo EN 61800-5-2
Gli Azionamenti elettrici aventi una o più funzioni di sicurezza funzionale sono denominati Safety Related Power Drive Systems o PDS(SR).
La norma EN 61800-5-2 definisce tre funzioni di arresto corrispondenti alle tre categorie di arresto 0, 1 e 2 previste da EN 60204-1:
Tab. 1 - Funzioni di arresto sicuro secondo EN 61800-5-2
Safe Torque Off (STO) / Disattivazione coppia in sicurezza
Questa funzione di sicurezza corrisponde a un arresto di categoria 0 (arresto incontrollato) secondo IEC 60204-1. L'alimentazione del motore viene interrotta immediatamente in modo sicuro, in modo che non siano possibili ulteriori movimenti (Vedi Fig. 2)
In circostanze nelle quali sono presenti influenze esterne possono essere necessarie ulteriori misure per prevenire in modo sicuro qualsiasi potenziale movimento.
Fig. 2 - Safe Torque Off (STO) / Disattivazione coppia in sicurezza
[box-note]Safe stop 1 SS1/Arresto in sicurezza 1
Safe Stop 1 (SS1) è una funzione di sicurezza che corrisponde a un arresto di categoria 1 (arresto controllato) secondo IEC 60204-1. E' possibile distinguere tra i seguenti arresti in sicurezza 1:
SS1 - d (decelerazione controllata): avvia e controlla la velocità di decelerazione del motore all’interno di limiti definiti per arrestare il motore e avvia la funzione STO quando la velocità del motore è inferiore a un limite specificato
SS1 - r (rampa monitorata): avvia e sorveglia la velocità di decelerazione del motore all’interno di limiti definiti per arrestare il motore e avvia la funzione STO quando la velocità del motore è inferiore a un limite specificato;
SS1 - t (tempo controllato): avvia la decelerazione del motore e avvia la funzione STO dopo un ritardo temporale specifico.
_______
Safe stop 2 SS2/Arresto in sicurezza 2
Safe Stop 2 (SS2) è una funzione di sicurezza che corrisponde a un arresto di categoria 2 (arresto controllato) secondo IEC 60204-1. E' possibile distinguere tra i seguenti arresti in sicurezza 2:
SS2 - d (decelerazione controllata): Avvia e controlla la velocità di decelerazione del motore all’interno di limiti definiti per arrestare il motore e avvia la funzione di arresto operativo sicuro quando la velocità del motore è inferiore a un limite specificato;
SS2 - r (rampa monitorata): avvia e sorveglia la velocità di decelerazione del motore all’interno di limiti definiti per arrestare il motore e avvia la funzione di arresto operativo sicuro quando la velocità del motore è inferiore a un limite specificato;
SS2 - t (tempo controllato): avvia la decelerazione del motore e avvia la funzione di arresto operativo sicuro dopo un ritardo temporale specifico.[/box-note]
...
[box-note]CEI EN 61800-5-2:2016 Estratto
4.2 Safety sub-functions
4.2.1 General
In most cases The safety functions of the PDS(SR)(*) are a part of the safety functions of an application, therefore the safety functions of the PDS(SR)are named safety sub-functions in this document.
Figure 2 shows an example of a safety function consisting of safety sub-functions:
System (machine, process) with a safety function e.g. "Safe Machine Stop”
(*) 3.16. PDS(SR) adjustable speed electrical power drive system providing safety sub-functions
Figure 2 - Safety function consisting of safety sub-functions
NOTE
For further information regarding safety sub-functions see IFA Report 7/2013e “Safe drive controls with frequency converters” (Bibliography).
4.2.2 Limit values
Where a safety sub-function relies on limit value(s) for any parameter(s), the maximum tolerance(s) for the limit value(s) shall be defined.
NOTE
Specification of any limit value can take into account possible exceeding of the limit value in case of violation of the limit.
For example, specification of the position limit value(s) in 4.2.4.9 can take into account the maximum allowable over travel distance(s).
A particular safety sub-function may have one or more specified limit values, which can be selected during operation.
4.2.3 Stopping functions
4.2.3.1 General
A variety of stopping methods is available for every type of PDS(SR).
The control requirements for initiating the stopping sequence and maintaining a hold mode upon reaching standstill are application-specific. Separate manual operations and connections to control circuits may be necessary to achieve the desired performance of the stopping functions.
NOTE
When applying safety stopping functions for functions like prevention of unexpected start-up or emergency stop, relevant standards can be considered, e. g. IEC 6 0204-1, ISO 13850, ISO 12100, ISO 14118.
Any particular requirements for stopping performance can be specified by the customers of the PDS(SR) manufacturer. The following examples of stopping functions are often used in practice.
4.2.3.2 Safe torque off (STO)
This function prevents force-producing power from being provided to the motor
This safety sub-function corresponds to an uncontrolled stop in accordance with stop category 0 of IEC 6 0204-1.
NOTE 1
This safety sub-functioncan be used where power removal is required to prevent an unexpected start-up according to ISO 1 4118.
NOTE 2
In circumstances where external influences (for example, falling of suspended loads) are present, additional measures (for example, mechanical brakes) can be necessary to prevent any hazard.
NOTE 3
Electronic means and some contactors are not adequate for protection against electric shock.
NOTE 4
While the function is active, a limited amount of movement is still possible in the event of a failure in the power section of the PDS(SR)
4.2.3.3 Safe Stop 1 (SS1)
This function is specified as either
a) Safe Stop 1 deceleration controlled
SS1-d
initiates and controls the motor deceleration rate within selected limits to stop the motor and performs the STO function (see 4.2.3.2) when the motor speed is below a specified limit; or
b) Safe Stop 1 ramp monitored
SS1-r
initiates and monitors the motor deceleration rate within selected limits to stop the motor and performs the STO function when the motor speed is below a specified limit; or
c) Safe Stop 1 time controlled
SS1-t
initiates the motor deceleration and performs the STO function after an application specific time delay.
This safety sub-function corresponds to a controlled stop in accordance with stop category 1 of IEC 6 0204-1.
...
4.2.4.2 Safe Operating Stop (SOS)
This function prevents the motor from deviating more than a defined amount from the stopped position. The PDS(SR) provides energy to the motor to enable it to resist external forces.
...
4.2.3.4 Safe stop 2 (SS2)
...
[/box-note]
Certifico Srl - IT | Rev. 2.0 2023
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 2.0 | 04.08.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 1.0 | 13.05.2021 | Aggiunti Esempi circuitali | Certifico Srl |
| 0.0 | 12.05.2021 | --- | Certifico Srl |
Collegati
[box-note]Regolamento (UE) 2023/1230
Direttiva macchine 2006/42/CE
Guida Direttiva macchine 2006/42/CE - Ed. 2010 ITA
EN ISO 13850 Arresto di emergenza
CEI EN 60204-1:2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Funzioni di arresto - Categorie di arresto macchine e azionamenti Rev. 2.0 2023.pdf Certifico Srl - Rev. 2.0 2023 |
802 kB | 213 | ||
| Funzioni di arresto - Categorie di arresto macchine e azionamenti Rev. 1.0 2021.pdf Certifico S.r.l. Rev. 1.0 2021 |
789 kB | 348 | ||
| Funzioni di arresto - Categorie di arresto macchine e azionamenti Rev. 0.0 2021.pdf Certifico S.r.l. Rev. 0.0 2021 |
283 kB | 70 |
Regolamento certificazione PED - INAIL
Regolamento certificazione PED - INAIL 2025
ID 13480 | Update Rev. 21 del 13/01/2025
Il Regolamento descrive le modalità e le risorse con le quali INAIL O.N. 0100 gestisce l’erogazione dei servizi, in conformità alle norme UNI CEI EN ISO/IEC 17065, 17024, 17021-1, 17020, sotto notifica per le attrezzature a pressione e insiemi, nell’ambito della direttiva 2014/68/UE PED.
L'INAIL ON 0100 è un organismo notificato per la direttiva 2014/68/UE PED.
Nel Regolamento sono indicate le modalità che il Fabbricante deve seguire per l'ottenimento degli attestati di certificazione richiesti.
Sono inoltre indicati i diritti e i doveri del Fabbricante e le modalità seguite da INAIL O.N. 0100 per l'accertamento della conformità in relazione al modulo/i scelto/i dal Fabbricante. Agli effetti del Regolamento si intende per Fabbricante il soggetto che richiede la certificazione.
Il Regolamento riporta adempimenti relativamente alla direttiva 2014/68/UE PE.
La direttiva 2014/68/UE è una direttiva di prodotto riguardante gli apparecchi a pressione emanata dalla Comunità Europea e recepita in Italia con decreto legislativo n. 26 del 15/02/2016. Disciplina la progettazione, la costruzione, l’equipaggiamento e l’istallazione in sicurezza di apparecchi a pressione.
Il servizio di certificazione è effettuato dall'Inail in qualità di organismo notificato. I tecnici dell’Istituto eseguono – in accordo al relativo modulo di valutazione della conformità – adeguati esami e verifiche sulle attrezzature o insiemi a pressione fabbricati in accordo alla direttiva 2014/68/UE destinati a essere immessi sul mercato e messi in servizio all’interno dell’Unione Europea.
Il documento può essere considerato un valido esempio delle modalità in cui opera un organismo notificato.
Nel Regolamento, difatti, sono riportati oltre alle condizioni economiche anche i doveri dei richiedenti la certificazione.
...
Destinatari
Fabbricante o suo rappresentante autorizzato stabilito nell’Unione Europea, dell’attrezzatura/insieme a pressione destinato a essere immesso sul mercato europeo e marcato CE.
Finalità
Moduli di valutazione della conformità
Approvazione modalità operative e del personale che esegue giunzioni permanenti
Caratteristiche
La direttiva 2014/68/UE PED si applica alle attrezzature o insiemi di attrezzature a pressione (recipienti, generatori di vapore, tubazioni, accessori a pressione).
Il servizio di certificazione è effettuato dall'Inail in qualità di organismo notificato. I tecnici dell’Istituto eseguono – in accordo al relativo modulo di valutazione della conformità – adeguati esami e verifiche sulle attrezzature o insiemi a pressione fabbricati in accordo alla direttiva 2014/68/UE PED destinati a essere immessi sul mercato e messi in servizio all’interno dell’Unione Europea.
Modalità di richiesta
Il cliente richiede il servizio di certificazione all’Organismo Notificato 0100 e, per conoscenza, all’Unità operativa territoriale di certificazione, verifica e ricerca competente, attraverso la compilazione delle richieste di prestazione PED.
Il cliente deve allegare alla richiesta tutta la documentazione tecnica necessaria per consentire la valutazione della conformità del prodotto ai corrispondenti requisiti essenziali di sicurezza previsti dalla direttiva di riferimento. La richiesta può essere inoltrata:
- per posta ordinaria (O.N.0100- Via Roberto Ferruzzi 38-40, 00143 Roma);
- attraverso PEC (Questo indirizzo email è protetto dagli spambots. E' necessario abilitare JavaScript per vederlo.
).
Modalità di erogazione del servizio
Al termine dell'iter, l'Istituto rilascia il certificato e invia all’utente la fattura con i costi relativi alla prestazione svolta. Il relativo pagamento può essere effettuato a mezzo bonifico bancario con specifico riferimento al numero della fattura assegnato.
_______
[panel]12. Doveri della ditta richiedente la certificazione
La Ditta richiedente la Certificazione deve:
- rispettare le prescrizioni del presente Regolamento;
- fornire tutta la documentazione tecnica (come previsto da ciascun Modulo di cui all’Allegato III della Direttiva PED) relativa al prodotto da certificare in lingua italiana (eventualmente può essere accettata la lingua inglese), necessaria alla valutazione dello stesso;
- mettere a disposizione gli esemplari, eventuali campioni o il prototipo per l’esecuzione della verifica finale prevista dalla Direttiva e tutte le verifiche e prove necessarie, garantendo al personale ispettivo di INAIL O.N. 0100 accesso ai locali di fabbricazione del prodotto;
- non commercializzare prodotti prima della conclusione con esito positivo dell’iter di Certificazione;
- comunicare ad INAIL O.N. 0100, in forma preventiva, delle eventuali modifiche apportate al prodotto oggetto di certificazione e/o al relativo processo di produzione e/o al sistema qualità;
- comunicare ad INAIL O.N. 0100 eventuali reclami ricevuti da clienti relativamente al prodotto certificato;
- consentire, nel periodo di validità del contratto e del certificato, ove applicabile, lo svolgimento delle attività di sorveglianza sulla produzione o sul sistema di qualità attuato;
- fornire e mantenere aggiornata tutta la documentazione richiesta;
- informare INAIL O.N. 0100 in merito a trasferimenti di proprietà, variazioni di recapiti, apertura nuove sedi e/o succursali, cambi di denominazione sociale, modifiche significative dei propri cicli lavorativi;
- fornire, in caso rinnovo della certificazione, i dati aggiornati relativi al prodotto nonché gli eventuali reclami ricevuti;
- interrompere l’utilizzo di tutti i materiali pubblicitari che fanno riferimento alla certificazione, nel caso di sospensione o di revoca della stessa;
- rettificare tutti i materiali pubblicitari qualora il campo di applicazione della certificazione sia stato ridotto;
- non lasciare intendere che la certificazione si applichi a prodotti o attività che sono fuori dal campo di applicazione della certificazione;
- non utilizzare la propria certificazione in modo tale da poter danneggiare la reputazione dell’organismo di certificazione e/o del sistema di certificazione e compromettere la fiducia del pubblico;
- garantire l’accesso degli Ispettori/Auditor ivi compresi quelli ACCREDIA alla documentazione, alle aree aziendali di produzione e, ove applicabile, a tutte le registrazioni del Sistema Qualità per assicurare il corretto svolgimento della Verifica Ispettiva;
- garantire l’accesso ai valutatori ACCREDIA previa comunicazione da parte di INAIL O.N. 0100 dei loro nominativi;
- il Fabbricante in possesso di Certificazione si impegna a mantenere efficiente ed efficace il proprio sistema di gestione della qualità conformemente ai requisiti della direttiva PED;
- attuare i trattamenti alle non conformità e le azioni correttive al proprio Sistema di Gestione a seguito degli scostamenti rilevati;
- garantire l’accesso al personale ispettivo in addestramento e in supervisione;
- rendersi disponibile ad eventuali verifiche supplementari richieste sia da parte di INAIL O.N. 0100 sia da parte dell’Ente di Accreditamento. Alcune verifiche supplementari possono essere eseguite con un preavviso massimo di 5 giorni e il fabbricante non può ricusare il team incaricato di eseguire l’attività di valutazione. Tali verifiche sono in genere a carico di INAIL O.N. 0100 e sono eseguite a fronte di segnalazioni gravi che coinvolgono il prodotto; la non effettuazione di questa tipologia di verifica, comporta la revoca della certificazione concessa;
- rendersi disponibile ad eseguire delle verifiche con un preavviso di 5 giorni, a seguito di ricezione di reclami e/o segnalazioni, di sospensioni della certificazione senza possibilità di ricusare il team incaricato di eseguire tale audit;
- in caso di scadenza, o ritiro/revoca della certificazione, restituire i certificati e cessare di utilizzare tutti i riferimenti alla certificazione. Nei casi di scadenza del certificato correlato ai moduli di qualità il fabbricante non può continuare la produzione e la relativa certificazione;
- obbligo di informazione su eventuali procedimenti giudiziari e/o amministrativi in corso L'Organizzazione in possesso di Certificazione si impegna a: - informare entro 5 giorni dall’evento l'Istituto a mezzo e-mail lettera raccomandata A.R. o PEC di tutte le situazioni difformi rilevate dalle Autorità di controllo, eventuali sospensioni o revoche di autorizzazioni, concessioni, ecc. relative alla produzione/erogazione di prodotti e/o servizi connessi alla certificazione - comunicare immediatamente all’Istituto eventuali procedimenti giudiziari e/o amministrativi in corso, riguardanti l’oggetto della certificazione, fatti salvi i limiti posti dalla legge; - comunicare immediatamente il verificarsi di incidenti o di infortuni gravi o mortali o di danni ambientali. - mantenere informato l’Istituto sugli sviluppi dei suddetti procedimenti. In relazione a quanto sopra l’Istituto si riserva la facoltà di eseguire opportune e tempestive verifiche ispettive straordinarie ed, eventualmente, adottare provvedimenti di sospensione, riduzione, e/o revoca della certificazione rilasciata, in base agli impatti sul Sistema di gestione dell’Organizzazione.[/panel]
Fonte: INAIL
Collegati:
[box-note]Nuova Direttiva PED 2014/68/UE
Norme Armonizzate nuova Direttiva PED Settembre 2018
Nuova Direttiva PED 2014/68/UE: file CEM[/box-note]
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2021
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2021
CECE, January 2021
The purpose of this frequently asked questions (hereinafter ‘FAQ’) document is to contribute to a clear understanding of the Regulation (EU) 2016/1628, as amended by Regulation (EU) 2020/1040 (hereafter referred to as ‘the regulation’) and the relevant supplementing legislation:
a) Commission Delegated Regulation (EU) 2017/654 with regard to technical and general requirements relating to emission limits and type-approval for internal combustion engines for non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/989
b) Commission Delegated Regulation (EU) 2017/655 on monitoring of gaseous pollutant emissions from in-service combustion engines installed in non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/987
c) Commission Implementing Regulation (EU) 2017/656 on administrative requirements relating to emission limits and type-approval for internal combustion engines for non-road mobile machinery, and amended by Delegated Regulation (EU) 2018/988
The new requirements introduced in the amendments to the supplementing legislation are applicable from the following dates:
- 07 August 2018: These amendments may be used for Stage V type-approvals, revisions or extensions from this date onwards
- 01 January 2019: These amendments must be used for Stage V type-approvals, revisions or extensions from this date onwards
- 01 July 2019: All engines placed on market from this date must comply with these amendments and, for Stage V engines, be covered by a type-approval that was originally issued, or where necessary has been updated, in accordance with these amendments
The new requirements introduced in the amendment Regulation (EU) 2020/1040 to the Regulation (EU) 2016/1628 are applicable from the following dates:
- 01 July 2020: Amending Regulation (EU) 2016/1628 as regards its transitional provisions in order to address the impact of the COVID-19 crisis. The amendment covers only machines in which transition engines (variable or constant speed) that are in the power categories <56kW and ≥130kW are installed.
This regulation:
- concerns emission limits and type approval procedures for engines installed or intended to be installed in non-road mobile machinery
- it is also applicable to non-road mobile machinery where these engines are fitted
- entered into force on 6 October 2016 and is applicable from 1 January 2017
This FAQ:
- is intended to provide answers to key questions that are likely to be asked by users of the regulations, focusing especially on relevant provisions and obligations for the machine manufacturer (original equipment manufacturer (OEM)), importers and distributors
- does not cover the type-approval of the engine
...
Fonte: CECE, January 2021
Correlati
[box-note]Regolamento (UE) 2016/1628 NRMM
Non-Road Mobile Machinery emissions - NRMM Guide
Non-Road Mobile Machinery emissions - NRMM Guide | Update 2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Non-Road Mobile Machinery emissions - NRMM Guide Update 2021.pdf |
1417 kB | 10 |
Rettifica del regolamento (UE) 2020/740 | 30.04.2021
Rettifica del regolamento (UE) 2020/740 | 30.04.2021
Rettifica del regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009
GU L 147/23 del 30.4.2021
...
1) Nella Tavola di concordanza e alla pagina 1, titolo
anziché:
«Regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009»,
leggasi:
«Regolamento (UE) 2020/740 del Parlamento europeo e del Consiglio del 25 maggio 2020 sull’etichettatura dei pneumatici in relazione al consumo di carburante e ad altri parametri, che modifica il regolamento (UE) 2017/1369 e che abroga il regolamento (CE) n. 1222/2009 (Testo rilevante ai fini del SEE)».
2) Pagina 18, allegato II, punto 2.1, l'immagine della parte superiore dell'etichetta del pneumatico è sostituita dalla seguente:

3) Pagina 20, allegato II, punto 2.1.4, l'immagine della parte inferiore dell'etichetta del pneumatico è sostituita dalla seguente:
4) Pagina 21, allegato II, punto 2.2, lettera e), trattino 28:
anziché:
«pittogramma aderenza sulla neve: larghezza 15 mm, altezza 13 mm, <…>»,
leggasi:
«pittogramma aderenza sulla neve: larghezza 15 mm, altezza 14 mm, <…>».
Collegati
[box-note]Regolamento (UE) 2020/740[/box-note]
RAPEX Report 14 del 09/04/2021 N. 01 A12/00484/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 14 del 09/04/2021 N. 01 A12/00484/21 Repubblica Ceca
Approfondimento tecnico: Felpa per bambini
Il prodotto, di marca KILPI, mod. COTNY, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla norma tecnica europea EN 14682:2015 “Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini - Specifiche”
Il laccio del cappuccio è troppo lungo e con le estremità libere, il bambino potrebbe restare intrappolato con conseguente strangolamento.
EN 14682:2015 Sicurezza dell'abbigliamento per bambini - Cordoncini e lacci nell'abbigliamento per bambini – Specifiche
[…]
3.3 - Zona testa, collo e parte superiore del torace nei capi di abbigliamento per bambini più grandi e ragazzi (figura 1, zona A)
I lacci non devono avere estremità libere.
I lacci passanti privi di estremità libere non devono avere passanti sporgenti quando il capo di abbigliamento è steso su una superficie piana, alla massima estensione. Quando il capo è steso in taglia, ossia con la chiusura regolata alla vestibilità prevista, la circonferenza massima dei passanti sporgenti non deve essere di 15 cm.
Quando sono utilizzati dei fermacorda per la regolazione dei lacci passanti privi di estremità, il fermacorda deve essere fissato al capo di abbigliamento.
I cordoncini funzionali devono avere lunghezza non maggiore di 7.5 cm. I cordoncini funzionali non devono essere realizzati con cordoncini elastici.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 14 del 09_04_2021 N. 01 A12_00484_21 Repubblica Ceca.pdf Felpa per bambini |
364 kB | 0 |
Medical Devices - EUDAMED
Medical Devices - EUDAMED
ID 13951 | 09.07.2021 / Documentazione allegata
EUDAMED is the IT system developed by the European Commission to implement Regulation (EU) 2017/745 on medical devices and Regulation (EU) 2017/746 on in vitro diagnosis medical devices.
The new Regulations contain important improvements including a much larger EUDAMED database than the one that currently exists under the Medical Devices Directives (Eudamed2).
EUDAMED will improve transparency and coordination of information regarding medical devices available on the EU market.
The system will be multipurpose. It will function as a registration system, a collaborative system, a notification system and a dissemination system (open to the public) and will be interoperable.
EUDAMED is structured around 6 interconnected modules and a public website:
[alert] Actors registration
[box-note]On 1 December 2020 the European Commission has made available the Actor registration module.
It is the first of six EUDAMED modules.
- EUDAMED restricted
- EUDAMED public
The Commission is not in a position to require the use of the Actor registration module until EUDAMED is fully functional according to the Medical Device Regulation and additional national requirements on registrations can therefore not be excluded.[/box-note]
UDI/Devices registration
Notified Bodies and Certificates
Clinical Investigations and performance studies
Vigilance and post-market surveillance
Market Surveillance[/alert]
What is the state of play of the implementation of EUDAMED?
The development and implementation of EUDAMED is a high priority for the Commission
The module on Actor registration is available since December 2020
The module on UDI/device registration (second module) and the module on Certificates and Notified Bodies (third module) will become available in September 2021 except for the mechanism for scrutiny and the clinical evaluation consultation procedure (CECP) functionalities. Afterwards, the remaining modules as well as the mechanism for scrutiny and the CECP will be released when EUDAMED is fully functional.
Functional specifications
The Eudamed functional specifications have been public since February 2019. These functional specifications might be subject to possible changes as some issues are still under discussion.
MDR/IVDR UDI and device
Overview of the MDR UDI and device data sets and IVDR UDI and device data set to provide for their registration in EUDAMED.
EUDAMED UDI device data dictionary. This document clarifies the data that you should provide to EUDAMED for the UDI device registration module.
Management of Legacy devices in EUDAMED - Updated version (1.2) - February 2021
Data exchange
Data exchange guidelines
Machine-to-machine (M2M) data exchange documentation for economic operators
- M2M data exchange services and entity models introduction
- M2M data exchange services definition
- Service entity model XSD
- Service entity model UML diagrams
- xml samples
...
Fonte: EC
Collegati
[box-note]MDR Eudamed Functional Specifications
Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
Linee guida Regolamento Medical Devices (UE) 2017/745
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| xml samples.zip |
56 kB | 8 | ||
| Service entity model UML diagrams.zip |
931 kB | 8 | ||
| Service entity model XSD.zip |
76 kB | 6 | ||
| M2M data exchange services definition.pdf |
591 kB | 8 | ||
| M2M data exchange services and entity models introduction.pdf |
1446 kB | 12 | ||
| Data exchange guidelines.pdf |
124 kB | 4 | ||
| Management of Legacy devices in EUDAMED.pdf |
1137 kB | 6 | ||
| UDI device data dictionary.xlsx |
147 kB | 6 | ||
| IVDR UDI and device data sets.pdf |
220 kB | 4 | ||
| MDR UDI and device data sets.pdf |
259 kB | 10 | ||
| Eudamed functional specifications.pdf |
2494 kB | 9 |
Rettifica regolamento (UE) 2017/745 | 08.07.2021
Rettifica regolamento (UE) 2017/745 | 08.07.2021
Rettifica del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio, del 5 aprile 2017, relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio
GU L 241/7 del 8.7.2021
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Linee guida Regolamento Medical Devices (UE) 2017/745[/box-note]
Regolamento (UE) 2021/1068
Regolamento (UE) 2021/1068
Regolamento (UE) 2021/1068 del Parlamento europeo e del Consiglio del 24 giugno 2021 che modifica il regolamento (UE) 2016/1628 per quanto riguarda le disposizioni transitorie per alcune macchine munite di motori nell’intervallo di potenza pari o superiore a 56 kW e inferiore a 130 kW e pari o superiore a 300 kW, al fine di far fronte agli effetti della crisi COVID-19
GU L 230/1 del 30.6.2021
...
Articolo 1
L’articolo 58 del regolamento (UE) 2016/1628 è così modificato:
1) al paragrafo 5 è aggiunto il comma seguente:
«Per i motori di tutte le sottocategorie per i quali la data di cui all’allegato III per l’immissione sul mercato dei motori della fase V è il 1° gennaio 2020, a eccezione dei motori di cui al secondo comma e al terzo comma, il periodo di transizione è prorogato di nove mesi e il periodo di 18 mesi di cui al primo comma è prorogato di sei mesi.»;
2) al paragrafo 7 è aggiunta la lettera seguente:
«e) 33 mesi a decorrere dalla data applicabile all’immissione sul mercato dei motori di cui all’allegato III, nel caso di cui al paragrafo 5, sesto comma.
...
Collegati
[box-note]Regolamento (UE) 2016/1628 NRMM[/box-note]
Rapporto attività di vigilanza sui dispositivi medici Ed. 2020/1
Rapporto attività di vigilanza sui dispositivi medici Ed. Dicembre 2020
Il rapporto contiene un'analisi dei dati relativi all'anno 2019 sugli incidenti con dispositivi medici, raccolti nella banca dati del sistema di vigilanza del Ministero
La vigilanza sui dispositivi medici, svolta dal Ministero della Salute, costituisce un’attività di fondamentale importanza al fine di garantire la circolazione sul territorio nazionale di prodotti sicuri ed efficaci per i pazienti, gli utilizzatori e gli operatori sanitari. Il sistema di vigilanza si esplica attraverso un costante monitoraggio degli incidenti che avvengono con i dispositivi medici successivamente alla loro immissione in commercio, grazie anche alla collaborazione con tutti gli stakeholders coinvolti nel sistema. In particolare, il Ministero monitora le attività dei fabbricanti/distributori di dispositivi medici e degli operatori sanitari raccogliendo e analizzando tutti i dati che confluiscono nel sistema di vigilanza. Inoltre il Ministero effettua una valutazione puntuale degli incidenti segnalati e se del caso, divulga le informazioni al fine di ridurre la possibilità che lo stesso tipo di incidente si ripeta.
Il report 2019 si amplia rispetto alla versione 2018 con lo scopo di consentire al lettore, sia esso un utente/paziente del SSN, un fabbricante o un operatore sanitario di acquisire elementi informativi rilevanti per le proprie conoscenze e attività professionali.
Il documento è strutturato in due sezioni: la prima riguarda la descrizione dei dati sugli incidenti verificatisi nell’anno 2019, e pone particolare attenzione alle categorie di dispositivi medici con maggiore frequenza di incidente; la seconda fornisce un quadro su alcune tematiche di particolare interesse emerse nell’anno 2019, che sono state oggetto di approfondimento da parte del Ministero.
Sono stati inoltre introdotte interessanti sezioni relative ai dispositivi del settore ortopedico, e al settore dei dispositivi da somministrazione, prelievo e raccolta.
Un capitolo è dedicato al tema delle falsificazioni e, in vista dell’applicazione del nuovo Regolamento Europeo 745/2017 si è dedicata una sezione a tutte le iniziative in corso in materia di vigilanza da parte dei gruppi dedicati della Commissione Europea.
Inoltre nel presente Rapporto è inserita una sezione dedicata alla analisi dei dati relativi agli incidenti con i dispositivi medici diagnostici in vitro. In allegato, oltre alla normativa di riferimento, è stato inserito un glossario al fine di aiutare nella lettura delle numerose sigle presenti nel documento.
L’obiettivo del documento è quello di condividere, con tutti gli attori coinvolti nel settore, i risultati delle analisi derivanti dall’attività di vigilanza, in maniera trasparente e con finalità informativa.
L’informazione trasparente e condivisa è infatti considerata tra le priorità del Ministero della Salute, in quanto punto di partenza per una vigilanza attiva ed a tutela della salute pubblica.
___
Sommario
1 Introduzione
2 Il Sistema di Vigilanza del Ministero della Salute
3 Segnalazioni di incidente
Analisi delle segnalazioni di incidente per Classi di Rischio
Analisi delle segnalazioni di incidente per categoria CND
Analisi delle segnalazioni di incidente per categoria di CND e per classificazione dell’incidente
Analisi delle segnalazioni di incidente che hanno portato al decesso per categoria di CND
Analisi delle segnalazioni di incidente che hanno portato ad un inaspettato peggioramento dello stato
di salute e/o serio pericolo per la salute pubblica per Categoria di CND
Trend delle segnalazioni di incidenti nel triennio 2016-2019
Segnalazioni degli incidenti per Regione e Provincia Autonoma
Analisi dei rapporti operatore e fabbricante pervenuti per Regione e Provincia Autonoma
Rapporti di Sintesi Periodica (Periodic Summary Report)
4 Avvisi di sicurezza
5 I dispositivi medico diagnostici in vitro (IVD)
Analisi delle segnalazioni di incidente per gli IVD
5.1.1 Analisi delle segnalazioni di incidente per Gruppi della Categoria CND W
5.1.2 Analisi delle segnalazioni di incidente per classe di rischio
5.1.3 Analisi del numero di Avvisi di Sicurezza diffusi sul territorio nazionale per tipologia
6 Approfondimenti
Le Protesi mammarie
Le Apparecchiature sanitarie e relativi componenti e accessori
I dispositivi medici del settore cardiocircolatorio
I dispositivi medici del settore cardiovascolare
I dispositivi da somministrazione, prelievo e raccolta
I dispositivi medici del settore ortopedico
La rete della dispositivo-vigilanza
Nuove attività della Vigilanza sui dispositivi medici: lotta alle falsificazioni
L’Italia nel sistema di vigilanza europeo
Allegato 1 - Glossario
Allegato 2 - Riferimenti Normativi
Allegato 3 - Elenco delle Tabelle
Allegato 4 - Elenco delle Figure
...
Fonte: Ministero della Salute
Collegati
[box-note]Rapporto attività di vigilanza sui dispositivi medici Ed. 2020
Linee guida Regolamento Medical Devices (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Dispositivi medici - rapporto sulle attività di vigilanza 2019.pdf |
3330 kB | 34 |
RAPEX Report 22 del 04/06/2021 N. 17 A12/00787/21 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 22 del 04/06/2021 N. 17 A12/00787/21 Polonia
Approfondimento tecnico: Uovo di dinosauro per bambini
Il prodotto di marca sconosciuta, mod. LSB1375-1, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica EN 71-1:2018 “Sicurezza dei giocattoli - Parte 1: Proprietà meccaniche e fisiche”.
Il materiale del giocattolo aumenta di dimensioni se immerso in acqua per più del 50% della sua dimensione. Il giocattolo può essere messo in bocca e ingerito dai bambini. Man mano che il giocattolo aumenta di dimensioni, può causare l'occlusione delle vie respiratorie o il blocco intestinale dei bambini più piccoli.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
I. Proprietà fisico-meccaniche
[…]
4. a) I giocattoli e le loro parti non devono comportare un rischio di strangolamento.
b) I giocattoli e le loro parti non devono presentare alcun rischio di asfissia per blocco del flusso d’aria a causa di un’ostruzione delle vie aeree all’esterno della bocca e del naso.
c) I giocattoli e le loro parti devono avere dimensioni tali da non comportare alcun rischio di asfissia per interruzione del flusso d’aria a seguito dell’ostruzione interna delle vie aeree causata da corpi incastrati nella bocca o nella faringe o introdotti all’ingresso delle vie respiratorie inferiori.
d) I giocattoli chiaramente destinati ad essere utilizzati da bambini di età inferiore a 36 mesi, i loro componenti e le eventuali parti staccabili devono avere dimensioni tali da prevenirne l’ingestione o inalazione. Questo requisito si applica anche agli altri giocattoli destinati a essere portati alla bocca, ai loro componenti e alle loro eventuali parti staccabili. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 22 del 04_06_2021 N. 17 A12_00787_21 Polonia.pdf Uovo di dinosauro giocattolo |
363 kB | 0 |
Elenco norme armonizzate DPI cadute dall'alto
Elenco norme armonizzate DPI cadute dall'alto / Aggiornato 09 Gennaio 2024
ID 13784 | Rev. 2.0 del 09 gennaio 2024 / Documento completo allegato
Elenco delle norme armonizzate relative ai Dispositivi individuali per la protezione contro le cadute/cadute dall'alto ai sensi del Regolamento 2016/425/UE (DPI) e altre non armonizzate (Rev. 1.0 2023 / Rev. 2.0 2024).
Per il Regolamento DPI (Regolamento (UE) 2016/425) i DPI contro le cadute dall'alto sono DPI di terza categoria e devono:
- devono essere marcati CE;
- deve essere disposta la Dichiarazione UE di conformità;
- deve essere disposto il Manuale di Istruzioni.
L'elenco delle norme è completo di descrizione del contenuto e comprensivo dei link ad UNI.
Vedi Elenco norme armonizzate Regolamento DPI
[panel]Elenco delle norme armonizzate relative ai Dispositivi individuali per la protezione contro le cadute/cadute dall'alto:
1. EN 353-1:2014+A1:2017
Dispositivi individuali per la protezione contro le cadute - Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio - Parte 1: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio rigida
2. EN 353-2:2002
Dispositivi di protezione individuale contro le cadute dall'alto - Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio flessibile
3. EN 354:2010
Dispositivi individuali per la protezione contro le cadute - Cordini
4. EN 355:2002
Dispositivi di protezione individuale contro le cadute dall'alto - Assorbitori di energia
5. EN 358:2018
Dispositivi di protezione individuale per il posizionamento sul lavoro e la prevenzione delle cadute dall'alto - Cinture di posizionamento sul lavoro e di trattenuta e cordini di posizionamento sul lavoro [Rev. 1.0 2023]
6. EN 360:2002
Dispositivi di protezione individuale contro le cadute dall'alto - Dispositivi anticaduta di tipo retrattile
7. EN 361:2002
Dispositivi di protezione individuale contro le cadute dall'alto - Imbracature per il corpo
8. EN 362:2004
Dispositivi di protezione individuale contro le cadute dall'alto - Connettori
9. EN 365:2004
Dispositivi di protezione individuale contro le cadute dall'alto - Requisiti generali per le istruzioni per l'uso, la manutenzione, l'ispezione periodica, la riparazione, la marcatura e l'imballaggio
10. EN 795:2012
Dispositivi individuali per la protezione contro le cadute - Dispositivi di ancoraggio
11. EN 813:2008
Dispositivi di protezione individuale per la prevenzione dalle cadute dall'alto - Cinture con cosciali
12. EN 1497:2007
Dispositivo di protezione individuale contro le cadute - Imbracature di salvataggio
13. EN 1891:1998
Dispositivi di protezione individuale per la prevenzione delle cadute dall'alto - Corde con guaina a basso coefficiente di allungamento
14. EN 12841:2006
Dispositivi di protezione individuale per la prevenzione delle cadute dall'alto - Sistemi di accesso con fune - Dispositivi di regolazione della fune per il posizionamento sul lavoro[/panel]
Estratto
Dispositivi individuali per la protezione contro le cadute - Cordini
Recepisce: EN 354:2010
La presente norma è la versione ufficiale della norma europea EN 354 (edizione luglio 2010). La norma specifica i requisiti, i metodi di prova, la marcatura, le informazioni fornite dal fabbricante e l’imballaggio per i cordini. I cordini conformi alla norma sono utilizzati come elementi di collegamento o come componenti nei sistemi individuali per la protezione contro le cadute (ossia sistemi di trattenuta, sistemi di posizionamento sul lavoro, sistemi di accesso mediante corda, sistemi di arresto caduta e sistemi di salvataggio).
[...]
Dispositivi di protezione individuale per la prevenzione delle cadute dall'alto - Corde con guaina a basso coefficiente di allungamento
Recepisce: EN 1891:1998
La presente norma è la versione ufficiale in lingua italiana della norma europea EN 1891 (edizione aprile 1998). La norma si applica alle corde tessili a basso coefficiente di allungamento con guaina, di diametro compreso fra 8,5 mm e 16 mm, utilizzate dalle persone per gli accessi mediante corda, compresi tutti i tipi di posizionamento sul lavoro e di trattenuta, per il salvataggio e in speleologia.
Dispositivi individuali per la protezione contro le cadute - Sistemi di accesso con fune - Dispositivi di regolazione della fune
Recepisce: EN 12841:2006
La presente norma è la versione ufficiale della norma europea EN 12841 (edizione agosto 2006). La norma si applica ai dispositivi di regolazione della fune destinati ad essere utilizzati nei sistemi di accesso con fune. Essa specifica i requisiti, i metodi di prova, la marcatura e le informazioni fornite dal fabbricante. I dispositivi di regolazione della fune conformi alla norma possono essere progettati per l’utilizzo da parte di una persona oppure, in caso di salvataggio, da due persone simultaneamente. I dispositivi di regolazione della fune come descritti non sono idonei per l’utilizzo in un sistema di arresto caduta.
...
Altre norme non armonizzate [Rev. 2.0 2024]
...
segue in allegato
Certifico Srl - IT | Rev. 2.0 2024
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 2.0 | 09.01.2024 | EN 360:2023 | Certifico Srl |
| 1.0 | 30.10.2023 | EN 358:2018 Inserire norme non armonizzate: UNI EN 341:2011 UNI EN 363:2019 UNI EN 1496:2017 UNI EN 1498:2007 UNI CEN/TS 16415:2013 UNI ISO 22846-1:2017 UNI ISO 22846-2:2017 |
Certifico Srl |
| 0.0 | 15.06.2021 | --- | Certifico Srl |
Collegati
[box-note]EN 360:2023 - Personal fall protection equipment
UNI EN 361:2003
UNI EN 362:2005
UNI EN 363:2019
UNI EN 364:1993
UNI EN 365:2005
UNI EN 1497:2008
UNI 11158:2015 DPI cadute dall'alto - Guida selezione ed uso
Regolamento (UE) 2016/425
Elenco norme armonizzate Regolamento DPI
D.Lgs. 81/2008
Decreto Legislativo n. 475 del 4 dicembre 1992
Dispositivi anticaduta: procedura uso e verifica[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Elenco norme armonizzate DPI cadute dall'alto Rev. 2.0 2024.pdf Certifico Srl - Rev. 2.0 2024 |
671 kB | 92 | ||
| Elenco norme armonizzate DPI cadute dall'alto Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
674 kB | 117 | ||
| Elenco norme armonizzate DPI cadute dall'alto Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
868 kB | 91 |
Rapporto ISTISAN 21/9 - Identificazione e tracciabilità dei dispositivi medici
Rapporto ISTISAN 21/9 - Identificazione e tracciabilità dei dispositivi medici
Rapporto ISTISAN 21/9 - Identificazione e tracciabilità dei dispositivi medici: ruolo e responsabilità degli operatori economici e strumenti per l’applicazione del Regolamento (UE) 2017/745
Un inadeguato sistema di gestione dei dispositivi medici può rappresentare un serio rischio per la sicurezza e la salute di pazienti o utilizzatori finali. Un dispositivo medico deve, in qualsiasi momento e per qualsiasi evenienza, essere identificabile e tracciabile, nella catena di fornitura, e sul mercato. Questo requisito diventa critico in caso di contraffazione o potenziale danno per la salute. Il nuovo Regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio modifica il quadro normativo europeo nel settore dei dispositivi medici, la principale innovazione introdotta è l’istituzione in Unione Europea del sistema UDI per l’identificazione unica dei dispositivi.
Il Regolamento sottolinea l’importanza del ruolo di ogni operatore economico coinvolto nella gestione del dispositivo medico, durante il suo ciclo di vita. Fabbricanti, mandatari, importatori e distributori devono ora assicurare il rispetto di nuovi obblighi e assumersi specifiche responsabilità. Questo lavoro, destinato principalmente agli operatori economici, analizza i nuovi requisiti introdotti dal Regolamento (UE) 2017/745 per la tracciabilità dei dispositivi medici, fornisce degli strumenti per la corretta gestione dei dispositivi medici e tiene in considerazione l’impatto dell’attuale emergenza COVID-19 sull’applicazione delle nuove regole.
...
Fonte: ISS
Collegati
[box-note]Regolamento (UE) 2017/745
Rettifica del regolamento (UE) 2017/745 | 03.05.2019
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
Linee guida Regolamento Medical Devices (UE) 2017/745[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Rapporto ISTISAN 21 9.pdf |
2588 kB | 10 |
Direttiva delegata (UE) 2021/884
Direttiva delegata (UE) 2021/884
Direttiva delegata (UE) 2021/884 della Commissione dell’8 marzo 2021 che modifica, adeguandolo al progresso scientifico e tecnico, l’allegato IV della direttiva 2011/65/UE del Parlamento europeo e del Consiglio per quanto riguarda il periodo di validità dell’esenzione relativa all’uso di mercurio nei connettori elettrici rotanti presenti nei dispositivi medici per l’imaging ad ultrasuoni intravascolare
GU L 194/37 del 2.6.2021
Entrata in vigore: 22.06.2021
In applicazione: a decorrere dal 1° luglio 2022
...
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell’Unione europea,
vista la direttiva 2011/65/UE del Parlamento europeo e del Consiglio, dell’8 giugno 2011, sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche, in particolare l’articolo 5, paragrafo 1, lettera a),
considerando quanto segue:
(1) La direttiva 2011/65/UE impone agli Stati membri di garantire che le apparecchiature elettriche ed elettroniche immesse sul mercato non contengano le sostanze pericolose elencate nell’allegato II della direttiva stessa. Tale restrizione non riguarda alcune applicazioni soggette ad esenzione che sono specifiche ai dispositivi medici e agli strumenti di monitoraggio e di controllo e sono elencate nell’allegato IV di tale direttiva.
(2) Le categorie di apparecchiature elettriche ed elettroniche cui si applica la direttiva 2011/65/UE sono elencate nell’allegato I della direttiva stessa.
(3) Il mercurio è una sostanza soggetta a restrizioni inclusa nell’elenco di cui all’allegato II della direttiva 2011/65/UE.
(4) Con la direttiva delegata (UE) 2015/574 la Commissione ha concesso un’esenzione per l’uso del mercurio nei dispositivi medici per l’imaging ad ultrasuoni intravascolare (in appresso «l’esenzione»), inserendo tale applicazione nell’allegato IV della direttiva 2011/65/UE. L’esenzione doveva giungere a termine il 30 giugno 2019, conformemente all’articolo 5, paragrafo 2, terzo comma, della citata direttiva.
(5) La Commissione ha ricevuto una domanda di rinnovo dell’esenzione (in appresso «la domanda di rinnovo») il 6 ottobre 2017, ossia entro i termini di cui all’articolo 5, paragrafo 5, della direttiva 2011/65/UE. Conformemente a tale disposizione, l’esenzione resta valida fino all’adozione di una decisione sulla domanda di rinnovo.
(6) La valutazione della domanda di rinnovo ha compreso consultazioni dei portatori di interessi conformemente all’articolo 5, paragrafo 7, della direttiva 2011/65/UE. I commenti ricevuti nel corso di dette consultazioni sono stati pubblicati su un apposito sito Internet.
(7) Il mercurio è utilizzato nei connettori elettrici rotanti presenti nei dispositivi medici per l’imaging ad ultrasuoni intravascolare che forniscono la via per la conduzione elettrica tra il trasduttore rotante e l’apparecchiatura elettronica fissa. L’uso del mercurio consente, tra l’altro, il funzionamento con frequenze più elevate che permette di ottenere un imaging a risoluzione maggiore vantaggioso per i pazienti.
(8) La sostituzione o l’eliminazione del mercurio nelle applicazioni oggetto della presente direttiva risulta attualmente impraticabile sotto il profilo scientifico e tecnico, a causa della mancanza di alternative. L’esenzione è coerente con il regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio (3), e pertanto non indebolisce la protezione dell’ambiente e della salute da esso offerta.
(9) È pertanto opportuno concedere il rinnovo dell’esenzione.
(10) È opportuno concedere il rinnovo dell’esenzione per un periodo di 7 anni fino al 30 giugno 2026, conformemente all’articolo 4, paragrafo 3, e all’articolo 5, paragrafo 2, terzo comma, della direttiva 2011/65/UE. Alla luce dei risultati delle iniziative in atto tese a trovare una sostituzione affidabile, è improbabile che la durata dell’esenzione abbia ripercussioni negative sull’innovazione.
(11) È pertanto opportuno modificare di conseguenza la direttiva 2011/65/UE,
HA ADOTTATO LA PRESENTE DIRETTIVA:
Articolo 1
L’allegato IV della direttiva 2011/65/UE è modificato conformemente all’allegato della presente direttiva.
Articolo 2
1. Gli Stati membri adottano e pubblicano, entro il 30 giugno 2022, le disposizioni legislative, regolamentari e amministrative necessarie per conformarsi alla presente direttiva. Essi comunicano immediatamente alla Commissione il testo di tali disposizioni.
Essi applicano tali disposizioni a decorrere dal 1° luglio 2022.
Le disposizioni adottate dagli Stati membri contengono un riferimento alla presente direttiva o sono corredate di tale riferimento all’atto della pubblicazione ufficiale. Le modalità del riferimento sono stabilite dagli Stati membri.
2. Gli Stati membri comunicano alla Commissione il testo delle disposizioni principali di diritto interno che adottano nel settore disciplinato dalla presente direttiva.
Articolo 3
La presente direttiva entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Articolo 4
Gli Stati membri sono destinatari della presente direttiva.
______
ALLEGATO
Nella voce 42 dell’allegato IV della direttiva 2011/65/UE , il secondo capoverso è sostituito dal seguente:
«Scade il 30 giugno 2026.».
Collegati
[box-note]Direttiva RoHS: Open Scope dal 22 luglio 2019
Direttiva RoHS: Evoluzioni
Direttiva (UE) 2015/863: Modifica all'allegato II RoHS II
Dichiarazione UE di Conformità RoHS II - Modello
Direttiva RoHS III | Testo consolidato
Decreto Legislativo n. 27 del 4 Marzo 2014
Indicazioni operative ambito applicazione direttiva RAEE[/box-note]
RAPEX Report 19 del 14/05/2021 N. 03 A12/00665/21 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 19 del 14/05/2021 N. 03 A12/00665/21 Francia
Approfondimento tecnico: Braccialetto
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006 , concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una quantità eccessiva di cadmio e piombo (valori misurati: 82% e 0,11% in peso, rispettivamente).
Il cadmio è dannoso per la salute umana perché si accumula nel corpo, può danneggiare i reni e le ossa e può provocare il cancro.
Il piombo è dannoso per la salute umana, si accumula nel corpo ed è neurotossico. Inoltre, può essere dannoso durante l’allattamento ed in gravidanza.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
23. Cadmium
[…] 10. Sono vietati l'uso o l'immissione sul mercato se il tenore è pari o superiore allo 0,01 % in peso del metallo in:
i) monili di metallo e altri componenti di metallo impiegati nella fabbricazione di oggetti di gioielleria;
ii) parti di metallo di articoli di gioielleria e di bigiotteria e accessori per capelli, compresi:
- braccialetti, collane e anelli
- gioielli per piercing,
- orologi da polso e cinturini,
- spille e gemelli per polsini. […]
63. Piombo
1. Da non immettere sul mercato o usare in singole parti di articoli di gioielleria se la concentrazione di piombo (espressa in metallo) in tale parte è uguale o superiore a 0,05 % in peso.
2. Ai fini del paragrafo 1:
i) «articoli di gioielleria» comprende gli articoli di gioielleria e di bigiotteria e gli accessori per capelli, inclusi:
a) braccialetti, collane e anelli;
b) articoli di gioielleria per piercing;
c) orologi da polso e bracciali da uomo;
d) spille e gemelli per polsini;
ii) «singole parti» comprende i materiali che costituiscono l’articolo di gioielleria, nonché le singole componenti degli articoli di gioielleria. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 19 del 14_05_2021 N. 03 A12_00665_21 Francia.pdf Braccialetto |
355 kB | 0 |
Decreto Legislativo 31 ottobre 2002, n. 271
Decreto Legislativo 31 ottobre 2002, n. 271
Modifiche ed integrazioni al decreto legislativo 24 febbraio 1997, n. 46, concernente i dispositivi medici, in attuazione delle direttive 2000/70/CE e 2001/104/CE.
(GU n.291 del 12.12.2002)
Collegati
[box-note]Decreto Legislativo n. 46 del 24 Febbraio 1997[/box-note]
Guidelines for compliance with delegated regulation (EU) 2019/320
Guidelines for compliance with delegated regulation (EU) 2019/320
The purpose of this document is to support the Notified Bodies in charge ofradio equipment compliance assessment in applying a consistent approach related to the requirements stemming from Delegated Regulation (EU) 2019/320.
[box-note]Regolamento delegato (UE) 2019/320
Regolamento delegato (UE) 2019/320 della Commissione del 12 dicembre 2018 che integra la direttiva 2014/53/UE del Parlamento europeo e del Consiglio per quanto riguarda l'applicazione dei requisiti essenziali di cui all'articolo 3, paragrafo 3, lettera g), di tale direttiva, al fine di garantire la localizzazione del chiamante nelle comunicazioni di emergenza da dispositivi mobili.
GU L 55/3 del 25.02.2019
Entrata in vigore: 17.03.2019
Esso si applica a decorrere dal 17 marzo 2022[/box-note]
___
Contents
1. Introduction
2. Policy and legal context
3. Requirements
4. Definitions
5. GNSS Test Specifications
5.1. GNSS Radio Frequency (RF) testing environment
5.2. Compatibility with Galileo
5.2.1. GNSS Simulator Configuration in the Conformance Testing
5.2.2. NMEA output test
5.2.3. Time to first fix test
5.2.4. Horizontal accuracy test
5.3. Galileo Open Service Navigation Message Authentication readiness
5.4. Exposure of additional Galileo observables
6. Specifications related to making available for transmission of the data referred to in Article 1(2) of Delegated Regulation (EU) 2019/320
7. Specifications related to wireless local area network for positioning
8. List of Abbreviation
...
Collegati
[box-note]Regolamento delegato (UE) 2019/320[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidelines for compliance with delegated regulation EU 2019 320.pdf |
643 kB | 7 |
Guidance document n° 20 on the application of Directive 2009/48/EC
Guidance document n° 20 on the application of Directive 2009/48/EC on the safety of toys
30 April 2021
Decorative products and products for collectors
This Guidance document is a non-binding document intended to provide guidelines to help Member States and stakeholders making the distinction between toys and other consumer products. It expresses the views of the majority of members in the Expert Group on Toy Safety.
The images appearing in the document constitute examples intended to facilitate the decisionmaking. They do not presuppose the conformity of the represented products.
This Guidance document does not relieve national authorities from their obligation to determine for any individual product, on a case-by-case basis, whether it falls within the scope of application of the Toy Safety Directive 2009/48/EC or within the scope of application of other sectoral legislation. The Court of Justice of the European Union has repeatedly held that the national authorities, acting under the supervision of the courts, must proceed on a caseby-case basis, taking account of all the characteristics of the product. Therefore, this document shall not ‘prescribe’ which regulatory framework applies. Rather, it shall serve as one out of many elements supporting the national competent authorities in their case-by-case decision on individual products. In particular, this Guidance document does not prevent a national authority from consulting with colleagues from other regulated sectors concerned in order to reach a complete view on all aspects related to a given product.
...
Fonte: EC
Collegati
[box-note]Raccolta UE Linee Guida Giocattoli - AGG. 03.2015
Direttiva 2009/48/CE giocattoli
Giocattoli | Direttiva 2009/48/CE e NTA[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Guidance document n 20 on the application of Directive 2009 48 EC on the safety of toys.pdf 30.04.2021 |
1977 kB | 9 |
RAPEX Report 17 del 30/04/2021 N. 06 A12/00586/21 Ungheria

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 17 del 30/04/2021 N. 06 A12/00586/21 Ungheria
Approfondimento tecnico: Asciugacapelli
Il prodotto, di marca HOOMEI, mod. HM-7650, è stato sottoposto alle procedura di richiamo presso i consumatori e ritiro dal mercato perché non conforme Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alle norme tecniche EN 60335-1 “Sicurezza degli apparecchi elettrici d'uso domestico e similare -Sicurezza Parte 1: Norme generali” e EN 60335-2-23 “Sicurezza degli apparecchi elettrici d'uso domestico e similare Parte 2: Norme particolari per gli apparecchi per la cura della pelle e dei capelli.”
L'asciugacapelli non è dotato di dispositivo di protezione termica, pertanto, può surriscaldarsi e prendere fuoco durante l'uso.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 17 del 30_04_2021 N. 06 A12_00586_21 Ungheria.pdf Asciugacapelli |
366 kB | 0 |
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine
Tavola di concordanza estesa RESS Direttiva / Regolamento Macchine - Pubblicato in GU in vigore dal 19.07.2023
13531 | 04.07.2023 / Tavola di concordanza completa in allegato Rev. 4.0 2023
[box-info]Rev. 4.0 del 04 Luglio 2023
- Rettifica del regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio, del 14 giugno 2023, relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU L 169/35 del 4.7.2023)
…
Applicazione dal 20.01.2027. Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
- gli articoli da 26 a 42 si applicano a decorrere dal 20.01.2024
- l'articolo 50, paragrafo 1, si applica a decorrere dal 20.10.2026
- l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19.07.2023
- l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20.07.2024
La direttiva 2006/42/CE è abrogata a decorrere dal 20.01.2027
La direttiva 73/361/CEE è abrogata[/box-info]
[box-info]Rev. 3.0 del 03 Luglio 2023
- Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio. (GU n. 165/1 del 29.06.2023). Entrata in vigore: 19.07.2023[/box-info]
La tavola di seguito proposta mette a confronto e raccorda i RESS (Requisiti essenziali di sicurezza e di tutela della salute) di cui all’Allegato I della Direttiva 2006/42/CE con i novelli propri di cui all’Allegato III del del Regolamento (UE) 2023/1230 del Parlamento europeo e del Consiglio del 14 giugno 2023 relativo alle macchine e che abroga la direttiva 2006/42/CE del Parlamento europeo e del Consiglio e la direttiva 73/361/CEE del Consiglio, pubblicato in GU n. 165/1 del 29.06.2023 ed in vigore dal 19.07.2023.
Il fabbricante di un prodotto della macchina o il suo rappresentante autorizzato deve garantire che venga effettuata una valutazione del rischio al fine di determinare la salute e la sicurezza requisiti, che si applicano al prodotto macchina. Il prodotto macchina deve quindi essere progettato e costruito per prevenire e ridurre al minimo tutti i rischi rilevanti, tenendo conto del risultati della valutazione del rischio.
Con il processo iterativo di valutazione e riduzione del rischio, il fabbricante o il suo rappresentante autorizzato devono:
[alert]- determinare i limiti del prodotto macchina, che includono l'uso previsto e qualsiasi uso improprio ragionevolmente prevedibile degli stessi;
- determinare i rischi derivanti dalle interazioni tra macchine;
- identificare i pericoli che possono essere generati dal prodotto della macchina e dal situazioni pericolose associate, inclusi i pericoli che possono essere generati durante il ciclo di vita del prodotto macchina prevedibile al momento della collocazione del prodotto macchinario immesso sul mercato come voluta evoluzione del suo prodotto in tutto o in parte comportamento o logica in evoluzione come risultato del prodotto macchina progettato per funzionare con diversi livelli di autonomia. A questo proposito, dove il prodotto macchina integra un sistema di intelligenza artificiale, la valutazione del rischio della macchina deve considerare la valutazione del rischio per quel sistema di intelligenza artificiale.
- stimare i rischi, tenendo conto della gravità del possibile infortunio o danno a salute e probabilità che si verifichi;
- valutare i rischi, al fine di determinare se è necessaria una riduzione del rischio;
- eliminare i pericoli o ridurre i rischi associati a questi pericoli mediante l'applicazione delle misure di protezione, nell'ordine di priorità stabilito nella sezione 1.1.2 (b).[/alert]
Gli obblighi previsti dai requisiti essenziali di salute e sicurezza si applicano solo quando il rischio corrispondente esiste per il prodotto macchina in questione quando viene utilizzato sotto le condizioni previste dal fabbricante o dal suo mandatario o in situazioni anomale prevedibili. Tuttavia, i principi di integrazione della sicurezza stabiliti in sezione 1.1.2 e gli obblighi relativi alla marcatura dei prodotti e delle istruzioni delle macchine di cui alle sezioni 1.7.3 e 1.7.4 si applicano in tutti i casi.
Il regolamento si applicherà dal 20 gennaio 2027, per consentire ai fabbricanti, agli organismi notificati e gli Stati membri tempo per adeguarsi ai nuovi requisiti.
[box-warning]Regolamento (UE) 2023/1230
Articolo 51 Abrogazioni
1. La direttiva 73/361/CEE è abrogata.
I riferimenti alla direttiva 73/361/CEE abrogata si intendono fatti al presente regolamento.
2. La direttiva 2006/42/CE è abrogata a decorrere dal 20 gennaio 2027.
I riferimenti alla direttiva 2006/42/CE abrogata si intendono fatti al presente regolamento e si leggono secondo la tavola di concordanza di cui all'allegato XII.
Articolo 52 Disposizioni transitorie
1. Gli Stati membri non impediscono la messa a disposizione sul mercato di prodotti immessi sul mercato in conformità della direttiva 2006/42/CE prima del 20 gennaio 2027. Tuttavia, il capo VI del presente regolamento si applica a decorrere dal 19 luglio 2023 mutatis mutandis a tali prodotti in sostituzione dell'articolo 11 di tale direttiva, compresi i prodotti per i quali è già stata avviata una procedura ai sensi dell'articolo 11 della direttiva 2006/42/CE.
2. I certificati di esame CE del tipo e le decisioni di approvazione rilasciate in conformità dell'articolo 12 della direttiva 2006/42/CE rimangono validi fino alla loro scadenza.
Articolo 53 Valutazione e riesame
1. Entro il 20 luglio 2028 e, successivamente, ogni quattro anni, la Commissione presenta una relazione sulla valutazione e sul riesame del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
2. Tenendo conto del progresso tecnico e dell'esperienza pratica acquisita negli Stati membri come specificato all'articolo 6, la Commissione include nella relazione una valutazione dei aspetti seguenti del presente regolamento:
a) i requisiti essenziali di sicurezza e di tutela della salute di cui all'allegato III;
b) la procedura di valutazione della conformità applicabile alle macchine o ai prodotti correlati elencati nell’allegato I.
Se del caso, la relazione è corredata di una proposta legislativa di modifica delle pertinenti disposizioni del presente regolamento.
3. Entro il 20 luglio 2026 e, successivamente, ogni cinque anni, la Commissione presenta una relazione specifica sulla valutazione dell'articolo 6, paragrafi 4 e 5, del presente regolamento al Parlamento europeo e al Consiglio. Tali relazioni sono rese pubbliche.
La Commissione include nelle sue relazioni gli elementi seguenti:
a) una sintesi dei dati e delle informazioni forniti dagli Stati membri a norma dell'articolo 6, paragrafo 5, durante il periodo di riferimento;
b) una valutazione dell'elenco delle categorie di macchine o prodotti correlati di cui all'allegato I alla luce dei criteri di cui all'articolo 6, paragrafo 4.
Nelle relazioni la Commissione valuta l'adeguatezza e la disponibilità dei dati e delle informazioni forniti dagli Stati membri, comprese la loro adeguatezza e idoneità al fine di effettuare confronti, individuando eventuali carenze onde garantire il funzionamento efficace e l'applicazione dell'articolo 6.
Articolo 54 Entrata in vigore e applicazione
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Esso si applica a partire dal 20 gennaio 2027.
Tuttavia, gli articoli seguenti si applicano a decorrere dalle date seguenti:
a) gli articoli da 26 a 42 si applicano a decorrere dal 20 gennaio 2024;
b) l'articolo 50, paragrafo 1, si applica a decorrere dal 20 ottobre 2026;
c) l'articolo 6, paragrafo 7, e gli articoli 48 e 52 si applicano a decorrere dal 19 luglio 2023;
d) l'articolo 6, paragrafi da 2 a 6, paragrafo 8 e paragrafo 11, l'articolo 47 e l'articolo 53, paragrafo 3, si applicano a decorrere dal 20 luglio 2024.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.[/box-warning]
...
Estratto
Tavola di concordanza estesa RESS Direttiva/Regolamento Macchine
Colonna (1) - Direttiva 2006/42/CE
Colonna (2) - Regolamento (UE) 2023/1230
[...]
... Segue in allegato
Certifico Srl - IT | Rev. 4.0 2023
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 4.0 | 04.07.2023 | Rettifica del regolamento (UE) 2023/1230 | Certifico Srl |
| 3.0 | 03.07.2023 | Regolamento (UE) 2023/1230 | Certifico Srl |
| 2.0 | 23.04.2023 | Testo approvato - Macchine - P9_TA(2023)0097 | Certifico Srl |
| 1.0 | 08.11.2021 | Emendamenti del 20 Ottobre 2021 | Certifico Srl |
| 0.0 | 12.05.2021 | --- | Certifico Srl |
Collegati
[box-note]Regolamento macchine | Regolamento (UE) 2023/1230
Regolamento (UE) 2023/1230
Tavola di concordanza estesa Direttiva/Regolamento Macchine
Direttiva macchine 2006/42/CE
Proposal for a Regulation on machinery products
Nuovo Regolamento macchine 2021: emendamenti del 20 Ottobre 2021
Direttiva macchine 2021: la proposta di revisione
Revisione della Direttiva macchine: primo trimestre 2021
Position Paper FEM 2020 | Revisione direttiva macchine
Revisione della Direttiva Macchine: Parere CESE 2020[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Tavola di concordanza RESS Direttiva-Regolamento Macchine Rev. 4.0 2023.pdf Certifico Srl - Rev. 4.0 2023 |
620 kB | 295 | ||
| Tavola di concordanza RESS Direttiva-Regolamento Macchine Rev. 3.0 2023.pdf Certifico Srl - Rev. 3.0 2023 |
616 kB | 89 | ||
| Tavola di concordanza RESS Direttiva-Regolamento Macchine Rev. 2.0 2023.pdf Certifico Srl - Rev. 2.0 2023 |
607 kB | 152 | ||
| Tavola di concordanza RESS Direttiva-Regolamento Macchine Rev. 1.0 2021.pdf Certifico Srl - Rev. 1.0 2021 |
1019 kB | 102 | ||
| Tavola di concordanza RESS Direttiva-Regolamento Macchine Rev. 00 2021.pdf Certifico Srl - Rev. 0.0 2021 |
817 kB | 192 |
Regolamento certificazione T-PED - INAIL 2021
Regolamento certificazione T-PED - INAIL 2021
Certificazione in accordo alla direttiva 2010/35/UE T-PED
Destinatari
Fabbricante, proprietario o utilizzatore dell’attrezzatura
Caratteristiche
La direttiva T-PED (2010/35/UE) si applica alle attrezzature a pressione trasportabili (Apt), disciplinando:
- la valutazione della conformità (immissione sul mercato e messa in servizio)
- la rivalutazione della conformità dei recipienti costruiti in accordo alle normative nazionali previgenti
- l’ispezione periodica.
L’Inail realizza il servizio in qualità di organismo notificato. I tempi di esecuzione e il tipo di verifica variano in funzione dell’equipaggiamento del richiedente e del tipo di attrezzatura da verificare. La valutazione della conformità e l’ispezione periodica delle A.p.t. può essere anche direttamente effettuata dal Fabbricante/Richiedente che opera in accordo ad un sistema di gestione in qualità approvato da INAIL 0100.
Finalità
Accertare la conformità alla Direttiva 2010/35/UE delle attrezzature a pressione trasportabili in sede di valutazione della conformità, rivalutazione della conformità e ispezione periodica.
Modalità di richiesta
Il fabbricante, il proprietario o l’utilizzatore dell’attrezzatura inviano attraverso la compilazione delle richieste di prestazione TPED, specificando il luogo e il tipo di intervento richiesto, all’Unità operativa territoriale di certificazione, verifica e ricerca competente e ad ON0100.
Modalità di erogazione del servizio
L’Unità operativa territoriale di certificazione esegue le verifiche e prove previste dalla Direttiva e comunica a ON0100 l’esito delle stesse predisponendo le certificazioni del caso che vengono riesaminate dal Responsabile Tecnico. La comunicazione al fabbricante/richiedente sull’esito della certificazione avviene comunque contestualmente in sede di verifica sul luogo dell’intervento e, in seguito, attraverso posta ordinaria.
Costi a carico dell’utente
Il rilascio della certificazione prevede un costo a carico dell’utente secondo quanto previsto dal Tariffario pubblicato in Gazzetta Ufficiale n. 165 del 18 luglio 2005. Il pagamento deve essere effettuato a seguito del ricevimento della fattura.
_______
[panel]5.1 Doveri dell'organizzazione certificata
Il fabbricante non deve aver presentato analoga domanda di certificazione/ispezione ad altro Organismo Notificato per il medesimo prodotto ne la stessa domanda può essere già stata rifiutata da un altro Organismo Notificato.
Al richiedente INAIL O.N. 0100 richiede:
- di mantenere una registrazione dei procedimenti delle istruttorie per azioni di controllo del mercato, relativi alla non conformità dei prodotti certificati, da segnalare con tempestività a INAIL O.N. 0100;
- di registrare le azioni correttive adottate, nonché relativi eventuali provvedimenti degli organi di vigilanza;
- il rispetto dei doveri cogenti, descritti dalle disposizioni vigenti che traspongono le direttive 2010/35/UE e 2020/1833/UE;
- il rispetto dei doveri contrattuali sottoscritti, nell'accettazione dell'offerta e del presente regolamento;
- di mettere a disposizione di INAIL O.N. 0100, se pertinente, un campione del tipo ed essere consapevole che INAIL O.N. 0100 possa chiedere altri campioni, se il programma delle prove lo richiede;
- di consentire a INAIL O.N. 0100 di accedere, a fini ispettivi in funzione delle procedure di certificazione richiesta, ai locali di progettazione, fabbricazione, ispezione, prova e deposito e di fornirgli tutte le informazioni necessarie e la relativa documentazione.
L'Organizzazione richiedente la Certificazione e quella certificata devono, inoltre:
1. consentire, previo accordo con INAIL O.N. 0100, durante il periodo di validità della certificazione relativa alla sorveglianza del servizio interno di ispezione del richiedente, lo svolgimento delle verifiche ispettive di sorveglianza sulla produzione e sul sistema di gestione;
2. fornire e mantenere aggiornata tutta la documentazione richiesta da INAIL O.N. 0100;
3. non commercializzare prodotti prima della conclusione con esito positivo dell'iter di certificazione;
4. comunicare a INAIL O.N. 0100 eventuali reclami ricevuti da clienti relativamente al prodotto certificato;
5. informare preventivamente INAIL O.N. 0100 in merito a trasferimenti di proprietà, variazioni di recapiti, apertura nuove sedi e/o filiali, cambi di denominazione sociale, modifiche significative dei propri cicli lavorativi.
6. Fornire, prima del rinnovo della certificazione relativa al sistema di gestione in qualità, i dati aggiornati sull'introduzione di nuovi processi/prodotti e sulle modifiche alla struttura organizzativa;
7. non emettere senza preventiva autorizzazione di INAIL O.N. 0100 versioni modificate della
documentazione tecnica di prodotto e/o della documentazione del sistema di gestione in qualità che contengano variazioni ai requisiti previsti dalla Direttiva e/o dalle norme applicate;
8. comunicare l'eventuale coinvolgimento del Legale Rappresentante in procedimenti giudiziari connessi con l'attività dell'Organizzazione;
9. evitare di fare e vietare ad altri di mettere in atto azioni che possano trarre in inganno riguardo la certificazione ottenuta;
10. evitare di utilizzare e vietare l'utilizzo del certificato o di una sua parte in modo ingannevole;
11. interrompere l'utilizzo di materiale pubblicitario che fa riferimento alla certificazione nel caso di sospensione o di revoca della stessa;
12. non lasciare intendere che la certificazione si applichi ad attività/prodotti che sono fuori dal campo di applicazione della stessa;
13. non utilizzare la propria certificazione in modo tale da poter danneggiare la reputazione dell'organismo di certificazione e compromettere la fiducia del pubblico;
14. garantire l'accesso degli ispettori, ivi compresi quelli ACCREDIA (salvo quanto riportato al successivo punto “diritti dell’organizzazione certificata”, a tutte le aree aziendali ed a tutte le registrazioni pertinenti al fine di assicurare il corretto svolgimento della valutazione di conformità;
15. garantire (salvo quanto riportato al successivo punto “diritti dell’organizzazione certificata”) l'accesso ai valutatori ACCREDIA previa comunicazione da parte di INAIL O.N. 0100 dei loro nominativi,
16. garantire (salvo quanto riportato al successivo punto “diritti dell’organizzazione certifica
17. accettare che in caso di diniego della certificazione l'informazione sia fornita in copia all'Ente di Accreditamento;
18. rendersi disponibile all'esecuzione di verifiche ispettive con un preavviso di 5 giorni, a seguito di ricezione di reclami e/o segnalazioni, o di sospensione della certificazione, senza possibilità di ricusare il personale tecnico incaricato di eseguire tale ispezione.[/panel]
Fonte: INAIL
Collegati
[box-note]Direttiva 2010/35/UE
Attrezzature T-PED
Direttiva TPED Consolidato
Pacchi di bombole ADR | TPED
Cisterne ADR | TPED[/box-note]
RAPEX Report 16 del 23/04/2021 N. 20 A12/00543/21 Repubblica Ceca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 16 del 23/04/2021 N. 20 A12/00543/21 Repubblica Ceca
Approfondimento tecnico: Seggiolone per bambini
Il prodotto, di marca 4 BABY® Fashion Red, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2001/95/CE del Parlamento Europeo e del Consiglio del 3 dicembre 2001 relativa alla sicurezza generale dei prodotti ed alla norma tecnica EN 14988:2017 “Seggioloni per bambini - Requisiti e metodi di prova”.
Il seggiolone non è sufficientemente stabile e può facilmente ribaltarsi all'indietro.
La norma tecnica EN 14988:2017 “Seggioloni per bambini - Requisiti e metodi di prova” al punto 8.12.2.4 descrive come eseguire la prova per verificare che i seggioloni siano sufficientemente stabili da non ribaltarsi all’indietro.
La prova consiste nel posizionare il seggiolone come nella figura seguente ed nell’applicare gradualmente una forza verticale verso il basso di 150 N a una distanza di 140 mm misurata orizzontalmente verso l'esterno dal punto anteriore in cui la trave di prova scarica è appoggiata allo schienale.
La forza deve essere applicata per (60 ± 3)s, a meno che il seggiolone non si ribalti prima.
Fig. 1 - Test stabilità ribaltamento all’indietro
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 16 del 23_04_2021 N. 20 A12_00543_21 Repubblica Ceca.pdf Seggiolone per bambini |
406 kB | 0 |
RAPEX Report 15 del 16/04/2021 N. 02 A11/00025/21 Malta

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 15 del 16/04/2021 N. 02 A11/00025/21 Malta
Approfondimento tecnico: Friggitrice
Il prodotto, di marca GIRMI, mod. FG20, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica EN 60335-2-13:2010 “Sicurezza degli apparecchi elettrici d'uso domestico e similare Parte 2: Norme particolari per padelle per friggere, friggitrici e apparecchi similari”.
l termostato non spegne correttamente la friggitrice. Il prodotto si può surriscaldare e causare un incendio.
Direttiva 2014/35/UE - Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 15 del 16_04_2021 N. 02 A11_00025_21 Malta.pdf Friggitrice |
367 kB | 0 |
Proposal for a Regulation on a European approach for Artificial Intelligence
Proposal for a Regulation on a European approach for Artificial Intelligence
ID 13380 | 12.07.204 / Documenti in allegato
Update 12.07.2024 / Testo Pubblicato GU 12.07.2024
Regolamento (UE) 2024/1689 del Parlamento europeo e del Consiglio, del 13 giugno 2024, che stabilisce regole armonizzate sull'intelligenza artificiale e modifica i regolamenti (CE) n. 300/2008, (UE) n. 167/2013, (UE) n. 168/2013, (UE) 2018/858, (UE) 2018/1139 e (UE) 2019/2144 e le direttive 2014/90/UE, (UE) 2016/797 e (UE) 2020/1828 (regolamento sull'intelligenza artificiale) (GU L 2024/1689 del 12.7.2024)
EP, 14.06.2023 Amendments adopted by the European Parliament
Emendamenti del Parlamento europeo, approvati il 14 giugno 2023, alla proposta di regolamento del Parlamento europeo e del Consiglio che stabilisce regole armonizzate sull'intelligenza artificiale (legge sull'intelligenza artificiale) e modifica alcuni atti legislativi dell'Unione (COM(2021)0206 – C9-0146/2021 – 2021/0106(COD))
_________
EC, 21.04.2021 Regolamento AI 2021: la proposta
In allegato:
- COM(2021) 206 final - Proposta di regolamento su un approccio europeo all'intelligenza artificiale
- COM(2021) 206 final - Allegati
...
Fonte: CE
Vedi Roadmap:
Collegati
[box-note]Regolamento intelligenza artificiale (AI Act): Roadmap
Proposal for a Regulation on machinery products
Artificial Intelligence for Europe[/box-note]