Revisione della Direttiva macchine: primo trimestre 2021
Revisione della Direttiva macchine: Roadmap EC / Adozione primo trimestre 2021
ID 11648 | Update 30 Settembre 2020
La Roadmap per la revisione della Direttiva macchine 2016/42/CE è stata lanciata dalla Commissione Europea a Gennaio 2019 (primo step), e dovrebbe concludersi con l'adozione da parte della Commissione entro il primo trimestre 2021.
1
Primo step "Roadmap"
- Questo passaggio ha definito l'inizio della Roadmap dal 14/01/2019 al 11/02/2019.
2
Secondo step "consultazione delle pubblicazioni"
Questa fase è stata aperta dal 07.06.2019 al 30.08.2019
3
Terzo step "adozione"
Il terzo passo sarà l'adozione da parte della Commissione prevista per il primo trimestre del 2021
_______
Gli obiettivi di questa revisione della direttiva macchine
La direttiva macchine deve essere aggiornata per migliorare ulteriormente i livelli di sicurezza e tenere conto delle ultime innovazioni IT. La revisione proposta:
- allinea la direttiva con la legislazione armonizzata dell'UE sulla salute e la sicurezza dei prodotti e
- affronta le sfide che possono derivare dal progresso tecnico nella digitalizzazione
A. Contesto, definizione del problema e controllo della sussidiarietà
L'UE ha un vantaggio competitivo in settori leader a livello mondiale come la produzione e la robotica, producendo più di un quarto dei robot di servizio industriale e professionale del mondo. Con l'emergere di nuove tecnologie digitali come l'Intelligenza Artificiale (AI) e l'Internet of Things (IoT), l'UE deve rimanere competitiva in un mercato globale in trasformazione. Le tecnologie digitali emergenti stanno prendendo sempre più piede non solo nelle applicazioni di consumo ma anche a livello commerciale / industriale, dove possono portare nuovi livelli di efficienza e produttività.
La comunicazione della Commissione sull'intelligenza artificiale per l'Europa (adottata il 25 aprile 2018) mostra come l'UE stia preparando un ambiente in cui le imprese e la società possono fare il miglior uso dell'IA. Si riferisce alla Direttiva macchine 2016/42/CE quale atto legislativo chiave sui robot.
Questa iniziativa dovrebbe essere vista nel contesto del quarto settore politico prioritario nell'ambito dell '"agenda per l'occupazione, la crescita, l'equità e il cambiamento democratico" del presidente Juncker, vale a dire un mercato interno più profondo ed equo con una base industriale rafforzata.
La Direttiva Macchine ha due obiettivi generali:
- garantire un elevato livello di sicurezza e protezione per gli utenti dei macchinari e le altre persone ad esso esposte; e
- garantire la libera circolazione delle macchine nel mercato interno.
I prodotti che copre vanno dai tosaerba alle stampanti 3D, dagli utensili manuali elettrici ai macchinari da costruzione, dai robot alle linee di produzione industriale automatizzate complete. Un ulteriore obiettivo, la tutela dell'ambiente, è limitato ai macchinari utilizzati nelle applicazioni dei pesticidi.
Questa iniziativa affronta le questioni individuate in una valutazione della direttiva, che è stata effettuata nell'ambito del programma di adeguatezza e rendimento della regolamentazione della Commissione (REFIT). La valutazione ha concluso (cfr.SWD (2018) 160) che la direttiva è generalmente pertinente, efficace, efficiente e coerente e ha un valore aggiunto per l'UE, ma che erano necessari miglioramenti e semplificazioni specifici.
Sebbene la valutazione indichi che la direttiva consente sviluppi tecnologici nell'era digitale, dato che è sostenuta dai principi del "nuovo approccio'' che stabilisce requisiti di base obbligatori, lasciando i dettagli tecnici per soddisfare tali requisiti alle norme tecniche, sono necessarie ulteriori analisi per quanto riguarda la sua efficacia e idoneità allo scopo in futuro, rispetto agli sviluppi nella digitalizzazione, come IoT, AI e la nuova generazione di robot autonomi.
...
[box-note]REVISIONE DELLA DIRETTIVA MACCHINE: PARARE CESE 2020
Riferimento: CCMI/172-EESC-2020
Il CESE accoglie con favore gli attuali sforzi della Commissione per analizzare e possibilmente migliorare le prestazioni della direttiva macchine 2006/42/CE come parte del suo programma di adeguatezza e rendimento regolamentare (REFIT).
Il CESE ritiene che la direttiva macchine sia uno strumento molto importante e di successo per l'industria europea e il suo approccio di base deve essere lasciato invariato. Sebbene il CESE concordi sulla necessità di apportare alcune modifiche, modifiche di massa alla direttiva macchine, in particolare ai requisiti essenziali di salute e sicurezza (EHSR) di cui all'allegato I, avrebbero un profondo impatto negativo sul lavoro di sviluppo delle norme armonizzate necessarie e devono essere evitate.
CESE: Comitato Economico e Sociale Europeo
Vedi[/box-note]
add more in attachment
Collegati
[box-note]Evaluation of the Machinery Directive 2006/42/EC | EC 2018
Direttiva macchine 2016/42/CE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Revisione della Direttiva macchine - Roadmap EC Rev. 00.2020.pdf Certifico Srl - Rev. 0.0 2020 |
111 kB | 193 | ||
| Inception impact assessment - Ares(2019)132242.pdf EC 2020 |
449 kB | 58 |
RAPEX Report 38 del 18/09/2020 N. 23 INFO/00130/20 Regno Unito

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 38 del 18/09/2020 N. 23 INFO/00130/20 Regno Unito
Approfondimento tecnico: Macchina per incisione
Il prodotto, di marca CNC, mod. CNC3-3018PRO, è stato sottoposto alla procedura di distruzione perché non conforme alla Direttiva 2006/42/CE del Consiglio, del 17 maggio 2006, relativa alle macchine e che modifica la direttiva 95/16/CE ed alla Direttiva 2006/95/CE el Parlamento Europeo e del Consiglio del 12 dicembre 2006 concernente il ravvicinamento delle legislazioni degli Stati membri relative al materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione. La Direttiva 2006/95/CE è stata abrogata a decorrere dal 20 aprile 2016, data di entrata in vigore della Direttiva 2014/35/UE.
Il diametro dei conduttori di tensione è inadeguato. I contatti sulla spina sono troppo grandi e il contatto di terra è parzialmente rivestito, ciò può portare a surriscaldamento e rischio di ustioni e scosse elettriche da contatto.
Direttiva 2006/42/CE
Allegato I
Requisiti essenziali di sicurezza e di tutela della salute
1.5. Rischi dovuti ad altri pericoli
1.5.1. Energia elettrica
Se la macchina è alimentata con energia elettrica, essa deve essere progettata, costruita ed equipaggiata in modo da prevenire o da consentire di prevenire tutti i pericoli dovuti all'energia elettrica.
Gli obiettivi di sicurezza fissati dalla direttiva 73/23/CEE si applicano alle macchine. Tuttavia gli obblighi concernenti la valutazione della conformità e l'immissione sul mercato e/o la messa in servizio di macchine in relazione ai pericoli dovuti all'energia elettrica sono disciplinati esclusivamente dalla presente direttiva.
Direttiva 2006/95/CE
Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato ad essere adoperato entro taluni limiti di tensione
[…]2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità al punto 1 sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di ferite o altri danni che posson derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e gli oggetti siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l'esperienza, possono derivare dal materiale elettrico;
d) l'isolamento sia proporzionato alle sollecitazioni previste.[…]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 38 18_0920_20 N. 23 INFO_00130_20 Regno Unito.pdf Macchina per incisione |
444 kB | 0 |
Decreto 5 agosto 2020
Decreto 5 agosto 2020
Attuazione delle direttive delegate della Commissione europea (UE) 2020/360, (UE) 2020/361, (UE) 2020/364, (UE) 2020/365 e (UE) 2020/366, di modifica del decreto legislativo 4 marzo 2014, n. 27, sulla restrizione di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
(GU Serie Generale n.228 del 14-09-2020)
...
Collegati:
[box-note]Direttiva delegata (UE) 2020/360
Direttiva delegata (UE) 2020/361
Direttiva delegata (UE) 2020/364
Direttiva delegata (UE) 2020/365
Direttiva delegata (UE) 2020/366
Direttiva RoHS III | Testo consolidato
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
RAPEX Report 36 del 04/09/2020 N. 15 A12/01199/20 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 36 del 04/09/2020 N. 15 A12/01199/20 Svezia
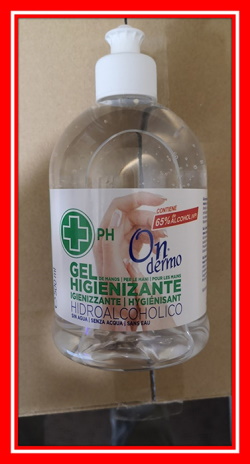
Approfondimento tecnico: Crema per la pelle
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di divieto di commercializzazione perché non conforme Regolamento (CE) 1223/2009.
Il prodotto contiene mercurio (valore misurato: 21,3 mg/kg).
Il mercurio si accumula nel corpo e può danneggiare i reni, il cervello e il sistema nervoso. Inoltre, può influire sulla riproduzione e sul nascituro.
Regolamento (CE) 1223/2009
Articolo 14
Restrizioni applicabili alle sostanze elencate negli allegati
1. Fatto salvo l'articolo 3, i prodotti cosmetici non possono contenere:
a) sostanze vietate:
- sostanze vietate di cui all'allegato II;
b) sostanze soggette a restrizioni:
- sostanze soggette a restrizioni non impiegate conformemente alle restrizioni indicate nell'allegato III; […]
Regolamento (CE) 1223/2009
Allegato I
Elenco delle sostanze vietate nei prodotti cosmetici
n. 221 Mercurio e suoi composti, ad eccezione di quelli inclusi nell'allegato V
Numero CAS 7439-97-6
Numero CE 231-106-7
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 36 del 04_09_2020 N. 15 A12_01199_20 Svezia.pdf Crema per la pelle |
399 kB | 1 |
Radiazioni gamma materiali da costruzione | D.lgs 101/2020 e Reg. CPR
Radiazioni gamma emesse materiali da costruzione | D.lgs 101/2020 e Reg. CPR / Agg. Dlgs 203/2022
ID 11522 | 08.01.2023 - Documento completo allegato
Questa disposizione costituisce una novità normativa propria del D.lgs 101/2020, che si applica ad alcune tipologie di materiali da costruzione presenti sul mercato quindi non ai materiali già in opera e va ad integrare il Regolamento UE 305/2011 sui prodotti da costruzione relativamente a quanto previsto per la stesura della dichiarazione di prestazione. Difatti, i risultati delle misurazioni e il corrispondente indice di concentrazione di attività, costituiranno parte integrante della dichiarazione di prestazione.
Il livello di riferimento applicabile all’esposizione esterna alle radiazioni gamma emesse da materiali da costruzione in ambienti chiusi, in aggiunta all’esposizione esterna all’aperto, è fissato in 1 mSv/anno.
[box-note]Update Rev. 1.0 dell’08 gennaio 2023
- Decreto Legislativo 25 novembre 2022 n. 203
Disposizioni integrative e correttive al decreto legislativo 31 luglio 2020, n. 101, di attuazione della direttiva 2013/59/Euratom, che stabilisce norme fondamentali di sicurezza relative alla protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti, e che abroga le direttive 89/618/Euratom, 90/641/Euratom, 96/29/Euratom, 97/43/Euratom e 2003/122/Euratom e riordino della normativa di settore in attuazione dell'articolo 20, comma 1, lettera a), della legge 4 ottobre 2019, n. 117. (GU n. 2 del 03.01.2023)[/box-note]
[panel]Decreto Legislativo 31 Luglio 2020 n. 101
In rosso le modifiche di cui al Decreto Legislativo 25 novembre 2022 n. 203
Art. 29 Radiazioni gamma
1. Il livello di riferimento applicabile all’esposizione esterna alle radiazioni gamma emesse da materiali da costruzione in ambienti chiusi, in aggiunta all’esposizione esterna all’aperto, è fissato in 1 mSv/anno.
2. L’elenco dei materiali da costruzione individuati come oggetto di attenzione dal punto di vista della radioprotezione è riportato nell’allegato II.
3. Il soggetto responsabile dell’immissione sul mercato dei materiali di cui al comma 2, prima dell’immissione stessa, garantisce che:
a) sono determinate le concentrazioni di attività dei radionuclidi specificati nell’allegato II, seguendo le norme di buona tecnica o linee guida nazionali e internazionali, e che sia calcolato l’indice di concentrazione di attività come stabilito nell’allegato II;
b) su richiesta sono fornite ai Ministeri dello sviluppo economico, dell’ambiente e della tutela del territorio e del mare e della salute, le informazioni e i risultati delle misurazioni di concentrazione di attività e il corrispondente indice di concentrazione di attività, nonché gli altri fattori pertinenti come definiti nell’allegato II;
c) i risultati delle misurazioni e il corrispondente indice di concentrazione di attività costituiscono parte integrante della dichiarazione di prestazione di cui all’articolo 4, del regolamento (UE) n. 305/2011 del Parlamento europeo e del Consiglio, del 9 marzo 2011 che fissa condizioni armonizzate per la commercializzazione dei prodotti da costruzione e che abroga la direttiva 89/106/ CEE del Consiglio.
4. Restano fermi gli obblighi previsti dal regolamento (UE) n. 305/2011 per il fabbricante, il mandatario, il distributore e l’importatore.
5. Nel caso in cui l’indice di concentrazione di attività sia superiore al valore riportato nell’allegato II, ai fini dell’utilizzo del materiale per edifici di ingegneria civile, come abitazioni ed edifici a elevato fattore di occupazione, il fabbricante effettua valutazioni di dose secondo le indicazioni di cui all’allegato II. Il risultato e le ipotesi di calcolo delle valutazioni di dose sono resi noti dal responsabile dell’immissione sul mercato nel rispetto delle disposizioni del regolamento (UE) n. 305/2011.
6. Qualora sia superato il livello di riferimento in termini di dose di cui al comma 1, il materiale non può essere utilizzato per edifici di ingegneria civile, come abitazioni ed edifici a elevato fattore di occupazione.
7. Per le stime di dose di cui al comma 5, il fabbricante si avvale dell’esperto di radioprotezione con abilitazione di secondo o terzo grado. [/panel]
I materiali da costruzione che rientrano nel campo di applicazione della legge sono elencati nell’allegato II sezione II-ter (Ndr - nuova Sezione II ter dell’allegato II di cui al Decreto Legislativo 25 novembre 2022 n. 203 che ha sostituito la sezione II dell’allegato da paragrafo 1 a 6) di seguito riportati:
2. Elenco dei materiali da costruzione di cui dell’articolo 29, comma 2
I. Materiali naturali:
a) Alum-shale;
b) Materiali da costruzione o additivi di origine naturale ignea tra cui:
- granitoidi (quali graniti, sienite e ortogneiss);
- porfidi;
- tufo;
- pozzolana;
- lava;
- derivati delle sabbie zirconifere.
II. Materiali che incorporano residui dalle industrie che lavorano materiali radioattivi naturali tra cui:
- ceneri volanti;
- fosfogesso;
- scorie di fosforo;
- scorie di stagno;
- scorie di rame;
- fanghi rossi (residui della produzione dell’alluminio);
- residui della produzione di acciaio.
[panel]Decreto Legislativo 31 luglio 2020 n. 101 come modificato dal Decreto Legislativo 25 novembre 2022 n. 203
Allegato II
SEZIONE II-TER: RADIAZIONI GAMMA EMESSE DA MATERIALI DA COSTRUZIONE
1. Livello di riferimento di cui all’articolo 29, comma 1
Il livello di riferimento applicabile all’esposizione esterna in ambienti chiusi alle radiazioni gamma emesse da materiali da costruzione, in aggiunta all’esposizione esterna all’aperto, è fissato in 1 mSv a -1 .
2. Elenco dei materiali da costruzione di cui dell’articolo 29, comma 2
I. Materiali naturali:
a) Alum-shale;
b) Materiali da costruzione o additivi di origine naturale ignea tra cui:
- granitoidi (quali graniti, sienite e ortogneiss);
- porfidi;
- tufo;
- pozzolana;
- lava;
- derivati delle sabbie zirconifere.
II. Materiali che incorporano residui dalle industrie che lavorano materiali radioattivi naturali tra cui:
- ceneri volanti;
- fosfogesso;
- scorie di fosforo;
- scorie di stagno;
- scorie di rame;
- fanghi rossi (residui della produzione dell’alluminio);
- residui della produzione di acciaio.
3. Radionuclidi per cui devono essere misurate le concentrazioni di attività di cui all’articolo 29, comma 3 lettera a)
I radionuclidi da sottoporre a misurazione sono: Ra226, Th-232 (o il suo prodotto di decadimento Ra-228) e K-40.
4. Indice di concentrazione di attività di cui all’articolo 29, comma 3 lettera a)
L’indice di concentrazione di attività I è dato dalla seguente formula:
I = C Ra-226 /(300) + C Th-232 /(200)+ C K-40 /(3000)
dove C Ra226, C Th232 e C K40 sono le concentrazioni di attività in Bq kg- 1 dei corrispondenti radionuclidi nel materiale da costruzione.
L’indice si riferisce alla dose da radiazioni gamma presente in un edificio costruito con un determinato materiale da costruzione, in eccesso rispetto all’esposizione esterna tipica. L’indice si applica al materiale da costruzione e non ai suoi componenti, tranne nei casi in cui tali componenti sono anch’essi materiali da costruzione e in quanto tali sono valutati separatamente. Per l’applicazione dell’indice a tali componenti, in particolare ai residui delle industrie che lavorano materiali contenenti radionuclidi presenti in natura riciclati nei materiali da costruzione, deve essere utilizzato un fattore di suddivisione appropriato.
5. Valore dell’indice di concentrazione di attività di cui all’articolo 29
Il valore dell’indice di concentrazione di attività pari a 1 può essere utilizzato come uno strumento di screening per individuare materiali che possono portare al superamento del livello di riferimento di cui all’articolo 29, comma 1.
6. Indicazioni sulla valutazione della dose di cui all’articolo 29, comma 5.
Ai fini della valutazione della dose, si applicano metodi di stima della dose previsti da standard nazionali e internazionali che tengano conto di altri fattori, tra cui la densità, lo spessore del materiale, nonché fattori relativi al tipo di edificio e all’uso previsto del materiale (strutturale o superficiali);[/panel]
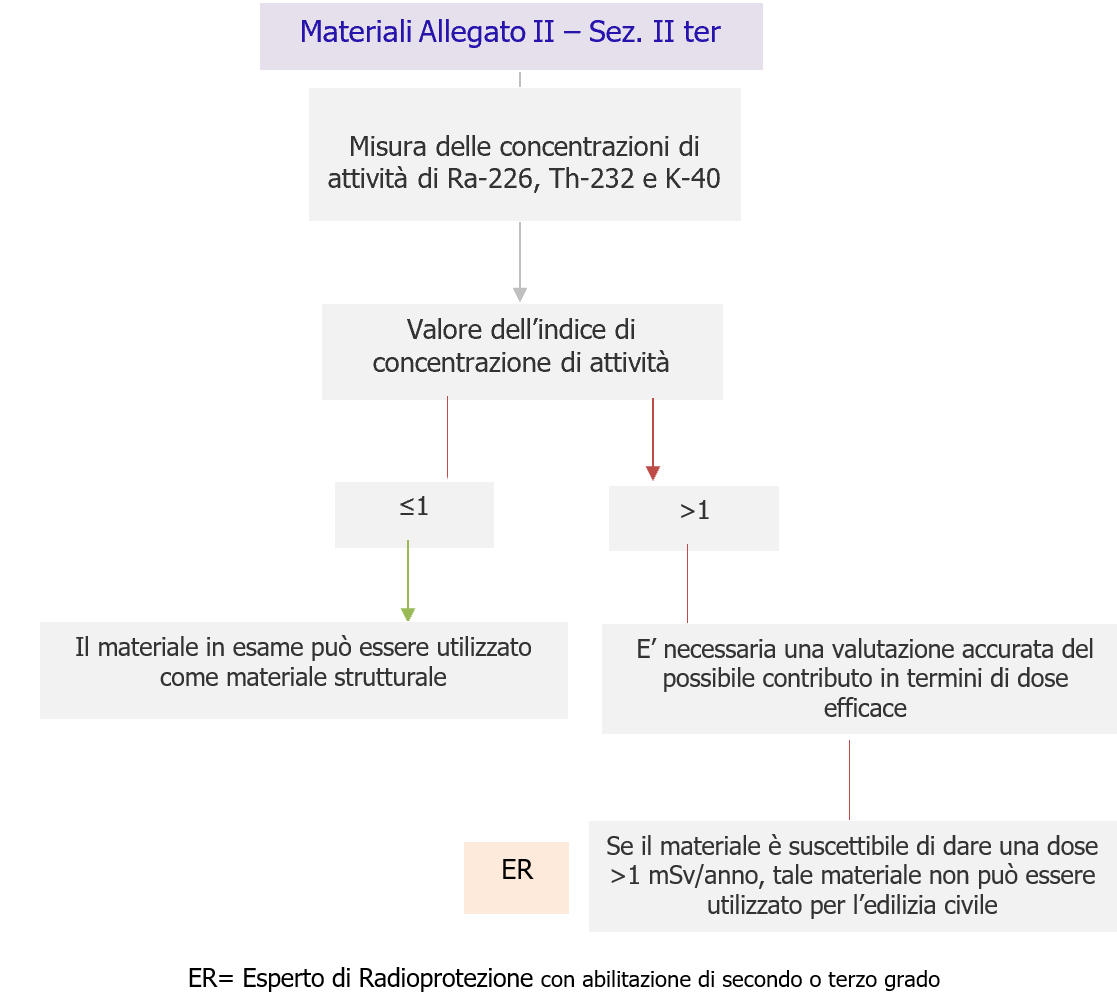
Per questi materiali che rientrano nell’elenco di cui all’allegato II, è necessario effettuare una misura delle concentrazioni di attività di Ra-226, Th-232 e K-40.
Se il valore dell’indice di concentrazione di attività è pari o minore di 1, il materiale in esame può essere utilizzato come materiale strutturale (quindi in grandi quantità) senza che il livello di riferimento sia superato.
Se il valore dell’indice risulta superiore a 1, è necessaria una valutazione accurata del possibile contributo in termini di dose efficace, tenuto conto delle caratteristiche del materiale in termini di spessore e densità.
Nei casi in cui il materiale è suscettibile di dare una dose>1 mSv/anno, tale materiale non può essere utilizzato per l’edilizia civile (materiale strutturale di abitazioni e di edifici a elevato fattore di occupazione) ma per scopi diversi, che vanno previsti che nei codici e nei regolamenti edilizi.
Fig. 1 - Materiali Allegato II
...Segue in allegato
Certifico Srl - IT | Rev. 1.0 2023
©Copia autorizzata Abbonati
Matrice revisioni
| Rev. | Data | Oggetto | Autore |
| 1.0 | 08.01.2023 | D.Lgs. 25 novembre 2022 n. 203 | Certifico Srl |
| 0.0 | 09.09.2020 | --- | Certifico Srl |
Collegati:
[box-note]Regolamento Prodotti da Costruzione (CPR) Armonizzato IT 2019
Sezione D.Lgs. 101/2020 Radiazioni ionizzanti
Decreto Legislativo 31 luglio 2020 n. 101
Radiazioni ionizzanti: quadro normativo
Esperto di radioprotezione[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Radiazioni gamma materiali da costruzione D.lgs 101 2020 e Reg. CPR Rev. 1.0 2023.pdf Certifico Srl - Rev. 1.0 2023 |
537 kB | 45 | ||
| Radiazioni gamma materiali da costruzione D.lgs 101 2020 e Reg. CPR.pdf Certifico Srl - Rev. 0.0 2020 |
599 kB | 80 |
Impact assessment study on the revision of Directive 2006/42/EC
Impact assessment study on the revision of Directive 2006/42/EC on machinery
EC, June 2020
The scope of the study is to assess the impacts of the different policy options identified in view of choosing the most cost-effective policy option that ensures a high level of health and safety. The geographic scope of this study was the 2019 composition of the European Union (i.e. including the UK) and the EEA as a whole.3 It also examined relevant existing laws and initiatives at international level, especially in significant market such as the US, Japan, South Korea and China, as well as how international standards contribute to the competitiveness of the European machinery sector.
The issues to be addressed, identified by the REFIT evaluation, were:
[alert]- The need for specific improvements and simplification in the Directive’s provisions in order to ensure its effectiveness going forward;
- The need to carry out further analysis concerning the Directive’s fitness for the Internet of Things, Artificial Intelligence, new generation of autonomous robots and cybersecurity; and
- The need for a clear and stable legal framework that positively contributes to the development of the (digital) single market for the economic operators, in order to manage their economic activities more effectively and improve their competitiveness on global markets.[/alert]
These three main issues were further developed and targeted to the concrete aspects that were identified as needs to a revision. These aspects fed into the development of the policy options to assess, described in more detail in this report. They included:
- Addressing new challenges and risks posed by technological developments in digitisation;
- Addressing in detail the problems identified during the evaluation of the Machinery
Directive, with a concrete focus on the following aspects:
- A missing alignment of the Machinery Directive to the New Legislative Framework (NLF);
- Adapting the scope and definitions, in particular with regards to the list of lowvoltage products excluded and the definition of Partly Completed Machinery, as well as the threshold speed of slow-speed lifts and the relationship with the Pressure Equipment Directive;
- Adapting the requirements for fully enclosed carrier or hold-to-run control with regards to slow-speed lifts; and
- Allowing digital formats for documentation.
- Modifying Annex IV on high-risk machinery and their conformity assessment with internal checks; and
- Conversion of the Directive into a Regulation.
Throughout the assessment study, other aspects were raised by stakeholders that could be considered for a revision. These have also been summarised in the report. However, a more in-depth assessment of those aspects may be conducted in the future, if needed.
As specified in the Terms of Reference, this report presents the main results of the fieldwork and analysis conducted. Following the format outlined in the Toolbox 12 under the Better Regulation Guidelines, the report is divided into the following chapters:
1. Chapter 2 – What is the problem and why is it a problem?
2. Chapter 3 – Why should the EU act?
3. Chapter 4 – What should be achieved?
4. Chapter 5 – What are the various options to achieve the objectives?
5. Chapter 6 – What are the impacts of the different policy options and who will be affected?
6. Chapter 7 – How do the options compare?
7. Chapter 8 – Preferred policy options
8. Chapter 9 – How would actual impacts be monitored and evaluated?
9. Annexes
In order to understand the aspects assessed in this report, the following section provides an overview of the machinery market, including trends in digitalisation, a description of two main aspects with regards to the scope, the list of low-voltage products and slow-speed lifts, as well as the role that harmonised standards play in the application of the Directive.
The Directive 2006/42/EC on Machinery is the core legislation regulating products of the mechanical engineering industries. It was adopted on 17 May 2006 and implemented in 2009. The Directive was the result of a comprehensive revision of previous legislation dating back to the first Directive 89/392/EEC, which was reviewed in 1991 and 1993, and the second Directive 98/37/EC.
The general objectives of the 2006 Machinery Directive (MD) are to:
1. Ensure free movement of machinery within the internal market; and
2. Ensure a high level of protection for users and other exposed persons.
With the amendment 2009/127/EC, a third objective was added:
3. Ensure the protection of environment in the context of using machinery for pesticide application.
The MD aims to ensure a high level of protection for workers, final users and other exposed persons by focusing on the safety of machinery itself. In practice, this translates into mandatory Essential Health and Safety Requirements (EHSR), including conformity assessment procedures based on product risk. The detailed technical requirements to comply with the EHSR are not enshrined in the MD but must be applied by the manufacturers via “harmonised standards” or other technical specifications under certain conditions as explained in section 1.2.5.
This kind of approach differs from other pieces of legislation aimed also at increasing health and safety. In fact, these often focus on detailed requirements for persons dealing with specific products at a specific time of the production/consumption process. For instance, this is the case of Directive 2009/104/EC, which lays down specific minimum health and safety requirements for the use of work equipment. In contrast with a regulatory approach, in other areas self-regulation can be found, characterised by the development of voluntary codes of practice or standards developed by the industry, with the industry solely responsible for enforcement.
The objective of this study is limited to the scope and approach of the MD, assessing and developing its ability to deal with new and specific risks, as identified in section 2, in the fulfilment of its goals.
The scope of the MD covers a wide range of products. Machinery is broadly defined as an assembly “of linked parts or components, at least one of which moves”, which is applicable to a great variety of products, from lawnmowers to 3D printers, from powered hand-tools to construction machinery, and from robots to complete automated industrial production lines.
The MD applies across the whole value chain, from the design and manufacturing until the placing on the market of the machinery for consumer and professional use. The machinery manufacturers must take the appropriate measures to eliminate any risk throughout the foreseeable lifetime of the machinery including the phases of transport, assembly, dismantling, disabling and scrapping.
Some products are explicitly excluded from the scope of the MD. This is the case, for instance, for some products that fall under the scope of the Low Voltage Directive (LVD), as listed in Art. 1.2(k) of the MD. In other cases, the MD may apply together with or even alternatively to other pieces of legislation. The issues are whether, and to what extent, the MD overlaps with other pieces of legislation, exceptions create legal uncertainty and whether there are differences in market surveillance and thus distorted competition.
This study was conducted to support the European Commission services in carrying out an impact assessment on a revision of the Directive 2006/42/EC on machinery. The revision of the MD results from the REFIT evaluation2 on the necessity to improve, simplify and adapt the Directive to the needs of the market.
The general objectives of the revision of the Directive are to:
[alert]1. Create a level playing field for economic operators and preserve the competitiveness of machinery sector in global digital markets; and
2. Establish a high level of trust in digital innovative technologies for consumers and users.[/alert]
The specific objectives of the revision are to:
[alert]- Ensure the clarity of the scope;
- Align the Directive to the New Legislative Framework (Decision 768/2008);
- Preserve the technology neutral principle allowing the use of innovative technologies as far as safety is ensured;
- Reduce administrative requirements related to documentation; and
- Cover new risks related to digital emerging technologies.[/alert]
add more in attachment
Fonte: EU
Collegati:
[box-note]Direttiva macchine 2006/42/CE
Report consultation Evaluation Machinery Directive 2006/42/EC
Guida direttiva macchine 2006/42/CE - Ed. 2019 EN
Evaluation of the Machinery Directive 2006/42/EC | EC 2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Impact assessment study on the revision of Directive 2006 42 EC.pdf EC, June 2020 |
11549 kB | 64 |
RAPEX Report 34 del 21/08/2020 N. 17 A12/01153/20 Danimarca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 34 del 21/08/2020 N. 17 A12/01153/20 Danimarca
Approfondimento tecnico: Sbiancante per i denti
Il prodotto, di marca DENTECH, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n. 1223/2009 del Parlamento europeo e del Consiglio del 30 novembre 2009, sui prodotti cosmetici.
Il prodotto contiene perossido di idrogeno come sostanza sbiancante (concentrazione misurata: 10,8% in peso).
Il perossido di idrogeno ad alte concentrazioni provoca irritazione cutanea ed è nocivo se ingerito.
Regolamento (CE) n. 1223/2009
Capo III
Valutazione della sicurezza, documentazione informativa sul prodotto, notifica
Articolo 10 Valutazione della sicurezza
1. Al fine di dimostrare la conformità di un prodotto cosmetico all’articolo 3, la persona responsabile garantisce che i prodotti cosmetici, prima dell’immissione sul mercato, siano stati sottoposti alla valutazione della sicurezza sulla base delle informazioni pertinenti e che sia stata elaborata una relazione sulla sicurezza dei prodotti cosmetici a norma dell’allegato I.
La persona responsabile garantisce che:
a) l’uso verosimile cui è destinato il prodotto cosmetico e l’esposizione sistemica anticipata ai singoli ingredienti in una formulazione finale siano presi in considerazione nella valutazione della sicurezza;
b) nella valutazione della sicurezza sia utilizzato un approccio adeguato basato sulla forza probante per rivedere i dati provenienti da tutte le fonti esistenti;
c) la relazione sulla sicurezza dei prodotti cosmetici sia aggiornata tenendo conto delle informazioni supplementari pertinenti disponibili successivamente all’immissione sul mercato del prodotto.
Il primo comma si applica altresì ai prodotti cosmetici che sono stati notificati a norma della direttiva 76/768/CEE.
La Commissione, in stretta cooperazione con tutte le parti interessate, adotta linee guida adeguate che consentano alle imprese, in particolare alle piccole e medie imprese, di ottemperare ai requisiti figuranti all’allegato I. Tali linee guida sono adottate secondo la procedura di regolamentazione di cui all’articolo 32, paragrafo 2.
2. La valutazione della sicurezza dei prodotti cosmetici di cui all’allegato I, parte B, è eseguita da persone in possesso di diplomi o altri documenti attestanti qualifiche formali ottenute in seguito al completamento di corsi universitari teorici e pratici in campo farmaceutico, tossicologico, medico o in discipline analoghe, o di corsi riconosciuti equivalenti da uno Stato membro.
3. Gli studi non clinici sulla sicurezza eseguiti nell’ambito della valutazione della sicurezza di cui al paragrafo 1, realizzati dopo il 30 giugno 1988 per valutare la sicurezza di un prodotto cosmetico, rispettano la legislazione comunitaria sui principi di buona prassi di laboratorio, nella versione applicabile al periodo di realizzazione dello studio, o altre norme internazionali riconosciute equivalenti dalla Commissione o dall’ECHA.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 34 del 21_08_2020 N. 17 A12_01153_20 Danimarca.pdf Sbiancante per i denti |
392 kB | 0 |
Norme armonizzate Click: testi consolidati norme pubblicate Gennaio 2020 / Agosto 2020
Norme armonizzate Click | Gennaio 2020 / Agosto 2020
ID 11428 | 27.08.2020
I testi consolidati dell'elenco delle norme armonizzate per Direttiva / Regolamento UE pubblicate Gennaio 2020 / Agosto 2020.
Download Norme armonizzate Click Gennaio 2020 / Agosto 2020
Come consultare i riferimenti delle norme armonizzate 2019/2020.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti pubblicati ai sensi delle Direttive nuovo approccio UE devono essere letti in relazione alle pubblicazioni precedenti.
Per facilitare la consultazione sono stati realizzati dei "testi consolidati" che saranno aggiornati nel tempo, dove sono riporti l'elenco dei titoli delle norme armonizzate pubblicate per Direttiva/Regolamento UE.
I testi consolidati Gennaio 2020 / Agosto 2020:

18 Maggio 2020
Direttiva EMC
Norme armonizzate Direttiva RoHS
Norme armonizzate Direttiva RED

20 Aprile 2020
Norme armonizzate Direttiva PED

02 Aprile 2020
Direttiva Macchine

26 Febbraio 2020
Direttiva ATEX
Direttiva Imbarcazioni da diporto
Collegati
[box-note]Norme armonizzate Click
Direttiva click
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Agosto 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Settembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Ottobre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Novembre 2019
Norme armonizzate Click: i testi consolidati delle norme pubblicate Marzo 2019 / Gennaio 2020
Norme armonizzate Click: i testi consolidati delle norme pubblicate Gennaio 2020 / Luglio 2020[/box-note]
RAPEX Report 32 del 07/08/2020 N. 07 A12/01123/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 32 del 07/08/2020 N. 07 A12/01123/20 Polonia
Approfondimento tecnico: Spaccalegna
Il prodotto, di marca Kraft & Dele, mod. KD1580, KD1582, è stato sottoposto alla procura di ritiro dal mercato perché non conforme alla Direttiva 2006/42/CE del Parlamento europeo e del Consiglio, del 17 maggio 2006, relativa alle macchine e che modifica la direttiva 95/16/CE ed alla norma tecnica EN 609-1 “Macchine agricole e forestali - Sicurezza degli spaccalegna - Parte 1: Spaccalegna a cuneo”.
Il dispositivo non è dotato di una copertura di protezione. La mano dell'utente potrebbe rimanere intrappolata tra gli elementi affilati e in movimento della macchina.
Direttiva 2006/42/CE
Allegato I
Requisiti essenziali di sicurezza e di tutela della salute relativi alla progettazione e alla costruzione delle macchine
[…] 1.4. Caratteristiche richieste per i ripari ed i dispositivi di protezione
1.4.1. Requisiti generali
I ripari e i dispositivi di protezione:
- devono essere di costruzione robusta,
- devono essere fissati solidamente,
- non devono provocare pericoli supplementari,
- non devono essere facilmente elusi o resi inefficaci,
- devono essere situati ad una distanza sufficiente dalla zona pericolosa,
- non devono limitare più del necessario l'osservazione del ciclo di lavoro, e
- devono permettere gli interventi indispensabili per l'installazione e/o la sostituzione degli utensili e per i lavori di manutenzione, limitando però l'accesso soltanto al settore in cui deve essere effettuato il lavoro e, se possibile, senza smontare il riparo o senza disattivare il dispositivo di protezione.
Inoltre, se possibile, i ripari devono proteggere dalla caduta e dalla proiezione di materiali od oggetti e dalle emissioni provocate dalla macchina. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 32 del 07_08_2020 N. 07 A12_01123_20 Polonia.pdf Spaccalegna |
137 kB | 0 |
Regolamento di esecuzione (UE) 2020/1170
Regolamento di esecuzione (UE) 2020/1170
Regolamento di esecuzione (UE) 2020/1170 della Commissione del 16 luglio 2020 relativo ai requisiti di progettazione, costruzione ed efficienza e alle norme di prova per l’equipaggiamento marittimo, che abroga il regolamento di esecuzione (UE) 2019/1397
GU L 264/1 del 12.08.2020
Entrata in vigore: 01.09.2020
[box-warning]Abrogazione dal 28.05.2021 in base a quanto disposto dall'art. 2 del Regolamento di esecuzione (UE) 2021/1158[/box-warning]
_______
Articolo 1
I requisiti di progettazione, costruzione ed efficienza e le norme di prova previste negli strumenti internazionali di cui alla direttiva 2014/90/UE si applicano a ciascun elemento dell’equipaggiamento marittimo, come stabilito nell’allegato.
Articolo 2
Il regolamento di esecuzione (UE) 2019/1397 è abrogato.
Articolo 3
1. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione (UE) 2018/773» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 19 giugno 2018 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave dell’UE fino al 19 giugno 2021.
2. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione (UE) 2019/1397» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 3 ottobre 2019 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave dell’UE fino al 3 ottobre 2022.
3. L’equipaggiamento marittimo elencato come «nuova voce inserita dal regolamento di esecuzione 2020/1170» nella colonna 1 dell’allegato, che rispetta i requisiti nazionali per l’omologazione in forza prima del 1o settembre 2020 in uno Stato membro, può continuare a essere immesso sul mercato e installato a bordo di una nave dell’UE fino al 1° settembre 2023.
...
Collegati:
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
Convenzione SOLAS[/box-note]
RAPEX Report 30 del 24/07/2020 N. 05 A12/1084/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 30 del 24/07/2020 N. 05 A12/1084/20 Polonia
Approfondimento tecnico: Levigatrice per pietra
Il prodotto, di marca AL-FA, mod. ALWG24, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2006/42/CE del Consiglio, del 17 maggio 2006, relativa alle macchine.
Il prodotto può funzionare con un fluido che lo attraversa ma manca del dispositivo di protezione della corrente residua. Di conseguenza, se il liquido entra in contatto con le parti in tensione, il prodotto non smetterebbe di funzionare e l'utente potrebbe ricevere una scossa elettrica.
Direttiva 2006/42/CE
Allegato I
1.5.1. Energia elettrica
Se la macchina è alimentata con energia elettrica, essa deve essere progettata, costruita ed equipaggiata in modo da prevenire o da consentire di prevenire tutti i pericoli dovuti all'energia elettrica.
Gli obiettivi di sicurezza fissati dalla direttiva 73/23/CEE (ad oggi Direttiva 2014/35/UE) si applicano alle macchine. Tuttavia gli obblighi concernenti la valutazione della conformità e l'immissione sul mercato e/o la messa in servizio di macchine in relazione ai pericoli dovuti all'energia elettrica sono disciplinati esclusivamente dalla presente direttiva.
Direttiva 2014/35/UE
Allegato I
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 30 del 24_07_2020 N. 05 A12_1084_20 Polonia.pdf Levigatrice per pietra |
378 kB | 1 |
RAPEX Report 29 del 17/07/2020 N. 02 A12/0908/19 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 29 del 17/07/2020 N. 02 A12/0908/19 Finlandia
Approfondimento tecnico: Spaccalegna
Il prodotto, di marca Preeco, mod. 7T, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2006/42/CE del Consiglio, del 17 maggio 2006, relativa alle macchine.
ll comando a due mani non funziona adeguatamente e ciò può portare a delle lesioni per l’utilizzatore.
Inoltre, l'arresto di emergenza non arresta tutti i movimenti, ferma solo il motore.
Direttiva 2006/42/CE
Allegato I
1.2.2. Dispositivi di comando
I dispositivi di comando devono essere:
- chiaramente visibili e individuabili utilizzando, se del caso, pittogrammi,
- disposti in modo da garantire una manovra sicura, univoca e rapida,
- progettati in modo tale che il movimento del dispositivo del comando sia coerente con l'azione del comando,
- situati fuori delle zone pericolose tranne il caso, all'occorrenza, di taluni dispositivi di comando, come un arresto di emergenza o una pulsantiera pensile,
- sistemati in modo che la loro manovra non causi rischi supplementari,
- progettati o protetti in modo che l'azione comandata, se comporta un pericolo, possa avvenire soltanto in seguito ad un'azione deliberata,
- fabbricati in modo da resistere alle sollecitazioni prevedibili. Particolare attenzione sarà data ai dispositivi di arresto di emergenza che possono essere soggetti a grosse sollecitazioni.
Se un dispositivo di comando è progettato e costruito per consentire varie azioni differenti, vale a dire se la sua azione non è univoca, l'azione comandata deve essere chiaramente indicata e, all'occorrenza, confermata.
La posizione e la corsa dei dispositivi di comando, nonché lo sforzo richiesto devono essere compatibili con l'azione comandata, tenendo conto dei principi ergonomici. La macchina deve essere munita di indicatori necessari per un funzionamento sicuro.
Dal posto di comando l'operatore deve poter leggere i suddetti indicatori. Da ogni posto di comando l'operatore deve poter essere in grado di assicurarsi dell'assenza di persone nelle zone pericolose oppure il sistema di comando deve essere progettato e costruito in modo che l'avviamento sia impedito fintanto che qualsiasi persona si trova nella zona pericolosa.
Qualora nessuna di tali possibilità sia applicabile, prima dell'avviamento della macchina deve essere emesso un segnale di avvertimento sonoro e/o visivo. La persona esposta deve avere il tempo di abbandonare la zona pericolosa o impedire l'avviamento della macchina.
Se necessario, vanno previsti mezzi per assicurarsi che la macchina possa essere comandata solo dai posti di comando situati in una o più zone o posti prestabiliti.
Quando vi sono più posti di comando, il sistema di comando deve essere progettato in modo che l'impiego di uno di essi renda impossibile l'uso degli altri, ad eccezione dei comandi di arresto e degli arresti di emergenza.
Quando la macchina è munita di più posti di manovra, ognuno di essi deve disporre di tutti i dispositivi di comando necessari, senza ostacolare né mettere in situazione pericolosa mutuamente gli operatori.
1.2.4.3. Arresto di emergenza
La macchina deve essere munita di uno o più dispositivi di arresto di emergenza, che consentano di evitare situazioni di pericolo che rischino di prodursi nell'imminenza o che si stiano producendo.
Sono escluse da quest'obbligo:
- le macchine per le quali il dispositivo di arresto di emergenza non può ridurre il rischio, perché non riduce il tempo per ottenere l'arresto normale oppure perché non permette di prendere le misure specifiche che il rischio richiede,
- le macchine portatili tenute e/o condotte a mano.
Il dispositivo deve:
- comprendere dispositivi di comando chiaramente individuabili, ben visibili e rapidamente accessibili,
- provocare l'arresto del processo pericoloso nel tempo più breve possibile, senza creare rischi supplementari,
- quando necessario avviare, o permettere di avviare, alcuni movimenti di salvaguardia.
Quando si smette di azionare il dispositivo di arresto di emergenza dopo un ordine di arresto, detto ordine deve essere mantenuto da un blocco del dispositivo di arresto di emergenza, sino al suo sblocco; non deve essere possibile ottenere il blocco del dispositivo senza che quest'ultimo generi un ordine di arresto; lo sblocco del dispositivo deve essere possibile soltanto con una apposita manovra e non deve riavviare la macchina, ma soltanto autorizzarne la rimessa in funzione.
La funzione di arresto di emergenza deve essere sempre disponibile e operativa a prescindere dalla modalità di funzionamento.
I dispositivi di arresto di emergenza devono offrire soluzioni di riserva ad altre misure di protezione e non sostituirsi ad esse.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 29 del 17_07_2020 N. 02 A12_0908_19 Finlandia.pdf Spaccalegna |
422 kB | 1 |
Controllo periodico decennale serbatoi interrati GPL metodo EA
Controllo periodico decennale serbatoi interrati GPL metodo Emissione Acustica (EA)
Il controllo periodico (decennale) dei piccoli serbatoi interrati per GPL con la metodologia di Emissione Acustica (EA). Procedura ISPESL Rev. 2 2008 e altri documenti sulla metodologia volontaria EA (INAIL) a seguire.
Procedura per il controllo di serbatoi interrati per GPL di capacità non superiore a 13 m3 con tecnica basata sul metodo di Emissione Acustica ai fini della verifica di integrità Revisione 2 – Dicembre 2008 - ISPESL (Rev. 1 vedi Decreto 17 gennaio 2005).
[box-info]Verifica di integrità decennale serbatoi GPL
Attrezzature/insiemi contenenti fluidi del gruppo 2 (D.lgs. 93/2000 art. 3)
Recipienti/insiemi contenenti gas compressi, liquefatti e disciolti o vapori diversi dal vapor d'acqua classificati in I e II categoria.
Verifica di integrità: decennale[/box-info]
Con riferimento al D.M. 23 Settembre 2004 “Modifica del decreto del 29 Febbraio 1988, recante norme di sicurezza per la progettazione, l’installazione e l’esercizio dei depositi di gas, di petrolio liquefatto con capacità complessiva non superiore a 5 m3 e adozione dello standard europeo EN 12818 per i serbatoi di gas di petrolio liquefatto di capacità inferiore a 13 m3” ed al D.D. 17 gennaio 2005 “Procedura operativa per la verifica decennale dei serbatoi interrati per GPL con la tecnica basata sul metodo delle emissioni acustiche”, la procedura di seguito illustrata (per brevità indicata come “procedura EA”) è finalizzata alla valutazione dell’integrità strutturale di serbatoi per gas di petrolio liquefatti (GPL) interrati ed alla loro relativa classificazione, mediante l’impiego di una specifica tecnica basata sul metodo di Emissione Acustica. (“EA”).
La procedura EA in conformità alle disposizioni di legge ed alle indicazioni fornite nello standard europeo UNI EN 12818 (edizione agosto 2004 ed emendamento EN 12818:2002/A1)(1) “Ispezione e riqualifica dei serbatoi interrati per gas di petrolio liquefatti (GPL) di capacità geometrica minore o uguale a 13 m3”, può essere applicata per l’accertamento (verifica di integrità) dell’idoneità all’esercizio di piccoli serbatoi per GPL per un ulteriore periodo di tempo (riqualificazione periodi ca di integrità). La procedura EA è conforme alle indicazioni fornite nell’Appendice C dello standard europeo UNI EN 12818 (edizione agosto 2004 ed emendamento EN 12818:2002/A1) (1).
(1) Attuale EN 12818:2015
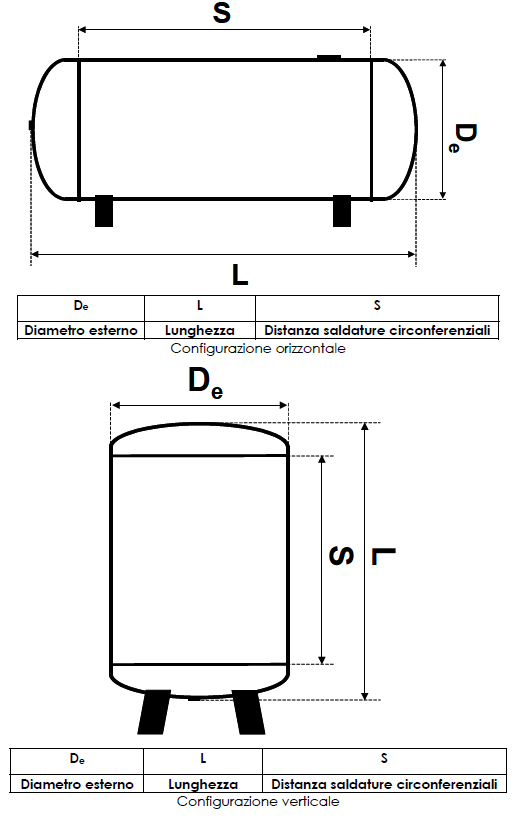
La procedura EA è applicabile a serbatoi interrati con configurazione verticale o orizzontale del tipo indicato in figura 1 e che abbiano i seguenti requisiti essenziali:
- capacità non superiore a 13 m3;
- membrature metalliche protette da un idoneo sistema (rivestimento con resine epossidiche e anodi sacrificali, guscio in polietilene, cassa di contenimento in conglomerato cementizio);
- pressione massima ammissibile non superiore a 17,65 bar;
- accessibilità, sia pur limitata, al serbatoio in pressione.
Fig. 1 - Tipi serbatoi interrati a cui è applicabile la procedura EA
L’applicazione della procedura EA ai serbatoi di tipologia orizzontale e capacità superiore a 3 m3 e fino a 13 m3 è regolamentata dall’Appendice E.
...
Soggetti abilitati
segue in allegato
Collegati
[box-note]Decreto 17 gennaio 2005
Verifiche periodiche attrezzature a pressione
Depositi GPL: Quadro normativo Prevenzione Incendi
Periodicità e metodi dei controlli sui serbatoi interrati[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Chiarimenti applicativi EA.pdf INAIL 2020 |
370 kB | 58 | ||
| Attività certificativa EA Marzo 2020.pdf INAIL 2020 |
1359 kB | 47 | ||
| Proceduta controllo serbatoi GPL con metodo EA Rev. 2 Dicembre 2008.pdf ISPESL 2008 Rev. 2 |
1409 kB | 76 |
Mascherine e DPI: La Legge rilancio introduce la competenza regionale per la validazione in deroga
Mascherine e DPI: la Legge rilancio introduce la competenza regionale per la validazione in deroga (solo importazione)
ID 11211 | Rev. 2.0 del 09.10.2020 Documento completo allegato
______
Rev. 2.0 del 09.10.2020
In data 2 Ottobre 2020 INAIL ha pubblicato i Criteri semplificati di validazione in deroga alle norme vigenti per l'importazione e l'immissione in commercio dei DPI, definiti dal comitato tecnico appositamente istituito.
Con l'entrata in vigore dell'art. 66 bis del D.L. n. 34/2020, convertito con modificazioni dalla Legge n. 77/2020, è stata significativamente innovata la procedura di validazione straordinaria in deroga dei DPI. In particolare, per assicurare alle imprese il necessario fabbisogno dei dispositivi e sostenere la ripresa in sicurezza delle attività produttive, è stata prevista la definizione di criteri semplificati di validazione, in deroga alle norme vigenti, che assicurino l'efficacia protettiva, idonea all'utilizzo specifico, fino al termine dello stato di emergenza.
Il comitato tecnico, istituito ai sensi del comma 3 della medesima disposizione, ha definito tali criteri semplificati e li ha resi disponibili alle Regioni.
Rev. 1.0 del 05.08.2020 Documento completo allegato
Mascherine e DPI: La Legge rilancio Legge 17 luglio 2020 n. 77 (18 Luglio 2020) introduce la competenza regionale per la validazione in deroga per l’importazione, in particolare:
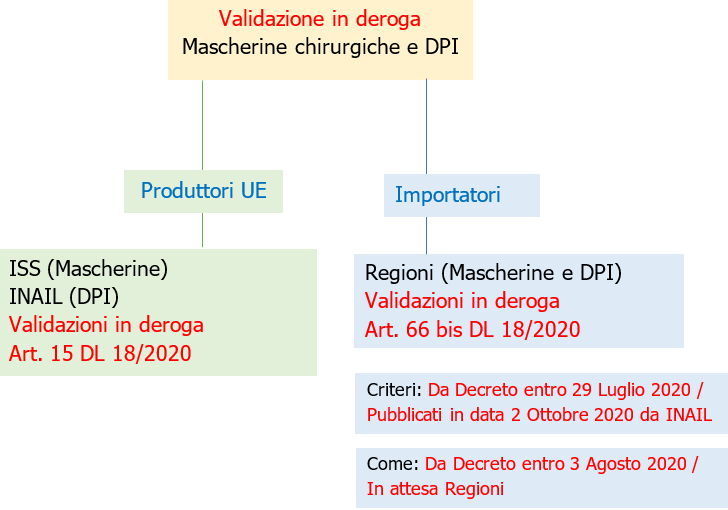
1. Validazione in deroga Mascherine e DPI competenza ISS/INAIL (per Produttori UE)
2. Validazione in deroga Mascherine e DPI Competenza Regioni (per Importatori)
______
Validazione in deroga Mascherine e DPI separati se Produttori UE o Importatori
Riferimento Legge 17 luglio 2020 n. 77 in vigore dal 19/07/2020 (Conversione Decreto Legge Rilancio)
A. PRODUTTORI UE
L’ art. 66-bis della Legge 17 luglio 2020 n. 77, di conversione del decreto-legge 19 maggio 2020, n. 34, ha modificato le competenze dell’Iss e dell’Inail nella procedura di validazione straordinaria, con particolare riferimento all’importazione e all’immissione in commercio delle mascherine chirurgiche e dei dispositivi di protezione individuale, fino al termine dello stato di emergenza epidemiologica da Covid-19 (art. 15, co. 3).
L’Inail resta competente per la sola validazione delle richieste presentate dai produttori di dispositivi di protezione individuale (così come l’ISS per le mascherine chirurgiche), mentre per quelle presentate dagli importatori è previsto il passaggio alle regioni e la costituzione di un Comitato tecnico per la definizione di criteri semplificati di validazione, in deroga alle norme vigenti, che assicurino l'efficacia protettiva idonea all'utilizzo specifico.
A partire dal 4 agosto 2020, pertanto, le richieste di validazione straordinaria, ai sensi dell’articolo 15, co. 3, del decreto-legge 19 maggio 2020, n. 34, possono essere inoltrate all’Inail esclusivamente dai "produttori" con sede in un paese dell’Unione Europea.
Le modalità di presentazione online restano invariate.
B. IMPORTATORI
Con il nuovo Art. 66 bis. introdotto dalla Legge 17 luglio 2020 n. 77 - Conversione in legge, con modificazioni, del decreto-legge 19 maggio 2020, n. 34, recante misure urgenti in materia di salute, sostegno al lavoro e all'economia, nonche' di politiche sociali connesse all'emergenza epidemiologica da COVID-19. (GU n.180 del 18-07-2020 - S.O. n. 25), diventano di competenza regionale le modalità di presentazione delle domande di validazione delle mascherine chirurgiche e dei dispositivi di protezione individuale "importati" ai sensi del presente articolo, le Regioni individuano le strutture competenti per la medesima validazione.
1) Entro il 29 luglio 2020 sono definiti i criteri semplificati di validazione, in deroga alle norme vigenti, da apposito comitato ISS, ACCREDIA, UNI (Pubblicati il 2 Ottobre da INAIL).
2) Entro il 3 agosto le regioni definiscono le modalità di presentazione delle domande di validazione delle mascherine chirurgiche e dei dispositivi di protezione individuale. (In attesa dopoi 1))
Fig. 1 - Nuove procedure di validazione ed in deroga Mascherine chirurgiche e DPI alle norme vigenti
______
[box-note]Decreto-legge 19 maggio 2020, n. 34 (modificato Legge 17 luglio 2020 n. 77)
...
Art. 66-bis Disposizioni in materia di semplificazione dei procedimenti per l’importazione e la validazione di mascherine chirurgiche e dispositivi di protezione individuale
1. Al fine di assicurare alle imprese il necessario fabbisogno di mascherine chirurgiche e di dispositivi di protezione individuale e di sostenere la ripresa in sicurezza delle attività produttive, per l’importazione e l’immissione in commercio dei predetti dispositivi sono definiti criteri semplificati di validazione, in deroga alle norme vigenti, che assicurino l’efficacia protettiva idonea all’utilizzo specifico fino al termine dello stato di emergenza epidemiologica da COVID-19.
2. Per le mascherine chirurgiche i criteri di cui al comma 1 sono definiti entro dieci giorni dalla data di entrata in vigore della legge di conversione del presente decreto da un comitato tecnico composto da un rappresentante dell’Istituto superiore di sanità (ISS), che lo presiede, da un rappresentante designato dalle regioni, da un rappresentante dell’Ente italiano di accreditamento – ACCREDIA, da un rappresentante dell’Ente nazionale italiano di unificazione (UNI) e da un rappresentante degli organismi notificati indicato dalle associazioni degli organismi di valutazione della conformità socie dell’ACCREDIA. Il supporto amministrativo al comitato è assicurato dall’ISS. Ai componenti del comitato tecnico non spettano compensi, gettoni di presenza, rimborsi di spese o altri emolumenti comunque denominati.
3. Per i dispositivi di protezione individuale i criteri di cui al comma 1 sono definiti entro dieci giorni dalla data di entrata in vigore della legge di conversione del presente decreto da un comitato tecnico composto da un rappresentante dell’Istituto nazionale per l’assicurazione contro gli infortuni sul lavoro (INAIL), che lo presiede, da un rappresentante designato dalle regioni, da un rappresentante dell’ACCREDIA, da un rappresentante dell’UNI e da un rappresentante degli organismi notificati indicato dalle associazioni degli organismi di valutazione della conformità socie dell’ACCREDIA. Il supporto amministrativo al comitato è assicurato dall’INAIL. Ai componenti del comitato tecnico non spettano compensi, gettoni di presenza, rimborsi di spese o altri emolumenti comunque denominati.
4. Entro quindici giorni dalla data di entrata in vigore della legge di conversione del presente decreto, le regioni definiscono le modalità di presentazione delle domande di validazione delle mascherine chirurgiche e dei dispositivi di protezione individuale ai sensi del presente articolo e individuano le strutture competenti per la medesima validazione, in applicazione dei criteri di cui ai commi 1, 2 e 3, avvalendosi degli organismi notificati e dei laboratori di prova accreditati dall’ACCREDIA, nonché delle università e dei centri di ricerca e laboratori specializzati per l’effettuazione delle prove sui prodotti, e provvedono ai relativi controlli. Il monitoraggio sull’applicazione dei criteri semplificati di validazione è assicurato dai comitati di cui ai commi 2 e 3, che supportano l’attività delle regioni.
5. Restano ferme le validazioni in deroga effettuate dall’ISS e dall’INAIL in attuazione dell’articolo 15, commi 2 e 3, del decreto-legge 17 marzo 2020, n. 18, convertito, con modificazioni, dalla legge 24 aprile 2020, n. 27. L’ISS e l’INAIL rimangono competenti per la definizione delle domande pervenute ai predetti Istituti fino al quindicesimo giorno successivo alla data di entrata in vigore della legge di conversione del presente decreto, salvo che il richiedente rinunci espressamente a presentare domanda alla regione.
6. A decorrere dalla medesima data di cui al comma 5 del presente articolo, all’articolo 15 del decreto-legge 17 marzo 2020, n. 18, convertito, con modificazioni, dalla legge 24 aprile 2020, n. 27, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «, importare e immettere in commercio» sono soppresse;
b) al comma 2, le parole: «e gli importatori», ovunque ricorrono, e le parole: «e coloro che li immettono in commercio,» sono soppresse;
c) al comma 3:
1) al primo periodo, le parole: «, gli importatori» e le parole: «e coloro che li immettono in commercio» sono soppresse;
2) al secondo periodo, le parole: «e gli importatori» sono soppresse;
d) al comma 4, le parole: «e all’importatore è fatto divieto di immissione in commercio» sono soppresse.
7. Per tutta la durata dello stato di emergenza epidemiologica da COVID-19 resta fermo quanto disposto dall’articolo 5 -bis del decreto-legge 17 marzo 2020, n. 18, convertito, con modificazioni, dalla legge 24 aprile 2020, n. 27.[/box-note]
[box-info]Validazione in deroga delle mascherine chirurgiche e DPI dall’ISS/INAIL solo Produttori UE
Non è più prevista la validazione in deroga delle mascherine chirurgiche e DPI all’ISS/INAIL per l’importazione e relativi obblighi importazione. Tale gestione diventa di competenza regionale.[/box-info]
[box-note]Decreto-legge 17 marzo 2020, n. 18 (modificato Legge 17 luglio 2020 n. 77)
// Modifica articolo 15 del decreto-legge 17 marzo 2020, n. 18 //:
Art. 15. Disposizioni straordinarie per la produzione di mascherine chirurgiche e dispositivi di protezione individuale
1. Fermo quanto previsto dall’articolo 5 -bis, per la gestione dell’emergenza COVID-19, e fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, è consentito produrre, importare e immettere in commercio mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni.
2. I produttori e gli importatori delle mascherine chirurgiche di cui al comma 1, e coloro che le immettono in commercio i quali intendono avvalersi della deroga ivi prevista, inviano all’Istituto superiore di sanità una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche delle mascherine e dichiarano che le stesse rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dall’invio della citata autocertificazione, i produttori e gli importatori devono altresì trasmettere all’Istituto superiore di sanità ogni elemento utile alla validazione delle mascherine chirurgiche oggetto della stessa. L’Istituto superiore di sanità, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza delle mascherine chirurgiche alle norme vigenti.
3. I produttori, gli importatori dei dispositivi di protezione individuale di cui al comma 1 e coloro che li immettono in commercio, i quali intendono avvalersi della deroga ivi prevista, inviano all’INAIL una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche dei citati dispositivi e dichiarano che gli stessi rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dall’invio della citata autocertificazione, i produttori e gli importatori devono altresì trasmettere all’INAIL ogni elemento utile alla validazione dei dispositivi di protezione individuale oggetto della stessa. L’INAIL, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza dei dispositivi di protezione individuale alle norme vigenti.
4. Qualora all’esito della valutazione di cui ai commi 2 e 3 i prodotti risultino non conformi alle vigenti norme, impregiudicata l’applicazione delle disposizioni in materia di autocertificazione, il produttore ne cessa immediatamente la produzione e all’importatore è fatto divieto di immissione in commercio. [/box-note]
...
segue in allegato
Certifico Srl - IT | Rev. 2.0 2020
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 2.0 | 09.10.2020 | Criteri semplificati INAIL | Certifico Srl |
| 1.0 | 05.08.2020 | Correzioni e integrazioni | Certifico Srl |
| 0.0 | 19.07.2020 | --- | Certifico Srl |
Collegati
[box-note]Validazione in deroga DPI: criteri semplificati
Legge 17 luglio 2020 n. 77
Decreto-Legge 19 maggio 2020 n. 34
Decreto Legge 17 marzo 2020 n. 18
Legge 24 aprile 2020 n. 27[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Mascherine chirurgiche e DPI Validazione ed in deroga - Regioni Rev 2.0 2020.pdf Certifico S.r.l. Rev. 2.0 2020 |
448 kB | 77 | ||
| Mascherine chirurgiche e DPI Validazione ed in deroga - Regioni Rev. 1.0 2020.pdf Certifico S.r.l. Rev. 1.0 2020 |
442 kB | 47 | ||
| Mascherine chirurgiche e DPI Validazione ed in deroga - Regioni Rev. 00 2020.pdf Certifico S.r.l. Rev. 00 2020 |
427 kB | 95 |
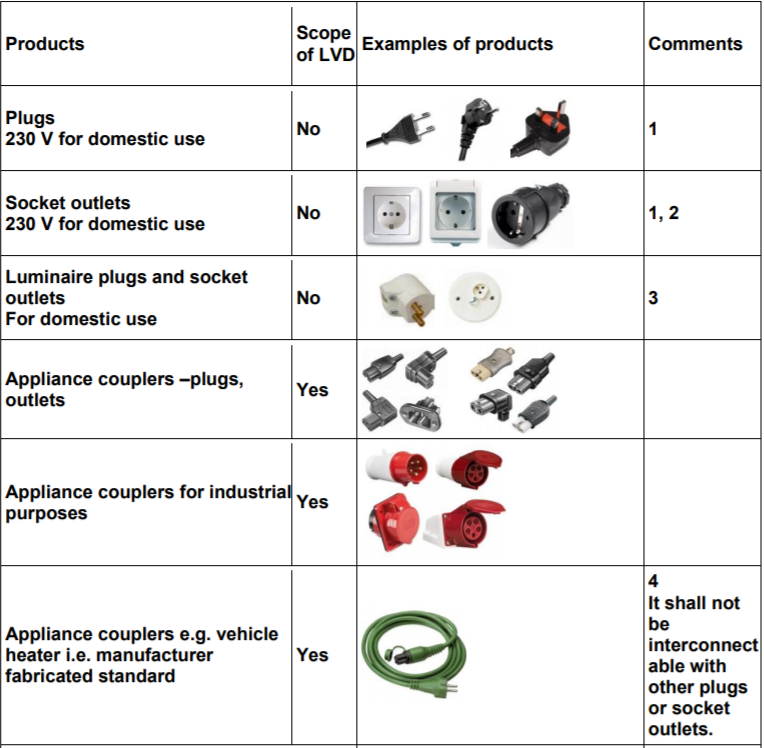
Prodotti elettrici esclusi Direttiva 2014/35/UE Bassa Tensione: Esempi
Prodotti elettrici esclusi Direttiva 2014/35/UE Bassa Tensione: Esempi
ID 11179 | 11.07.2020
La direttiva 2014/35/UE (BT) si applica al materiale elettrico destinato ad essere adoperato ad una tensione nominale compresa fra 50 e 1 000 V in corrente alternata e fra 75 e 1 500 V in corrente continua, fatta eccezione per i materiali e per i fenomeni di cui all’allegato II.
ALLEGATO II
MATERIALI E FENOMENI ESCLUSI DALL’AMBITO DI APPLICAZIONE DELLA PRESENTE DIRETTIVA
Materiali elettrici destinati ad essere usati in ambienti esposti a pericoli di esplosione.
Materiali elettrici per radiologia e uso clinico.
Parti elettriche di ascensori e montacarichi.
Contatori elettrici.
Prese di corrente (basi e spine) a uso domestico.
Dispositivi di alimentazione di recinti elettrici.
Disturbi radioelettrici.
Materiali elettrici speciali, destinati ad essere usati sulle navi o sugli aeromobili e per le ferrovie, conformi alle disposizioni di sicurezza stabilite da organismi internazionali cui partecipano gli Stati membri.
Kit di valutazione su misura per professionisti, destinati ad essere utilizzati unicamente in strutture di ricerca e sviluppo a tali fini.
...
Esempi
...
segue in allegato
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]Nuova Direttiva Bassa Tensione 2014/35/UE
Guidelines LVD 2014/35/EU - August 2018[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Prodotti elettrici esclusi BT Rev. 00.2020.pdf Certifico S.r.l. Rev. 00 2020 |
1646 kB | 86 |
General Safety and Performance Requirements (Annex I) MDR
General Safety and Performance Requirements (Annex I) in the New Medical Device Regulation
Comparison with the Essential Requirements of the Medical Device Directive and Active Implantable Device Directive
As compliance with the ‘Essential Requirements (ERs)’ is the keystone for establishing conformity with the Medical Device Directive (MDD, 93/42/EEC) and Active Implantable Medical Device Directive (AIMDD, 90/385/EEC), so too is compliance with the ‘General Safety and Performance Requirements (SPRs)’ in establishing conformity with the recently published Medical Device Regulation – EU Regulation 2017/745 (MDR). The Regulation’s date of publication was 5 May 2017 and date for Entry into Force was 25 May 2017 with a 3-year transition period (postponed 25 May 2021).
The purpose of this white paper is to compare the ERs in the MDD and AIMDD to the SPRs in Annex I of the new MDR. Where there are 13 ERs in the MDD and 16 in the AIMDD, there are 23 SPRs in the new MDR. The overall text and requirements are expanded, but the scope and topics are consistent overall with the previous directives with a few notable exceptions. Some topics such as clinical evaluation and medicinal consultation have moved from the requirements list into the articles, while other topics are new to the requirements list, including devices without a medical purpose and requirements for devices used by lay persons. A number of areas now have increased emphasis and more explicit requirements, which in many cases align with harmonized standards and industry guidances. Importantly, all of these points will now become European law under this Regulation.
The areas in Annex I considered to have highest impact to manufacturers are:
- medicinal substances (and substances absorbed or locally dispersed);
- devices incorporating materials of biological origin;
- substances of concern;
- labelling requirements;
- emphasis on cybersecurity.
Other key areas of impact in the MDR outside Annex I include:
- clinical data and evaluation requirements;
- reclassification of some device types;
- post-market requirements.
These topics outside Annex I are beyond the scope of the current white paper, but manufacturers should be aware that these important areas are also changing in comparison to the directives. An updated white paper will follow focusing on the implications of the MDR and MEDDEV 2.7.1 Rev. 4 for clinical data and evaluation.
The paper is organized in order of the new safety and performance requirements by number, with the goal that the readers begin to become familiar with the new numbering and organization. The intent is not to reproduce each requirement, but to highlight areas of particular similarity and difference between the ERs and SPRs.
While many of the SPRs (namely numbers 10-23) have explicit headings or titles, others have been added here in an attempt to highlight the theme of each requirement. Cross-references to ERs and other documents with similar text have been identified for each requirement.
In addition, each SPR has been graded (low, medium or high) relative to the expected impact of the changes to the manufacturer (see Appendix 1 for SPR/ER Cross-reference Mapping Guide). Understanding the SPRs will be an important aspect of manufacturers’ transition plans from the directives to the MDR.
Add more in attachment
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| General Safety and Performance Requirements (Annex I) MDR.pdf BSI 2017 |
228 kB | 13 |
Ingegnere biomedico: elenco nazionale certificato
Ingegnere biomedico: elenco nazionale certificato / Documento e Nominativi Update Dicembre 2022
ID 11150 | Rev. 3.0 del 29.12.2022
Normativa, Regolamento CNI e Circolari sulla figura dell'Ingegnere biomedico e clinico istituito con la Legge 11 gennaio 2018 n. 3: elenco nazionale certificato. Elenco nominativi - Update Dicembre 2022
[box-note]Rev. 3.0 del 29.12.2022
Allegato:
1. Elenco nazionale certificato - Update Dicembre 2022[/box-note]
[box-note]Rev. 2.0 del 25.11.2022
Allegato:
1. Elenco nazionale certificato - Update Novembre 2022
Inseriti Rif:
1. Circolare CNI n. 680/XIX Sess./2021
Modalità di iscrizione all’Elenco nazionale certificato degli Ingegneri biomedici e clinici di cui all’art. 10, comma 1, della legge 11 gennaio 2018, n.3
2. Circolare CNI n. 626/XIX Sess./2020
Elenco nazionale certificato degli ingegneri biomedici e clinici di cui all’art.10, comma 1, della legge 11 gennaio 2018, n.3 – PROCEDURE PER ISCRIZIONE.[/box-note]
[box-note]Rev. 1.0 del 10.07.2020
Inserita la Circolare CNI n. 589/XIX Sess./2020 avente ad oggetto le osservazioni in merito all’Atto del Governo 157 alla luce del D.M. 27 febbraio 2020, n. 60[/box-note]
Istituita la nuova figura dell'Ingegnere biomedico / clinico "certificato", competenze certificate dal CNI.
Nella gazzetta ufficiale n.155 del 20-06-2020, è stato pubblicato il decreto ministero della giustizia del 27 febbraio 2020, n. 60 – “Regolamento recante l’individuazione dei requisiti per l’iscrizione nell’elenco nazionale certificato degli ingegneri biomedici e clinici ai sensi dell’art. 10, co. 2, della Legge 11 gennaio 2018 n. 3”, in vigore dal 5 luglio 2020.
Per l'iscrizione nell'elenco, l'ingegnere biomedico e clinico deve avere competenza professionale nelle attivita' tipiche documentabili di:
- pianificazione, progettazione, sviluppo, direzione lavori, stima, attivita' di installazione, icollaudo, gestione, controllo, manutenzione, verifiche e valutazione di appropriatezza tecnologica di progetti-prodotti-processi, formazione e assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute, sia nella libera professione sia nelle imprese manifatturiere o di servizi che nelle amministrazioni pubbliche, enti privati e istituti di ricerca.
Nello svolgimento di tali attivita', l'ingegnere biomedico e clinico e' legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.
______
Circolare CNI n. 589/XIX Sess./2020
Oggetto: Osservazioni in merito all’Atto del Governo 157 alla luce del D.M. 27 febbraio 2020, n. 60 - GU n. 155 del 20/06/2020
La nota riporta le integrazioni proposte dal Consiglio Nazionale all’Atto del Governo n. 157 relativo allo schema di decreto legislativo recante attuazione della direttiva 2013/59/EURATOM, che stabilisce norme fondamentali di sicurezza relative alla protezione contro i pericoli derivanti dall'esposizione alle radiazioni ionizzanti.
Tali proposte di integrazione sono volte ad una armonizzazione con il Decreto Ministeriale 27 febbraio 2020 n.60 (GU n. 155 del 20/06/2020), che istituisce l’elenco nazionale certificato degli ingegneri biomedici e clinici, al fine, tra l’altro, di evitare una disparità di trattamento tra la figura dell’ingegnere biomedico nell’ordinamento italiano rispetto agli altri paesi europei relativamente alle sue competenze.
Il Decreto Ministeriale 27 febbraio 2020 n.60 disciplina altresì le competenze dell’ingegnere biomedico e clinico iscritto nella sezione A dell’elenco nazionale tra cui si annovera: “la pianificazione, la progettazione, lo sviluppo, la direzione lavori, la stima, l'attività di installazione, il collaudo, la gestione, il controllo, la manutenzione, le verifiche e la valutazione di appropriatezza tecnologica di progetti-prodotti-processi, la formazione e l'assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute”.
Nello svolgimento delle attività su indicate, l'ingegnere biomedico e clinico “è legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.”[...]
...
I Requisiti di iscrizione per l'iscrizione nell'elenco sono riportati all'Art. 3 del Decreto 27 febbraio 2020 n. 60, richiesto possesso di competenze in materia di ingegneria biomedica e clinica certificate dal Consiglio nazionale degli ingegneri.
[box-info]Regolamenti MD e IVDR / Persona responsabile del rispetto della normativa
Gli Ingegneri biomedici (certificati) possono avere requisiti adeguati per la nuova Figura della “Persona responsabile del rispetto della normativa” (PR o PRRC da Person Responsible for Regulatory Compliance), introdotta dal Regolamento (UE) 2017/745 (MD), e dal Regolamento (UE) 2017/746 IDVR.[/box-info]
______
[box-note]Legge 11 gennaio 2018 n. 3
Art. 10 Elenco nazionale degli ingegneri biomedici e clinici
1. E' istituito presso l'Ordine degli ingegneri l'elenco nazionale certificato degli ingegneri biomedici e clinici.
2. Con regolamento del Ministro della giustizia, di concerto con il Ministro della salute, da adottare entro novanta giorni dalla data di entrata in vigore della presente legge ai sensi dell'articolo 17, comma 3, della legge 23 agosto 1988, n. 400, sono stabiliti i requisiti per l'iscrizione, su base volontaria, all'elenco nazionale di cui al comma 1.
3. Dall'attuazione del presente articolo non devono derivare nuovi o maggiori oneri a carico della finanza pubblica.[/box-note]
[box-note]Decreto 27 febbraio 2020 n. 60
Regolamento recante l'individuazione dei requisiti per l'iscrizione nell'elenco nazionale certificato degli ingegneri biomedici e clinici ai sensi dell'articolo 10, comma 2, della legge 11 gennaio 2018, n. 3.
...
Art. 1 Tenuta dell'elenco nazionale certificato degli ingegneri biomedici e clinici
1. L'elenco nazionale certificato degli ingegneri biomedici e clinici, istituito a norma dell'articolo 10, comma 1, della legge 11 gennaio 2018, n. 3, e' tenuto dal Consiglio nazionale degli ingegneri, che ne cura la pubblicazione e l'aggiornamento periodico. 2. L'elenco di cui al comma 1 e' suddiviso nelle sezioni A e B.
Art. 2 Ambito di competenza professionale
1. E' iscritto nella sezione A dell'elenco di cui all'articolo 1 l'ingegnere biomedico e clinico che ha competenza professionale nelle seguenti attivita' tipiche documentabili: la pianificazione, la progettazione, lo sviluppo, la direzione lavori, la stima, l'attivita' di installazione, il collaudo, la gestione, il controllo, la manutenzione, le verifiche e la valutazione di appropriatezza tecnologica di progetti-prodotti-processi, la formazione e l'assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per la salute, sia nella libera professione sia nelle imprese manifatturiere o di servizi che nelle amministrazioni pubbliche, enti privati e istituti di ricerca.
2. Nello svolgimento delle attivita' di cui al comma 1, l'ingegnere biomedico e clinico e' legittimato a operare su dispositivi, materiali, processi, macchine, apparati ed impianti, tecnologie biomediche e a coadiuvare il personale medico, odontoiatrico e sanitario nell'applicazione delle tecnologie a favore del paziente senza compiere specificatamente atti diagnostici, terapeutici o di riabilitazione.
3. E' iscritto nella sezione B dell'elenco di cui all'articolo 1 l'ingegnere biomedico e clinico iunior che ha competenza professionale nelle seguenti attivita' tipiche documentabili: il concorso e la collaborazione alle attivita' di pianificazione, progettazione, sviluppo, direzione lavori, stima, attivita' di installazione, collaudo, gestione, controllo, manutenzione, verifiche e valutazione di appropriatezza tecnologica di progetti-prodotti-processi, formazione e assistenza all'uso di dispositivi, dispositivi medici e diagnostici in vitro, materiali, processi, macchine ed impianti per salute, sia nella libera professione e nelle imprese manifatturiere o di servizi, sia nelle amministrazioni pubbliche, enti privati e istituti di ricerca, nonche' direttamente le attivita' di cui sopra che implichino l'uso di metodologie standardizzate o di sistemi e processi di tipologia semplice o ripetitiva.
Art. 3 Requisiti di iscrizione
1. Costituiscono requisiti necessari per l'iscrizione nella sezione A dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea magistrale nella classe LM-21 di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea specialistica nella classe 26/S, di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509 in ingegneria biomedica, ovvero di laurea in ingegneria biomedica conseguita secondo le previsioni dell'ordinamento degli studi universitari previgente al citato decreto n. 509 del 1999;
b) l'iscrizione attiva all'Albo degli ingegneri nella sezione A dei settori dell'ingegneria industriale o dell'ingegneria dell'informazione, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328.
2. Quando il possesso di competenze afferenti alla disciplina dell'ingegneria biomedica e clinica sono certificate dal Consiglio nazionale degli ingegneri ai sensi dell'articolo 5, costituiscono requisiti necessari per l'iscrizione nella sezione A dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea magistrale di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea specialistica di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509, diversi dai titoli di cui al comma 1, lettera a), in materie che consentono l'iscrizione all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione A, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328, ovvero il possesso di laurea in ingegneria conseguita precedentemente all'entrata in vigore del citato decreto n. 509 del 1999;
b) l'iscrizione attiva all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione A, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328.
3. Costituiscono requisiti necessari per l'iscrizione nella sezione B dell'elenco di cui all'articolo 1:
a) il possesso di un titolo di laurea nelle classi L-8 (ingegneria dell'informazione) e L-9 (ingegneria industriale) di cui al decreto del Ministro dell'universita' e della ricerca 22 ottobre 2004, n. 270 o di laurea nelle classi 9 (ingegneria dell'informazione) e 10 (ingegneria industriale), di cui al decreto del Ministro dell'universita' e della ricerca 3 novembre 1999, n. 509;
b) l'iscrizione attiva all'Albo degli ingegneri nei settori dell'ingegneria industriale o dell'ingegneria dell'informazione della sezione B, ai sensi dell'articolo 45 del decreto del Presidente della Repubblica 5 giugno 2001, n. 328;
c) il possesso di competenze in materia di ingegneria biomedica e clinica certificate dal Consiglio nazionale degli ingegneri ai sensi dell'articolo 5.
...
(GU n.155 del 20-06-2020)[/box-note]
...
segue in allegato
Certifico Srl - IT Rev. 3.0.2022
©Copia autorizzata Abbonati
Matrice Revisioni
| Rev. | Data | Oggetto | Autore |
| 3.0 | 29.12.2022 | Elenco nominatici Update Dicembre 2022 | Certifico Srl |
| 2.0 | 25.11.2022 | Elenco nominativi Update Novembre 2022 Circolare CNI n. 680/XIX Sess./2021 Circolare CNI n. 626/XIX Sess./2020 |
Certifico Srl |
| 1.0 | 10.07.2020 | Circolare CNI n. 589/XIX Sess./2020 | Certifico Srl |
| 0.0 | 07.07.2020 | -- | Certifico Srl |
Collegati
[box-note]Circolare CNI n. 680/XIX Sess./2021
Circolare CNI n. 626/XIX Sess./2020
Circ.CNI n. 589/XIX Sess./2020
Legge 11 gennaio 2018 n. 3
Decreto 27 febbraio 2020 n. 60[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Ingegnere biomedico - Elenco nazionale certificato Rev. 3.0 2022.pdf Certifico Srl - Rev. 3.0 2022 |
185 kB | 3 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 2.0 2022.pdf Certifico Srl - Rev. 2.0 2022 |
186 kB | 9 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 1.0 2020.pdf Certifico Srl - Rev. 1.0 2020 |
418 kB | 23 | ||
| Ingegnere biomedico - Elenco nazionale certificato Rev. 00 2020.pdf Certifico Srl - Rev. 0.0 2020 |
146 kB | 16 |
ACCREDIA | Mascherine: Come riconoscere un'attestazione valida
ACCREDIA | Mascherine: Come riconoscere un'attestazione valida
ID 11103 | 29.06.2020
Di fronte all’emergenza sanitaria da Coronavirus, con la necessità di garantire una tempestiva ed elevata disponibilità di Dispositivi di Protezione Individuale (DPI) e dispositivi medici e ridurre i tempi di attesa della produzione e commercializzazione, è stata disposta una deroga alla procedura ordinaria di valutazione della conformità di questi prodotti.
Durante la normale produzione di DPI, le aziende sono sottoposte a un’attività di valutazione della conformità da parte degli organismi accreditati e notificati alla Commissione europea. Sulla base di tali verifiche, i produttori, gli importatori e chi commercializza possono apporre la marcatura CE sui prodotti e immetterli sul mercato.
I DPI possono circolare ed essere commercializzati solo se accompagnati da documenti corretti e validi, dal momento che devono attestarne la conformità alle norme applicabili, in materia di salute, sicurezza e protezione degli utilizzatori.
Verificare la validità di un certificato di conformità di un DPI
Nel seguito, Accredia fornisce alcune indicazioni per riconoscere un certificato valido di attestazione della conformità di un DPI, emesso ai sensi del Regolamento UE 425/2016 da un organismo notificato.
CONTROLLARE GLI ELEMENTI ESSENZIALI CHE IL CERTIFICATO DEVE CONTENERE
Se il documento da verificare è un certificato UE, emesso ai sensi del Regolamento UE 425/2016 sui DPI da un organismo notificato, questo deve contenere almeno le seguenti informazioni:
[alert]a) nome e numero di identificazione dell’organismo notificato;
b) nome e indirizzo del fabbricante e, qualora la domanda sia presentata dal mandatario, nome e indirizzo di quest’ultimo;
c) identificazione del DPI oggetto del certificato (numero del Tipo);
d) dichiarazione in cui si attesta che il Tipo di DPI soddisfa i requisiti essenziali di salute e di sicurezza applicabili;
e) se le norme armonizzate sono state applicate in tutto o in parte, i riferimenti di tali norme o parti di esse;
f) se sono state applicate altre specifiche tecniche, i loro riferimenti;
g) se del caso, il livello di prestazioni o la classe di protezione del DPI;
h) per i DPI prodotti come unità singole per adattarsi a un singolo utilizzatore, la gamma delle variazioni consentite dei parametri pertinenti sulla base del modello di base approvato;
i) la data di rilascio, la data di scadenza e, se del caso, la data o le date di rinnovo;
j) le eventuali condizioni connesse al rilascio del certificato;
k) per i DPI della categoria III, una dichiarazione secondo cui il certificato deve essere utilizzato solo in combinazione con una delle procedure di valutazione della conformità di cui all’articolo 19, lettera c).[/alert]
NOTA BENE
Le informazioni di cui ai punti e), f), g), h) potrebbero anche non essere sempre presenti in base alle scelte progettuali e costruttive dei diversi fabbricanti.
VERIFICARE ON LINE LA NOTIFICA DELL’ORGANISMO CHE HA EMESSO IL CERTIFICATO
Per essere sicuri che il certificato che contiene gli elementi sopra riportati sia stato emesso da un organismo notificato per tale tipologia di DPI, si può effettuare un controllo sul database della Commissione europea che riporta l’elenco degli organismi notificati in Europa per il Regolamento UE 425/2016.
LINK –> Database NANDO
Bisogna verificare se nella specifica notifica è riportato il DPI oggetto della ricerca (Equipment providing respiratory system protection).
NOTA BENE
Se il documento su cui si vogliono eseguire accertamenti, non contiene le informazioni sopra riportate o non è stato emesso da un organismo notificato per lo specifico DPI, quel documento non è un certificato per marcatura CE di un DPI.
In questo periodo di emergenza è possibile che – benché non marcati CE – alcuni DPI siano immessi in commercio in forza di quanto previsto dall’art. 15 del DL 18/2020 “Cura Italia”. L’elenco di tali DPI è pubblico e consultabile sul sito di Inail.
Qualora il DPI oggetto di approfondimento non dovesse risultare correttamente marcato CE e non “validato” da INAIL, è possibile segnalarlo alle Autorità preposte alla Sorveglianza del mercato. Per i DPI le segnalazioni vanno inviate al Ministero dello Sviluppo Economico e al Ministero del Lavoro e delle Politiche Sociali agli indirizzi pubblicati sui relativi siti.
Per i Dispositivi Medici (mascherine chirurgiche) si specifica che le Autorità preposte alla Sorveglianza del mercato sono il Ministero della Salute e l’Istituto Superiore di Sanità.
CONTROLLARE CHE IL CERTIFICATO RIPORTI IL LOGO ACCREDIA E CONTATTARE L’ORGANISMO CHE HA EMESSO IL CERTIFICATO
Per accertarsi della reale emissione di un certificato (che deve riportare il nostro logo nel caso di DPI certificati da parte di organismi accreditati da Accredia) si deve in ogni caso contattare il soggetto che lo ha emesso ed è l’unico che può dichiararne l’emissione, lo stato di vigenza, la corrispondenza al DPI oggetto della certificazione o addirittura la falsità.
Tale verifica può essere generalmente eseguita direttamente on line sul sito web dell’organismo interessato o inviando una e-mail.
ATTENZIONE A DOCUMENTI SOMIGLIANTI MA CHE NON SONO CERTIFICATI AI SENSI DEL REGOLAMENTO UE 425/2016 DPI
Stanno circolando documenti simili a dei certificati del Tipo di DPI ai sensi del Regolamento UE 425/2016 DPI ma che non lo sono.
Diciture generiche sui facsimili di certificati presentati a supporto di DPI del tipo FFP2 e FFP3 che contengano diciture come “Qualified Certificate”, “Protective Mask” o “Contrasto COVID-19” non sono previste dalla legislazione vigente e anzi rappresentano un elemento che può confondere i consumatori finali e di cui bisogna diffidare ponendo la massima attenzione alla reale conformità del DPI che viene proposto.
ESEMPI DI DOCUMENTI CHE NON SONO CERTIFICATI DI CONFORMITA' DI DPI
Caso 1

Caso 4*
*certificato FALSO, non emesso dall’organismo ISET s.r.l. (visita il sito http://odc.iset-italia.eu/)
Caso 5*
*certificato pubblicato su richiesta e autorizzazione dell’organismo CELAB SRL.
Caso 6
________
Infografica
Fonte: ACCREDIA
Collegati:
[box-note]UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Classificazione Mascherine DPI NIOSH (US)
ISS | Procedure per richiesta produzione mascherine
Coronavirus: Corretto uso delle mascherine[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| ACCREDIA Mascherine Come riconoscere un'attestazione valida.pdf Certifico Srl - Rev. 0.0 2020 |
1110 kB | 27 |
Structure of Technical Documentation (Medical Devices)
Structure of Technical Documentation (Medical Devices)
ID 11637 | 28.09.2020
- Note Technical Documentation Regulation (EU) 2017/745 (MDR)
- Example Structure Model Rev. 1.0 sept. 2020
The following structure is based on Regulation (EU) 2017/745 (MDR) but is also suitable for technical documentation according to Directive 93/42/EEC.
1. Device description and specification
1.1. General description of the device, its variants and its intended purpose
1.1.1. Name and address of the manufacturer
1.1.2. Overview of devices/ device groups/device types e.g. table with designation and reference to the REF number, including UDI-DI (if applicable)
1.1.3. All trade names under which the device is placed on the market
1.1.4. Description and specifications of the device including its intended purpose, indication(s), contraindication(s) and warnings, the intended patient group and the medical conditions to be diagnosed/treated/monitored
1.1.5. UMDNS/GMDN classification (if applicable)
1.1.6. Technical specifications of the device, such as characteristics, dimensions and performance attributes of the device
1.1.7. Variants/components/configurations and accessories of the device
1.1.8. Exact software version (if applicable)
1.1.9. Explanations of new characteristics and new intended purposes/indications
1.2. UDI (as soon as implemented or obligatory)
Description of the basis-UDI-DI, taking into account all variants covered by the technical documentation
Until the complete implementation of the UDI requirements at least a clear representation of all variants covered by the TD (sizes, forms, coatings, etc.).
1.3. Designation / Classification
Justification for the designation as a medical device and description of the classification of the device including justification for on the applied classification rule(s), exact identification of the applied indent, statement for the classification
1.4. Declaration of Conformity (DoC)
DoC according to Annex IV MDR or according to MDD (considering EK-MED-Beschluss 3.9 A4). For initial certifications (e.g. MDR) the DoC has to be filed in draft status.
....
segue in allegato
Certifico Srl - IT | Rev. 0.0 2020
©Copia autorizzata Abbonati
Collegati
[box-note]Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Regolamento (UE) 2017/745
Technical File Medical Device[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Technical file Medical device - Note.pdf Certifico S.r.l. Rev. 00 2020 |
400 kB | 46 | ||
| Structure Technical Documentation Medical Devices.docx Certifico Srl - Rev. 0.0 2020 |
38 kB | 29 | ||
| Structure Technical Documentation Medical Devices.pdf Certifico Srl - Rev. 0.0 2020 |
355 kB | 42 |
RAPEX Report 37 del 11/09/2020 N. 10 A12/01212/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 37 del 11/09/2020 N. 10 A12/01212/20 Polonia
Approfondimento tecnico: Cavalli giocattolo di plastica
Il prodotto, di marca HH Poland, mod. HM164232, No.CF1015, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n.1907/2006 REACH del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il materiale plastico del giocattolo contiene una quantità eccessiva di bis (2-etilesil) ftalato (DEHP) (valore misurato fino allo 0,53% in peso). Questo ftalato può nuocere alla salute dei bambini, provocando possibili danni al sistema riproduttivo.
Regolamento (CE) n .1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. ftalato di bis(2-etilesile) (DEHP)
1. Non possono essere utilizzati come sostanze o in miscele in concentrazioni superiori allo 0,1 % in peso del materiale plastificato, nei giocattoli e negli articoli di puericultura.
2. I giocattoli e gli articoli di puericultura contenenti tali ftalati in concentrazione superiore allo 0,1 % in peso del materiale plastificato non possono essere immessi sul mercato.
4. Ai fini della presente voce, per «articoli di puericultura» si intende qualsiasi prodotto destinato a conciliare il sonno, il rilassamento, l’igiene, il nutrimento e il succhiare dei bambini.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 37 del 11_09_2020 N. 10 A12_01212_20 Polonia.pdf Cavalli giocattolo di plastica |
383 kB | 0 |
Decreto 19 Maggio 2020
Decreto 19 maggio 2020
Attuazione delle direttive delegate della Commissione europea (UE) 2019/1845 ed (UE) 2019/1846, di modifica del decreto legislativo 4 marzo 2014, n. 27, sulla restrizione di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
(GU Serie Generale n.228 del 14-09-2020)
...
Collegati:
[box-note]Direttiva RoHS III | Testo consolidato
Direttiva delegata (UE) 2019/1845
Direttiva delegata (UE) 2019/1846
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
RAPEX Report 35 del 28/08/2020 N. 15 A12/01184/20 Polonia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 35 del 28/08/2020 N. 15 A12/01184/20 Polonia
Approfondimento tecnico: Slime giocattolo
Il prodotto, di marca Midex, mod. N0.020A e N0: D30941, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2009/48/CE del Parlamento europeo e del Consiglio del 18 giugno 2009 sulla sicurezza dei giocattoli ed alla norma tecnica armonizzata EN 71-3 “Sicurezza dei giocattoli - parte 3: Migrazione di alcuni elementi”.
La migrazione del boro dal giocattolo è troppo elevata (valore misurato: 404,65 mg/kg). L'ingestione o il contatto con una quantità eccessiva di boro può nuocere alla salute dei bambini danneggiando il loro sistema riproduttivo.
Direttiva 2009/48/CE
Allegato II
Requisiti particolari di sicurezza
III. Proprietà Chimiche
13. Fatti salvi i punti 3, 4 e 5, non devono essere superati i seguenti limiti di migrazione degli elementi sotto indicati dai giocattoli o dai loro componenti:
Boro
- mg/kg di materiale per giocattoli secco, fragile, in polvere o flessibile = 1200
- mg/kg di materiale per giocattoli liquido o colloso = 300
- mg/kg di materiale rimovibile dal giocattolo mediante raschiatura = 15000
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 35 del 28_08_2020 N. 15 A12_01184_20 Polonia.pdf Slime giocattolo |
417 kB | 1 |
Circolare del 1° settembre 2020 (Prot. 42211)
Circolare del 1° settembre 2020 (Prot. 42211)
Direttiva 2014/90/UE sull’equipaggiamento marittimo e che abroga la direttiva 96/98/CE
Disposizioni in merito all’applicazione del Regolamento di esecuzione (UE) 2020/1170 del 16 Luglio 2020 relativo ai requisiti di progettazione, costruzione ed efficienza e alle norme di prova per l'equipaggiamento marittimo, che abroga il regolamento di esecuzione (UE) 2019/1397.
La circolare n.4/2020 fornisce chiarimenti per garantire l’omogeneità di comportamento degli ispettori di bordo in sede di collaudo e di ispezione a stazioni radio, installate a bordo di unità navali, costituite da apparati conformi alla Direttiva 2014/90/UE ed al relativo Regolamento vigente.
...
Fonte: MISE
Collegati:
[box-note]Direttiva 2014/90/UE e Direttiva 2014/93/UE Equipaggiamento marittimo
Regolamento di esecuzione (UE) 2020/1170[/box-note]
Rapporto attività di vigilanza sui dispositivi medici Ed. 2020
Rapporto sulle attività di vigilanza sui dispositivi medici Ed. 2020
Min Salute 25 agosto 2020 (Rif. Anno 2018)
Il ministero pubblica il primo Rapporto sulle attività di vigilanza sui dispositivi medici, con l'obiettivo di condividere, con tutti gli attori coinvolti nel settore, quali fabbricanti, operatori sanitari, associazioni di pazienti, istituzioni locali e centrali interessate all’acquisto e alla gestione dei dispositivi medici, i risultati delle analisi derivanti dall’attività di vigilanza, in maniera trasparente e con finalità informativa.
La pubblicazione offre una panoramica su quella che è la costante attività di vigilanza sui dispositivi medici, svolta dal ministero per garantire la circolazione sul territorio nazionale di prodotti sicuri ed efficaci per i pazienti, gli utilizzatori e gli operatori sanitari.
Il Rapporto contiene un'analisi dei dati relativi all'anno 2018 sugli incidenti con dispositivi medici, raccolti nella banca dati del sistema di vigilanza su segnalazione degli operatori sanitari e dei fabbricanti. Dal Rapporto è esclusa l’analisi dei dispositivi in vitro.
La pubblicazione è articolata in due sezioni:
- la prima riguarda la descrizione dei dati sugli incidenti verificatisi nell’anno 2018, con particolare attenzione alle categorie di dispositivi medici che hanno presentato una maggiore frequenza di incidente;
- la seconda fornisce approfondimenti su alcune tematiche di particolare interesse emerse nell’anno 2018.
Il sistema di sorveglianza del ministero della Salute ha registrato, nell’anno 2018, 6.068 incidenti con i dispositivi medici, numero sostanzialmente stabile rispetto all’anno 2017.
Delle segnalazioni di incidente, il 77% vede coinvolti dispositivi medici appartenenti alle categorie della CND - Classificazione Nazionale dei Dispositivi medici: dispositivi impiantabili attivi, dispositivi protesici impiantabili e prodotti per osteosintesi, apparecchiature sanitarie e relativi componenti, accessori e materiali, dispositivi da somministrazione, prelievo e raccolta e dispositivi per apparato cardiocircolatorio.
Con riferimento alla regione di registrazione dell’evento il Rapporto mette in evidenza una forte disomogeneità territoriale di segnalazione, facendo supporre fenomeni, più o meno marcati, di under-reporting.
Nella seconda sezione del Rapporto sono riportati alcuni approfondimenti relativi a impianti protesici mammari, ad apparecchiature sanitarie e componenti e a dispositivi medici di interesse cardiovascolare (dispositivi per la funzionalità cardiaca e protesi vascolari e cardiache).
...
segue in allegato
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE
Regolamento delegato (UE) 2017/1475 [/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Rapporto attività di vigilanza dispositivi medici Ed. 2020.pdf Min Salute 2020 |
1560 kB | 23 |
RAPEX Report 33 del 14/08/2020 N. 01 A12/01137/20 Danimarca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 33 del 14/08/2020 N. 01 A12/01137/20 Danimarca
Approfondimento tecnico: Disinfettante per le mani
Il prodotto, di marca MissLife, è stato sottoposto alla procedura che prevede la distruzione del prodotto stesso perché non conforme al Regolamento (CE) n. 1272/2008 del Parlamento Europeo e del Consiglio del 16 dicembre 2008 relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le direttive 67/548/CEE e 1999/45/CE e che reca modifica al regolamento (CE) n. 1907/2006.
Il prodotto contiene metanolo (valore misurato: 11,6 %), che è estremamente tossico per il sistema nervoso centrale e per gli occhi. Mancano, inoltre, i pittogrammi di pericolo e le avvertenze. Gli utilizzatori non dispongono, pertanto, delle informazioni sulla tossicità e sull'infiammabilità del prodotto. L'imballaggio non è munito di una chiusura di sicurezza per i bambini. L'ingestione o il contatto con il metanolo può portare a cecità e morte.
Regolamento (CE) n. 1272/2008
Articolo 3
Sostanze e miscele pericolose e specificazione delle classi di pericolo
Una sostanza o miscela che corrisponde ai criteri relativi ai pericoli fisici, per la salute o per l'ambiente definiti nelle parti da 2 a 5 dell'allegato I è considerata pericolosa ed è classificata nelle rispettive classi di pericolo contemplate in detto allegato.
Qualora nell'allegato I le classi di pericolo siano differenziate in base alla via di esposizione o alla natura degli effetti, la sostanza o miscela è classificata secondo tale differenziazione.
Articolo 4
Obblighi generali di classificazione, etichettatura e imballaggio
1. I fabbricanti, gli importatori e gli utilizzatori a valle classificano le sostanze e le miscele in conformità del titolo II prima di immetterle sul mercato.
2. Fatte salve le prescrizioni del paragrafo 1, i fabbricanti, i produttori di articoli e gli importatori classificano le sostanze non immesse sul mercato in conformità del titolo II quando:
a) l'articolo 6, l'articolo 7, paragrafo 1 o 5, l'articolo 17 o l'articolo 18 del regolamento (CE) n. 1907/2006 prevedono la registrazione di una sostanza;
b) l'articolo 7, paragrafo 2, o l'articolo 9 del regolamento (CE) n. 1907/2006 prevedono la notifica.
3. Se una sostanza è soggetta a classificazione ed etichettatura armonizzate in conformità del titolo V mediante una voce dell'allegato VI, parte 3, tale sostanza è classificata conformemente a tale voce e una classificazione di tale sostanza secondo il titolo II non è effettuata per le classi di pericolo o relative differenziazioni figuranti in tale voce. Tuttavia, se la sostanza rientra anche in una o più classi di pericolo o relative differenziazioni non figuranti in una voce dell'allegato VI, parte 3, per tali classi di pericolo o differenziazioni è effettuata una classificazione secondo il titolo II.
4. Se una sostanza o miscela è classificata come pericolosa, i fornitori assicurano che tale sostanza o miscela sia etichettata e imballata conformemente ai titoli III e IV prima di immetterla sul mercato.
5. Nell'adempimento delle responsabilità di cui al paragrafo 4, i distributori possono utilizzare la classificazione di una sostanza o una miscela derivata in conformità del titolo II da un attore della catena d'approvvigionamento.
6. Nell'adempimento delle responsabilità di cui ai paragrafi 1 e 4, gli utilizzatori a valle possono utilizzare la classificazione di una sostanza o una miscela derivata in conformità del titolo II da un attore della catena d'approvvigionamento, a condizione che non ne modifichino la composizione.
7. Una miscela di cui alla parte 2 dell'allegato II contenente una sostanza classificata come pericolosa non è immessa sul mercato, a meno che non sia etichettata in conformità del titolo III.
8. Ai fini del presente regolamento, gli articoli di cui alla sezione 2.1 dell'allegato I sono classificati, etichettati e imballati in conformità delle disposizioni che si applicano alle sostanze e alle miscele prima dell'immissione sul mercato.
9. I fornitori di una catena d'approvvigionamento cooperano per soddisfare i requisiti in materia di classificazione, etichettatura e imballaggio del presente regolamento.
10. Le sostanze e le miscele sono immesse sul mercato solo se rispettano il presente regolamento.
3. Parte 3: disposizioni particolari relative all’imballaggio
3.1. Disposizioni riguardanti le chiusure di sicurezza per bambini
3.1.1. Imballaggi che devono essere muniti di chiusura di sicurezza per bambini
3.1.1.1. Imballaggi di qualunque capienza contenenti sostanze o miscele fornite al pubblico e classificate per la tossicità acuta (categorie da 1 a 3), STOT — esposizione singola (categoria 1), STOT — esposizione ripetuta (categoria 1) o corrosione della pelle (categoria 1) sono muniti di chiusura di sicurezza per bambini.
3.1.1.2. Gli imballaggi di qualunque capienza contenenti sostanze o miscele fornite al pubblico che presentano un pericolo in caso di aspirazione, classificate secondo i punti 3.10.2 e 3.10.3 dell’allegato I ed etichettate secondo il punto 3.10.4.1 dell'allegato I, ad eccezione delle sostanze e delle miscele immesse sul mercato sotto forma di aerosol o in un recipiente munito di un dispositivo di nebulizzazione sigillato, sono muniti di chiusura di sicurezza per bambini.
3.1.1.3. Quando in una sostanza o miscela è presente almeno una delle sostanze sottoindicate, in concentrazione uguale o superiore alla massima concentrazione specificata per ciascuna sostanza, l'imballaggio, di qualunque capienza, è munito di chiusura di sicurezza per bambini.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 33 del 14_08_2020 N. 01 A12_01137_20 Danimarca.pdf Disinfettante per le mani |
409 kB | 0 |
Regolamento di esecuzione (UE) 2020/1207
Regolamento di esecuzione (UE) 2020/1207
della Commissione del 19 agosto 2020 recante modalità di applicazione del regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio per quanto riguarda le specifiche comuni per il ricondizionamento dei dispositivi monouso.
GU L 273/3 del 23.08.2020
Entrata in vigore: 09.09.2020
_____
Articolo 1 Oggetto
Il presente regolamento stabilisce le norme per l’applicazione dell’articolo 17, paragrafo 3, del regolamento (UE) 2017/745, qualora il diritto nazionale autorizzi il ricondizionamento dei dispositivi monouso e uno Stato membro abbia deciso di non applicare tutte le norme relative agli obblighi dei fabbricanti previste in tale regolamento in relazione ai dispositivi monouso ricondizionati e utilizzati all’interno di un’istituzione sanitaria.
Il presente regolamento stabilisce inoltre le norme applicabili nel caso in cui uno Stato membro abbia deciso di applicare l’articolo 17, paragrafo 3, del regolamento (UE) 2017/745 anche per quanto riguarda i dispositivi monouso ricondizionati da un ricondizionatore esterno.
Articolo 2 Definizioni
Ai fini del presente regolamento si applicano le seguenti definizioni:
1) «ricondizionatore»: l’istituzione sanitaria e il ricondizionatore esterno che ricondizionano dispositivi monouso;
2) «ricondizionatore esterno»: il soggetto che ricondiziona dispositivi monouso su richiesta di un’istituzione sanitaria;
3) «ciclo di ricondizionamento»: un ciclo che comprende tutte le fasi di ricondizionamento applicate a un dispositivo monouso per garantire che la sicurezza e le prestazioni del dispositivo ricondizionato siano equivalenti a quelle del dispositivo d’origine.
[...]
Articolo 5 Valutazione preliminare dell’idoneità di un dispositivo monouso al ricondizionamento
1. Prima di decidere di iniziare a ricondizionare un dispositivo monouso, o di chiedere di farlo a un ricondizionatore esterno, l’istituzione sanitaria valuta se il dispositivo monouso sia adatto al ricondizionamento.
2. Ai fini del paragrafo 1, l’istituzione sanitaria valuta se la sicurezza e le prestazioni del dispositivo monouso una volta ricondizionato saranno equivalenti a quelle del dispositivo monouso d’origine.
3. Nel valutare l’idoneità di un dispositivo monouso al ricondizionamento, l’istituzione sanitaria, ove applicabile:
a) verifica che il dispositivo monouso rechi la marcatura CE;
b) verifica che il dispositivo monouso non sia stato ritirato dal mercato e che il suo certificato di conformità non sia stato sospeso, ritirato o sottoposto a limitazioni;
c) verifica se l’utilizzo del dispositivo monouso sia stato sottoposto a limitazioni per motivi di sicurezza, secondo quanto indicato negli avvisi di sicurezza;
d) effettua un’analisi delle proprietà del dispositivo monouso, tenendo conto di tutta la documentazione e di tutte le informazioni disponibili sul dispositivo monouso, per garantire una comprensione e una conoscenza sufficienti in materia di progettazione, proprietà di fabbricazione, caratteristiche dei materiali, proprietà funzionali e altri fattori di rischio connessi al ricondizionamento del dispositivo monouso, compreso l’uso precedente.
Ove applicabile, nell’effettuare una valutazione a norma del primo comma, l’istituzione sanitaria consulta un ricondizionatore esterno e si avvale del suo sostegno operativo conformemente al contratto di cui all’articolo 3.
Ai fini delle lettere b) e c), l’istitu ione sanitaria verifica le informazioni contenute nella banca dati europea dei dispositivi medici (Eudamed). Fino a quando Eudamed non sarà pienamente operativa, l’istituzione sanitaria verifica le informazioni conformemente alle disposizioni sullo scambio di informazioni di cui all’articolo 123, paragrafo 3, lettera d), del regolamento (UE) 2017/745.
Qualora le informazioni non possano essere ottenute conformemente al terzo comma, l’istituzione sanitaria verifica le informazioni sul sito web del fabbricante o del suo mandatario.
Ai fini della lettera d), l’istituzione sanitaria riesamina le informazioni di cui all’allegato I, capo III, punto 23.4, lettera p), del regolamento (UE) 2017/745 e qualsiasi altra documentazione e informazione pertinente di pubblico dominio.
4. La decisione dell’istituzione sanitaria in merito all’idoneità di un dispositivo monouso al ricondizionamento è basata su un parere positivo scritto fornito dalla persona responsabile del ricondizionamento. Il dispositivo monouso non viene ricondizionato se la persona responsabile del ricondizionamento ha espresso un parere negativo sull’idoneità del dispositivo monouso al ricondizionamento.
[...]
Articolo 7 Determinazione del ciclo di ricondizionamento
1. Le istituzioni sanitarie che ricondizionano dispositivi monouso stabiliscono, se applicabile insieme ai ricondizionatori esterni, il ciclo di ricondizionamento del dispositivo monouso da sottoporre a ricondizionamento.
2. Il ciclo di ricondizionamento è stabilito in base alla documentazione e alle informazioni raccolte conformemente all’articolo 5 e ai risultati di una valutazione tecnica che comprende, ove opportuno, test fisici, elettrici, chimici, biologici e microbiologici, e ingegneria inversa. Il ciclo di ricondizionamento non modifica la destinazione d’uso del dispositivo monouso, tiene conto delle conoscenze scientifiche e tecniche e, se applicabile, del metodo originale di sterilizzazione e delle norme pertinenti.
3. Il ciclo di ricondizionamento è stabilito per iscritto ed è convalidato dall’istituzione sanitaria che ricondiziona i dispositivi monouso, se applicabile insieme ai ricondizionatori esterni. Il ciclo di ricondizionamento descrive ogni fase del ricondizionamento. Per ciascuna fase è stabilita la procedura pertinente e ogni fase è convalidata. La convalida delle fasi di ricondizionamento consiste nell’installazione e nelle qualifiche del funzionamento e delle prestazioni.
4. La convalida garantisce che le prestazioni e la sicurezza del dispositivo monouso rimangano equivalenti a quelle del dispositivo monouso d’origine dopo ogni ciclo di ricondizionamento e fino al numero massimo consentito di cicli di ricondizionamento.
5. Il ciclo di ricondizionamento è monitorato mediante periodici test di routine e controlli della contaminazione, monitoraggi fisici, elettrici, chimici e biologici e verifiche dei parametri di processo e della calibrazione.
6. Il dispositivo monouso ricondizionato è rilasciato dopo che è stato confermato che le fasi di pulizia, disinfezione e sterilizzazione e i test pertinenti secondo i casi assicurano che il ciclo di ricondizionamento è stato completato conformemente alle prescrizioni applicabili a tale ciclo.
Articolo 8 Numero massimo di cicli di ricondizionamento
1. Ciascun ricondizionamento conforme all’articolo 11 è conteggiato come un unico ciclo di ricondizionamento. Ogni ciclo di ricondizionamento di un dispositivo monouso è conteggiato per determinare il numero massimo di cicli di ricondizionamento, anche qualora un dispositivo monouso non sia stato riutilizzato su un paziente in seguito al ricondizionamento.
2. L’istituzione sanitaria, se applicabile insieme al ricondizionatore esterno, stabilisce il numero massimo di cicli di ricondizionamento che possono essere applicati al dispositivo monouso ricondizionato durante i quali le prestazioni e la sicurezza di tale dispositivo rimangono equivalenti a quelle del dispositivo monouso d’origine.
3. Una volta raggiunto il numero massimo di cicli di ricondizionamento, il dispositivo monouso ricondizionato è smaltito.
Articolo 9 Documentazione tecnica
1. Il ricondizionatore dispone di una documentazione tecnica sulle sue attività di ricondizionamento che comprende:
a) le procedure di controllo e monitoraggio periodico dei locali e delle attrezzature di cui all’articolo 4, paragrafi 5 e 6;
b) qualsiasi decisione relativa al fatto di essere in grado o meno di ricondizionare un tipo di dispositivo monouso.
2. Il ricondizionatore dispone anche di una documentazione tecnica specifica per ciascun modello di dispositivo monouso, fabbricato dallo stesso fabbricante, quale identificato dal suo identificativo del dispositivo nel sistema di identificazione unica del dispositivo («UDI-DI»). La documentazione tecnica comprende:
a) i risultati della determinazione del ciclo e delle procedure di ricondizionamento di cui all’articolo 7;
b) le azioni da intraprendere nel caso in cui una o più fasi del ciclo di ricondizionamento non siano state eseguite.
3. La documentazione tecnica specifica per ciascun modello di dispositivo monouso fabbricato dallo stesso fabbricante, quale identificato dal suo UDI-DI, conservata dalle istituzioni sanitarie comprende altresì:
a) i risultati della valutazione dell’idoneità del dispositivo monouso al ricondizionamento di cui all’articolo 5 e i dati e le informazioni utilizzati per stabilire che la sicurezza e le prestazioni del dispositivo ricondizionato saranno equivalenti a quelle del dispositivo monouso d’origine;
b) i risultati del processo di monitoraggio di cui all’articolo 6;
c) la descrizione del sistema di tracciabilità del dispositivo monouso dal primo utilizzo fino al suo ultimo riutilizzo;
d) la descrizione del sistema di segnalazione di incidenti gravi conformemente all’articolo 23;
e) la descrizione del sistema di identificazione e di smaltimento del dispositivo monouso in caso di mancata conformità ad aspetti di funzionalità, prestazioni o sicurezza prima o durante il riutilizzo.
4. La documentazione tecnica è conservata per 10 anni dopo l’ultimo riutilizzo del dispositivo monouso.
... Segue in allegato
Collegati:
[box-note]MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)[/box-note]
RAPEX Report 31 del 31/07/2020 N. 27 A11/00068/20 Irlanda

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 31 del 31/07/2020 N. 27 A11/00068/20 Irlanda
Approfondimento tecnico: Computer portatile
Il prodotto MacBook Pro, di marca Apple, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme alla Direttiva 2014/35/UE del Parlamento Europeo e del Consiglio del 16 aprile 2014 concernente l'armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato di apparecchiature radio e che abroga la direttiva 1999/5/CE.
Pagina di richiamo di Apple: https://support.apple.com/en-ie/15-inch-macbook-pro-battery-recall
La batteria può surriscaldarsi e di conseguenza può provocare ustioni o un incendio.
Direttiva 2014/35/UE
Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 31 del 31_07_2020 N. 27 A11_00068_20 Irlanda.pdf Computer portatile |
136 kB | 0 |
Faq Unique Device Identification (UDI) System
Faq Unique Device Identification (UDI) System
EC, 11.08.2020
The existing regulatory framework on medical devices dates back to the 1990s and consists of three Directives. Two new Regulations (Regulation (EU) 745/2017 on medical devices and Regulation (EU) 746/2017 on In Vitro diagnostic medical devices) were adopted in April 2017 and entered into force on 25 May 2017. The general application dates of the two Regulations are 26 May 2021 for medical devices and 26 May 2022 for In Vitro diagnostic medical devices, though different timelines apply for certain specific provisions.
These Regulations introduce an EU identification system for medical devices based on a Unique Device Identifier (UDI).
The UDI system will facilitate easier traceability of medical devices, significantly enhance the effectiveness of the post-market safety-related activities for devices and allow for better monitoring by competent authorities. It will also help to reduce medical errors and to fight against falsified devices. The use of the UDI system finally should also improve purchasing and waste disposal policies and stock-management by health institutions and other economic operators.
The new system will be applied to all medical devices except custom-made and performance study/investigational devices and is substantially based on internationally recognised principles, notably by using definitions that are compatible with those used by major trade partners
Article 27 of Regulation (EU) 2017/745 (‘MDR’) and Article 24 of Regulation (EU) 2017/746 (‘IVDR’) lay down that the UDI system shall consist of:
[alert]a. the production of a UDI that comprises a UDI device identifier (‘UDI-DI’) specific to a manufacturer and a device, providing access to the information, and a UDI production identifier (‘UDI-PI’) that identifies the unit of device production and if applicable the packaged devices, as specified in Part C of Annex VI;
b. the placing of the UDI carrier on the label of the device or on its packaging or in case of reusable devices on the device itself (direct marking);
c. the storage of the UDI by economic operators, health institutions and healthcare professionals, in accordance with the conditions laid down in paragraphs 8 and 9, respectively, of the Articles;
d. the establishment of an electronic database for Unique Device Identification (the ‘UDI database’), which is part of the Eudamed database, in accordance with Article 28 of MDR and Article 25 of IVDR.[/alert]
In accordance with the new rules, any manufacturer shall thus assign a unique UDI to a device and to all higher levels of packaging before placing that device on the market except custom-made medical devices and performance study/investigational devices.
The UDI carrier shall be placed on the label of the device and on all higher levels of packaging and in case of reusable devices on the device itself (direct marking). The manufacturer shall also ensure that the information – related to the device in question - referred to in Part B and Part A, Section 2, of Annex VI of the relevant Regulation, is correctly submitted to the European Database on Medical Devices (Eudamed) as required by Article 27(3) of MDR and Article 24(3) of IVDR. The manufacturer shall also maintain unique UDIs for its devices.
NOTE: Timelines related to those obligations are indicated under question 6 of this document.
Within the EU, the manufacturer shall assign to their devices, together with a UDI, also a Basic UDI-DI, which is not yet required by other jurisdictions. The Basic UDI-DI is the main key in Eudamed and relevant documentation (e.g. certificates, declaration of conformity, technical documentation and summary of safety and clinical performance) and will also be the access key for device-related information entered in the database.
UDI issuing entities designated by the European Commission operate a system for the assignment of UDI in the EU
[panel]1. What is the UDI?
The UDI is a series of numeric or alphanumeric characters that is created through a globally accepted device identification and coding standard. It allows the unambiguous identification of a specific medical device on the market. The UDI is comprised of the UDI-DI and UDI-PI. The unique identifier may include information on the lot or serial number and be able to be applied anywhere in the world.
The production of a UDI comprises the following:
• A UDI device identifier (‘UDI-DI’) specific to a device, providing access to the information laid down in Part B of Annex VI.
• A UDI production identifier (‘UDI-PI’) that identifies the unit of device production and if applicable the packaged devices, as specified in Part C of Annex VI.
2. What is the Basic UDI-DI?
The Basic UDI-DI is the main access key for device-related information in the Eudamed database and it is referenced in relevant documentation [e.g. certificates (including certificate of free sale), EU declaration of conformity, technical documentation and summary of safety and (clinical) performance)].
It is intended to identify and connect devices with the same intended purpose, risk class and essential design and manufacturing characteristics.
It is independent/separate from the packaging/labelling of the device and it does not appear on any trade item.
Any Basic UDI-DI shall identify the devices (group) covered by that Basic UDI-DI in a unique manner.
MDCG 2018-1 v3 guidance provides additional information on Basic UDI-DI.
3. Which products are subject to the UDI system?
The UDI system should apply to all devices, except custom-made and performance study/investigational devices.
4. Who is responsible for placing the UDI carrier on the device itself, on the label and on the package of a device?
The manufacturer is responsible for complying with all UDI related requirements. This includes the assignment of the UDI (and Basic UDI-DI), the UDI (and Basic UDI-DI) registration in the Eudamed database and the placement of the UDI carrier on the label of the device or on its packaging or, in case of reusable devices, on the device itself (direct marking).
4.1 What happens in the case of Article 16 of the MDR and IVDR? Which obligations do economic operators have regarding UDI when assuming obligation incumbent on manufacturers per Article 16 of the MDR and IVDR?
Any distributor, importer or other natural or legal person that assumes the obligations incumbent on manufacturers in accordance with Article 16(1), assumes all the relevant responsibilities related to UDI, including UDI labelling.
The distributor or importer carrying out the operations described in Article 16(2) (providing translation or repackaging of devices) shall ensure that:
• the activities are performed by means and under conditions that in no way compromise the readability of the UDI carrier and its information identifying the actual device.
• the specific procedures are part of the distributor’s or importer’s quality management system. A dedicated guideline with additional information on this aspect is available at the MDCG 2018-6 guidance document.[/panel]
... Segue in allegato
Collegati:
[box-note]Regolamento (UE) 2017/745
Raccolta Linee guida MEDDEV Dispositivi medici
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
UDI for Medical Devices Used in the Gas Industry
UDI-DI Formati e caratteristiche | EU 2019[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Faq Unique Device Identification UDI System.pdf EC 11.08.2020 |
422 kB | 14 |
IEC 60601 Medical electrical equipment
IEC 60601-1-X Medical electrical equipment
ID 11296 | State 08.2020
Stato e Preview allegati delle norme tecniche generali per apparecchi elettromedicali.
IEC 60601 è una serie di norme tecniche per la sicurezza e le prestazioni essenziali degli apparecchi elettromedicali, pubblicate dalla Commissione elettrotecnica internazionale.
Pubblicate per la prima volta nel 1977 e regolarmente aggiornate e ristrutturate, a partire dal 2011 sono attualmente costituite da uno standard generale IEC 60601-1, 8 standard collaterali (IEC 60601-1-X) e 80 standard particolari/performance ca (IEC 60601-2-X, IEC 60601-3-X).
[box-note]IEC 60601-x-xx Example
The IEC 60601-1-xx series of collateral standards for MEDICAL DEVICE ELECTRICAL EQUIPEMENT
The IEC 60601-2-xx series of particular standards for particular types of MEDICAL ELECTRICAL EQUIPMENT
The IEC 60601-3-xx series of performance standards for particular types of MEDICAL ELECTRICAL EQUIPEMNT[/box-note]
La norma generale IEC 60601-1 - Apparecchi elettromedicali - Parte 1: Requisiti generali per la sicurezza di base e le prestazioni essenziali - stabilisce i requisiti generali della serie di norme. IEC 60601-1 è un punto di riferimento ampiamente accettato per le apparecchiature elettromedicali e la conformità a IEC 60601-1 è diventata un requisito per la commercializzazione di apparecchiature elettromedicali in molti paesi (in UE la norma è armonizzata per la Direttiva Dispositivi medici 93/42/CEE e il Regolamento Dispositivi medici (UE) 2017/745 che prevedono la marcatura CE).
La conformità a IEC 60601-1, è per le aziende di apparecchi elettromedicali, un requisito per la maggior parte dei mercati. Questo standard non garantisce l'efficacia di un dispositivo medico. Negli Stati Uniti, la FDA richiede prove di efficacia confermate tramite un'approvazione pre-mercato (PMA-Premarket Approval)(1) o similare ad un dispositivo già autorizzato tramite una notifica pre-mercato 510 (k) (Premarket Notification 510(k)(2).
(1) Premarket approval (PMA) is the FDA process of scientific and regulatory review to evaluate the safety and effectiveness of Class III medical devices, and the most stringent of the device marketing applications. Class III devices are those that support or sustain human life, are of substantial importance in preventing impairment of human health, or which present a potential, unreasonable risk of illness or injury. Due to the level of risk associated with Class III devices, FDA has determined that general and special controls alone are insufficient to assure the safety and effectiveness of Class III devices. Therefore, these devices require a premarket approval (PMA) application under section 515 of the FD&C Act in order to obtain marketing clearance. Please note that some Class III preamendment devices may require a Class III 510(k). PMA applications will include technical sections, usually divided into non-clinical laboratory studies and clinical investigations. PMA approval typically requires a facility inspection to confirm compliance to 21 CFR 820 prior to approval.
(2) A 510(k) is the technical dossier required by the US Food and Drug Administration (FDA) to sell a medium-risk medical device or IVD in the United States. It is formally called a Pre-market Notification. A 510(k) contains detailed technical, safety, and performance information about a medical device. The documentation must demonstrate the device in question is "substantially equivalent" to a predicate device (i.e. a product already cleared for sale in the US). The FDA must review the 510(k) and "clear" your device before you can legally sell or distribute it in the United States.
510(k) submissions are required for most Class II (as well as some Class I and Class III) medical devices and IVDs. If you cannot determine the classification for your product, you can submit a 513(g), which is a written request to the FDA seeking classification confirmation.
Each person who wants to market in the U.S., a Class I, II, and III device intended for human use, for which a Premarket Approval (PMA) is not required, must submit a 510(k) submission to FDA unless the device is exempt from 510(k) requirements of the Federal Food, Drug, and Cosmetic Act (the Act) and does not exceed the limitations of exemptions in part .9 of the device classification regulation chapters (e.g., 21 CFR 862.9, 21 CFR 864.9). A 510(k) is a premarket submission made to FDA to demonstrate that the device to be marketed is at least as safe and effective (substantially equivalent) to a legally marketed device that is not subject to PMA. Submitters must compare their device to one or more similar legally marketed devices (predicates) and make and support their substantial equivalency claims. Until the submitter receives an order declaring a device SE, the submitter may not proceed to market the device. Once the device is determined to be SE, it can then be marketed in the U.S.
IEC Serie
IEC 60601-1:2005+AMD1:2012 (Armonizzzata MD)
IEC 60601-1-2:2014 (Armonizzzata MD)
IEC 60601-1-3:2008+AMD1:2013 (Armonizzzata MD)
IEC 60601-1-4:1996 (Ritirata)
IEC 60601-1-6:2010+AMD1:2013+AMD2:2020 (Armonizzzata MD)
IEC 60601-1-8:2006+AMD1:2012+AMD2:2020 (Armonizzzata MD)
IEC 60601-1-9:2007+AMD1:2013+AMD2:2020 (Non Armonizzzata MD)
IEC 60601-1-10:2007+AMD1:2013+AMD2:2020 (Armonizzzata MD)
IEC 60601-1-11:2015+AMD1:2020 (Armonizzzata MD)
IEC 60601-1-12:2014+AMD1:2020 (Non Armonizzzata MD)
IEC TR 62348:2012
IEC 60601-1:2005+AMD1:2012
Medical electrical equipment - Part 1: General requirements for basic safety and essential performance
IEC 60601-1:2005+A1:2012 contains requirements concerning basic safety and essential performance that are generally applicable to medical electrical equipment. For certain types of medical electrical equipment, these requirements are either supplemented or modified by the special requirements of a collateral or particular standard. Where particular standards exist, this standard should not be used alone. This consolidated version consists of the third edition (2005) and its amendment 1 (2012). Therefore, there is no need to order the amendment in addition to this publication. This document includes the contents of the corrigenda 1 (2006) and 2 (2007), the contents of the corrigendum to Amendment 1 (2014), as well as the interpretation sheets 1 (2008), 2 (2009) and 3 (2013).
IEC 60601-1-2:2014
Medical electrical equipment - Part 1-2: General requirements for basic safety and essential performance - Collateral Standard: Electromagnetic disturbances - Requirements and tests
IEC 60601-1-2:2014 applies to the basic safety and essential performance of Medical Equipment (ME) equipment and ME systems in the presence of electromagnetic disturbances and to electromagnetic disturbances emitted by me equipment and me systems. This collateral standard to IEC 60601-1 specifies general requirements and tests for basic safety and essential performance with regard to electromagnetic disturbances and for electromagnetic emissions of ME equipment and ME systems. They are in addition to the requirements of the general standard IEC 60601-1 and serve as the basis for particular standards. This fourth edition cancels and replaces the third edition of IEC 60601-1-2, and constitutes a technical revision. The most significant changes with respect to the previous edition include the following modifications:
- specification of immunity test levels according to the environments of intended use, categorized according to locations that are harmonized with IEC 60601-1-11: the professional healthcare facility environment, the home healthcare environment and special environments;
- specification of tests and test levels to improve the safety of medical electrical equipment and medical electrical systems when portable RF communications equipment is used closer to the medical electrical equipment than was recommended based on the immunity test levels that were specified in the third edition;
- specification of immunity tests and immunity test levels according to the ports of the medical electrical equipment or medical electrical system;
- specification of immunity test levels based on the reasonably foreseeable maximum level of electromagnetic disturbances in the environments of intended use, resulting in some immunity test levels that are higher than in the previous edition; and
- better harmonization with the risk concepts of basic safety and essential performance, including deletion of the defined term "life-supporting". This new edition includes the following main additions:
- guidance for determination of immunity test levels for special environments;
- guidance for adjustment of immunity test levels when special considerations of mitigations or intended use are applicable;
- guidance on risk management for basic safety and essential performance with regard to electromagnetic disturbances; and
- guidance on identification of immunity pass/fail criteria.
IEC 60601-1-3:2008+AMD1:2013
Medical electrical equipment - Part 1-3: General requirements forbasic safety and essential performance - Collateral Standard: Radiation protection in diagnostic X-ray equipment
IEC 60601-1-3:2008+A1:2013 applies to X-ray equipment and to subassemblies of such equipment, where radiological images of a human patient are used for diagnosis, planning or guidance of medical procedures. The object of this collateral standard is to establish general requirements for protection against X-radiation in X-ray equipment, in order that the irradiation of the human patient, the operator, staff and members of the public can be kept as low as reasonably achievable, without jeopardizing the benefit of the radiological procedure. Particular standards may specify their appropriate values and/or measures for general requirements specified in this collateral standard. The implementation of the general requirements or the reference to the particular standard instead, shall be justified in the risk management process. This collateral standard considers radiation protection aspects related to X-radiation only. Requirements for the control of the electrical energy used to generate X-radiation, which is also an important aspect of radiation protection, are included in IEC 60601-1 and in particular standards for the safety and essential performance of the equipment concerned. This document cancels and replaces the first edition of IEC 60601-1-3, published in 1994 (which replaced IEC 60407 issued in 1973). It constitutes a technical revision. This edition has been restructured and aligned to IEC 60601-1(2005) and focussed on general requirements for RADIATION PROTECTION that apply to all diagnostic X-RAY EQUIPMENT. Requirements particular to specific equipment have been removed and will be covered in particular standards. For a description of the changes, see the mapping in Annex C. This consolidated version consists of the second edition (2008) and its amendment 1 (2013). Therefore, no need to order amendment in addition to this publication.
IEC 60601-1-6:2010+AMD1:2013+AMD2:2020
Medical electrical equipment - Part 1-6: General requirements for basic safety and essential performance - Collateral standard: Usability
IEC 60601-1-6:2010+A1:2013+A2:2020 specifies a process for a manufacturer toanalyse, specify, design, verify and validate usability, as it relates to basic safety and essential performance of medical electrical equipment. This usability engineering process assesses and mitigates risks caused by usability problems associated with correct use and use errors, i.e., normal use. It can be used to identify but does not assess or mitigate risks associated with abnormal use. If the usability engineering process detailed in this collateral standard has been complied with and the acceptance criteria documented in the usability validation plan have been met (see 5.9 of IEC 62366:2007), then the residual risks, as defined in ISO 14971, associated with usability of me equipment are presumed to be acceptable, unless there is objective evidence to the contrary (see 4.1.2 of IEC 62366:2007). The object of this collateral standard is to specify general requirements that are in addition to those of the general standard and to serve as the basis for particular standards. This document cancels and replaces the second edition of IEC 60601-1-6 which has been technically revised. It was revised to align with the usability engineering process in IEC 62366. To allow for equipment manufacturers and testing organizations to make products and to equip themselves for conducting revised tests in accordance with this third edition, it is recommended by SC 62A that the content of this document not be adopted for mandatory implementation earlier than 3 years from the date of publication for equipment newly designed and not earlier than 5 years from the date of publication for equipment already in production. This consolidated version consists of the third edition (2010), its amendment 1 (2013) and its amendment 2 (2020). Therefore, no need to order amendments in addition to this publication
IEC 60601-1-8:2006+AMD1:2012+AMD2:2020
Medical electrical equipment - Part 1-8: General requirements for basic safety and essential performance - Collateral Standard: General requirements, tests and guidance for alarm systems in medical electrical equipment and medical electrical systems
IEC 60601-1-8:2006+A1:2012+A2:2020 Specifies basic safety and essential performance requirements and tests for alarm systems in medical electrical equipment and medical electrical systems and to provide guidance for their application. This is accomplished by defining alarm categories (priorities) by degree of urgency, consistent alarm signals and consistent control states and their marking for all alarm systems. This consolidated version consists of the second edition (2006), its amendment 1 (2012) and its amendment 2 (2020). Therefore, no need to order amendments in addition to this publication.
IEC 60601-1-9:2007+AMD1:2013+AMD2:2020
Medical electrical equipment - Part 1-9: General requirements for basic safety and essential performance - Collateral Standard: Requirements for environmentally conscious design
IEC 60601-1-9:2007+A1:2013+A2:2020 The objective of this collateral standard is to improve the environmental impact for the entire range of medical electrical equipment, taking into account all stages of the product life cycle:
- product specification;
- design;
- manufacturing;
- sales, logistics, installation;
- use;
- end of life management. This means protecting the environment and human health from hazardous substances, conserving raw materials and energy, minimizing the generation of waste, as well as minimizing the adverse environmental impacts associated with waste. The criteria needed to reach this goal must be integrated into all stages of the medical electrical equipment life cycle from the specification stage to end of life management. The environmental impacts of me equipment through all life-cycle stages are determined from the medical electrical equipment's environmental aspects defined during the identification of need, product planning, and design stages. Consideration of environmental aspects as early as possible in these stages can produce numerous benefits that might include lower costs, stimulation of innovation and creativity, and increased knowledge about the product. It can also provide new business opportunities, and improved product quality as well as reduction of adverse environmental impacts. The assessment of the environmental aspects and impacts of medical electrical equipment is a developing science and it is anticipated that this collateral standard will require periodic updating as the science develops. The requirements given in this collateral standard do not replace national or international laws and regulations. Environmental protection is one element of the overall risk management process as required by the general standard. The acceptability of medical electrical equipment's environmental impacts are balanced against other factors, such as the product's intended function, performance, safety, cost, marketability, quality, legal and regulatory requirements. This balance can differ depending on the intended function of the medical electrical equipment. For example, a solution appropriate for life-saving or life-supporting medical electrical equipment might not be appropriate for a device intended to correct a minor ailment. A manufacturer of medical electrical equipment might have to justify, as a result of risk management, that a medical benefit outweighs the associated adverse environmental impacts. This consolidated version consists of the first edition (2007), its amendment 1 (2013) and its amendment 2 (2020). Therefore, no need to order amendments in addition to this publication.
IEC 60601-1-10:2007+AMD1:2013+AMD2:2020
Medical electrical equipment - Part 1-10: General requirements for basic safety and essential performance - Collateral Standard: Requirements for the development of physiologic closed-loop controllers
IEC 60601-1-10:2007+A1:2013+A2:2020 Specifies requirements for the development (analysis, design, verification and validation) of a physiologic closed-loop controller (PCLC) as part of a physiologic closed-loop control system (PCLCS) in medical electrical equipment and medical electrical systems to control a physiologic variable. This collateral standard applies to various types of PCLC, e.g. linear and non-linear, adaptive, fuzzy, neural networks. This collateral standard applies to a closed-loop controller that sets the controller output variable in order to adjust (i.e., change or maintain) the measured physiologic variable by relating it to the reference variable. This consolidated version consists of the first edition (2007), its amendment 1 (2013) and its amendment 2 (2020). Therefore, no need to order amendments in addition to this publication.
IEC 60601-1-11:2015+AMD1:2020
Medical electrical equipment - Part 1-11: General requirements for basic safety and essential performance - Collateral Standard: Requirements for medical electrical equipment and medical electrical systems used in the home healthcare environment
- the dwelling place in which a patient lives;
- other places where patients are present both indoors and outdoors, excluding professional healthcare facility environments where operators with medical training are continually available when patients are present.
This second edition cancels and replaces the first edition of IEC 60601-1-11, published in 2010, and constitutes a technical revision. The most significant changes with respect to the previous edition include the following modifications:
- correction of test method for relative humidity control at temperatures above 35 °C;
- redrafting of subclauses that altered instead of adding to the general standard or other collateral standards; and
- harmonizing with the changes to the amendments to the general standard and other collateral standards.
This consolidated version consists of the second edition (2015) and its amendment 1 (2020). Therefore, no need to order amendment in addition to this publication.
IEC 60601-1-12:2014+AMD1:2020
Medical electrical equipment - Part 1-12: General requirements for basic safety and essential performance - Collateral Standard: Requirements for medical electrical equipment and medical electrical systems intended for use in the emergency medical services environment
IEC 60601-1-12:2014+A1:2020 constitutes a collateral standard to IEC 60601-1: Medical electrical equipment - Part 1: General requirements for basic safety and essential performance hereafter referred to as the general standard. Medical practice is increasingly using medical electrical equipment and medical electrical systems for monitoring, treatment or diagnosis of patients in the emergency medical services environment. The safety of medical electrical equipment in this uncontrolled, rough environment is a cause for concern. This collateral standard was developed with contributions from clinicians, engineers and regulators. The terminology, requirements, general recommendations and guidance of this collateral standard are intended to be useful for manufacturers of medical electrical equipment and medical electrical systems and for technical committees responsible for the development of particular standards. This International Standard applies to the basic safety and essential performance of medical electrical equipment and medical electrical systems, hereafter referred to as ME equipment and ME systems, which are intended, as indicated in the instructions for use by their manufacturer, for use in the EMS environment (Emergency Medical Services environment). The object of this collateral standard is to provide general requirements for ME equipment and ME systems carried to the scene of an emergency and used there, as well as in transport, in situations where the ambient conditions differ from indoor conditions. The object of this collateral standard is to specify general requirements that are in addition to those of the general standard and to serve as the basis for particular standards. This consolidated version consists of the first edition (2014) and its amendment 1 (2020). Therefore, no need to order amendment in addition to this publication.
IEC TR 62348:2012
Assessment of the impact of the most significant changes in Amendment 1 to IEC 60601-1:2005 and mapping of the clauses of IEC 60601-1:2005 to the previous edition
IEC/TR 62348:2012(E) which is a technical report, provides a tool to assist users of IEC 60601-1:2005 to assess the impact of the most significant changes in Amendment 1:2012. This technical report also provides a tool to assist users of IEC 60601-1 to trace requirements between the third edition and their source in the documents that form the basis of the third edition; principally the second edition as amended. This report is intended to be used by:
- those who must align standards based on the second edition of IEC 60601-1 with the third edition as amended;
- manufacturers of medical electrical equipment or medical electrical systems; and
- health care regulatory authorities, test houses and other organizations responsible for implementing standards for medical electrical equipment and medical electrical systems. This second edition cancels and replaces the first edition published in 2006. The second edition retains the mapping that traces the requirements of IEC 60601-1:2005 and its Amendment A1:2012 (Edition 3.1) from their source in the documents that relate to IEC 60601-1:1998 and its amendments (Edition 2.2). The second edition adds an assessment of the impact of the most significant changes in Amendment 1:2012.
...
segue in allegato
Certifico Srl - IT | Rev. 00.2020
©Copia autorizzata Abbonati
Collegati
[box-note]Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Dichiarazione di conformità UE Regolamento (UE) 2017/745
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Linee guida Regolamento Medical Devices (UE) 2017/745
Direttiva Dispositivi medici 93/42/CEE[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| IEC 60601 Medical electrical equipment Rev. 00 2020.pdf Certifico Srl - Rev. 0.0 2020 |
180 kB | 40 | ||
| IEC 60601-1-1 Preview.pdf IEC 2012 |
2132 kB | 11 | ||
| IEC 60601-1-2 Preview.pdf IEC 2014 |
533 kB | 8 | ||
| IEC 60601-1-3 Preview.pdf IEC 2013 |
336 kB | 8 | ||
| IEC 60601-1-6 Preview.pdf IEC 2020 |
1185 kB | 9 | ||
| IEC 60601-1-8 Preview.pdf IEC 2020 |
1069 kB | 10 | ||
| IEC 60601-1-9 Preview.pdf IEC 2020 |
1127 kB | 9 | ||
| IEC 60601-1-10 Preview.pdf IEC 2020 |
1232 kB | 9 | ||
| IEC 60601-1-11 Preview.pdf IEC 2020 |
1334 kB | 14 | ||
| IEC 60601-1-12 Preview.pdf IEC 2020 |
1162 kB | 11 | ||
| IEC TR 62348 Preview.pdf IEC 2012 |
292 kB | 8 |
RAPEX Report 28 del 10/07/2020 N. 04 A12/01010/20 Francia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 28 del 10/07/2020 N. 04 A12/01010/20 Francia
Approfondimento tecnico: Disinfettante per le mani
Il prodotto, di marca ON DERMO, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio del 16 dicembre 2008 relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le Direttive 67/548/CEE e 1999/45/CE e che reca modifica al Regolamento (CE) n. 1907/2006.
Il prodotto contiene una quantità insufficiente di etanolo e propan-2-olo (valori misurati: ≤ 50% e ≤ 6%, rispettivamente). Di conseguenza, non uccide batteri o virus, che potrebbero quindi infettare l’utilizzatore.
Inoltre, la presenza di alcoli non è accompagnata dai pittogrammi e dalle avvertenze di pericolo appropriati. Pertanto, gli utenti non hanno informazioni sulla tossicità e sull'infiammabilità del prodotto, che in presenza di una fonte di innesco potrebbe provocare un incendio.
Titolo III Regolamento (CE) n. 1272/2008
Comunicazione dei pericoli per mezzo dell'etichettatura
Capo I
Contenuto dell’etichetta
Articolo 17 Disposizioni generali
1. Una sostanza o miscela classificata come pericolosa e contenuta in un imballaggio è provvista di un'etichetta in cui figurano gli elementi seguenti:
a) nome, indirizzo e numero di telefono del fornitore o dei fornitori;
b) la quantità nominale della sostanza o miscela contenuta nel collo messo a disposizione dal pubblico, se tale quantità non è indicata altrove nel collo;
c) gli identificatori del prodotto specificati all'articolo 18;
d) se del caso, i pittogrammi di pericolo conformemente all'articolo 19;
e) se del caso, le avvertenze conformemente all'articolo 20;
f) se del caso, le indicazioni di pericolo conformemente all'articolo 21;
g) se del caso, gli opportuni consigli di prudenza conformemente all'articolo 22;
h) se del caso, una sezione per informazioni supplementari conformemente all'articolo 25.
2. L'etichetta è scritta nella lingua o nelle lingue ufficiali dello Stato membro o degli Stati membri in cui la sostanza o miscela è immessa sul mercato salvo altrimenti previsto dallo Stato membro o dagli Stati membri in questione.
I fornitori possono utilizzare nell'etichetta più lingue di quelle prescritte dagli Stati membri, purché in tutte le lingue utilizzate siano riportate le stesse informazioni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 28 del 10_07_2020 N. 04 A12_01010_20 Francia.pdf Disinfettante per le mani |
359 kB | 0 |
Regolamento delegato (UE) 2020/1059
Regolamento delegato (UE) 2020/1059
Regolamento delegato (UE) 2020/1059 della Commissione del 27 aprile 2020 che rettifica alcune versioni linguistiche dei regolamenti delegati (UE) n. 1059/2010, (UE) n. 1060/2010, (UE) n. 1061/2010, (UE) n. 1062/2010, (UE) n. 626/2011, (UE) n. 392/2012 e (UE) n. 874/2012 per quanto attiene all’etichettatura di alcuni prodotti connessi all’energia
GU L 232/28 del 20.07.2020
_____
Collegati:
[box-note]Regolamento delegato (UE) n. 1059/2010
Regolamento delegato (UE) n. 1061/2010
Regolamento Delegato (UE) N. 392/2012
Regolamento delegato (UE) 874/2012 della Commissione del 12 Luglio 2012[/box-note]
RAPEX Report 27 del 03/07/2020 N. 03 A12/00950/20 Irlanda

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 27 del 03/07/2020 N. 03 A12/00950/20 Irlanda
Approfondimento tecnico: Filo per saldatura
Il prodotto, di marca ibero, mod. 41068, 5K394, è stato respinto alla frontiera perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006 , concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una quantità eccessiva piombo (valori dichiarato: 40% in peso) e non è correttamente etichettato per l'uso limitato da parte di professionisti.
Il piombo è dannoso per la salute umana, si accumula nel corpo, può causare neurotossicità per lo sviluppo e può anche interessare i bambini allattati al seno o non ancora nati.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
63. Piombo
[…]7. Da non immettere sul mercato o usare negli articoli forniti al pubblico se in tali articoli, o in loro parti accessibili, la concentrazione di piombo (espressa in metallo) è uguale o superiore allo 0,05 % in peso e, in condizioni d'uso normali o ragionevolmente prevedibili, tali articoli o loro parti accessibili possano essere messi in bocca dai bambini.
Tale limite non si applica nei casi in cui si possa dimostrare che il tasso di cessione del piombo da un siffatto articolo o da una parte accessibile di un articolo (rivestito o no) non supera 0,05 μg/cm2 all'ora (equivalente a 0,05 μg/g/h) e, per gli articoli rivestiti, che il rivestimento è sufficiente a garantire che detto tasso di cessione non è superato per un periodo di almeno due anni in condizioni d'uso dell'articolo normali o ragionevolmente prevedibili.
Ai fini del presente paragrafo si ritiene che un articolo o una parte accessibile di un articolo possano essere messi in bocca dai bambini se hanno una dimensione inferiore ai 5 cm o se presentano una parte staccabile o sporgente di tale dimensione.
8. A titolo di deroga, il paragrafo 7 non si applica:
a. agli articoli di gioielleria di cui al paragrafo 1;
b. al vetro cristallo quale definito all'allegato I (categorie 1, 2, 3 e 4) della direttiva 69/493/CEE;
c. alle pietre preziose e semipreziose non sintetiche o ricostituite [codice NC 7103 istituito dal regolamento (CEE) n. 2658/87], eccetto quelle trattate con piombo o suoi composti o con miscele contenenti tali sostanze;
d. agli smalti, definiti come miscele vetrificabili risultanti dalla fusione, dalla vetrificazione o dalla sinterizzazione di minerali fusi ad una temperatura di almeno 500 °C;
e. alle chiavi e alle serrature, compresi i lucchetti;
f. agli strumenti musicali;
g. agli articoli e alle parti di articoli contenenti leghe di ottone, se la concentrazione di piombo (espressa in metallo) nella lega di ottone non supera lo 0,5 % in peso;
h. alle punte per strumenti di scrittura;
i. articoli religiosi;
j. alle pile portatili zinco-carbone e alle pile a bottone;
k. agli articoli rientranti nel campo di applicazione:
i) della direttiva 94/62/CE;
ii) del regolamento (CE) n. 1935/2004;
iii) della direttiva 2009/48/CE del Parlamento europeo e del Consiglio;
iv) della direttiva 2011/65/UE del Parlamento europeo e del Consiglio.[…]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 27 del 03_07_2020 N. 01 A12_00950_20 Irlanda.pdf Filo per saldatura |
130 kB | 1 |
EN IEC IEEE 82079-1:2020 | Istruzioni per l’uso di un prodotto
EN IEC IEEE 82079-1:2020 | Istruzioni per l’uso di un prodotto
ID 11177 | Rev. 1.0 del 19.05.2025 / Documento di approfondimento in allegato
La norma EN IEC IEEE 82079 fornisce principi e requisiti generali per la redazione delle informazioni per l'uso dei prodotti. Le informazioni per l'uso sono:
- necessarie per l'uso sicuro di un prodotto;
- utili per l'uso efficiente ed efficace di un prodotto; e
- spesso necessarie per adempiere agli obblighi di mercato, legali e regolamentari.
[box-note]Rev. 1.0 2025
Aggiornamento in accordo alla versione in lingua italiana della norma CEI UNI EN IEC/IEEE 82079-1.[/box-note]
I prodotti per cui può essere presa come riferimento questa norma includono, ad esempio:
[panel]- prodotti industriali (ad esempio macchine, componenti, dispositivi e apparecchiature);
- prodotti di consumo (ad esempio apparecchi elettrodomestici, dispositivi audio video, dispositivi di comunicazione e prodotti fai-da-te);
- dispositivi, apparecchiature e sistemi medici;
- sistemi complessi contenuti all’interno di altri sistemi (ad esempio impianti industriali, raffinerie, siti di produzione e data center);
- mezzi di trasporto (ad esempio automobili, camion, navi e aeroplani);
- software applicativi (ad esempio software per ufficio e applicazioni web);
- software per il funzionamento e controllo automatico dei sistemi; e
- servizi tecnici.[/panel]
[box-info]IEC/IEEE 82079-1:2019 - Preparation of information for use (instructions for use) of products - Part 1: Principles and general requirements (Data di pubblicazione: 20 Maggio 2019)
EN IEC/IEEE 82079-1:2020 - Preparation of information for use (instructions for use) of products - Part 1: Principles and general requirements (Data di pubblicazione: 10 Marzo 2020)
CEI UNI EN IEC/IEEE 82079-1 - Preparazione di informazioni per l’uso (istruzioni per l’uso) dei prodotti - Parte 1: Principi e prescrizioni generali (CEI: 3-65) (Data di pubblicazione: Agosto 2021)) - Versione in lingua Italiana[/box-info]
Le informazioni per l’uso dei prodotti si applicano alle fasi del ciclo di vita del prodotto, come trasporto, assemblaggio, installazione, messa in servizio, funzionamento, monitoraggio, troubleshooting, manutenzione, riparazione, dismissione e smaltimento, e alle specifiche attività svolte da personale qualificato e non qualificato.
La norma EN IEC IEEE 82079 si applica alle informazioni per l’uso fornite come prodotti informativi, sia in formato elettronico che cartaceo, ad esempio:
[panel]- informazioni per l’ assistenza alle macchine, fornite come PDF da scaricare via web e ad uso dei tecnici qualificati per l’assistenza;
- informazioni per l’uso dei software, fornite in formato elettronico insieme al software come help online;
- informazioni per il troubleshooting ad uso dell’ operatore, visibili sul display della macchina; - descrizione sul funzionamento di un dispositivo medico presente sul sito web;
- informazioni per l’ assemblaggio, stampate e fornite nell’imballo di un mobile destinato ai consumatori;
- informazioni cartacee per la manutenzione di una macchina da caffè automatica;
- informazioni per l’installazione di un sensore di sicurezza, scaricabili da un sito web ad uso degli ingegneri meccanici;
- tutorial di prodotto come supporto alla formazione basata sul web
- materiali per la formazione on site sui prodotti; e
- etichette per il personale addetto al trasporto, stampate sull’imballaggio di un recipiente per contenere prodotti pesanti.[/panel]
La norma è destinata all'uso di tutte le parti responsabili o coinvolte nella progettazione, creazione, manutenzione, traduzione, localizzazione, integrazione del contenuto, produzione, fornitura e valutazione, acquisizione e distribuzione di informazioni per l’uso. Le parti interessate alle informazioni per l’uso comprendono:
- acquirenti e fornitori dei prodotti;
- manager con responsabilità di processo o prodotto;
- titolari e creatori di contenuti, come redattori tecnici, sviluppatori di informazioni e illustratori;
- traduttori tecnici, esperti in localizzazione e terminologia; e
- autorità, agenzie ed esperti autorizzati.
Lo scopo della norma è fornire a queste parti le basi comuni e le basi per lo sviluppo delle informazioni per l’ uso di prodotti supportati, della qualità richiesta.
[panel]Indice
1. Premessa
2. Soddisfacimento dei requisiti per le informazioni per l'Uso
2.1 Valutazione delle informazioni per l’uso di un prodotto destinato ai consumatori
2.2 Evidenza documentale della valutazione
3. Principi
3.1 Scopo delle informazioni per l'uso
3.2 Informazioni per l'uso come parte del prodotto
3.3 Orientamento del pubblico destinatario
3.4 Uso sicuro del prodotto supportato
3.5 Conformità del prodotto per mezzo delle informazioni per l'uso
3.6 Qualità delle informazioni
3.7 Completezza
3.8 Minimalismo
3.9 Correttezza
3.10 Sintesi
3.11 Coerenza
3.12 Comprensibilità
3.13 Accessibilità
3.14 Uso di processi ripetibili
4. Processo di gestione delle informazioni
4.1 Analisi e pianificazione delle informazioni
4.2 Destinatari
4.3 Supporti
4.4 Lingue
4.5 Fonti dell'informazione
4.6 Mantenimento delle informazioni
4.7 Gestione del rischio
4.8 Accordi contrattuali e vincoli legali
4.9 Gestione e controllo del progetto
4.10 Gestione della configurazione
4.11 Gestione delle risorse umane
4.12 Assicurazione qualità
4.13 Progettazione e sviluppo, inclusi revisione, editing e verifica
4.14 Progettazione, raccolta delle informazioni e sviluppo
4.15 Revisione, modifica e test
4.6 Produzione e distribuzione
4.7 Sostegno, manutenzione e miglioramento
5. Contenuto delle istruzioni
6. Dimensioni minime raccomandate per il font e altezze dei segnali di sicurezza e dei simboli grafici
7. Guida alla valutazione
7.1 Verifica della comprensibilità
7.2 Ispezione per la verifica dell’efficacia (desk check)
7.3 Verifica empirica dell’efficacia
7.4 Controllo dei rischi residui
7.5 Controllo delle Norme specifiche del prodotto
7.6 Valutazione del processo
7.7 Valutazione delle competenze
7.8 Risultato della valutazione e azioni correttive
7.9 Valutazione di informazioni simili per l'uso[/panel]
[...]
3.1 Scopo delle informazioni per l'uso
Le informazioni per l’uso devono fornire le informazioni necessarie per un uso sicuro, efficiente ed efficace di un prodotto supportato, da parte dei destinatari.
Per soddisfare questo obiettivo, le informazioni per l’uso forniscono i seguenti tipi di informazione:
a) informazioni di carattere concettuale: concetti, spiegazioni e descrizioni necessari per consentire ai destinatari di svolgere le attività, comprendendo lo scopo e i principi di funzionamento del prodotto supportato;
b) informazioni di tipo istituzionale: procedure e istruzioni passo-passo per svolgere le attività; e
c) informazioni di riferimento: informazioni dettagliate che devono essere recuperate occasionalmente come quelle relative al troubleshooting , ai comandi o ai codici.
3.2 Informazioni per l'uso come parte del prodotto
Le informazioni per l’uso sono parte integrante del prodotto supportato a cui si deve attribuire la stessa attenzione e importanza di qualsiasi altra parte del prodotto.
Se le informazioni per l’uso sono carenti (ad esempio non soddisfano i requisiti), il prodotto nel suo insieme è difettoso. Le informazioni per l’uso devono essere chiaramente e facilmente identificabili insieme al prodotto supportato.
3.3 Orientamento del pubblico destinatario
Le informazioni per l’uso devono essere utilizzabili e rilevanti per i destinatari rispetto alle attività e agli obiettivi prefissati.
NOTA La ISO/IEC 26514 fornisce maggiori informazioni sull’analisi dei destinatari.
[...]
4.15 Revisione, modifica e test
La revisione e la verifica delle informazioni per l’uso dovrebbero essere eseguite durante l’intero processo di sviluppo delle informazioni. Le valutazioni dovrebbero essere eseguite utilizzando metodi quali le revisioni tra pari, le procedure passo passo e le ispezioni eseguite da esperti esterni al team responsabile dello sviluppo del prodotto supportato. La valutazione empirica interattiva delle informazioni per l’uso dovrebbe essere eseguita da un gruppo rappresentativo della varietà di destinatari interessati. Dovrebbero essere effettuate anche prove informali o di tipo controllato sull’usabilità. L’ editing dovrebbe essere eseguito da persone diverse da quelle coinvolte nella redazione o traduzione delle informazioni per l’uso.
Il testo di origine dovrebbe essere revisionato per verificarne l’accuratezza, la coerenza e l’usabilità prima di essere tradotto. Le traduzioni dovrebbero essere revisionate dal punto di vista dell’accuratezza e della chiarezza tecnica e linguistica da persone competenti. I dettagli sono riportati in 10.4.
La valutazione empirica (ad esempio la verifica dell’usabilità) dovrebbe essere eseguita come mezzo per determinare se le informazioni per l’uso raggiungono lo scopo. La Tabella 1 mostra esempi di metodi empirici.
Tabella 1 - Esempi di metodi empirici
[...]
5. Contenuto delle istruzioni
Le istruzioni per l’uso devono contenere le informazioni sugli argomenti riportati in tabella.
6. Dimensioni minime raccomandate per il font e altezze dei segnali di sicurezza e dei simboli grafici
[...] segue in allegato
Certifico Srl - IT | Rev. 1.0 2025
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 1.0 | 19.05.2025 | Aggiornato in accordo alla versione in lingua italiana della norma CEI UNI EN IEC/IEEE 82079-1 | Certifico Srl |
| 0.0 | 16.07.2020 | -- | Certifico Srl |
Collegati
[box-note]UNI EN ISO 20607:2019 | Manuale di istruzioni
ISO 20607:2019 Redazione manuale di istruzioni
ISO 20607:2019 Safety of machinery Instruction handbook
IEC IEEE 82079-1:2019
Direttiva macchine: Il Manuale di Istruzioni, redazione e validazione
Focus Direttiva macchine - Il Manuale di Istruzioni
EN ISO 12100 Valutazione del Rischio | File CEM
Direttiva macchine 2006/42/CE
Certifico MIUM & MIA SUITE Ed. 14.0 2023[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| EN IEC IEEE 82079 1 2020 Redazione delle istruzioni per l'uso di un prodotto Rev. 1.0 2025 IT.pdf Certifico Srl - Rev. 1.0 2025 |
948 kB | 72 | ||
| EN IEC IEEE 82079 1 2020 Redazione delle istruzioni per l'uso di un prodotto Rev. 00 2020 IT.pdf Certifico Srl - Rev. 00 2020 |
450 kB | 246 |
Regolamento MD: casi pratici in cui il Distributore non assume il ruolo di Fabbricante
Regolamento UE 2017/745: casi pratici in cui il Distributore non assume il ruolo di Fabbricante del DM
Position Paper Assogastecnici
A differenza della precedente regolamentazione relativa ai Dispositivi Medici (Direttiva 93/42/CEE), il nuovo Regolamento (UE) 2017/745 identifica e definisce alcune responsabilità di gestione del DM anche a carico dei “distributori”, oltre che per i “fabbricanti”, “importatori” ecc. definiti nel Regolamento come “Operatori Economici”.
Il presente documento intende fornire un contributo alle Aziende Associate relativamente alle possibili interpretazioni dell’articolo 16, indicando al HCP che egli può sostenere il proprio ruolo senza assumere gli obblighi del fabbricante o, come l’adattamento di più DM per la prosecuzione del trattamento ospedaliero a domicilio del paziente, possa non rientrare nella definizione di “sistema o kit”, come disciplinato dall’ art. 22.
[box-note]Articolo 16 Casi in cui gli obblighi dei fabbricanti si applicano agli importatori, ai distributori o ad altre persone
1. Un Distributore, un Importatore o un'altra persona fisica o giuridica assume gli obblighi dei fabbricanti in relazione a uno dei seguenti casi:
a) se mette un dispositivo a disposizione sul mercato con il proprio nome, la propria denominazione commerciale o il proprio marchio registrato, tranne nei casi in cui un Distributore o un importatore conclude un accordo con un fabbricante in base al quale il fabbricante è indicato come tale sull'etichetta ed è responsabile del rispetto degli obblighi che incombono ai fabbricanti a norma del presente regolamento;
b) se modifica la destinazione d'uso di un dispositivo già immesso sul mercato o messo in servizio;
c) se modifica un dispositivo già immesso sul mercato o messo in servizio in modo tale che la sua conformità alle prescrizioni applicabili possa risultare compromessa. Il primo comma non si applica ai soggetti che, pur non essendo considerati un fabbricante secondo la definizione di cui all'articolo 2, punto 30, montano o adattano per un paziente specifico un dispositivo già presente sul mercato senza modificarne la destinazione d'uso.
2. Ai fini del paragrafo 1, lettera c), non sono considerate modifiche di un dispositivo tali da compromettere la sua conformità alle prescrizioni applicabili:
a) la fornitura, compresa la traduzione, delle informazioni date dal fabbricante conformemente all'allegato I, punto 23, in merito a un dispositivo già immesso sul mercato e di ulteriori informazioni necessarie per commercializzare il dispositivo nello Stato membro in questione;
b) le modifiche del confezionamento esterno di un dispositivo già immesso sul mercato, compresa la modifica delle dimensioni del confezionamento, se il riconfezionamento è necessario per commercializzare il dispositivo nello Stato membro in questione e se è effettuato in condizioni tali da non alterare lo stato originale del dispositivo. Nel caso di dispositivi immessi sul mercato in condizioni di sterilità, si presume che lo stato originale del dispositivo sia compromesso se il confezionamento che è necessario per mantenerne la sterilità è aperto, danneggiato o intaccato in altro modo dal riconfezionamento.
3. Un Distributore o un importatore che effettui una qualsiasi delle attività di cui al paragrafo 2, lettere a) e b), indica sul dispositivo o, qualora ciò sia impossibile, sul suo confezionamento o in un documento che accompagna il dispositivo, l'attività svolta insieme al proprio nome, denominazione commerciale o marchio registrato, alla sede e all'indirizzo presso cui può essere contattato, in modo tale da poter essere localizzato. 9 I distributori e gli importatori assicurano di disporre di un sistema di gestione della qualità comprendente procedure destinate a garantire che la traduzione delle informazioni sia esatta e aggiornata e che le attività di cui al paragrafo 2, lettere a) e b), siano realizzate con mezzi e in condizioni tali da preservare lo stato originale del dispositivo e che confezionamento del dispositivo riconfezionato non sia difettoso, di scarsa qualità o poco curato. Il sistema di gestione della qualità comprende tra l'altro procedure atte a garantire che il Distributore o l'importatore sia informato delle eventuali azioni correttive adottate dal fabbricante in relazione al dispositivo in questione al fine di rispondere a problemi di sicurezza o per renderlo conforme al presente regolamento.
4. Almeno 28 giorni prima di procedere alla messa a disposizione sul mercato del dispositivo rietichettato o riconfezionato, i distributori o gli importatori che svolgono una delle attività di cui al paragrafo 2, lettere a) e b), informano il fabbricante e l'autorità competente dello Stato membro in cui intendono mettere a disposizione il dispositivo dell'intenzione di rendere disponibile il dispositivo rietichettato o riconfezionato e, su richiesta, forniscono al fabbricante e all'autorità competente un campione o un modello del dispositivo rietichettato o riconfezionato, comprese le eventuali etichette e istruzioni per l'uso tradotte. Entro lo stesso termine di 28 giorni il Distributore o l'importatore presenta all'autorità competente un certificato, rilasciato da un organismo notificato e designato per la tipologia di dispositivi oggetto delle attività di cui al paragrafo 2, lettere a) e b), in cui si attesta che il sistema di gestione della qualità del Distributore o dell'importatore è conforme alle prescrizioni di cui al paragrafo 3.
Articolo 22 Sistemi e kit procedurali
1. Ogni persona fisica o giuridica deve redigere una dichiarazione che combina dispositivi recanti la marcatura CE con i seguenti altri dispositivi o prodotti, in maniera compatibile con la destinazione d'uso dei dispositivi o degli altri prodotti e nei limiti di utilizzo previsti dai loro fabbricanti, per immetterli sul mercato come sistema o kit procedurale:
a) altri dispositivi recanti la marcatura CE;
b) dispositivi medico-diagnostici in vitro recanti la marcatura CE conformemente al regolamento (UE) 2017/746;
c) altri prodotti conformi alla normativa a essi applicabile solo qualora siano utilizzati nell'ambito di una procedura medica o ne sia altrimenti giustificata la presenza nel sistema o kit procedurale.
2. Nella dichiarazione a norma del paragrafo 1, la persona fisica o giuridica in questione indica:
a) di aver verificato la compatibilità reciproca dei dispositivi e, se del caso, degli altri prodotti secondo le istruzioni dei fabbricanti e di aver effettuato le sue attività secondo tali istruzioni;
b) di aver imballato il sistema o kit procedurale e fornito agli utilizzatori le relative informazioni, comprese le informazioni che devono essere fornite dai fabbricanti dei dispositivi o degli altri prodotti che sono stati assemblati;
c) che l'attività di combinare dispositivi e, se del caso, altri prodotti come sistemi o kit procedurali è stata sottoposta a metodi adeguati di controllo interno, verifica e convalida.
3. Ogni persona fisica o giuridica che, ai fini della loro immissione sul mercato, sterilizza i sistemi o kit procedurali di cui al paragrafo 1 applica, a sua scelta, una delle procedure di cui all'allegato IX o la procedura di cui all'allegato XI, parte A. L'applicazione di tali procedure e l'intervento dell'organismo notificato si limitano agli aspetti della procedura che riguardano il 10 mantenimento della sterilità fino a quando la confezione sterile non sia aperta o danneggiata. La persona fisica o giuridica redige una dichiarazione in cui afferma che la sterilizzazione è stata eseguita secondo le istruzioni del fabbricante.
4. Se il sistema o kit procedurale contiene dispositivi che non recano la marcatura CE o se la combinazione di dispositivi scelta non è compatibile con la destinazione d'uso originaria, o se la sterilizzazione non è stata eseguita secondo le istruzioni del fabbricante, il sistema o kit procedurale è considerato un dispositivo a sé stante ed è soggetto alla pertinente procedura di valutazione della conformità di cui all'articolo 52. La persona fisica o giuridica assume gli obblighi dei fabbricanti. I sistemi o kit procedurali di cui al paragrafo 1 del presente articolo non recano una nuova marcatura CE, bensì il nome, la denominazione commerciale o il marchio registrato della persona di cui ai paragrafi 1 e 3 del presente articolo e l'indirizzo presso il quale tale persona può essere contattata, in modo tale che essa possa essere localizzata. I sistemi o kit procedurali sono corredati delle informazioni di cui all'allegato I, punto 23. La dichiarazione di cui al paragrafo 2 del presente articolo è tenuta a disposizione delle autorità competenti, dopo l'assemblaggio del sistema o kit procedurale, per il periodo applicabile ai dispositivi combinati conformemente all'articolo 10, paragrafo 8. In caso di periodi di durata diversa, si applica quello di maggior durata.[/box-note]
Assogastecnici 2020
Collegati
[box-note]Regolamento (UE) 2017/745
Regolamento (UE) 2017/746[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Position Paper Aprile 2020.pdf Assogastecnici 2020 |
477 kB | 31 |
RAPEX Report 26 del 26/06/2020 N. 01 A12/00929/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 26 del 26/06/2020 N. 01 A12/00929/20 Germania
Approfondimento tecnico: Fermagli per capelli
Il prodotto, di marca Tedi, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una quantità eccessiva di cadmio (valore misurato: 91,6% in peso).
Il cadmio è dannoso per la salute umana perché si accumula nel corpo, può danneggiare i reni e le ossa e può provocare il cancro.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
23. Cadmium
[…] 10. Sono vietati l'uso o l'immissione sul mercato se il tenore è pari o superiore allo 0,01 % in peso del metallo in:
i) monili di metallo e altri componenti di metallo impiegati nella fabbricazione di oggetti di gioielleria;
ii) parti di metallo di articoli di gioielleria e di bigiotteria e accessori per capelli, compresi:
- braccialetti, collane e anelli
- gioielli per piercing,
- orologi da polso e cinturini,
- spille e gemelli per polsini. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 26 del 26_06_2020 N. 01 A12_00929_20 Germania.pdf Fermagli per capelli |
350 kB | 1 |
RAPEX Report 25 del 19/06/2020 N. 01 A12/00891/20 Germania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 25 del 19/06/2020 N. 01 A12/00891/20 Germania
Approfondimento tecnico: Tubo flessibile a LED
Il prodotto, di marca Salcar, mod. X000QNN1B9, è stato sottoposto al divieto di commercializzazione, all’obbligo di distruzione ed al ritiro dal mercato perché non conforme al Regolamento (UE) 2019/1021 (POPS).
Il prodotto contiene paraffine clorurate a catena corta (SCCP) (misurate fino allo 0,710% in peso).
Gli SCCP persistono nell'ambiente, sono tossici per gli organismi acquatici a basse concentrazioni e si bioaccumulano nella fauna selvatica e nell'uomo, rappresentando un rischio per la salute umana e l'ambiente.
Regolamento (UE) 2019/1021 (POPS)
Allegato I
Alcani, C10-C13, cloro (paraffine clorurate a catena corta) (SCCP)
1. In deroga a quanto sopra, si consente la produzione, la commercializzazione e l'uso di sostanze o miscele contenenti SCCP in concentrazioni inferiori all'1 % in peso o di articoli contenenti SCCP in concentrazioni inferiori allo 0,15 % in peso.
2. L'uso è consentito per quanto concerne:
a) i nastri trasportatori per il settore minerario e i sigillanti per dighe contenenti SCCP già in uso al 4 dicembre 2015 o anteriormente; e
b) gli articoli contenenti SCCP diversi da quelli di cui alla lettera a) già in uso al 10 luglio 2012 o anteriormente.
3. Agli articoli di cui al punto 2 si applica l'articolo 4, paragrafo 2, terzo e quarto comma.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 25 del 19_06_2020 N. 01 A12_00891_20 Germania.pdf Tubo flessibile a LED |
155 kB | 0 |