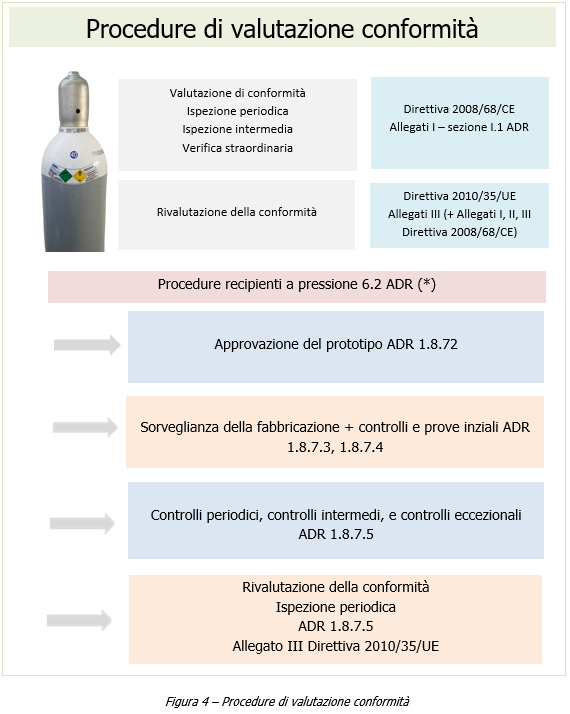
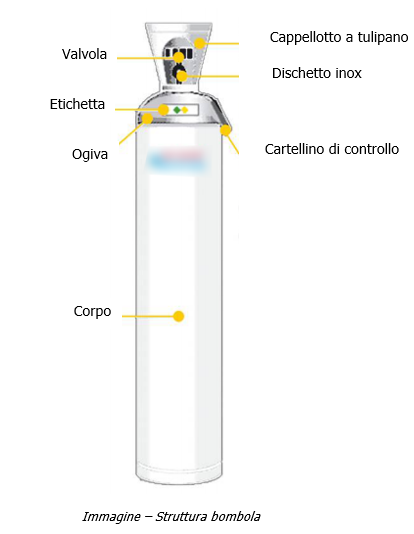
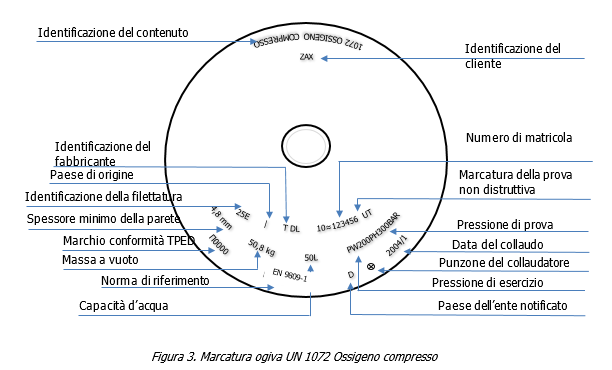
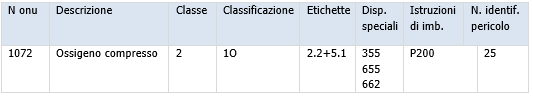
Dispositivi diagnostici in vitro per COVID-19
Dispositivi diagnostici in vitro per COVID-19
Update 15.06.2020 - Versione del 23 Maggio 2020
Rapporti ISS COVID-19 n. 46/2020 - Dispositivi diagnostici in vitro per COVID-19. Parte 2: evoluzione del mercato e informazioni per gli stakeholder. Versione del 23 maggio 2020
I dispositivi diagnostici in vitro (IVD) rappresentano strumenti essenziali per un’efficace gestione dell’epidemia di COVID-19. È tuttavia cruciale comprendere appieno quali informazioni possano fornire i differenti test disponibili sul mercato e quale livello di prestazioni mostrino. Questi aspetti hanno infatti notevole impatto sull’identificazione delle persone con infezione in corso e sul monitoraggio del decorso clinico e, quindi, sul controllo della pandemia.
Il 15 aprile 2020 la Commissione Europea ha pubblicato le linee guida sui dispositivi diagnostici in vitro per COVID-19.
Nel presente rapporto vengono diffusi i contenuti relativi (i) agli aspetti normativi che regolano l’uso e la commercializzazione degli IVD per COVID-19 in Italia e nei paesi dell’Unione Europea e (ii) alle diverse tipologie di IVD che possono essere rinvenute sul mercato.
_______
Indice
Introduzione
Dispositivi diagnostici in vitro: il contesto normativo dell’Unione Europea
Direttiva 98/79/CE
Regolamento UE 2017/746
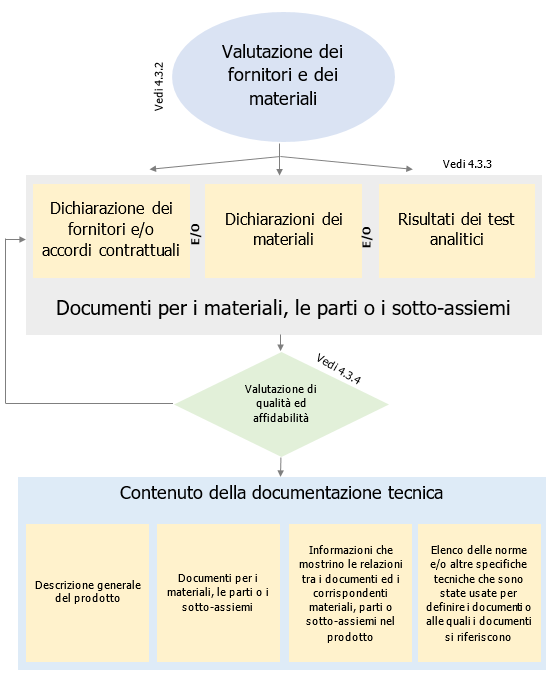
Tipologie di dispositivi per la diagnosi di COVID-19
Classificazione in base all’uso o meno di apparecchiature
Classificazione in base alla tipologia di marcatore rilevato
Saggi che rilevano la presenza di componenti del virus (RNA o antigene): metodi diretti
Saggi sierologici (o anticorpali) che rilevano l’avvenuta esposizione al virus: metodi indiretti
Classificazione in base all’utilizzatore previsto
Test ad uso professionale
Test auto-diagnostici (self-test)
Bibliografia
Fonte: ISS
Collegati:
[box-note]Regolamento (UE) 2017/746
COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
Certifico | Sezione Covid-19[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| Rapporti ISS COVID-19 n. 46 2020 - Dispositivi diagnostici in vitro per COVID-19.pdf Rapporti ISS 46/2020 |
1707 kB | 1 | ||
| Dispositivi diagnostici in vitro per COVID-19.pdf Rapporto ISS 28/2020 |
1533 kB | 23 |
Norme armonizzate Regolamento (UE) 2016/425 DPI
Norme armonizzate Regolamento (UE) 2016/425 DPI / Maggio 2025
ID 10807 | Rev. 10.0 del 16 Maggio 2025
Elenco consolidato Norme armonizzate al 16 Maggio 2025 a seguito della pubblicazione della Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025.
Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" (Vedasi Com.(2018) 764 EC).
I riferimenti delle norme armonizzate pubblicati ai sensi del Regolamento 2016/425/UE sono contenuti nelle:
1. Comunicazione 2018/C 209/03 della Commissione nell'ambito dell'applicazione del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GUUE 2018/C 209/17 del 15.06.2018). Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
Essa continua tuttavia ad applicarsi ai riferimenti delle norme armonizzate che figurano nell’allegato II della Decisione di esecuzione (UE) 2023/941 fino alle date di ritiro di tali riferimenti indicate nel medesimo allegato.
2. Rettifica della comunicazione della Commissione nell'ambito dell'attuazione del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio (GU C 222/30 del 26.06.2018). N.B Comunicazione 2018/C 209/03. Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
3. Decisione di esecuzione (UE) 2020/668della Commissione del 18 maggio 2020 relativa alle norme armonizzate per i dispositivi di protezione individuale redatte a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio (GU L 156/13 del 19.05.2020). Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
4. Decisione di esecuzione (UE) 2021/395 della Commissione del 4 marzo 2021 che modifica la Decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sulle proprietà elettrostatiche degli indumenti di protezione, sugli indumenti di protezione per vigili del fuoco e sugli indumenti protettivi per motociclisti, sugli indumenti di protezione per l’utilizzo nello snowboard, sugli indumenti di protezione indossati da operatori che applicano prodotti pesticidi e lavoratori esposti a questi pesticidi applicati, sull’attrezzatura di visibilità migliorata per situazioni a medio rischio, sull’attrezzatura per alpinismo e sugli indumenti di protezione contro i pericoli termici da arco elettrico. (GU L 77/35 del 5.3.2021). N.B. Decisione di esecuzione (UE) 2020/668Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
5. Decisione di esecuzione (UE) 2021/1201 della Commissione del 16 luglio 2021 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui protettori dell’udito. (GU L 259/8 del 21.7.2021). N.B. Decisione di esecuzione (UE) 2020/668 abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
6. Decisione di esecuzione (UE) 2022/1914 della Commissione del 6 ottobre 2022 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui dispositivi individuali di galleggiamento - aiuti al galleggiamento, giubbotti di salvataggio e accessori (GU L 261/60 del 7.10.2022). N.B. Decisione di esecuzione (UE) 2020/668 abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
7. Decisione di esecuzione (UE) 2022/2414 della Commissione del 6 dicembre 2022 che modifica la decisione di esecuzione (UE) 2020/668 per quanto riguarda le norme armonizzate sui requisiti, le prove e la marcatura dei filtri antiparticolato per i dispositivi di protezione delle vie respiratorie, sui requisiti generali per gli indumenti di protezione, sui requisiti per le protezioni per gli occhi per lo squash e le protezioni per gli occhi per il racquetball e lo squash 57 e sui requisiti e i metodi di prova per le calzature di protezione contro i rischi presenti nelle fonderie e durante le operazioni di saldatura e i procedimenti connessi. (GU L 317/136 del 9.12.2022). N.B. Decisione di esecuzione (UE) 2020/668 Abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023)
8. Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 relativa alle norme armonizzate per i dispositivi di protezione individuale elaborate a sostegno del regolamento (UE) 2016/425del Parlamento europeo e del Consiglio. (GU L 125/37 dell'11.5.2023). Entrata in vigore: 11.5.2023
9. Decisione di esecuzione (UE) 2023/2752 della Commissione, del 7 dicembre 2023, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per l’attrezzatura per alpinismo, gli elmetti per attività equestri e i guanti elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2023/2752 del 11.12.2023). Entrata in vigore: 11.12.2023
10. Decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 della Commissione per quanto riguarda le norme armonizzate relative ai dispositivi individuali per la protezione contro le cadute, agli elettrorespiratori a filtro per la protezione delle vie respiratorie, alle calzature, agli elmetti isolanti e alle protezioni degli occhi e del viso per uso professionale elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2024/2599 dell'8.10.2024). Entrata in vigore: 08.10.2024
11. Rettifica della decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 della Commissione per quanto riguarda le norme armonizzate relative ai dispositivi individuali per la protezione contro le cadute, agli elettrorespiratori a filtro per la protezione delle vie respiratorie, alle calzature, agli elmetti isolanti e alle protezioni degli occhi e del viso per uso professionale elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio (GU L 2024/90712 dell'8.11.2024)
12. Decisione di esecuzione (UE) 2025/286 della Commissione, del 13 febbraio 2025, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per i protettori dell’udito, i dispositivi individuali per la protezione contro le cadute e gli equipaggiamenti di protezione degli occhi e del viso elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2025/286 del 14.02.2025). Entrata in vigore: 14.2.2025
13. Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025, che modifica la decisione di esecuzione (UE) 2023/941 per quanto riguarda le norme armonizzate per i protettori dell’udito, i dispositivi di protezione individuale contro le cadute, i protettori delle ginocchia, gli indumenti di protezione contro le punture di zecche e gli elmetti isolanti elaborate a sostegno del regolamento (UE) 2016/425 del Parlamento europeo e del Consiglio. (GU L 2025/895 del 16.5.2025). Entrata in vigore: 16.05.2025
e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione.
[box-download]In Allegato Documento PDF con l'elenco consolidato delle norme armonizzate DPI a Maggio 2025 riservato Abbonati.[/box-download]
Certifico Srl - IT | Rev. 10.0 2025
©Copia autorizzata Abbonati
Vedi la nuova sezione 2019/2025 "Norme armonizzate click"
...
Elenco consolidato Norme armonizzate Regolamento (UE) 2016/425 DPI al 16 Maggio 2025
Consolidato con:
- la Comunicazione 2018/C 209/03, abrogata dalla Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 (GU L 125/37 dell'11.5.2023).
Essa continua tuttavia ad applicarsi ai riferimenti delle norme armonizzate che figurano nell’allegato II della Decisione di esecuzione (UE) 2023/941 fino alle date di ritiro di tali riferimenti indicate nel medesimo allegato.
- la Decisione di esecuzione (UE) 2023/941 della Commissione del 2 maggio 2023 relativa alle norme armonizzate per i dispositivi di protezione individuale elaborate a sostegno del regolamento (UE) 2016/425del Parlamento europeo e del Consiglio. (GU L 125/37 dell'11.5.2023). Entrata in vigore: 11.5.2023
- Decisione di esecuzione (UE) 2023/2752 della Commissione, del 7 dicembre 2023 (GU L 2023/2752 del 11.12.2023). Entrata in vigore: 11.12.2023
- Decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024 (GU L 2024/2599 dell'8.10.2024). Entrata in vigore: 08.10.2024
- Rettifica della decisione di esecuzione (UE) 2024/2599 della Commissione, del 4 ottobre 2024, che modifica la decisione di esecuzione (UE) 2023/941 (GU L 2024/90712 dell'8.11.2024)
- Decisione di esecuzione (UE) 2025/286 della Commissione, del 13 febbraio 2025 (GU L 2025/286 del 14.02.2025). Entrata in vigore: 14.2.2025
- Decisione di esecuzione (UE) 2025/895 della Commissione, del 14 maggio 2025 (GU L 2025/895 del 16.5.2025). Entrata in vigore: 16.05.2025
|
OEN (1) |
Riferimento e titolo della norma (e documento di riferimento) |
Data di inizio della presunzione di conformità Nota 0 |
Riferimento della norma sostituita |
Data di cessazione della presunzione di conformità della norma sostituita Nota 1 |
Decisione di esecuzione Nota 4 |
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
|
CEN |
EN 136:1998 Apparecchi di protezione delle vie respiratorie - Maschere intere - Requisiti, prove, marcatura EN 136:1998/AC:2003 |
11.05.2023 |
|
|
|
|
CEN |
EN 137:2006 Dispositivi di protezione delle vie respiratorie - Autorespiratori a circuito aperto ad aria compressa con maschera intera - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 140:1998 Apparecchi di protezione delle vie respiratorie - Semimaschere e quarti di maschera - Requisiti, prove, marcatura EN 140:1998/AC:1999 |
11.05.2023 |
|
|
|
|
CEN |
EN 142:2002 Apparecchi di protezione delle vie respiratorie - Boccaglio completo - Requisiti, prove, marcatura |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 143:2000 Apparecchi di protezione delle vie respiratorie - Filtri antipolvere - Requisiti, prove, marcatura |
21.4.2018 |
|
|
Con dec. di esec. (UE) 2022/2414 la norma è ritirata dal 09.06.2024 Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 09.06.2024 |
|
EN 143:2000/AC:2005 |
|
|
|
||
|
EN 143:2000/A1:2006 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 143:2021 Dispositivi di protezione delle vie respiratorie - Filtri antiparticolato - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 144-1:2000 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 1: Raccordo filettato per gambo di collegamento EN 144-1:2000/A1:2003 EN 144-1:2000/A2:2005 |
11.05.2023 |
|
|
|
|
CEN |
EN 144-2:1998 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 2: Raccordi di uscita |
11.05.2023 |
|
|
|
|
CEN |
EN 144-3:2003 Apparecchi di protezione delle vie respiratorie - Valvole per bombole per gas - parte 3: Raccordi di uscita per gas per l’immersione subacquea, Nitrox e ossigeno EN 144-3:2003/AC:2003 |
11.05.2023 |
|
|
|
|
CEN |
EN 145:1997 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito chiuso ad ossigeno compresso o ad ossigeno-azoto compressi - Requisiti, prove, marcatura EN 145:1997/A1:2000 |
11.05.2023 |
|
|
|
|
CEN |
EN 148-1:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 1: Raccordo filettato normalizzato |
11.05.2023 |
|
|
|
|
CEN |
EN 148-2:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 2: Raccordo con filettatura centrale |
11.05.2023 |
|
|
|
|
CEN |
EN 148-3:1999 Apparecchi di protezione delle vie respiratorie - Filettature per facciali - parte 3: Raccordo filettato M 45 x 3 |
11.05.2023 |
|
|
|
|
CEN |
EN 149:2001+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere filtranti antipolvere - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 166:2001 Protezione personale degli occhi - Specifiche |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 169:2002 Protezione personale degli occhi - Filtri per la saldatura e tecniche connesse - Requisiti di trasmissione e utilizzazioni raccomandate |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 170:2002 Protezione personale degli occhi - Filtri ultravioletti - Requisiti di trasmissione e utilizzazioni raccomandate |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 172:1994 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
EN 172:1994/A1:2000 |
21.4.2018 |
Nota 3 |
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
|
EN 172:1994/A2:2001 |
21.4.2018 |
Nota 3 |
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
|
CEN |
EN 174:2001 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’11.11.2024 |
|
CEN |
EN 175:1997 Protezione personale - Equipaggiamenti di protezione degli occhi e del viso durante la saldatura e i procedimenti connessi |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dall’11.11.2025
|
|
CEN |
EN 207:2017 Equipaggiamento di protezione personale degli occhi - Filtri e protettori dell’occhio contro radiazioni laser (protettori dell’occhio per laser) |
11.05.2023 |
|
|
|
|
CEN |
EN 208:2009 Protezione personale degli occhi - Protettori dell’occhio per i lavori di regolazione sui laser e sistemi laser (protettori dell’occhio per regolazioni laser) |
11.05.2023 |
|
|
|
|
CEN |
EN 250:2014 Equipaggiamento per la respirazione - Autorespiratori per uso subacqueo a circuito aperto ad aria compressa - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 342:2017 Indumenti di protezione - Completi e capi di abbigliamento per la protezione contro il freddo |
11.05.2023 |
|
|
|
|
CEN |
EN 343:2019 |
11.05.2023 |
|
|
|
|
CEN |
EN 352-1:2002 Protettori dell'udito - Requisiti generali - Parte 1: Cuffie |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-1:2020 Protettori dell’udito - Requisiti generali - parte 1: Cuffie Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN 352-2:2002 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-2:2020 Protettori dell’udito - Requisiti generali - parte 2: Inserti Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026
|
|
CEN |
EN 352-2:2020+A1:2024 Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425 |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 352-3:2002 |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
CEN |
EN 352-3:2020 Protettori dell’udito - Requisiti generali - parte 3: Cuffie montate su dispositivi di protezione della testa e/o dispositivi di protezione del viso Avvertenza: questa norma non comporta l’obbligo di apporre sul prodotto un’etichettatura recante il livello di riduzione acustica. La conformità a questa norma non conferisce pertanto una presunzione di conformità all’allegato II, punto 3.5, secondo comma, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 352-4:2001 Protettori auricolari - Requisiti di sicurezza e prove - Cuffie con risposta in funzione del livello sonoro |
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
EN 352-4:2001/A1:2005 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 352-4:2020 Protettori dell’udito - Requisiti di sicurezza - parte 4: Cuffie con risposta in funzione del livello sonoro |
11.05.2023 |
|
|
|
|
CEN |
EN 352-5:2002
|
21.4.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 21.07.2024 |
|
EN 352-5:2002/A1:2005 |
21.4.2018 |
Nota 3 |
|
||
|
CEN |
EN 352-5:2020 Protettori dell’udito - Requisiti di sicurezza - parte 5: Cuffie con controllo attivo della riduzione del rumore |
11.05.2023 |
|
|
|
|
CEN |
EN 352-6:2020 Protettori dell’udito - Requisiti di sicurezza - parte 6: Cuffie con comunicazione audio legata alla sicurezza |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-6:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 6: Cuffie con comunicazione audio legata alla sicurezza |
14.02.2025 |
|
|
|
|
CEN |
EN 352-7:2020 Protettori dell’udito - Requisiti di sicurezza - parte 7: Inserti con attenuazione in funzione del livello sonoro |
11.05.2023 |
|
|
|
|
CEN |
EN 352-8:2020 Protettori dell’udito - Requisiti di sicurezza - parte 8: Cuffie con possibilità di ascolto audio non legato al lavoro |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-8:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 8: Cuffie con possibilità di ascolto audio non legato al lavoro |
14.02.2025 |
|
|
|
|
CEN |
EN 352-9:2020 Protettori dell’udito - Requisiti di sicurezza - parte 9: Inserti con comunicazione audio legata alla sicurezza |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 352-9:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 9: Inserti con comunicazione audio legata alla sicurezza |
14.02.2025 |
|
|
|
|
CEN |
EN 352-10:2020 Protettori dell’udito - Requisiti di sicurezza - parte 10: Inserti con possibilità di ascolto audio non legato al lavoro |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
N 352-10:2020+A1:2024 Protettori dell’udito - Requisiti di sicurezza - parte 10: Inserti con possibilità di ascolto audio non legato al lavoro |
14.02.2025 |
|
|
|
|
CEN |
EN 353-1:2014+A1:2017 Dispositivi individuali per la protezione contro le cadute - Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio - parte 1: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio rigida |
11.05.2023 |
|
|
|
|
CEN |
EN 353-2:2002 Dispositivi di protezione individuale contro le cadute dall’alto - parte 2: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio flessibile |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 353-2:2024 Dispositivi di protezione individuale contro le cadute - parte 2: Dispositivi anticaduta di tipo guidato comprendenti una linea di ancoraggio flessibile |
16.05.2025 |
|
|
|
|
CEN |
EN 354:2010 Dispositivi individuali per la protezione contro le cadute - Cordini |
11.05.2023 |
|
|
|
|
CEN |
EN 355:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Assorbitori di energia |
11.05.2023 |
|
|
|
|
CEN |
EN 358:2018 Dispositivi di protezione individuale per il posizionamento sul lavoro e la prevenzione delle cadute dall’alto - Cinture e cordini di posizionamento sul lavoro o trattenuta |
11.05.2023 |
|
|
|
|
CEN |
EN 360:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Dispositivi anticaduta di tipo retrattile |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 360:2023 Dispositivi individuali per la protezione contro le cadute – Dispositivi anticaduta di tipo retrattile |
08.10.2024 |
|
|
|
|
CEN |
EN 361:2002 Dispositivi di protezione individuale contro le cadute dall’alto - Imbracature per il corpo |
11.05.2023 |
|
|
|
|
CEN |
EN 362:2004 Dispositivi di protezione individuale contro le cadute dall’alto - Connettori |
11.05.2023 |
|
|
|
|
CEN |
EN 365:2004 Dispositivi di protezione individuale contro le cadute dall’alto - Requisiti generali per le istruzioni per l’uso, la manutenzione, l’ispezione periodica, la riparazione, la marcatura e l’imballaggio EN 365:2004/AC:2006 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 374-1:2016 Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - parte 1: Terminologia e requisiti prestazionali per rischi chimici (ISO 374-1:2016) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 374-5:2016 Guanti di protezione contro i prodotti chimici e microorganismi pericolosi - parte 5: Terminologia e requisiti prestazionali per rischi da microorganismi (ISO 374-5:2016) |
11.05.2023 |
|
|
|
|
CEN |
EN 379:2003+A1:2009 Protezione personale degli occhi - Filtri automatici per saldatura |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 388:2016+A1:2018 Guanti di protezione contro rischi meccanici |
11.05.2023 |
|
|
|
|
CEN |
EN 397:2012+A1:2012 Elmetti di protezione per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 402:2003 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito aperto ad aria compressa con dosatore automatico e con maschera intera o boccaglio completo per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 403:2004 Apparecchi di protezione delle vie respiratorie per autosalvataggio - Dispositivi filtranti con cappuccio per la fuga dal fuoco - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 404:2005 Dispositivi di protezione delle vie respiratorie per autosalvataggio - Filtri per autosalvataggio da monossido di carbonio con boccaglio completo |
11.05.2023 |
|
|
|
|
CEN |
EN 405:2001+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere filtranti antigas o antigas e antipolvere dotate di valvole - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 407:2004 Guanti di protezione contro rischi termici (calore e/o fuoco) |
11.05.2023 |
|
|
|
|
CEN |
EN 420:2003+A1:2009 Guanti di protezione - Requisiti generali e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 421:2010 Guanti di protezione contro le radiazioni ionizzanti e la contaminazione radioattiva |
11.05.2023 |
|
|
|
|
CEN |
EN 443:2008 Elmi per la lotta contro l’incendio in edifici e in altre strutture |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941
|
|
CEN |
EN 469:2020 Indumenti di protezione per vigili del fuoco - Requisiti prestazionali per indumenti di protezione per le attività di lotta contro l’incendio |
11.05.2023 |
|
|
|
|
CEN |
EN 510:2019 Specifiche per indumenti di protezione da utilizzare in presenza di rischio di impigliamento con parti in movimento |
11.05.2023 |
|
|
|
|
CEN |
EN 511:2006 Guanti di protezione contro il freddo |
11.05.2023 |
|
|
|
|
CEN |
EN 564:2014 Attrezzatura per alpinismo - Cordino - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 564:2023 Attrezzatura per alpinismo - Cordino - Requisiti di sicurezza e metodi di prova |
08.01.2024 |
|
|
|
|
CEN |
EN 565:2017 Attrezzatura per alpinismo - Fettuccia - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 566:2017 Attrezzatura per alpinismo - Anelli - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 567:2013 Attrezzatura per alpinismo - Bloccanti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 568:2015 Attrezzatura per alpinismo - Ancoraggi da ghiaccio - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 569:2007 Attrezzatura per alpinismo - Chiodi - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 659:2003+A1:2008 Guanti di protezione per vigili del fuoco EN 659:2003+A1:2008/AC:2009 |
11.05.2023 |
|
|
|
|
CEN |
EN 795:2012 Dispositivi individuali per la protezione contro le cadute - Dispositivi di ancoraggio Attenzione: la presente pubblicazione non riguarda l’equipaggiamento descritto in: - tipo A (dispositivi di ancoraggio con uno o più punti di ancoraggio fissi e con la necessità di ancoraggi strutturali o elementi di fissaggio da assicurare alla struttura) di cui ai punti 3.2.1, 4.4.1, 5.3; - tipo C (dispositivi di ancoraggio che utilizzano linee di ancoraggio flessibili orizzontali) di cui ai punti 3.2.3, 4.4.3 e 5.5; - tipo D (dispositivi di ancoraggio che utilizzano linee di ancoraggio rigide orizzontali) di cui ai punti 3.2.4, 4.4.4 e 5.6; - qualunque combinazione degli elementi di cui sopra. Per i tipi A, C e D, la presente pubblicazione non riguarda neppure i punti: 4.5, 5.2.2, 6, 7; Allegati A e ZA. Non vi è di conseguenza alcuna presunzione di conformità alle disposizioni del regolamento (UE) 2016/425 per i tipi di equipaggiamento di cui sopra, in quanto non sono considerati DPI. |
11.05.2023 |
|
|
|
|
CEN |
EN 812:2012 Copricapo antiurto per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 813:2008 Dispositivi individuali per la protezione contro le cadute - Cinture con cosciali |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2025/286 la norma è soppressa dal 14.08.2026 |
|
CEN |
EN 813:2024 Dispositivi individuali per la protezione contro le cadute - Cinture con cosciali |
14.02.2025 |
|
|
|
|
CEN |
EN 892:2012+A3:2023 |
11.12.2023 |
|
|
|
|
CEN |
EN 893:2019 Attrezzatura per alpinismo - Ramponi - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 943-1:2015+A1:2019 Indumenti di protezione contro prodotti chimici pericolosi solidi, liquidi e gassosi, inclusi aerosol liquidi e solidi - parte 1: Requisiti prestazionali per tute di protezione chimica di Tipo 1 (a tenuta di gas) |
11.05.2023 |
|
|
|
|
CEN |
EN 943-2:2019 Indumenti di protezione contro prodotti chimici pericolosi solidi, liquidi e gassosi, inclusi aerosol liquidi e solidi - parte 2: Requisiti prestazionali per tute di protezione chimica di Tipo 1 (a tenuta di gas) per squadre di emergenza (ET) |
11.05.2023 |
|
|
|
|
CEN |
EN 958:2017 Attrezzatura per alpinismo - Sistemi di assorbimento di energia utilizzati nelle ascensioni per via ferrata - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 958:2024 Attrezzatura per alpinismo - Sistemi di assorbimento di energia utilizzati nelle ascensioni per via ferrata - Requisiti di sicurezza e metodi di prova |
16.05.2025 |
|
|
|
|
CEN |
EN 966:2012+A1:2012 Caschi per sport aerei |
11.05.2023 |
|
|
|
|
CEN |
EN 1073-1:2016+A1:2018 Indumenti di protezione contro particolati solidi aerotrasportati inclusa la contaminazione radioattiva - parte 1: Requisiti e metodi di prova per indumenti di protezione ventilati con aria compressa dalla linea che proteggono il corpo e i tratti respiratori |
11.05.2023 |
|
|
|
|
CEN |
EN 1073-2:2002 Indumenti di protezione contro la contaminazione radioattiva - parte 2: Requisiti e metodi di prova per indumenti di protezione non ventilati contro la contaminazione radioattiva sotto forma di particelle |
11.05.2023 |
|
|
|
|
CEN |
EN 1077:2007 Caschi per la pratica dello sci alpino e per lo snowboard |
11.05.2023 |
|
|
|
|
CEN |
EN 1078:2012+A1:2012 Caschi per ciclisti e per utilizzatori di tavole a rotelle (skateboards) e pattini a rotelle |
11.05.2023 |
|
|
|
|
CEN |
EN 1080:2013 Caschi di protezione contro gli urti per bambini |
11.05.2023 |
|
|
|
|
CEN |
EN 1082-1:1996 Indumenti di protezione - Guanti e proteggi-braccia contro tagli e coltellate causati da coltelli a mano - parte 1: Guanti e proteggi-braccia di maglia metallica |
11.05.2023 |
|
|
|
|
CEN |
EN 1082-2:2000 Indumenti di protezione - Guanti e proteggi-braccia contro tagli e coltellate causati da coltelli a mano - parte 2: Guanti e proteggi-braccia costruiti con materiale diverso dalla maglia metallica |
11.05.2023 |
|
|
|
|
CEN |
EN 1146:2005 Dispositivi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con cappuccio, per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 1149-5:2018 Indumenti di protezione - Proprietà elettrostatiche - parte 5: Requisiti prestazionali dei materiali e di progettazione |
11.05.2023 |
|
|
|
|
CEN |
EN 1384:2023 Elmetti per attività equestri |
11.12.2023 |
|
|
|
|
CEN |
EN 1385:2012 Elmetti per canoa-kayak e sport in acque torrentizie |
11.05.2023 |
|
|
|
|
CEN |
EN 1486:2007 Indumenti di protezione per vigili del fuoco - Metodi di prova e requisiti per indumenti riflettenti per operazioni speciali di lotta contro l’incendio |
11.05.2023 |
|
|
|
|
CEN |
EN 1497:2007 Dispositivi individuali per la protezione contro le cadute - Imbracature di salvataggio |
11.05.2023 |
|
|
|
|
CEN |
EN 1731:2006 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2024/2599 la norma è ritirata dall’11.11.2025 |
|
CEN |
EN 1827:1999+A1:2009 Dispositivi di protezione delle vie respiratorie - Semimaschere senza valvole di inspirazione e con filtri smontabili per la protezione contro gas o gas e particelle o solamente particelle - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 1891:1998 Dispositivi di protezione individuale per la prevenzione delle cadute dall’alto - Corde con guaina a basso coefficiente di allungamento |
11.05.2023 |
|
|
|
|
CEN |
EN 1938:2010 Protezione personale degli occhi - Occhiali a visiera per utilizzatori di motocicli e ciclomotori |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 10819:2013 Vibrazioni meccaniche e urti - Vibrazioni al sistema mano-braccio - Metodo per la misurazione e la valutazione della trasmissibilità delle vibrazioni dai guanti al palmo della mano (ISO 10819:2013) EN ISO 10819:2013/A1:2019 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2023/2752 la norma è soppressa dall’11.06.2025 |
|
CEN |
EN ISO 10819:2013 Vibrazioni meccaniche e urti - Vibrazioni al sistema mano-braccio - Metodo per la misurazione e la valutazione della trasmissibilità delle vibrazioni dai guanti al palmo della mano (ISO 10819:2013) |
11.12.2023 |
|
|
|
|
CEN |
EN ISO 10862:2009 Unità di piccole dimensioni - Sistema di sgancio rapido per imbracatura a trapezio (ISO 10862:2009) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-2:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 2: Requisiti prestazionali e metodi di prova per protettori delle gambe (ISO 11393-2:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-4:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 4: Requisiti prestazionali e metodi di prova per guanti di protezione (ISO 11393-4:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-5:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 5: Requisiti prestazionali e metodi di prova per ghette di protezione (ISO 11393-5:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 11393-6:2019 Indumenti di protezione per utilizzatori di seghe a catena portatili - parte 6: Requisiti prestazionali e metodi di prova per protettori per la parte superiore del corpo (ISO 11393-6:2018) |
11.05.2023 |
|
|
|
|
CEN |
EN 12021:2014 Equipaggiamento per la respirazione - Gas compressi per respiratori |
11.05.2023 |
|
|
|
|
CEN |
EN 12083:1998 Apparecchi di protezione delle vie respiratorie - Filtri con tubi di respirazione (filtri non montati su maschera) - Filtri antipolvere, filtri antigas e filtri combinati - Requisiti, prove, marcatura EN 12083:1998/AC:2000 |
11.05.2023 |
|
|
|
|
CEN |
EN 12270:2013 Attrezzatura per alpinismo - Blocchi da incastro - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12275:2013 Attrezzatura per alpinismo - Connettori - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12276:2013 Attrezzatura per alpinismo - Ancoraggi regolabili - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12277:2015+A1:2018 Attrezzatura per alpinismo - Imbracature - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12278:2007 Attrezzatura per alpinismo - Pulegge - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12312-1:2013 Protezione degli occhi e del viso - Occhiali da sole e dispositivi similari - parte 1: Occhiali da sole per uso generale (ISO 12312-1:2013) EN ISO 12312-1:2013/A1:2015 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12312-2:2015 Protezione degli occhi e del viso - Occhiali da sole e dispositivi similari - parte 2: Filtri per l’osservazione diretta del sole (ISO 12312-2:2015) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12401:2009 Unità di piccole dimensioni - Imbracatura di sicurezza da ponte e nastro di sicurezza - Requisiti di sicurezza e metodi di prova (ISO 12401:2009) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-2:2020 Dispositivi individuali di galleggiamento - parte 2: Giubbotti di salvataggio, livello prestazionale 275 - Requisiti di sicurezza (ISO 12402-2:2020) Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-3:2020 Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-4:2020 Dispositivi individuali di galleggiamento - parte 4: Giubbotti di salvataggio, livello prestazionale 100 - Requisiti di sicurezza (ISO 12402-4:2020) Avvertenza: L’applicazione del punto 5.6 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.1.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.1.3, 5.1.5, 5.1.7, 5.2, 5.3.1.1, 5.3.1.2, 5.3.2.2, 5.3.2.3, 5.3.4.3, 5.3.4.4, 5.6.1.4, 5.6.1.7, 5.6.1.8, 5.6.1.9, 5.6.1.10 e 5.6.1.11 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 1.2.1, del regolamento (UE) 2016/425. L’applicazione dei punti 5.1.2, 5.2, 5.3.1.1, 5.3.2.2, 5.3.4.2, 5.3.4.4, 5.6.3 e 5.7 di questa norma non conferisce una presunzione di conformità al requisito fondamentale di salute e di sicurezza di cui all’allegato II, punto 3.4, del regolamento (UE) 2016/425. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-5:2020 Dispositivi individuali di galleggiamento - parte 5: Aiuti al galleggiamento (livello 50) - Requisiti di sicurezza (ISO 12402-5:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-6:2020 Dispositivi individuali di galleggiamento - parte 6: Giubbotti di salvataggio e aiuti al galleggiamento per applicazioni speciali - Requisiti di sicurezza e metodi di prova supplementari (ISO 12402-6:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 12402-8:2020 Dispositivi individuali di galleggiamento - parte 8: Accessori - Requisiti di sicurezza e metodi di prova (ISO 12402-8:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN 12477:2001 Guanti di protezione per saldatori EN 12477:2001/A1:2005 |
11.05.2023 |
|
|
|
|
CEN |
EN 12492:2012 Attrezzature per alpinismo - Caschi per alpinisti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 12841:2006 Dispositivi individuali per la protezione contro le cadute - Sistemi di accesso con fune - Dispositivi di regolazione della fune |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 12841:2024 Dispositivi individuali per la protezione contro le cadute - Sistemi di accesso con fune - Dispositivi di regolazione della fune |
08.10.2024 |
|
|
|
|
CEN |
EN 12941:1998 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di elmetto o cappuccio - Requisiti, prove, marcatura EN 12941:1998/A1:2003 EN 12941:1998/A2:2008 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.10.2026 |
|
CEN |
EN 12941:2023 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di facciali non ermetici - Requisiti, prove, marcatura |
08.10.2024 |
|
|
|
|
CEN |
EN 12942:1998 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di maschere intere, semimaschere o quarti di maschere - Requisiti, prove, marcatura EN 12942:1998/A1:2002 EN 12942:1998/A2:2008 |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.10.2026 |
|
CEN |
EN 12942:2023 Dispositivi di protezione delle vie respiratorie - Elettrorespiratori a filtro completi di maschere intere, semimaschere o quarti di maschere - Requisiti, prove, marcatura |
08.10.2024 |
|
|
|
|
CEN |
EN 13034:2005+A1:2009 Indumenti di protezione contro agenti chimici liquidi - Requisiti prestazionali per indumenti di protezione chimica che offrono una protezione limitata contro agenti chimici liquidi (equipaggiamento tipo 6 e tipo PB [6]) |
11.05.2023 |
|
|
|
|
CEN |
EN 13061:2009 Indumenti di protezione - Parastinchi per giocatori di calcio - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13089:2011+A3:2023 Attrezzatura per alpinismo - Utensili da ghiaccio – Requisiti di sicurezza e metodi di prova |
11.12.2023 |
|
|
|
|
CEN |
EN 13138-1:2021 Aiuti al galleggiamento per l’apprendimento delle tecniche di nuoto - parte 1: Requisiti di sicurezza e metodi di prova per aiuti al galleggiamento destinati ad essere indossati EN 13138-1:2021/AC:2022 |
11.05.2023 |
|
|
|
|
CEN |
EN 13158:2018 Indumenti di protezione - Giacche di protezione, protettori del corpo e delle spalle per uso equestre, per cavalieri e persone che lavorano con cavalli e per conducenti di cavalli - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13178:2000 Protezione personale degli occhi - Protettori dell’occhio per utilizzatori di motoslitte |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-1:2000 Equipaggiamento di protezione per arti marziali - parte 1: Requisiti e metodi di prova generali |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-2:2000 Equipaggiamento di protezione per arti marziali - parte 2: Requisiti e metodi di prova supplementari per protettori del collo del piede, per protettori della tibia e per protettori dell’avambraccio |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-3:2013 Equipaggiamento di protezione per arti marziali - parte 3: Requisiti e metodi di prova supplementari per protettori del torso |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-4:2001 Equipaggiamento di protezione per arti marziali - parte 4: Requisiti e metodi di prova supplementari per protettori della testa EN 13277-4:2001/A1:2007 |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-5:2002 Equipaggiamenti di protezione per arti marziali - parte 5: Requisiti e metodi di prova supplementari per conchiglie e protettori addominali |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-6:2003 Equipaggiamenti di protezione per arti marziali — parte 6: Requisiti e metodi di prova supplementari per protettori del petto per donne |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-7:2009 Equipaggiamento di protezione per arti marziali - parte 7: Requisiti e metodi di prova supplementari per protettori delle mani e dei piedi |
11.05.2023 |
|
|
|
|
CEN |
EN 13277-8:2017 Equipaggiamento di protezione per arti marziali - parte 8: Requisiti e metodi di prova supplementari per protettori del viso per karate |
11.05.2023 |
|
|
|
|
CEN |
EN 13484:2012 Caschi per utilizzatori di slittini |
11.05.2023 |
|
|
|
|
CEN |
EN 13546:2002+A1:2007 Indumenti di protezione - Protettori delle mani, delle braccia, del torace, dell’addome, delle gambe, dei piedi e conchiglie per portieri di hockey su prato e protettori della tibia per giocatori - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13567:2002+A1:2007 Indumenti di protezione - Protettori delle mani, delle braccia, del torace, dell’addome, delle gambe, del viso e conchiglie per schermidori - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13688:2013 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dal 09.06.2024 |
|
CEN |
EN 13594:2015 Guanti di protezione per motociclisti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 13634:2017 Calzature di protezione per motociclisti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13688:2013 Indumenti di protezione - Requisiti generali (ISO 13688:2013) EN ISO 13688:2013/A1:2021 |
11.05.2023 |
|
|
|
|
CEN |
EN 13781:2012 Caschi di protezione per conducenti e passeggeri di motoslitte e bob |
11.05.2023 |
|
|
|
|
CEN |
EN 13794:2002 Apparecchi di protezione delle vie respiratorie - Autorespiratori a circuito chiuso per la fuga - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 13832-2:2018 Calzature di protezione contro agenti chimici - parte 2: Requisiti per il contatto limitato con gli agenti chimici |
11.05.2023 |
|
|
|
|
CEN |
EN 13832-3:2018 Calzature di protezione contro agenti chimici - parte 3: Requisiti per il contatto prolungato con gli agenti chimici |
11.05.2023 |
|
|
|
|
CEN |
EN 13949:2003 Equipaggiamento per la respirazione - Autorespiratori per uso subacqueo a circuito aperto per uso con Nitrox e ossigeno compressi - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13982-1:2004 Indumenti di protezione per l’utilizzo contro particelle solide - parte 1: Requisiti prestazionali per indumenti di protezione contro prodotti chimici che offrono protezione all’intero corpo contro particelle solide disperse nell’aria (indumenti tipo 5) (ISO 13982-1:2004) EN ISO 13982-1:2004/A1:2010 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 13998:2003 Indumenti di protezione - Grembiuli, pantaloni e giubbetti di protezione contro tagli e coltellate causati da coltelli a mano (ISO 13998:2003) |
11.05.2023 |
|
|
|
|
CEN |
EN 14021:2003 Pettorina per il motociclismo fuoristrada adatta a proteggere il motociclista da pietre e detriti - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14052:2012+A1:2012 Elmetti ad elevate prestazioni per l’industria |
11.05.2023 |
|
|
|
|
CEN |
EN 14058:2017 Indumenti di protezione - Capi di abbigliamento per la protezione contro gli ambienti freddi |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN 14058:2017+A1:2023 Indumenti di protezione - Capi di abbigliamento per la protezione contro gli ambienti freddi |
08.10.2024 |
|
|
|
|
CEN |
EN 14120:2003+A1:2007 Indumenti di protezione - Protettori di polsi, palme, ginocchia e gomiti per utilizzatori di attrezzature per sport su rotelle - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14126:2003 Indumenti di protezione - Requisiti prestazionali e metodi di prova per gli indumenti di protezione contro gli agenti infettivi EN 14126:2003/AC:2004 |
11.05.2023 |
|
|
|
|
CEN |
EN 14143:2013 Equipaggiamento per la respirazione - Autorespiratori a circuito chiuso per uso subacqueo |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-1:2017 Tute per immersione - parte 1: Tute umide - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-2:2017 Tute per immersione - parte 2: Tute stagne - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14225-3:2017 Tute per immersione - parte 3: Tuta con sistemi attivi di riscaldamento o di raffreddamento - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14328:2005 Indumenti di protezione - Guanti e proteggi-braccia contro tagli causati da coltelli motorizzati - Requisiti e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 14387:2004+A1:2008 Dispositivi di protezione delle vie respiratorie - Filtri antigas e filtri combinati - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14404-2:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 2: Requisiti per i protettori del ginocchio indossabili (tipo 1) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14404-3:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 3: Requisiti per la combinazione individuale di ginocchiere e indumenti (tipo 2) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
Avvertenza: oltre che ai punti 5.5.1.1, 5.5.1.2, 5.5.5.1 e 5.5.5.2, è necessaria anche la conformità al punto 5.5.1.3 per conferire una presunzione di conformità ai requisiti essenziali di cui all’allegato II, punto 1.3.1, del regolamento (UE) 2016/425. |
|||||
|
CEN |
EN 14404-4:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 4: Requisiti per la combinazione di ginocchiere e indumenti interoperabili (tipo 2) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14404-6:2024 Dispositivi di protezione individuale - Protettori delle ginocchia per lavori in posizione inginocchiata - parte 6: Requisiti per i sistemi di inginocchiamento (tipo 4) |
16.05.2025 |
|
|
Decisione di esecuzione (UE) 2025/895
|
|
CEN |
EN 14435:2004 Apparecchi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con semimaschera, progettati per essere utilizzati solamente con pressione positiva - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14458:2018 Equipaggiamento individuale per gli occhi - Visiere ad alte prestazioni destinate all’uso con caschi/elmetti di protezione |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 14460:1999 Indumenti di protezione per piloti di automobili - Protezione contro calore e fuoco - Requisiti prestazionali e metodi di prova (ISO 14460:1999) EN ISO 14460:1999/AC:1999 EN ISO 14460:1999/A1:2002 |
11.05.2023 |
|
|
|
|
CEN |
EN 14529:2005 Dispositivi di protezione delle vie respiratorie - Autorespiratori ad aria compressa a circuito aperto con semimaschera, progettati per comprendere un dosatore automatico a pressione positiva, solamente per scopi di fuga |
11.05.2023 |
|
|
|
|
CEN |
EN 14593-1:2005 Apparecchi di protezione delle vie respiratorie - Respiratori ad aria compressa alimentati dalla linea con erogatore a domanda - parte 1: Apparecchi con maschera intera - Requisiti, prove, marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14594:2018 Apparecchi di protezione delle vie respiratorie - Respiratori ad aria compressa, a flusso continuo, alimentati dalla linea - Requisiti, prove e marcatura |
11.05.2023 |
|
|
|
|
CEN |
EN 14605:2005+A1:2009 Indumenti di protezione contro agenti chimici liquidi - Requisiti prestazionali per indumenti con collegamenti a tenuta di liquido (Tipo 3) o a tenuta di spruzzi (Tipo 4), inclusi gli articoli che proteggono solamente parti del corpo (Tipi PB [3] e PB [4]) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 14877:2002 Indumenti di protezione per operazioni di sabbiatura con abrasivi in grani (ISO 14877:2002) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 15027-1:2012 Tute di protezione termica in caso di immersione - parte 1: Tute da indossare permanentemente, requisiti inclusa la sicurezza (ISO 15027-1:2012) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 15027-2:2012 Tute di protezione termica in caso di immersione - parte 2: Tute per abbandono, requisiti inclusa la sicurezza (ISO 15027-2:2012) |
11.05.2023 |
|
|
|
|
CEN |
EN 15090:2012 Calzature per vigili del fuoco |
11.05.2023 |
|
|
|
|
CEN |
EN 15151-1:2012 Attrezzatura per alpinismo - Dispositivi di frenatura - parte 1: Dispositivi di frenatura con bloccaggio manuale assistito, requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 15333-1:2008 Equipaggiamento per la respirazione - Apparecchi subacquei a circuito aperto a gas compresso alimentati tramite ombelicale - parte 1: Apparecchi a domanda EN 15333-1:2008/AC:2009 |
11.05.2023 |
|
|
|
|
CEN |
EN 15333-2:2009 Equipaggiamento per la respirazione - Apparecchi subacquei a circuito aperto a gas compresso alimentati tramite ombelicale - parte 2: Apparecchi a flusso continuo |
11.05.2023 |
|
|
|
|
CEN |
EN 15613:2008 Protettori di ginocchia e gomiti per sport all’interno (indoor) - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 16027:2011 Indumenti di protezione - Guanti con effetto di protezione per i portieri di calcio |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-1:2022 Protezione degli occhi e del viso per uso professionale - parte 1: Requisiti generali (ISO 16321-1:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-2:2021 Protezione degli occhi e del viso per uso professionale - parte 2: Requisiti aggiuntivi per protezioni utilizzate durante la saldatura e tecniche correlate (ISO 16321-2:2021) Avvertenza: questa norma rinvia al riferimento normativo EN ISO 16321-1:2020, la cui data non è corretta. Esso deve invece essere inteso come EN ISO 16321-1:2022. |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 16321-3:2022 Protezione degli occhi e del viso per uso professionale - parte 3: Requisiti aggiuntivi per protezioni a maglia (ISO 16321-3:2021) Avvertenza: questa norma rinvia al riferimento normativo EN ISO 16321-1:2020, la cui data non è corretta. Esso deve invece essere inteso come EN ISO 16321-1:2022. |
11.05.2023 |
|
|
|
|
CEN |
EN 16350:2014 Guanti di protezione - Proprietà elettrostatiche |
11.05.2023 |
|
|
|
|
CEN |
EN 16473:2014 Elmi per vigili del fuoco - Elmi per soccorsi tecnici |
11.05.2023 |
|
|
|
|
CEN |
EN 16716:2017 Attrezzatura per alpinismo - Sistemi di airbag da valanga - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-2:2020 Indumenti protettivi per motociclisti - parte 2: Indumenti di classe AAA - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-3:2020 Indumenti protettivi per motociclisti - parte 3: Indumenti di classe AA - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-4:2020 Indumenti protettivi per motociclisti - parte 4: Indumenti di classe A - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-5:2020 Indumenti protettivi per motociclisti - parte 5: Indumenti di classe B - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17092-6:2020 Indumenti protettivi per motociclisti - parte 6: Indumenti di classe C - Requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17109:2020 Attrezzatura per alpinismo - Sistemi di sicurezza individuali per percorsi acrobatici - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Con Decisione di esecuzione (UE) 2025/895 La norma è ritirata dal 16.11.2026 |
|
CEN |
EN 17109:2020+A1:2024 Attrezzatura per alpinismo - Sistemi di sicurezza individuali per percorsi acrobatici - Requisiti di sicurezza e metodi di prova |
16.05.2025 |
|
|
|
|
CEN |
EN ISO 17249:2013 Calzature di sicurezza con resistenza al taglio da sega a catena (ISO 17249:2013) EN ISO 17249:2013/AC:2014 |
11.05.2023 |
|
|
|
|
CEN |
EN 17353:2020 Indumenti di protezione - Attrezzatura di visibilità migliorata per situazioni a medio rischio - Metodi di prova e requisiti |
11.05.2023 |
|
|
|
|
CEN |
EN 17487:2024 Indumenti di protezione - Indumenti trattati con permetrina come articoli che supportano la protezione contro le punture di zecche |
16.05.2025 |
|
|
|
|
CEN |
EN 17520:2021 Attrezzatura per alpinismo - Cordini autoassicuranti - Requisiti di sicurezza e metodi di prova |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 18527-1:2022 Dispositivi di protezione degli occhi e del viso per utilizzo sportivo - parte 1: Requisiti delle maschere per lo sci da discesa e lo snowboard (ISO 18527-1:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 18527-2:2021 Protezione degli occhi e del viso per uso sportivo - parte 2: Requisiti per le protezioni per gli occhi per lo squash e le protezioni per gli occhi per il racquetball e lo squash 57 (ISO 18527-2:2021) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20320:2020 Indumenti di protezione per l’utilizzo nello snowboard - Protettori del polso - Requisiti e metodi di prova (ISO 20320:2020) |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20345:2011 |
21.04.2018 |
|
|
Con Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’11.11.2024 |
|
CEN |
EN ISO 20345:2022 Dispositivi di protezione individuale - Calzature di sicurezza (ISO 20345:2021) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20345:2022 Dispositivi di protezione individuale – Calzature di sicurezza (ISO 20345:2021) EN ISO 20345:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20346:2014 Dispositivi di protezione individuale - Calzature di protezione (ISO 20346:2014) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20346:2022 Dispositivi di protezione individuale – Calzature di protezione (ISO 20346:2021) EN ISO 20346:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20347:2012 Dispositivi di protezione individuale - Calzature da lavoro (ISO 20347:2012) |
11.05.2023 |
|
|
Decisione di esecuzione (UE) 2023/941 la norma è ritirata dall’08.04.2026 |
|
CEN |
EN ISO 20347:2022 Dispositivi di protezione individuale - Calzature da lavoro (ISO 20347:2021) EN ISO 20347:2022/A1:2024 |
08.10.2024 |
|
|
|
|
CEN |
EN ISO 20349-1:2017 Dispositivi di protezione individuale - Calzature di protezione contro i rischi presenti nelle fonderie e nelle operazioni di saldatura - parte 1: Requisiti e metodo di prova per la protezione contro i rischi presenti nelle fonderie (ISO 20349-1:2017) EN ISO 20349-1:2017/A1:2020 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20349-2:2017 Dispositivi di protezione individuale - Calzature di protezione contro i rischi presenti nelle fonderie e nelle operazioni di saldatura - parte 2: Requisiti e metodi di prova per la protezione contro i rischi presenti nelle operazioni di saldatura e nei procedimenti connessi (ISO 20349-2:2017) EN ISO 20349-2:2017/A1:2020 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 20471:2013 Indumenti ad alta visibilità - Metodi di prova e requisiti (ISO 20471:2013, versione rettificata 2013-06-01) EN ISO 20471:2013/A1:2016 |
11.05.2023 |
|
|
|
|
CEN |
EN ISO 27065:2017 Indumenti di protezione - Requisiti prestazionali per indumenti di protezione indossati da operatori che applicano prodotti pesticidi e lavoratori esposti a questi pesticidi applicati (ISO 27065:2017) EN ISO 27065:2017/A1:2019 |
11.05.2023 |
|
|
|
|
CEN |
EN 50321-1:2018 Lavori sotto tensione - Calzature di protezione dielettrica - Calzature e sovrastivali isolanti EN 50321-1:2018/AC:2018-08 |
11.05.2023 |
|
|
|
|
CEN |
EN 50365:2023 Lavori sotto tensione – Elmetti isolanti da utilizzare su impianti di media e bassa tensione EN 50365:2023/AC:2024-09 |
08.10.2024 |
|
|
Decisione di esecuzione (UE) 2024/2599 Norma sostituita dalla Decisione di esecuzione (UE) 2025/895 |
|
CEN |
EN 61482-2:2020 Lavori sotto tensione - Indumenti protettivi contro l’effetto termico dell’arco elettrico - parte 2: Prescrizioni (IEC 61482-2:2018, modificata) |
11.05.2023 |
|
|
|
(1) OEN: Organizzazione europea di normazione:
- CEN: Rue de la Science 23, 1040 Bruxelles, Tel. + 32 25500811; Fax + 32 25500819 (http://www.cen.eu)
- CENELEC: Rue de la Science 23, 1040 Bruxelles, Tel. + 32 25500811; Fax + 32 25500819 (http://www.cenelec.eu)
- ETSI: 650 route des Lucioles, 06921 Sophia Antipolis, Tel.+33 492944200; Fax + 33 493654716, (http://www.etsi.eu)
(2) GU C 338 del 27.9.2014, pag. 31.
Nota 0: questa è la data a partire dalla quale il rispetto della norma armonizzata o di parti di essa conferisce una presunzione di conformità alle prescrizioni pertinenti della legislazione dell'Unione
Nota 1: in genere la data di cessazione della presunzione di conformità coincide con la data di ritiro («dow»), fissata dall’organizzazione europea di normazione, ma è bene richiamare l’attenzione di coloro che utilizzano queste norme sul fatto che in alcuni casi eccezionali può avvenire diversamente.
Nota 2.1: la norma nuova (o modificata) ha lo stesso campo di applicazione della norma sostituita. Alla data stabilita, la norma sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.2: la nuova norma ha un campo di applicazione più ampio delle norme sostituite. Alla data stabilita le norme sostituite cessano di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione.
Nota 2.3: la nuova norma ha un campo di applicazione più limitato rispetto alla norma sostituita. Alla data stabilita la norma (parzialmente) sostituita cessa di dare la presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per quei prodotti o servizi che rientrano nel campo di applicazione della nuova norma. La presunzione di conformità ai requisiti essenziali e agli altri requisiti previsti dalla normativa pertinente dell'Unione per i prodotti o servizi che rientrano ancora nel campo di applicazione della norma (parzialmente) sostituita, ma non nel campo di applicazione della nuova norma, rimane inalterata.
Nota 3: In caso di modifiche, la Norma cui si fa riferimento è la EN CCCCC:YYYY, comprensiva delle sue precedenti eventuali modifiche, e la nuova modifica citata.
Nota 4: Dal 1° dicembre 2018 i riferimenti delle norme armonizzate sono pubblicati e ritirati dalla Gazzetta ufficiale dell'Unione europea non più come "Comunicazioni della Commissione" ma mediante "Decisioni di esecuzione della Commissione" e devono essere letti insieme, tenendo conto che la decisione modifica alcuni riferimenti pubblicati nella comunicazione. (Vedasi Com.(2018) 764 EC).
NOTA:
- Ogni informazione relativa alla disponibilità delle norme può essere ottenuta o presso le organizzazioni europee di normazione o presso gli organismi nazionali di normazione il cui l’elenco è pubblicato nella Gazzetta ufficiale dell'Unione europea conformemente all'articolo 27 del regolamento (UE) n. 1025/2012 (2).
- Le norme armonizzate sono adottate dalle organizzazioni europee di normazione in lingua inglese (il CEN e il Cenelec pubblicano norme anche in francese e tedesco). Successivamente i titoli delle norme armonizzate sono tradotti in tutte le altre lingue ufficiali richieste dell'Unione europea dagli organismi nazionali di normazione. La Commissione europea non è responsabile della correttezza dei titoli presentati per la pubblicazione nella Gazzetta ufficiale.
- La pubblicazione dei riferimenti alle rettifiche «…/AC:YYYY» avviene a solo scopo di informazione. Una rettifica elimina errori di stampa, linguistici o simili nel testo di una norma e può riferirsi a una o più versioni linguistiche (inglese, francese e/o tedesco) di una norma adottata da un'organizzazione europea di normazione.
- La pubblicazione dei riferimenti nella Gazzetta ufficiale dell'Unione europea non implica che le norme siano disponibili in tutte le lingue ufficiali dell'Unione.
- Il presente elenco sostituisce tutti gli elenchi precedenti pubblicati nella Gazzetta ufficiale dell'Unione europea. La Commissione europea assicura l'aggiornamento del presente elenco.
- Per ulteriori informazioni sulle norme armonizzate o altre norme europee, consultare il seguente indirizzo Internet: http://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/index_en.htm
_______
Collegati:
[box-note]Vedi la nuova sezione 2019/2020/2021/2022/2023/2024 "Norme armonizzate click"[/box-note]
Decreto 20 febbraio 2020 n. 32

Decreto 20 febbraio 2020 n. 32
Regolamento recante modifica dell'Allegato II del decreto legislativo 4 settembre 2002, n. 262.
(GU Serie Generale n.124 del 15-05-2020)
Entrata in vigore del provvedimento: 30/05/2020
...
Articolo unico
Modifiche all’Allegato II del decreto legislativo 4 settembre 2002, n. 262.
1. All’Allegato II del decreto legislativo 4 settembre 2002, n. 262, sono apportate le seguenti modificazioni:
a) le parole: «rinvio al presente decreto» sono sostituite dalle seguenti: «rinvio alla direttiva n. 2000/14/CE»;
b) le parole: «dichiarazione di conformità ai requisiti del presente decreto» sono sostituite dalle seguenti:
«dichiarazione di conformità ai requisiti della direttiva n. 2000/14/CE»
...
Collegati:
[box-note]Decreto Legislativo n. 262 del 4 settembre 2002
Decreto Legislativo 17 febbraio 2017 n. 41
ebook Direttiva rumore macchine all'aperto (OND)
Decreto 4 ottobre 2011[/box-note]
Regolamento di esecuzione (UE) 2020/639
Regolamento di esecuzione (UE) 2020/639
della Commissione del 12 maggio 2020 che modifica il regolamento di esecuzione (UE) 2019/947 per quanto riguarda gli scenari standard per le operazioni effettuate entro o oltre la distanza di visibilità
GU L 150/1 del 13.05.2020
Entrata in vigore: 02.06.2020
...
Articolo 1 Modifiche del regolamento di esecuzione (UE) 2019/947
Il regolamento di esecuzione (UE) 2019/947 è così modificato:
1) All’articolo 2 sono aggiunti i seguenti punti da 24) a 34):
«24) “osservatore dell’aeromobile senza equipaggio”: una persona, posta a fianco del pilota remoto, che, mediante l’osservazione visiva senza strumenti dell’aeromobile senza equipaggio, aiuta il pilota remoto a mantenere l’aeromobile senza equipaggio in VLOS e ad effettuare il volo in sicurezza;
25) “osservatore dello spazio aereo”: una persona che assiste il pilota remoto mediante una scansione visiva senza strumenti dello spazio aereo in cui opera l’aeromobile senza equipaggio, al fine di prevenire potenziali rischi in volo;
26) “unità di comando” (“CU”, command unit): il dispositivo o il sistema di dispositivi di controllo remoto di aeromobili senza equipaggio quale definito all’articolo 3, punto 32), del regolamento (UE) 2018/1139, che supporta il controllo o il monitoraggio degli aeromobili senza equipaggio in tutte le fasi del volo, ad eccezione delle infrastrutture di supporto al servizio di collegamento per le funzioni di comando e controllo (C2);
27) “servizio di collegamento C2”: un servizio di comunicazione fornito da un terzo, che assicura le funzioni di comando e controllo tra gli aeromobili senza equipaggio e la CU;
28) “geografia di volo”: il volume dello spazio aereo definito nello spazio e nel tempo, in cui l’operatore UAS prevede di effettuare l’operazione secondo le normali procedure di cui all’appendice 5, punto 6, lettera c), dell’allegato;
29) “area della geografia di volo”: la proiezione della geografia di volo sulla superficie terrestre;
30) “volume di contingenza”: il volume di spazio aereo al di fuori della geografia di volo, in cui si applicano le procedure di contingenza di cui all’appendice 5, punto 6, lettera d), dell’allegato;
31) “area di contingenza”: la proiezione del volume di contingenza sulla superficie terrestre;
32) “volume delle operazioni”: la combinazione della geografia di volo e del volume di contingenza;
33) “buffer contro i rischi a terra”: un’area sulla superficie terrestre, che circonda il volume operativo ed è specificamente designata per ridurre al minimo i rischi a terra per i terzi nei casi in cui gli aeromobili senza equipaggio lascino il volume delle operazioni;
34) “notte”: le ore comprese tra la fine del crepuscolo serale civile e l’inizio del crepuscolo mattutino civile, quale definita nel regolamento di esecuzione (UE) n. 923/2012 della Commissione (*)..
_____________
(*) Regolamento di esecuzione (UE) n. 923/2012 della Commissione, del 26 settembre 2012, che stabilisce regole dell’aria comuni e disposizioni operative concernenti servizi e procedure della navigazione aerea e che modifica il regolamento di esecuzione (UE) n. 1035/2011 e i regolamenti (CE) n. 1265/2007, (CE) n. 1794/2006, (CE) n. 730/2006, (CE) n. 1033/2006 e (UE) n. 255/2010 (GU L 281 del 13.10.2012, pag. 1).»;
2) all’articolo 5, il paragrafo 5 è sostituito dal seguente:
«5. L’operatore UAS che presenti una dichiarazione all’autorità competente dello Stato membro di immatricolazione in conformità alla parte B, punto UAS.SPEC.020, dell’allegato, per un’operazione conforme a uno scenario standard di cui all’appendice 1 di tale allegato, non è tenuto a ottenere un’autorizzazione operativa in conformità ai paragrafi da 1 a 4 del presente articolo e si applica la procedura di cui all’articolo 12, paragrafo 5. L’operatore UAS si avvale della dichiarazione di cui all’appendice 2 di tale allegato.»;
3) all’articolo 13 è aggiunto un nuovo paragrafo 4:
«4. Qualora intenda effettuare un’operazione nella categoria “specifica”, da svolgersi in tutto o in parte nello spazio aereo di uno Stato membro diverso dallo Stato membro di immatricolazione, l’operatore UAS titolare di un LUC con privilegi in conformità al punto UAS.LUC.060 dell’allegato fornisce all’autorità competente dello Stato membro dell’operazione prevista le seguenti informazioni:
a) una copia delle condizioni di approvazione ricevute in conformità al punto UAS.LUC.050 dell’allegato; e
b) il luogo o i luoghi dell’operazione prevista in conformità al paragrafo 1, lettera b), del presente articolo.»;
4) all’articolo 14 è aggiunto il seguente paragrafo 9:
«9. In aggiunta ai dati di cui al paragrafo 2, gli Stati membri possono raccogliere ulteriori informazioni sull’identità presso gli operatori UAS.»;
5) all’articolo 15, paragrafo 1, la lettera a) è sostituita dalla seguente:
«a) vietare alcune o tutte le operazioni UAS, richiedere particolari condizioni per alcune o per tutte le operazioni UAS o richiedere un’autorizzazione di volo preventiva per alcune o per tutte le operazioni UAS;»;
6) l’articolo 22 è sostituito dal seguente:
«Articolo 22
Fatto salvo l’articolo 20, l’uso di UAS nella categoria “aperta” che non siano conformi ai requisiti di cui alle parti da 1 a 5 dell’allegato del regolamento delegato (UE) 2019/945 della Commissione (*) è consentito per un periodo transitorio di due anni a decorrere da un anno dalla data di entrata in vigore del presente regolamento, nel rispetto delle seguenti condizioni:
a) gli aeromobili senza equipaggio con una massa al decollo inferiore a 500 g sono utilizzati conformemente ai requisiti operativi di cui alla parte A, punto UAS.OPEN.020, punto 1, dell’allegato, da un pilota remoto con un livello di competenza definito dallo Stato membro interessato;
b) gli aeromobili senza equipaggio con una massa al decollo inferiore a 2 kg sono utilizzati mantenendo una distanza minima orizzontale di 50 metri dalle persone e i piloti remoti devono avere un livello di competenza almeno equivalente a quello di cui alla parte A, punto UAS.OPEN.030, punto 2, dell’allegato;
c) gli aeromobili senza equipaggio con una massa al decollo inferiore a 25 kg sono utilizzati rispettando i requisiti operativi di cui al punto UAS.OPEN.040, punti 1 e 2, e i piloti remoti hanno un livello di competenza almeno equivalente a quello di cui alla parte A, punto UAS.OPEN.020, punto 4, lettera b), dell’allegato.
_____________
(*) Regolamento delegato (UE) 2019/945 della Commissione, del 12 marzo 2019, relativo ai sistemi aeromobili senza equipaggio e agli operatori di paesi terzi di sistemi aeromobili senza equipaggio (GU L 152 dell’11.6.2019, pag. 1).»;
7) l’articolo 23 è sostituito dal seguente:
«Articolo 23
1. Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell’Unione europea.
Esso si applica a decorrere dal 1° luglio 2020.
2. L’articolo 5, paragrafo 5, e il punto UAS.SPEC.050, punto 1, lettera l), si applicano a decorrere dal 2 dicembre 2021.
3. Il punto UAS.OPEN.060, punto 2, lettera g), si applica a decorrere dal 1° luglio 2022.
4. Fatto salvo l’articolo 21, paragrafo 1, fino al 2 dicembre 2021 gli Stati membri possono accettare dichiarazioni rese dagli operatori UAS in conformità all’articolo 5, paragrafo 5, sulla base di scenari standard nazionali o equivalenti, se tali scenari nazionali soddisfano i requisiti di cui al punto UAS.SPEC.020 dell’allegato.
Tali dichiarazioni cessano di essere valide dal 2 dicembre 2023.
5. L’articolo 15, paragrafo 3, si applica a decorrere dal 1° luglio 2021.»;
8) l’allegato è sostituito dall’allegato del presente regolamento.
...
Collegati:
[box-note]Regolamento delegato (UE) 2019/945
Droni: il Nuovo Regolamento Unico Europeo e marcatura CE a breve
Regolamento di esecuzione (UE) 2019/947[/box-note]
RAPEX Report 17 del 24/04/2020 N. 3 A12/00628/20 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 17 del 24/04/2020 N. 3 A12/00628/20 Lituania
Approfondimento tecnico: Luci multicolore
Il prodotto, di marca sconosciuta, mod. YL-DC-50, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2014/35/UE del Parlamento europeo e del Consiglio del 26 febbraio 2014 concernente l’armonizzazione delle legislazioni degli Stati membri relative alla messa a disposizione sul mercato del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione ed alla norma tecnica “EN 60598-1:2015 Apparecchi di illuminazione - parte 1: Prescrizioni generali e prove”.
Le parti in tensione nel prodotto sono facilmente accessibili. L'utente potrebbe ricevere una scossa elettrica.
Direttiva 2014/35/UE
Allegato I
Elementi principali degli obiettivi di sicurezza del materiale elettrico destinato a essere adoperato entro taluni limiti di tensione
1. Requisiti generali
a) Le caratteristiche essenziali del materiale elettrico, la cui conoscenza e osservanza sono indispensabili per un impiego conforme alla destinazione ed esente da pericolo, sono indicate sul materiale elettrico stesso oppure, qualora ciò non sia possibile, su un documento che l’accompagna;
b) il materiale elettrico e le sue parti costitutive sono costruiti in modo da poter essere assemblati e collegati in maniera sicura ed adeguata;
c) il materiale elettrico è progettato e fabbricato in modo da assicurare la protezione dai pericoli citati ai punti 2 e 3, sempre che esso sia adoperato in conformità della sua destinazione e osservando le norme di manutenzione.
2. Protezione dai pericoli che possono derivare dal materiale elettrico
In conformità del punto 1, sono previste misure di carattere tecnico affinché:
a) le persone e gli animali domestici siano adeguatamente protetti dal pericolo di lesioni fisiche o altri danni che possono derivare da contatti diretti o indiretti;
b) non possano prodursi sovratemperature, archi elettrici o radiazioni che possano causare un pericolo;
c) le persone, gli animali domestici e i beni siano adeguatamente protetti dai pericoli di natura non elettrica che, come insegna l’esperienza, possono derivare dal materiale elettrico;
d) l’isolamento sia proporzionato alle sollecitazioni prevedibili.
3. Protezione dai pericoli dovuti all’influenza di fattori esterni sul materiale elettrico
In conformità del punto 1, sono previste misure di ordine tecnico affinché il materiale elettrico:
a) presenti le caratteristiche meccaniche richieste in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
b) sia resistente a fenomeni di natura non meccanica nelle condizioni ambientali previste, in modo da non causare pericolo alle persone, agli animali domestici e ai beni;
c) nelle condizioni di sovraccarico prevedibili, non causi pericolo alle persone, agli animali domestici e ai beni.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 17 del 24_04_2020 N. 3 A12_00628_20 Lituania.pdf Luci multicolore |
404 kB | 1 |
MDCG 2020-9 | Ventilatori MD: requisiti normativi
MDCG 2020-9 | Ventilatori MD: requisiti normativi
EU, 29 Aprile 2020
MDCG 2020-9 Regulatory requirements for ventilators and related accessories Medical Device Directive 93/42/CEE.
The World Health Organization (WHO) declared the COVID-19 outbreak a pandemic on March the 12th 2020. Patients infected by SARS-CoV-2 virus and developing the COVID-19 disease with acute and severe respiratory symptoms have to be treated with mechanical ventilators to assure possibilities of survival. This guidance document focuses on ventilators and related accessories that are currently regulated under the Council Directive 93/42/EEC (MDD). According to the MDD, devices may be placed on the market and/or put into service only if they comply with the requirements laid down in this Directive when duly supplied and properly installed, maintained and used in accordance with their intended purpose.
The devices must meet the essential requirements set out in Annex I of the MDD, which apply to them, taking account of the intended purpose of the devices concerned. In addition, devices may be placed and circulate on the European single market if they have been subject to a conformity assessment in accordance with the provisions of Article 11 of the MDD.
Under the current COVID-19 context, the demand for ventilators and related accessories has rapidly increased. Therefore, this document intends to outline the different regulatory options for placing these devices on the EU market indicating their feasibility to allow short-term supply.
_____
[box-note]Index
1. INTRODUCTION AND SCOPE
2. TYPES OF MEDICAL DEVICES AND THEIR PARTS/COMPONENTS
2.1. Ventilators
2.2. Accessories
2.3. Parts or component
3. CLASSIFICATION
3.1. Ventilators
3.2. Accessories
3.3. Impact of classification on conformity assessment
4. REGULATORY OPTIONS FOR PLACING VENTILATORS ON THE MARKET
4.1. Supplying parts, components or the finished devices to medical devices manufacturers currently placing on the market ventilators
4.2. Derogation procedure – placing on the market authorised by the relevant authorities of one Member State in the interest of public health
4.3. Manufacturing of the finished device by a producer that was not previously placing on the market ventilators[/box-note]
TYPES OF MEDICAL DEVICES AND THEIR PARTS/COMPONENTS
Ventilators
Ventilators are breathing support devices and can fall into different types according to their intended use and characteristics
[alert]- Ventilator for critical care: automatic equipment that is intended to augment or provide ventilation of the lungs of the patient when connected to the airway of the patient:
-- intended for use in an environment that provides specialized care for patients whose conditions can be life threatening and who can require comprehensive care and constant monitoring in a professional healthcare facility;
-- intended to be operated by a healthcare professional operator; and
-- intended for those patients who need differing levels of support from artificial ventilation including for ventilator-dependent patients. (See e.g. EN ISO/IEC 80601-2-12:2011 + Cor.:2011).
- Home healthcare environment ventilators for ventilator-dependent patients:
intended for use in the home healthcare environment; intended for use by a lay operator; intended for use with patients who are dependent on mechanical ventilation for their life support. Depending on the intended purpose can be also used in the clinical setting (See e.g. EN ISO 80601-2-72:2015).
- Ventilators for emergency and transport: these ventilators are used in Emergency Medical Service environment, e.g. in ambulances, transport of patients to the hospital, patient transport from hospital to hospital or transport within the hospital. The alarm and safety concept of emergency and transport ventilators in general is designed for a permanent presence of the user. This facilitates fast recognition and response in the event of an alarm or in the event of any malfunction (See e.g. EN 794-3:1998+A2:2009).
- Anaesthetic ventilator: are designed for use during anaesthesia with an anaesthetic breathing system (See e.g. EN ISO 80601-2-13:2012). [/alert]
Ventilators for critical care are usually invasive, which enables the ventilator machine to provide lung support for inspiration and expiration through tracheal intubation. However, most critical care ventilators allow non-invasive ventilation modes for critical care patients as well. Ventilators for non-critical care are usually non-invasive and therefore provide air pressure support to natural breathing through e.g. a facemask.
Ventilators may offer different types of additional complementary functions that include:
- High flow oxygen supply (nasal high flow therapy);
- Monitoring systems;
- Nebulisation systems.
...
CLASSIFICATION
Ventilators
There are different types of ventilators depending on the degree of invasiveness and the setting in which they are used in (e.g. Intensive Care Unit - ICU). Ventilators fall under two different classes in accordance with rule 11 (or rule 9) of Annex IX6,7 to the MDD:
- Class IIa: only applicable to non-invasive devices, e.g. continuous positive airway pressure – CPAP non-intended for critical care, or devices that only support spontaneous breathing.
- Class IIb: applicable to most ventilators.
The classification depends on the intended purpose of the ventilator and has important implications in the selection of appropriate conformity assessment procedure(s) for the device including timing and complexity (see section 4 for details).
[...] Segue in allegato
Fonte: EU
Collegati:
[box-note]Certifico | Sezione Covid-19
Direttiva Dispositivi medici 93/42/CEE
Decreto Legislativo N. 46 del 24 Febbraio 1997
Regolamento (UE) 2017/745
Norme armonizzate Direttiva Dispositivi medici
Raccolta Linee guida MEDDEV Dispositivi medici[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| MDCG 2020-9.pdf EU April 2020 |
914 kB | 15 |
Regolamento (UE) 2020/561
Regolamento (UE) 2020/561
Regolamento (UE) 2020/561 del Parlamento Europeo e del Consiglio del 23 aprile 2020 che modifica il regolamento (UE) 2017/745 relativo ai dispositivi medici, per quanto riguarda le date di applicazione di alcune delle sue disposizioni
GU L 130/18 del 24.04.2020
Entrata in vigore: 24.04.2020
[box-warning]Emergenza COVID-19: con il Regolamento (UE) 2020/561 viene rinviata di un anno l'applicazione del regolamento (UE) 2017/745 Dispositivi medici[/box-warning]
______
Il Parlamento Europeo e il Consiglio dell'Unione Europea,
visto il trattato sul funzionamento dell’Unione europea, in particolare l’articolo 114 e l’articolo 168, paragrafo 4, lettera c),
vista la proposta della Commissione europea,
previa trasmissione del progetto di atto legislativo ai parlamenti nazionali,
previa consultazione del Comitato economico e sociale europeo,
previa consultazione del Comitato delle regioni,
deliberando secondo la procedura legislativa ordinaria,
considerando quanto segue:
[panel](1) Il regolamento (UE) 2017/745 del Parlamento europeo e del Consiglio stabilisce un nuovo quadro normativo per garantire il corretto funzionamento del mercato interno per quanto riguarda i dispositivi medici oggetto di tale regolamento, basandosi su un elevato livello di protezione della salute dei pazienti e degli utilizzatori e tenendo conto delle piccole e medie imprese attive nel settore. Nel contempo, esso fissa standard elevati di qualità e sicurezza dei dispositivi medici al fine di rispondere alle esigenze comuni di sicurezza relative a tali dispositivi. Inoltre, il regolamento (UE) 2017/745 rafforza in maniera significativa i principali elementi dell’approccio normativo vigente di cui alle direttive 90/385/CEE e 93/42/CEE del Consiglio, quali la supervisione degli organismi notificati, le procedure di valutazione della conformità, le indagini e le valutazioni cliniche e la vigilanza e la sorveglianza del mercato, introducendo al tempo stesso disposizioni che garantiscono la trasparenza e la tracciabilità dei dispositivi medici al fine di migliorare la salute e la sicurezza.
(2) L’epidemia di COVID-19 e la relativa crisi sanitaria pubblica rappresentano una sfida senza precedenti per gli Stati membri e costituiscono un onere immenso per le autorità nazionali, le istituzioni sanitarie, i cittadini dell’Unione e gli operatori economici. La crisi sanitaria pubblica ha dato luogo a circostanze eccezionali, che richiedono notevoli risorse supplementari e un aumento della disponibilità di dispositivi medici di vitale importanza, che non si sarebbero potute prevedere all’epoca dell’adozione del regolamento (UE) 2017/745. Tali circostanze eccezionali hanno un impatto considerevole su diversi ambiti contemplati dal regolamento (UE) 2017/745, quali la designazione e il lavoro degli organismi notificati e l’immissione sul mercato e la messa a disposizione sul mercato di dispositivi medici nell’Unione.
(3) Nel contesto dell’epidemia di COVID-19 e della relativa crisi sanitaria, i dispositivi medici, quali i guanti medicali, le mascherine chirurgiche, le attrezzature per la terapia intensiva e altre attrezzature mediche, svolgono un ruolo fondamentale nel garantire la salute e la sicurezza dei cittadini dell’Unione e nel consentire agli Stati membri di prestare le cure mediche necessarie ai pazienti che ne hanno urgente bisogno.
(4) Data l’entità senza precedenti delle sfide attuali, e tenendo conto della complessità del regolamento (UE) 2017/745, è molto probabile che gli Stati membri, le istituzioni sanitarie, gli operatori economici e gli altri soggetti pertinenti non saranno in grado di garantirne l’attuazione e l’applicazione corrette a decorrere dal 26 maggio 2020, come ivi previsto.
(5) Al fine di assicurare il corretto funzionamento del mercato interno e un elevato livello di protezione della salute pubblica e della sicurezza dei pazienti, di garantire la certezza del diritto e di evitare possibili perturbazioni del mercato, è necessario rinviare l’applicazione di determinate disposizioni del regolamento (UE) 2017/745. Tenendo conto dell’epidemia di COVID-19 e della relativa crisi sanitaria, della sua evoluzione epidemiologica e delle risorse supplementari necessarie per gli Stati membri, le istituzioni sanitarie, gli operatori economici e gli altri soggetti pertinenti, è opportuno rinviare di un anno l’applicazione di tali disposizioni del regolamento (UE) 2017/745.
(6) È opportuno rinviare l’applicazione delle disposizioni del regolamento (UE) 2017/745 che altrimenti diventerebbero applicabili a decorrere dal 26 maggio 2020. Per garantire la continua disponibilità dei dispositivi medici sul mercato dell’Unione, compresi i dispositivi medici che sono di vitale importanza nel contesto dell’epidemia di COVID-19 e della relativa crisi sanitaria, è altresì necessario adeguare determinate disposizioni transitorie del regolamento (UE) 2017/745 che altrimenti non sarebbero più applicabili.
(7) Le direttive 90/385/CEE e 93/42/CEE e il regolamento (UE) 2017/745 conferiscono alle autorità nazionali competenti la facoltà di autorizzare, su richiesta debitamente motivata, l’immissione sul mercato di dispositivi medici per i quali le pertinenti procedure di valutazione della conformità non sono state espletate, ma il cui impiego è nell’interesse della protezione della salute, o nell’interesse della salute pubblica o della sicurezza o salute dei pazienti («deroga nazionale»). Il regolamento (UE) 2017/745 consente inoltre alla Commissione, in casi eccezionali, di estendere la validità di una deroga nazionale al territorio dell’Unione per un periodo di tempo limitato («deroga a livello di Unione»). Tenendo conto dell’epidemia di COVID-19 e della relativa crisi sanitaria, la Commissione dovrebbe poter adottare deroghe a livello di Unione in risposta alle deroghe nazionali al fine di affrontare in maniera efficace possibili carenze a livello di Unione di dispositivi medici di vitale importanza. È pertanto opportuno che la pertinente disposizione del regolamento (UE) 2017/745 si applichi alla prima data possibile e che le disposizioni corrispondenti delle direttive 90/385/CEE e 93/42/CEE siano abrogate a decorrere da tale data.
Tenendo conto del fatto che alla Commissione deve essere concessa la possibilità, per un periodo transitorio, di adottare deroghe a livello di Unione in relazione alle deroghe nazionali alle direttive 90/385/CEE e 93/42/CEE, è necessario apportare alcune modifiche alle pertinenti disposizioni del regolamento (UE) 2017/745.
(8) Al fine di includere eventuali deroghe nazionali concesse dagli Stati membri conformemente alle direttive 90/385/CEE o 93/42/CEE nel contesto dell’epidemia di COVID-19 prima dell’entrata in vigore del presente regolamento, è necessario prevedere la possibilità per gli Stati membri di notificare tali deroghe nazionali, e per la Commissione di estenderne la validità al territorio dell’Unione.
(9) Per garantire la continua presenza di un quadro normativo funzionante ed efficace per i dispositivi medici è necessario rinviare l’applicazione della disposizione che abroga le direttive 90/385/CEE e 93/42/CEE.
(10) Poiché gli obiettivi del presente regolamento, ovvero rinviare l’applicazione di determinate disposizioni del regolamento (UE) 2017/745 e consentire l’estensione della validità delle deroghe nazionali concesse a norma delle direttive 90/385/CEE o 93/42/CEE al territorio dell’Unione, non possono essere conseguiti in misura sufficiente dagli Stati membri ma, a motivo della loro portata e dei loro effetti, possono essere conseguiti meglio a livello di Unione, quest’ultima può intervenire in base al principio di sussidiarietà sancito dall’articolo 5 del trattato sull’Unione europea (TUE). Il presente regolamento si limita a quanto è necessario per conseguire tali obiettivi in ottemperanza al principio di proporzionalità enunciato nello stesso articolo.
(11) L’adozione del presente regolamento avviene in circostanze eccezionali derivanti dall’epidemia di COVID-19 e dalla relativa crisi sanitaria pubblica. Al fine di ottenere l’effetto desiderato della modifica del regolamento (UE) 2017/745 per quanto riguarda le date di applicazione di determinate disposizioni, è necessario che il presente regolamento entri in vigore prima del 26 maggio 2020. È stato pertanto ritenuto opportuno disporre un’eccezione al periodo di otto settimane di cui all’articolo 4 del protocollo n. 1 sul ruolo dei parlamenti nazionali nell’Unione europea, allegato al TUE, al trattato sul funzionamento dell’Unione europea e al trattato che istituisce la Comunità europea dell’energia atomica.
(12) Alla luce dell’esigenza imperativa di affrontare immediatamente la crisi sanitaria causata dall’epidemia di COVID-19, è opportuno che il presente regolamento entri in vigore con urgenza il giorno della pubblicazione nella Gazzetta ufficiale dell’Unione europea
(13) È pertanto opportuno modificare di conseguenza il regolamento (UE) 2017/745,[/panel]
HANNO ADOTTATO IL PRESENTE REGOLAMENTO:
...
Articolo 1
Il regolamento (UE) 2017/745 è così modificato:
1) all’articolo 1, paragrafo 2, il secondo comma è così modificato:
a) nella prima frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
b) nella seconda frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
2) l’articolo 17 è così modificato:
a) il paragrafo 5 è così modificato:
i) nella prima frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
ii) nella terza frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
b) al paragrafo 6, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
3) all’articolo 34, paragrafo 1, la data «25 marzo 2020» è sostituita dalla data «25 marzo 2021»;
4) l’articolo 59 è così modificato:
a) il paragrafo 1 è sostituito dal seguente:
«1. In deroga all’articolo 52 del presente regolamento o, per il periodo a decorrere dal 24 aprile 2020 al 25 maggio 2021, in deroga all’articolo 9, paragrafi 1 e 2, della direttiva 90/385/CEE o all’articolo 11, paragrafi da 1 a 6, della direttiva 93/42/CEE, le autorità competenti possono autorizzare, su richiesta debitamente motivata, l’immissione sul mercato o la messa in servizio, nel territorio dello Stato membro interessato, di dispositivi specifici per i quali le procedure applicabili di cui a detti articoli non sono state espletate, ma il cui impiego è nell’interesse della salute pubblica o della sicurezza o salute dei pazienti.»;
b) al paragrafo 2 è aggiunto il comma seguente:
«Lo Stato membro può informare la Commissione e gli altri Stati membri in merito a eventuali autorizzazioni rilasciate a norma dell’articolo 9, paragrafo 9, della direttiva 90/385/CEE o dell’articolo 11, paragrafo 13, della direttiva 93/42/CEE prima del 24 aprile 2020.»;
c) al paragrafo 3, il primo comma è sostituito dal seguente:
«A seguito di un’informazione ai sensi del paragrafo 2 del presente articolo, la Commissione può, in casi eccezionali connessi alla salute pubblica o alla sicurezza o alla salute dei pazienti, mediante atti di esecuzione, estendere per un periodo di tempo limitato la validità di un’autorizzazione rilasciata da uno Stato membro a norma del paragrafo 1 del presente articolo o, nel caso in cui il rilascio sia avvenuto prima del 24 aprile 2020, a norma dell’articolo 9, paragrafo 9, della direttiva 90/385/CEE o dell’articolo 11, paragrafo 13, della direttiva 93/42/CEE, al territorio dell’Unione e fissare le condizioni alle quali il dispositivo può essere immesso sul mercato o messo in servizio. Tali atti di esecuzione sono adottati secondo la procedura d’esame di cui all’articolo 114, paragrafo 3.»;
5) all’articolo 113, la data «25 febbraio 2020» è sostituita dalla data «25 febbraio 2021»;
6) l’articolo 120 è così modificato:
a) al paragrafo 1, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
b) al paragrafo 3, il primo comma è sostituito dal seguente:
«3. In deroga all’articolo 5 del presente regolamento, un dispositivo di classe I ai sensi della direttiva 93/42/CEE, per il quale è stata redatta una dichiarazione di conformità prima del 26 maggio 2021 e per il quale la procedura di valutazione della conformità ai sensi del presente regolamento richiede il coinvolgimento di un organismo notificato, o un dispositivo con un certificato rilasciato ai sensi della direttiva 90/385/CE o della direttiva 93/42/CEE e valido in virtù del paragrafo 2 del presente articolo, può essere immesso sul mercato o messo in servizio fino al 26 maggio 2024, a condizione che a decorrere dal 26 maggio 2021 continui a essere conforme a una di tali direttive, e a condizione che non vi siano cambiamenti significativi nella progettazione e nella destinazione d’uso.
Tuttavia, le prescrizioni del presente regolamento in materia di sorveglianza post-commercializzazione, sorveglianza del mercato, vigilanza, registrazione di operatori economici e dispositivi si applicano e sostituiscono le corrispondenti prescrizioni di cui a dette direttive.»;
c) il paragrafo 4 è sostituito dal seguente:
«4. I dispositivi immessi legittimamente sul mercato ai sensi delle direttive 90/385/CEE e 93/42/CEE anteriormente al 26 maggio 2021 e i dispositivi immessi sul mercato a decorrere dal 26 maggio 2021 ai sensi del paragrafo 3 del presente articolo, possono continuare a essere messi a disposizione sul mercato o a essere messi in servizio fino al 26 maggio 2025.»;
d) al paragrafo 5, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
e) il paragrafo 6 è sostituito dal seguente:
«6. In deroga alle direttive 90/385/CEE e 93/42/CEE, gli organismi di valutazione della conformità che risultano conformi al presente regolamento possono essere designati e notificati anteriormente al 26 maggio 2021. Gli organismi notificati che sono designati e notificati a norma del presente regolamento possono applicare le procedure di valutazione della conformità stabilite nel regolamento e rilasciare certificati a norma del presente regolamento anteriormente al 26 maggio 2021.»;
f) il paragrafo 10 è sostituito dal seguente:
«10. I dispositivi che rientrano nell’ambito di applicazione del presente regolamento a norma dell’articolo 1, paragrafo 6, lettera g), che sono stati legalmente immessi sul mercato o messi in servizio conformemente alle norme in vigore negli Stati membri anteriormente al 26 maggio 2021, possono continuare a essere immessi sul mercato e messi in servizio negli Stati membri interessati.»;
g) il paragrafo 11 è così modificato:
i) nella prima frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
ii) nella seconda frase, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
7) all’articolo 122, il primo comma è così modificato:
a) nella parte introduttiva, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
b) è aggiunto il trattino seguente:
«— l’articolo 9, paragrafo 9, della direttiva 90/385/CEE e l’articolo 11, paragrafo 13, della direttiva 93/42/CEE, che sono abrogati a decorrere dal 24 aprile 2020.»;
8) l’articolo 123 è così modificato:
a) al paragrafo 2, la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
b) il paragrafo 3 è così modificato:
i) alla lettera a), la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021»;
ii) alla lettera d), prima frase, la data «26 maggio 2020» è sostituita da «26 maggio 2021»;
iii) la lettera g) è sostituita dalla seguente:
«g) per i dispositivi riutilizzabili che devono recare il vettore UDI sul dispositivo stesso, l’articolo 27, paragrafo 4, si applica:
i) ai dispositivi impiantabili e ai dispositivi appartenenti alla classe III a decorrere dal 26 maggio 2023;
ii) ai dispositivi appartenenti alle classi IIa e IIb a decorrere dal 26 maggio 2025;
iii) ai dispositivi appartenenti alla classe I a decorrere dal 26 maggio 2027;»;
iv) è aggiunta la lettera seguente:
«j) l’articolo 59 si applica a decorrere dal 24 aprile 2020.»;
9) nell’allegato IX, punto 5.1, lettera h), la data «26 maggio 2020» è sostituita dalla data «26 maggio 2021».
...
Collegati:
[box-note]COVID-19: Proposta di rinvio di un anno per applicazione MDR
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
Decisione 1999/468/CE
Decisione 1999/468/CE
Decisione del Consiglio del 28 giugno 1999 recante modalità per l'esercizio delle competenze di esecuzione conferite alla Commissione
(GU L 184 del 17.7.1999)
Abrogata da Regolamento (UE) n. 182/2011
Collegati
[box-note]Regolamento (UE) n. 182/2011
Regolamento (CE) n. 1882/2003[/box-note]
Direttiva 2003/32/CE
Direttiva 2003/32/CE
Direttiva 2003/32/CE della Commissione, del 23 aprile 2003, recante modalità specifiche relative ai requisiti previsti dalla direttiva 93/42/CEE per i dispositivi medici fabbricati con tessuti d’origine animale
(GU L 105 del 26.4.2003)
Abrogato da:
Regolamento (UE) n. 722/2012 della Commissione, dell’ 8 agosto 2012, relativo ai requisiti particolari per quanto riguarda i requisiti di cui alle direttive 90/385/CEE e 93/42/CEE del Consiglio per i dispositivi medici impiantabili attivi e i dispositivi medici fabbricati con tessuti d’origine animale Testo rilevante ai fini del SEE
(GU L 212 del 9.8.2012)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE
Direttiva 90/385/CEE[/box-note]
Direttiva 2005/50/CE
Direttiva 2005/50/CE
Direttiva 2005/50/CE della Commissione, dell’11 agosto 2005, relativa alla riclassificazione delle protesi articolari dell’anca, del ginocchio e della spalla nel quadro della direttiva 93/42/CEE concernente i dispositivi medici
(GU L 210 del 12.8.2005)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE[/box-note]
Regolamento (UE) n. 207/2012
Regolamento (UE) n. 207/2012
Regolamento (UE) n. 207/2012 della Commissione, del 9 marzo 2012, relativo alle istruzioni per l’uso elettroniche dei dispositivi medici
(GU L 72 del 10.3.2012)
[box-warning]Regolamento di esecuzione (UE) 2021/2226
Il regolamento (UE) n. 207/2012 della Commissione è abrogato. Esso continua tuttavia ad applicarsi ai dispositivi immessi sul mercato o messi in servizio conformemente all’articolo 120, paragrafo 3, del regolamento (UE) 2017/745 fino al 26 maggio 2024[/box-warning]
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE[/box-note]
Regolamento (CE) n. 1882/2003
Regolamento (CE) n. 1882/2003
Regolamento (CE) n. 1882/2003 del Parlamento europeo e del Consiglio del 29 settembre 2003 recante adeguamento alla decisione 1999/468/CE del Consiglio delle disposizioni relative ai comitati che assistono la Commissione nell'esercizio delle sue competenze di esecuzione previste negli atti soggetti alla procedura prevista all'articolo 251 del trattato CE.
(GU L 284 del 31.10.2003)
Collegati
[box-note]Decisione 1999/468/CE
Regolamento (UE) n. 182/2011
Regolamento (CE) n. 1882/2003[/box-note]
Direttiva 2000/70/CE
Direttiva 2000/70/CE
Direttiva 2000/70/CE del Parlamento europeo e del Consiglio, del 16 novembre 2000, che modifica la direttiva 93/42/CEE del Consiglio per quanto riguarda i dispositivi medici che incorporano derivati stabili del sangue o del plasma umano.
(GU L 313 del 13.12.2000)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE[/box-note]
RAPEX Report 15 del 10/04/2020 N. 33 A12/00558/20 Svezia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 15 del 10/04/2020 N. 33 A12/00558/20 Svezia
Approfondimento tecnico: Cerchietto per i capelli
Il prodotto, di marca sconosciuta, mod. 62650, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme al Regolamento (CE) n.1907/2006 REACH, al Regolamento (UE) 2019/1021 (POPS) ed alla Direttiva 2011/65/UE RoHS.
Il banner di Halloween contiene quantità eccessive di bis (2-etilesil) ftalato (DEHP) (valore misurato fino al: 16% in peso) e di paraffine clorurate a catena corta (SCCP) (valore misurato: 0,5% in peso). Le saldature contengono una quantità eccessiva di piombo (valore misurato fino al 10,9% in peso). Il DEHP può danneggiare la salute dei bambini, causando possibili danni al loro sistema riproduttivo. Gli SCCP resistono nell'ambiente, sono tossici per gli organismi acquatici a basse concentrazioni e si bio-accumulano nella fauna selvatica e nell'uomo, rappresentando un rischio per la salute umana e l'ambiente.
Regolamento (CE) n .1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
51. ftalato di bis(2-etilesile) (DEHP)
1. Non possono essere utilizzati come sostanze o in miscele in concentrazioni superiori allo 0,1 % in peso del materiale plastificato, nei giocattoli e negli articoli di puericultura.
2. I giocattoli e gli articoli di puericultura contenenti tali ftalati in concentrazione superiore allo 0,1 % in peso del materiale plastificato non possono essere immessi sul mercato.
4. Ai fini della presente voce, per «articoli di puericultura» si intende qualsiasi prodotto destinato a conciliare il sonno, il rilassamento, l’igiene, il nutrimento e il succhiare dei bambini.
Direttiva 2011/65/UE
ALLEGATO II
Sostanze con restrizioni d’uso di cui all’articolo 4, paragrafo 1, e valori delle concentrazioni massime tollerate per peso nei materiali omogenei
- Piombo (0,1 %)
- Mercurio (0,1 %)
- Cadmio (0,01 %)
- Cromo esavalente (0,1 %)
- Bifenili polibromurati (PBB) (0,1 %)
- Eteri di difenile polibromurato (PBDE) (0,1 %)
- Ftalato di bis(2-etilesile) (DEHP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Benzilbutilftalato (BBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Dibutilftalato (DBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Diisobutilftalato (DIBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
Regolamento (UE) 2019/1021 (POPS)
Articolo 3
Controllo della fabbricazione, dell'immissione in commercio e dell'uso, e inserimento di sostanze nell'elenco
1. Sono vietati la fabbricazione, l'immissione in commercio e l'uso delle sostanze elencate nell'allegato I, sia allo stato puro che all'interno di miscele o di articoli, fatto salvo l'articolo 4.
Regolamento (UE) 2019/1021 (POPS)
Allegato I
Alcani, C10-C13, cloro (paraffine clorurate a catena corta) (SCCP)
1. In deroga a quanto sopra, si consente la produzione, la commercializzazione e l'uso di sostanze o miscele contenenti SCCP in concentrazioni inferiori all'1 % in peso o di articoli contenenti SCCP in concentrazioni inferiori allo 0,15 % in peso.
2. L'uso è consentito per quanto concerne:
a) i nastri trasportatori per il settore minerario e i sigillanti per dighe contenenti SCCP già in uso al 4 dicembre 2015 o anteriormente;
b) gli articoli contenenti SCCP diversi da quelli di cui alla lettera a) già in uso al 10 luglio 2012 o anteriormente.
3. Agli articoli di cui al punto 2 si applica l'articolo 4, paragrafo 2, terzo e quarto comma.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 15 del 10_04_2020 N. 33 A12_00558_20 Svezia.pdf Cerchietto per i capelli |
375 kB | 1 |
Report Validazione in deroga DPI Emergenza Covid-19
Report Validazione in deroga dispositivi di protezione individuale Emergenza Covid-19
INAIL, 04 Ottobre 2020 allegati:
Report allegato 04 ottobre 2020
Report allegato 04 agosto 2020
Report allegato 04 maggio 2020
Report allegato 05 aprile 2020
1. Premessa
Il Decreto-legge n. 18 del 17 marzo 2020 (Cura Italia) detta disposizioni straordinarie per la gestione dell’emergenza Covid-19. L’articolo 15, in particolare, prevede la possibilità di produrre, importare e immettere sul mercato mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni. Sono previste due distinte e separate procedure di validazione in deroga alle normative vigenti, attribuite rispettivamente alla competenza dell’Istituto superiore di sanità (comma 2), per la validazione straordinaria delle mascherine chirurgiche a uso medico (DM), e dell’Inail (comma 3), per la validazione straordinaria dei dispositivi di protezione individuale (DPI). La procedura di validazione in deroga non si applica ai prodotti già in possesso di una valida marcatura CE. Per altre tipologie di mascherine reperibili in commercio prive del marchio CE, che non siano né DM né DPI e che per ciò solo non possono essere destinate né all’utilizzo degli operatori sanitari durante il servizio, né alla protezione dei lavoratori per i quali è prescritto l’uso di specifici dispositivi di sicurezza, non è prevista alcuna procedura di validazione straordinaria, ai sensi dell’articolo 15, ma possono essere prodotte in deroga alle vigenti norme sull’immissione in commercio, ai sensi dell’articolo 16 del decreto legge 18/2020, sotto la responsabilità del produttore, che deve comunque garantire la sicurezza del prodotto. Al riguardo il Ministero della Salute ha precisato che chi le indossa deve comunque rispettare le norme precauzionali sul distanziamento sociale e le altre introdotte per fronteggiare l’emergenza Covid-19.
2. La validazione straordinaria introdotta dall’art. 15
La deroga introdotta dal legislatore fino al termine dello stato di emergenza riguarda la procedura e la relativa tempistica e non gli standard di qualità e sicurezza dei DPI, che si andranno a produrre, importare e commercializzare, che devono assicurare la rispondenza alle norme vigenti. Terminato il periodo di emergenza, sarà ripreso il percorso ordinario e i DPI, validati in attuazione della disposizione richiamata, per continuare a essere prodotti, importati o commercializzati, dovranno ottenere la marcatura CE seguendo la procedura standard. In considerazione della specifica finalità della norma, i DPI contemplati dalla disposizione sono unicamente quelli idonei e funzionali a mitigare i rischi connessi all’emergenza sanitaria in corso. Sul portale www.inail.it sono pubblicate specifiche istruzioni operative per chi intendesse avvalersi della suddetta deroga, ivi incluso il modello semplificato di autocertificazione da scaricare. Nelle istruzioni sono indicati, tra l’altro, i DPI soggetti alla validazione straordinaria dell’Inail e le norme tecniche di riferimento che gli stessi dispositivi devono rispettare. Per gestire le pratiche di validazione e assicurare la più celere conclusione dei procedimenti, l’Inail ha adottato le seguenti misure organizzative:
- è stata costituita una task force multidisciplinare con professionalità tecniche e amministrative provenienti da quattro strutture dell’Istituto (Contarp, Dimeila, Dit e Direzione centrale Ricerca), supportate a livello organizzativo e informatico al fine sia di semplificare al massimo il flusso procedurale istruttorio e di validazione, sia di consentire il rispetto delle misure generali di prevenzione imposte dall’emergenza in corso, attraverso il ricorso massivo al lavoro agile da remoto per l’esame documentale;
- è stata realizzata un’apposita sezione dedicata nel portale web dell’Inail, dove è possibile acquisire tutte le informazioni utili per presentare la richiesta di validazione (per esempio tipologia di DPI, norme tecniche, moduli, Faq). La sezione è aggiornata periodicamente, anche con la pubblicazione della lista dei DPI validati in deroga;
- è stata attivata dapprima una casella di posta elettronica certificata dedicata all’inoltro delle richieste di validazione Questo indirizzo email è protetto dagli spambots. E' necessario abilitare JavaScript per vederlo.
, unica per tutto il territorio nazionale e dal 13 maggio 2020 è stato reso disponibile un nuovo servizio online “Art. 15 Validazione DPI” per la gestione informatizzata delle richieste di validazione straordinaria dei dispositivi di protezione individuale; per accedere al servizio online occorre essere in possesso delle credenziali al portale dell’Istituto. L’Inail verifica la conformità dei prodotti presentati alle normative e agli standard di riferimento e, ove necessario, richiede tempestivamente agli interessati la regolarizzazione di eventuali carenze documentali/amministrative in caso di esito positivo del riscontro tecnico. I controlli tecnici si sostanziano nei seguenti passaggi:
1. verificare se il prodotto di cui si chiede la validazione rientra o meno tra i dispositivi di protezione individuale. Nel caso di prodotti che potrebbero essere valutati come mascherine chirurgiche è segnalata al soggetto interessato tale possibilità;
2. verificare se è stata allegata tutta la documentazione tecnica relativa al dispositivo proposto per l’immissione nel mercato (relazione illustrativa, disegni tecnici, rapporti di prova e relativi risultati, istruzioni di utilizzo);
3. verificare la conformità del DPI ai requisiti essenziali di salute e di sicurezza applicabili nel caso, necessari per stabilire la relativa classe di protezione, come previsto dalla normativa tecnica di riferimento.
L’Inail non svolge prove di laboratorio sui prodotti presentati. La procedura straordinaria di verifica di rispondenza dei DPI alle normative tecniche vigenti è effettuata sulla base dell’autocertificazione presentata e della documentazione prodotta a corredo della stessa sotto la responsabilità del produttore e dell’importatore. È necessario che i produttori o gli importatori di DPI alleghino alla richiesta di validazione i test di prova dei prodotti, effettuati presso laboratori specializzati anche diversi da quelli qualificati (per esempio laboratori universitari), purché l’esecuzione delle prove tecniche e i risultati delle stesse siano conformi a quanto previsto dalla vigente normativa, con particolare riferimento a specifici punti delle norme considerati imprescindibili per il loro utilizzo anche nell’attuale situazione di emergenza sanitaria. In luogo dei report delle prove tecniche, l’Inail accetta anche certificati di conformità rilasciati da enti di certificazione accreditati da un Ente di accreditamento nazionale ufficiale italiano o straniero, come ad esempio CNAS (Cina) e ANAB (USA). Tali certificazioni accreditate devono riguardare espressamente lo specifico prodotto di cui si chiede la validazione in deroga e la destinazione per l’uso come DPI. Altre certificazioni emesse in ambito volontario, ossia al di fuori dell’accreditamento, sono accettabili solo se corredate dai risultati delle prove tecniche effettuate.
3. La modifica operata dall’art 66-bis Legge n. 77/2020
Con l’art. 66-bis della Legge 17 luglio 2020, n. 77, di conversione del Decreto-legge 19 maggio 2020, n. 34, sono state introdotte rilevanti modifiche all’art. 15 del Decreto-legge n. 18 del 2020, con particolare riferimento all’importazione e all’immissione in commercio di mascherine chirurgiche e dispositivi di protezione individuale, rivedendo le competenze rispettivamente dell’ISS e dell’INAIL in relazione allo stato di emergenza epidemiologica da COVID-19.
Per effetto delle modifiche disposte rimane nella competenza dell’Istituto (ed in parallelo dell’ISS per le mascherine chirurgiche) la valutazione esclusivamente delle richieste presentate dai produttori con sede in un paese dell’Unione Europea di dispositivi di protezione individuale, mentre per quelle presentate dagli importatori è previsto il passaggio nella sfera di responsabilità delle Regioni e la costituzione di un Comitato tecnico per la definizione di criteri semplificati di validazione, in deroga alle norme vigenti, che assicurino l'efficacia protettiva idonea all'utilizzo specifico fino al termine del citato stato di emergenza. La norma ha previsto un lasso di tempo di 15 giorni per consentire la concretizzazione delle modalità organizzative per il nuovo flusso nei confronti degli Enti Regione. A partire dal 4 agosto p.v., pertanto, le richieste di validazione straordinaria, ai sensi dell’articolo 15, comma 3, del Decreto-legge n. 18 del 2020, potranno essere inoltrate all’Istituto esclusivamente dai produttori avente sede in un paese dell’Unione Europea. Si rammenta che la validazione straordinaria e in deroga è valevole fino al termine dello stato di emergenza, attualmente prorogato al 15 ottobre 2020.
4. Report dati (aggiornato al 4 agosto 2020)
9.359 totale di richieste pervenute (che comprendono anche invii multipli da parte dello stesso soggetto, richieste identiche inviate più volte, integrazioni documentali, e per quanto riguarda i messaggi pervenuti sulla casella pec dedicata anche solleciti e riscontri, nonché richieste di informazioni) 7.284 pratiche di validazione processate a livello tecnico, esitate in 6.867 provvedimenti/note di risposta inviate agli interessati (N.B. con un provvedimento/nota di risposta sono definite e comunicate una o più validazioni processate a livello tecnico), di cui: 600 definite con provvedimenti positivi di conformità, per la quasi totalità in favore di importatori (v. lista aggiornata periodicamente sul sito dell’Istituto). Per quanto riguarda le domande valutate non conformi, le carenze riscontrate nella documentazione presentata dagli interessati riguardano principalmente: l’assenza di report sulle prove effettuate sui dispositivi, ovvero l’allegazione di test report carenti o non rispondenti nei risultati esposti ai limiti indicati nella normativa tecnica di riferimento; la presentazione di “attestazioni di conformità” o di “certificati di compliance” non valutabili perché rilasciati su base volontaria da enti non accreditati per i DPI e, in alcuni casi, non risultati presenti nei database dei predetti enti; la mancata indicazione puntuale dei modelli di prodotto o del produttore
Fonte: INAIL
Collegati:
[box-note]Elenco dei dispositivi di protezione individuale validati dall’Inail
Mascherine e DPI: La Legge rilancio introduce la competenza regionale per la validazione in deroga
FAQ Validazione in deroga DPI COVID-19
Decreto Cura Italia: validazione straordinaria dei DPI
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Coronavirus: Corretto uso delle mascherine
Decreto Legge 17 marzo 2020 n. 18
Comunicato relativo al decreto-legge 17 marzo 2020 n. 18
Protocollo Sicurezza luoghi di lavoro Covid-19
Ministero dei trasporti: nessuna limitazione transito merci | DPCM 8 Marzo 2020
DPCM 11 marzo 2020
Comunicazione sospensione attività lavorativa | DPCM 11 Marzo 2020
DPCM 9 Marzo 2020
DPCM 9 marzo: Sintesi misure Zona protetta
DPCM 9 Marzo 2020: autodichiarazione spostamento persone fisiche
DPCM 9 Marzo 2020: dichiarazione spostamento Datore di Lavoro
DPCM 8 Marzo 2020
Nuovo Coronavirus: fonti di informazione
Il Rischio biologico lavoro: quadro normativo
D.P.C.M. 1 marzo 2020
Raccomandazioni MLPS 2009: pandemia influenzale luoghi di lavoro
Coronavirus: Garante Privacy e raccolta dei dati Lavoratori[/box-note]
RAPEX Report 13 del 27/03/2020 N. 2 A12/00487/20 Lussemburgo

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 13 del 27/03/2020 N. 02 A12/00487/20 Lussemburgo
Approfondimento tecnico: Mini aspirapolvere
Il prodotto, di marca Pylones, mod. HP01-2018, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2011/65/UE del Parlamento europeo e del Consiglio dell’8 giugno 2011 sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche.
Le saldature contengono una quantità eccessiva di piombo (valore misurato fino al 60%).
Il piombo è pericoloso per l’ambiente.
Direttiva 2011/65/UE
Allegato II
Sostanze con restrizioni d’uso di cui all’articolo 4, paragrafo 1, e valori delle concentrazioni massime tollerate per peso nei materiali omogenei
- Piombo (0,1 %)
- Mercurio (0,1 %)
- Cadmio (0,01 %)
- Cromo esavalente (0,1 %)
- Bifenili polibromurati (PBB) (0,1 %)
- Eteri di difenile polibromurato (PBDE) (0,1 %)
- Ftalato di bis(2-etilesile) (DEHP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Benzilbutilftalato (BBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Dibutilftalato (DBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
- Diisobutilftalato (DIBP) (0,1%) | Aggiunta da Direttiva delegata (UE) 2015/863
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 13 del 27_03_2020 N. 2 A12_00487_20 Lussemburgo.pdf Mini aspirapolvere |
370 kB | 1 |
COVID-19: Proposta di rinvio di un anno per applicazione MDR
COVID-19: Proposta di rinvio di un anno per applicazione MDR
Update 24.04.2020
[box-warning]Pubblicato il Regolamento (UE) 2020/561 che rinvia di un anno l'applicazione del Regolamento (UE) 2017/745[/box-warning]
....
Il 25 marzo 2020 la Commissione ha annunciato che sta lavorando su una proposta di rinvio della data di applicazione del Regolamento (UE) 2017/745 sui dispositivi medici (MDR) per un anno.
La Commissione presenterà questa proposta ai primi di aprile al Parlamento ed al Consiglio per adottarla rapidamente poiché la data di applicazione decorre dal 26 maggio 2020.
Questo decisione alleggerirà la pressione delle autorità nazionali, degli organismi notificati, dei produttori e altri attori e consentirà loro di concentrarsi pienamente sulle priorità urgenti relative alla crisi del coronavirus.
In allegato la proposta.
Fonte: EU
...
Collegati:
[box-note]Regolamento (UE) 2020/561
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
EU FAQ | COVID-19: Procedure di valutazione conformità DPI
EU FAQ | COVID-19: Procedure di valutazione conformità DPI
Conformity assessment procedures for protective equipment
Version 1: 27 March 2020
This document is addressed to prospective manufacturers of protective equipment. The document will be complemented on a regular basis in order to address any additional questions or concerns expressed by the economic operators.
N.B. These Guidelines are intended only to facilitate the application of Regulation (EU) 2016/425, Council Directive 93/42/EEC and Regulation (EU) 2017/745. However, the Commission accepts no responsibility or liability whatsoever with regard to the information in this document.
This information is:
- of a general nature only and is not intended to address the specific circumstances of any particular individual or entity;
- not necessarily comprehensive and complete;
- sometimes referring to actions of external actors over which the Commission services have no direct control and for which the Commission cannot assume responsibility;
- not professional or legal advice.
...
[panel]Q1: Which are the applicable EU legal frameworks in the case of protective equipment?
The COVID-19 is transmitted via small airborne droplets emitted by infected people when sneezing, coughing or talking. Therefore, a wide array of protective products designed to ensure protection against airborne particles or small droplets are used such as: face masks, gloves, coveralls, etc.
Most of these products are among the so-called ‘harmonised products’ for which there is specific EU product legislation in place. A majority of the products used in the context of the current health crisis, including FFP-type masks, are considered as Personal Protective Equipment (PPE) and hence fall under the scope of Regulation (EU) 2016/425.
Other products such as medical gloves, surgical masks, intensive care and other medical equipment are products falling within the scope of the EU legal framework on medical devices – Council Directive 93/42/EEC, to be replaced by Regulation (EU) 2017/745 as from 26 May 2020.
Each of the two legal frameworks fully harmonises the performance requirements for the products that it covers in order to ensure protection of the health and safety of users. Thus, products manufactured in accordance with these rules can circulate freely throughout the internal market and Member States may not introduce additional and diverging requirements regarding the manufacturing and placement on the market of such products.
Q2: Are there mandatory EU standards, which should be followed in order to produce protective equipment?
Both the PPE Regulation and the Directive on Medical Devices lay down essential requirements on health, safety and performance of the products they cover. However, both EU legal frameworks are technologically neutral and do not prescribe any specific mandatory technical solutions for the design of the products. Therefore, a number of technical solutions may be used by manufacturers to meet these essential requirements.
Both the PPE Regulation and the Directive on Medical Devices offer the possibility for manufacturers to rely on specific technical solutions, which are detailed in harmonised standards or parts thereof.
The references of these harmonised standards have been published in the Official Journal of the European Union. Where a manufacturer chooses to adopt such a technical solution, the product is presumed to be in conformity with the applicable essential health, safety and performance requirements.
In the case of face masks, the harmonised standards are EN 149:2001+A1:2009 for the FFP-type masks and EN 14683:2019 for surgical masks.
Compliance with the exact specifications laid down in these standards is not mandatory since manufacturers may choose to adopt different technical solutions. However, the major advantage offered by these technical solutions is that compliance with their prescriptions allows a swifter placement on the market. The reason is that the product does not have to be re-tested once again by a third party/certification authority prior to the placement on the market, if the manufacturer brings evidence that his product has passed all the necessary tests prescribed in the standard.
Q3: If a manufacturer chooses to follow the EN 14683 standard on surgical masks, who should perform the tests specified therein?
The tests are prescribed in the standard and can be performed by the manufacturer himself or by a laboratory on his behalf.
These tests are not strictly speaking a mandatory step prior to the placement on the market.
However, in case of control by the market surveillance authorities, if the manufacturer claims that the product complies with the standard, a sample may be tested in accordance with the test prescribed therein.
Q4: If a manufacturer intends to follow the EN 149 or EN 14683 standards, where can these standards be obtained?
European standards are copyright-owned by the European standardisation organisations which have developed them. Normally, manufacturers must purchase the standards they need from the national members of the European standardisation organisations, i.e. the national standardisation bodies.
However, to ensure that European industry can quickly respond to the increased demand for protective equipment generated by the COVID-19 outbreak, the Commission has agreed with the European standardisation organisation CEN that 14 standards (including EN 149 and 14683) will be exceptionally made freely and fully available by the national standardisation bodies.
Manufacturers can download the standards EN 149 and EN 14683 for free from the online catalogues of the national standardisation bodies.
Q5: Are there any other standards that can be followed in order to produce protective equipment?
Any standard or specific technical solution may be used provided that it complies with the applicable essential requirements laid down by the EU legal frameworks. While the harmonised standards (e.g. EN 149 and EN 14683 on masks above) tend to be the technical solution most widely used by the industry in the EU, there are other specific technical solutions which ensure a comparable level of safety.
The World Health Organisation guidelines on the choice of protective equipment provide a reference in that respect.
However, in contrast to the use of harmonised standards (EN 149 and EN 14683), where a manufacturer chooses to follow one of the alternative standards referred to by the WHO, a sample of the product should be tested by a notified body (third party testing body) in the case of products falling within the scope of the PPE Regulation In the COVID-19 context, the Commission issued on 13 March 2020 a Recommendation to facilitate the rapid uptake of new products on the EU market. On the one hand, the Commission urged all notified bodies (third party testing bodies) to prioritise any new requests submitted by manufacturers for COVID-19 related products. The attention of the notified bodies was drawn to the fact that the WHO guidelines could present alternative adequate technical solutions.
On the other hand, the Recommendation provides for two scenarios in which products, may be already placed on the market even if the conformity assessment procedures have not yet been finalised or, in some exceptional cases, even initiated:
1) If national market surveillance authorities find that equipment in the EU market ensure an adequate level of health and safety in accordance with the essential requirements set out in EU law, they may authorise these products on the EU market, even though the conformity assessment procedures, including the affixing of CE marking, have not been fully finalised.
2) In exceptional circumstances, products can be placed on the market even if the certification procedures have not been initiated and no CE marking has been affixed upon them, if the following cumulative conditions are fulfilled:
a) the products are manufactured in accordance with one of the EN standards or in accordance with any of the other standards referred to in the WHO guidelines or a technical solution ensuring an adequate level of safety;
b) the products are part of a purchase organised by the relevant Member State authorities;
c) the products are only made available for the healthcare workers;
d) the products are only made available for the duration of the current health crisis; and
e) the products are not entering the regular distribution channels and made available to other users.
The assessment of the specific technical solution as per point a) above is to be performed by a market surveillance authority in the course of the purchase process organised by the relevant authority of the Member State.
A number of national market surveillance authorities have already started implementing the recommendation and have developed testing protocols:
- On 20 March 2020, the Bavarian Central Authority of the Federal States for Safety published its testing protocol for face masks;
- On 20 March 2020, the Spanish Ministry of Industry, Commerce and Tourism issued a resolution laying down specific implementation measures;
- On 23 March 2020, the Dutch Health and Youth Inspectorate also communicated a decision on the assessment of the compliance of products manufactured in accordance with non-EU standards with the applicable safety requirements.
Q6: Is there any authorisation/mandatory certification that needs to be performed before the products are placed on the market?
Surgical/medical masks, examination gloves and some types of gowns (when supplied in non-sterile condition) are ‘Class I Medical devices’. As such, they do not require the mandatory involvement of a notified body (third party testing body) prior to being placed on the market. The manufacturer must certify that the product complies with the applicable requirements. This regime is essentially one of self-certification. If such devices are supplied in a sterile condition they are however classified in a higher risk class and a conformity assessment by a Notified Body is required.
Conversely, face masks and other equipment used in the COVID-19 context that are covered by the PPE Regulation are considered as ‘PPE of Category III’. Therefore, a notified body (third party testing body) must be involved in all cases. A sample of the product needs to be presented to such a body for assessment prior to placing on the market. However, under the PPE Regulation, once the initial sample is tested, there is no obligation to subject every single item coming off the production line to the same tests. Instead, there are supervised product checks at random intervals or other similar production control procedures, which are put in place.
Q7: Should the CE marking be affixed in all circumstances?
The CE marking is the final step, marking the end of all procedures prior to the placement on the market. In the case of some Medical Devices, the manufacture may affix this marking, without necessarily involving a third party (c.f. paragraph 1 of Q6 above). In the case of PPE items, the CE marking should normally be affixed by the manufacturer once the first sample of the product has been assessed and approved by the notified body (third party testing body) (c.f. paragraph 2 of Q6
above). In the specific COVID-19 context however, there might be derogations to this requirement in specific circumstances (c.f. sections 1) and 2) in Q5 above).
Please note that according to both legal frameworks, the CE marking should be affixed on each individual item.
Q8: Are there any specifications as to the exact materials to be used to manufacture face masks?
Neither the applicable EU legal frameworks, nor the harmonised standards EN 149 and EN 14683 impose any mandatory specifications as to the materials to be used. The legal frameworks essentially introduce performance requirements, which are further detailed by the relevant standards.
Therefore, manufacturers retain full choice as to the type of materials they can use.
In practice, in the case of FFP-type face masks, the following materials tend to be the most popular choice:
- Filter layer: Polypropylene;
- Valve (if applicable): Rubber or Polypropylene;
- Straps: Polyester, Polyisoprene, Lycra
- Seal: Polyethylene foam, Polyurethane etc.
- Clips/staples (if applicable): aluminium, steel
In the case of surgical masks, the material of choice tends to be a nonwoven material (S-M-S type) using a combination of melt-blown and spun-bond fabrics. The fabrics are usually based on Polypropylene.[/panel]
...
Fonte EU
Collegati:
[box-note]Regolamento DPI | Regolamento (UE) 2016/425
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Rischio biologico Coronavirus | Titolo X D.Lgs. 81/08[/box-note]
CEI EN IEC 63000:2021 - Documentazione tecnica conformità restrizione sostanze pericolose
CEI EN IEC 63000:2021 - Documentazione tecnica conformità restrizione sostanze pericolose
ID 10814 | Rev. 1.0 del 30.06.2021
La norma CEI EN IEC 63000:2021, traduzione in IT della EN IEC 63000, specifica la documentazione tecnica che il costruttore deve compilare per dichiarare la conformità con le restrizioni applicabili alle sostanze.
La Norma sostituisce completamente la Norma CEI EN 50581:2013-05, che rimane applicabile fino al 07-12-2023.
[box-note]Rev. 1.0 del 30.06.2021
CEI EN IEC 63000:2021-03 – Traduzione in lingua italiana della EN IEC 63000[/box-note]
Alcune sostanze contenute nei prodotti elettrici ed elettronici sono soggette a limitazioni di legge e/o indicate nelle specifiche del cliente.
Pertanto i fabbricanti di prodotti finiti devono essere in grado di dimostrare che i loro prodotti rispettano le limitazioni di sostanze. Per quanto attiene alle limitazioni applicabili a livello di componente o materiale, la verifica di tutti i materiali contenuti nel prodotto finito, condotta dai fabbricanti di prodotti elettrici ed elettronici, è impraticabile. I fabbricanti, invece, lavorano con i loro fornitori per la gestione della conformità e compilano una documentazione tecnica a dimostrazione della stessa.
Tale approccio è riconosciuto sia all’interno del settore che dalle autorità di controllo.
Scopo del presente documento è quello di indicare la documentazione tecnica da compilare a cura del fabbricante per dichiarare la conformità alle limitazioni di sostanze, ai sensi dei diversi regolamenti sull’uso di sostanze a livello mondiale.
Il presente documento è basato sulla Norma Europea EN 50581:2012, che supporta la Direttiva 2011/65/UEdel Parlamento Europeo e del Consiglio dell’8 giugno 2011 sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche (RoHS).
___
La norma EN IEC 63000:2018 è stata pubblicata in GU L 155/12 del 18.05.2020. Il riferimento alla norma EN 50581:2012 è ritirato a decorrere dal 18 novembre 2021.
[panel]Decisione di Esecuzione (UE) 2020/659 della Commissione del 15 maggio 2020 sulla norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche elaborata a sostegno della direttiva 2011/65/UE del Parlamento europeo e del Consiglio
GU L 155/12 del 18.05.2020
Entrata in vigore: 18.05.2020
Articolo 1
Il riferimento della norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche redatta a sostegno della Direttiva 2011/65/UE, elencata nell'allegato I della presente decisione, è pubblicata nella Gazzetta ufficiale dell'Unione europea.
Articolo 2
Il riferimento alla norma armonizzata per la documentazione tecnica richiesta per la valutazione di materiali, componenti e apparecchiature elettriche ed elettroniche redatta a sostegno della Direttiva 2011/65/UE, elencata nell'allegato II della presente decisione, è ritirato dalla Gazzetta ufficiale delle Comunità europee Unione a decorrere dalla data indicata in tale allegato.
Allegato I
EN IEC 63000:2018 Documentazione tecnica per la valutazione di prodotti elettrici ed elettronici rispetto alla restrizione delle sostanze pericolose (IEC 63000:2016)
Allegato II
EN 50581:2012 Documentazione tecnica per la valutazione di prodotti elettrici ed elettronici rispetto alla restrizione delle sostanze pericolose
Data di ritiro: 18 novembre 2021[/panel]
[panel]Decreto Legislativo n.27 del 4 Marzo 2014
Attuazione della Direttiva 2011/65/UE sulla restrizione dell’uso di determinate sostanze pericolose nelle apparecchiature elettriche ed elettroniche
GU n.62 del 15-3-2014
Entrata in vigore: 30.03.2014
…
Art. 14 Documentazione del prodotto
1. La documentazione tecnica di cui all'articolo 7, comma 2, è redatta secondo la norma armonizzata EN 50581:2012, e successive modificazioni.
2. La documentazione tecnica è redatta in una delle lingue ufficiali dell'Unione.
3. In seguito ad una richiesta motivata dell’autorità di vigilanza nazionale del mercato di cui all'articolo 19, il fabbricante fornisce una traduzione delle parti pertinenti della documentazione tecnica in italiano. Qualora a un fabbricante sia richiesta la documentazione tecnica o la traduzione di parti di essa dalla predetta autorità di vigilanza, questa può fissare un termine pari a trenta giorni.
4. Nel caso il fabbricante non osservi gli obblighi di cui ai commi 1, 2 e 3, la predetta autorità di vigilanza può richiedere che il fabbricante faccia effettuare a proprie spese una prova, entro un termine determinato, da parte di un organismo notificato per verificare la conformità alle norme armonizzate e ai requisiti di cui all'articolo 4.[/panel]
__________
1. Campo di applicazione
Il presente documento specifica la documentazione tecnica compilata a cura del fabbricante per dichiarare la conformità alle restrizioni applicabili alle sostanze. La documentazione del sistema di gestione del fabbricante esula dal campo di applicazione del presente documento.
2 Riferimenti normativi
I documenti seguenti* sono citati nel testo in modo tale che il loro contenuto costituisca, in tutto o in parte, prescrizioni per il presente documento. Per quanto riguarda i riferimenti datati, si applica esclusivamente l’edizione citata. Per quanto riguarda i riferimenti non datati, si applica l’ultima edizione del documento al quale viene fatto riferimento (comprese eventuali Modifiche).
* N.d.R. Per l’elenco delle Pubblicazioni, si rimanda all’Allegato ZA.
3. Termini e definizioni
- sostanza soggetta a limitazioni sostanza il cui uso in un prodotto, un sottoassieme, una parte, o un materiale è limitato
- fabbricante persona fisica o giuridica che fabbrica oppure fa progettare o costruire un prodotto e lo commercializza con il proprio nome o marchio
- fornitore organizzazione che fornisce al fabbricante materiali, parti e/o sottoassiemi
4 Documentazione tecnica
4.1 Panoramica
Il fabbricante deve compilare la documentazione tecnica per dimostrare la conformità dei prodotti elettrici ed elettronici alle restrizioni sulle sostanze (si veda 0 e 4.3).
4.2 Contenuto della documentazione tecnica
La documentazione tecnica deve comprendere almeno i seguenti elementi:
- una descrizione generale del prodotto;
NOTE La descrizione del prodotto insieme all’uso previsto è uno degli elementi che determinano le (eventuali) esenzioni applicabili.
- documenti relativi a materiali, parti e/o sottoassiemi (si veda 4.3);
- informazioni che mostrano la relazione tra i documenti tecnici individuati in 4.3 e i materiali, le parti e/o i sottoassiemi del prodotto corrispondenti;
- elenco delle Norme e/o delle altre specifiche tecniche utilizzate per definire, o alle quali si riferiscono, i documenti tecnici individuati in 4.3.
4.3 Informazioni su materiali, parti e/o sottoassiemi
4.3.1 Compiti da svolgere a cura del fabbricante
Il fabbricante deve svolgere le seguenti quattro azioni:
- determinare le informazioni necessarie (si veda 4.3.2);
- raccogliere le informazioni (si veda 4.3.3);
- valutare la qualità e l’affidabilità delle informazioni e deciderne l’inclusione nella documentazione tecnica (si veda 4.3.4);
- garantire il mantenimento della validità della documentazione tecnica (si veda 4.3.5).
La Fig. 1 mostra il processo di creazione della documentazione tecnica:
Figura 1 - Rappresentazione schematica del processo per la creazione della documentazione tecnica
...Segue in allegato
Fonti
EN IEC 63000:2021
Certifico Srl - IT | Rev. 1.0 2021
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto |
| 1.0 | 30 Giugno 2021 | CEI EN IEC 63000:2021 |
| 0.0 | 20 Maggio 2020 | EN IEC 63000:2018Traduzione non ufficiale IT |
Collegati
[box-note]CEI EN IEC 63000:2021
Decisione di Esecuzione (UE) 2020/659
Direttiva RoHS: Open Scope dal 22 luglio 2019
Dichiarazione UE di Conformità RoHS III - Modello
Direttiva RoHS: Evoluzioni
Decreto Legislativo n. 27 del 4 Marzo 2014[/box-note]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| EN IEC 63000 2021 - Documentazione tecnica conformità restrizione sostanze pericolose Rev. 1.0 2021.pdf Certifico Srl - Rev. 1.0 2021 |
507 kB | 186 | ||
| EN IEC 63000 2018 Documentazione tecnica valutazione RoHS Rev. 0.0 2020.pdf Certifico Srl - Rev. 00 2020 |
193 kB | 135 |
RAPEX Report 19 del 08/05/2020 N. 01 A12/00682/20 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 19 del 08/05/2020 N. 01 A12/00682/20 Lituania
Approfondimento tecnico: Liquido per sigarette elettroniche
Il prodotto, di marca Vampire Vape, mod. Heidelberg, è stato sottoposto alla procedura di ritiro dal mercato perché non perché non conforme alla Direttiva 2014/40/UE del Parlamento Europeo e del Consiglio del 3 aprile 2014 sul ravvicinamento delle disposizioni legislative, regolamentari e amministrative degli Stati membri relative alla lavorazione, alla presentazione e alla vendita dei prodotti del tabacco e dei prodotti correlati e che abroga la direttiva 2001/37/CE.
Il prodotto contiene una quantità eccessiva di nicotina (valore misurato: 24,3 mg/ml). La nicotina è altamente tossica e può mettere in pericolo la sicurezza dell'utilizzatore, in particolare se il prodotto viene a contatto con la pelle o viene ingerito.
TITOLO III
Sigarette elettroniche e prodotti da fumo a base di erbe
Articolo 20
Sigarette elettroniche
[…] 3. Gli Stati membri provvedono affinché:
a) il liquido contenente nicotina sia immesso sul mercato solo in contenitori di liquido di ricarica appositi il cui volume non superi i 10 ml, in sigarette elettroniche usa e getta o in cartucce monouso con cartucce o serbatoi di volume non superiore a 2 ml;
b) il liquido contenente nicotina non presenti un contenuto di nicotina superiore a 20 mg/ml;
c) il liquido contenente nicotina non contenga gli additivi elencati all’articolo 7, paragrafo 6;
d) per produrre il liquido contenente nicotina siano usati solo ingredienti di elevata purezza. Le sostanze diverse dagli ingredienti di cui al secondo comma del paragrafo 2, lettera b), del presente articolo sono presenti nel liquido contenente nicotina solo a livello di tracce, se tali tracce sono tecnicamente inevitabili durante la produzione;
e) ad eccezione della nicotina, nel liquido contenente nicotina siano usati solo ingredienti che non
presentano, anche se riscaldati, pericoli per la salute umana;
f) le sigarette elettroniche rilascino le dosi di nicotina a livelli costanti in condizioni normali d’uso;
g) le sigarette elettroniche e i contenitori di liquido di ricarica siano a prova di bambino e manomissione,
siano protetti contro la rottura e le perdite e muniti di un meccanismo per una ricarica senza perdite. […]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 19 del 08_05_2020 N. 01 A12_00682_20 Lituania.pdf Liquido per sigarette elettroniche |
356 kB | 1 |
Circolare Ministero della Salute del 05 Maggio 2020 n. 26342
Circolare Ministero della Salute del 05 Maggio 2020 n. 26342
OGGETTO: Richieste di Autorizzazioni in deroga ai sensi dell’art. 11, comma 14 del D.Lgs. n. 46/97 ed Emergenza COVID 19
In merito alla possibilità di ricorrere ad autorizzazioni in deroga per la valutazione della conformità ai fini della immissione in commercio di dispositivi medici ai sensi dell’art. 11, comma 14, del D.Lgs. n. 46/97, si ritiene opportuno fornire alcuni chiarimenti, anche in ragione dell’attuale stato di emergenza dovuto alla pandemia da COVID-19, nonché in considerazione della necessità di ribadire, che sebbene nell’ambito di un contesto emergenziale come l’attuale, è comunque imprescindibile garantire la sicurezza dei dispositivi medici utilizzati. La normativa nazionale a cui fare riferimento è Il D.Lgs. n. 46/97 (che recepisce la direttiva 2007/47/CE) e che stabilisce, all’articolo 11, comma 14: “14. Il Ministero della salute autorizza, su richiesta motivata, l'immissione in commercio e la messa in servizio, nel territorio nazionale, di singoli dispositivi per i quali le procedure di cui ai commi da 1 a 6 non sono state espletate o completate, il cui impiego è nell'interesse della protezione della salute. La domanda di autorizzazione deve contenere la descrizione del dispositivo, dell'azione principale cui è destinato e dei motivi per i quali la domanda è stata presentata. Il Ministero della salute comunica, entro trenta giorni, il provvedimento in merito all'autorizzazione.”
La Commissione europea ha adottato la Raccomandazione UE n. 2020/403, sulle procedure di valutazione della conformità e di vigilanza del mercato nel contesto della minaccia rappresentata dalla COVID-19 e ha pubblicato la Guidance on medical devices, active implantable medical devices and in vitro diagnostic medical devices in the COVID-19 context.
Il documento da ultimo citato, sotto forma di domande e risposte, fornisce una guida su vari punti relativi ai dispositivi medici tra cui: requisiti legali per l'immissione sul mercato e verifica della conformità, procedure di deroga ed uso delle norme armonizzate. In allegato alla linea guida è inoltre presente un elenco delle più rilevanti norme armonizzate per i dispositivi medici pertinenti a COVID19, il cui rispetto conferisce ai dispositivi stessi presunzione di conformità ai requisiti essenziali fissati nelle direttive.
Risulta chiaro dal tenore delle norme e degli altri documenti ora richiamati, che la deroga di cui trattasi, oltre ad essere limitata esclusivamente a quei dispositivi medici indispensabili per il contrasto all’emergenza COVID-19, e rispetto ai quali vi sia una oggettiva carenza, afferisce ai passaggi procedurali richiesti in via ordinaria per l’immissione in commercio e la messa in servizio di singoli dispositivi medici, ferma restando l’imprescindibile necessità che il richiedente produca una domanda di autorizzazione in deroga corredata dei documenti necessari per consentire al Ministero della salute ed agli organismi tecnici competenti di valutare l’effettiva rispondenza del dispositivo ai requisiti di salute e sicurezza che in nessun modo possono essere derogati. Per tale ragione si suggerisce che il richiedente, parallelamente all’avvio della procedura in deroga, presenti ad un Organismo Notificato la documentazione comprovante i requisiti di salute e sicurezza per cui richiede la deroga, dandone evidenza nella domanda di deroga presentata al Ministero.
Tanto premesso, ai fini dell’autorizzazione all’immissione in commercio in Italia in deroga ai sensi dell’art. 11, comma 14 del D.Lgs. n. 46/97, i fabbricanti di dispositivi medici inviano al Ministero della salute, Direzione generale dei dispositivi medici e del servizio farmaceutico un’istanza i cui elementi minimi sono:
[alert]- la motivazione della richiesta;
- l’indicazione circa la ragione del mancato completamento delle ordinarie procedure (laddove già avviate);
- la descrizione del dispositivo;
- l’azione principale cui il dispositivo è destinato.[/alert]
Unitamente alla domanda, i fabbricanti autocertificano, ai sensi del D.P.R. 445/2000:
[alert]- informazioni sul fabbricante e sul suo eventuale rappresentante autorizzato stabilito in Italia o nella UE (per i fabbricanti stabiliti al di fuori dell’Unione europea);
- denominazione, sede sociale e indirizzo PEC del fabbricante, estremi di identificazione del suo legale rappresentante;
- denominazione, sede sociale e indirizzo PEC del mandatario, estremi di identificazione del suo legale rappresentante;
- informazioni relative al dispositivo medico da autorizzare: denominazione, modello, destinazione d’uso, descrizione, azione principale, motivi di presentazione della domanda, estremi di eventuali autorizzazioni all’immissione in commercio come dispositivo medico al di fuori dell’Unione europea, e ogni altra informazione ritenuta utile per la valutazione del dispositivo;
- informazioni per l’etichettatura del dispositivo che dovrà essere in lingua italiana;
- informazioni in merito alle attività già intraprese ai fini della valutazione della conformità (documentazione tecnica, valutazione clinica, analisi rischio/beneficio per l’utilizzo, includendo informazioni rilasciate dall’organismo notificato, ove prescritto, cui il fabbricante si è rivolto circa i tempi previsti per il completamento della valutazione della conformità);
- informazioni in merito alle norme tecniche armonizzate applicate durante i processi di progettazione e fabbricazione;
- informazioni in merito alle modalità con cui il dispositivo soddisfa i requisiti essenziali di sicurezza e prestazione di cui all’allegato I del D.Lgs. 46/97.[/alert]
Nel ribadire che la deroga di cui trattasi, oltre ad essere limitata esclusivamente a quei dispositivi medici indispensabili per il contrasto all’emergenza COVID-19, e rispetto ai quali vi sia una oggettiva carenza, si precisa che la stessa, laddove accordata nell'interesse della protezione della salute, sarà temporanea e il periodo di validità limitato a quanto è strettamente necessario per rendere il dispositivo conforme alle prescrizioni formali previste dalla legislazione o in attesa di sostituti adeguati e comunque non oltre la fine dell’emergenza di cui alla Delibera del Consiglio dei Ministri del 31 gennaio 2020.
I fabbricanti dei dispositivi medici autorizzati in deroga devono assicurare la conformità di tutti i dispositivi da essi messi a disposizione alle caratteristiche descritte nelle informazioni fornite ai fini dell’autorizzazione e alle prescrizioni emesse dal Ministero con l’autorizzazione, e sono soggetti agli obblighi di vigilanza previsti dalle vigenti norme.
...
Fonte: Ministero della Salute
Collegati:
[box-note]COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
Certifico | Sezione Covid-19[/box-note]
RAPEX Report 18 del 01/05/2020 N. 50 INFO/00051/20 Danimarca

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 18 del 01/05/2020 N. 50 INFO/00051/20 Danimarca
Approfondimento tecnico: Mascherina di protezione
Il prodotto, di marca sconosciuta, è stato sottoposto al divieto di commercializzazione perché non conforme al Regolamento (UE) 2016/425 del Parlamento Europeo e del Consiglio del 9 marzo 2016 sui dispositivi di protezione individuale e che abroga la direttiva 89/686/CEE del Consiglio.
Il prodotto ha un marchio CE ma non è certificato come DPI (Dispositivi di Protezione Individuale) da nessun Organismo Notificato.
Di conseguenza, il prodotto potrebbe non soddisfare i requisiti di salute e sicurezza del Regolamento (UE) 2016/425 e proteggere adeguatamente le vie respiratorie.
Il Regolamento (UE) 2016/425 classifica i DPI (Dispositivi di Protezione Individuale) in tre categorie in base alla gravità del rischio da cui devono proteggere l’utilizzatore.
I dispositivi di protezione delle vie respiratorie, come le mascherine, sono DPI (Dispositivi di Protezione Individuale) di III Categoria.
Regolamento (UE) 2016/425
Articolo 17
Regole e condizioni per l'apposizione della marcatura CE
1. La marcatura CE è apposta sul DPI in modo visibile, leggibile e indelebile. Se ciò fosse impossibile o ingiustificato a causa della natura del DPI, la marcatura CE è apposta sull'imballaggio o sui documenti di accompagnamento del DPI.
2. La marcatura CE è apposta sul DPI prima della sua immissione sul mercato.
3. Per i DPI della categoria III, la marcatura CE è seguita dal numero di identificazione dell'organismo notificato che interviene nella procedura di cui agli allegati VII o VIII. Il numero di identificazione dell'organismo notificato è apposto dall'organismo stesso o, in base alle sue istruzioni, dal fabbricante o dal suo mandatario.
4. La marcatura CE e, se del caso, il numero di identificazione dell'organismo notificato possono essere seguiti da un pittogramma o da un'altra marcatura con l'indicazione del rischio dal quale il DPI è destinato a proteggere.
5. Gli Stati membri si avvalgono dei meccanismi esistenti per garantire un'applicazione corretta del regime che disciplina la marcatura CE e promuovono le azioni opportune contro l'uso improprio di tale marcatura.
Regolamento (UE) 2016/425
Articolo 19
Procedure di valutazione della conformità
Le procedure di valutazione della conformità da seguire, per ognuna delle categorie di rischio di cui all'allegato I, sono le seguenti:
a) categoria I: controllo interno della produzione (modulo A) di cui all'allegato IV;
b) categoria II: esame UE del tipo (modulo B) di cui all'allegato V seguito dalla conformità al tipo basata sul controllo interno della produzione (modulo C) di cui all'allegato VI;
c) categoria III: esame UE del tipo (modulo B) di cui all'allegato V e una delle seguenti:
i) conformità al tipo basata sul controllo interno della produzione unito a prove del prodotto sotto controllo ufficiale effettuate ad intervalli casuali (modulo C2) di cui all'allegato VII;
ii) conformità al tipo basata sulla garanzia di qualità del processo di produzione (modulo D) di cui all'allegato VIII.
A titolo di deroga, per i DPI prodotti come unità singole per adattarsi ad un singolo utilizzatore e classificati secondo la categoria III, può essere seguita la procedura di cui alla lettera b).
Regolamento (UE) 2016/425
ALLEGATO I
Categorie di rischio dei DPI
[...] Categoria III
La categoria III comprende esclusivamente i rischi che possono causare conseguenze molto gravi quali morte o danni alla salute irreversibili con riguardo a quanto segue:
a) sostanze e miscele pericolose per la salute;
b) atmosfere con carenza di ossigeno;
c) agenti biologici nocivi;
d) radiazioni ionizzanti;
e) ambienti ad alta temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di almeno 100 °C;
f) ambienti a bassa temperatura aventi effetti comparabili a quelli di una temperatura dell'aria di – 50 °C o inferiore;
g) cadute dall'alto;
h) scosse elettriche e lavoro sotto tensione;
i) annegamento;
j) tagli da seghe a catena portatili;
k) getti ad alta pressione;
l) ferite da proiettile o da coltello;
m) rumore nocivo. [...]
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 18 del 01_05_2020 N. 50 INFO_00051_20 Danimarca.pdf Mascherina di protezione |
370 kB | 2 |
Marcatura AEE
Marcatura AEE
[box-note]Decreto Legislativo 14 marzo 2014 n. 49
Attuazione della direttiva 2012/19/UE sui rifiuti di apparecchiature elettriche ed elettroniche (RAEE). (GU Serie Generale n.73 del 28-03-2014 - Suppl. Ordinario n. 30)
...
Art. 28 Marchio di identificazione del produttore
1. Il produttore appone sulle apparecchiature elettriche ed elettroniche da immettere sul mercato un marchio. Il marchio apposto deve consentire di individuare in maniera inequivocabile il produttore delle AEE e che le stesse sono state immesse sul mercato successivamente al 13 agosto 2005.
2. Il marchio di cui al comma 1, conformemente a quanto stabilito nella norma tecnica CEI EN 50419:2006-05, che adotta senza alcuna modifica la norma europea CENELEC EN 50419:2006-03, deve contenere almeno una delle seguenti indicazioni: nome del produttore, logo del produttore (se registrato), numero di registrazione al Registro nazionale di cui all'articolo 29.
Figura 1 - Marcatura dell’apparecchiatura elettrica ed elettronica CEI EN 50419
3. In aggiunta ad una delle opzioni di marcatura di cui al comma 2, il produttore puo' utilizzare sistemi di identificazione a radio frequenza (RFID), previa comunicazione ed approvazione da parte del Comitato di vigilanza e controllo.
4. Il marchio deve essere visibile, leggibile ed indelebile. Per verificare se la marcatura e' duratura, essa deve risultare leggibile dopo la procedura indicata dalla norma tecnica CEI EN 50419:2006-05, al punto 4.2.
5. Per assicurare che i RAEE non vengano smaltiti come rifiuti urbani misti e facilitarne la raccolta differenziata, il produttore appone sulle apparecchiature il simbolo riportato all'Allegato IX.
6. Il marchio ed il simbolo sono apposti sulla superficie dell'AEE, o su una superficie visibile dopo la rimozione di un coperchio o di una componente dell'apparecchiatura stessa. Tale operazione deve, comunque, poter essere effettuata senza l'utilizzo di utensili.
7. Qualora non sia possibile, a causa delle dimensioni o della funzione del prodotto, apporre il marchio del produttore e il simbolo sull’apparecchiatura elettrica ed elettronica, gli stessi sono apposti sull’imballaggio, sulle istruzioni per l’uso e sulla garanzia, anche se in formato digitale, dell’apparecchiatura elettrica ed elettronica
Art. 29 Registro nazionale dei soggetti obbligati al finanziamento dei sistemi di gestione dei RAEE
1. Il Registro nazionale dei soggetti obbligati al finanziamento dei sistemi di gestione dei RAEE, istituito e funzionante ai sensi del regolamento 25 settembre 2007, n. 185, garantisce la raccolta e la tenuta delle informazioni necessarie a verificare il rispetto delle prescrizioni del presente decreto legislativo e il corretto trattamento dei RAEE, nonche' idonee a consentire la definizione delle quote di mercato di cui all'articolo 35, comma 1, lettera c).
2. Sono tenuti ad iscriversi al Registro nazionale, i produttori prima che inizino ad operare nel territorio italiano, secondo le modalita' indicate all'articolo 1 del regolamento 25 settembre 2007, n. 185.
3. All'interno di tale Registro, oltre alla sezione relativa ai sistemi collettivi di gestione dei RAEE domestici, e' istituita una apposita sezione relativa ai sistemi individuali riconosciuti ai sensi dell'articolo 9.
4. Il produttore di AEE soggetto agli obblighi di cui al comma 1 puo' immettere sul mercato dette apparecchiature solo a seguito di iscrizione presso la Camera di commercio di competenza. All'atto dell'iscrizione, il produttore deve indicare, qualora il codice di attivita' non individui esplicitamente la natura di produttore di AAE, anche lo specifico codice di attivita' che lo individua come tale, nonche' il sistema attraverso il quale intende adempiere agli obblighi di finanziamento della gestione dei RAEE e di garanzia previsti dal presente decreto.
5. L'iscrizione al registro, con l'indicazione delle pertinenti informazioni, e' effettuata esclusivamente per via telematica dal produttore o dal rappresentante autorizzato ai sensi dell'articolo 30, secondo le modalita' indicate all'articolo 3 del regolamento 25 settembre 2007, n. 185. Nel caso in cui l'iscrizione sia effettuata dal rappresentate autorizzato, tale soggetto risponde degli obblighi gravanti sul produttore che lo ha incaricato anche con riferimento agli oneri di registrazione di cui al presente comma.
6. All'atto dell'iscrizione al Registro nazionale il produttore o il suo rappresentante autorizzato fornisce le informazioni previste all'Allegato X e si impegna ad aggiornarle opportunamente.
7. Per facilitare l'iscrizione anche negli altri Stati, il Registro nazionale predispone all'interno del proprio sito web istituzionale, appositi rimandi (link) agli altri registri nazionali.
8. Ai fini della predisposizione e dell'aggiornamento del Registro, le Camere di commercio, industria, artigianato e agricoltura comunicano al Comitato di vigilanza e controllo l'elenco delle imprese iscritte al Registro come produttori di AEE.[/box-note]
Collegati
[box-note]Decreto Legislativo 14 marzo 2014 n. 49[/box-note]
RAPEX Report 16 del 17/04/2020 N. 23 A11/00039/20 Finlandia

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 16 del 17/04/2020 N. 23 A11/00039/20 Finlandia
Approfondimento tecnico: Motosega
Il prodotto, di marca Norrköping, mod. TF-GCS001, è stato sottoposto alla procedura di ritiro dal mercato perché non conforme alla Direttiva 2006/42/CE del Consiglio, del 17 maggio 2006, relativa alle macchine e che modifica la direttiva 95/16/CE ed alla norma tecnica EN ISO 11681-1:2012 “Macchine forestali - Requisiti di sicurezza e prove per motoseghe a catena portatili - Parte 1: Motoseghe a catena per lavori forestali”
La forma e le dimensioni dell’impugnatura sono non conformi. L’utente potrebbe non posizionare correttamente la mano sul prodotto e perdere il controllo della motosega. Inoltre, la resistenza della maniglia è insufficiente e la stessa potrebbe rompersi durante l’uso.
La protezione per la mano ed il freno della catena sono difettosi.
Direttiva 2006/42/CE
Allegato I
1.1.2. Principi d'integrazione della sicurezza
a) Per progettazione e costruzione, le macchine devono essere atte a funzionare, ad essere azionate, ad essere regolate e a subire la manutenzione senza che tali operazioni espongano a rischi le persone, se effettuate nelle condizioni previste tenendo anche conto dell'uso scorretto ragionevolmente prevedibile.
Le misure adottate devono avere lo scopo di eliminare ogni rischio durante l'esistenza prevedibile della macchina, comprese le fasi di trasporto, montaggio, smontaggio, smantellamento (messa fuori servizio) e rottamazione.
b) Per la scelta delle soluzioni più opportune il fabbricante o il suo mandatario deve applicare i seguenti principi, nell'ordine indicato:
- eliminare o ridurre i rischi nella misura del possibile (integrazione della sicurezza nella progettazione e nella costruzione della macchina),
- adottare le misure di protezione necessarie nei confronti dei rischi che non possono essere eliminati,
- informare gli utilizzatori dei rischi residui dovuti all'incompleta efficacia delle misure di protezione adottate, indicare se è richiesta una formazione particolare e segnalare se è necessario prevedere un dispositivo di protezione individuale.
c) In sede di progettazione e di costruzione della macchina, nonché all'atto della redazione delle istruzioni il fabbricante, o il suo mandatario, deve prendere in considerazione non solo l'uso previsto della macchina, ma anche l'uso scorretto ragionevolmente prevedibile.
La macchina deve essere progettata e costruita in modo da evitare che sia utilizzata in modo anormale, se ciò può comportare un rischio. Negli altri casi le istruzioni devono richiamare l'attenzione dell'utilizzatore sulle controindicazioni nell'uso della macchina che potrebbero, in base all'esperienza, presentarsi.
d) La macchina deve essere progettata e costruita tenendo conto delle limitazioni imposte all'operatore dall'uso necessario o prevedibile delle attrezzature di protezione individuale.
e) La macchina deve essere fornita completa di tutte le attrezzature e gli accessori speciali essenziali per poterla regolare, eseguirne la manutenzione e utilizzarla in condizioni di sicurezza.
1.3.2. Rischio di rottura durante il funzionamento
Gli elementi della macchina, nonché i loro organi di collegamento, devono resistere agli sforzi cui devono essere sottoposti durante l'utilizzazione.
I materiali utilizzati devono presentare caratteristiche di resistenza sufficienti ed adeguate all'ambiente di utilizzazione, previsto dal fabbricante o dal suo mandatario, in particolare per quanto riguarda i fenomeni di fatica, invecchiamento, corrosione e abrasione.
Nelle istruzioni devono essere indicati i tipi e le frequenze delle ispezioni e manutenzioni necessarie per motivi di sicurezza. Devono essere indicati dove appropriato gli elementi soggetti ad usura, nonché i criteri di sostituzione. Se nonostante le precauzioni prese sussistono rischi di disintegrazione o di rottura, gli elementi in questione devono essere montati, disposti e/o protetti in modo che i loro eventuali frammenti vengano trattenuti evitando situazioni pericolose.
Le tubazioni rigide o elastiche contenenti fluidi, in particolare ad alta pressione, devono poter sopportare le sollecitazioni interne ed esterne previste e devono essere solidamente fissate e/o protette affinché, in caso di rottura, esse non presentino rischi. In caso di alimentazione automatica del materiale da lavorare verso l'utensile, devono essere soddisfatte le seguenti condizioni per evitare rischi per le persone:
- al momento del contatto utensili/pezzo, l'utensile deve aver raggiunto le sue normali condizioni di lavoro,
- al momento dell'avviamento e/o dell'arresto dell'utensile (volontario o accidentale), il movimento di alimentazione e il movimento dell'utensile debbono essere coordinati.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 16 del 17_04_2020 N. 23 A11_00039_20 Finlandia.pdf Motosega |
385 kB | 3 |
Elenco dei dispositivi di protezione individuale validati dall’Inail
Elenco dei dispositivi di protezione individuale validati dall’Inail
ID 10641 | INAIL, Update 06.05.2021
[box-warning]AVVISO:
Non è più consentito produrre mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni. E' cessata, quindi, la funzione di validazione straordinaria e in deroga dei dispositivi di protezione individuale (dpi) attribuita all’INAL.
Decreto Legge 22 aprile 2021, n. 52
ALLEGATO 2 (ART. 11 (Proroga dei termini correlati con lo stato di emergenza epidemiologica da COVID-19)
...
Art. 15 del decreto legge 17 marzo 2020 n. 18 (Disposizioni straordinarie per la produzione di mascherine chirurgiche e dispositivi di protezione individuale)
1. Fermo quanto previsto dall'articolo 5-bis, per la gestione dell'emergenza COVID-19, e fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, è consentito produrre mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni. (soppresso dalla legge 17 giugno 2021, n. 87) [/box-warning]
[box-warning]AVVISO:
Dal 4 agosto 2020 le richieste di validazione straordinaria possono essere inoltrate all’Inail esclusivamente dai produttori con sede in un paese dell’Unione Europea (Art. 15 Decreto-legge 17 marzo 2020, n. 18 modificato dalla legge di conversione Legge 17 luglio 2020 n. 77). Per i DPI importati la competenza e' regionale, Vedi)[/box-warning]
Emergenza Coronavirus, pubblicato l’elenco dei dispositivi di protezione individuale validati dall’Inail
Elenco dei dispositivi autorizzati - produttori (art. 66 bis l. n. 77 del 17 luglio 2020)
6. Elenco dispositivi di protezione individuale validati - produttori - 03 Maggio 2021
5. Elenco dispositivi di protezione individuale validati - produttori - 07 Aprile 2021
4. Elenco dispositivi di protezione individuale validati - produttori - 04 Marzo 2021
3. Elenco dispositivi di protezione individuale validati - produttori - 05 Gennaio 2021
2. Elenco dispositivi di protezione individuale validati - produttori - 18 Dicembre 2020
1. Elenco dispositivi di protezione individuale validati - produttori - 06 Novembre 2020
Elenco dei dispositivi autorizzati (art. 15 d.l. n. 18 del 17 marzo 2020)
13. Elenco dei dispositivi di protezione individuale validati Inail - 18 Gennaio 2021
12. Elenco dei dispositivi di protezione individuale validati Inail - 18 Dicembre 2020
11. Elenco dei dispositivi di protezione individuale validati Inail - 31 Agosto 2020
10. Elenco dei dispositivi di protezione individuale validati Inail - 10 Agosto 2020
9. Elenco dei dispositivi di protezione individuale validati Inail - 03 Agosto 2020
8. Elenco dei dispositivi di protezione individuale validati Inail - 20 Luglio 2020
7. Elenco dei dispositivi di protezione individuale validati Inail - 06 Luglio 2020
6. Elenco dei dispositivi di protezione individuale validati Inail - 29 Giugno 2020
5. Elenco dei dispositivi di protezione individuale validati Inail - 15 Giugno 2020
4. Elenco dei dispositivi di protezione individuale validati Inail - 15 Giugno 2020
3. Elenco dei dispositivi di protezione individuale validati Inail - 26 Maggio 2020
2. Elenco dei dispositivi di protezione individuale validati Inail - 19 Maggio 2020
1. Elenco dei dispositivi di protezione individuale validati Inail - 23 Aprile 2020
L’art. 15 del decreto legge n. 18 del 2020 detta disposizioni straordinarie per la gestione dell’emergenza Covid-19 e attribuisce all’Inail la funzione di validazione straordinaria e in deroga dei dispositivi di protezione individuale (dpi).
Fermo restando i poteri del Commissario straordinario ai sensi dell’art. 122, si tratta per l’Inail, che collabora alle misure di mitigazione del rischio Covid-19 in qualità di soggetto attuatore degli interventi di protezione civile, di una competenza nuova attribuita in via straordinaria, per il tempo strettamente necessario, fino al termine dello stato di emergenza, in deroga alle procedure ordinarie.
La deroga riguarda la procedura e la relativa tempistica e non gli standard di qualità dei prodotti che si andranno a produrre, importare e commercializzare, che dovranno assicurare la rispondenza alle norme vigenti e potranno così concorrere, unitamente all’adozione delle altre misure generali, al contenimento e alla gestione dell’emergenza epidemiologica in corso. Terminato il periodo di emergenza, sarà ripreso il percorso ordinario e i dpi, validati in attuazione della disposizione richiamata, dovranno, per continuare a essere prodotti, importati o commercializzati, ottenere la marcatura CE seguendo la procedura standard.
In considerazione della specifica finalità della norma, i dpi interessati dalla disposizione sono unicamente quelli funzionali a mitigare i rischi connessi all’emergenza sanitaria in corso e sono indicati nella tabella:
| PROTEZIONE | DISPOSITIVO | NORMA |
|---|---|---|
| Protezione occhi | Occhiali (DPI II cat.) | UNI EN 166:2004 |
| Protezione occhi | Occhiali a maschera (DPI III cat.) | UNI EN 166:2004 |
| Protezione occhi e mucose | Visiera (DPI III cat.) | UNI EN 166:2004 |
| Protezione vie respiratorie | Semimaschera filtrante | UNI EN 149:2009 |
| Protezione vie respiratorie | Semimaschera e quarti di maschera | UNI EN 140:2000 |
| Protezione vie respiratorie | Maschere intere | UNI EN 136:2000 |
| Protezione corpo | Indumenti di protezione (DPI III cat) | UNI EN 14126:2004 UNI EN13688:2013 |
| Protezione mani | Guanti monouso (DPI III cat) | UNI EN 420:2010 UNI EN ISO 374-5:2017 UNI EN ISO 374-2:2020 UNI EN 455 |
A partire da martedì 4 agosto 2020 l’Inail è competente per la sola validazione delle richieste presentate dai produttori con sede in un paese dell’Unione Europea di dispositivi di protezione individuale.
La richiesta, dal 13 maggio 2020, deve essere inviata esclusivamente in via telematica attraverso il servizio online “Art.15 Validazione DPI”, utilizzando il facsimile di autocertificazione allegato e avendo cura di inserire tutti gli allegati richiesti.
Per accedere al servizio, gli utenti privi di credenziali devono procedere alla registrazione al portale istituzionale come utente generico, cliccando sul link “Registrazione”, presente in calce alla pagina oppure seguendo il percorso “Accedi ai Servizi online”>“Registrazione”>“Registrazione Utente Generico”. Gli utenti già in possesso di credenziali troveranno il nuovo servizio attivo nel menu.
Per informazioni e assistenza nella sezione “SUPPORTO” del portale sono a disposizione i seguenti canali di sostegno all’utenza:
- “ Faq", consultabili inserendo nel motore di ricerca la parola dpi o cliccando direttamente sulla sezione “in evidenza”;
- il servizio “Inail risponde”, che consente l’invio di richieste attraverso un form strutturato.
Sono disponibili in calce gli elenchi, corredati di immagini, relativi ai dispositivi autorizzati, che sono soggetti a costante aggiornamento.
...
Fonte: INAIL
Collegati:
[box-note]Validazione straordinaria / Deroga DPI: cessata
Decreto-Legge 19 maggio 2020 n. 34
Legge 17 luglio 2020 n. 77
Documentazione tecnica DPI Vie respiratorie
Mascherine e DPI: La Legge rilancio introduce la competenza regionale per la validazione in deroga
Report Validazione in deroga DPI Emergenza Covid-19
FAQ Validazione in deroga DPI COVID-19
Decreto Cura Italia: validazione straordinaria dei DPI
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Coronavirus: Corretto uso delle mascherine
Decreto Legge 17 marzo 2020 n. 18
Comunicato relativo al decreto-legge 17 marzo 2020 n. 18
Protocollo Sicurezza luoghi di lavoro Covid-19
Ministero dei trasporti: nessuna limitazione transito merci | DPCM 8 Marzo 2020
DPCM 07 Settembre 2020
DPCM 7 Agosto 2020
DPCM 14 Luglio 2020
DPCM 11 giugno 2020
DPCM 11 marzo 2020
Comunicazione sospensione attività lavorativa | DPCM 11 Marzo 2020
DPCM 9 Marzo 2020
DPCM 9 marzo: Sintesi misure Zona protetta
DPCM 9 Marzo 2020: autodichiarazione spostamento persone fisiche
DPCM 9 Marzo 2020: dichiarazione spostamento Datore di Lavoro
DPCM 8 Marzo 2020
Nuovo Coronavirus: fonti di informazione
Il Rischio biologico lavoro: quadro normativo
DPCM 1 marzo 2020
Raccomandazioni MLPS 2009: pandemia influenzale luoghi di lavoro
Coronavirus: Garante Privacy e raccolta dei dati Lavoratori[/box-note]
Raccomandazione 2013/473/UE
Direttiva 2003/12/CE
Direttiva 2003/12/CE
Direttiva 2003/12/CE della Commissione, del 3 febbraio 2003, riguardante la riclassificazione delle protesi mammarie nel quadro della direttiva 93/42/CEE concernente i dispositivi medici
(GU L 28 del 4.2.2003)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE[/box-note]
Regolamento (UE) n. 722/2012
Regolamento (UE) n. 722/2012
Regolamento (UE) n. 722/2012 della Commissione, dell’ 8 agosto 2012 , relativo ai requisiti particolari per quanto riguarda i requisiti di cui alle direttive 90/385/CEE e 93/42/CEE del Consiglio per i dispositivi medici impiantabili attivi e i dispositivi medici fabbricati con tessuti d’origine animale.
(GU L 212 del 9.8.2012)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE
Direttiva 90/385/CEE[/box-note]
Direttiva 2007/47/CE
Direttiva 2007/47/CE
Direttiva 2007/47/CE del Parlamento europeo e del Consiglio, del 5 settembre 2007, che modifica la direttiva 90/385/CEE del Consiglio per il ravvicinamento delle legislazioni degli Stati membri relative ai dispositivi medici impiantabili attivi, la direttiva 93/42/CEE del Consiglio concernente i dispositivi medici, e la direttiva 98/8/CE relativa all’immissione sul mercato dei biocidi (Testo rilevante ai fini del SEE)
(GU L 247 del 21.9.2007)
Abrogata da: Regolamento (UE) 2017/745
Collegati
[box-note]Regolamento (UE) 2017/745
Direttiva Dispositivi medici 93/42/CEE
Direttiva 90/385/CEE
Direttiva 98/8/CE [/box-note]
Direttiva 2001/104/CE
Direttiva 2001/104/CE
Direttiva 2001/104/CE del Parlamento europeo e del Consiglio, del 7 dicembre 2001, che modifica la direttiva 93/42/CEE del Consiglio relativa ai dispositivi medici (Testo rilevante ai fini del SEE)
(GU L 6 del 10.1.2002)
Collegati
[box-note]Direttiva Dispositivi medici 93/42/CEE[/box-note]
EU FAQ | COVID-19: Procedure di valutazione conformità Stampa 3D
EU FAQ | COVID-19: Procedure di valutazione conformità Stampa 3D
EU, 27.03.2020
Il settore della produzione additiva (AM) aiuta a mitigare diversi effetti COVID-19 perché può rapidamente introdurre ulteriori capacità industriali per fabbricare merci mancanti. Il processo di produzione additiva è anche noto come "stampa 3D" (3DP) perché utilizza stampanti 3D per produrre un'ampia gamma di prodotti per diverse applicazioni. Gli stessi prodotti stampati in 3D possono anche essere utilizzati per produrre dispositivi medici.
Al momento, ci sono esempi dell'uso di strumenti di macchine per la stampa 3D per fabbricare componenti di ventilatori polmonari per unità di terapia intensiva. Per aiutare l'industria e le piccole e medie imprese (PMI) a esplorare le capacità industriali offerte dai processi di produzione additiva, di seguito sono sintetizzate le domande più frequenti.
...
[panel]
Procedure di valutazione della conformità per la stampa 3D e per i prodotti stampati in 3D da utilizzare in ambito medico per la COVID-19
Domanda 1: esiste un quadro giuridico dell'UE applicabile alla stampa 3D?
La stampa 3D (3DP), nota anche come produzione additiva (Additive Manufacturing - AM), è un processo di fabbricazione che utilizza stampanti 3D, note anche come macchine per la produzione additiva, per fabbricare altri prodotti di mercato.
Le stampanti 3D, note anche come macchine per la produzione additiva, sono mezzi di produzione che possono essere utilizzati per fabbricare vari prodotti per diverse applicazioni.
Le stampanti 3D figurano tra i cosiddetti "prodotti armonizzati", per i quali esiste una specifica normativa di armonizzazione dell'UE relativa ai prodotti, e rientrano in particolare nella definizione di macchine ai sensi della direttiva 2006/42/CE relativa alle macchine (direttiva macchine). I fabbricanti devono pertanto garantire la conformità delle stampanti 3D ai requisiti essenziali di sicurezza e di tutela della salute applicabili della direttiva macchine, redigere un fascicolo tecnico e apporre la marcatura CE prima di immetterle sul mercato interno dell'UE.
Oltre alla direttiva macchine, altri atti legislativi dell'UE possono essere applicabili alle stampanti 3D: la direttiva 2014/30/UE sulla compatibilità elettromagnetica e la legislazione dell'UE sulle sostanze chimiche, che include la direttiva 2012/19/UE (direttiva RAEE), la direttiva 2011/65/UE (direttiva RoHS II), la direttiva (UE) 2017/2102 e il regolamento (CE) n. 1907/2006 (regolamento REACH).
I prodotti progettati e fabbricati conformemente alla direttiva 2006/42/CE relativa alle macchine possono circolare liberamente in tutto il mercato interno e gli Stati membri non possono introdurre requisiti aggiuntivi e/o divergenti per quanto riguarda la fabbricazione e l'immissione sul mercato di tali prodotti.
I prodotti stampati in 3D possono essere utilizzati di per sé per produrre dispositivi medici che rientrano nell'ambito di applicazione della specifica legislazione dell'UE sui prodotti, come la direttiva 93/42/CEE (direttiva sui dispositivi medici). I fabbricanti di tali dispositivi medici devono pertanto: garantire che i prodotti stampati in 3D rispettino i requisiti della legislazione dell'UE applicabile, eseguire le necessarie procedure di valutazione della conformità, redigere un fascicolo tecnico redigere la dichiarazione di conformità UE e apporre la marcatura CE prima di immettere tali prodotti sul mercato dell'UE (cfr. le successive domande).
Domanda 2: esistono norme dell'UE obbligatorie per le stampanti 3D?
Per quanto riguarda le stampanti 3D, il fabbricante di una macchina, o il suo mandatario, deve garantire che sia effettuata una valutazione dei rischi per stabilire i requisiti di sicurezza e di tutela della salute che concernono la macchina. La macchina deve inoltre essere progettata e costruita tenendo conto dei risultati di tale valutazione dei rischi.
La direttiva 2006/42/CE relativa alle macchine stabilisce i requisiti essenziali di tutela della salute, sicurezza e prestazione dei prodotti contemplati. Tuttavia tale quadro giuridico dell'UE è tecnologicamente neutro e non impone specifiche soluzioni tecniche obbligatorie per la progettazione dei prodotti. I fabbricanti possono pertanto utilizzare diverse soluzioni tecniche per rispettare tali requisiti essenziali.
La direttiva macchine offre ai fabbricanti la possibilità di avvalersi di soluzioni tecniche specifiche, descritte dettagliatamente nelle norme europee armonizzate o parti di esse, i cui riferimenti sono stati pubblicati nella Gazzetta ufficiale dell'Unione europea (GUUE). Se un fabbricante decide di adottare una tale soluzione tecnica, si presume che il prodotto sia conforme ai requisiti essenziali di tutela della salute, sicurezza e prestazione applicabili cui la norma armonizzata intende riferirsi. Se decide invece di adottare altre soluzioni tecniche, il fabbricante deve fornire nel fascicolo tecnico una spiegazione dettagliata sulla conformità di tale soluzione tecnica ai requisiti della legislazione dell'UE.
Di seguito figurano alcune tra le norme armonizzate più pertinenti citate nella GUUE ai sensi della direttiva macchine per le stampanti 3D laser (per metalli):
- EN ISO 12100 (Sicurezza del macchinario – Principi generali di progettazione – Valutazione del rischio e riduzione del rischio)
- EN 60204-1 (Sicurezza del macchinario – Equipaggiamento elettrico delle macchine)
- EN 13849-1 (Sicurezza del macchinario – Parti dei sistemi di comando legate alla sicurezza)
- EN 13850 (Sicurezza del macchinario – Funzione di arresto di emergenza – Principi di progettazione)
- EN ISO 11553-1 (Macchine laser)
- EN 1127-1 (Atmosfere esplosive – Prevenzione dell'esplosione e protezione contro l'esplosione)
- EN ISO 19353 (Sicurezza del macchinario – Prevenzione e protezione contro l'incendio)
Le norme in materia di esplosione e di incendio sono pertinenti anche per le stampanti per materie plastiche.
È utile prendere inoltre in considerazione alcune norme non armonizzate sulla sicurezza dei prodotti laser:
- EN 60825-1 (Sicurezza dei prodotti laser – Parte 1: Classificazione degli apparecchi e requisiti)
Domanda 3: esiste un quadro giuridico dell'UE applicabile ai prodotti stampati in 3D utilizzati in ambito medico?
In base alla destinazione d'uso dei prodotti stampati in 3D, essi possono essere considerati dispositivi medici o accessori, conformemente alle definizioni contenute nella legislazione sui dispositivi medici.
Tali prodotti devono soddisfare tutti i requisiti applicabili contenuti nella direttiva 93/42/CEE. In particolare, gli accessori dei dispositivi medici, che non sono di per sé dispositivi medici, ma che sono destinati dal fabbricante a essere impiegati specificamente per consentire l'uso di un dispositivo medico, possono essere considerati come dispositivi e devono rispettare i requisiti della legislazione sui dispositivi medici. Non è necessariamente così per le parti e i componenti dei dispositivi medici, che non sono contemplati nelle definizioni della direttiva sui dispositivi medici 93/42/CEE, ma che tuttavia si prevede soddisfino i requisiti di sicurezza del dispositivo medico di cui fanno parte.
Ad esempio, le valvole di plastica stampate in 3D utilizzate nei ventilatori polmonari possono essere considerate sia come accessori di dispositivi medici sia come parti e componenti di dispositivi medici.
Se la procedura di valutazione della conformità per il dispositivo medico si basa sul sistema di gestione della qualità dei fabbricanti, è possibile ricorrere alla norma armonizzata seguente:
- EN ISO 13485:2016 Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari (ISO 13485:2016) EN ISO 13485:2016/AC:2018
In base a tale norma, il fabbricante dovrebbe validare il processo di produzione come indicato al punto 7.5.6 della norma stessa. Tra gli altri requisiti, la procedura di validazione dovrebbe comprendere anche la qualificazione delle apparecchiature.
Norme armonizzate sulle parti prodotte additivamente da utilizzare nel settore dei dispositivi medici.
- Non esistono norme armonizzate che si applicano specificamente alle parti prodotte additivamente da utilizzare nel settore dei dispositivi medici, tuttavia è possibile ricorrere ad altre norme.
- Le norme di sicurezza esistenti relative alla fabbricazione e all'utilizzo di parti/componenti specifici del settore dei dispositivi medici sono applicabili indipendentemente dal tipo di macchina/processo utilizzato per la produzione.
- È importante scegliere i materiali corretti per lo sviluppo delle parti o dei componenti necessari (ad es. nel caso delle valvole per ventilatori dovrebbe essere eseguita una prova di compatibilità tra il materiale e il fluido arricchito di ossigeno da somministrare).
- Successivamente alla fabbricazione, è importante che le parti prodotte siano sottoposte a processi adeguati (ad es. pulitura, sterilizzazione, valutazione biologica) per garantire l'assenza di particelle di polvere in eccesso e di altri elementi potenzialmente dannosi.
- Altri requisiti specifici stabiliti nella legislazione dell'UE sui dispositivi medici sono disciplinati da norme, come le norme sulle informazioni fornite dal fabbricante, sulle apparecchiature elettromedicali ecc.
Oltre alle norme armonizzate, è possibile acquisire le specifiche di progettazione per dispositivi e parti, componenti o accessori di dispositivi specifici mediante un accordo con un fabbricante di dispositivi medici esistente o contattando un'autorità nazionale competente.
Elenco di norme armonizzate recentemente pubblicate ai sensi della direttiva sui dispositivi medici e pertinenti per le parti, i componenti e gli accessori dei ventilatori
- EN ISO 17510-1:2009 Terapia respiratoria per l'apnea nel sonno - Parte 1: Dispositivi per la terapia respiratoria dell'apnea nel sonno (ISO 17510-1:2007)
- EN ISO 17510-2:2009 Terapia respiratoria per l'apnea nel sonno - Parte 2: Maschere e accessori di applicazione (ISO 17510-2:2007)
- EN 12342:1998+A1:2009 Tubi di respirazione destinati all'uso con sistemi per anestesia e ventilatori
- EN ISO 8835-3:2009 Sistemi di anestesia per inalazione - Parte 3: Sistemi di trasferimento e di ricezione degli impianti di evacuazione dei gas anestetici (ISO 8835-3:2007) EN ISO 8835-3:2009/A1:2010
- EN ISO 5366-1:2009 Apparecchiature per anestesia e ventilazione polmonare - Tubi di tracheostomia - Parte 1: Tubi e connettori per l'utilizzo su adulti (ISO 5366-1:2000)-
- EN ISO 7376:2009 Apparecchiature per anestesia e ventilazione polmonare - Laringoscopi per intubazione tracheale (ISO 7376:2009)
- EN 13544-1:2007+A1:2009 Attrezzatura per terapia respiratoria - Parte 1: Sistemi di nebulizzazione e loro componenti
- EN 13544-2:2002+A1:2009 Attrezzatura per terapia respiratoria - Parte 2: Tubi e connettori
Questioni riguardanti i materiali utilizzati
È essenziale che i materiali utilizzati per la stampa in 3D siano sicuri ed efficaci e siano sottoposti a prova considerando lo scopo del prodotto stampato in 3D e il suo uso finale, ad es. resistenza termica, resistenza meccanica, resistenza chimica e resistenza alla sterilizzazione.
Domanda 4: esistono specifiche di progettazione per la realizzazione di prodotti stampati in 3D utilizzati nei ventilatori?
- Per la fabbricazione di parti, componenti o accessori di dispositivi medici, le aziende di stampa 3D dovrebbero contattare un fabbricante di dispositivi medici esistente e chiedere le specifiche di progettazione necessarie. Tali specifiche illustreranno i requisiti e i progetti tecnici per il prodotto. Ad esempio, per fabbricare valvole per ventilatori sarebbe fondamentale avere accesso al documento di progettazione per conoscere le caratteristiche dimensionali, i materiali da utilizzare e le tolleranze richieste.
- Si segnala inoltre che è opportuno aggiornare la qualificazione del processo di stampa di ogni nuovo prodotto destinato ad essere stampato in 3D. Ciò è necessario per confermare che l'utilizzo della stampante consente di ottenere la corretta geometria del prodotto stampato in 3D. Dovrebbero essere inoltre individuati e confermati i parametri di processo per la successiva produzione in serie di tali prodotti 3D.
Domanda 5: un prodotto stampato in 3D che rientra nell'ambito di applicazione della direttiva sui dispositivi medici può essere immesso sul mercato con una dichiarazione di conformità?
Come per la precedente domanda 3, ciò dipende dal fatto che il prodotto in questione possa essere considerato o meno come un dispositivo medico. Se il prodotto è considerato come un dispositivo medico ed è un dispositivo a basso rischio (ad es. di classe I), esso può essere immesso sul mercato con una dichiarazione di conformità emessa dal fabbricante o dal suo mandatario. [/panel]
Fonte: EU
Collegati:
[box-note]EU FAQ | COVID-19: Procedure di valutazione conformità DPI
EU FAQ | COVID-19: Guida legislazione disinfettanti per le mani
Direttiva macchine 2006/42/CE
Norme armonizzate Direttiva macchine 2006/42/CE (DM)
Nuovo Coronavirus: fonti di informazione
Il Rischio biologico lavoro: quadro normativo[/box-note]
RAPEX Report 14 del 03/04/2020 N. 1 A12/00494/20 Lussemburgo

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 14 del 03/04/2020 N. 01 A12/00494/20 Lussemburgo
Approfondimento tecnico: Set di gioielli
Il prodotto, di marca sconosciuta, è stato sottoposto alla procedura di divieto di commercializzazione perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio del 18 dicembre 2006 concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
La parte metallica del prodotto rilascia una quantità eccessiva di nichel (valore misurato fino a: 4 µg/cm2/ settimana). Il nichel è un forte sensibilizzante e provoca reazioni allergiche se presente in articoli che entrano in contatto diretto e prolungato con la pelle.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
27. Nickel
1. Non è consentito l’uso:
a) in tutti gli oggetti metallici che vengono inseriti negli orecchi perforati o in altre parti perforate del corpo umano, a meno che il tasso di cessione di nickel da tali oggetti metallici sia inferiore a 0,2 μg/cm2 per settimana (limite di migrazione);
b) in articoli destinati ad entrare in contatto diretto e prolungato con la pelle, quali:
- orecchini,
- collane, bracciali e catenelle, cavigliere, anelli,
- casse di orologi da polso, cinturini per orologi e chiusure di orologi,
- bottoni automatici, fermagli, rivetti, cerniere lampo e marchi metallici, se sono applicati agli indumenti, se il tasso di cessione di nickel dalle parti di questi articoli che vengono a contatto diretto e prolungato con la pelle è superiore a 0,5 μ/cm2/settimana;
c) negli articoli di cui alla lettera b) se hanno un rivestimento senza nickel, a meno che tale rivestimento sia sufficiente a garantire che il tasso di cessione di nickel dalle parti di tali articoli che sono a contatto diretto e prolungato con la pelle non superi 0,5 μg/cm2/settimana per un periodo di almeno due anni di uso normale dell’articolo.
2. Gli articoli che sono oggetto del paragrafo 1 non possono essere immessi sul mercato se non sono conformi alle prescrizioni di tale paragrafo.
3. Le norme adottate dal Comitato europeo di normalizzazione (CEN) sono utilizzate come metodi di prova per dimostrare la conformità degli articoli ai paragrafi 1 e 2.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 14 del 03_04_2020 N. 1 A12_00494_20 Lussemburgo.pdf Set di gioielli |
378 kB | 1 |
Vademecum bombole ossigeno
Vademecum bombole ossigeno / Update Rev. 3.0 Giugno 2025
ID 10520 | Rev. 3.0 del 19 Giugno 2025 / Vademecum completo in allegato
Tutta la disciplina Tecnico/Normativa - Direttiva TPED | ADR
Il Documento allegato, intende fornire un quadro di riferimento trasversale per la sicurezza delle bombole trasportabili di ossigeno (N. CE 231-956 9), rientranti in:
- Direttiva TPED (Direttiva 2010/35/UE);
- Accordo ADR.
[box-note]Update Rev. 3.0 del 19.06.2025
- Aggiornamento ADR 2025[/box-note]
________
Contenuto:
Premessa
1. Disposizioni TPED
1.1 Obblighi dei fabbricanti
1.2 Obblighi dei rappresentanti autorizzati
1.3 Obblighi degli importatori
1.4 Obblighi dei distributori
1.5 Obblighi dei proprietari
1.6 Casi in cui gli obblighi dei fabbricanti sono applicati agli importatori e ai distributori
2. Conformità delle attrezzature a pressione trasportabili
2.1 Conformità delle attrezzature a pressione trasportabili e relativa valutazione
2.2 Rivalutazione della conformità
3. Bombole struttura
4. Marchio π
5. Disposizioni ADR - Bombole Ossigeno
5.1 Progettazione e costruzione
5.2 Equipaggiamento di servizio
5.3 Controlli e prove iniziali
5.4 Controlli e prove periodici
5.5 Prescrizioni applicabili ai costruttori
5.6 Prescrizioni applicabili agli organismi di controllo
6. Marcatura dei recipienti a pressione ricaricabili
7. Trasporto bombole ossigeno
7.1 UN 1072 Ossigeno compresso
7.2 UN 1073 Ossigeno liquido refrigerato
Fonti
...
Excursus
L’ossigeno è un gas incolore, inodore, insapore, non tossico, incombustibile ma perfetto comburente. In presenza di gas combustibili, può dare origine a miscele esplosive. Esso può provocare l’infiammabilità spontanea nelle materie organiche, in particolare oli, grassi o materie da essi impregnate.
All’aumentare della percentuale di ossigeno in aria, aumentano in modo esponenziale tutte le caratteristiche di ossidabilità, combustibilità e infiammabilità.
L’inalazione di ossigeno puro gassoso non è dannosa per l’organismo, salvo casi di esposizione prolungata che possono provocare fenomeni di iperossia. L’inalazione continua di concentrazioni superiori al 75% può causare nausea, vertigini, difficoltà respiratorie.
Il suo utilizzo nelle strutture sanitarie svolge funzioni medicali e terapeutiche per il trattamento di malattie respiratorie e di rianimazione e quale vettore di farmaci per inalazione somministrati mediante nebulizzatori.
Il suo stato fisico nelle condizioni ambientali è gassoso e può essere stoccato allo stato gassoso o liquido:
- Ossigeno gassoso compresso, a circa 200 atmosfere, in una bombola in acciaio, concentrazione di erogazione non inferiore al 99,5%.
- L’ossigeno diventa liquido a -183°C, viene conservato in recipienti criogenici (UNI EN 1251-2) e viene erogato alla concentrazione non inferiore al 99,5%. Un volume di ossigeno liquido genera 873 volumi di ossigeno gassoso alla temperatura ambiente.
[alert]Definizioni (Cap. 1.2.1 ADR)
Bombola, recipiente trasportabile [ADR 2023] a pressione, di capacità in acqua non superiore a 150 litri (cfr. anche "Pacco di bombole")
Recipiente criogenico chiuso, un recipiente a pressione isolato termicamente per il trasporto di gas liquefatti refrigerati, di capacità in acqua non superiore a 1000 l [ADR 2023]
Recipiente criogenico aperto, un recipiente trasportabile, isolato termicamente, per il trasporto di gas liquefatti refrigerati, mantenuto alla pressione atmosferica tramite ventilazione continua del gas liquefatto refrigerato [/alert]
1. Disposizioni TPED
La direttiva 2010/35/UE del Parlamento Europeo e del Consiglio del 16 giugno 2010, direttiva TPED (Trasportable Pressure Equipment Directive), emanata al fine di accrescere la sicurezza delle attrezzature a pressione trasportabili, omologate per il trasporto su strada e ferrovia delle merci pericolose, si applica contenitori (bombole, tubi, fusti a pressione, recipienti criogenici, incastellature di bombole) per il trasporto di gas della classe 2, esclusi i gas o gli oggetti con codici di classificazione contenenti le cifre 6 e 7, nonché per il trasporto delle sostanze pericolose di altre classi indicate nell’allegato I della direttiva 2008/68/CE.
1.1 Obblighi dei fabbricanti
All’atto dell’immissione delle loro attrezzature a pressione trasportabili sul mercato, i fabbricanti garantiscono che esse siano state progettate, fabbricate e corredate di documentazione conformemente ai requisiti stabiliti negli allegati della direttiva 2008/68/CE e nella presente direttiva.
Qualora la conformità delle attrezzature a pressione trasportabili ai requisiti applicabili sia stata dimostrata dalla procedura di valutazione della conformità stabilita dagli allegati della direttiva 2008/68/CE e dalla presente direttiva, i fabbricanti appongono il marchio .
Nell’ambito delle attività di cui alla Direttiva 2010/35/UE, una volta ottenuto il Certificato, il fabbricante, prima dell’immissione sul mercato delle nuove attrezzature a pressione trasportabili o delle parti rimovibile delle attrezzature ricaricabili con una funzione diretta di sicurezza, appone il marchio π sull’attrezzatura certificata seguito dal numero identificativo dell’Organismo Notificato alla Comunità Europea, secondo le modalità indicate all’Allegato III della Direttiva 2010/35/UE.
I fabbricanti conservano la documentazione tecnica specificata negli allegati della direttiva 2008/68/CE. Tale documentazione è conservata per il periodo prescritto da detti allegati. I fabbricanti che ritengono o hanno motivo di credere che le attrezzature a pressione trasportabili che hanno immesso sul mercato non siano conformi agli allegati della direttiva 2008/68/CE o alla direttiva TPED adottano immediatamente le misure correttive necessarie per rendere conformi tali attrezzature, per ritirarle o richiamarle, a seconda dei casi. Inoltre, qualora le attrezzature a pressione trasportabili presentino un rischio, i fabbricanti ne informano immediatamente le autorità nazionali competenti degli Stati membri in cui hanno messo a disposizione le attrezzature a pressione trasportabili, indicando in particolare i dettagli relativi alla non conformità e qualsiasi misura correttiva adottata.
I fabbricanti documentano tutti i casi di non conformità e le misure correttive.
I fabbricanti, a seguito di una richiesta motivata dell’autorità nazionale competente, forniscono a quest’ultima tutte le informazioni e la documentazione necessarie per dimostrare la conformità delle attrezzature a pressione trasportabili, in una lingua che possa essere facilmente compresa da tale autorità.
[...]
2. Conformità delle attrezzature a pressione trasportabili
2.1 Conformità delle attrezzature a pressione trasportabili e relativa valutazione
Le attrezzature a pressione trasportabili di cui all’articolo 1, paragrafo 2, lettera a), devono soddisfare i requisiti relativi alla valutazione della conformità, alle ispezioni periodiche, alle ispezioni intermedie e alle verifiche straordinarie stabiliti negli allegati della direttiva 2008/68/CE e nei capi III e IV della direttiva TPED.
Tali attrezzature sono soggette alle ispezioni periodiche, alle ispezioni intermedie e alle verifiche straordinarie in conformità degli allegati della direttiva 2008/68/CE e dei requisiti di cui ai capi III e IV della direttiva 2010/35/UE. Le parti rimovibili delle attrezzature a pressione trasportabili ricaricabili possono essere oggetto di una valutazione della conformità separata.
[...]
4. Bombole struttura
[...]
6. Marcatura dei recipienti a pressione ricaricabili
I recipienti a pressione ricaricabili devono recare, in modo chiaro e leggibile, il marchio di certificazione, operativo e di fabbricazione.
Questi marchi devono essere apposti in modo permanente (per esempio mediante punzonatura, incisione o fissati) sui recipienti a pressione. I marchi devono essere posizionati sull'ogiva, sull'estremo superiore o sul collo del recipiente a pressione o su uno degli elementi non smontabili.
[...]
7. Trasporto bombole ossigeno
1. UN 1072 Ossigeno compresso
Gas compresso: un gas che, quando è imballato sotto pressione per il trasporto, è completamente gassoso a -50 °C, questa categoria comprende tutti i gas aventi una temperatura critica inferiore o uguale a -50 °C
2. UN 1073 Ossigeno liquefatto refrigerato
Gas liquefatto refrigerato: un gas che, quando è imballato sotto pressione per il trasporto è parzialmente liquido in funzione della sua bassa temperatura
7.1 UN 1072 Ossigeno compresso
Etichettatura dei recipienti per gas ossigeno compresso
Etichettatura secondo ADR
Etichettatura secondo il Regolamento CE n. 1272/2008 CLP
Ossigeno compresso classificazione N. CE 231-956-9
... Segue in allegato
Certifico Srl - IT | Rev. 3.0 2025
©Copia autorizzata Abbonati
Matrice Revisioni:
| Rev. | Data | Oggetto | Autore |
| 3.0 | Giugno 2025 | Aggiornamento ADR 2025 | Certifico Srl |
| 2.0 | Aprile 2024 | Aggiornamento ADR 2023 | Certifico Srl |
| 1.0 | Marzo 2021 | Aggiornamento ADR 2021 | Certifico Srl |
| 0.0 | Aprile 2020 | -- | Certifico Srl |
Collegati
[box-note]Direttiva 2010/35/UE
Direttiva 2008/68/CE[/box-note]
COVID 19 | Guida UE dispositivi medici/impiantabili attivi/in vitro
COVID 19 | Guida UE dispostivi medici/impiantabili attivi/in vitro
EU, 03.04.2020
Guidance on medical devices, active implantable medical devices and in vitro diagnostic medical devices in the COVID-19 context
[panel]Question 1: What is a medical device, active implantable medical device and an in vitro diagnostic medical device?
Medical devices are defined by Article 1 of the Medical devices directive (93/42/EEC), Active implantable medical devices are defined by Article 1 of the Directive on active implantable medical devices (90/385/EEC), In vitro diagnostic medical devices are defined by Article 1 of the Directive on in vitro diagnostic medical devices (98/79/EC),
Question 2: What are the legal requirements for placing such medical devices on the EU market and how should the compliance with them be verified and documented?
In order to place a medical device of any of the three types on the market, the manufacturer has to comply with the provisions of the applicable Directive mentioned under Q1.
Based on the level of potential hazard inherent in the type of device concerned the devices are classified in risk classes for which different types of conformity assessment procedures are applied.
For low risk devices, the manufacturer ensures and declares conformity with the applicable requirements. The Directives contain essential requirements that the device must satisfy and certain requirements on the technical documentation to be prepared by the manufacturer.
Medium and high risk devices (such as masks supplied in a sterile condition, ventilators, or diagnostic self-tests) require an intervention of a notified body which would in most cases need to assess both the manufacturer’s quality management system and the specific device technical documentation prior to issuing a certification. Notified bodies are listed in the NANDO (New Approach Notified and Designated Organisations) Information System,
Question 3: How can standards be used under the legislation?
The Directives lay down essential requirements on safety and performance of the devices they cover, but do not prescribe any specific mandatory technical solutions for the manufacturing and design of the devices. Therefore, the manufacturer can choose which technical solution to use to meet these essential requirements.
The Directives offer the possibility for manufacturers to rely on specific technical solutions, which are detailed in harmonised European standards or parts thereof. The references to these harmonised standards are published in the Official Journal of the European Union. Where a manufacturer chooses to follow a harmonised standard, the product is presumed to be in conformity with the applicable essential health, safety and performance requirements. The harmonised standards under the Medical devices directive most relevant for the public health crisis associated to the COVID19 outbreak are listed in annex 1.
Most European standards for medical devices have their origin in international ISO or IEC standards. The annex 2 to this Q & A contains a table indicating the recognition of international standards under the legal systems of the member jurisdictions of the International Medical Device Regulators Forum (IMDRF).
Question 4: Where can standards be obtained?
Normally, manufacturers must purchase the standards they need from the national members of the European standardisation organisations in the field (CEN and CENELEC), i.e. the national standardisation bodies.
However, to ensure that European industry can quickly respond to the increased demand of medical devices generated by the public health crisis associated to the COVID-19 outbreak, the Commission has agreed with the European standardisation organisations that several standards are made freely and fully available by the national standardisation bodies.
Manufacturers can download these standards without cost from the online catalogues of the national standardisation bodies.
Question 5: Due to the urgency caused by the COVID-19 outbreak, is there a possibility to derogate from the normal conformity assessment procedures?
The directives prescribe that, on duly justified request, a Member State may, in the interest of protection of health, authorize the placing on the market within the territory of the Member State concerned, of individual devices for which the conformity assessment procedures haven´t been carried out yet. The public health crisis associated to the COVID-19 outbreak is to be considered justified circumstance for that purpose.
In addition, the Commission Recommendation (EU) 2020/403 on conformity assessment and market surveillance of 13 March 2020 provides recommendations to Member States with regard to personal protective equipment and medical devices for protection (such as surgical masks, exploration gloves and some gowns). The recommendation is accompanied by a guidance document on conformity assessment procedures for protective equipment.
When assessing the need for a derogation, the national competent authority in a Member State may consider factors such as:
1. the degree of criticality of the use of the device for the protection of health;
2. availability of suitable substitutes;
3. documentation of compliance with a harmonised standard or other specific technical solutions ensuring fulfilment of the applicable essential requirements laid down in the relevant Directive;
4. review of reports of tests performed by competent bodies;
5. indications from vigilance and/or market surveillance.
The derogation should be temporary and the period of validity limited to what is strictly required for rendering the device compliant with the legislation or, if earlier, when suitable substitutes can be expected or the critical needs will no longer be present.
If Member States identify on the market devices for which the conformity assessment procedures have not been carried out and no valid derogation decision has been issued, they should take appropriate market surveillance measures in accordance with the relevant directive. Recent experience indicates that there is, in addition, a need to be attentive to falsified certificates and counterfeit devices.
Question 6: Is it necessary to register the devices?
In most cases there is an obligation for a manufacturer who makes devices available on the market to inform the competent authorities of the Member State in which he has his registered place of business, about the address of the registered place of business and the description of the devices concerned. Manufacturers outside the EU must have an authorised representative in the EU who then informs Member State competent authorities of the above.
Question 7: How can I get in touch with the national competent authorities?
The national competent authorities are listed here: https://ec.europa.eu/growth/sectors/medical-devices/contacts_en
Question 8: Off label use of a medical device
A medical device should be used as intended by the manufacturer and described in the instructions for use. If a device is used in any other way, this is considered ‘offlabel’ use. Off-label use of a device could entail serious risks.
When it is deemed necessary to use an existing medical device for a purpose or in a way that is different from that intended by the manufacturer, risks and benefits to the patient must be carefully assessed.
The assessment may typically include steps or factors such as:
- a documented risk assessment on the use of the device
- consideration of ethical and legal implications
- implementation of suitable precautions to minimise the risk
- reviewing the risk assessment at suitable periods
- obtaining approval from the national competent authorities when required.
Question 9: Will the new Regulations on medical devices and in vitro diagnostic medical devices replace the three current Directives?
The new Regulations (MDR and IVDR) will replace the current Directives 90/385/EEC and 93/42/EEC on 26 May 2020 and 98/79/EC on 26 May 2022.
In light of the public health crisis associated to the COVID-19 outbreak and with patient health and safety as a guiding principle, Commission adopted, on 3 April, a proposal to postpone the current application date of 26 May 2020 of the Medical Devices Regulation (MDR) for one year is ongoing. The Commission intends to submit the proposal to the co-legislators (the European Parliament and Council) in early April 2020 with the aim to have the proposal adopted before the end of May.
Information about the new Regulations is available at https://ec.europa.eu/growth/sectors/medical-devices/new-regulations_en
N.B. These Guidelines are intended solely for facilitating the application of Council Directives 90/385/EEC, 93/42/EEC and 98/79/EC. However, the Commission accepts no responsibility or liability whatsoever with regard to the information in this document. This information provided in this document is:
- of a general nature only and is not intended to address the specific circumstances of any particular individual or entity;
- not necessarily comprehensive and complete;
- sometimes referring to actions of external actors over which the Commission services have no direct control and for which the Commission cannot assume responsibility;
- not of professional nature or should not be read as legal advice;
- to the extent that these Q&A:s may interpret legislation, the Commission's position is without prejudice to any interpretation of this legislation that may be issued by the Court of Justice of the European Union.
Annexes:
1. Harmonised standards under 93/42/EEC - Medical devices directive with relevance to COVID-19
2. Table indicating recognition of international standards under the legal systems of the member jurisdictions of the International Medical Device Regulators Forum (IMDRF) – based on information provided in 2019, updated with regard to EU Harmonised standards April 2020: https://ec.europa.eu/docsroom/documents/40606[/panel]
Fonte: EU
Collegati:
[box-note]UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745[/box-note]
Raccomandazione (UE) 2020/403
Raccomandazione (UE) 2020/403
Raccomandazione (UE) 2020/403 della Commissione del 13 marzo 2020 sulle procedure di valutazione della conformità e di vigilanza del mercato nel contesto della minaccia rappresentata dalla COVID-19
GU L 79 I/1 del 16.03.2020
...
HA ADOTTATO LA PRESENTE RACCOMANDAZIONE:
1. Al fine di assicurare la disponibilità di DPI e dispositivi medici per garantire un’adeguata protezione nel contesto dell’epidemia di COVID-19, la Commissione invita tutti gli operatori economici lungo l’intera catena di approvvigionamento nonché gli organismi notificati e le autorità di vigilanza del mercato a mettere in atto tutte le misure a loro disposizione per sostenere gli sforzi volti a garantire che l’offerta di DPI e di dispositivi medici in tutto il mercato dell’UE soddisfi la domanda in continuo aumento. Tali misure non dovrebbero tuttavia avere un effetto negativo sul livello generale di salute e di sicurezza e tutti i soggetti interessati dovrebbero provvedere affinché qualsiasi DPI o dispositivo medico immesso sul mercato dell’UE continui a garantire un livello adeguato di protezione della salute e della sicurezza degli utilizzatori.
PROCEDURE DI VALUTAZIONE DELLA CONFORMITÀ
2. Gli organismi notificati di cui al Regulation (EU) 2016/425 dovrebbero trattare in via prioritaria e condurre rapidamente le attività di valutazione della conformità nel quadro di tutte le nuove richieste presentate dagli operatori economici in relazione ai DPI necessari per garantire la protezione nel contesto dell’epidemia di COVID-19.
3. Nel caso di DPI fabbricati applicando soluzioni tecniche diverse dalle norme armonizzate, le raccomandazioni dell’OMS sulla selezione appropriata dei DPI possono essere utilizzate come fonte di riferimento potenziale per tali soluzioni tecniche, a condizione che queste ultime garantiscano un adeguato livello di protezione corrispondente ai requisiti essenziali di salute e di sicurezza applicabili in forza del Regulation (EU) 2016/425 .
4. Gli organismi notificati che rilasciano certificati per DPI fabbricati applicando soluzioni tecniche diverse dalle norme
armonizzate dovrebbero informare immediatamente l’autorità di notifica competente e gli altri organismi notificati di cui al Regulation (EU) 2016/425 in merito ai certificati rilasciati e alle specifiche soluzioni tecniche applicate. Gli organismi notificati dovrebbero scambiarsi tali informazioni tramite il gruppo di coordinamento degli organismi notificati istituito a norma dell’articolo 36 del Regulation (EU) 2016/425 .
5. Nel caso dei dispositivi medici dovrebbe essere presa in considerazione anche la possibilità che gli Stati membri autorizzino deroghe alle procedure di valutazione della conformità, conformemente all’articolo 11, paragrafo 13, della direttiva 93/42/CEE, e all’articolo 59 del regolamento (UE) 2017/745, una volta che quest’ultimo diverrà applicabile, anche nei casi in cui non sia richiesto l’intervento di un organismo notificato.
PROCEDURE DI VIGILANZA DEL MERCATO
6. Le competenti autorità di vigilanza del mercato negli Stati membri dovrebbero concentrarsi in via prioritaria sui DPI o sui dispositivi medici non conformi che sollevano seri rischi per la salute e la sicurezza degli utilizzatori cui sono destinati.
7. Qualora le autorità di vigilanza del mercato constatino che i DPI o i dispositivi medici garantiscono un adeguato livello di salute e di sicurezza conformemente ai requisiti essenziali stabiliti dal Regulation (EU) 2016/425 o ai requisiti di cui alla direttiva 93/42/CEE o al regolamento (UE) 2017/745, anche se le procedure di valutazione della conformità (compresa l’apposizione della marcatura CE) non sono state interamente finalizzate in conformità alle norme armonizzate, le autorità di vigilanza del mercato possono autorizzare la messa a disposizione di tali prodotti sul mercato dell’Unione per un periodo di tempo limitato mentre vengono completate le necessarie procedure.
8. Anche i DPI o i dispositivi medici privi della marcatura CE potrebbero essere valutati e far parte di acquisti organizzati dalle autorità competenti degli Stati membri, purché sia garantito che tali prodotti siano resi disponibili unicamente agli operatori sanitari per la durata dell’attuale crisi sanitaria e che non siano introdotti nei circuiti di distribuzione regolari e messi a disposizione di altri utilizzatori.
9. Le autorità di vigilanza del mercato dovrebbero informare immediatamente la Commissione e gli altri Stati membri di qualunque regime temporaneo da esse concesso a specifici DPI o dispositivi medici. Per quanto riguarda i DPI, ciò dovrebbe avvenire tramite il sistema di informazione e comunicazione per la vigilanza del mercato (ICSMS).
...
Collegati:
[box-note]Regolamento DPI | Regolamento (UE) 2016/425
UNI EN 149:2009 | Marcatura CE semimaschere filtranti FFP
Decisione di esecuzione (UE) 2020/437
Direttiva Dispositivi medici 93/42/CEE
Coronavirus: Corretto uso delle mascherine
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Rischio biologico Coronavirus | Titolo X D.Lgs. 81/08
DPCM 22 Marzo 2020
DPCM 11 marzo 2020
DPCM 9 Marzo 2020
DPCM 8 Marzo 2020
Nuovo Coronavirus: fonti di informazione
Protocollo Sicurezza luoghi di lavoro Covid-19[/box-note]
RAPEX Report 12 del 20/03/2020 N. 4 A12/00434/20 Lituania

RAPEX: Rapid Alert System for Non-Food Consumer Products
Report 12 del 20/03/2020 N. 04 A12/00434/20 Lituania
Approfondimento tecnico: Liquido tergicristallo
Il prodotto Clean & Go, di marca sconosciuta, è stato sottoposto alla procedura di richiamo presso i consumatori perché non conforme al Regolamento (CE) n. 1907/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006 , concernente la registrazione, la valutazione, l'autorizzazione e la restrizione delle sostanze chimiche (REACH), che istituisce un'Agenzia europea per le sostanze chimiche, che modifica la direttiva 1999/45/CE e che abroga il regolamento (CEE) n. 793/93 del Consiglio e il regolamento (CE) n. 1488/94 della Commissione, nonché la direttiva 76/769/CEE del Consiglio e le direttive della Commissione 91/155/CEE, 93/67/CEE, 93/105/CE e 2000/21/CE.
Il prodotto contiene una quantità eccessiva di metanolo (valore misurato: 20,06% in peso). Il metanolo è molto tossico per il sistema nervoso centrale e l'occhio. L'ingestione di metanolo porta alla cecità e alla morte.
Regolamento (CE) n. 1907/2006
Allegato XVII
Restrizioni in materia di fabbricazione, immissione sul mercato e uso di talune sostanze, miscele e articoli pericolosi
69. Metanolo
N. CAS 67-56-1
N. CE 200-659-6
Non è ammessa l'immissione sul mercato per la vendita al pubblico dopo il 9 maggio 2019 in liquidi di lavaggio o sbrinamento del parabrezza, in una concentrazione pari o superiore allo 0,6 % in peso.
| Descrizione | Livello | Dimensione | Downloads | |
|---|---|---|---|---|
| RAPEX Report 12 del 20_03_2020 N. 4 A12_00434_20 Lituania.pdf Liquido tergicristallo |
437 kB | 1 |