Tavole corrispondenza CEI UNI EN ISO 13485:2022 e Reg. UE MD
ID 16037 | 13.03.2022 / Documento completo in allegato
Tavole di corrispondenza MDR/ISO 13845, tra le disposizioni ed i requisiti dell’art.10 "Obblighi generali ddei fabbricanti", dell’allegato IX “Valutazione della conformità basata sul sistema di gestione della qualità e sulla valutazione della documentazione tecnica” e dell’allegato XI “Valutazione della conformità basata sulla verifica della conformità del prodotto” del Regolamento (UE) 2017/745 Dispositivi medici e della norma CEI UNI EN ISO 13485:2022 “ Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari”.
Tavole di corrispondenza:
Table ZA.1 - Correspondence between this European standard and the requirements of Article 10 of Regulation (EU) 2017/745 [OJ L 117]
Table ZA.2 - Correspondence between this European standard and the requirements of Annex IX of Regulation (EU) 2017/745 [OJ L 117]
Table ZA.3 - Correspondence between this European standard and the requirements of Annex XI of Regulation (EU) 2017/745 [OJ L 117]
CEI UNI EN ISO 13485:2022
Dispositivi medici - Sistemi di gestione per la qualità - Requisiti per scopi regolamentari
Medical devices - Quality management systems - Requirements for regulatory purposes
La presente Norma specifica i requisiti per i sistemi di gestione per la qualità che permettono ad una organizzazione di dimostrare la sua capacità di fornire dispositivi medici e relativi servizi che siano conformi ai requisiti dei clienti e ai requisiti regolamentari applicabili.
Questa Norma è una consolidata dell’edizione 2016 ed il doc. EN ISO 13485/A11:2021-09 che contiene gli Allegati ZA e ZZ relativi alla relazione tra la Norma Europea CEI UNI EN/ISO 13485:2016 e i requisiti dei regolamenti (EU) 2017/745 e (EU) 2017/746.
La Norma in oggetto sostituisce completamente la Norma CEI UNI EN ISO 13485:2016-03 e la Norma CEI UNI EN ISO 13485:2017-01.
_______
Annex ZA (informative)
Relationship between this European standard and the requirements of Regulation (EU) 2017/745 aimed to be covered
This European standard has been prepared under a Commission’s standardisation request M/575 of 14.4.2021 to provide one voluntary means of conforming to the requirements of Regulation (EU) 2017/745 of 5 April 2017 concerning medical devices [OJ L 117].
Once this standard is cited in the Official Journal of the European Union under that Regulation, compliance with the normative clauses of this standard given in Tables ZA.1, ZA.2 or ZA.3 confers, within the limits of the scope of this standard, a presumption of conformity with the corresponding requirements of that Regulation, and associated EFTA regulations.
This Annex covers the relationship of this European standard with:
- the general obligations of the manufacturer in Article 10 (Table ZA.1); and,
- the quality management system requirements in the conformity assessment annexes (Annexes IX and XI) (Table ZA.2 and ZA.3 respectively).
EN ISO 13485:2016 is an adoption of an international standard, ISO 13485:2016, which is intended to be applicable in jurisdictions all over the world. Therefore, it is not the primary goal of ISO 13485:2016 to cover exactly the European quality management system requirements. Consequently, for all of the quality management system requirements, conformity is not entirely achieved by complying only with the requirements specified in EN ISO 13485. Manufacturers and conformity assessment bodies will need to integrate the quality management system requirements in the applicable European Regulation into the processes provided by EN ISO 13485. In addition, the European Regulations require the incorporation of certain processes in the quality management system, such as clinical evaluation, risk management, post-market surveillance, and assignment of unique device identification.
EN ISO 13485 requires the integration of these processes into the quality management system in accordance with regulatory requirements but does not explicitly include the details of the particular European Union regulatory requirements within the standard. Furthermore, the definitions in applicable regulatory requirements differ from nation to nation and region to region.
As a result, the definitions in this document can differ in wording from those in European Regulations. For use in support of European requirements, definitions in the European regulations for medical devices take precedence.
In addition to requirements on the manufacturer’s quality management system, Article 10 and Annexes IX and XI of the European Regulations include a description of the regulatory processes and activities undertaken by the notified body, competent authority and European Commission, which are outside of the scope of EN ISO 13485 and therefore not covered by the standard.
NOTE 1
Where a reference from a clause of this standard to the risk management process is made, the risk management process needs to be in compliance with Regulation (EU) 2017/745. This means that risks have to be ‘reduced as far as possible’, ‘reduced to the lowest possible level’, ‘reduced as far as possible and appropriate’, ‘removed or reduced as far as possible’, ‘eliminated or reduced as far as possible’, ’removed or minimized as far as possible’, or ‘minimized’, according to the wording of the corresponding General Safety and Performance Requirement.
NOTE 2
The manufacturer’s policy for determining acceptable risk must be in compliance with General Safety and Performance Requirements 1, 2, 3, 4, 5, 8, 9, 10, 11, 14, 16, 17, 18, 19, 20, 21 and 22 of the Regulation.
NOTE 3 This Annex ZA is based on normative references according to the table of references in the European Foreword, replacing the references in the core text.
NOTE 4
When a requirement does not appear in Tables ZA.1, ZA.2 or ZA.3 it means that it is not addressed by this European Standard.Table ZA.1 – Correspondence between this European standard and the requirements of Article 10 of Regulation (EU) 2017/745 [OJ L 117]
Regolamento (UE) 2017/745
Articolo 10 Obblighi generali dei fabbricanti
1. All'atto dell'immissione dei loro dispositivi sul mercato o della loro messa in servizio, i fabbricanti garantiscono che siano stati progettati e fabbricati conformemente alle prescrizioni del presente regolamento.
2. I fabbricanti istituiscono, documentano, attuano e mantengono un sistema per la gestione del rischio quale descritto all'allegato I, punto 3.
3. I fabbricanti effettuano una valutazione clinica nel rispetto dei requisiti di cui all'articolo 61 e all'allegato XIV, ivi compreso un PMCF.
4. I fabbricanti di dispositivi diversi dai dispositivi su misura redigono e tengono aggiornata una documentazione tecnica per tali dispositivi. La documentazione tecnica è tale da consentire che sia valutata la conformità del dispositivo alle prescrizioni del presente regolamento. La documentazione tecnica comprende gli elementi di cui agli allegati II e III.
Alla Commissione è conferito il potere di adottare atti delegati conformemente all'articolo 115 per modificare, alla luce del progresso tecnico, gli allegati II e III.
5. I fabbricanti di dispositivi su misura redigono, tengono aggiornata e mettono a disposizione delle autorità competenti la documentazione conformemente all'allegato XIII, punto 2.
6. Quando la conformità alle prescrizioni applicabili è stata dimostrata dalla pertinente procedura di valutazione della conformità, i fabbricanti di dispositivi, diversi dai dispositivi su misura od oggetto di indagine, redigono una dichiarazione di conformità UE ai sensi dell'articolo 19 e appongono la marcatura CE di conformità ai sensi dell'articolo 20.
7. I fabbricanti si attengono agli obblighi connessi con il sistema UDI, di cui all'articolo 27, e agli obblighi di registrazione, di cui agli articoli 29 e 31.
8. I fabbricanti conservano la documentazione tecnica, la dichiarazione di conformità UE e, se del caso, una copia del certificato pertinente rilasciato a norma dell'articolo 56, comprese le eventuali modifiche e integrazioni, a disposizione delle autorità competenti per un periodo di almeno 10 anni dall'immissione sul mercato dell'ultimo dispositivo oggetto della dichiarazione di conformità UE. Per i dispositivi impiantabili, il periodo è di almeno 15 anni dall'immissione sul mercato dell'ultimo dispositivo.
Su richiesta di un'autorità competente, il fabbricante fornisce, secondo quanto ivi indicato, tale documentazione tecnica completa o una sua sintesi.
Al fine di consentire al mandatario di assolvere i compiti di cui all'articolo 11, paragrafo 3, il fabbricante avente sede legale al di fuori dell'Unione provvede affinché costui abbia costantemente a disposizione la documentazione necessaria.
9. I fabbricanti provvedono a che siano predisposte le procedure necessarie affinché la produzione in serie continui a essere conforme alle prescrizioni del presente regolamento. Le modifiche della progettazione o delle caratteristiche del dispositivo, nonché le modifiche delle norme armonizzate o delle SC in riferimento a cui è dichiarata la conformità di un dispositivo devono essere tenute in debita considerazione in maniera opportuna e tempestiva. I fabbricanti di dispositivi diversi dai dispositivi oggetto di indagine provvedono a istituire, documentare, applicare, mantenere, aggiornare e migliorare costantemente un sistema di gestione della qualità che garantisca la conformità al presente regolamento nella maniera più efficace e in modo proporzionato alla classe di rischio e alla tipologia di dispositivo.
Il sistema di gestione della qualità riguarda tutte le parti e gli elementi dell'organizzazione del fabbricante che si occupano della qualità di processi, procedure e dispositivi. Esso disciplina la struttura, le competenze, le procedure, i processi e le risorse gestionali richiesti per attuare i principi e le azioni necessarie a conseguire il rispetto delle disposizioni del presente regolamento.
Il sistema di gestione della qualità riguarda almeno i seguenti aspetti:
a) una strategia per il rispetto della normativa, tra cui il rispetto delle procedure di valutazione della conformità e delle procedure per la gestione delle modifiche dei dispositivi coperti dal sistema;
b) l'identificazione dei requisiti generali di sicurezza e prestazione applicabili e il vaglio delle opzioni intese a soddisfare tali requisiti;
c) la responsabilità della gestione;
d) la gestione delle risorse, compresi la selezione e il controllo dei fornitori e dei subcontraenti;
e) la gestione dei rischi di cui all'allegato I, punto 3;
f) la valutazione clinica, ai sensi dell'articolo 61 e dell'allegato XIV, compreso il PMCF;
g) la realizzazione del prodotto, compresi pianificazione, progettazione, sviluppo, produzione e fornitura di servizi;
h) la verifica delle attribuzioni degli UDI effettuate a norma dell'articolo 27, paragrafo 3, a tutti i dispositivi pertinenti, attraverso cui è garantita la coerenza e la validità delle informazioni fornite ai sensi dell'articolo 29;
i) la predisposizione, l'implementazione e il mantenimento di un sistema di sorveglianza post-commercializzazione ai sensi dell'articolo 83;
j) la gestione della comunicazione con le autorità competenti, gli organismi notificati, altri operatori economici, i clienti e/o altri soggetti interessati;
k) i processi per la segnalazione di incidenti gravi e le azioni correttive di sicurezza nel contesto della vigilanza;
l) la gestione delle azioni correttive e preventive e la verifica della loro efficacia;
m) le procedure per il monitoraggio e la misurazione dei risultati, l'analisi dei dati e il miglioramento dei prodotti.
10. I fabbricanti di dispositivi istituiscono e tengono aggiornato il sistema di sorveglianza post-commercializzazione di cui all'articolo 83.
11. I fabbricanti provvedono a che il dispositivo sia corredato delle informazioni indicate all'allegato I, punto 23, in una delle lingue ufficiali dell'Unione stabilita dallo Stato membro in cui il dispositivo è messo a disposizione dell'utilizzatore o del paziente. Le indicazioni che figurano sull'etichetta sono indelebili e scritte in modo da risultare facilmente leggibili e chiaramente comprensibili all'utilizzatore o al paziente previsto.
12. I fabbricanti che ritengono o hanno motivo di credere che un dispositivo da essi immesso sul mercato o messo in servizio non sia conforme al presente regolamento adottano immediatamente le azioni correttive necessarie per rendere conforme tale dispositivo, ritirarlo o richiamarlo, a seconda dei casi. Essi informano di conseguenza i distributori del dispositivo in questione e, se del caso, il mandatario e gli importatori.
Se il dispositivo presenta un rischio grave, i fabbricanti informano immediatamente le autorità competenti degli Stati membri in cui lo hanno immesso sul mercato e, se del caso, l'organismo notificato che ha rilasciato un certificato per il dispositivo a norma dell'articolo 56, in particolare, della non conformità e delle eventuali azioni correttive intraprese.
13. I fabbricanti dispongono di un sistema di registrazione e segnalazione degli incidenti e delle azioni correttive di sicurezza conformemente agli articoli 87 e 88.
14. I fabbricanti, su richiesta di un'autorità competente, forniscono a quest'ultima tutte le informazioni e la documentazione necessarie per dimostrare la conformità del dispositivo, in una lingua ufficiale dell'Unione stabilita dallo Stato membro interessato. L'autorità competente dello Stato membro in cui il fabbricante ha sede può richiedere che il fabbricante fornisca campioni del dispositivo a titolo gratuito o, qualora ciò sia impossibile, che garantisca l'accesso al dispositivo stesso. I fabbricanti cooperano con qualsiasi autorità competente ne faccia richiesta, per qualsiasi azione correttiva adottata al fine di eliminare o, qualora ciò non fosse possibile, attenuare i rischi presentati dai dispositivi da essi immessi sul mercato o messi in servizio.
Al fine di garantire la protezione della salute pubblica e della sicurezza dei pazienti, se il fabbricante non collabora o le informazioni e la documentazione fornite sono incomplete o inesatte, l'autorità competente può adottare tutte le misure appropriate per vietare o limitare la messa a disposizione del dispositivo sul suo mercato nazionale, per ritirare il dispositivo da detto mercato o per richiamarlo finché il fabbricante non coopera o non fornisce informazioni complete e esatte.
Se ritiene o ha motivo di credere che un dispositivo abbia causato danni, un'autorità competente deve, su richiesta, agevolare la fornitura delle informazioni e della documentazione di cui al primo comma al paziente o all'utilizzatore eventualmente leso e, se del caso, al suo avente causa, alla sua compagnia di assicurazione sanitaria o altre parti interessate dal danno causato al paziente o all'utilizzatore, fatte salve le norme in materia di protezione dei dati e, senza pregiudicare la tutela dei diritti di proprietà intellettuale, a meno che sussista un interesse pubblico prevalente rispetto alla divulgazione.
Non occorre che l'autorità competente osservi l'obbligo di cui al terzo comma se la divulgazione delle informazioni e della documentazione di cui al primo comma è già trattata normalmente nell'ambito di un procedimento giudiziario.
15. Se i dispositivi di un fabbricante sono stati progettati o fabbricati da un'altra persona fisica o giuridica, i dati relativi all'identità di tale persona figurano tra le informazioni da presentare conformemente all'articolo 29, paragrafo 4.
16.Le persone fisiche o giuridiche possono chiedere un risarcimento per danni causati da un dispositivo difettoso, ai sensi della normativa applicabile a livello dell'Unione e del diritto nazionale.
In modo proporzionale alla classe di rischio, alla tipologia di dispositivo e alla dimensione dell'impresa, i fabbricanti dispongono di misure che forniscono una copertura finanziaria sufficiente in relazione alla loro potenziale responsabilità ai sensi della direttiva 85/374/CEE, fatte salve eventuali misure di protezione più rigorose ai sensi del diritto nazionale.[/panel]
ALLEGATO IX Regolamento (UE) 2017/745
Valutazione della conformità basata sul sistema di gestione della qualità e sulla valutazione della documentazione tecnica
[…]
ALLEGATO XI Regolamento (UE) 2017/745
Valutazione della conformità basata sulla verifica della conformità del prodotto
[…]
Tavole di corrispondenza
Table ZA.1 - Correspondence between this European standard and the requirements of Article 10 of Regulation (EU) 2017/745 [OJ L 117]
Table ZA.2 - Correspondence between this European standard and the requirements of Annex IX of Regulation (EU) 2017/745 [OJ L 117]
Table ZA.3 - Correspondence between this European standard and the requirements of Annex XI of Regulation (EU) 2017/745 [OJ L 117]
_______
Table ZA.1 Correspondence between this European standard and the requirements of Article 10 of Regulation (EU) 2017/745 [OJ L 117]
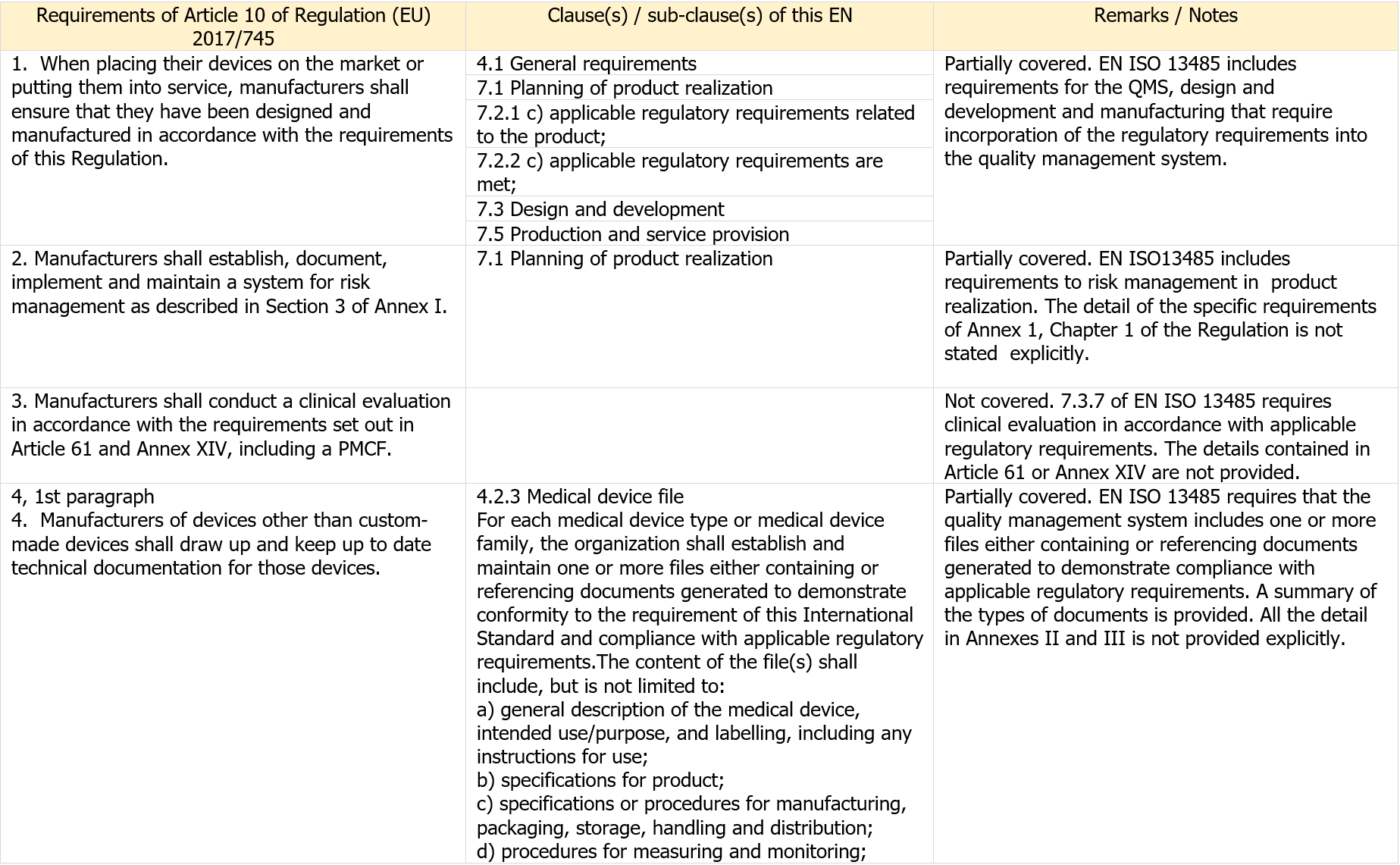

[...] Segue in allegato
Table ZA.2 – Correspondence between this European standard and the requirements of Annex IX of Regulation (EU) 2017/745 [OJ L 117]
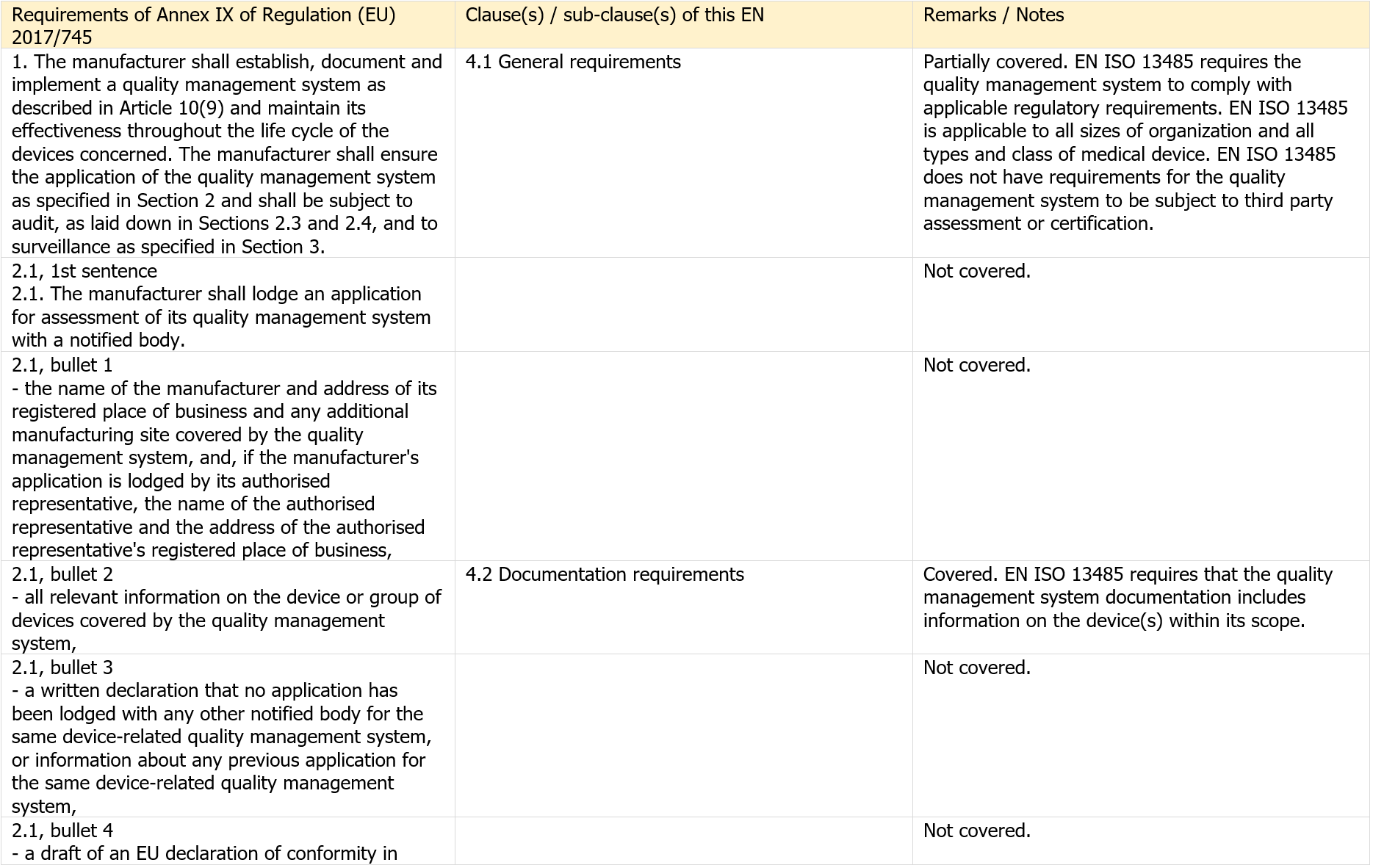

[...] Segue in allegato
Table ZA.3 – Correspondence between this European standard and the requirements of Annex XI of Regulation (EU) 2017/745 [OJ L 117]

[...] Segue in allegato
Certifico Srl - EN | Rev. 0.0 2022
Pagine documento: nr. 83
©Copia autorizzata Abbonati
Info e download
Collegati
CEI UNI EN ISO 13485:2022
EN ISO 13485:2016+A11:2021
Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)

|