EN 455 | Guanti medicali monouso
| Appunti Normazione | ||
| 15 Maggio 2025 | ||
| Salve Visitatore | ||
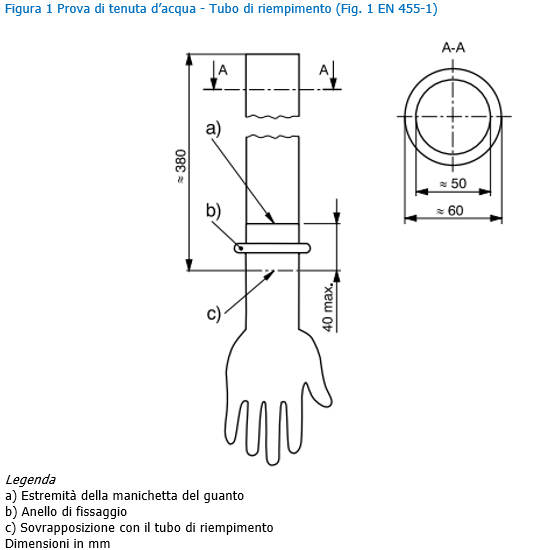
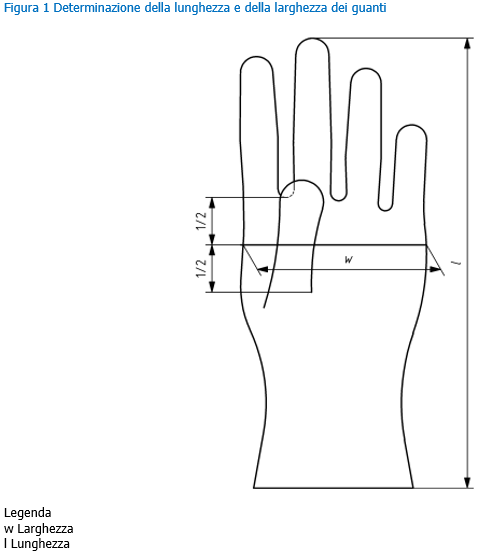
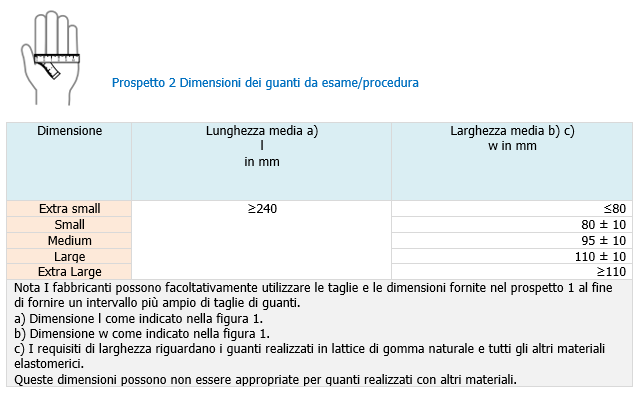
EN 455 | Guanti medicali monouso ID 10765 | 13.05.2020 Il presente documento riporta i requisiti e i metodi di prova dei guanti medicali monouso, destinati all’uso in campo medico per proteggere il paziente e l’utilizzatore dalla contaminazione incrociata, in accordo alla norma tecnica EN 455 “Guanti medicali monouso”. La EN 455 è costituita dalle seguenti parti, sotto il titolo generale “Medical gloves for single use”: - Part 1: Requirements and testing for freedom from holes ... Indice 1. Premessa _______ Dispositivi medici Requisiti generali EN 455 Per dispositivo medico si intende qualsiasi strumento, apparecchio, impianto, o altro prodotto destinato dal fabbricante ad essere impiegato nell’uomo a scopo di diagnosi, prevenzione, controllo, terapia, attenuazione di una malattia, di una ferita o di un handicap. La Direttiva 93/42/CEE si prefigge lo scopo di disciplinare la produzione e l’immissione sul mercato dei dispositivi medici. Il guanto monouso può avere funzioni di dispositivo medico in funzione del suo utilizzo a contatto con il corpo umano e/o per scopi diagnostici o terapeutici. Il guanto monouso non sterile (per il tipo di utilizzi cui è preposto) è classificato come Dispositivo Medico di classe I. Per tutti i dispositivi medici quali i guanti la normativa di riferimento è la EN 455 (1-2-3-4) che individua ed impone livelli di prestazione minima per quanto concerne le caratteristiche dimensionali e qualitative (spessori, assenza di difetti, resistenza del materiale) del prodotto e che impone debba essere garantito un AQL minimo di 1,5. E’ altresì essenziale che il prodotto abbia acquisito e riporti la marcatura CE e che esso sia iscritto presso il registro dei dispositivi presso il Ministero della Salute. Dispositivi di Protezione Individuale Requisiti generali EN 420 I guanti per poter essere certificati come dispositivi di protezione individuale devono rispettare delle esigenze normative. Per i guanti di protezione la norma base è la EN 420:2003+A1:2009, ossia la norma generale che fissa i requisiti indispensabili, quali: - Innocuità (Cromo esavalente, Ph, Cadmio etc.) Requisiti generali EN 374 I guanti di protezione utilizzati nelle lavorazioni che presentano il rischio di contatto diretto con prodotti chimici o con microrganismi, devono soddisfare i requisiti della EN ISO 374-2:2019, della EN 16523-1:2015+A1:2018 e della EN ISO 374-4:2019. Marcatura CE dispositivi medici utilizzati come DPI Nota Min. Salute 24 aprile 2014 - Marcatura CE di dispositivi medici (DM) destinati ad essere utilizzati in conformità delle disposizioni in materia di dispositivi di protezione individuale (DPI). Alcuni prodotti possono essere destinati dal fabbricante ad essere utilizzati sia come dispositivi medici (Direttiva 93/42/CEE, recepita in Italia con D. Lgs. 46/1997 e succ. mod.) che come dispositivi di protezione individuale (Direttiva 89/686/CEE, recepita in Italia con D. Lgs. 475/1992 e succ. mod.). A questi prodotti, dunque, si attribuisce una duplice funzione. I guanti per uso chirurgico e quelli da esplorazione, ad esempio, in quanto impiegati sul paziente ai fini di prevenzione di una malattia, sono dispositivi medici. Allo stesso tempo possono anche rispondere all’esigenza di protezione dell’operatore che li indossa: in questo caso rientrano anche nella definizione di DPI. Analoghe situazioni possono presentarsi per altre tipologie di prodotti. Antecedentemente all’emendamento introdotto dalla Direttiva 2007/47/CE, l’art. 1, c.6 della Direttiva 93/42/CEE stabiliva che la stessa non era applicabile ai DPI e che la destinazione d’uso principale del prodotto ne determinava l’appartenenza o meno ad una sola categoria tra DM e DPI. Tale situazione normativa aveva presentato diversi problemi applicativi, anche di tipo legale, per quei prodotti che potevano essere utilizzati con una duplice funzione DM – DPI. A tale proposito questo Ministero aveva emanato due note circolari (datate 4 maggio 2005 e 21 giugno 2005) specifiche per i guanti chirurgici e da esplorazione, con le quali si ribadiva che detti prodotti erano da considerarsi DM ma che ciò non escludeva che i guanti, sul piano tecnico, potessero essere allo stesso tempo conformi alle norme tecniche relative ai guanti DM e alle norme tecniche concernenti i guanti DPI, né che le relative confezioni potessero far riferimento alla conformità a tali norme. L’intera problematica è stata oggetto di un riesame a livello comunitario con conseguente modifica della direttiva di riferimento. In particolare, l’art. 1, c.6 della Direttiva 93/42/CEE, così come emendato dalla Direttiva 2007/47/CE (recepita in Italia con D. Lgs. 37/2010), stabilisce ora che, se un prodotto è destinato dal fabbricante ad essere utilizzato sia in conformità delle disposizioni in materia di DPI (di cui alla Direttiva 89/686/CEE), sia in conformità delle disposizioni in materia di DM (di cui alla Direttiva 93/42/CEE), sono rispettati anche i requisiti essenziali in materia di sanità e sicurezza stabiliti nella Direttiva 89/686/CEE. Alla luce di quest’ultimo emendamento risulta chiaro che un prodotto possa avere la duplice funzione di DM e DPI; in tale caso dovranno essere rispettati i pertinenti requisiti essenziali di entrambe le direttive. Come indicato dalla Commissione europea nella nota “Interpretative document on the interpretation of the relation between the revised Directive 93/42/EEC concerning medical devices and Directive 89/686/EEC on personal protective equipment”, del 21 agosto 2009, è da prevedere comunque una unica marcatura CE con l’eventuale indicazione di uno o due Organismi Notificati, eventualmente intervenuti nel processo di certificazione per le direttive di riferimento. Pertanto l’etichetta e le istruzioni per l’uso che accompagnano i prodotti con duplice destinazione d’uso, riporteranno un solo marchio CE, corredato dall’indicazione delle direttive applicate, ciascuna eventualmente preceduta dal numero identificativo dell’Organismo Notificato intervenuto nel procedimento di valutazione della conformità. Requisiti e prove: Assenza di fori La norma 455-1 specifica i requisiti e fornisce il metodo per la prova dei guanti medicali monouso al fine di determinare l’assenza di fori. Nota Si richiama l’attenzione sulla EN 374-1 "Protective gloves against chemicals and micro-organisms - Terminology and performance requirements". Termini e definizioni Ai fini della presente norma, si applica il termine e la definizione seguente. Guanti medicali monouso: Guanti destinati all’uso in campo medico per proteggere il paziente e l’utilizzatore dalla contaminazione incrociata. Requisito I guanti medicali monouso devono essere a tenuta, quando sottoposti a prova. PROVA DI TENUTA D’ACQUA PER LA RILEVAZIONE DI FORI Prova di riferimento Posizionare verticalmente un tubo di riempimento delle dimensioni illustrate in figura 1 o di dimensioni atte ad alloggiare il guanto, in modo tale che il tubo sia in grado di trattenere dai 1 000 ml d’acqua la parte eccedente il naturale volume di riempimento del guanto. Appendere il guanto al tubo di riempimento, sovrapponendo la manichetta all’estremità del tubo per un massimo di 40 mm e fissarlo con mezzi idonei ad assicurare una tenuta d’acqua, senza danneggiare il guanto (vedere figura 1). Campionamento, livello di controllo e LQA Ogni lotto deve essere campionato in conformità alla ISO 2859-1 livello di ispezione generale 1, ma utilizzando una dimensione minima del campione e corrispondenti valori di accettazione/rifiuto equivalenti alla dimensione del campione con lettera codice L. Per le prove secondo il metodo descritto a scopo di riferimento, il livello di conformità per l’assenza di fori deve essere un LQA di 1,5. Nota Il livello di ispezione soddisfa i requisiti dell’Allegato IV punto 6.3 della Direttiva 93/42/CEE sui dispositivi medici e non implica dimensioni eccessive del campione che potrebbero incidere sui costi di produzione e prova. Una dimensione minima del campione equivalente alla dimensione del campione con lettera codice L è necessaria per garantire che sia conseguita un’adeguata valutazione della qualità del lotto quando le dimensioni del lotto sono ridotte o sconosciute. Il Livello di Qualità Accettabile (AQL), unità di misura statistica, è un indicatore di previsione della qualità di un prodotto. Si applica a tutti i tipi di produzione in lotti per garantire che il processo produttivo soddisfi gli standard stabiliti. I dispositivi medici, ad esempio, devono essere sempre tutti prodotti ad uno standard molto elevato. Termini e definizioni Ai fini del presente documento si applicano i termini e le definizioni seguenti. Dimensioni Quando misurato come descritto nei punti successivi (lunghezza e larghezza), prelevando 13 campioni da ogni lotto, il valore medio ottenuto per le dimensioni deve corrispondere a quello fornito nei prospetti 1 e 2. Lunghezza Misurare la lunghezza (dimensione l, come indicato nella figura 1) ponendo il guanto in libera sospensione con il dito medio infilato su di una riga graduata verticale la cui estremità è arrotondata per adattarsi all'estremità del dito del guanto. Distendere le pieghe e le grinze senza allungare il guanto. Registrare la lunghezza media misurata. Per facilitare la misurazione, è ammesso l'utilizzo di una riga graduata leggermente incurvata all'indietro in modo che il guanto sia a contatto con la riga. [...] [...] Segue in allegato Fonti Certifico Srl - IT | Rev. 00 2020
Collegati: |
||
|
|
||
 |
||
| www.certifico.com
è un sito di INVIO NEWSLETTTER Se vuoi cancellarti dall'invio della newsletter oppure effettua il login al sito ed entra nella Tua Area Riservata, in “Modifica dati” agisci con la spunta sul box di selezione “Newsletter”. L'Elenco completo di tutte le ns newsletter è qui: Archivio newsletter. |
||
  |
||
| Certifico Srl 2000-2020 | VAT IT02442650541 | ||