Dispositivi medici: Registrazione in Eudamed e banca dati nazionale
ID 13955 | 08.07.2021 / Documento allegato
Attualmente, tutte le imprese che ricoprono ruoli individuati dai Regolamenti per i quali sussiste l'obbligo di registrazione in Eudamed, possono procedere alla registrazione su base volontaria al fine di ottenere il Single Registration Number (SRN).
Tuttavia, la registrazione in Eudamed e l'ottenimento dell'SRN non sostituiscono l'obbligo di adempiere alla registrazione nella banca dati nazionale.
Nei prossimi mesi di uso del sistema su base volontaria, è prevista la doppia registrazione in Eudamed e nella banca dati Italiana.
_______
A tal proposito, si ricorda quanto previsto dal Regolamento (UE) 2017/745 nell’art.123.3(d) "Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti”; per l’Italia tale circostanza è relativa agli obblighi di registrazione nella banca dati nazionale dei dispositivi medici del Ministero della Salute. Analoghe disposizioni sono previste per il settore IVD.
Nel corso di questa fase, il Ministero sta lavorando all’impostazione e gestione integrata dei sistemi di registrazione di livello nazionale ed europeo.
_______
Registrazione in Eudamed e banca dati nazionale Art.123.3(d) Regolamento (UE) 2017/745
"Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione".
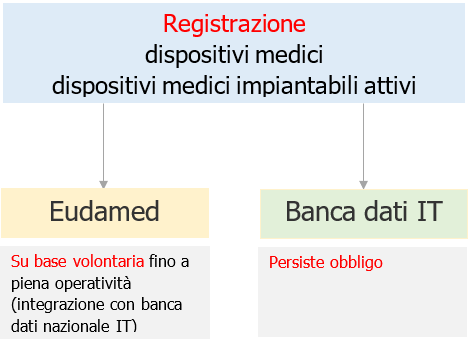
Fig. 1 – Applicazione di Eudamed e Banca dati nazionale IT
_______
Regolamento (UE) 2017/745
Articolo 123 Entrata in vigore e data di applicazione
1. Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
2. Esso si applica a decorrere al 26 maggio 2021
3. In deroga al paragrafo 2:
a) gli articoli da 35 a 50 si applicano a decorrere dal 26 novembre 2017. Tuttavia, a decorrere da tale data fino al 26 maggio 2021, gli obblighi degli organismi notificati a norma degli articoli da 35 a 50 si applicano solo agli organismi che presentano una domanda di designazione a norma dell'articolo 38;
b) gli articoli 101 e 103 si applicano a decorrere dal 26 novembre 2017;
c) l'articolo 102 si applica a decorrere dal 26 maggio 2018;
d) fatti salvi gli obblighi della Commissione ai sensi dell'articolo 34, qualora, a causa di circostanze che non avrebbero potuto essere ragionevolmente previste alla stesura del piano di cui all'articolo 34, paragrafo 1, Eudamed non sia pienamente operativa il 26 maggio 2021, gli obblighi e le prescrizioni relativi a Eudamed si applicano a decorrere dalla data corrispondente a sei mesi dalla data di pubblicazione dell'avviso di cui all'articolo 34, paragrafo 3.
Le disposizioni di cui alla frase precedente sono le seguenti:
— articolo 29,
— articolo 31,
— articolo 32,
— articolo 33, paragrafo 4,
— articolo 40, paragrafo 2, seconda frase,
— articolo 42, paragrafo 10,
— articolo 43, paragrafo 2,
— articolo 44, paragrafo 12, secondo comma,
— articolo 46, paragrafo 7, lettere d) ed e),
— articolo 53, paragrafo 2,
— articolo 54, paragrafo 3,
— articolo 55, paragrafo 1,
— articoli da 70 a 77,
— articolo 78, paragrafi da 1 a 13,
— articoli da 79 a 82,
— articolo 86, paragrafo 2,
— articoli 87 e 88,
— articolo 89, paragrafi 5 e 7, e articolo 89, paragrafo 8, terzo comma,
— articolo 90,
— articolo 93, paragrafi 4, 7 e 8,
— articolo 95, paragrafi 2 e 4,
— articolo 97, paragrafo 2, ultima frase,
— articolo 99, paragrafo 4,
— articolo 120, paragrafo 3, primo comma, seconda frase.
Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione.
...
segue in allegato
_______
Certifico Srl - IT | Rev. 0.0 2021
©Copia autorizzata Abbonati
Info e download
Collegati
Regolamento (UE) 2017/745
Il Regolamento Dispositivi Medici (UE) 2017/745 - (MDR)
Regolamento (UE) 2017/745 MDR: Persona responsabile rispetto normativa (PR)
MDR Regolamento dispositivi medici | Reg. (UE) 2017/745
Dichiarazione di conformità UE Regolamento (UE) 2017/745
Eudamed - Banca Dati EUropea sui Dispositivi MEdici

|