EN ISO 14971 Dispositivi medici: Gestione e Valutazione del rischio | Edizione 2022
| Appunti Normazione | ||||||||||||||
| 01 Maggio 2025 | ||||||||||||||
| Salve Visitatore | ||||||||||||||
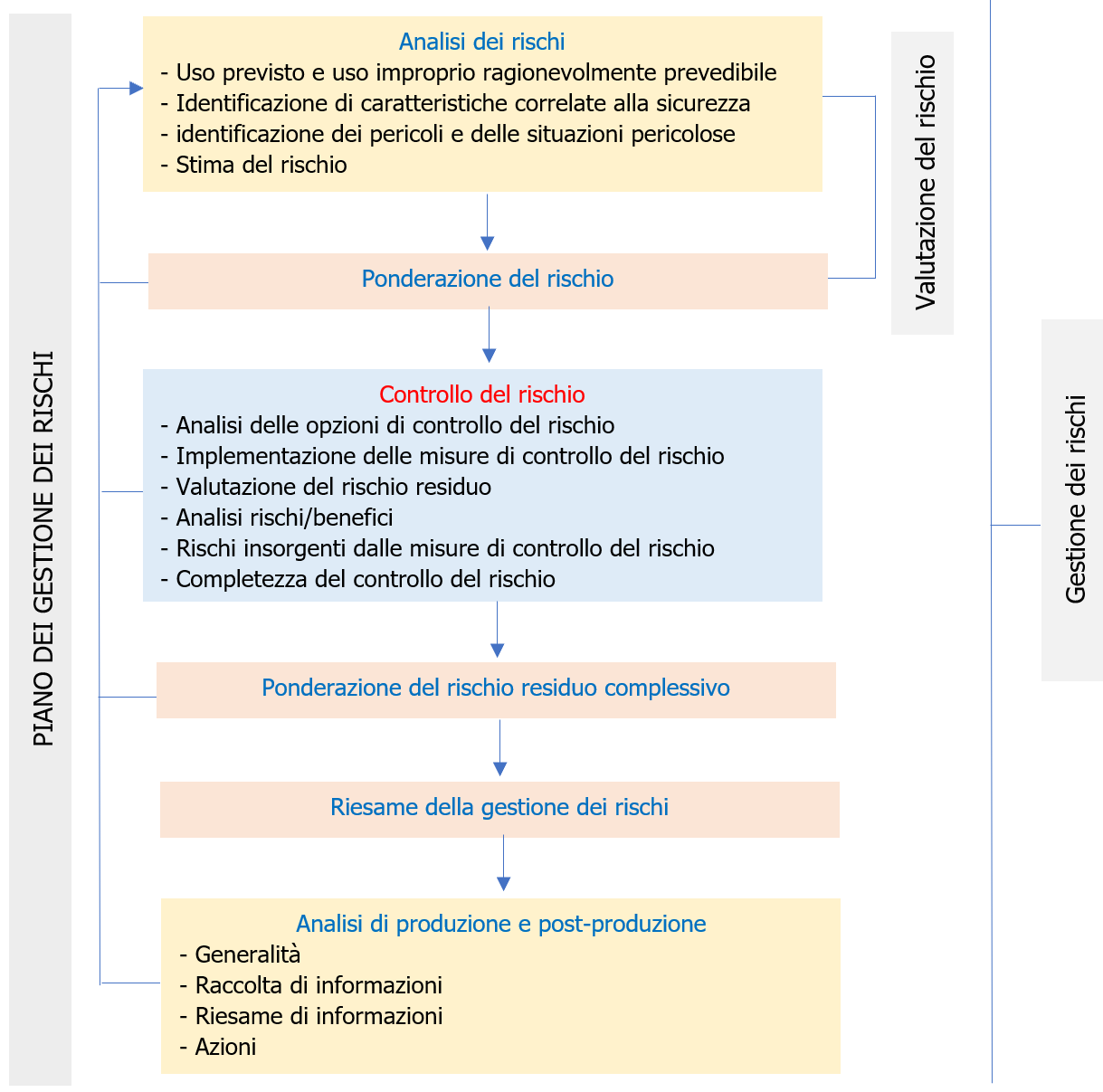
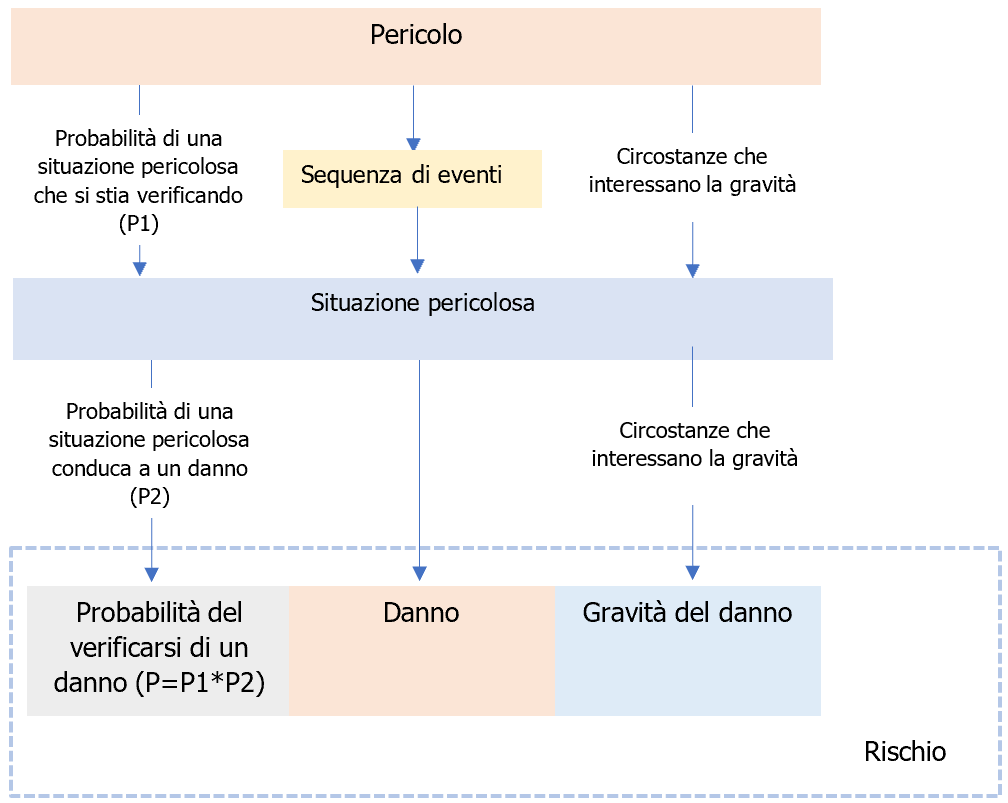
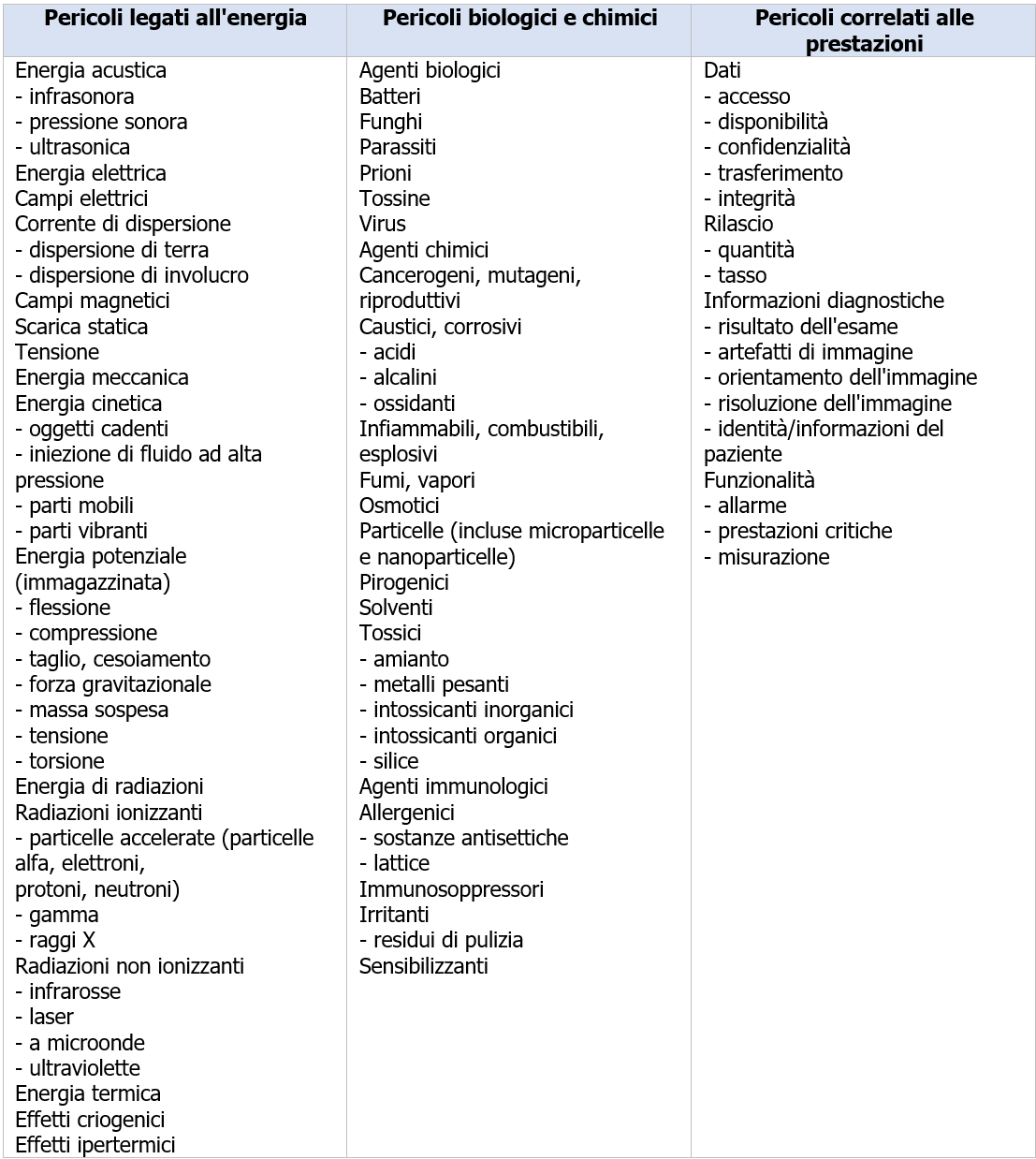
EN ISO 14971 Dispositivi medici: Valutazione del rischio / Ed. 2022 ID 4114 | Rev. 1.0 dell'11.11.2022 / In allegato documento completo Il Documento, estratto EN ISO 14971, intende fornire gli elementi essenziali per la Procedura di Valutazione dei rischi per i Dispositivi Medici, nel termine più ampio di gestione dei rischi, fornendo le informazioni essenziali con schemi ed esempi. Update 10 novembre 2022 Pubblicata da CEI ad Ottobre 2022 la Variante V11 (2022) in lingua IT alla UNI CEI EN ISO 14971:2020 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (ora UNI CEI EN ISO 14971:2022 o CEI UNI EN ISO 14971:2022 Update 23 gennaio 2020 Pubblicata da UNI il 23 gennaio 2020 la UNI CEI EN ISO 14971:2020 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici (EN) Update 18 dicembre 2019 Pubblicata da ISO il 18 Dicembre 2019 la ISO 14971:2019 Medical devices - Application of risk management to medical devices. Il 25 Maggio 2017 sono entrati in vigore i nuovi Regolamenti sui Dispositivi medici Regolamento (UE) 2017/745 (MDR) e Regolamento (UE) 2017/746 (IVDR) che si applicano con decorrenza principale rispettivamente dal 26 Maggio 2020 e 26 Maggio 2022. UNI CEI EN ISO 14971:2022 Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici La norma specifica la terminologia, i principi ed un processo di gestione dei rischi relativo a dispositivi medici, incluso il software utilizzato come dispositivo medico e i dispositivi medico-diagnostici in vitro. Il processo descritto nella norma intende aiutare i fabbricanti di dispositivi medici ad identificare i pericoli associati ai dispositivi medici, per stimare e valutare i rischi associati, per controllare tali rischi, e per monitorare l'efficacia dei controlli. I requisiti della norma sono applicabili a tutte le fasi del ciclo di vita di un dispositivo medico. Sostituisce: UNI CEI EN ISO 14971:2020 Vedi il Documento sul Regolamento MDR: Il Regolamento (UE) 2017/745 (MDR) Il Documento è estratto dalla norma EN ISO 14971:2019, EN ISO 14971:2019/A11:2021 (UNI CEI EN ISO 14971:2022) Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici, che è armonizzata (con Decisione di esecuzione (UE) 2022/757 della Commissione del 11 maggio 2022 in GU L 138/27 del 17.5.2022) per il: - Regolamento (UE) 2017/745 del Parlamento e del Consiglio del 5 aprile 2017 relativo ai dispositivi medici, che modifica la direttiva 2001/83/CE, il regolamento (CE) n. 178/2002 e il regolamento (CE) n. 1223/2009 e che abroga le direttive 90/385/CEE e 93/42/CEE del Consiglio. (GU L 117/92 del 05.05.2017) La EN ISO 14971, insieme alle: - IEC 60601-1 (sicurezza elettrica), definisce la base standard delle norme per la sicurezza dei dispositivi medici. I requisiti contenuti all'interno del documento forniscono ai fabbricanti una struttura all'interno della quale esperienza, intuizione e giudizio sono applicati sistematicamente per gestire i rischi associati all'uso dei dispositivi medici. Il documento è stato sviluppato specificamente per i fabbricanti di dispositivi medici sulla base di principi assodati di gestione dei rischi che si sono evoluti in molti anni e potrebbe essere utilizzato come guida per lo sviluppo e il mantenimento di un processo di gestione dei rischi per altri prodotti che non sono necessariamente dispositivi medici in alcune giurisdizioni e per fornitori e altri soggetti coinvolti nel ciclo di vita dei dispositivi medici. Il documento tratta i processi per la gestione dei rischi associati ai dispositivi medici. I rischi possono essere correlati a una lesione, non esclusivamente al paziente, ma altresì all'utilizzatore e ad altre persone. I rischi possono altresì essere correlati a danni a proprietà (per esempio oggetti, dati e altre apparecchiature) oppure all'ambiente. La gestione dei rischi è un argomento complesso in quanto ciascuna parte interessata può attribuire un valore diverso all'accettabilità dei rischi in relazione ai benefici attesi. Tali concetti di gestione dei rischi sono di particolare importanza in relazione ai dispositivi medici a causa della varietà delle parti interessate, inclusi medici, organizzazioni sanitarie, governi, industria, pazienti e pubblico. Generalmente, è comunemente accettato che il concetto di rischio ha due componenti chiave: - la probabilità del verificarsi di un danno; e È necessario che tutte le parti interessate comprendano che l'impiego di un dispositivo medico comporta un certo grado intrinseco di rischio, anche in seguito alla riduzione dei rischi a un livello accettabile. È ben noto che nel contesto di una procedura clinica permangono dei rischi residui. L'accettabilità di un rischio per una parte interessata è influenzata da tali componenti chiave di cui in precedenza e dalla percezione del rischio e del beneficio da parte della parte interessata. I fattori che incidono sulla percezione da parte di ciascuna parte interessata dipendono dall'ambiente socio-economico e di istruzione della società interessata e dallo stato di salute effettivo e percepito del paziente. Le modalità di percezione di un rischio tengono altresì in considerazione altri fattori, per esempio, del fatto che l'esposizione al pericolo o a una situazione pericolosa sembri essere involontaria, evitabile, da una fonte creata dall'uomo, dovuta a negligenza, derivante da una causa scarsamente compresa o diretta a un gruppo vulnerabile all'interno della società. In qualità di parte interessata, il fabbricante riduce i rischi ed emette giudizi relativi alla sicurezza di un dispositivo medico, compresa l'accettabilità dei rischi residui. Il fabbricante tiene in considerazione lo stato dell'arte generalmente riconosciuto, al fine di determinare l'idoneità di un dispositivo medico a essere immesso sul mercato per il suo uso previsto. Il presente documento specifica un processo attraverso il quale il fabbricante di un dispositivo medico può identificare i pericoli associati al dispositivo medico, stimare e valutare i rischi associati a tali pericoli, controllare tali rischi e monitorare l'efficacia dei controlli nell'arco dell'intero ciclo di vita del dispositivo medico. La decisione di utilizzare un dispositivo medico nel contesto di una particolare procedura clinica richiede che i rischi residui siano equilibrati rispetto ai benefici della procedura. Tali decisioni vanno oltre lo scopo e il campo di applicazione del presente documento e tengono in considerazione l'uso previsto, le circostanze d'uso, le prestazioni e i rischi associati al dispositivo medico, nonché i rischi e benefici associati alla procedura clinica. Alcune di tali decisioni possono essere prese esclusivamente da un medico qualificato con conoscenza dello stato di salute di un singolo paziente o dall'opinione del paziente stesso. I punti trattati nel documento sono inerenti ai punti della norma: 4 REQUISITI GENERALI PER IL SISTEMA DI GESTIONE DEI RISCHI 5 ANALISI DEI RISCHI 6 PONDERAZIONE DEL RISCHIO 7 CONTROLLO DEL RISCHIO 8 VALUTAZIONE DEL RISCHIO RESIDUO COMPLESSIVO 9 RIESAME DELLA GESTIONI DEI RISCHI 10 ATTIVITÀ DI PRODUZIONE E POST-PRODUZIONE APPENDICE A Razionale per i requisiti APPENDICE B Processo di gestione dei rischi per i dispositivi medici APPENDICE C Concetti di rischio fondamentali APPENDICE ZA Rapporto tra la presente norma europea e i requisiti generali di sicurezza e prestazione del Regolamento (UE) 2017/745 da soddisfare APPENDICE ZB Rapporto tra la presente norma europea e i requisiti generali di sicurezza e prestazione del Regolamento (UE) 2017/746 da soddisfare BIBLIOGRAFIA Excursus 4.1 Processo di gestione dei rischi Il fabbricante deve stabilire, attuare, documentare e mantenere un processo continuativo per: a) identificare pericoli e situazioni pericolose associate a un dispositivo medico; Tale processo si deve applicare nell'arco dell'intero ciclo di vita del dispositivo medico. Tale processo deve includere i seguenti elementi: - analisi dei rischi; Ove esiste un processo documentato di realizzazione del prodotto, esso deve incorporare le parti appropriate del processo di gestione dei rischi. Nota 1 Processi di realizzazione del prodotto sono descritti, per esempio, nel punto 7 della ISO 13485:2016[5]. Nota 2 Un processo documentato all'interno di un sistema di gestione per la qualità può essere utilizzato per rispondere alla sicurezza in un modo sistematico, in particolare per consentire l'identificazione preventiva di pericoli e situazioni pericolose in dispositivi medici complessi. Nota 3 Una rappresentazione schematica del processo di gestione dei rischi è illustrata in figura 1. A seconda della fase del ciclo di vita specifica, possono avere enfasi variabile i singoli elementi della gestione dei rischi. Altresì, le attività di gestione dei rischi possono essere eseguite in modo iterativo o in più fasi come appropriato al dispositivo medico. L'appendice B contiene una panoramica più dettagliata delle fasi nel processo di gestione dei rischi. La conformità è verificata mediante ispezione dei documenti appropriati. Figura 1 Rappresentazione schematica del processo di gestione dei rischi [...] 4.5 Documentazione di gestione dei rischi Per il particolare dispositivo medico preso in considerazione, il fabbricante deve stabilire e mantenere una documentazione di gestione dei rischi. Oltre ai requisiti degli altri punti del presente documento, la documentazione di gestione dei rischi deve fornire la tracciabilità per ciascun pericolo identificato per: - l'analisi dei rischi; Nota 1 Le registrazioni e altri documenti che costituiscono la documentazione di gestione dei rischi possono formare parte di altri documenti e documentazioni richiesti, per esempio, da un sistema di gestione per la qualità del fabbricante. La documentazione di gestione dei rischi non necessita di contenere fisicamente tutte le registrazioni e altri documenti. Tuttavia, essa necessita di contenere almeno riferimenti o indicazioni a tutta la documentazione richiesta, in modo che il fabbricante possa assemblare le informazioni a cui si fa riferimento nella documentazione di gestione dei rischi in modo tempestivo. Nota 2 La documentazione di gestione dei rischi può avere qualunque forma o tipo di supporto. Nota 3 Vedere ISO/TR 24971[9] per una guida per stabilire una documentazione di gestione dei rischi per componenti e dispositivi che sono stati progettati senza utilizzare la ISO 14971. 5 ANALISI DEI RISCHI Il fabbricante deve eseguire un'analisi dei rischi per il particolare dispositivo medico come descritto nei punti da 5.2 a 5.5. L'attuazione delle attività di analisi dei rischi pianificate e i risultati dell'analisi dei rischi devono essere registrati nella documentazione di gestione dei rischi. Nota 1 Se per un dispositivo medico simile è disponibile un'analisi dei rischi o altre informazioni pertinenti, tale analisi o informazioni può/possono essere utilizzata/e quale punto di partenza per la nuova analisi dei rischi. Il grado di pertinenza dipende dalle differenze tra i dispositivi medici e se essi introducano nuovi pericoli o differenze significative in elementi in uscita, caratteristiche, prestazioni o risultati. La portata d'uso di un'analisi dei rischi esistente è basata su una valutazione sistematica degli effetti che le differenze possono avere sul verificarsi di situazioni pericolose. Nota 2 Vedere ISO/TR 24971[9] per una guida su tecniche di analisi dei rischi selezionate e su tecniche per l'analisi dei rischi per dispositivi medici diagnostici in vitro. Oltre alle registrazioni richieste nei punti da 5.2 a 5.5, la documentazione della condotta e i risultati dell'analisi dei rischi devono includere almeno quanto segue: a) identificazione e descrizione del dispositivo medico che è stato analizzato; b) identificazione della/e persona/e dell'organizzazione che ha/hanno svolto l'analisi dei rischi; e c) scopo e data dell'analisi dei rischi. Nota 3 Il campo d’applicazione dell'analisi dei rischi può essere molto ampio (come per lo sviluppo di un nuovo dispositivo medico con il quale un fabbricante ha scarsa o nessuna esperienza) oppure il campo d’applicazione può essere limitato (come per l'analisi dell'impatto di una modifica a un dispositivo medico esistente per il quale esistono già molte più informazioni nelle documentazioni del fabbricante). La conformità è verificata mediante ispezione della documentazione di gestione dei rischi. ... 6 PONDERAZIONE DEL RISCHIO Per ciascuna situazione pericolosa identificata, il fabbricante deve valutare i rischi stimati e determinare se il rischio, è accettabile o meno, utilizzando i criteri per l'accettabilità del rischio definiti nel piano di gestione dei rischi. Se il rischio è accettabile, l'applicazione dei requisiti indicati nei punti da 7.1 a 7.5 non è richiesta per tale situazione pericolosa (ovvero, procedere al punto 7.6) e il rischio stimato deve essere trattato come rischio residuo. Se il rischio non è accettabile, allora il fabbricante deve eseguire attività di controllo del rischio come descritto nei punti da 7.1 a 7.6. I risultati di tale ponderazione del rischio devono essere registrati nella documentazione di gestione dei rischi. La conformità è verificata mediante ispezione della documentazione di gestione dei rischi. 7 CONTROLLO DEL RISCHIO Il fabbricante deve determinare misure di controllo del rischio che siano appropriate per ridurre i rischi a un livello accettabile. Il fabbricante deve utilizzare una o più delle seguenti opzioni di controllo del rischio nell'ordine di priorità elencato: a) progettazione e fabbricazione intrinsecamente sicura; [...] 8 VALUTAZIONE DEL RISCHIO RESIDUO COMPLESSIVO Quando tutte le misure di controllo del rischio sono state attuate e verificate, il fabbricante deve valutare il rischio residuo complessivo posto dal dispositivo medico, prendendo in considerazione i contributi di tutti i rischi residui, in relazione ai benefici dell'uso previsto, utilizzando il metodo e i criteri per l'accettabilità del rischio residuo complessivo definiti nel piano di gestione dei rischi [vedere punto 4.4 e)]. Se il rischio residuo complessivo è giudicato accettabile, il fabbricante deve informare gli utilizzatori di rischi residui significativi e deve includere le informazioni necessarie nella documentazione di accompagnamento al fine di divulgare tali rischi residui. [...] 9 RIESAME DELLA GESTIONI DEI RISCHI Prima del rilascio per la distribuzione commerciale del dispositivo medico, il fabbricante deve riesaminare l'esecuzione del piano di gestione dei rischi. Tale riesame deve garantire almeno che: - il piano di gestione dei rischi è stato attuato in modo appropriato; I risultati di tale riesame devono essere registrati e mantenuti come rapporto di gestione dei rischi e devono essere inclusi nella documentazione di gestione dei rischi. La responsabilità del riesame deve essere assegnata nel piano di gestione dei rischi a persone aventi l'autorità appropriata [vedere punto 4.4 b)]. La conformità è verificata mediante ispezione della documentazione di gestione dei rischi. 10 ATTIVITÀ DI PRODUZIONE E POST-PRODUZIONE Il fabbricante deve stabilire, documentare e mantenere un sistema per raccogliere attivamente e riesaminare informazioni pertinenti al dispositivo medico nelle fasi di produzione e post-produzione. Quando si stabilisce tale sistema, il fabbricante deve considerare metodi appropriati per la raccolta e l'elaborazione di informazioni. ... APPENDICE B PROCESSO DI GESTIONE DEI RISCHI PER I DISPOSITIVI MEDICI (informativa) B.1 Corrispondenza tra la seconda e la terza edizione La numerazione dei punti e dei sottopunti è cambiata con questa terza edizione della ISO 14971. Il prospetto B.1 fornisce la corrispondenza tra i punti e i sottopunti nella seconda edizione della ISO 14971:2007 e quelli nella terza edizione della ISO 14971:2019. Tale prospetto è fornito per assistere gli utilizzatori del presente documento nell'effettuare una transizione dalla seconda alla terza edizione e per facilitare l'aggiornamento dei riferimenti alla ISO 14971 in altri documenti. prospetto B.1 Corrispondenza tra elementi della ISO 14971:2007 e della ISO 14971:2019 [...] APPENDICE C CONCETTI DI RISCHIO FONDAMENTALI (informativa) Il presente documento richiede che il fabbricante compili un elenco dei pericoli noti e prevedibili associati al dispositivo medico in condizioni sia correnti sia di difetto e di considerare le sequenze prevedibili di eventi che possono produrre situazioni pericolose e un danno. Secondo le definizioni, un pericolo non può sfociare in un danno fino a che una sequenza di eventi o altre circostanze (incluso l'utilizzo normale) conducono a una situazione pericolosa. In questo punto, il rischio può essere accertato stimando sia la gravità sia la probabilità del verificarsi di un danno che potrebbe risultare (vedere figura C.1). La probabilità del verificarsi di un danno può essere espressa come una combinazione di probabilità separate (P1, P2) oppure come una singola probabilità (P). Una scomposizione in P1 e P2 non è obbligatoria. figura C.1 Esempio illustrato della relazione tra pericolo, sequenza di eventi, situazione pericolosa e danno (dalla ISO/IEC Guide 63:2019[2]) Esempi di pericoli L'elenco nel prospetto C.1 può essere utilizzato per assistere all'identificazione di pericoli associati a un particolare dispositivo medico, che potrebbe sfociare in definitiva in un danno. prospetto C.1 Esempi di pericoli ... Certifico Srl - IT | Rev. 1.0 2022 Matrice Revisioni
Collegati |
||||||||||||||
|
|
||||||||||||||
 |
||||||||||||||
| www.certifico.com
è un sito di INVIO NEWSLETTTER Se vuoi cancellarti dall'invio della newsletter oppure effettua il login al sito ed entra nella Tua Area Riservata, in “Modifica dati” agisci con la spunta sul box di selezione “Newsletter”. L'Elenco completo di tutte le ns newsletter è qui: Archivio newsletter. |
||||||||||||||
  |
||||||||||||||
| Certifico Srl 2000-2025 | VAT IT02442650541 | ||||||||||||||