
CEI UNI EN ISO 14971/A11:2022 (Variante V.11 RESS / P. Norma)
ID 18043 | 10.11.2022 / In allegato
La Variante V11 (2022 IT) della Norma CEI UNI EN ISO 14971:2021 (IT) contiene gli Allegati ZA e ZB che riportano rispettivamente la relazione tra questa Norma Europea e i requisiti generali di sicurezza e prestazione del regolamento (UE) 2017/745 e del regolamento (UE) 2017/746 che si intendono coprire.
Con la variante V11, la norma è ora codificata come UNI CEI EN ISO 14971:2022 o CEI UNI EN ISO 14971:2022.
________
CEI UNI EN ISO 14971/A11:2022
Dispositivi medici - Applicazione della gestione dei rischi ai dispositivi medici
Data Pubblicazione: 10.2022
Classificazione CEI: 62-121;V1
________
La presente Variante della Norma CEI UNI EN ISO 14971 contiene gli Allegati ZA e ZB che riportano rispettivamente la relazione tra questa Norma Europea e i requisiti generali di sicurezza e prestazione del regolamento (UE) 2017/745 e del regolamento (UE) 2017/746 che si intendono coprire.
La presente Variante riporta la traduzione completa della EN ISO 14971/A11; la versione inglese è riportata nel fascicolo 18779E di agosto 2022.
________
APPENDICE ZA
RAPPORTO TRA LA PRESENTE NORMA EUROPEA E I REQUISITI GENERALI DI SICUREZZA E PRESTAZIONE DEL REGOLAMENTO (UE) 2017/745 DA SODDISFARE (informativa)
La presente norma europea è stata elaborata nell'ambito di una richiesta di normazione da parte della Commissione M/575 per fornire uno strumento di conformità volontario ai requisiti generali di sicurezza e prestazione del Regolamento (UE) 2017/745 del 5 aprile 2017 relativo ai dispositivi medici [GU L 117].
Una volta che la presente norma è stata citata nella Gazzetta Ufficiale dell'Unione Europea come rientrante in quel Regolamento, la conformità ai punti della presente norma elencati nell’appendice ZA.1 conferisce, entro i limiti dello scopo e campo di applicazione della presente norma, una presunzione di conformità con i corrispondenti requisiti generali di sicurezza e prestazione di tale Regolamento e regolamenti EFTA associati.
Per l'applicazione della presente norma europea ai sensi del Regolamento (EU) 2017/745,
1) il campo di applicazione è limitato ai dispositivi medici e agli accessori per dispositivi medici come definiti in tale Regolamento e ai prodotti regolamentati come dispositivi ai sensi di tale Regolamento;
2) in caso di differenze tra i termini definiti nella presente norma europea e quelli definiti nel Regolamento, prevalgono i termini definiti nel Regolamento;
3) la politica del fabbricante per la definizione dei criteri di accettabilità del rischio (vedere punto 4.2 della presente norma europea) deve garantire che i criteri siano conformi ai requisiti generali di sicurezza e prestazione di tale Regolamento.
Il prospetto ZA.1 contiene spiegazioni sulla corrispondenza tra la norma e i requisiti generali di sicurezza e prestazione.
...
Prospetto ZA.1
Corrispondenza tra la presente norma europea e l'Appendice I del Regolamento (UE) 2017/ 745 [OJ L 117]
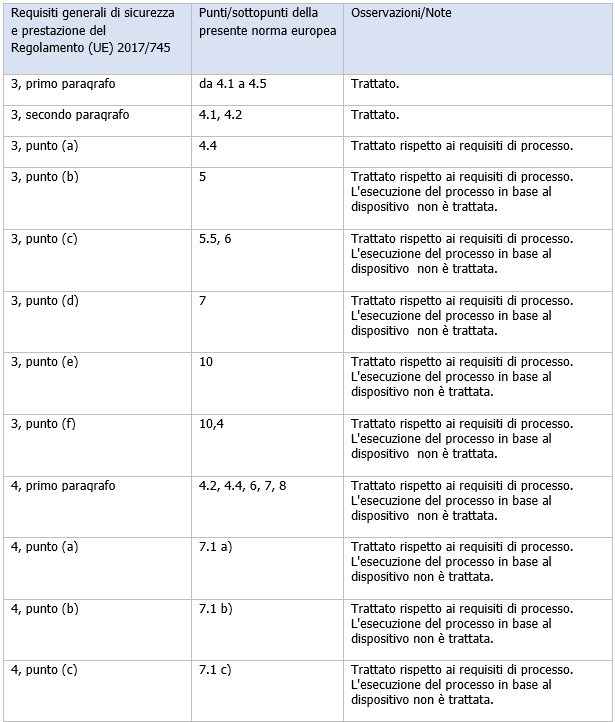
...
segue in allegato
Info e download Prospetto ZA.1
Si veda documento completo:

Collegati
Regolamento (UE) 2017/745
Regolamento (UE) 2017/746
UNI CEI EN ISO 14971:2022 - Gestione dei rischi dispositivi medici
UNI CEI EN ISO 14971:2020 | Dispositivi medici Gestione dei rischi
ISO 14971:2019
EN ISO 14971 Dispositivi medici: Gestione e Valutazione del rischio

|


























