UNI EN 14683:2019 | Requisiti maschere facciali uso medico (cd "chirurgiche")
| Appunti Normazione | ||
| 12 Luglio 2025 | ||
| Salve Visitatore | ||
UNI EN 14683:2019 | Requisiti maschere facciali uso medico (cd "chirurgiche") ID 10435 | 24.03.2020 Il presente documento riporta i requisiti per la costruzione, la progettazione delle maschere facciali ad uso medico (cd “mascherine chirurgiche”) destinate a limitare la trasmissione di agenti infettivi dal personale ai pazienti durante le procedure chirurgiche e altre attività mediche con requisiti simili. Le mascherine devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745. Marcatura CE Le maschere facciali ad uso medico devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745 (applicabile a decorrere dal 26 maggio 2020, entrato in vigore il 25 Maggio 2017). Ultima Edizione UNI EN 14683 UNI EN 14683:2019 Maschere facciali ad uso medico - Requisiti e metodi di prova Data entrata in vigore: 30 ottobre 2019 Recepisce: EN 14683:2019+AC:2019 Le maschere facciali ad uso medico devono essere marcate CE in accordo con Direttiva 93/42/CEE o Regolamento (UE) 2017/745 (applicabile a decorrere dal 26 maggio 2020, entrato in vigore il 25 Maggio 2017). La norma EN 14683 dà la presunzione di conformità ai requisiti generali di sicurezza e prestazione (Allegato I Regolamento (UE) 2017/745). La trasmissione di agenti infettivi durante le procedure chirurgiche nelle sale operatorie e in altre attività mediche può avvenire in diversi modi. Le fonti sono, ad esempio, nasi e bocche dei membri dell’equipe chirurgica. Il principale utilizzo previsto delle maschere facciali ad uso medico è quello di proteggere il paziente dagli agenti infettivi e, inoltre, in determinate circostanze, di proteggere chi le indossa da spruzzi di liquidi potenzialmente contaminati. Le maschere facciali ad uso medico (cd - “chirurgiche”) possono anche essere destinate ad essere indossate dai pazienti e da altre persone per ridurre il rischio di diffusione delle infezioni, in particolare in situazioni epidemiche o pandemiche. Fig. 1 - Esempio maschere facciali ad uso medico (cd “mascherine chirurgiche”) Quando si respira, si parla, si tossisce, si starnutisce, ecc., si rilasciano piccole o grandi quantità di goccioline di secrezioni dalle mucose della bocca e del naso. La maggior parte dei nuclei ha un diametro compreso tra 0,5 μm e 12 μm e soprattutto le goccioline più grandi possono contenere microrganismi provenienti dal sito di origine. I nuclei possono successivamente diffondersi attraverso l'aria in un sito suscettibile come una ferita operatoria aperta o un’attrezzatura sterile. Le maschere facciali ad uso medico destinate ad essere utilizzate in sale operatorie e in attività sanitarie con requisiti simili sono progettate per proteggere l'intero ambiente di lavoro. La presente norma descrive due tipi di maschere facciali ad uso medico con i relativi livelli di protezione. Come minimo, le maschere facciali ad uso medico di tipo I sono utilizzate per i pazienti al fine di ridurre il rischio di diffusione delle infezioni, in particolare in situazioni epidemiche o pandemiche. Le maschere di tipo II sono destinate principalmente all'uso da parte degli operatori sanitari in sala operatoria o in altre attività mediche con requisiti simili. Un caso particolare, coperto anche dalla legislazione europea sui dispositivi medici, è quello in cui chi lo indossa desidera proteggersi da spruzzi di liquidi potenzialmente contaminati. [panel]Se l'uso previsto della maschera è quello di proteggere chi la indossa da agenti infettivi (batteri, virus o funghi), l'uso di un dispositivo respiratorio è applicabile in conformità alla Direttiva sui dispositivi di protezione individuale (DPI) (89/686/CEE) o al Regolamento sui dispositivi di protezione individuale (DPI) (UE) 2016/425. I requisiti di prestazione per i respiratori rientrano nello scopo e campo di applicazione della norma EN 149. Il livello di efficienza offerto da una maschera dipende da una serie di fattori quali l'efficienza di filtrazione, la qualità del materiale e la vestibilità della maschera sul viso di chi la indossa. Progettazioni differenti sono idonee per applicazioni diverse e la scelta accurata della maschera è quindi importante per ottenere il risultato desiderato. La capacità di filtrazione dei materiali della maschera può variare a seconda del materiale filtrante. La vestibilità delle maschere varia notevolmente da quelle che vengono tenute in posizione da anelli fissati dietro le orecchie di chi le indossa a quelle con fascette di fissaggio intorno alla testa e una fascetta per il naso che può essere modellata al naso di chi le indossa. È usuale caratterizzare le prestazioni della maschera utilizzando prove in vitro del materiale di cui è fatta la maschera. Tuttavia, è importante considerare attentamente l'adattamento della maschera quando si sceglie una maschera per una determinata applicazione. Un ulteriore fattore da considerare è la capacità della maschera di assorbire l'umidità dell'aria espirata e quindi di mantenere le sue prestazioni per un periodo di tempo più lungo. Le progettazioni più avanzate mantengono facilmente le loro prestazioni anche in caso di operazioni molto lunghe, mentre quelle meno avanzate sono destinate solo a procedure brevi. Dato che le maschere usate sono considerate altamente contaminate, è essenziale che: - il corpo della maschera non sia toccato dalle dita/mani di chi lo indossa; ________ 2. Classificazione Le maschere facciali ad uso medico specificate nella presente norma europea sono classificate in due tipi (Tipo I e Tipo II) secondo l'efficienza di filtrazione batterica, mentre il Tipo II è ulteriormente suddiviso a seconda che la maschera sia resistente o meno agli spruzzi. La "R" indica la resistenza agli spruzzi. Tabella 1 - Requisiti di prestazione per le maschere facciali ad uso medico Fig. 2 - Sigla R "Resistenza spruzzi" 3. Requisiti Materiali e costruzione La maschera facciale ad uso medico è un dispositivo medico, generalmente composto da uno strato filtrante che viene posizionato, incollato o modellato tra gli strati di tessuto. La maschera facciale ad uso medico non deve disintegrarsi, rompersi o strapparsi durante l'uso previsto. Nella scelta dei materiali del filtro e dello strato, si deve prestare attenzione alla pulizia. Progettazione La maschera facciale ad uso medico deve essere fatta in modo da consentire di essere applicata strettamente sopra il naso, la bocca e il mento di chi la indossa e da assicurare che la maschera aderisca strettamente ai lati. Le maschere facciali ad uso medico possono avere forme e costruzioni diverse, oltre a caratteristiche aggiuntive come uno schermo facciale (per proteggere chi lo indossa da spruzzi e gocce) con o senza funzione antiappannamento, o un ponte nasale (per migliorare la vestibilità conformandosi ai contorni del naso). Efficienza di filtrazione batterica (BFE) Se sottoposta a prova in conformità all'appendice B della norma tecnica UNI EN 14683:2019, la BFE della maschera facciale ad uso medico deve essere conforme al valore minimo indicato per il tipo pertinente nella tabella 1. Per le maschere spesse e rigide, come le maschere rigide a becco d'anatra o a coppa, il metodo di prova può non essere idoneo in quanto non è possibile mantenere una tenuta adeguata nell’impattatore a cascata. In questi casi, per determinare il BFE si deve utilizzare un altro metodo equivalente valido. Quando una maschera è composta da due o più aree con caratteristiche diverse o con una diversa composizione di strati, ogni pannello o area deve essere sottoposto a prova individualmente. Il pannello o l'area con le prestazioni più basse deve determinare il valore BFE della maschera completa. Metodo per la determinazione in vitro dell'efficienza di filtrazione batterica (BFE) | Principio Un provino del materiale della maschera è bloccato tra un impattatore a cascata a sei stadi e una camera per aerosol. Un aerosol di Staphylococcus aureus è introdotto nella camera per aerosol e fatto passare attraverso il materiale della maschera e l’impattatore sotto vuoto. L'efficienza di filtrazione batterica (BFE) della maschera è data dal numero di unità formanti colonie che attraversano il materiale della maschera facciale ad uso medico espresso come percentuale del numero di unità formanti colonie presenti nell'aerosol di prova. ________ 4. Marcatura, etichettatura e imballaggio L'allegato I della Direttiva concernente i dispositivi medici (93/42/CEE) o l'allegato I, del Regolamento (UE) 2017/745 relativo ai dispositivi medici specifica le informazioni che dovrebbero essere specificate sull’imballaggio in cui viene fornita la maschera facciale ad uso medico. Devono essere fornite le seguenti informazioni: a) numero della presente norma europea; Si dovrebbero considerare la EN ISO 15223-1:2016 e la EN 1041:2008+A1:2013. Validazione straordinaria ed in deroga dei DPI Con il decreto legge 17 marzo 2020 n. 18, all’art. 15 è prevista la validazione straordinaria ed in deroga dei dispositivi di protezione individuale. L’art. 15 del decreto legge n. 18 del 2020 detta disposizioni straordinarie per la gestione dell’emergenza Covid-19 e attribuisce all’Inail la funzione di validazione straordinaria e in deroga dei dispositivi di protezione individuale (DPI). Art. 15 decreto legge n. 18 del 2020 (Disposizioni straordinarie per la produzione di mascherine chirurgiche e dispositivi di protezione individuale) 1. Fermo quanto previsto dall’articolo 34 del decreto-legge 2 marzo 2020, n. 9, per la gestione dell’emergenza COVID-19, e fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, è consentito produrre, importare e immettere in commercio mascherine chirurgiche e dispositivi di protezione individuale in deroga alle vigenti disposizioni. 2. I produttori e gli importatori delle mascherine chirurgiche di cui al comma 1, e coloro che li immettono in commercio i quali intendono avvalersi della deroga ivi prevista, inviano all’Istituto superiore di sanità una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche delle mascherine e dichiarano che le stesse rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dalla citata autocertificazione le aziende produttrici e gli importatori devono altresì trasmettere all’Istituto superiore di sanità ogni elemento utile alla validazione delle mascherine chirurgiche oggetto della stessa. L’Istituto superiore di sanità, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza delle mascherine chirurgiche alle norme vigenti. 3. I produttori, gli importatori dei dispositivi di protezione individuale di cui al comma 1 e coloro che li immettono in commercio, i quali intendono avvalersi della deroga ivi prevista, inviano all’INAIL una autocertificazione nella quale, sotto la propria esclusiva responsabilità, attestano le caratteristiche tecniche dei citati dispositivi e dichiarano che gli stessi rispettano tutti i requisiti di sicurezza di cui alla vigente normativa. Entro e non oltre 3 giorni dalla citata autocertificazione le aziende produttrici e gli importatori devono altresì trasmettere all’INAIL ogni elemento utile alla validazione dei dispositivi di protezione individuale oggetto della stessa. L’INAIL, nel termine di 3 giorni dalla ricezione di quanto indicato nel presente comma, si pronuncia circa la rispondenza dei dispositivi di protezione individuale alle norme vigenti. 4. Qualora all’esito della valutazione di cui ai commi 2 e 3 i prodotti risultino non conformi alle vigenti norme, impregiudicata l’applicazione delle disposizioni in materia di autocertificazione, il produttore ne cessa immediatamente la produzione e all’importatore è fatto divieto di immissione in commercio. Procedura straordinaria validazione mascherine Per la procedura di richiesta produzione mascherine consultare: ISS | Procedure per richiesta produzione mascherine e Decreto Cura Italia: validazione straordinaria dei DPI (INAIL)
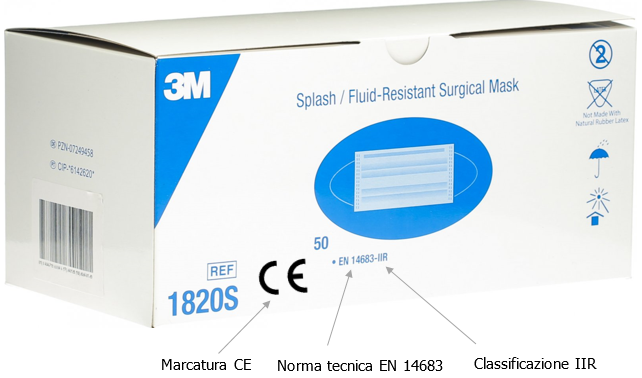
Fig. 3 - Esempio marcatura mascherine chirurgiche CE - EN 14683 - Classificazione IIR ... segue in allegato Fonti Certifico Srl - IT | Rev. 00 2020
Collegati |
||
|
|
||
 |
||
| www.certifico.com
è un sito di INVIO NEWSLETTTER Se vuoi cancellarti dall'invio della newsletter oppure effettua il login al sito ed entra nella Tua Area Riservata, in “Modifica dati” agisci con la spunta sul box di selezione “Newsletter”. L'Elenco completo di tutte le ns newsletter è qui: Archivio newsletter. |
||
  |
||
| Certifico Srl 2000-2020 | VAT IT02442650541 | ||