Tutte le linee guida Biocidi (BPR)
| ID 6207 | | Visite: 19232 | Documenti Riservati Chemicals | Permalink: https://www.certifico.com/id/6207 |
Tutte le linee guida Biocidi (BPR) | Update Agosto 2023
ID 6207 | 23.08.2023 / Linee guida in allegato
Tali documenti sono stati elaborati con la partecipazione di Stati membri, industria e parti interessate accreditate. L'obiettivo dei documenti è agevolare l'attuazione del regolamento relativo ai biocidi (BPR) descrivendo le buone pratiche su come soddisfare gli obblighi.
Oltre all'orientamento sul BPR, l'orientamento sulla direttiva relativa ai biocidi (BPD) e altri documenti correlati sono considerati applicabili per le nuove presentazioni a norma del BPR nei settori per i quali l'orientamento sul BPR è ancora in fase di preparazione.
Inoltre questi documenti sono ancora validi in relazione alle domande per l'iscrizione dei principi attivi nell'allegato I o alle domande di autorizzazione di un prodotto a norma del BPD che possono essere ancora in corso di valutazione.
Inserita le seguente linee guida aggiornata:
- Guidance on the BPR: Volume II Efficacy, Assessment + Evaluation (Parts B+C) (11/08/2023)
Fonte Immagine ECHA
Il regolamento sui biocidi (BPR, regolamento (UE) 528/2012) concerne l'immissione sul mercato e l'uso di biocidi, utilizzati per la tutela dell'uomo, degli animali, dei materiali o degli articoli contro organismi nocivi, quali parassiti o batteri, mediante l'azione dei principi attivi contenuti nel biocida. Lo scopo del regolamento è migliorare il funzionamento del mercato dei biocidi nell'UE, garantendo allo stesso tempo un elevato livello di tutela per l'uomo e per l'ambiente.
Il testo è stato adottato il 22 maggio 2012 e trovato applicazione a partire dal 1º settembre 2013, con un periodo di transizione per determinate disposizioni. Il regolamento abroga la direttiva sui biocidi (direttiva 98/8/CE).
Tutti i biocidi necessitano di un'autorizzazione prima di poter essere immessi sul mercato; inoltre, i principi attivi in essi contenuti devono essere stati precedentemente approvati. Esistono, tuttavia, alcune eccezioni a tale prassi. Ad esempio, i biocidi contenenti principi attivi soggetti al programma di riesame possono essere resi disponibili sul mercato e utilizzati (nel rispetto delle normative nazionali) in attesa della decisione finale sull'approvazione del principio attivo (e fino a tre anni dopo). Inoltre, anche i prodotti contenenti nuovi principi attivi ancora in fase di valutazione possono essere immessi sul mercato sulla base di autorizzazioni provvisorie.
Il BPR si pone come obiettivo di armonizzare il mercato a livello dell'Unione, di semplificare l'approvazione dei principi attivi e l'autorizzazione dei biocidi e di introdurre scadenze per le valutazioni, l'elaborazione di pareri e la formulazione di decisioni a livello degli Stati membri. Promuove inoltre la riduzione delle sperimentazioni sugli animali, introducendo obblighi relativi alla condivisione dei dati e incoraggiando l'uso di metodi di sperimentazione alternativi.
Come nella precedente direttiva, l'approvazione dei principi attivi avviene a livello dell'Unione e la successiva autorizzazione dei biocidi a livello degli Stati membri. Tale autorizzazione può essere estesa ad altri Stati membri tramite riconoscimento reciproco. Tuttavia, il nuovo regolamento fornisce ai richiedenti anche la possibilità di ottenere un nuovo tipo di autorizzazione a livello dell'Unione (autorizzazione dell'Unione).
Allegati tutti i documenti d'orientamento disponibili sul sito ECHA.
Tali documenti sono stati elaborati con la partecipazione di Stati membri, industria e parti interessate accreditate. L'obiettivo dei documenti è agevolare l'attuazione del regolamento relativo ai biocidi (BPR) descrivendo le buone pratiche su come soddisfare gli obblighi.
________
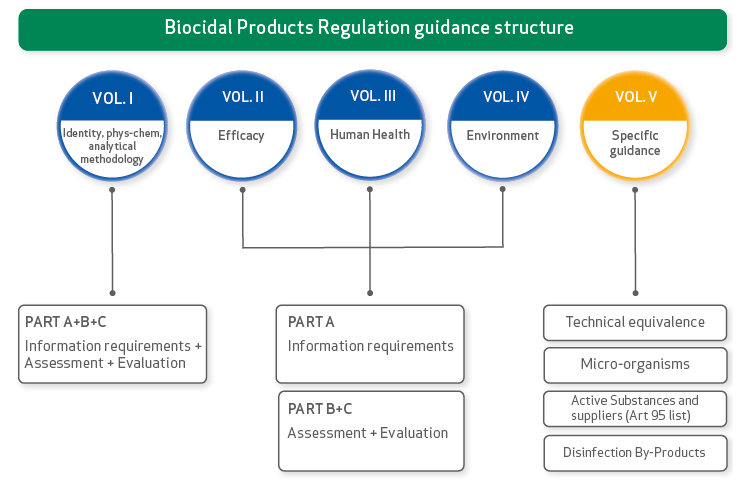
Guidelines Biocidal Products Regulation
Parts A+B+C: Information Requirements, Assessment and Evaluation
This Guidance describes the information requirements for active substances and biocidal products in accordance with the Title 1 of Annex II and Annex III of the BPR, including technical advice on how to perform the hazard and exposure assessment and risk characterisation for biocidal active substances and products. (29/03/2022)
Volume II Efficacy
Part A: Information Requirements
This Guidance describes the information requirements for active substances and biocidal products in accordance with the Title 1 of Annex II and III of the BPR. (29/03/2022)
Parts B+C: Assessment and Evaluation
Guidance on the BPR: Volume II Efficacy, Assessment + Evaluation (Parts B+C). This Guidance provides technical advice on how to perform the hazard and exposure assessment and risk characterisation for biocidal active substances and products with respect to efficacy. (11/08/2023)
Volume III Human health
Part A: Information Requirements
This Guidance describes the information requirements for active substances and biocidal products in accordance with the Title 1 of Annex II and III of the BPR. (29/03/2022)
Parts B+C: Assessment and Evaluation
This Guidance provides technical advice on how to perform the hazard and exposure assessment and risk characterisation for biocidal active substances and products with respect to human health risk assessment and evaluation. (11/12/2017)
Volume IV Environment
Part A: Information Requirements
This Guidance describes the information requirements for active substances and biocidal products in accordance with the Title 1 of Annex II and III of the BPR. (29/03/2022)
Parts B+C: Assessment and Evaluation
This Guidance provides technical advice on how to perform the hazard and exposure assessment and risk characterisation for biocidal active substances and biocidal products with respect to environmental risk assessment. (25/10/2017)
Volume V Specific Guidance
Guidance on Disinfection By-Products
This guidance document deals with the risk assessment for human health and the environment of Disinfection By-Products that is applicable for the authorisation of products under the EU Biocidal Products Regulation (BPR, Regulation (EU) 528/2012). (23/01/2017)
Guidance for identification of endocrine disruptors
This Guidance was developed jointly by ECHA and the European Food Safety Authority (EFSA) with support by the Joint Research Centre (JRC) and describes how to identify endocrine disruptors in the context of the Biocidal Products Regulation (EU) No 528/2012 and the Plant Protection Products Regulation (EC) No 1107/2009 in accordance with the scientific criteria for the determination of endocrine disrupting properties set out in Commission Delegated Regulation (EU) 2017/2100 and Commission Regulation (EU) 2018/605. The final guidance will be published in the EFSA Journal by July 2018. (07/06/2018)
Guidance on applications for technical equivalence
This Guidance informs potential applicants about their obligations resulting from the provisions of Article 54 of the BPR: when they need to apply for an assessment of technical equivalence and on the procedural steps in making that application. The Guidance also informs potential applicants about the assessment conducted by the Agency and the approach used for assessing the technical equivalence of the alternative source of an active substance versus its reference source. (12/07/2018)
Guidance on active substance suppliers
This Guidance describes the obligations under Article 95 of the BPR and explains the regulatory consequences. (29/03/2017)
Guidance on micro-organisms
This Guidance provides technical advice on the information requirements, the hazard and exposure assessment, the risk characterisation and the evaluation of the active substances and biocidal products in accordance with Annex II, Title 2 and Annex III, Title 2 of the BPR for micro-organisms. (29/03/2017)
Fonte: ECHA
...
Vedi Regolamento (UE) n. 528/2012 (BPR) | Testo consolidato
Il testo consolidato del Regolamento (UE) 528/2012 (BPR), tiene conto delle modifiche e abrogazioni dal 2013.
Collegati:
Tags: Chemicals Regolamento BPR BPR Abbonati Chemicals Guida ECHA